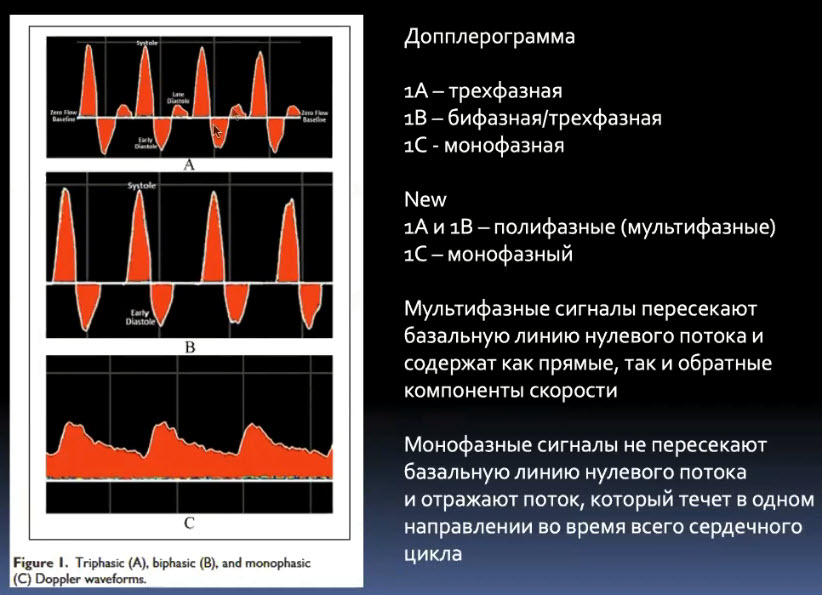
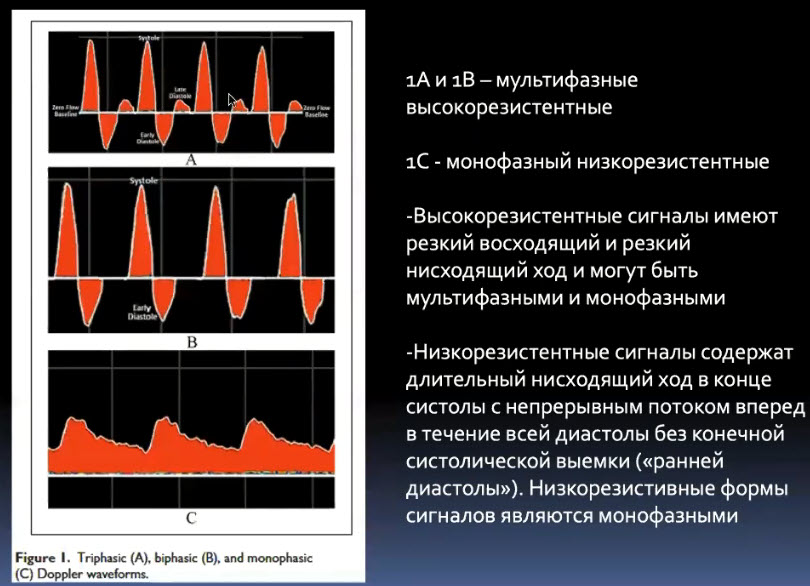
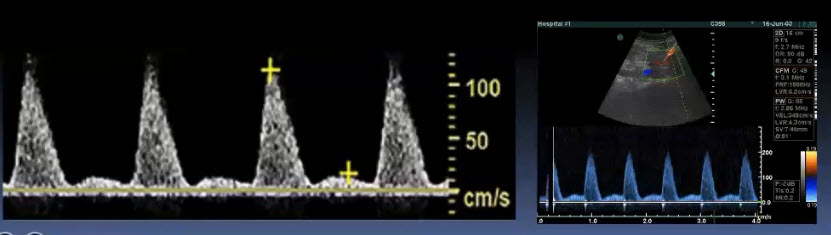
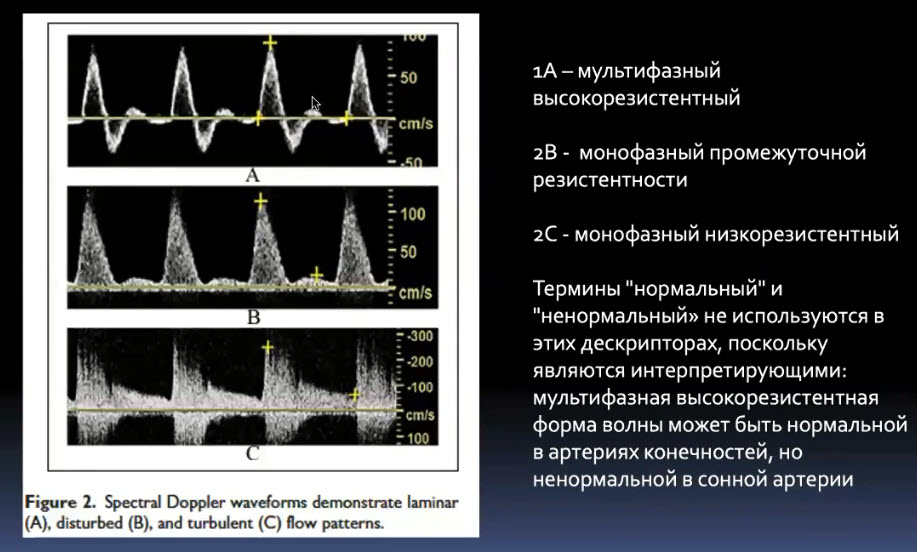
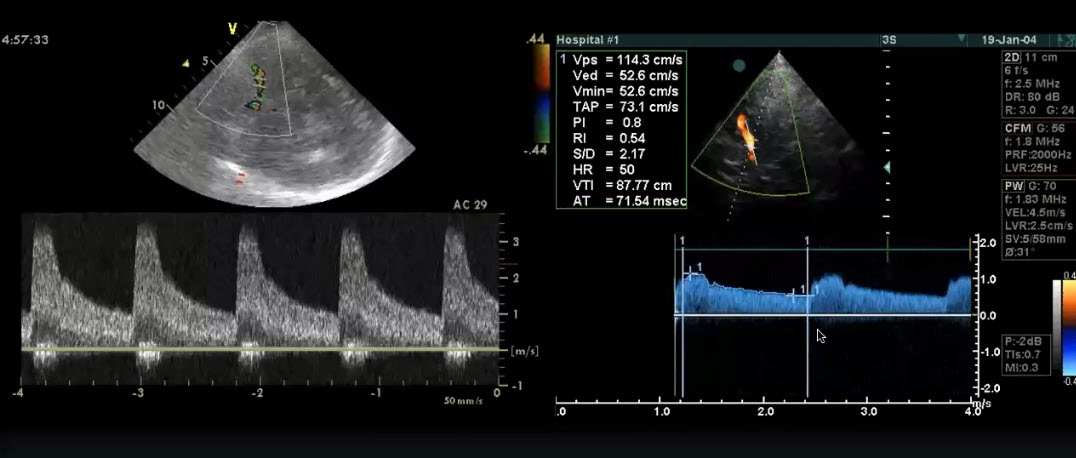
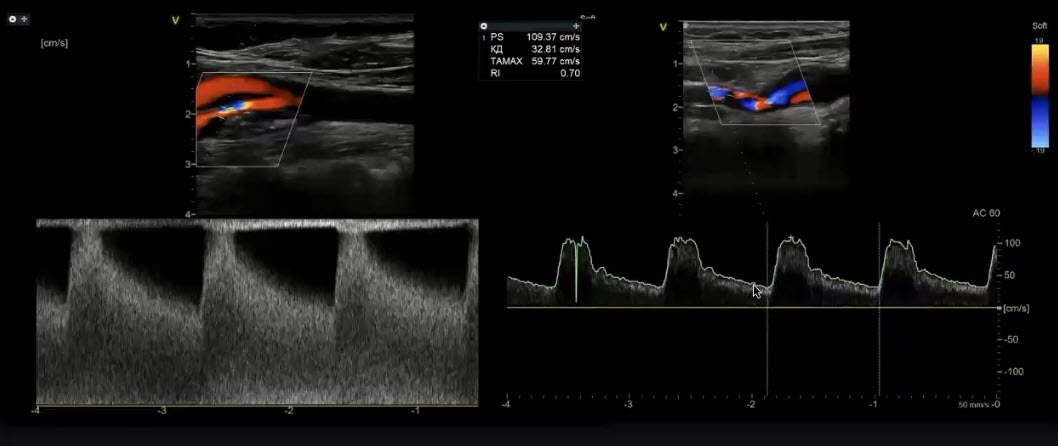
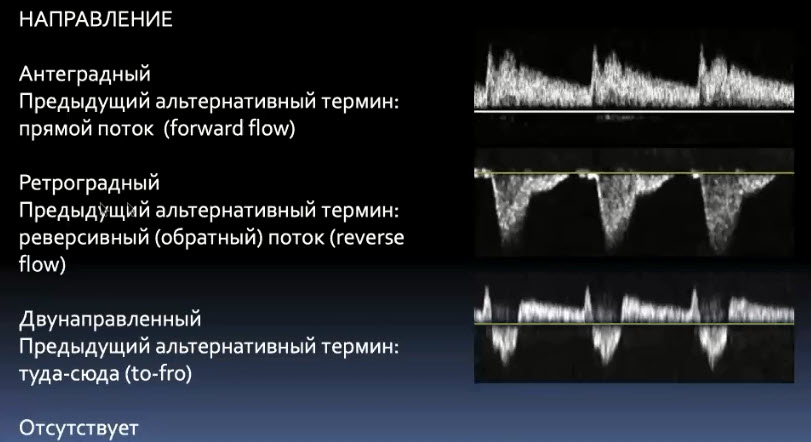
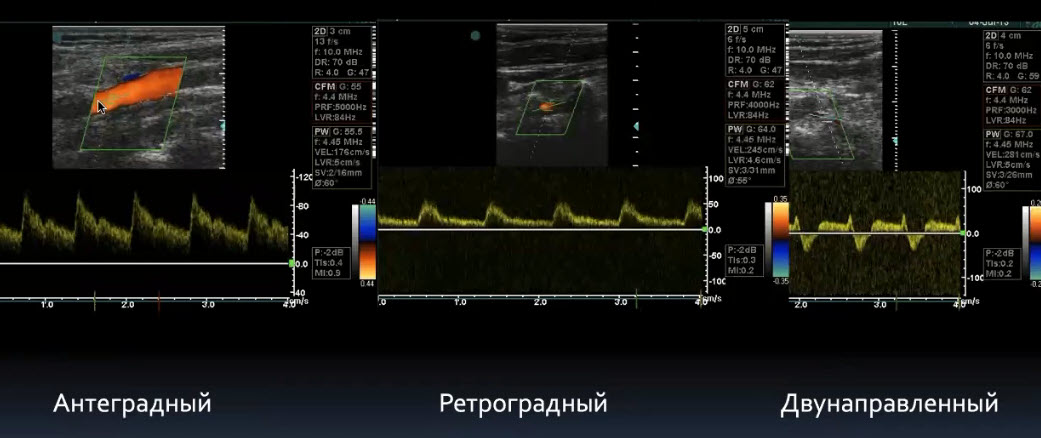
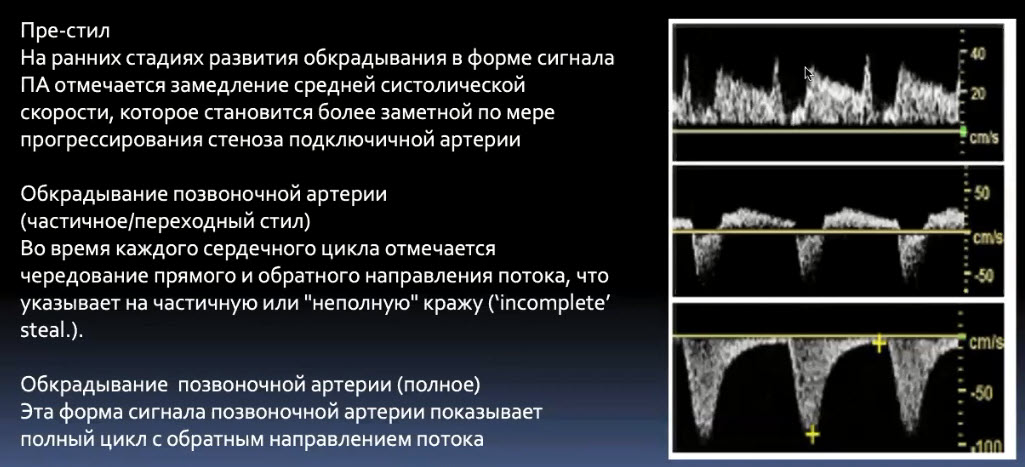
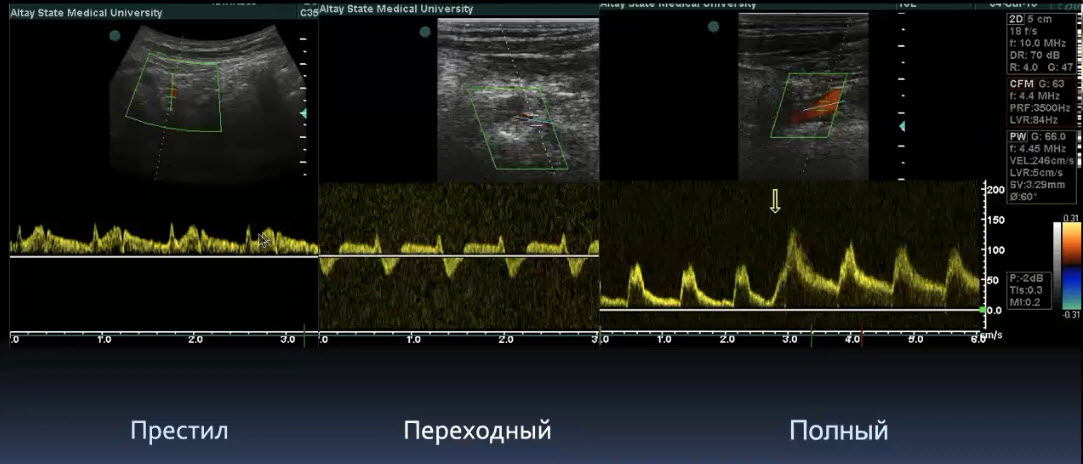
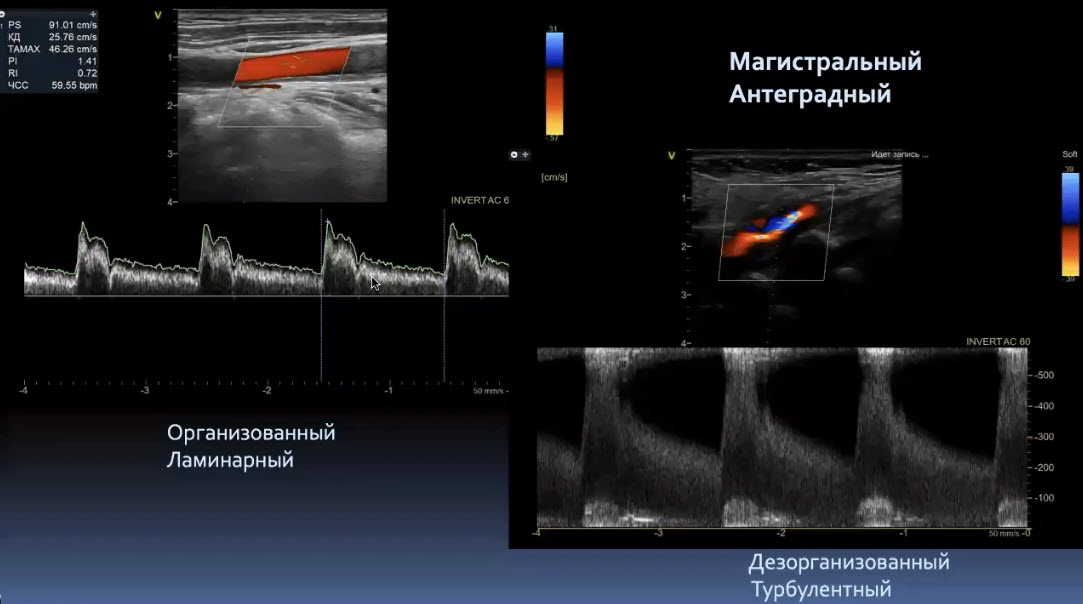
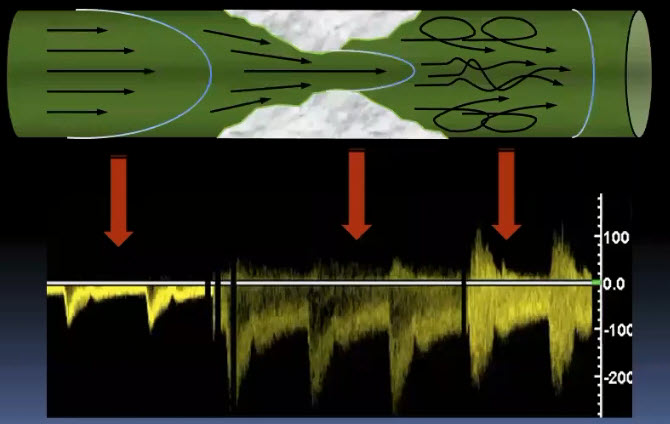
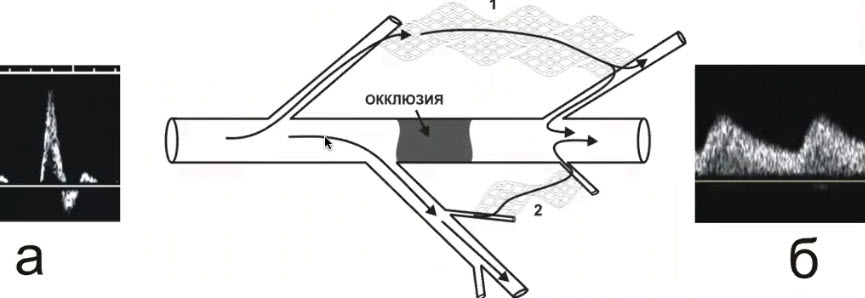
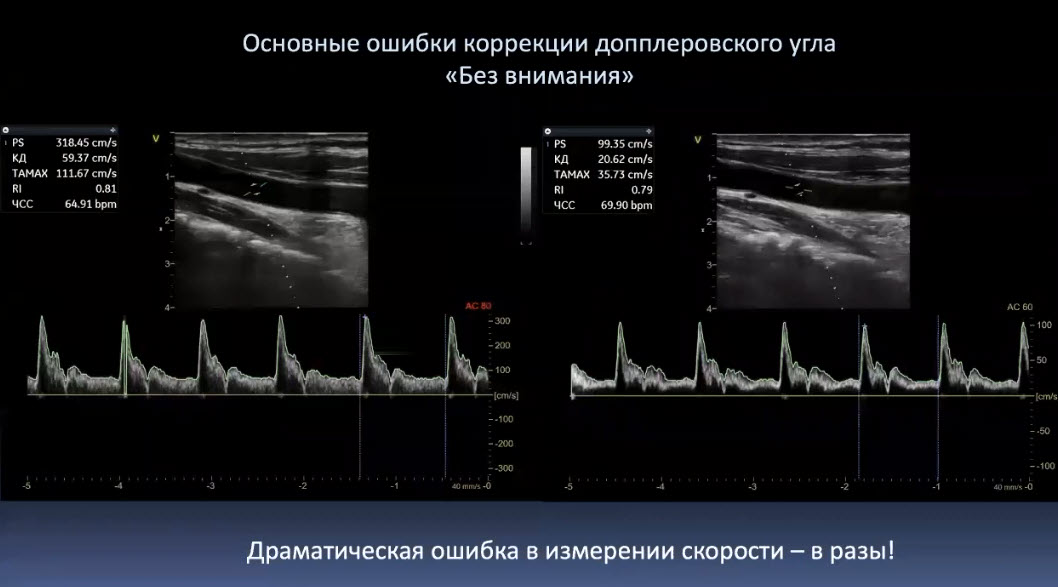
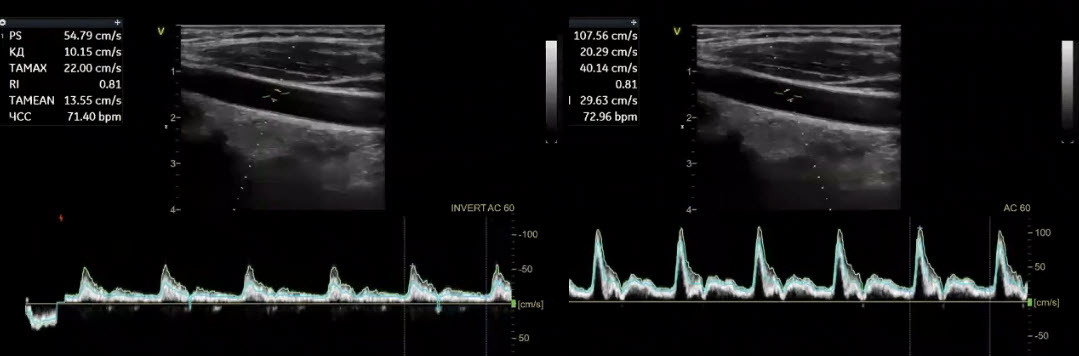
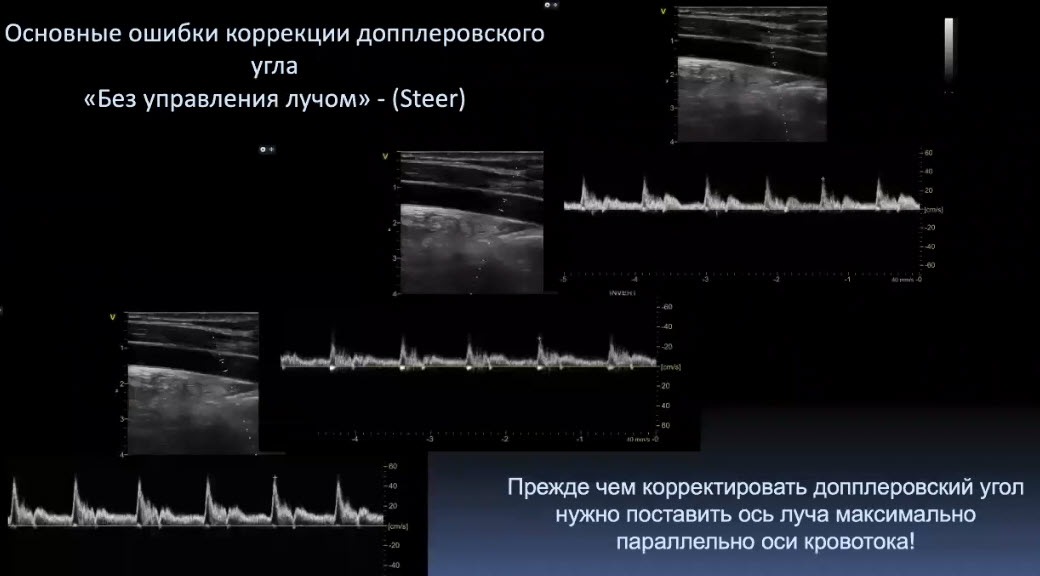
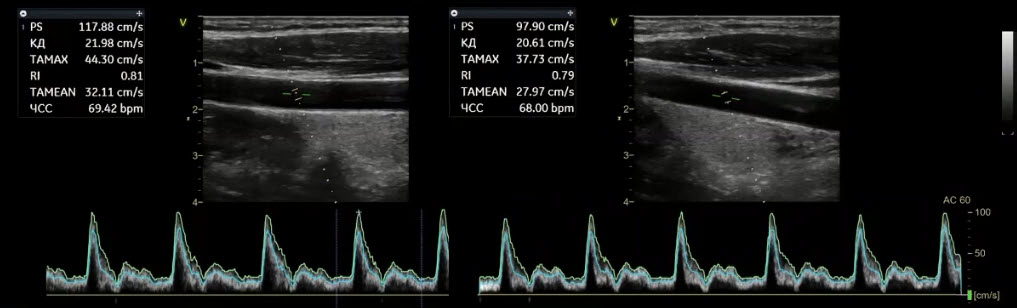
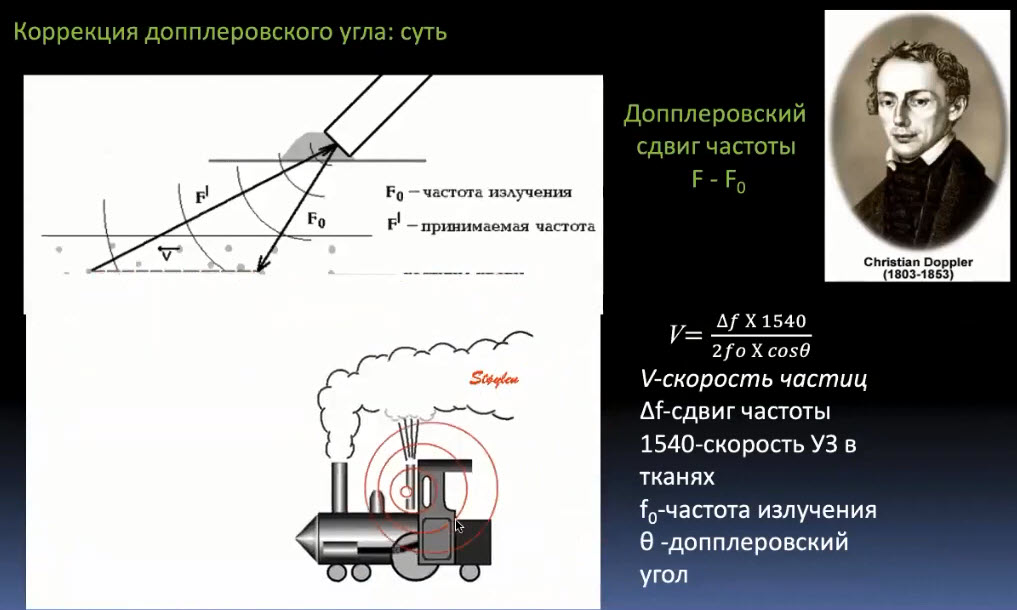
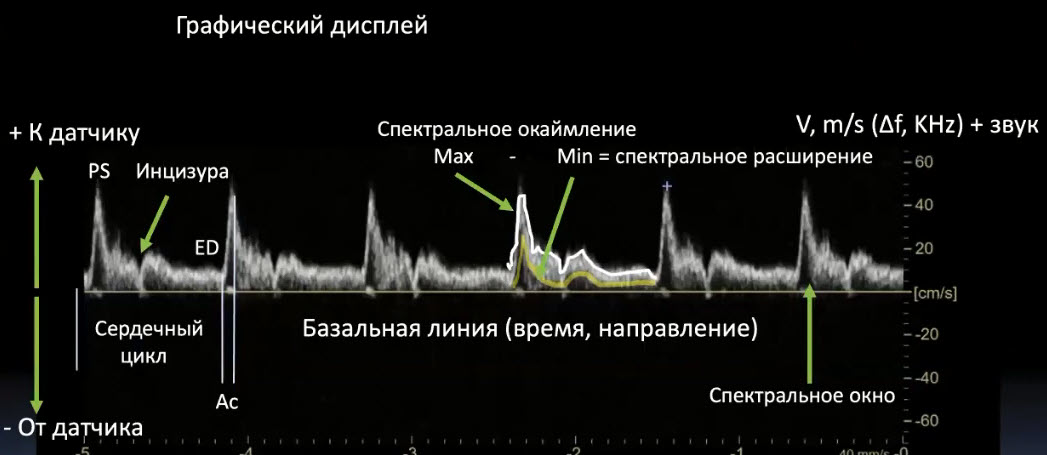
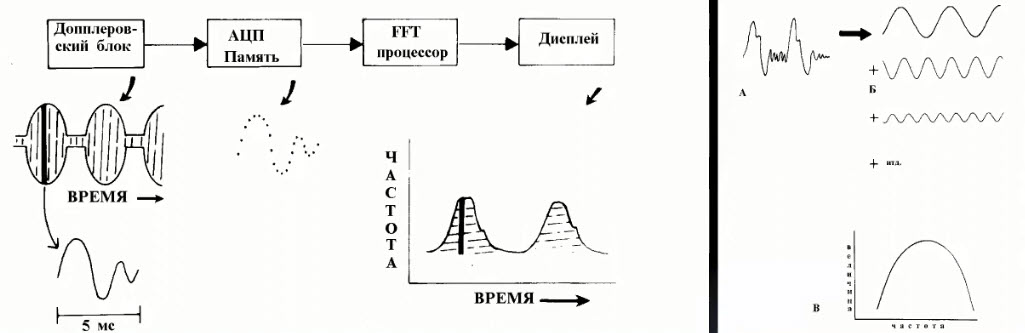
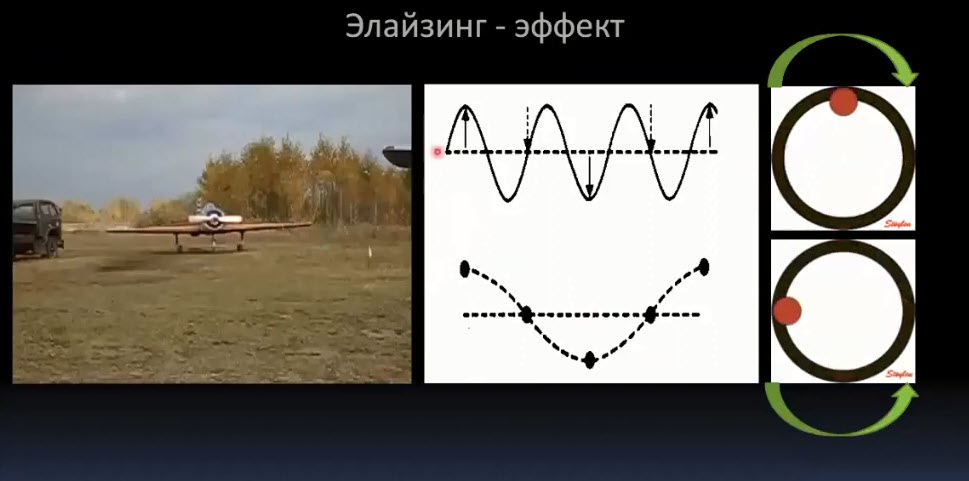
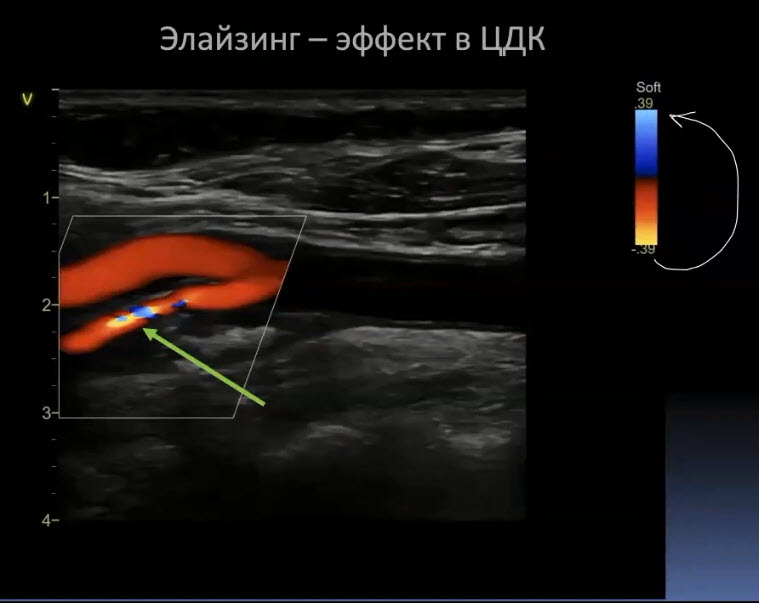
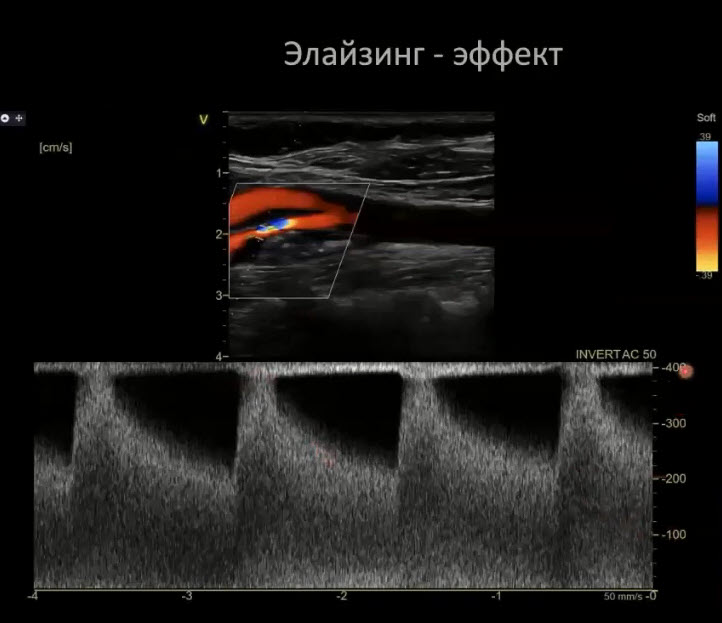
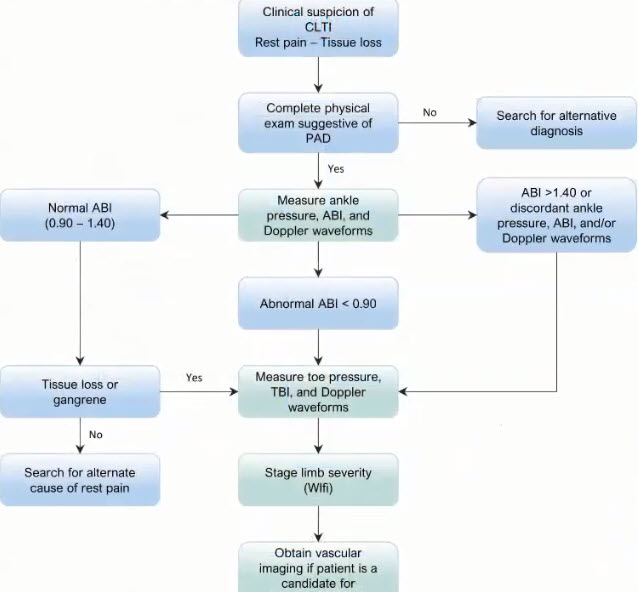
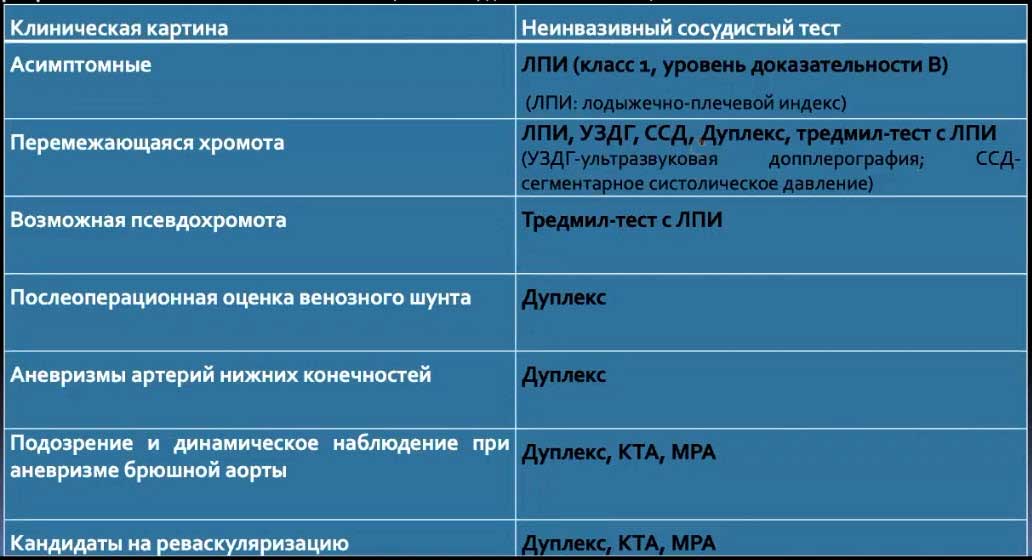
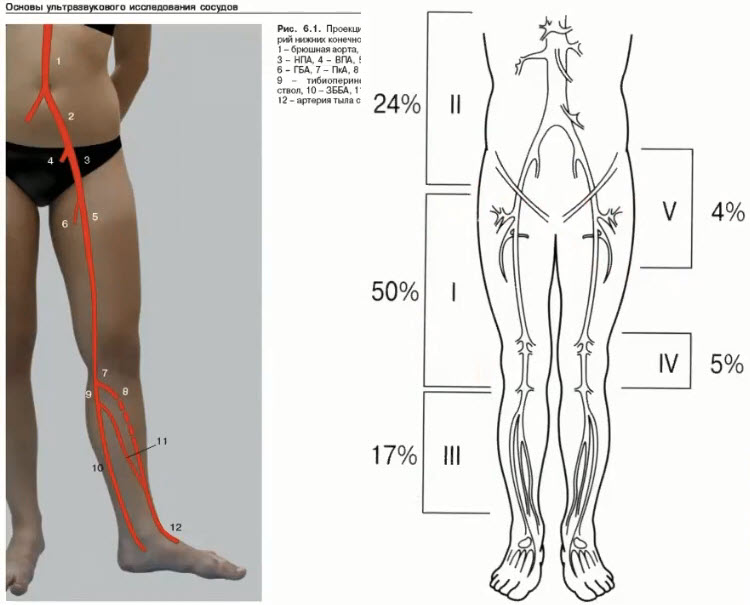
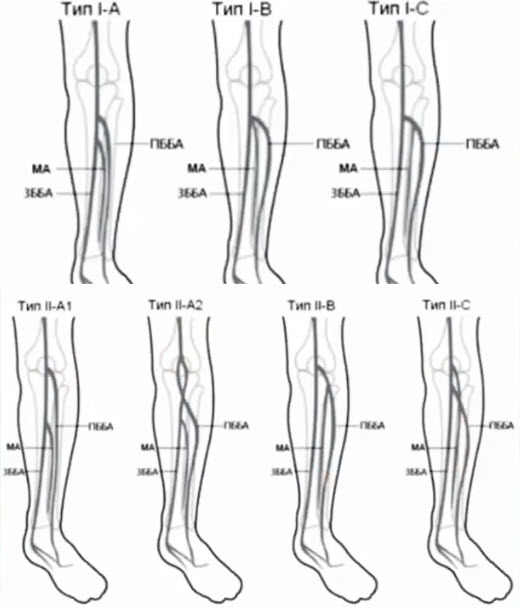
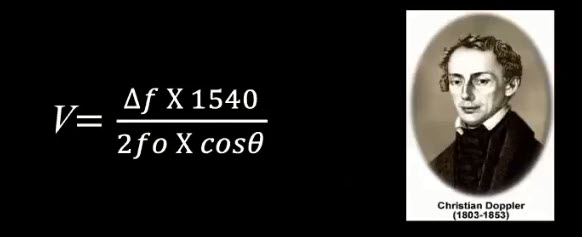Краткий обзор нового мануального подхода
Помимо структуры и функции
Эта книга представляет собой новую концепцию и ряд новых технических возможностей. Вместе они представляют собой совершенно иной подход к мануальному лечению суставов, который является «очернением» классического разделения между функцией и структурой. Наши методы основаны на результатах, достигнутых с помощью широкого круга пациентов в кли-нической практике с учетом безопасности пациентов.
Эта работа была первоначально выполнена как сборник клинических советов, разработанных главным образом первым автором Жан-Пьером Барралем. С тех пор авторы усовершенствовали эти методы вместе. Это происходит как анализ клинических случаев, встречающихся в течение многих лет повседневной практики.
После того как мы объединили эти методы вместе, у нас не было определенной сплоченности. Это стремление к единству побудило нас взглянуть на основы совместной деятельности и пересмотреть некоторые из наших основных предпосылок.
В итоге мы наметили наши манипуляции в отношении расширенной биомеханической структуры, которая в большей степени соответствует системному подходу, в котором части объединены в сеть взаимоотношений.
Эта стратегия оказывается очень полезной при лечении острой или сложной боли, когда классические методы не работают, сложны или невозможны.
Наша перспектива
Мы предполагаем, что сустав состоит из нескольких подсистем, взаимодействие которых создает сложный комплекс. По комплексу мы не имеем в виду сложный. Эдгар Морин (Edgar Morin, 2005) определил комплекс как «то, что соединено вместе», как совокупность частей в переплетении переплетенных ветвей, организованных так же, как мы представляем неврологическое сплетение.
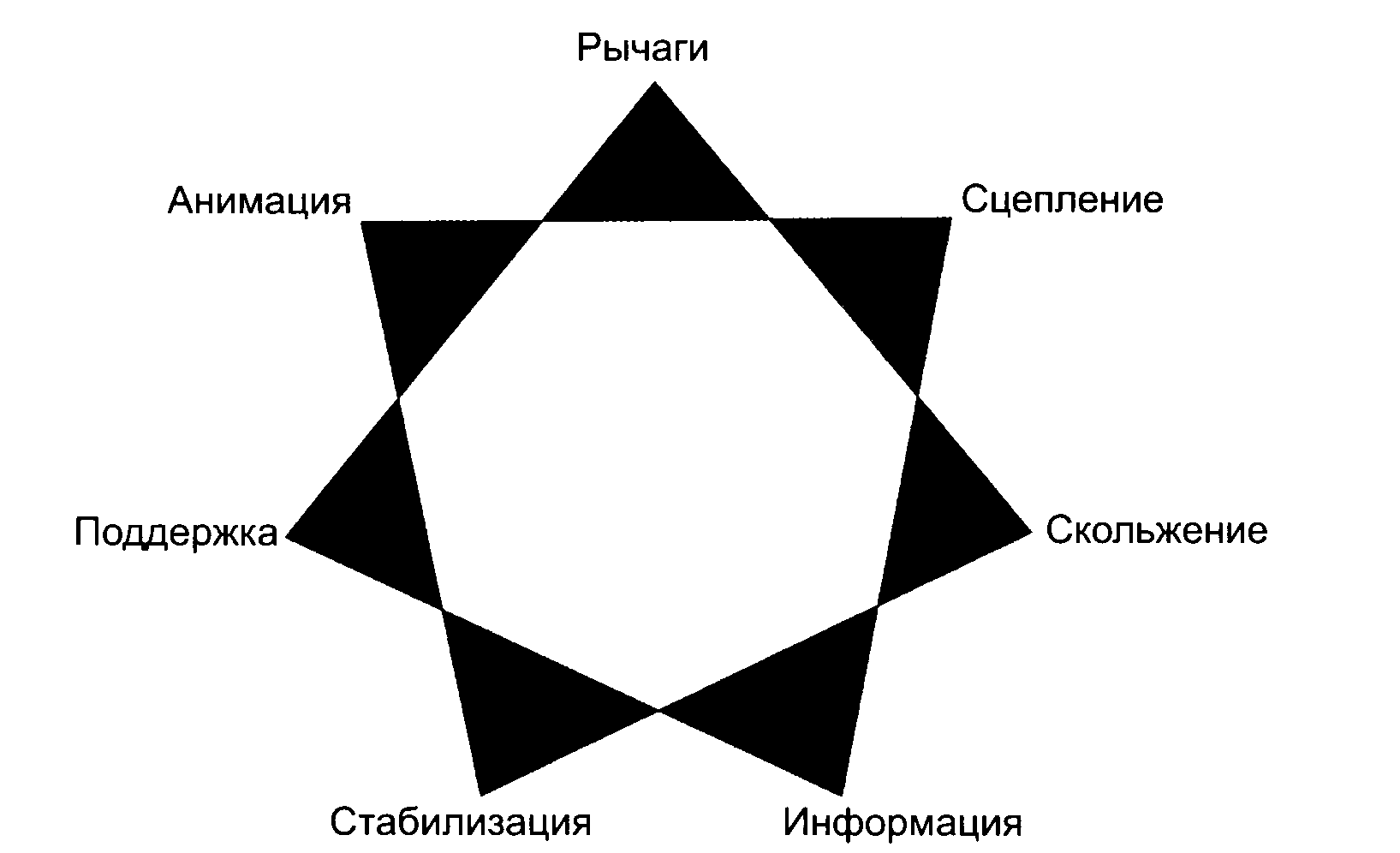
Рис. 1.1. Семь подсистем сустава
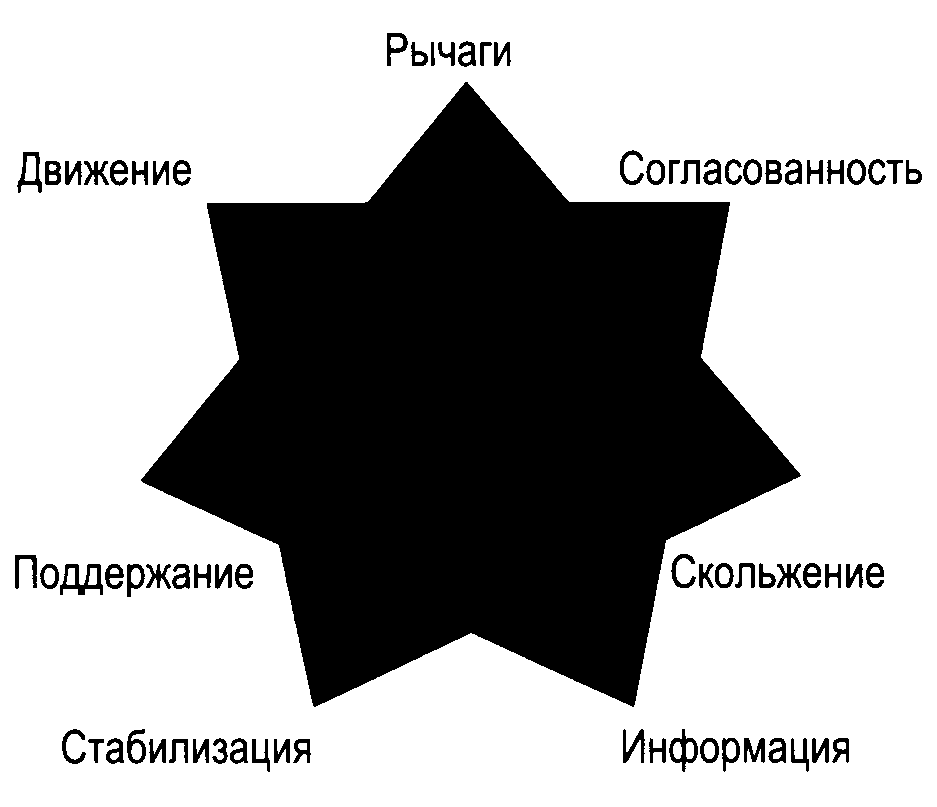
Мы различаем семь основных подсистем, которые работают в сочетании, поддерживая функцию (рис. 1.1).
Системные взаимодействия
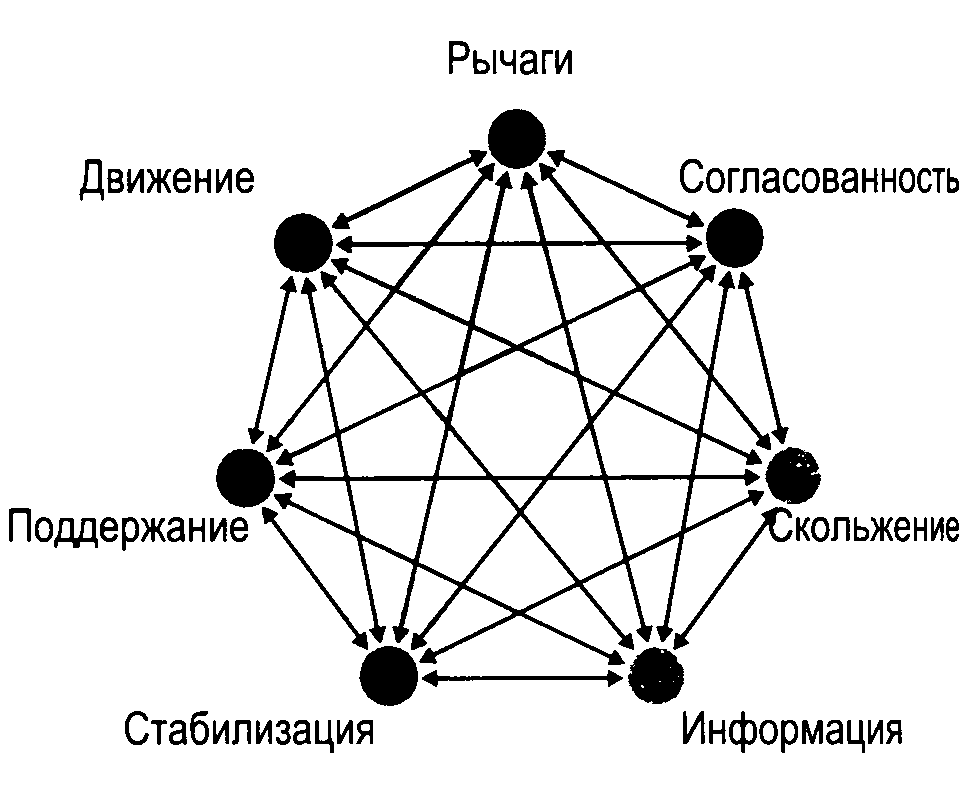
С системной точки зрения нормальная функция сустава неотделима от здоровой работы каждой подсистемы, а также от четкого взаимодействия и коммуникации между подсистемами (рис. 1.2). Более того, сустав может рассматриваться как «органный комплекс», функцией которого является движение. Эта функция также зависит от нормального взаимодействия и коммуникации между всеми компонентами.
Взаимодействия за пределами системы
В общем, человеческий организм представляет собой агрегат систем, который функционирует во взаимодействии друг с другом и с окружающей средой. Суставная система является частью этой общей совокупности, постоянно взаимодействующей с другими измерениями индивидуума. Она подвержена воздействию многих частей организма, таких как висцеральные, сосудистые, нервные и психоэмоциональные элементы. Более того, она постоянно адаптируется к внутренним и внешним условиям и компенсирует их.
Возникает широкий спектр взаимодействий. Тогда как некоторые взаимодействия достаточно очевидны, другие менее заметны, но все они в различной степени оказывают влияние на функцию суставной системы.
Рис. 1.2. Взаимодействие подсистем сустава
Системный подход
Для достижения новых перспектив лю-бых терапевтических программ действий в области работы суставов полезно сначала рассмотреть некоторые главные принципы системного подхода.
Системный подход является междисциплинарной областью, которая возникла в середине 1970-х годов. Иногда его называют системным анализом. Это способ изучения объектов во всей их сложности. Он направлен на понимание, как системы влияют друг на друга в рамках целого. Эта методология может применяться к физике, организму человека и даже к обществу. Системный способ понимания может рассматриваться как язык, образ мышления или даже как философия. Системный анализ применяется и имеет явные преимущества в огромном числе дисциплин, от экологии и биологии до изучения человеческой культуры. Этот способ мышления особенно подходит к остеопатическому подходу в целом и к суставам в частности.
Определения
Системный подход базируется на понятии системы. Система может определяться как группа элементов, которые взаимодействуют в достаточной мере, образуя целое, которое не может быть описано путем рассмотрения его элементов по отдельности.
Жоэль де Росней определил систему как «группу элементов, находящихся в динамическом взаимодействии и организованных в соответствии с некоей целью».
Теория описывает два типа систем:
- Закрытые системы с очень небольшим внешним обменом с окружающей средой
- Открытые системы, которые обмениваются веществом, энергией и информацией с окружающей средой
С этой точки зрения живые организмы, а также их клетки и некоторые органные группы могут быть определены как открытые системы, поскольку они взаимодействуют с окружающей средой.
Принципы
Людвиг фон Берталанфи - биолог австрийского происхождения, известный как один из пионеров общей теории систем. Любая открытая система функционирует в соответствии с тремя структурными и функциональными принципами:
- принцип совокупности
- принцип гомеостаза
- принцип эквифинальности.
Эти три принципа обеспечивают системе автономность, независимую от времени или начальных условий, нечто, состояние чего определяется исключительно параметрами системы (фон Берталанфи, 1973).
Принцип совокупности: взаимодействия
Система - это единое целое, которое является большим, чем сумма его частей, и несводимо к своим частям. Невозможно понять функцию системы путем простого изучения функции каждого компонента. Если целое больше суммы его частей, то это является следствием взаимодействия элементов - обмена внутри системы и взаимодействий между этими элементами и внешним контекстом системы.
Невозможно прогнозировать поведение целого просто путем подробного изучения его частей. С определенного уровня сложности у системы могут появляться новые свойства. Они называются эмерджентными свойствами. В любом системном вмешательстве фокус смещается с поведения частей в отдельности на их взаимодействие.
Принцип гомеостаза: регуляция
Открытая система обладает регуляторными механизмами, которые позволяют ей оставаться стабильной даже при изменении окружающей среды. Постоянная регуляция обеспечивает системе выживание и поддержание себя. Регуляторные механизмы функционируют посредством петель обратной связи, которые работают в тесной взаимосвязи с внутренними и внешними факторами. В суставной системе механизмы обратной связи обычно не очевидны.
Петли обратной связи могут быть положительными и отрицательными.
Отрицательная обратная связь отменяет действие внутренних или внешних факторов и может менять баланс системы. Так как баланс и стабильность системы зависят от этих механизмов обратной связи, они называются стабилизаторами.
Положительная обратная связь усиливает эффект разрушительных факторов и стремится дестабилизировать систему до той точки, в которой она достигает нового состояния равновесия. Эффекты таких механизмов кумулятивные. В крайнем случае они могут оказывать эффект снежного кома, который безгранично распространяется, разрывая блокады системы. Динамика изменения базируется на положительной обратной связи.
Круговая причинность - это понятие, возникшее из идеи обратной связи. Реакции обратной связи иногда затрудняют различение между причиной и эффектом в феномене системы. Фактически это становится бессмысленным вопросом. Лучше рассматривать эту петлю в ее общей динамике. Желая наблюдать ее с целью изучения, предпочтительно не вскрывать и не разделять ее.
Такой системный подход работает в любой терапии, которая использует возможности саморегуляции структур. Это иногда подразумевает активацию трансформирующих возможностей при разблокировании системы или устранении определенных петель круговой причинности. Не это ли мы стремимся делать в остеопатии?
Круговая причинность в остеопатии
Мы достаточно хорошо знакомы с этим типом петель обратной связи в остеопатии. Это неизменные примеры того, как эффект оказывает ретроактивное влияние на собственную причину. Он становится эффектом сами по себе. При некоторых патологиях может быть невозможно определить истинную причину проблемы.
Типичным примером такого затруднения является соматическая позвоночная дисфункция, которая раздражает латеровертебральную симпатическую цепь, вызывая органную дисфункцию. Раздраженный орган, в свою очередь, направляет ноцицептивные сигналы через позвоночные сегменты, уже подверженные дисфункции. Результатом является обострение спазмов позвоночных мышц, усиление раздражения позвоночных сегментов. Затем симпатическая цепь посылает больше эфферентных сигналов, которые усиливают раздражение органа, и так продолжается по кругу.
Принцип эквифинальности: адаптируемость
Эквифинальность - это способность системы достигать данного конечного состояния из различных начальных состояний и с использованием множественных потенциальных средств. Система считается эквифинальной, когда «то же конечное состояние может достигаться из различных исходных состояний альтернативными путями» (фон Берталанфи, 1973). Организм может оказаться неспособным полагаться на старые структурные иерархии для разрешения данной проблемы. Скорее корректирующие действия происходят из информационного обмена между взаимосвязанными и взаимозависимыми компонентами.
Механика человека
Как это работает на практике
Этот новый подход к манипуляциям может несколько приводить в замешательство остеопатов, которые остаются «остео- центрированными» в своих взглядах на манипуляции на суставах. У нас нет намерения подвергать сомнениям классические манипуляции. Мы изучили их и используем некоторые из них каждый день. Мы далеки от того, чтобы отвергать наши истоки. Мы просто хотели бы расширить нашу идею дисфункции сустава, выйдя за пределы понятия простого «механического нарушения». Такой подход ограничивает сам себя осями и плоскостями движения, которые вскоре демонстрируют свои концептуальные и функциональные пределы.
Раскрытие нашего сознания для других параметров позволило возникнуть другому видению физиологии суставов. Этот пересмотр позволяет нам лучше помогать нашим пациентам находить решения или улучшать их состояние, в особенности в случаях, которые плохо реагируют на классическую мануальную терапию.
Биомеханика
Существует множество взглядов на биомеханику сустава. Они варьируют от самых абстрактных математических конфигураций до самых конкретных биологических феноменов. Понимание механики тела человека колеблется между двумя противоположными взглядами: понятиями механического и физического, с одной стороны, и принципами жизни и физиологии - с другой. Эти два взгляда диаметрально противоположны. Они становятся еще более противоречивыми в повседневной реальности, в особенности когда применяются к статичному и движущемуся телу. Нервная, мышечная и сосудистая регуляция еще более усложняют любое точное исследование функции сустава.
Механический уровень
Механический аспект касается всех исследований, направленных на векторы, углы, усилия нагрузки и геометрические фигуры. Результаты выражаются в числах, графиках и математических расчетах, которые концептуально ближе к инженерии, чем к остеопатии.
Согласно Фика и соавторам (1987), тогда как кодирование физиологии является, возможно, похвальной амбицией, оно имеет скрытое намерение превращения биологии в точную науку несмотря на неуверенность и множество неизвестных факторов, присущих всем человеческим существам. Даже если эти более или менее абстрактные физические данные придают биомеханике «научный» характер, нельзя переоценивать их значение. Подобные данные никогда не будут чем-то большим, чем приближения, служащие только в качестве ориентиров. Однозначно неправильно отказываться от них полностью, равно как и не обоснованно доверять им больше при подборе наших манипуляций.
Биологический уровень
Биомеханика тела человека требует, чтобы мы учитывали структурную и функциональную сложность всех мягких тканей и компонентов сустава, включая их реципрокные взаимодействия, а также мышечные, нервные и сосудистые связи. Скелетно- мышечная система строго подчинена всем органическим функциям, выполняемым в тесной связи с нервной системой. Двигательная функция отходит от абсолютного автоматизма и обеспечивает человеку его физическую свободу и автономию.
Необходимая клиническая биомеханика
Редукционизм
С точки зрения д-ра Адальберта И. Капанджи (1987), большинство биомеханических данных и моделей должны рассматриваться в широком контексте. Подобная наука, часто вдохновленная техническим прогрессом, является фундаментально редукционистской. Внимание! По его мнению, следует четко разграничивать клиническую биомеханику и промышленную механику и освободиться от условных рефлексов мышления в слишком жестких механических рамках.
В статье о «биомеханической картофелине» Капанджи подчеркивает основное различие между промышленной и живой механикой. Живая биомеханика функционирует в четырех измерениях, в которых время не имеет того же значения, которое оно имеет в промышленной механике. Более того, механическая функция является сущностью живого сустава, тогда как в промышленных суставах она ущербна. Плоскости и оси движения материализованы и зафиксированы в промышленной механике, тогда как в живом движении это далеко не так.
Измерение времени
Капанджи также представлял биомеханику как четырехмерное пространство, в котором значение «временного измерения» удваивается.
В общих словах, время естественным образом вовлечено в движение. Стандартная кинематика описывает движение как взаимосвязь между пространством и временем.
Тогда как все движения требуют времени, время двукратно вовлечено в живые структуры, так как живые существа рождаются, трансформируются и эволюционируют. Рост и обновление непрерывны до тех пор, пока власть не переходит в руки необратимых дегенеративных тенденций (рис. 1.3).
Согласно Капанджи, человек по определению может наблюдаться только в данный момент своего существования. Таким образом, биомеханика радикально отличается от стандартной механики. Человек должен рассматриваться как «временной срез» четырехмерной реальности. Его состояние сочетает механические ограничения, которые он проходит, и его рост и потенциал износа.
Рис. 1.3. Беговое полотно жизни (А. Капанджи, 2011. Что такое биомеханика? Sauramps edition)

Негэнтропия
Под этим непонятным термином скрываются основные механизмы жизни. Термин «негэнтропия» (отрицательная энтропия) означает организующий фактор, который противодействует естественному постепенному стремлению системы к беспорядку, определяемому как энтропия.
Эффекты временной эволюции наблюдаются в постоянном изменении каждой части живого механизма. Способность к динамическому структурному изменению отличает биомеханику от промышленной механики.
Живые системы обладают гомеостазом. Гомеостаз (от слов «гомео» — тот же и «стазис» — остающийся в покое) определяется как способность системы поддерживать себя в константном состоянии с точки зрения формы и внутренних условий, несмотря на внешние изменения. Система, находящаяся в состоянии полного стабильного равновесия, в принципе, исчерпала все возможные обмены с окружающей ее средой. Это соответствует состоянию «смерти» системы. Все закрытые системы приходят к этому состоянию рано или поздно, этот физический принцип называется энтропией. Благодаря гомеостазу живой мир противостоит деградации, связанной с направлением времени. Благодаря этому процессу живые системы борются за обращение энтропии.
Износ системы
Даже если все живые существа могли бы временно обратить энтропию, они бы никогда не вернулись к своему исходному состоянию. Имеется тенденция эволюции в направлении несколько измененного состояния, близкого, насколько это возможно, к исходному состоянию. Всегда существует определенный естественный износ системы.
Износ - это враг в промышленной механике. Но жизнь постоянно перестраивает все биомеханические части. Наши кости, мышцы и суставы никогда не бывают одинаковыми дважды. Мы трансформируемся и восстанавливаемся. С ходом времени жизни любой износ частей компенсируется их восстановлением.
Эволюция системы
Из исходной клетки живое существо развивается и строит себя путем самоудвоения. Пластичность обеспечивает еще одну отличительную черту живых механических структур - адаптацию. Исследования соединительной ткани показывают, что жизненные силы адаптируют части тела к условиям среды. Жизнь реагирует на механические напряжения, что позволяет системе приспосабливаться к изменениям среды.
Повторные напряжения могут вызывать усиление попыток определенных механических структур противостоять изменениям среды. Это происходит, например, когда ткань становится фиброзной, или когда суставы формируют костные шпоры или откладывают дополнительные слои кости в попытке адаптироваться к новым условиям. И наоборот, недостаток механических потребностей, например при постельном режиме, вызывает значительную деминерализацию костей, которым больше не требуется быть твердыми и жесткими.
Терапевтические интересы
С ходом времени живой механизм может: (1) поддерживать свою форму и противостоять износу, при этом продолжая функционировать; (2) сохранять относительную стабильность за исключением некоторой крайней эволюции и адаптации.
В любой заданный момент биомеханическое состояние индивидуума определяется механическими напряжениями, которые он испытывает, и его способностью к росту и регенерации. Поддерживая усилия роста и сохранения, мануальная терапия может также влиять на условия функционирования сустава.
Использование механической свободы
Капанджи подчеркивал еще одно функциональное различие между промышленными и живыми суставами. В промышленных суставах износ пропорционален механической свободе. Отсутствие механической свободы важно для промышленных суставов, так как свобода может вызывать повреждение. Напротив, Капанджи считает, что некоторая степень свободы необходима для живых суставов. Тогда как части могут быть идеально приспособлены друг к другу в промышленной механике, это не всегда так в живой механике.
Капанджи выделил три основных фактора, которые обеспечивают свободу механического сустава:
- тенденция осей сустава эволюционировать
- неправильная форма поверхностей суставов
- реципрокная (взаимная) конформация (пространственное расположение) суставных поверхностей (комплементарная конформация).
Тенденция осей сустава эволюционировать
В промышленной механике оси фиксированы и часто материализованы. В биомеханике оси не вещественны, они имеют тенденцию эволюционировать как мгновенные оси. Следовательно, производство искусственного сустава - трудный процесс. Необходимо мыслить биомеханически, чтобы сконструировать части протеза, оси которого не материализованы и не фиксированы. Кроме того, оси этих суставов почти никогда не перпендикулярны друг другу (ортогональны). Они обычно косые и не соответствуют ортогональным плоскостям, которые обычно служат анатомическими ориентирами. Стандартные плоскости и оси были созданы ранними анатомами и изображены в декартовых координатах относительно фронтальной, поперечной и сагиттальной плоскостей секционного стола.
Вот почему Капанджи сравнивает биомеханику с картофелиной: в биомеханике нет ничего перпендикулярного, в отличие от промышленных конструкций. Картофелина не имеет ни четкой формы, ни четких осей, и она может катиться непоследовательным образом. В результате ось движения следует вдоль воображаемых линий.
Следует остерегаться любых концептуальных сравнений сустава с механическими моделями. Тогда как подобные схемы дают некоторое начальное понимание и позволяют нам визуализировать то или иное движение, они не должны ограничивать наше мышление. Это, в частности, касается стопы, исключительно сложного и удивительного ансамбля, который слишком часто упрощают до механических карикатур, таких как гетерокинетический коленчатый сустав, рычаг или торсионный стержень. Реальность намного сложнее и гораздо менее искажена.
Неправильная форма суставных поверхностей
Другой аспект «картофельной» механики, который наделяет ее теми качествами, которые промышленные инженеры пытаются устранить, связан с общепринятыми идеями о поверхностях суставов. Например, головка бедренной кости обычно описывается как шар, который соответствует выемке тазовой кости. Истинная картина более сложна.
С точки зрения формы даже самые правильные суставные поверхности далеки от идеальных геометрических фигур. Сферические поверхности, которые образуют чашеобразные суставы, такие как головка бедренной кости, не являются идеальными сферами, которые мы себе представляем.
Что касается конгруэнтности, большинство суставов подходят друг к другу при некоторой механической свободе, заключенной в их устройстве. Не нарушая функцию, элемент свободы полезен для смазки и амортизации ударов в суставе.
Взаимно подходящие друг к другу суставные поверхности обладают взаимной пространственной структурной организацией. Именно процесс округления костей налаживает наше генетически предопределенное строение.
Исследование Рудольфа Фика (1911) внесло большой вклад в наше понимание этого процесса. Его эксперименты были направлены на то, что происходит, когда два эпифиза контактируют. Один принимает выпуклую форму, тогда как другой становится вогнутым, подстраиваясь под первый. Анализ показывает, что движение создает форму, и мышечно-сухожильные соединения (плечи рычага) определяют положение вогнутой и выпуклой поверхностей. Суставные поверхности одновременно создаются и подстраиваются благодаря автоматическим движениям, начинающимся с произвольных жестов плода внутри матки и продолжающихся с использованием сустава.
Здесь мы обнаруживаем еще одну фундаментальную характеристику биомеханики: неразделимую связь между формой и движением. Предварительно заготовленная форма очерчивает движение, а затем движение определяет и подстраивает форму.
Подход, направленный на суставную систему
Учитывая все сказанное выше, имеет смысл отказаться от любых чисто механических подходов к суставам человека. Единственным способом пересмотреть наше представление является рассмотрение сустава как счастливого результата экстраординарного набора обстоятельств.
Помещение сустава в правильный контекст
Движение как система может быть организовано на нескольких уровнях:
- Первый уровень включает анатомические компоненты суставного узла, то есть все классические элементы: кость, хрящ, капсулу, синовиальную мембрану, синовиальную жидкость, мениски, суставную губу, связки и короткие односуставные мышцы
- Второй уровень организует различные суставные системы в нечто вроде сверхсистемы, которая может быть рассмотрена как суставная цепь или суставной сегмент. Здесь мы обнаруживаем фасции, апоневрозы, длинные мышцы и вообще любые полисуставные компоненты, которые механически укрепляют и объединяют различные суставные единицы. Позвоночник и конечности также в этой категории
- Третий уровень, опорно-двигательный аппарат, — неотъемлемая часть индивидуума. Можно рассматривать его как метасистему, включающую все субъединицы. Этот аппарат позволяет человеку совершать волевые действия в окружающей его среде посредством собственных решений и нейромоторных возможностей. Этот аппарат взаимодействует с многочисленными другими системами, такими как кровеносная, отвечающими за функционирование и поддержание. Именно на этом уровне проявляются психопостуральные и постуроэмоциональные эффекты как постуральные реакции на эмоциональные стимулы
Каждый уровень обладает саморегулирующимся свойством, необходимым для сохранения константного или стабильного состояния. Фактически, каждый уровень выполняет контроль не только над собой, но также и над соседними категориями организации. В результате базовый уровень подлежит наибольшей регуляции. Когда мы желаем воздействовать на элемент, расположенный ниже на организационной пирамиде, будет полезно выявить локальные регуляторные дисфункции на высших уровнях организации.
Требование защиты
Любое движение живой ткани должно щадить «благородные» структуры, которые обеспечивают питание и иннервацию мобилизующих сегментов. Двигаться можно только при условии, что эти анатомические элементы не подвергаются опасности.
Обязательным требованием является защита нейроваскулярных структур, так как они являются скрытыми элементами параметров нагрузки сустава. Соответственно, определенные движения просто запрещены в механической программе сустава. Когда нейроваскулярные ткани испытывают дисфункцию, механорецепторы, расположенные в этих структурах, называемые интерорецепторами, посылают информацию, которая может нарушать локальную проприоцепцию и подвижность сустава.
Будущие перспективы
К сожалению, биомеханику слишком часто представляют с точки зрения чистой и жесткой механики, чего-то наподобие физики Ньютона. Оторванная от своей истинной биологической природы, биомеханика может быть упрощена даже до промышленно-механической карикатуры, изображаемой как последовательность уравнений или цепь векторов. Некоторое базовое понимание биомеханики необходимо, но оно не может объяснить всего.
Рис. 1.4. Биомеханическое единство

Цитата профессора Жана Кастена в предисловии к книге Жана Жираде (1976) хорошо описывает образ мышления, необходимый остеопату, пытающемуся понять механику тела человека:
«Важно, чтобы механика не отгораживала саму жизнь. Похождения тела трудно и проблематично собрать воедино и упростить до абстрактной схемы. Неважно, как сложна модель, машина остается всего лишь объектом механических, биомеханических и кибернетических законов».
Жизненные силы вездесущи и являются неотъемлемой частью нашего нового подхода к лечению суставов. Фика и соавторы (1987) описывают это следующим образом: «Механическое и биологическое едины, в сущности два выражения одной дисциплины, как взаимопроникающие и неразделимые Инь и Ян в китайской философии» (рис. 1.4).
Пример системного взаимодействия
В целом мы обусловлены нашими знаниями и заранее сложившимися идеями. Чтобы прогрессировать, мы должны иногда пересматривать свой взгляд на вещи и отказываться от устоявшихся представлений. Например, когда мы представляем кость как нечто твердое, это связано с тем, что биомеханика и гистомеханика продемонстрировали нам множество свойств губчатой и кортикальной кости. Будучи засыпанными множеством числовых данных анизотропии сопротивления или даже значениями модуля Юнга различных костных тканей, мы выстроили картину жесткости кости через призму только этих элементов.
В целом, структурное сопротивление кости связано с прочностью кортикальной кости и трабекулярным строением губчатого компонента, который упрочняет кортикальный слой. Хорошо известно, что силовые линии материализуют различные усилия, которые прилагаются к данному сегменту кости. Тем не менее, структура губчатой и кортикальной кости представляет собой не более чем скелет минерального каркаса сухой кости. По этой причине мы можем забывать о мягких частях кости, которые заполняют межтрабекулярные пространства живой кости:
- Мягкая кость имеет выстилку жировыми и гемопоэтическими компонентами
- Сосуды обеспечивают питательными веществами костные ткани и способны поддерживать баланс анаболизма и катаболизма посредством их обмена
Рис. 1.5. Внутрикостные сосудисто-костномозговые силы
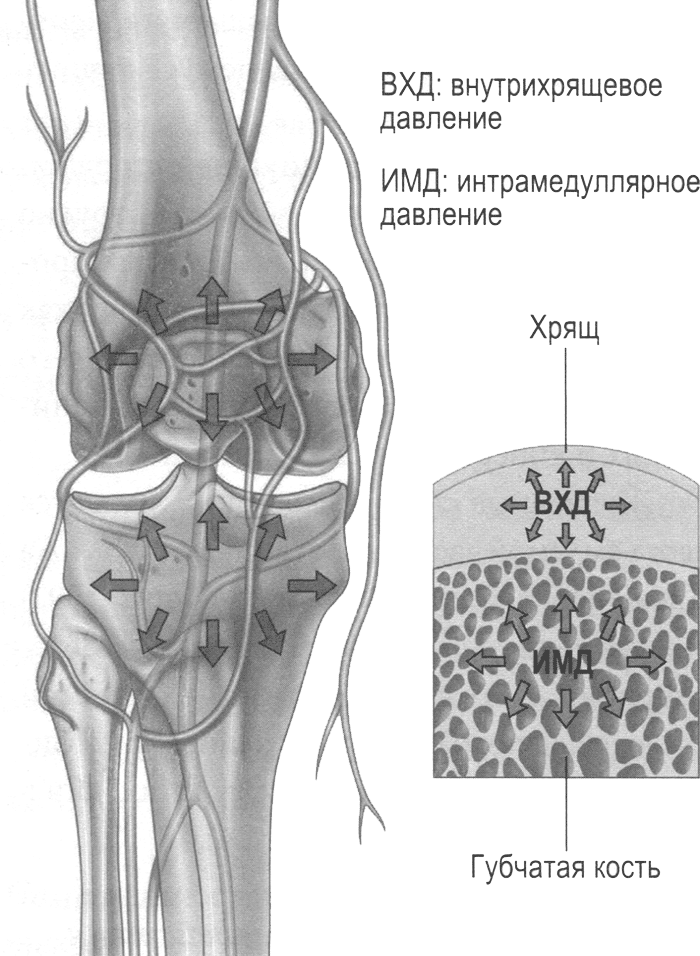
Живую кость правильнее рассматривать как спрессованный твердый орган, так как ее сосудисто-костномозговые компоненты оказывают давление порядка 20 мм ртутного столба на выстилку внутренней полости, эндост.
Это сосудисто-костномозговое напряжение тканей, обусловленное тургором, носит название тургорного эффекта, нечто подобное мы наблюдаем в висцеральной системе (рис. 1.5). Исследования показывают, что эта сила, даже будучи умеренной в сравнении с внутренним сопротивлением костной ткани, увеличивает трабекулярное сопротивление и эластичность кости. Тургорный эффект, будучи сосудистого происхождения, выполняет функцию гидравлического упрочнения. Увеличивая жесткость губчатой кости, а также упрочняя кортикальную кость, тургор эффективно упрочняет всю кость (Аибшнер и соавт., 2005).
Гидравлическое упрочнение значимо, в частности, в длинных костях нижних конечностей, которые постоянно «раздуваются» благодаря кровяному давлению внутри эпифизов. Эта сила помогает концу кости лучше амортизировать нагрузки на хрящ, одновременно упрочняя эпифиз. Сосудистое строение в тазобедренном суставе очень характерное, венозный объем в шесть-восемь раз больше артериального объема (Фика и соавт., 1987). Кроме метаболической функции кровеносные силы в тазобедренном суставе оказывают физическое влияние на механические свойства субхондральной кости и играют роль в защите хряща.
Благодаря этому простому примеру мы можем видеть, как сосудистые структуры вместе с функцией кровообращения участвуют и в механической функции, которая обычно рассматривается как принадлежащая только скелетным элементам.

Пациенты, которым нельзя было помочь в свое время, заставили авторов задуматься о причинах неудач. Иногда ответы можно было найти только после многих лет применения различных методов и обучения на собственных ошибках. Эта книга основана на клиническом процессе проб и ошибок.
В первой части книги Жан-Пьер Барраль и Ален Круабье исследуют "скрытые" императивы, влияющие на биомеханику позвонков. Что еще может ограничивать сложную комбинированную игру структур позвоночника помимо тех, что описываются стандартными законами? Используя новаторский подход, авторы представляют свою системную модель позвоночного столба применительно к сложностям шейного отдела позвоночника. Недостаточно вмешиваться только на уровне дугоотростчатых суставов. Врач должен учитывать нервную, сосудистую, мышечную, связочную системы, особенности твердой мозговой оболочки и прочие компоненты.
Во второй части книги представлены оригинальные техники, позволяющие облегчить состояние множеству пациентов, страдающих от боли в шее. Описанные техники являются плодом многолетнего клинического опыта. Точные и полные маневры воздействуют на суставы вместе с периартикулярными структурами.
Эта книга предназначена для профессиональных остеопатов, обучающихся врачей, реабилитологов и мануальных терапевтов, желающих расширить свою практику и обогатить диапазон навыков и методов.
Книга "Новый мануальный суставной подход. Нижняя конечность" - Жан-Пьер Барраль, Ален Круабье

Эта исчерпывающая книга предлагает инновационные и оригинальные техники для острых и хронических состояний нижней конечности. Она богато иллюстрирована рисунками и фотографиями. Книга представляет новые техники, простые, целенаправленные и не требующие усилий. Они являются плодом многих лет клинического опыта - динамического отбора эффективных техник с целью помочь остеопату принести облегчение пациентам.
Техники охватывают все, что может нарушать нормальное функционирование сустава: кожу, фасции, апоневрозы, мышцы, связки, капсулы, синовиальные мембраны, серозные сумки, жировую ткань, хрящ, суставную губу, кости, нервы и артерии. Кроме того, Жан-Пьер Барраль и Ален Круабье обсуждают важное влияние внутренних органов, психоэмоциональных взаимосвязей и даже поведения человека, так как все это может влиять на подвижность суставов.
«Новый мануальный суставной подход. Нижняя конечность» входит в серию книг «Новый мануальный суставной подход». Эта серия идеально подходит для остеопатов, студентов, изучающих остеопатию, физиотерапевтов и мануальных терапевтов, желающих углубить свою практику и обогатить свой набор навыков.
Жан-Пьер Барраль - дипломант остеопатии Европейской школы остеопатии (Мейдстон). Преподает на кафедре остеопатической манипуляции медицинского факультета Парижского университета, Париж, Франция, и является членом Регистра остеопатов Франции.
Ален Круабье - дипломант остеопатии. Член Регистра остеопатов Франции и член Французской академии остеопатии. Имеет степень Магистра наук о человеке и обществе.
Купить книгу "Новый мануальный суставной подход. Нижняя конечность" - Жан-Пьер Барраль, Ален Круабье

Новая книга Жан-Пьера Барраля «Расширенные висцеральные манипуляции: нейроэндокринный подход к брюшной полости» объединила весь накопленный автором опыт, вобрав в себя многое, что было опубликовано ранее, но впервые подробно описаны поиск, определение и использование в работе стратегических функциональных зон тела, особенности эмбрионального развития висцеральных органов применительно к остеопатическим подходам, и использование этих особенностей в поддержании здоровья, влияние нейроэндокринной системы на функционирование висцеральных органов, особенности поиска и техники работы на висцеральной нервной системе.
Подходы к работе на вегетативной нервной системе, симпатической и парасимпатической ее отделах уникальны. Разработанные техники простые и изящные. Большое внимание уделено сальникам, диафрагмам тела, подробно обосновываются подходы к каждому органу и остеопатические техники для восстановления всех видов подвижности и движения внутренних органов.
Весь материал прекрасно систематизирован, хорошо иллюстрирован рисунками, что значительно облегчает понимание и усвоение его студентами и врачами. Книга впервые издается на русском языке и, несомненно, будет востребована остеопатическим сообществом.
Книга "Травма. Остеопатический подход" - Жан-Пьер Барраль

Основанная на глубоких исследованиях и богато иллюстрированная книга открывается обзором биомеханики травмы. Авторы показывают возможности приложения остеопатического механического подхода к травме ко всему телу с особым вниманием к хлыстовой травме. Далее авторы обращаются к функционально-анатомическому подходу, делая акцент на структуры черепа и другие составляющие центральной нервной системы, равно как и окружающие и защищающие их структуры.
В завершение, они рассматривают травму с точки зрения ее влияния на различные ткани и системы тела, включая костно-суставную, висцеральную и сосудистую системы, а также возможные последствия травмы, проявляющиеся в состоянии каждой из перечисленных систем.
Представив остеопатическую интерпретацию травмы, авторы предлагают ряд собственных уникальных методов остеопатической диагностики с особым вниманием к структурам, которые наиболее часто поражаются при травме: твердой мозговой оболочке, швам черепа, кранио-фациальным мембранным соединениям, средостению и селезенке. Книга завершается описанием мануальных техник, рекомендуемых авторами для устранения некоторых наиболее стойких последствий травмы.
Книга "Мануальная терапия периферических нервов" - Барраль Ж. П., Круабье А.

«Мануальная терапия периферических нервов» — новая книга пользующихся мировой известностью специалистов в области остеопатии Жана-Пьера Барраля и Алена Круабье. Книга, ранее не издававшаяся в России. Остеопатия, ставшая врачебной специальностью в России, требует хорошей учебной литературы для постижения тонкостей специальности. Этот учебник включает самые последние данные по анатомии и физиологии нервной ткани и нервов, что позволяет легко понять предлагаемые авторами техники воздействия на нервы с целью улучшения их функционирования. Книга иллюстрирована большим количеством анатомических рисунков и фотографий, что значительно облегчает усвоение учебного материала.
Перевод книги и ее издание потребовали напряжения всех сил коллектива, занятого в этой работе. И мы с большой гордостью предлагаем вам нашу работу.
Купить книгу "Мануальная терапия периферических нервов" - Барраль Ж. П., Круабье А.