Лекция для врачей "Осложнения при имплантации кардиостимулятора: неэлектрические и электрические" (отрывок из книги "Иллюстрированное пошаговое руководство по применению кардиостимуляторов - Барольд С., Штрубандт С.)
Осложнения при кардиостимуляции
С имплантацией кардиостимулятора связаны две основные группы осложнений: а) неэлектрические осложнения, в том числе острые осложнения во время имплантации, такие как пневмоторакс, и осложнения, связанные с положением электродов, формированием ложа ЭКС (электрокардиостимулятор), и б) электрические осложнения и аритмии.
Неэлектрические осложнения
В табл. 7 перечислены основные неэлектрические и аритмические осложнения.

Таблица 7. Неэлектрические/аритмические осложнения

Осложнения, связанные с венозным доступом
Риски осложнений, связанных с техникой пункции подключичной вены, зависят от навыков оператора и сложности выполнения пункции подключичной вены из-за анатомии пациента. Применение методики выделения плечеголовной вены (v. cephalica) практически устраняет эти осложнения. Использование подмышечной вены (v. axillaris) безопаснее подключичной пункции. Частота пневмоторакса практически равна нулю при доступе через плечеголовную или подмышечную вену.
Пневмоторакс в результате подключичной пункции встречается редко, но иногда может возникать у пациентов с эмфиземой или анатомическими аномалиями. Пневмоторакс может протекать бессимптомно и выявляться при рутинной контрольной рентгенографии грудной клетки, или он может проявляться болью из-за раздражения плевры, респираторным дистресс-синдромом или гипотонией. Пневмоторакс, охватывающий менее 10% плевральной полости, в основном доброкачественный и проходит без вмешательства. Пневмоторакс, вовлекающий более 10% плевральной полости, или напряженный пневмоторакс требуют немедленной установки активного дренажа.
Кровохарканье может возникнуть при проколе легкого и может быть связано с пневмотораксом. Кровохарканье обычно проходит самостоятельно.
Гемоторакс — редкое осложнение подключичной пункции. Может быть вызван повреждением подключичной артерии или непреднамеренным введением в артерию большого интродьюсера и/или дилятора. При отсутствии пневмоторакса кровотечение обычно контролируется давлением в легких. Однако если ипсилатеральное легкое также коллапсирует, кровь может свободно проникать в плевральную полость (гемопневмоторакс), и это может привести к значительной гипотензии, связанной с кровотечением, и нарушениям гемодинамики, требующим дренирования.
Воздушная эмболия — редкое осложнение пункции подключичной вены. Чаще всего возникает при продвижении электрода через интродьюсер из-за развития в нем отрицательного давления. Этого осложнения можно избежать, используя глубокое положение Тренделенбурга во время продвижения интродьюсера или электродов, зажимая интродьюсер при извлечении дилятора или используя интродьюсеры с гемостатическим клапаном. Диагноз воздушной эмболии будет очевиден при рентгеноскопии. Пациенты в основном устойчивы к данному осложнению. Однако при большом эмболе могут возникнуть респираторный дистресс, гипотензия и десатурация артериальной крови кислородом.
Венозный тромбоз, или окклюзия подключичной и безымянной вен, — обычное явление, но часто бессимптомное. Острый симптомный тромбоз встречается относительно редко и может вызвать односторонний отек руки, обычно через несколько недель после имплантации. Синдром верхней полой вены (из-за окклюзии) встречается реже, но протекает тяжелее (вызывает отек лица, цианоз, а также появление коллатеральных вен на грудной клетке). Симптомный тромбоз, проявляющийся отеком руки, можно лечить консервативно, придав руке возвышенное положение, назначив гепарин с последующей пероральной антикоагулянтной терапией, или более агрессивно, с помощью тромболитических препаратов. Синдром верхней полой вены требует консультации сосудистого хирурга для возможной последующей хирургической коррекции. Окклюзия подключичной вены может выявляться примерно в 30% случаев при длительном наблюдении за пациентами с ЭКС/ИКД (имплантируемый кардиовертер-дефибриллятор).
Легочная эмболия возникает редко, но, вероятно, частота осложнений недооценена, поскольку в большинстве случаев эмболия остается нераспознанной. Присутствие симптомной тромбоэмболии легочной артерии (потенциально опасной для жизни) у пациента с устройством должно вызывать подозрение, что ее источником является электрод для кардиостимуляции или ИКД (имплантируемый кардиовертер-дефибриллятор).
Повреждение плечевого сплетения может произойти из-за попадания иглой в плечевое сплетение, которое расположено рядом с подключичной/подмышечной веной. Это осложнение следует заподозрить в послеоперационном периоде, если пациент жалуется на боли или парестезии верхней конечности. Обычно наступает полное выздоровление, но повреждение нервной системы может привести к стойкой атрофии мышц и нарушению подвижности плеча.
Осложнения, связанные с электродом
Неправильное положение электрода может быть результатом неправильной трансвенозной установки электрода. У пациентов с дефектом межпредсердной перегородки или большим открытым овальным окном желудочковый электрод может быть случайно проведен в ЛЖ (левый желудочек). Это осложнение возникает из-за того, что рентгеноскопия часто ограничивается одной прямой проекцией во время процедуры, а положение ЛЖ может совпадать с положением ПЖ (правый желудочек). Следует подозревать нахождение электрода в ЛЖ, когда дистальный конец электрода находится сзади на рентгеноскопии, а желудочковая стимуляция соответствует картине БПНПГ (блокада правой ножки пучка Гиса) на ЭКГ (электрокардиограмма).
Дислокация электрода обычно происходит в первые дни после имплантации, однако может возникнуть и в течение трех месяцев после первоначальной имплантации. Дислокация правожелудочкового электрода происходит примерно в 1% случаев, а дислокация предсердного электрода встречается чаще. Дислокация электрода может быть вызвана неправильным первоначальным расположением электродов, плохой фиксацией электродов или чрезмерными движениями руки и плеча вскоре после операции. Дислокация электрода может привести к потере захвата и потере восприятия. Диагноз подтверждается опросом устройства, показывающим изменения порогов восприятия и стимуляции по сравнению с данными при имплантации, и рентгеновским снимком грудной клетки в случае макродислокации. В данном случае обязательно требуется изменение положения электрода для восстановления функций стимуляции и восприятия.
Повреждение электрода. Во время имплантации может произойти повреждение электрода. Повреждение изоляции может произойти из-за ошибочного наложения шва вокруг электрода без использования специальной защитной муфты, слишком тугого шва на муфте или случайного пореза во время операции.
Осложнения, связанные с ложем электрокардиостимулятора
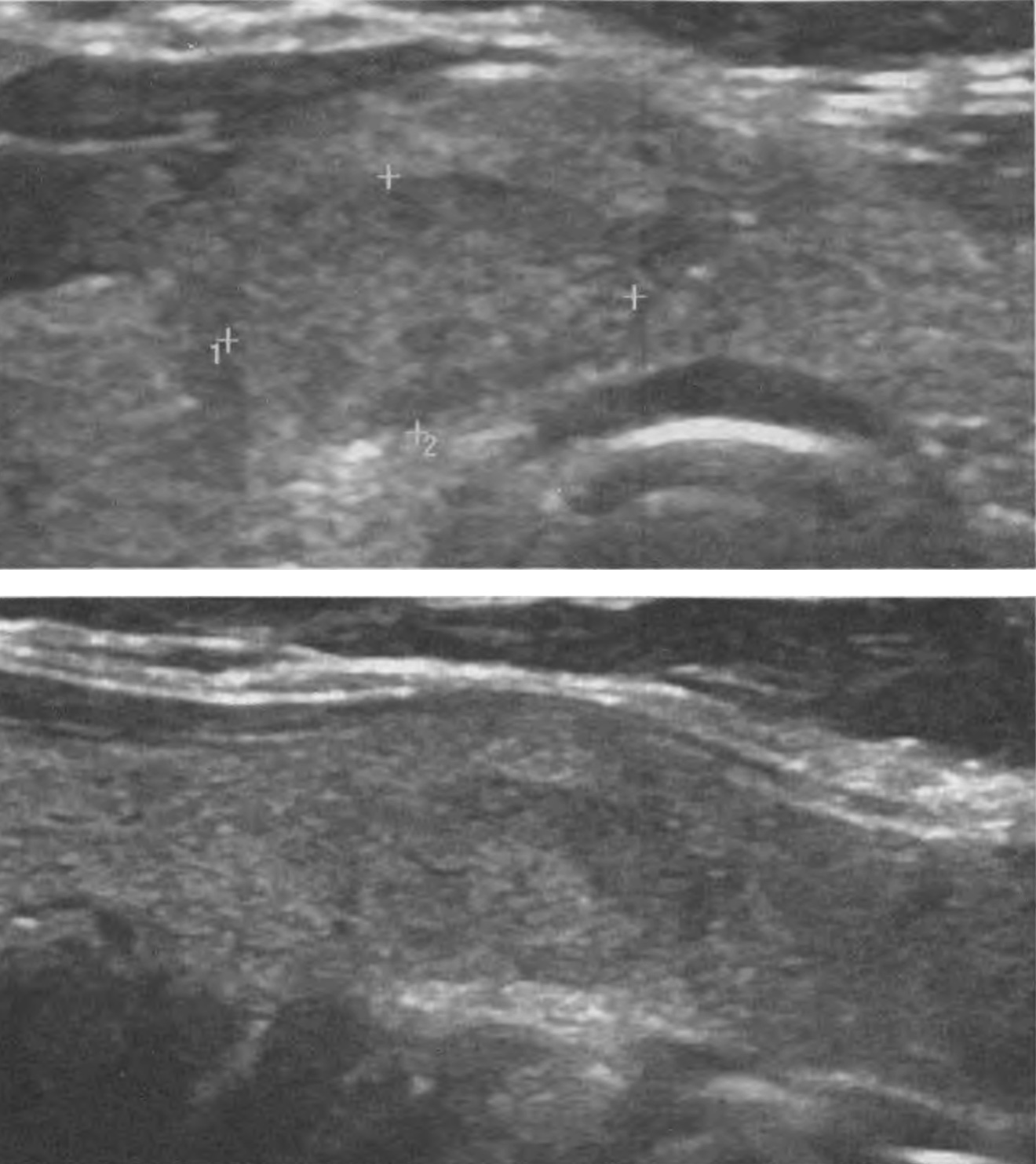
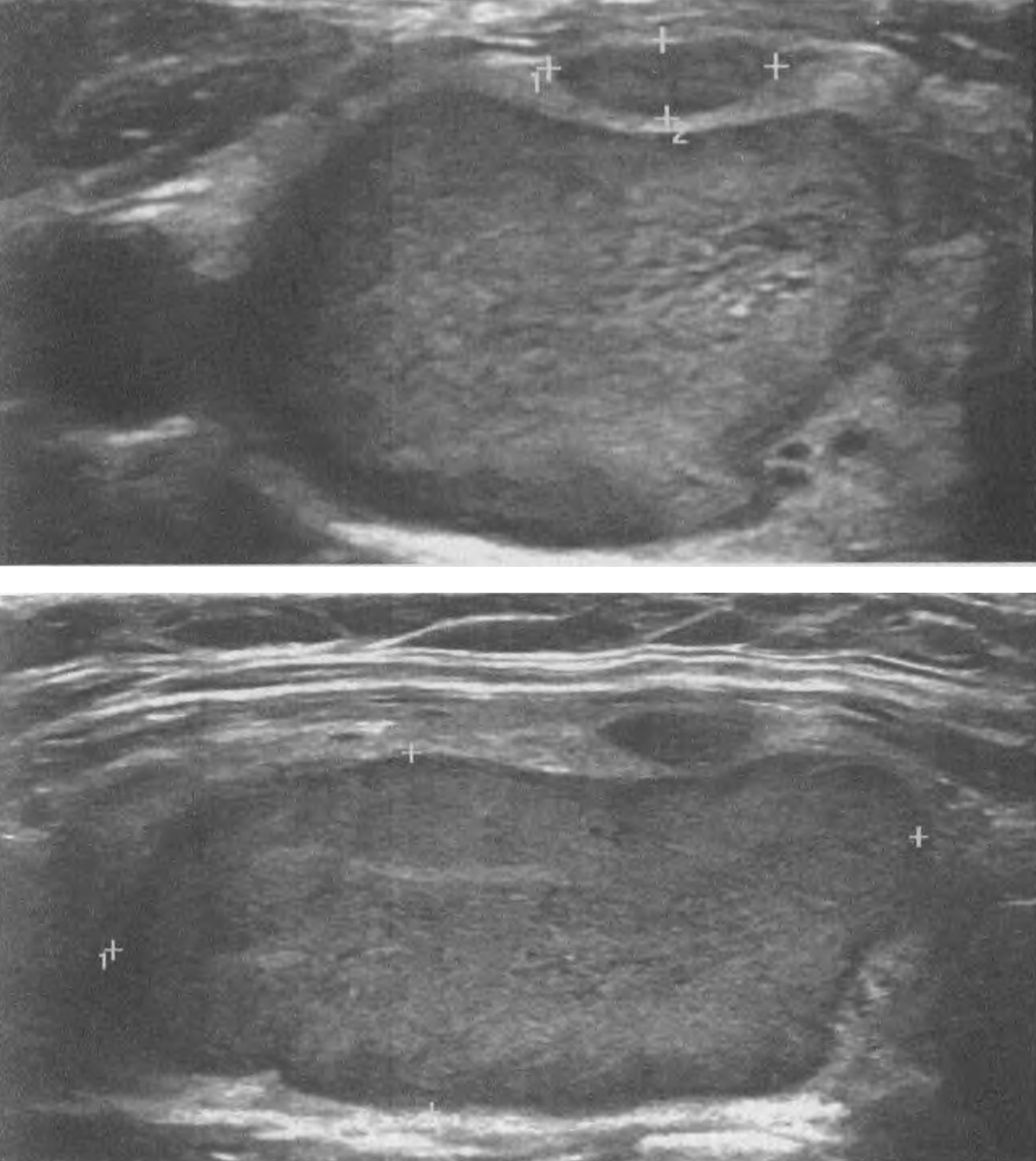
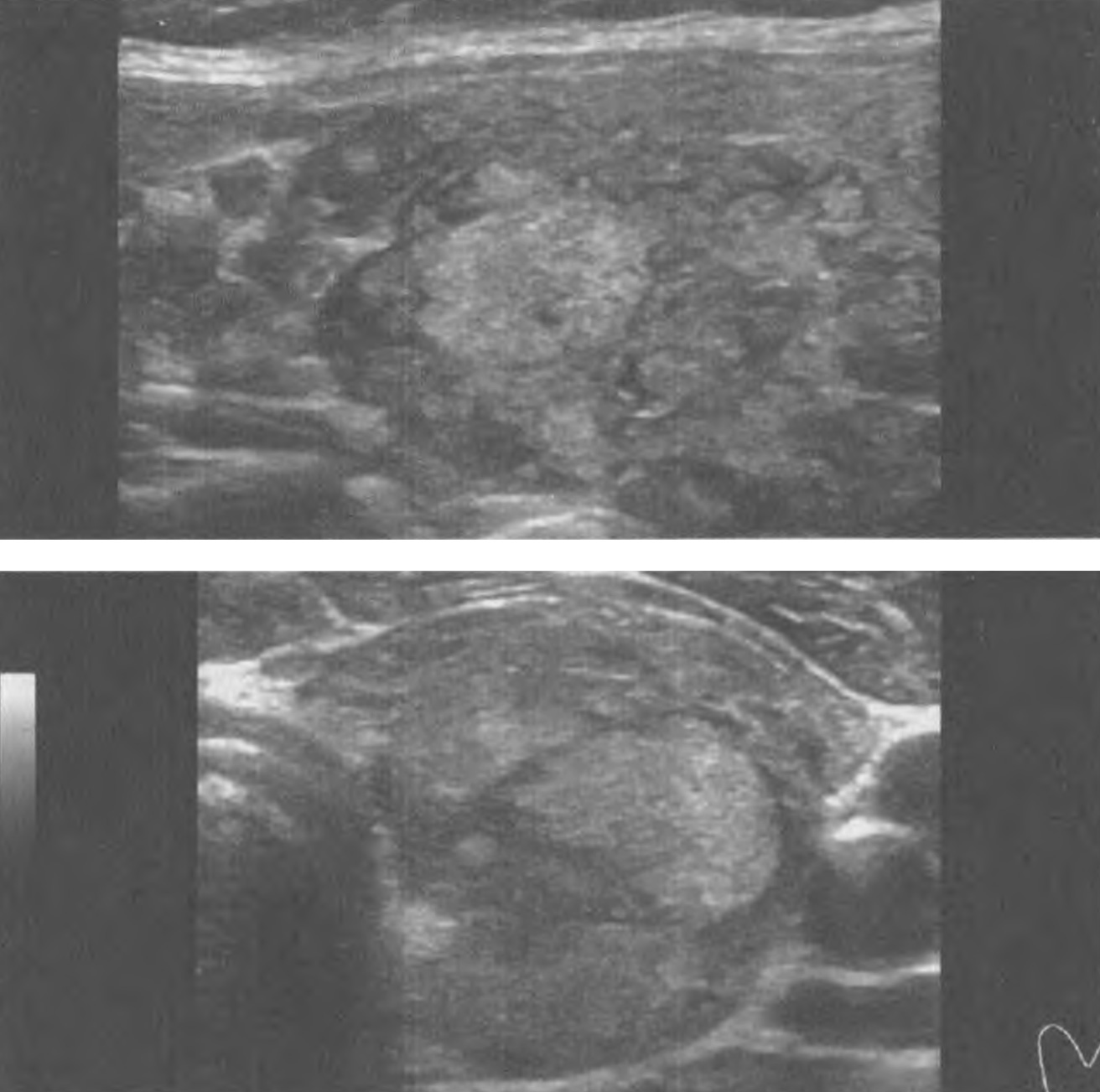
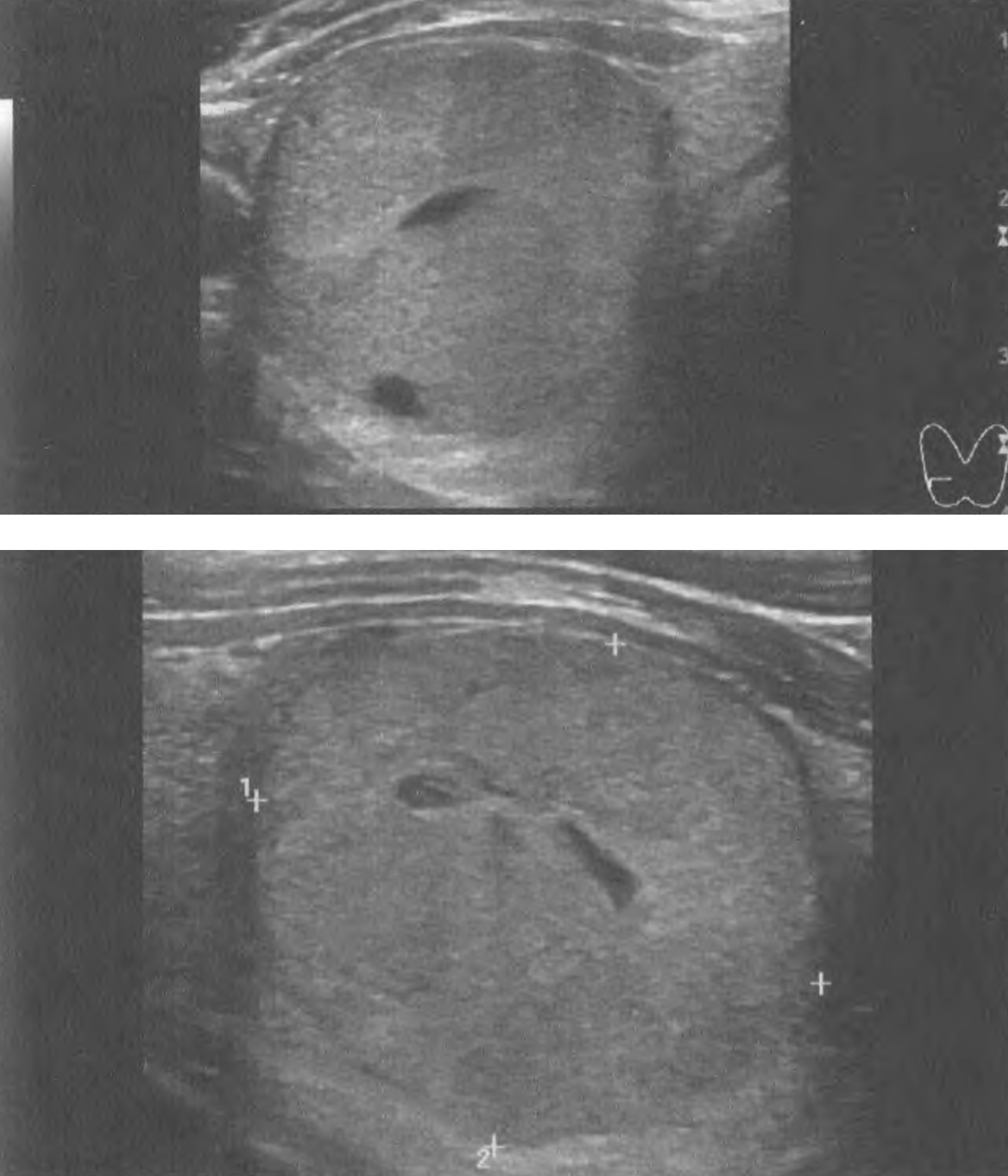
Серома ложа ЭКС возникает из-за скопления жидкости и обычно бывает доброкачественной по своему течению, если не сопровождается признаками воспаления. Это чаще наблюдается после смены ЭКС, когда новый ЭКС в своих размерах меньше предыдущего. Не рекомендуется использовать аспирацию из-за риска заражения инфекцией.
Гематома ложа ЭКС встречается относительно часто. Гематома обычно лечится консервативно, если только она не увеличивается в размерах, не становится напряженной и болезненной, после чего возникает необходимость в эвакуации содержимого ложа ЭКС с повторной операцией для выявления и контроля места кровотечения. Следует избегать аспирации из ложа ЭКС. Риск послеоперационного кровотечения выше при приеме гепарина, чем при приеме варфарина.
Эрозия характеризуется разрушением ткани над имплантированным ЭКС, возможно вследствие движений электрода под кожей. Факторы риска включают слишком маленькое ложе ЭКС с натяжением вышележащих тканей и слишком поверхностную или латеральную имплантацию ЭКС у худых взрослых или детей. Когда эрозия распознается на ранней стадии, о чем свидетельствует покраснение и истончение кожи, можно рассмотреть возможность повторной операции по перемещению ЭКС в подмышечную область. Если какая-либо часть ЭКС или электрода выступила наружу через кожу, эта сторона считается инфицированной.
Инфекция в ложе ЭКС попадает примерно в 1–2% случаев первичной имплантации, но чаще возникает после замены устройства. Показатель смертности очень высок, если не удалить ЭКС и электроды. Проявления могут варьировать от местных реакций (покраснение, болезненность, припухлость, абсцесс вокруг устройства) до нечастого опасного для жизни системного сепсиса с положительными посевами крови. Ранние инфекции обычно вызываются золотистым стафилококком (Staphylococcus aureus). Поздние инфекции обычно вызываются эпидермальным стафилококком (Staphylococcus epidermidis), протекают более медленно и могут проявляться через месяцы или годы после имплантации, иногда болью в области кардиостимулятора. Вегетации могут возникать в ПП (правое предсердие), ПЖ и трехстворчатом клапане. Вегетации лучше всего визуализируются с помощью чреспищеводной эхокардиографии. Наличие инфекции требует полного удаления электрода и устройства с последующим введением антибиотиков. Частичное удаление связано с высокой частотой рецидивов.
Перфорация
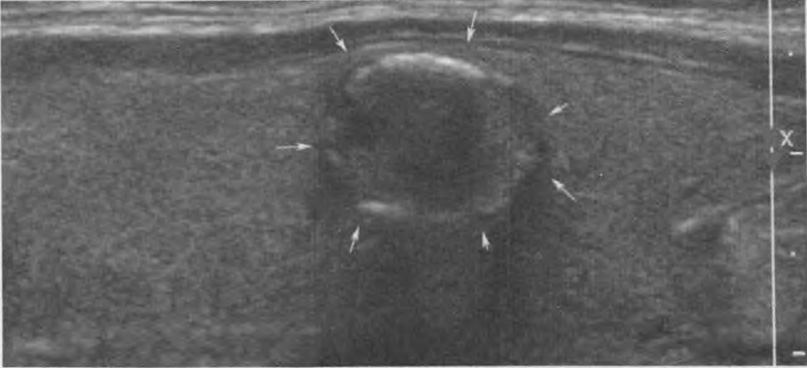
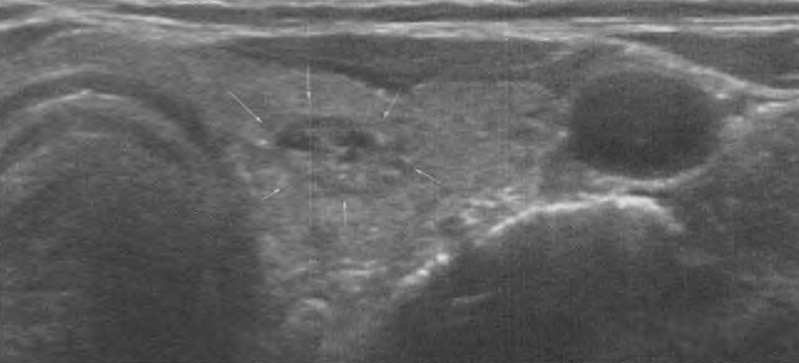
Перфорация сердца — редкое, но потенциально серьезное и часто нераспознаваемое вовремя осложнение имплантации ЭКС — может произойти во время имплантации и вызвать гипотензию из-за тампонады сердца. Перфорация обычно не приводит к тампонаде, если электрод извлекается и перемещается, поскольку перфорационное отверстие часто закрывается окружающими тканями.
Известная сегодня частота симптомной перфорации после имплантации составляет около 1%. Истинная частота перфорации неизвестна, поскольку она может протекать субклинически и бессимптомно. Действительно, компьютерная томография у пациентов с неосложненной кардиостимуляцией показывает 5% случаев перфорации ПЖ и 10% при использовании предсердных электродов. Факторы риска включают женский пол, возраст и использование жестких стилетов. Прием перорального стероида в течение 7 дней до имплантации электрода предрасполагает к перфорации.
После имплантации перфорацию свободной стенки ПЖ можно распознать по перикардиальной боли, боли в животе, одышке, обмороку, шуму трения перикарда, синусовой тахикардии, повышению порога стимуляции желудочков, плохой чувствительности, диафрагмальной стимуляции, стимуляции межреберных мышц, выпоту в перикарде и левостороннему гемотораксу. В редких случаях перфорация происходит в ЛЖ через межжелудочковую перегородку. ЭКГ при стимуляции может показать картину БПНПГ, если происходит стимуляция ЛЖ, обычно из перикардиального пространства. Рентген грудной клетки может показать контуры электрода за пределами сердечной тени. Для регистрации положения электрода необходимо выполнить эхокардиографию и компьютерную томографию. Чреспищеводная эхокардиография превосходит трансторакальную эхокардиографию в визуализации всего электрода. Компьютерная томография особенно полезна, когда эхокардиография сомнительна. Мультиспиральная компьютерная томография становится методом выбора при диагностике перфораций предсердными и желудочковыми электродами. Появление электродов с активной фиксацией и малого диаметра, электродов для имплантируемых кардиовертеров-дефибрилляторов, вероятно, увеличило риск отсроченной перфорации ПЖ. Подострая перфорация ПЖ (через несколько дней или недель после, казалось бы, неосложненной имплантации, а иногда и намного позже) — редкое, но серьезное осложнение имплантации электрода.
В настоящее время перфорация обычно может произойти в сроки до 60 дней после имплантации и, в редких случаях, через несколько месяцев после имплантации. Поздняя перфорация может создать сложную диагностическую проблему и привести к катастрофической ситуации, если ее не распознать.
Подобные осложнения могут привести к смерти, если их не распознать на ранней стадии. У большинства пациентов электроды можно безопасно удалить в операционной под рентгеноскопическим контролем и непрерывным мониторингом ЭГМ (электрограмма). Данные исследования необходимы для подтверждения перфорации. Удаление электрода нужно производить с хирургической поддержкой и под контролем чреспищеводной эхокардиографии. Простая тракция электрода бывает успешна в 80% случаев. Электрод при его стабильном положении и бессимптомной перфорации можно оставить в том же положении, если функции стимуляции и восприятия удовлетворительны. Если данные параметры неудовлетворительны, электрод можно оставить на месте и имплантировать новый электрод.
Комплексы на униполярной ЭГМ могут выглядеть вертикальными, соответствующими стандартным прекардиальным отведениям над боковой линией грудной клетки. При постепенном выводе электрода может возникнуть некоторая желудочковая эктопия, так как электрод проходит через стенку желудочка. Затем происходит очевидная элевация сегмента ST (ток повреждения). Данный признак исчезает, когда электрод перестает касаться эндокарда. Внутриполостная ЭГМ часто показывает глубокий зубец S с последующим постепенным уменьшением его амплитуды, а зубцы Р появляются по мере дальнейшего удаления электрода.
Запись обычной униполярной желудочковой ЭГМ с проксимального полюса электрода ПЖ и атипичной ЭГМ с дистального электрода должна вызвать подозрение на перфорацию электродом, равно как и наличие элевации сегмента ST на проксимальном полюсе и ее отсутствие на дистальном полюсе.
Предсердный электрод, перфорируя стенку предсердия, может перфорировать перикард и плевру, что, в свою очередь, может привести к правостороннему пневмотораксу, пневмоперикарду и, в редких случаях, к разрыву аорты.
Синдром рецидивирующего посткардиального повреждения при отсутствии перфорации следует рассматривать у пациентов, у которых после установки электрода развивается перикардиальный и плевральный выпот, связанный с другими признаками воспаления.
Электрические осложнения
Побочная мышечная стимуляция
Побочная мышечная стимуляция может происходить в нескольких местах.
- Сокращения диафрагмы. Стимуляция левой части диафрагмы стимулами от ЭКС может происходить во время традиционной правожелудочковой стимуляции, как с перфорацией правожелудочковым электродом, так и без нее. При диафрагмальной стимуляции всегда следует исключать перфорацию. Позднее появление диафрагмальной стимуляции может свидетельствовать о дефекте изоляции электрода. Стимуляция левой части диафрагмы при стимуляции ЛЖ электродом, находящимся в коронарной вене (при отсутствии перфорации), — важная и неприятная ситуация при бивентрикулярной стимуляции для лечения сердечной недостаточности. Сокращение правой части диафрагмы может быть связано с неправильным положением электрода в ПП.
- Стимуляция левой межреберной мышцы неизменно происходит из-за перфорации желудочковым электродом.
- Стимуляция большой грудной и дельтовидной мышц (мышечные подергивания) может быть вызвана: а) внесосудистым дефектом изоляции электрода (в случае биполярной стимуляции это всегда указывает на проблему изоляции); б) кардиостимулятором в униполярном режиме, который вследствие переворота прилежит анодом к скелетной мышце; в) нормально функционирующим униполярным кардиостимулятором без каких-либо проблем. В настоящее время это редкость, с учетом улучшенной конструкции современных кардиостимуляторов, но может встречаться при необходимости использования высоких выходных параметров.
Снижение выходных параметров, и прежде всего амплитуды напряжения импульса, при сохранении достаточного запаса безопасности часто сводит к минимуму или устраняет побочную мышечную стимуляцию. Уменьшения только длительности импульса обычно бывает недостаточно для ее устранения.
Купить медицинскую литературу по кардиологии в интернет-магазине медицинской книги shopdon.ru
Книга "Иллюстрированное пошаговое руководство по применению кардиостимуляторов"
Авторы: Барольд С., Штрубандт С., Синнейв А.

Данное руководство представляет собой наиболее известную и популярную в мире книгу, посвященную электрокардиостимуляции. Авторы прекрасно решили задачу донесения трудно воспринимаемой медицинской и технической информации до врачей, используя принцип “просто о сложном”, посредством множества оригинальных иллюстраций, схем, таблиц, пояснительного текстового материала.
Руководство начинается с описания базовых понятий и постепенно охватывает более сложные аспекты кардиостимуляции, включая устранение возникших проблем и последующее наблюдение за пациентом.
Издание будет интересно врачам всех специальностей, которые в своей практике в той или иной степени соприкасаются с электрокардиостимуляцией – кардиологам, кардиохирургам, электрофизиологам, аритмологам, анестезиологам и реаниматологам, работающим с пациентами кардиологического профиля.
Купить медицинскую литературу по кардиологии в интернет-магазине медицинской книги shopdon.ru
Содержание книги "Иллюстрированное пошаговое руководство по применению кардиостимуляторов" - Барольд С., Штрубандт С., Синнейв А.
Что такое электрокардиостимулятор
Регистрация деятельности электрокардиостимулятора
Основы электричества
Желудочковая стимуляция
Стимулирующие электроды
Восприятие: основные понятия
Функция восприятия: современная концепция
Основы электрокардиографии при электрокардиостимуляции
Другие однокамерные электрокардиостимуляторы
Основные функции в двухкамерных электрокардиостимуляторах DDD
Кардиостимуляторы DDD: максимальная частота ответа
Предсердно-желудочковый или атриовентрикулярный интервал (AVI)
Ретроградная вентрикулоатриальная синхрония в двухкамерных
кардиостимуляторах
Все функции двухкамерных кардиостимуляторов в режиме DDD
Виды тайминга базовой частоты
Предсердный захват
Автоматическое переключение режима (AMS)
Кардиостимуляция и рентгенография
Избыток восприятия, или оверсенсинг
Поиск и устранение неполадок
Влияние кардиостимулятора на гемодинамику и частотноадаптивная стимуляция
Кардиостимулятор и тахикардии (часть 1)
Кардиостимулятор и тахикардии (часть 2)
Купить медицинскую литературу по кардиологии в интернет-магазине медицинской книги shopdon.ru
Лечение тахикардии
Кардиостимулятор и электромагнитные помехи
Наблюдение и проверки кардиостимулятора
Удаленный мониторинг электрокардиостимулятора
Специальные функции
Бивентрикулярная стимуляция и сердечная ресинхронизация
Заключение
КАРДИОСТИМУЛЯЦИЯ
Имплантация
Основные функции
Источник питания
Частота или интервал?
Однокамерные стимуляторы
Основы электричества
Хронический порог стимуляции и запас безопасности
Восприятие
Полярность стимуляции и восприятия: униполярная и биполярная
Желудочковые сливные (fusion) и псевдосливные (pseudofusion)
комплексы
Рабочие параметры простого DDD-электрокардиостимулятора
Перекрестная помеха (crosstalk) и ее интервалы
Повышение сложности: наш простой DDD-электрокардиостимулятор дорос до девяти интервалов
Ответ на максимальную частоту в DDD- электрокардиостимуляторе
Тайминг базовой частоты в двухкамерных электрокардиостимуляторах
Фантомное программирование
Программируемость базовой частоты
Бесконечная петлевая тахикардия
Повторяющаяся вентрикулоатриальная синхрония без повторного
входа сродни бесконечной петлевой тахикардии
Типы двухкамерных электрокардиостимуляторов
Собственный ритм и феномен овердрайв-подавления
Влияние электрокардиостимулятора на гемодинамику
Частотно-адаптивные стимуляторы
Стимулы электрокардиостимулятора
Магнитный режим
Нормальные QRS-паттерны во время правожелудочковой
стимуляции
Левожелудочковая эндокардиальная стимуляция
Проявления инфаркта миокарда на фоне кардиостимуляции
Сердечная память
Альтернации QRS-комплекса при стимуляции (pacemaker alternans)
Осложнения при кардиостимуляции
Неэлектрические осложнения
Электрические осложнения
Функция автоматического переключения режима (automatic mode switching)
Минимизация правожелудочковой стимуляции
Влияние препаратов и электролитный дисбаланс
Применение магнита
Алгоритмы верификации захвата
Надлежащее сохранение информации
Факторы, влияющие на срок службы электрокардиостимулятора
Наблюдение и проверки кардиостимулятора
(процедуры follow-up)
Кардиостимулятор как имплантируемая система Холтера:
сохранение электрограмм
Специальные функции в электрокардиостимуляторах
Сердечная ресинхронизирующая терапия
Гемодинамика при сердечной ресинхронизации
Сердечная ресинхронизирующая терапия со стимуляцией только левого желудочка
Сердечная ресинхронизирующая терапия у пациентов с хронической сердечной недостаточностью I и II класса по Нью-Йоркской ассоциации сердца с блокадой левой ножки пучка Гиса и сниженной функцией левого желудочка
Сердечная ресинхронизирующая терапия у пациентов с блокадой правой ножки пучка Гиса
Сердечная ресинхронизирующая терапия у пациентов с узким
QRS- комплексом
Механизм лечебного действия и эффект от сердечной ресинхронизирующей терапии
Альтернативные способы стимуляции левого желудочка
Какого пациента можно назвать респондером на сердечную ресинхронизирующую терапию?
Осложнения при имплантации системы для сердечной
ресинхронизирующей терапии
Влияние сопутствующих заболеваний на прогноз
Программирование устройств для сердечной ресинхронизирующей терапии
Фибрилляция предсердий и предсердная тахиаритмия
Медикаментозная терапия при сердечной ресинхронизирующей терапии
Аритмии на фоне сердечной ресинхронизирующей терапии
Купить медицинскую литературу по кардиологии в интернет-магазине медицинской книги shopdon.ru