Лекция для врачей "Гельминтозы. Исследование кала. Методы лабораторной диагностики гельминтозов" (отрывок из книги "Общеклинические исследования (моча, кал, ликвор, мокрота, синовиальная жидкость)" - И. И. Миронова, Л. А. Романова, В. В. Долгов)
Гельминтозы - заболевания, вызываемые паразитическими червями - гельминтами.
Известно около 250 видов гельминтов - паразитов человека. На территории России выявлено приблизительно 100 видов гельминтов, 20 из которых имеют широкое или почти повсеместное распространение.
Все гельминты человека относятся к двум типам: плоские черви и круглые черви. Плоские черви представлены классами Trematoda — сосальщики и Cestoda — ленточные черви. Круглые черви представлены классом Nematoda — собственно круглые черви.
Паразитирование гельминтов в организме хозяина обозначается термином «инвазия». Это понятие включает все формы взаимодействия паразита с организмом хозяина, как манифестные, так и бессимптомные.
Гельминты человека весьма разнообразны по своим жизненным циклам, месту паразитирования в организме человека и патологическому воздействию на организм хозяина. Различные циклы развития гельминтов во внешней среде и в организме человека позволяют выделить 3 группы гельминтозов.
Биогелъминтозы — инвазии, при которых гельминты часть своего развития проходят в организме человека (окончательного хозяина), а другую часть - в организме одного или нескольких промежуточных хозяев. К биогельминтозам относятся все трематодозы, практически все цестодозы и только некоторые нематодозы.
Геогелъминтозы — инвазии, при которых один из этапов развития гельминта проходит в почве, так как яйца, выделяемые во внешнюю среду, требуют дозревания в условиях определенной температуры, влажности и аэрации.
Контагиозные (контактные) гельминтозы - инвазии, при которых возбудители выделяются зрелыми или почти зрелыми и непосредственно инвазивны для человека.
Эволюционно сформировавшееся «сродство» определенных видов гельминтов к человеку или к животным позволяет разделить гельминтозы на антропонозные и зоонозные.
Антропонозы — гельминтозы, при которых участие человека как биологического хозяина обязательно.
Зоонозы - гельминтозы животных, при которых паразитические черви развиваются в своей эпидемической цепочке без обязательного участия человека.
Гельминты, относящиеся к группе антропонозов, эволюционно адаптировались в течение многих тысячелетий к защитным реакциям организма человека, в связи с чем заболевание имеет часто более легкое течение, меньшее количество осложнений и более благоприятный прогноз по сравнению с зоонозными инвазиями.
Патологическое воздействие на организм человека гельминтов чрезвычайно вариабильно и обусловлено многими факторами. Наиболее патогенными, как правило, являются личиночные стадии гельминтов, в 1 уд особенности при продолжительной и обширной их миграции по кровеносной системе и тканям человека. Помимо травматического повреждения тканей, сопровождающегося геморрагиями, личинки, выделяя продукты жизнедеятельности, сбрасывая во время линьки свои покровы, погибая в тканях, вызывают выраженные аллергические реакции, как местного, так и общего характера. Для этой стадии заболевания характерны токсикоаллергические реакции, сопровождающиеся подъемом температуры, лейкоцитозом и эозинофилией периферической крови, полиморфными зудящими высыпаниями на коже, гепато-спленомегалией и легочным синдромом. Высокий уровень эндогенной интоксикации приводит к снижению иммунологической реактивности организма и несостоятельности иммунной системы, что, в свою очередь, способствует тяжелому течению заболевания. Нарушения в системе иммунитета рассматриваются как иммунодепрессия - фактор, поддерживающий хроническое воспаление и проявляющийся дисиммуноглобулинемией с повышением IgE и IgG, снижением IgA и IgM. Этап миграции личинок гельминта соответствует острой клинической стадии заболевания. Ведущими и прогностически серьезными органными и системными поражениями в острой фазе являются аллергический миокардит, пневмония, менингоэнцефалит, гепатит, нарушения в системе гемостаза.
Методы лабораторной диагностики гельминтозов
Паразитологическая диагностика гельминтозов пищеварительной системы основана на обнаружении пропагативных форм гельминтов в каловых массах.
Фекалии, полученные после самостоятельной дефекации, доставляются в лабораторию свежими (не более суточной давности) в количестве 10-50 г (объем чайной/столовой ложки). Крайне нежелательным является использование накануне исследования масляных клизм и свечей, а также прием адсорбентов или рентгеноконтрастных веществ.
Посуда, в которой кал транспортируется и хранится, должна быть одноразовой, изготовлена из прозрачного или полупрозрачного неокрашенного пластика, с плотно закрывающейся крышкой, не содержать остатков моющих средств. На наклеенной этикетке обязательно помимо данных пациента указываются дата и время сбора пробы. Материал, доставленный в лабораторию, исследуется в этот же день. При подозрении на стронгилоидоз, анкилостомидозы, трихостронгилоидозы материал необходимо исследовать 172 сразу после получения его от больного, не позднее 1 ч.
При невозможности немедленного исследования материал можно сохранять с применением консерванта в холодильнике (при t +4-5 °C). Кал заливается консервантом в соотношении 1 : 1 или 1 : 2, тщательно перемешивается одноразовой пластиковой и чистой стеклянной палочкой. В качестве консервирующей жидкости удобно использовать жидкость Барбагалло (3 мл формалина 40% + 97 мл физраствора). Данный раствор готовится заранее, хранится при комнатной температуре, не теряя длительное время своих консервирующих свойств.
Гельминтологическое исследование включает макро- и микроскопическое этапы.
Макроскопические методы
Макроскопические методы применяются для обнаружения взрослых особей паразитов (нематоды, трематоды) и их фрагментов (сколексы, членики и части стробилы цестод). Используются 2 метода исследования: отмучивание и отстаивание.
Метод отмучивания заключается в просмотре разжиженных водой до состояния суспензии каловых масс в чашках Петри. При обнаружении подозрительных на фрагменты гельминтов частиц белого цвета их извлекают пинцетом, помещают на предметное стекло в капле 50% глицерина или воды, покрывают покровным стеклом и изучают под лупой, а при необходимости - под микроскопом.
Метод отстаивания включает 3-кратное отстаивание суспензии каловых масс. В цилиндре в 3—4 объемах воды готовится каловая суспензия. Через 10-15 мин после отстаивания и образования осадка надосадочная жидкость сливается, заменяется новой порцией воды, вновь перемешивается и отстаивается. Трехкратно отмытый осадок исследуется в чашках Петри по методу отмучивания.
Микроскопические методы
Микроскопическое исследование направлено на поиск яиц и личинок гельминтов. Просмотр препаратов всегда начинают на малом увеличении (х100, х200), а при обнаружении объектов, подозрительных на яйца или личинки, переходят на увеличение х400.
Для приготовления препаратов-мазков необходимо отбирать материал из разных участков фекалий.
Метод нативного мазка
Препарат готовится из небольших кусочков фекалий (размером со спичечную головку), тщательно растертых на предметном стекле с 50% глицерином, физраствором или водой. Из подготовленного материала делают тонкий мазок на 2/3 стекла, покрывают покровным стеклом и просматривают под микроскопом. Исследуют не менее 2 препаратов!
Метод толстого мазка Като
Для приготовления толстого мазка по Като необходимо заранее приготовить смесь Като и покровные пластинки из гидрофильного целлофана размером 2x4 см.
Смесь Като: 500 мл 6% раствора фенола, 50 мл глицерина, 6 мл 3% водного раствора малахитовой зелени смешиваются. Смесь хранится при комнатной температуре в склянке с притертой пробкой.
Целлофановые пластинки предварительно замачиваются в смеси Като минимум на 24 ч (могут храниться замоченными в смеси длительное время).
Ход исследования. На предметное стекло помещают фрагмент каловых масс величиной с горошину, покрывают извлеченной из смеси Като целлофановой пластинкой и аккуратно раздавливают резиновой пробочкой для получения равномерного толстого мазка. Препарат оставляют для просветления минимум на 1 ч при комнатной температуре, после чего приступают к микроскопированию. Если мазок был очень плотный и толстый, для просветления препарата может потребоваться большее время (до 24 ч). Данный метод рекомендуется при массовых обследованиях населения на кишечные гельминтозы.
Дополнительный материал
Энтеробиоз. Исследование кала. Лабораторная диагностика
Язвенный колит. Исследование кала. Лабораторная диагностика
Кетоновые тела. Исследования мочи. Лабораторная диагностика
Книга "Общеклинические исследования (моча, кал, ликвор, мокрота, синовиальная жидкость)"
Авторы: И. И. Миронова, Л. А. Романова, В. В. Долгов

В учебно-практическом руководстве обобщен опыт преподавания раздела «Общеклинические методы исследования» врачам клинико-диагностических лабораторий лечебных учреждений. Общеклинические исследования - основной массовый анализ, особенно в поликлиниках. В последнее время общеклинические исследования автоматизируются, предлагаются программы для оценки лабораторных исследований.
Исследование этого биологического материала может проводиться с использованием тест-полосок «сухая химия». Однако интерпретация результатов общеклинических исследований нередко вызывает затруднения, особенно при применении новых современных технологий. В руководстве подробно разбирается клинико-диагностическое значение и представлены современные методы исследования мочи, кала, спинномозговой жидкости, синовиальной жидкости и мокроты. Настоящее издание является переработанным и дополненным по сравнению с изданием 2012 г.; в нем существенно увеличен раздел, касающийся лабораторной диагностики злокачественных заболеваний, приведены современные автоматизированные методы, представлено клинико-диагностическое значение маркеров повреждения тканей и органов.
Книга "Общеклинические исследования (моча, кал, ликвор, мокрота, синовиальная жидкость)" богато иллюстрирована, все представленные изображения являются результатом исследования авторов.
Содержание книги "Общеклинические исследования (моча, кал, ликвор, мокрота, синовиальная жидкость)" - И. И. Миронова, Л. А. Романова, В. В. Долгов
ИССЛЕДОВАНИЕ МОЧИ
Мочевая система
Процесс образования мочи
Фильтрация
Реабсорбция
Правила сбора мочи
для общего анализа
Физические свойства мочи
Количество
Цвет
Прозрачность
Запах
Диагностические тест-полоски
Полифункциональные полоски
для исследования мочи
Правила работы с диагностическими тест-полосками
Правила проведения теста
Химические свойства мочи, определяемые тест-полосками pH (реакция)
Клинические аспекты
Референтные значения
Определение pH с помощью тест-полосок
Белок
Клинические аспекты
Функциональные (транзиторные, интермитентные) протеинурии
Протеинурии при патологии
Полуколичественный метод определения белка в моче с помощью тест-полосок
Количественные методы определения белка в моче
Глюкоза
Клинические аспекты
Полуколичественный метод определения глюкозы в моче с помощью тест-полосок
Количественные методы определения глюкозы в моче
Кетоновые тела
Образование кетоновых тел
Клинические аспекты
Лабораторные методы определения кетоновых тел в моче
Принцип определения кетоновых тел с использованием тест-полосок
Билирубин
Клинические аспекты
Принцип определения билирубина с использованием тест-полосок
Уробилиноген
Клинические аспекты
Определение уробилиногена в моче с использованием тест-полосок
Кровь (эритроциты, гемоглобин), миоглобин
Клинические аспекты
Синдром гематурии
Почечные, или ренальные, гематурии
Постренальные (внепочечные) гематурии
Преренальная гематурия
Гемоглобинурии
Миоглобинурии
Состояния, имитирующие гемоглобинурию
Определение эритроцитов, гемоглобина (миоглобина) в моче с использованием тест-полосок
Лейкоциты
Клинические аспекты
Определение лейкоцитов с использованием тест-полосок
Нитриты (бактериурия)
Клинические аспекты
Определение нитритов с использованием тест-полосок
Относительная плотность (удельный вес)
Клинические аспекты
Функциональные исследования почек
Определение относительной плотности с использованием тест-полосок
Аскорбиновая кислота
Клинические аспекты
Определение аскорбиновой кислоты с использованием тест-полосок
Заключение по разделам исследования мочи с использованием тест-полосок «сухая химия»
Автоматизация общеклинического анализа мочи
Анализаторы химического состава мочи
Автоматические анализаторы морфологического (микроскопического) состава мочи
Исследование осадка мочи
Ориентировочный метод исследования мочевого осадка
Получение осадка мочи и приготовление нативного препарата
Микроскопическое исследование
Количественные методы исследования осадка мочи
Элементы мочевого осадка
Эритроциты и продукты их распада
Лейкоциты
Цилиндры
Эпителий
Слайд-планшеты для микроскопического исследования осадка мочи
Суправитальная окраска при исследовании мочевого осадка
ИССЛЕДОВАНИЕ КАЛА
Пищеварительный тракт и пищеварение
Правила сбора материала
Химическое исследование кала с помощью диагностических тест-полосок
Приготовление каловой эмульсии
Правила работы с реагентными полосками pH
Клинические аспекты
Белок
Клинические аспекты
Специфичность и чувствительность определения белка тест-полосками
Специфичность, чувствительность и оценка определения pH тест-полосками
Кровь
Клинические аспекты
Специфичность и чувствительность определения крови тест-полосками
Эозинофильный нейротоксин
Экспресс-тесты для выявления инфекционных агентов в кале
Определение антигенов
Helicobacter pylori
Определение антигенов ротавируса
Определение антигенов аденовируса
Определение антигенов астровируса
Определение антигенов Е. coli 0157 в образцах кала
Макроскопическое исследование кала
Количество
Уробилиноген (стеркобилиноген)
Клинические аспекты
Специфичность и чувствительность определения уробилиногена тест-полосками
Консистенция, форма
Цвет
Запах
Остатки непереваренной пищи
Микроскопическое исследование кала
Билирубин
Клинические аспекты
Специфичность и чувствительность определения билирубина тест-полосками
Приготовление препаратов для микроскопии
Копрологические синдромы
Лейкоциты
Клинические аспекты
Специфичность и чувствительность определения лейкоцитов тест-полосками
Нормальный кал
Недостаточность пищеварения в желудке
Недостаточность поджелудочной железы
Дополнительные лабораторные тесты для выявления панкреатической недостаточности
Специализированные тесты на маркеры воспаления кишечника
Фекальный кальпротектин (ФК)
Лактоферрин
Нарушение желчеотделения (ахолия)
Нарушение всасывания в тонкой кишке – синдром мальабсорбции
Патологические процессы в толстой кишке
Бродильные процессы
Гнилостные процессы
Язвенный колит
Замедленная эвакуация из толстой кишки (запор, спастический колит)
Особенности пищеварения и копрограммы детей грудного возраста в норме и при патологии
Первородный кал (меконий)
Кал здорового ребенка при грудном вскармливании
Кал здорового ребенка при искусственном вскармливании
Острый воспалительный процесс в желудочно-кишечном тракте у детей
Нарушение всасывания в тонкой кишке, вызванное врожденной несостоятельностью энтероцитов и энзиматической недостаточностью
Глютеновая энтеропатия (целиакия, или целиакическая болезнь)
Синдром дисахаридазной недостаточности (непереносимость углеводов)
А-бета-липопротеинемия (акантоцитоз)
Муковисцидоз, или кистозный фиброз (кишечная форма)
Экссудативная энтеропатия
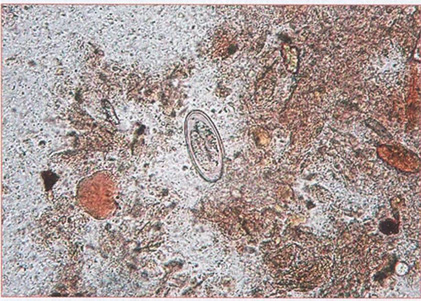
Гельминтозы
Сроки контрольных исследований для оценки эффективности лечения гельминтозов пищеварительной системы человека
Методы лабораторной диагностики гельминтозов
Макроскопические методы
Микроскопические методы
Методы обогащения
Методы исследования материла, полученного с перианальной области
Методы, направленные на обнаружение личинок
Strongyloides stercoralis
Серологические методы
Нематодозы
Аскаридоз
Трихоцефалез
Энтеробиоз
Анкилостомидозы
Стронгилоидоз
Трихостронгилоидозы
Цестодозы
Тениаринхоз
Тениоз
Гименолепидозы
Эхинококкоз
Дифиллоботриоз
Трематодозы
Описторхоз
Клонорхоз
Парагонимоз
Фасциолез
Дикроцелиоз
Нанофиетоз
Шистосомозы
Кишечные простейшие
Методы лабораторной диагностики кишечных простейших
Приготовление нативного препарата
Приготовление препарата с раствором Аюголя
Sarcodina - саркодовые
Entamoeba coli - кишечная амеба
Entamoeba histolytica - тканевая амеба
Entamoeba hartmanni
Endolimax папа - карликовая амеба
lodamoeba buetschlii
Blastocistis hominis
Условно-патогенные кишечные простейшие
Flagellata - жгутиковые
Lamblia intestinalis -лямблия
Trichomonas hominis
Chilomastix mesnili
Dientamoeba fragilis
Патогенные кишечные простейшие
Sporozoa - споровики (кокцидии)
Кокцидии
Ооцисты Isospora belli
Cryptosporidium spp
Ciliata - реснитчатые
Balantidium coli
Ликворная система
Ликворные пространства
Внутренние ликворные пространства (вентрикулярная система)
Внешние ликворные пространства. Оболочки и подпаутинное (субарахноидальное) пространство головного мозга
Ликвор
Правила получения и доставки ликвора в лабораторию
Правила проведения исследования ликвора с помощью диагностических полосок
Физико-химические свойства ликвора
Относительная плотность
Прозрачность
Фибриновая (фибринозная) пленка
Цвет
Эритроцитархия (эритроархия)
Билирубинархия
(ксантохромия)
Клинические аспекты pH
Протеинархия (общий белок)
Методические аспекты
Клинические аспекты изменения содержания общего белка в ликворе
Индивидуальные белки ликвора
Белки сосудистых оболочек мозга
Белки паренхимы мозга
Белки микроглии/макрофагальной системы
Гликоархия
Клинические аспекты
Кетонархия
Нитриты
Микроскопическое исследование ликвора
Определение цитоза
Методические аспекты
Клинические аспекты
Клеточные элементы ликвора
Происхождение, дифференциация
клеток ликвора
Лимфоциты
Моноциты
Макрофаги
Нейтрофилы
Эозинофилы
Базофилы
Плазматические клетки
Бласты
Клетки эпендимы
Клетки арахноэндотелия
Клетки опухолей
ИССЛЕДОВАНИЕ МОКРОТЫ
Дыхательная система
Воздухоносные пути
Мокрота
Порядок сбора мокроты
Физические свойства мокроты
Суточное количество мокроты
Деление на слои
Запах
Цвет и прозрачность
Характер мокроты
Микрокопическое исследование мокроты
Приготовление нативных препаратов
Клеточные элементы мокроты в нативных препаратах и препаратах, окрашенных азур-эозином
Нейтрофилы
Эозинофилы
Тучные клетки (тканевый базофил, мастоцит, лаброцит)
Моноцит
Лимфоциты
Эритроциты
Цилиндрический
реснитчатый эпителий
Цилиоцитофтория
Альвеолярные макрофаги
Альвеолярные макрофаги - «клетки курильщика», или «пылевые клетки» (кониофаги)
Альвеолярные макрофаги с миелином
Липофаги
Альвеолярные макрофаги с гемосидерином, сидерофаги, или клетки «сердечных пороков»
Макрофаги с фагоцитированными клетками
Альвеолярные макрофаги в препаратах, приготовленных из жидкости, полученной при бронхоальвеолярном лаваже (БАЛ), окрашенные азур-эозином
Альвеолярный эпителий
Эластические волокна
Коралловидные эластические волокна
Обызвествленные эластические волокна
Спирали Куршмана
Кристаллы в препаратах мокроты
Кристаллы Шарко-Лейдена
Кристаллы гематоидина
Кристаллы холестерина
Пробки Дитриха
Миелин
Простейшие
Трихомонады
Ent. histolytica
Пневмоцистоз
Гельминты
Стронгилоидоз
Парагонимоз
Аскаридоз. Легочная фаза
Эхинококкоз
Грибковые заболевания легких
Актиномикоз легких
Аспергиллез
Кокцидиоидоз
Гистоплазмоз
Кандидоз
Пенициллиозы
Криптококкоз
Пневмонии
Хламидийная пневмония
Пневмококковая пневмония
Пневмонии госпитальные
Вирусные пневмонии
Туберкулез
Процедура сбора мокроты
Контейнеры для сбора диагностического материала
Оценка объема и качества
поступающего материала
Микроскопическое исследование
Окраска препаратов мокроты по Цилю-Нильсену
Регистрация результатов исследования
Микобактерии туберкулеза в препаратах, окрашенных по Цилю-Нильсену
Препараты мокроты и пунктатов лимфоузлов больных туберкулезом, окрашенные азур-эозином
Эпителиоидные клетки
Гигантские клетки
Пирогова-Лангханса
Казеоз
Гигантская клетка «инородных тел»
Саркоидоз
Цитологические исследования препаратов, полученных при бронхоскопии
Клеточные элементы в препаратах из материала, полученного при бронхоскопии
Клетки цилиндрического (призматического) реснитчатого эпителия
Секреторные клетки: эндокринные и бокаловидные (при накоплении слизи), бронхиолярные клетки Clara, пневмоциты II типа
Базальные клетки
Клетки многослойного плоского эпителия
Цитологические признаки патологии бронхоальвеолярной системы
Гиперплазия цилиндрического эпителия
Гиперплазия цилиндрического реснитчатого эпителия
Гиперплазия бокаловидных клеток
Гиперплазия базальных клеток
Гиперплазия бронхиолярного и альвеолярного эпителия
Плоскоклеточная метаплазия бронхиального эпителия
Плоскоклеточная метаплазия без атипии
Плоскоклеточная метаплазия с признаками атипии
Плоскоклеточная метаплазия при воспалении
Дегенеративные изменения эпителиальных клеток
Предопухолевые изменения бронхиального эпителия
Атипическая гиперплазия бронхиального эпителия
Атипическая плоскоклеточная метаплазия (дисплазия)
бронхиального эпителия
Плоскоклеточный рак легкого
Плоскоклеточный рак легкого с ороговением (высокодифференцированный)
Клеточные элементы высокодифференцированного плоскоклеточного рака легкого в препаратах мокроты
Препараты больного А.
Плоскоклеточный рак легкого с ороговением (высокодифференцированный)
Препараты больного Б.
Плоскоклеточный рак с ороговением
«Жемчужины», или «луковицы» - комплексы клеток плоскоклеточного рака с ороговением в мокроте
Плоскоклеточный рак с ороговением из мелких клеток
Препараты больного Ч.
Плоскоклеточный рак из мелких клеток с ороговением. Мокрота и бронхо-альвеолярный лаваж
Препараты больного С.
Плоскоклеточный рак легкого с ороговением из мелких клеток. Мокрота
Препараты больного В.
Плоскоклеточный рак легкого с ороговением из мелких клеток. Мокрота
Плоскоклеточный рак без ороговения
Плоскоклеточный рак без ороговения из крупных клеток
Препараты больного С.
Плоскоклеточный неороговевающий рак легкого
Бронхоскопия
Препараты больного Т.
Плоскоклеточный рак без ороговения. Мокрота
Препараты больного Г.
Плоскоклеточный рак, преимущественно без ороговения. Мокрота
Препараты больного
Плоскоклеточный рак, преимущественно без ороговения. Бронхоскопия
Препараты больного У.
Плоскоклеточный рак, преимущественно без ороговения. Бронхоскопия
Препараты больного Н.
Плоскоклеточный рак без ороговения. Мокрота
Плоскоклеточный рак из мелких клеток без ороговения
Аденокарцинома
Железистоподобные структуры
Железистоподобные структуры в нативных и окрашенных азур-эозином препаратах мокроты
Аденокарцинома высокодифференцированная
Больная Б. Аденокарцинома высокодифференцированная
Мокрота
Больной А. Аденокарцинома высокодифференцированная
Бронхоскопия
Больной А. Мокрота
Больной Ф. Аденокарцинома высокодифференцированная
Мокрота
Больной Ф. Бронхоскопия
Больной Н. Аденокарцинома высокодифференцированная
Бронхоскопия
Больной Ал. Аденокарцинома высокодифференцированная.
Мокрота
Больной Г. Аденокарцинома высокодифференцированная.
Мокрота
Больной Ф. Аденокарцинома высоко дифференцированная.
Мокрота
Аденокарцинома умеренно-дифференцированная
Больной П.
Аденокарцинома умеренно-дифференцированная
Мокрота
Мелкоклеточный рак
Характеристика мелкоклеточного рака в препаратах мокроты
Мелкоклеточный рак
Бронхоскопия
Крупноклеточный рак
Больной Р. Предположительно недифференцированный рак
Мокрота
Больной К. Крупноклеточный недифференцированный рак
Бронхоскопия
Больной X. Крупноклеточный недифференцированный рак
Бронхоскопия
Образование синовиальной жидкости
Получение и подготовка синовиальной жидкости для лабораторного исследования
Макроскопическое исследование (физические свойства) синовиальной жидкости
Объем
Цвет
Прозрачность
Вязкость
Предварительный полуколичественный анализ методом «сухая химия»
Биохимическое исследование синовиальной жидкости
Белок
Глюкоза
Аактат
Гиалуроновая кислота
Мочевая кислота
Ферменты
Иммунологическое исследование синовиальной жидкости
Ревматоидный фактор
Иммуноглобулины
Иммунные комплексы
Иммунокомпетентные клетки
Комплемент
Цитокины
Микроскопическое исследование синовиальной жидкости
Микроскопическое исследование нативных препаратов синовиальной жидкости
Клеточные элементы в нативном препарате
Кристаллы
Некристаллические образования
Микроскопическое исследование суправитальноокрашенных клеток синовиальной жидкости
Методика суправитального окрашивания осадка синовиальной жидкости
Особенности суправитальноокрашенных клеточных популяций
Цитоз - подсчет клеточных элементов синовиальной жидкости
Клеточные элементы в окрашенных препаратах синовиальной жидкости
Нейтрофилы (полиморфно-ядерные лейкоциты)
Малые лимфоциты
Плазматические клетки
Клетки Мотта (Mott)
Моноцитоидные
мононуклеарные клетки - моноциты-макрофаги
Цитофагоцитирующие
мононуклеарные клетки
Синовиоциты
Гистиоциты
Эозинофилы
Тучные клетки (базофилы)
Многоядерные клетки
LE-клетки
Недифференцируемые клетки
Микробиологическое исследование
Бактериоскопическое исследование
Культуральные исследования
ПРИЛОЖЕНИЕ
Метастазы в мокроте
Мокрота. Метастаз рака желудка в легкое
Мокрота. Метастаз миеломы в легкое
Артефакты при исследовании мокроты