Лекция для врачей "Допплерография при беременности. Методика. Маточные артерии. Артерии пуповины." (отрывок из книги "Скрининговое ультразвуковое исследование в 30-34 недели беременности" - М. В. Медведев)
Допплеровские измерения при беременности
В нашей стране в 2001 г. в рамках IV зимней школы специалистов ультразвуковой диагностики была осуществлена первая стандартизация допплеровских исследований во второй половине беременности. Тогда было принято решение о минимальном обязательном объеме допплеровского исследования (обе маточные артерии, артерии пуповины), единых диагностических критериях (процентильные значения индекса резистентности) и единой классификации нарушений маточно-плацентарно-плодового кровотока.
Выбор индекса резистентности (ИР) в качестве диагностического критерия нарушений маточно-плацентарноплодового кровотока в те годы был вызван следующими основными причинами. Во-первых, как минимум в половине ультразвуковых сканеров в те годы в допплеровском режиме не было функции аппаратного определения усредненной по времени максимальной скорости кровотока, без которой невозможно точное определение пульсационного индекса (ПИ). Во-вторых, в те годы ПИ обладал меньшей воспроизводимостью в сравнении с ИР. Поэтому многие отечественные и зарубежные исследователи в те годы использовали ИР для оценки КСК в маточных артериях и артериях пуповины (М.В. Медведев, 1996; J. Kurmanavicius и соавт., 1997; К. Harrington, S. Campbell, 1995; Т. Murakoshi и соавт., 1996).
Прошли годы, и в настоящее время общепризнанным фактом стало использование в качестве основного диагностического критерия не численного значения ИР, а ПИ, учитывающего форму кривой кровотока. В практических рекомендациях ISUOG (Международное Общество Ультразвука в Акушерстве и Гинекологии) по применению допплерографии в акушерстве справедливо указано, что все три индекса, включая систоло-диастолическое отношение (СДО), ИР и ПИ могут быть использованы в клинической практике (A. Bhide и соавт., 2013). ПИ демонстрирует линейную зависимость с сосудистым сопротивлением в отличие от СДО и ИР, для которых характерна параболическая зависимость с увеличением сосудистого сопротивления. Кроме этого, ПИ не теряет математический смысл в случаях нулевых или реверсных значений диастолического кровотока. Особенно ПИ имеет существенные преимущества перед СДО и ИР при оценке КСК в маточных артериях, так как позволяет более точно оценить всю форму кривой кровотока, поскольку в его расчет включена аппаратная оценка усредненной по времени максимальной скорости кровотока (рис. 3.14).
Эти индексы относятся к так называемым уголнезависимым показателям и позволяют судить о величине периферического сопротивления. Использование в качестве критериев оценки абсолютных значений систолической и диастолической скоростей кровотока чаще всего нецелесообразно, поскольку эти показатели меняются при увеличении или уменьшении угла инсонации. Исключение составляет только средняя мозговая артерия плода, оценка кровотока в которой для диагностики анемии у плода преимущественно осуществляется по пиковой систолической скорости. Поэтому угол инсонации по отношению к средней мозговой артерии плода должен быть максимально приближен к 0°.
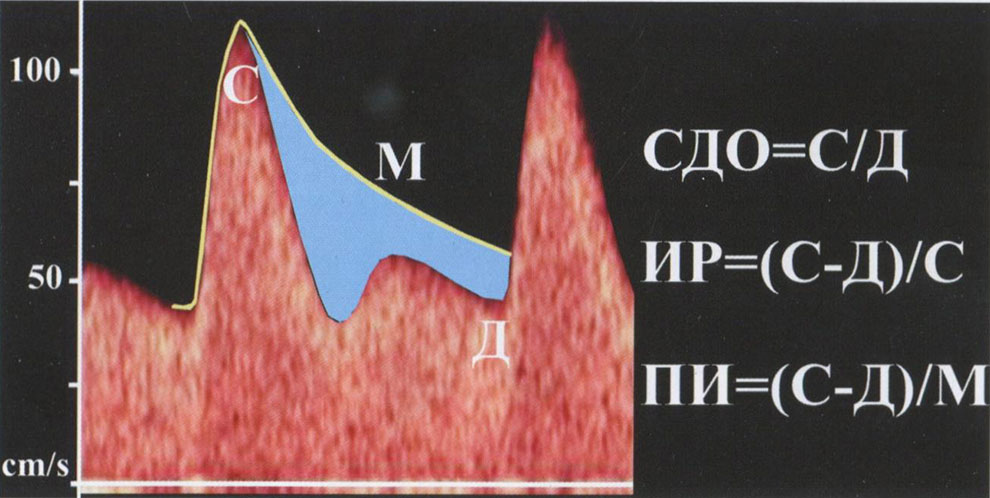
Рис. 3.14. Расчет индексов при оценке КСК в маточных артериях. С - пиковая систолическая скорость кровотока; Д - конечная диастолическая скорость кровотока; М - усредненная по времени максимальная скорость кровотока. Синим цветом отмечен «дефицит» кривой кровотока при патологических показателях кровотока в маточных артериях.
При изучении кровотока в сосудах плода целесообразно использовать автоматический расчет основных показателей с помощью специальной программы, но это возможно только при получении оптимального изображения спектра кровотока. При этом автоматически рассчитывается пиковая систолическая скорость кровотока, максимальная конечная диастолическая скорость кровотока и усредненная по времени максимальная скорость кровотока с последующим расчетом СДО, ИР и ПИ (рис. 3.15). При этом пиковая систолическая скорость кровотока - это максимальная скорость кровотока в систолу, а максимальная конечная диастолическая скорость кровотока - его максимальная скорость в конце диастолы. Усредненная по времени максимальная скорость кровотока является результатом усреднения скоростных составляющих огибающей допплеровского спектра за один сердечный цикл.
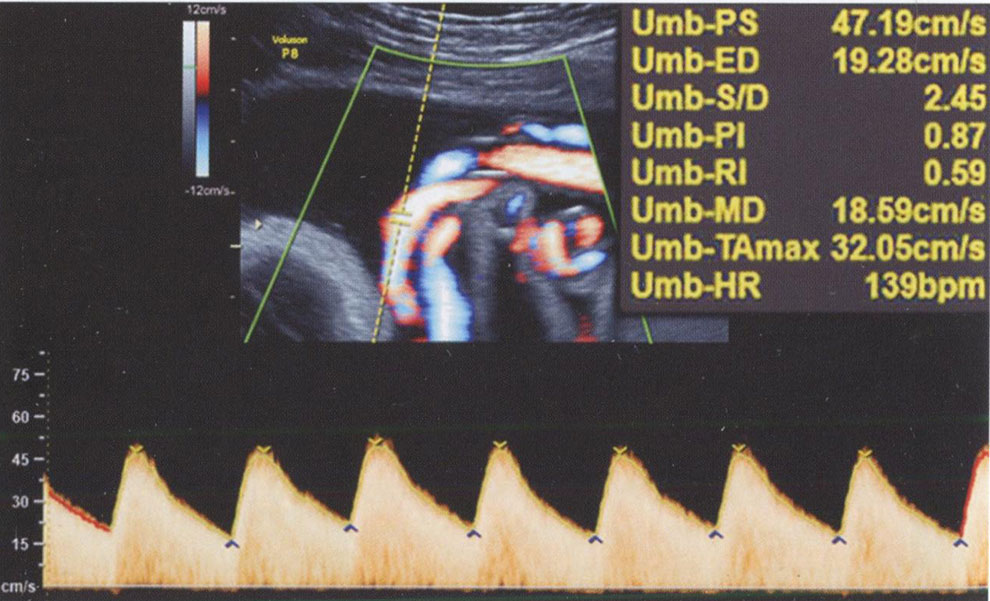
Рис. 3.15. Автоматический расчет показателей при оценке КСК в артерии пуповины: пиковая систолическая скорость - 47,19 см/с, конечная диастолическая скорость - 19,28 см/с, СДО - 2,45, ПИ - 0,87, ИР - 0,59, усредненная по времени максимальная скорость кровотока - 32,05 см/с, частота сердечных сокращений - 139 в минуту.
У плода численные значения индексов сосудистого сопротивления в разных кардиоциклах нередко различаются. Эти вариации можно значительно снизить при автоматическом расчете индексов по данным 3-5 одинаковых кардиоциклов с последующим их усреднением, что приводит к стабилизации получаемых результатов.
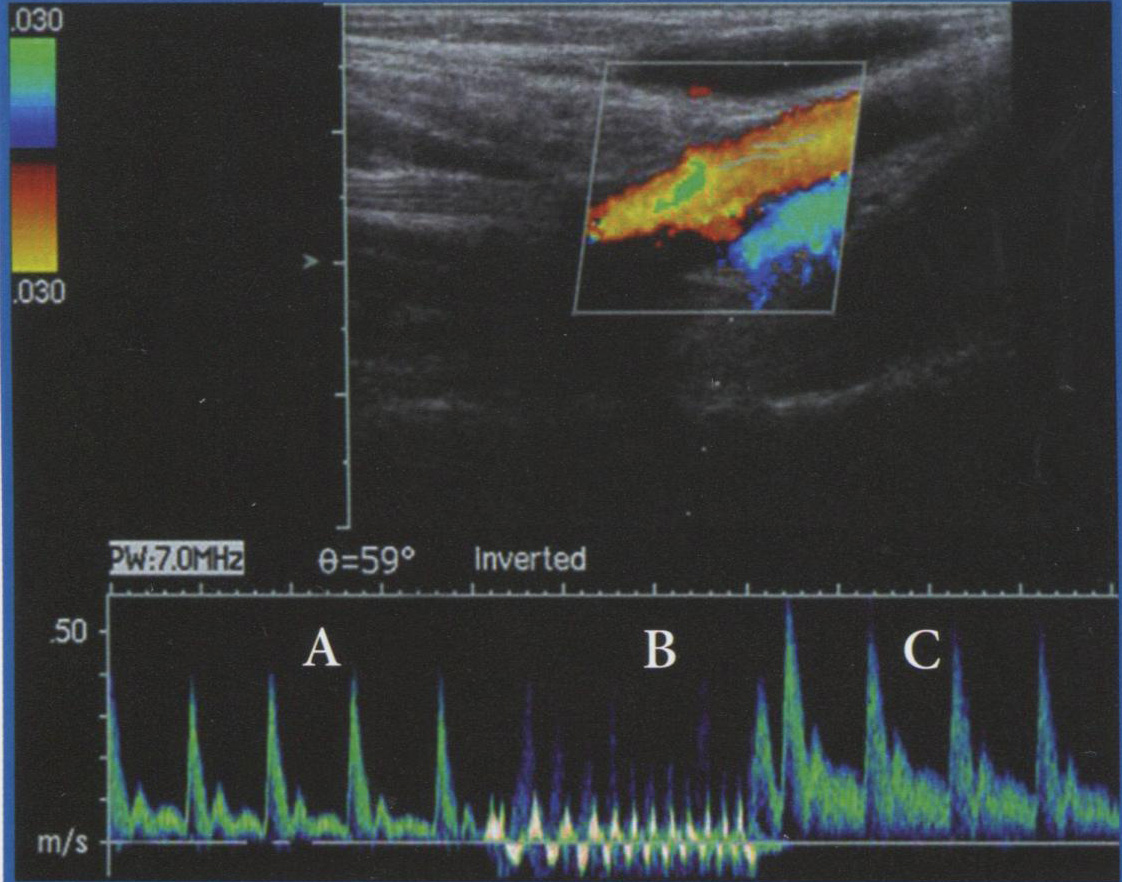
Кроме этих основных методов оптимизации изображений, при исследовании кровотока в сосудах плода необходимо учитывать его поведенческие реакции. В связи с влиянием высокоамплитудных дыхательных движений и двигательной активности плода на кровоток в его сосудах исследование допустимо проводить только в период апноэ и двигательного покоя плода при частоте сердечных сокращений от 120 до 160 уд/мин. Активные поведенческие состояния плода вызывают неравномерную форму КСК, что препятствует их правильной оценке (рис. 3.16). При повышении частоты сердечных сокращений плода отмечается снижение численных значений сосудистых индексов в артериальных сосудах плода и пуповины и соответственно при снижении - численные значения индексов возрастают. Также невозможно проводить объективную оценку кровотока в сосудах плода при нарушениях у него сердечного ритма.
Методика исследования
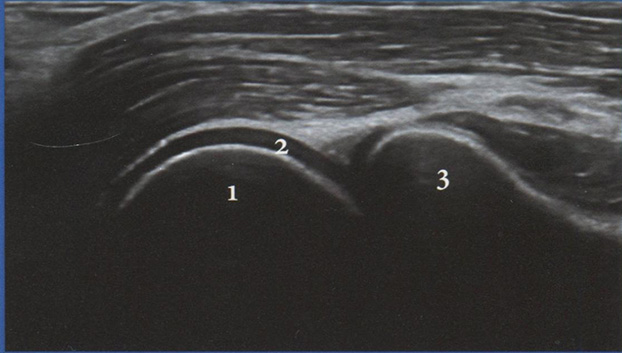
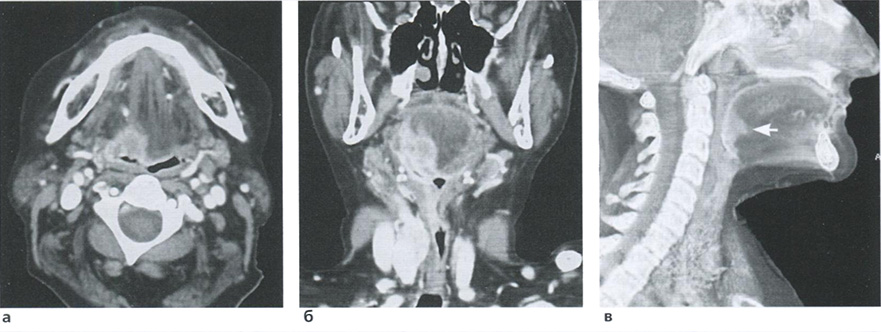
В настоящее время в акушерской практике доказана клиническая ценность изучения КСК в маточных артериях, артериях пуповины, венозном протоке и средней мозговой артерии плода (рис. 3.17). Именно эти сосуды рекомендованы ISUOG (Международное Общество Ультразвука в Акушерстве и Гинекологии) для оценки во второй половине беременности. Методика изучения КСК в этих сосудах имеет определенные особенности, которые необходимо соблюдать при скрининговом ультразвуковом исследовании в III триместре беременности.
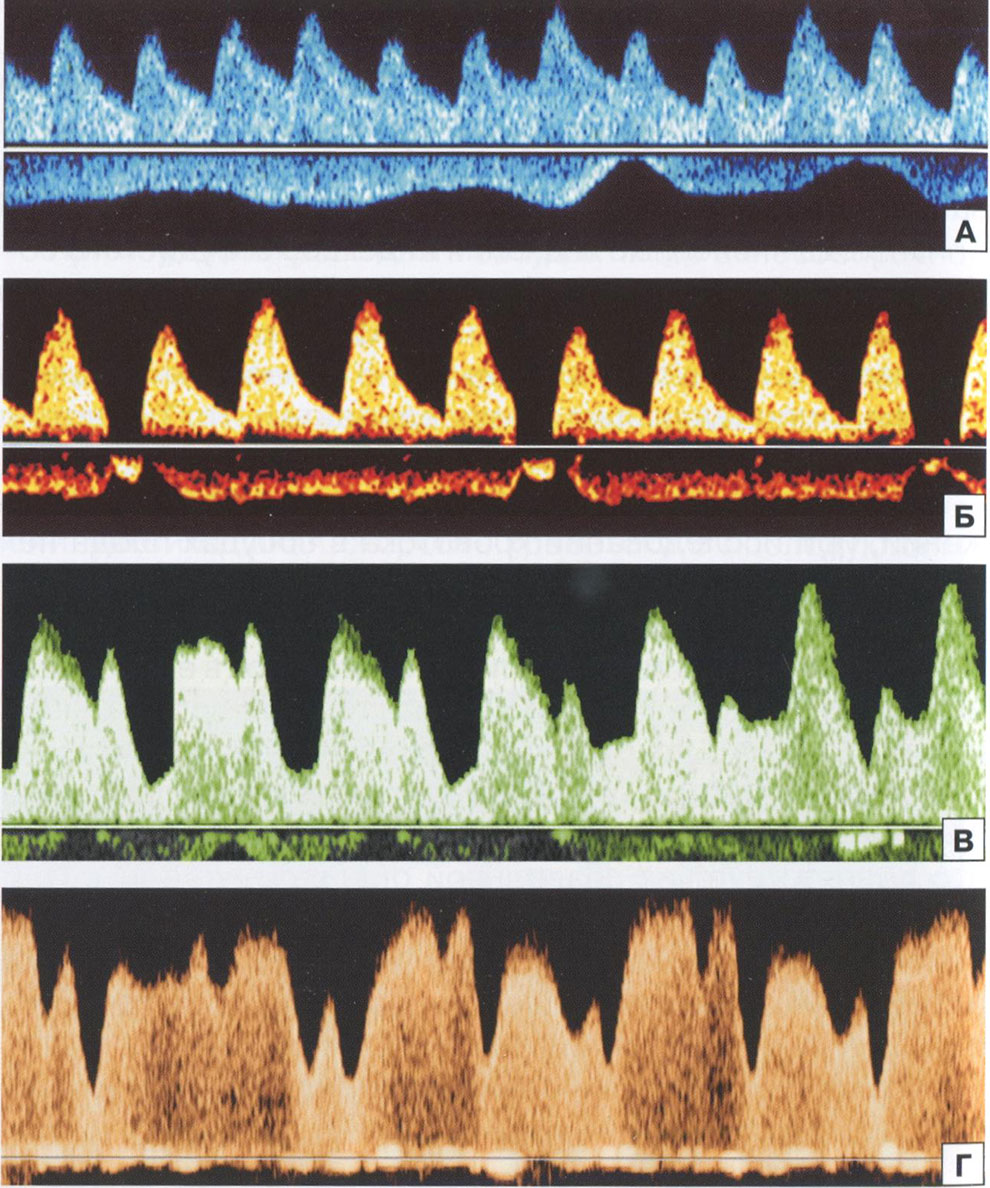
Рис. 3.16. КСК в артерии пуповины при дыхательных движениях (А), икотообразных дыхательных движениях (Б) и бигеминии (В) у плода. Г - КСК в венозном протоке плода при дыхательных движениях.
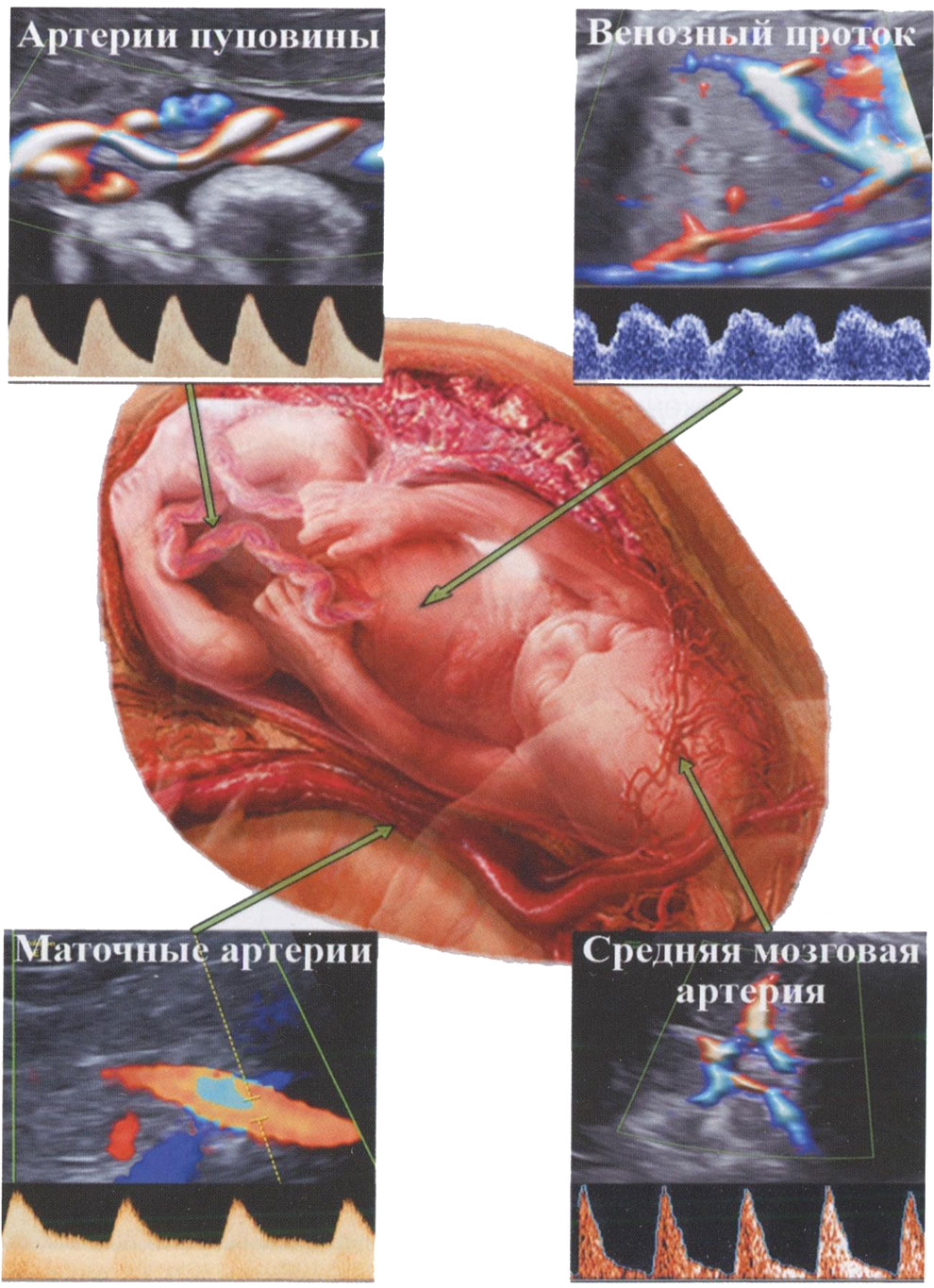
Рис. 3.17. Схематическое изображение изучения КСК в маточных артериях, артериях пуповины, венозном протоке и средней мозговой артерии плода.
Маточные артерии
Для визуализации маточных артерий и оценки кровотока в них необходимо придерживаться следующих правил:
• трансабдоминально датчик следует располагать продольно в нижнем латеральном квадранте живота с наклоном в медиальном направлении;
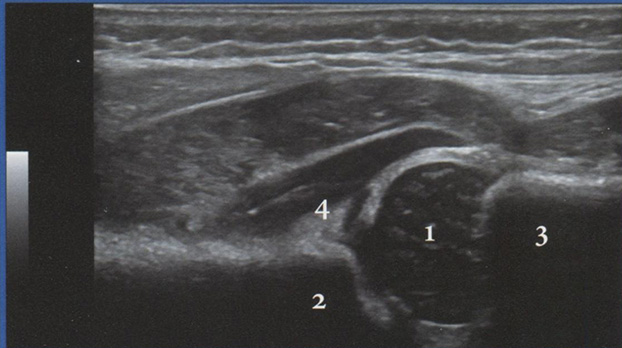
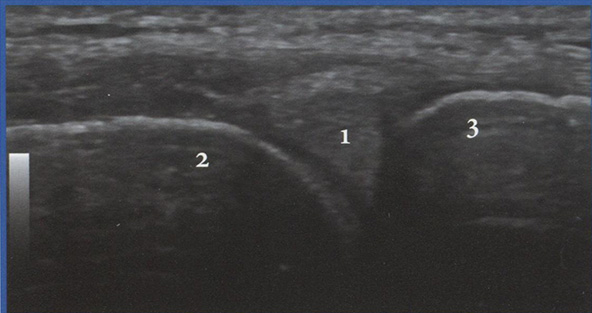
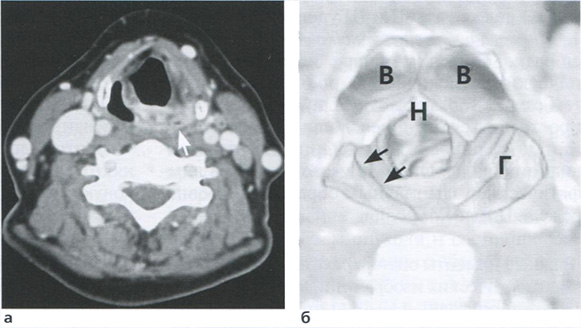
• для обнаружения маточной артерии в месте пересечения с наружной подвздошной артерией следует использовать режим ЦДК, так как маточные артерии практически не видны в В-режиме (рис. 3.18);
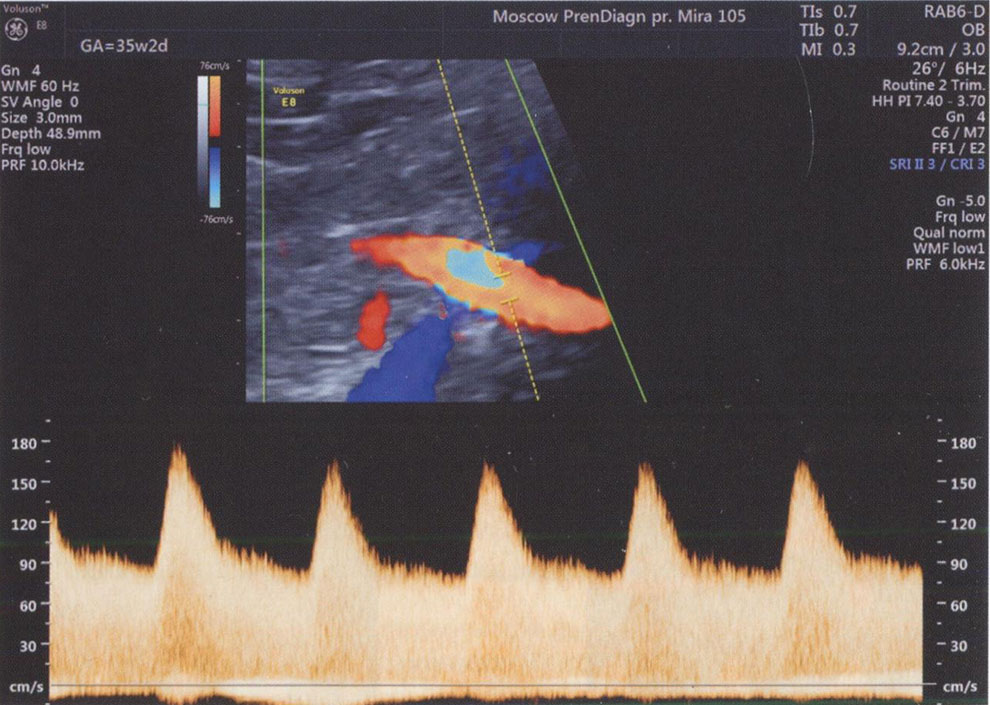
Рис. 3.18. Исследование кровотока в маточной артерии в 35 недель 2 дня: КСК в маточной артерии регистрируются в месте ее пересечения с наружной подвздошной артерией. Численные значения ПИ находятся в пределах нормативных значений.
• контрольный объем импульсноволнового допплера располагается по ходу идентифицированной маточной артерии;
• в тех случаях, когда маточная артерия разветвляется до момента пересечения с наружной подвздошной артерией, контрольный объем должен быть установлен на сегмент до места ее бифуркации;
• контрольный объем должен полностью пересекать просвет маточной артерии;
• измерения проводятся в сегменте перед началом разветвления маточной артерии на аркуатные артерии;
• для маточных артерий типична систолическая скорость кровотока выше 50 см/с, что может быть использовано для их разграничения с аркуатными артериями, скорость кровотока в которых обычно меньше 50 см/с;
• угол инсонации должен быть менее 30°;
• оцениваются КСК в обеих маточных артериях;
• с увеличением срока беременности матка обычно совершает ротацию вправо, поэтому левая маточная артерия может определяться не так латерально как правая;
• расчет ПИ осуществляется при получении не менее трех одинаковых КСК маточной артерии.
Нормальные КСК в маточных артериях имеют не только типичный спектр, но и характерный аудиосигнал, по которым их можно легко отличить от других близко расположенных сосудов. Во избежание диагностических ошибок при регистрации КСК в маточных артериях следует помнить, что КСК во внутренней подвздошной артерии имеют форму, схожую с патологическими КСК маточных артерий. Поэтому для идентификации маточной артерии необходимо первоначально добиваться визуализации бифуркации общей подвздошной артерии. При использовании режима ЦДК оценка КСК в маточных артериях возможна практически у всех беременных.
Одним из обязательных правил изучения маточно-плацентарного кровотока является оценка КСК в обеих маточных артериях. Это требование связано с тем, что изменения кровотока в маточных артериях более чем в 70% случаев выявляются только с одной стороны. Проведенный нами сравнительный анализ КСК в правой и левой маточных артериях при неосложненной беременности показал, что сосудистые индексы отличаются незначительно. Единственной особенностью являются относительно более низкие значения сосудистых индексов на стороне прикрепления плаценты при ее расположении преимущественно на боковой стенке матки.
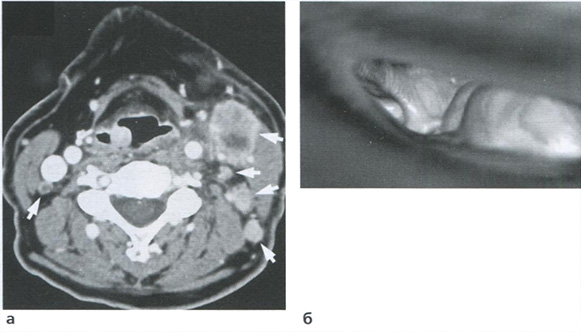
Характерными признаками нарушения кровотока в маточных артериях являются низкие значения диастолической скорости кровотока, которые соответственно приводят к повышению численных значений сосудистых индексов. При этом нарушение кровотока в маточных артериях констатируют при превышении 95-го процентиля нормативных значений ПИ (рис. 3.19). Появление в спектре КСК маточных артерий дикротической выемки свидетельствует о более глубоких нарушениях маточно-плацентарной гемодинамики и сопровождается сужением просвета спиральных артерий. Необходимо отметить, что дикротическую выемку следует регистрировать только тогда, когда ее вершина достигает уровня конечной диастолической скорости или находится ниже его (рис. 3.20).
Следует подчеркнуть, что патологические КСК характеризуются нестабильностью, в связи с чем численные значения ПИ, полученные в разные дни, могут существенно отличаться друг от друга, но всегда остаются выше нормативных значений.
Гемодинамические нарушения в единой функциональной системе мать-плацента-плод являются ведущим патогенетическим механизмом нарушения состояния и развития плода при различных осложнениях беременности. При этом в подавляющем большинстве наблюдений гемодинамические нарушения характеризуются универсальностью и однотипностью изменений вне зависимости от состояния плода и этиопатогенетического фактора (М.В. Медведев, 1996).
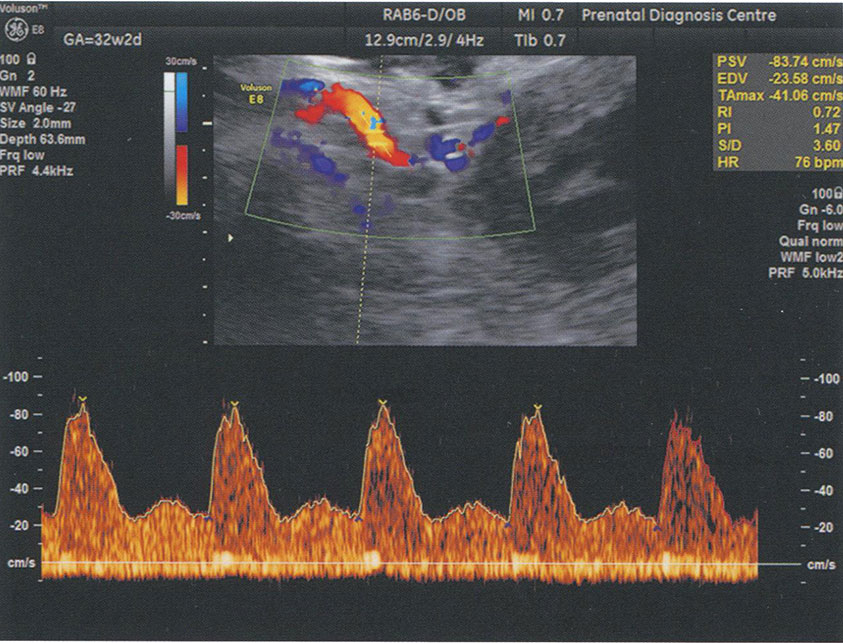
Рис. 3.19. Исследование кровотока в маточной артерии в 32 недели 2 дня у пациентки с преэклампсией и замедлением роста плода. Численные значения ПИ превышают 95-й процентиль нормативных значений.
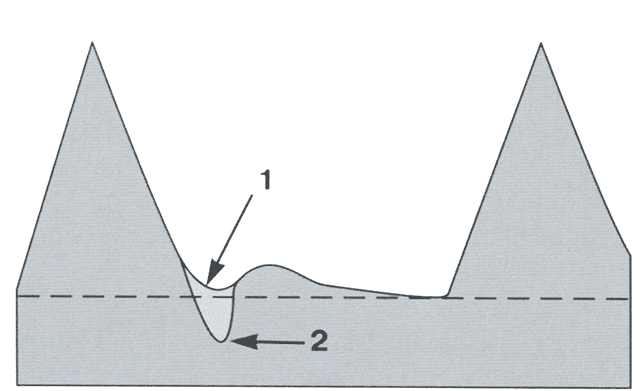
Рис. 3.20. Схема оценки дикротической выемки КСК маточных артерий. На схеме представлены патологические КСК без (1) и с (2) дикротической выемкой.
В основе механизма, обеспечивающего увеличение маточно-плацентарного кровотока при прогрессировании беременности, лежит снижение преплацентарного сопротивления току крови. Это достигается в ходе процесса инвазии трофобласта в спиральные артерии, в результате чего происходит замещение мышечной и эластической оболочек фибриноидом, и просвет спиральных артерий расширяется. Аналогичные процессы наблюдаются и в миометрии под базальной оболочкой, но слой фибриноида там менее выражен. Описанные изменения являются не отъемлемым признаком нормальной беременности и полу чили название «фибриноидный некроз стенки» (I. Brosens, М. Renaer, 1972), или нормальные гестационные изменения спиральных артерий. В результате этого сложного процесса оболочка спиральных артерий оказывается полностью лишенной гладкомышечных элементов и становится не чувствительной к действию различных эндогенных прессорных агентов.
Динамические допплеровские исследования, проведенные с конца I триместра беременности, показали, что максимальное снижение резистентности маточных артерий происходит к 16-18 неделям. Это означает завершение основных морфологических изменений спиральных артерий и окончательное формирование низкорезистентного кровотока в бассейне маточных артерий. Тем не менее во второй половине беременности продолжается постепенное снижение резистентности кровотоку в маточных артериях вплоть до 36-38 недель.
Поданным I. Brosensn М. Renaer (1972), состояние спиральных артерий во время беременности классифицируется следующим образом: 1) нормальные физиологические изменения; 2) отсутствие или недостаточные гестационные изменения; 3) изменения спиральных артерий, сопровождающиеся сужением их просвета.
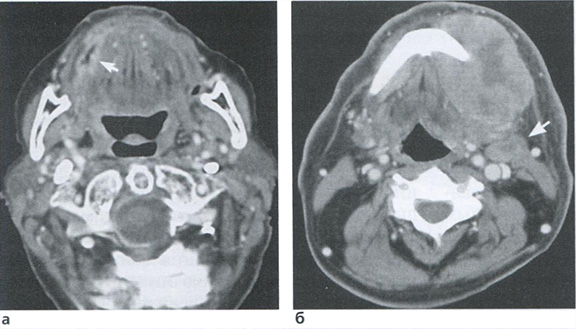
В наших исследованиях было установлено, что при отсутствии или неполных гестационных изменениях спиральных артерий, полученных для изучения при биопсии плацентарного ложа в ходе операции кесарева сечения, замедление роста плода было зарегистрировано в 59,3% случаев, средний срок родоразрешения составил 35,7 не дели, досрочное родоразрешение потребовалось в 66,7% наблюдений, средняя масса новорожденных составила 2037 г. При нормальных спиральных артериях аналогичные показатели составили соответственно 6,3%, 39,4 недели, 0% и 3481 г (М. В. Медведев и соавт., 1992). Наиболее интересными были данные анализа КСК в маточных артериях: при нормальных спиральных артериях нарушения кровотока в маточных артериях не были зарегистрированы ни в одном случае, тогда как при отсутствии или неполных гестационных изменениях спиральных артерий патологические КСК маточных артерий были обнаружены в 81,5% наблюдений (рис. 3.21,3.22).
Развитие плацентарной недостаточности при патологическом состоянии спиральных артерий проходит несколько этапов. Первоначально развивается гиперпластический артериосклероз спиральных артерий миометрия в области плацентарной площадки.
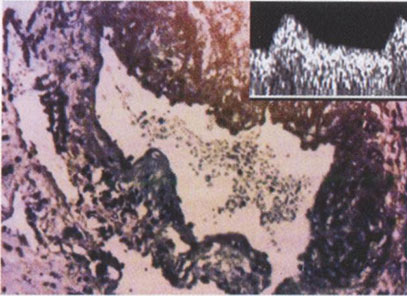
Рис. 3.21. Нормальные гестационные изменения сегмента спиральной артерии, расположенной в миометрии при нормальных КСК в маточной артерии.
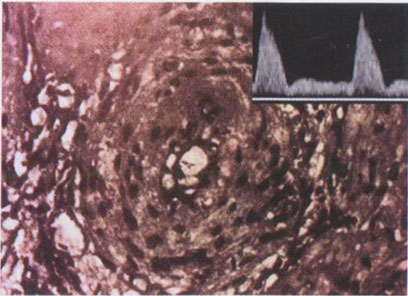
Рис. 3.22. Спиральная артерия плацентарного ложа с резким сужением просвета и гипертрофией мышечной оболочки при патологических КСК в маточной артерии.
Эти изменения приводят к патологии процесса инвазии трофобласта в децидуальную оболочку, что является импульсом к формированию аномального маточно-плацентарного кровотока. Нарушение сопровождается изменениями реологических свойств крови, гемостаза и микроциркуляции. Объем межворсинчатого пространства и скорость кровотока в этих условиях снижаются. Соответственно нарушается метаболическая и транспортная функция плаценты, ухудшается газообмен и снабжение плода питательными и пластическими веществами.
Теперь становится очевидным, что изучение КСК в маточных артериях позволяет фактически судить о состоянии спиральных артерий, патологические изменения которых являются основными в патогенезе плацентарной недостаточности и преэклампсии.
Купить медицинскую литературу по УЗИ в акушерстве в интернет-магазине shopdon.ru
Книга "Скрининговое ультразвуковое исследование в 30-34 недели беременности"
В книгу включен раздел по допплерографии в акушерстве!
Автор: М. В. Медведев, Н. А. Алтынник

В монографии представлены фундаментальные положения проведения скринингового исследования в 30-34 недели беременности. Подробно рассмотрены все аспекты протокола ультразвукового скринингового исследования в III триместре беременности. Особое внимание уделено ультразвуковой фетометрии, оценке плаценты, околоплодных вод и пуповины. Детально представлены вопросы ультразвуковой анатомии плода в III триместре беременности при нормальном развитии и различных врожденных пороках с поздней манифестацией. Отдельная глава посвящена методическим подходам к оценке маточно-плацентарного и плодового кровотока в норме и при замедлении роста плода. Приведены современные сведения по пренатальной диагностике и алгоритм ведения беременности при замедлении роста плода.
Монография предназначена для врачей ультразвуковой диагностики, акушеров-гинекологов и перинатологов.
Купить медицинскую литературу по УЗИ в акушерстве в интернет-магазине shopdon.ru
Содержание книги "Скрининговое ультразвуковое исследование в 30-34 недели беременности"
Глава 1. Методические подходы к проведению ультразвукового скринингового исследования в 30-34 недели беременности
Протокол скринингового ультразвукового исследования в 30-34 недели беременности
Фетометрия
Ультразвуковая оценка плаценты, околоплодных вод и пуповины
Шейка и стенки матки
Глава 2. Оценка ультразвуковой анатомии плода и пренатальная диагностика врожденных пороков в 30-34 недели беременности
Головной мозг
Лицо
Органы грудной клетки
Сердце и главные сосуды
Органы брюшной полости
Мочеполовая система
Глава 3. Допплерография маточно-плацентарного и плодового кровотока
Методы оптимизации допплеровских изображений
Цветовое допплеровское картирование
Импульсная допплерография
Допплеровские измерения
Методика исследования
Маточные артерии
Артерии пуповины
Венозный проток
Средняя мозговая артерия
Классификация нарушений маточно-плацентарно-плодового кровотока и алгоритм наблюдения плодов с замедлением роста с использованием допплерографии и кардиотокографии
Купить медицинскую литературу по УЗИ в акушерстве в интернет-магазине shopdon.ru
Книга "Скрининговое ультразвуковое исследование в 11-14 недель беременности" - М. В. Медведев, Н. А. Алтынник

В учебном пособии представлены фундаментальные положения проведения комбинированного скринингового исследования в 11-14 недель беременности. Подробно рассмотрены все аспекты протокола ультразвукового скринингового исследования в 11–14 недель беременности. Особое внимание уделено оценке ультразвуковой анатомии плода при нормальном развитии и различных врожденных пороках. Отдельная глава посвящена методическим подходам к оценке маркеров хромосомных аномалий плода в ранние сроки беременности. Приведены подробные сведения по комбинированному расчету риска хромосомных аномалий и преэклампсии в 11-14 недель беременности.
Учебное пособие предназначено для врачей ультразвуковой диагностики, акушеров-гинекологов, врачей-генетиков.
Книга "Врожденные пороки сердца пренатальная диагностика и патоморфология" - М. В. Медведев, И. В. Новикова

В книге подробно освещены вопросы пренатальной ультразвуковой диагностики и морфологии врожденных пороков сердца. Подробно рассмотрены вопросы оптимизации изображения сердца и главных сосудов плода в серошкальном режиме и режиме цветового допплеровского картирования. Детально представлена современная методика эхокардиографического исследования плода и эхографические признаки различных врожденных пороков сердца. Особое внимание уделено вопросам дифференциальной диагностики врожденных пороков сердца при оценке четырехкамерного среза сердца, среза через 3 сосуда и срезов через выходные тракты желудочков. В специальных подразделах каждой главы подробно рассмотрены морфологические особенности сердца и главных артерий, сочетанные пороки и хромосомные аномалии в зависимости от нозологической формы врожденного порока сердца.
Книга "Скрининговое ультразвуковое исследование в 18-21 неделю беременности" - М. В. Медведев

В монографии представлены фундаментальные положения проведения скринингового исследования в 18-21 неделю беременности. Подробно рассмотрены все аспекты протокола ультразвукового скринингового исследования во II триместре беременности. Особое внимание уделено ультразвуковой фетометрии, оценке плаценты, околоплодных вод и пуповины. Детально представлены вопросы ультразвуковой анатомии плода во II триместре беременности при нормальном развитии и различных врожденных пороках. Отдельная глава посвящена эхографическим маркерам хромосомных аномалий у плода.
Монография предназначена для врачей ультразвуковой диагностики, акушеров-гинекологов и перинатологов.
Книга "Врожденные пороки центральной нервной системы: пренатальная диагностика и патоморфология" – М. В. Медведев, И. В. Новикова, О. И. Козлова

В книге подробно освещены вопросы пренатальной ультразвуковой диагностики и морфологии врожденных пороков центральной нервной системы. Представлена современная методика ультразвукового исследования головного мозга плода и эхографические признаки различных врожденных пороков. Особое внимание уделено вопросам применения объемной эхографии и магнитно-резонансной томографии в оценке структур головного мозга плода и пренатальной диагностики пороков центральной нервной системы. В специальных подразделах каждой главы рассмотрены морфологические особенности головного мозга, сочетанные пороки и хромосомные аномалии в зависимости от нозологической формы врожденного порока центральной нервной системы.
Книга "Ультразвуковая диагностика в акушерстве и гинекологии для начинающих" - Н. А. Алтынник

В монографии представлены основные физико-технические принципы ультразвукового метода исследования. Детально разобраны теоретические и практические вопросы выбора ультразвуковых датчиков, типов ультразвуковых режимов, биологического действия и безопасности ультразвукового метода исследования в акушерстве. Особое внимание уделено оптимизации изображения в основных режимах сканирования. Отдельная глава посвящена рассмотрению стандартизированного подхода к ультразвуковому исследованию в гинекологии. Рассмотрены все основные аспекты практического освоения материала для проведения ультразвуковых исследований в I, II и III триместрах беременности. Уделено внимание аспектам ультразвукового исследования при многоплодной беременности. Отдельная глава посвящена базовым вопросам проведения ультразвукового исследования в гинекологической практике.
Книга предназначена для начинающих врачей ультразвуковой диагностики, врачей акушеров-гинекологов, ординаторов.
Купить книгу "Ультразвуковая диагностика в акушерстве и гинекологии для начинающих" - Н. А. Алтынник
"Плод по неделям беременности. Таблицы УЗИ фетометрии, допплерографии, эхокардиографии". Номограммы в 11-14 недель беременности. Комплект – М. В. Медведев

Таблицы нанесены с двух сторон на плотную картонную бумагу (в комплекте 4 листа). Таблицы цветные для удобства восприятия. Удобно использовать, как памятку.
Enzian классификация эндометриоза на русском языке

Таблица "Классификация эндометриоза ENZIAN"
Эндометриоз - хроническое заболевание, связанное с тазовой болью и бесплодием. Классификация ENZIAN была разработана для классификации глубоко инфильтрирующего эндометриоза и сосредоточена на забрюшинных структурах (классификация Американского общества репродуктивной медицины.).
Индекс фертильности эндометриоза был разработан для прогнозирования исходов фертильности у пациентов, перенесших операцию по поводу эндометриоза. Показатель ENZIAN (ENZIAN score) позволяет не только описать локализацию, но и оценить тяжесть глубокого инвазивного эндометриоза в баллах. Основное преимущество показателя ENZIAN – топографическое отображение эндометриоза, позволяющее составить план будущей операции: например, предположить потребуется ли частичная или полная резекция участка кишки, а также предсказать ее продолжительность.
Таблица ENZIAN с дух сторон нанесена на плотную бумагу. Таблицу можно класть под стекло или вешать на стену.
Купить таблицу ENZIAN в интернет-магазине медицинской литературы shopdon.ru
Книга "Ультразвуковая диагностика глубокого эндометриоза: IDEA, ENZIAN" - М. В. Медведев, Н. А. Алтынник
Авторы: М. В. Медведев, Н. А. Алтынник

В методических рекомендациях подробно освещены вопросы ультразвуковой диагностики глубокого эндометриоза. Представлена современная методика ультразвукового исследования органов малого таза у женщин с подозрением на глубокий эндометриоз. Особое внимание уделено эхографическим признакам глубокого эндометриоза в зависимости от локализации патологического процесса на основе консенсусного предложения международной группы экспертов (IDEA). Специальный раздел посвящен классификации ENZIAN, которая используя стандартизированные подходы, является наиболее оптимальной в предоперационной диагностике эндометриоза.
Методические рекомендации предназначены для врачей ультразвуковой диагностики, акушеров-гинекологов и хирургов.
Книга "Ультразвуковая дифференциальная диагностика новообразований яичников. Методические рекомендации" - М. В. Медведев

В методических рекомендациях подробно освещены вопросы современной ультразвуковой стратификации опухолей яичника и системы наблюдения (O-RADS). Специальный раздел посвящен консенсусу экспертов международных обществ ESGO/ISUOG/IOTA/ESGE в предположительном определении гистологического типа новообразований яичников.
Методические рекомендации предназначены для врачей ультразвуковой диагностики, акушеров-гинекологов и хирургов.
Содержание книги "Ультразвуковая дифференциальная диагностика новообразований яичников. методические рекомендации" - М. В. Медведев, Е. Д. Лютая
Раздел 1. Консенсусное предложение по ультразвуковой стратификации новообразований яичников и системе наблюдения (O-RADS, Ovarian-Adnexal Reporting and Data System)
Раздел 2. Консенсусное предложение экспертов международных обществ ESGO/ISUOG/IOTA/ESGE в предположительном определении гистологического типа новообразований яичников
Книга "Ультразвуковая фетометрия" – Н. А. Алтынник, М. В. Медведев
В методических рекомендациях подробно освещены вопросы проведения фетометрии при скрининговых и консультативных ультразвуковых исследованиях в разные сроки беременности. Подробно представлены методика и нормативные значения фетометрических параметров в зависимости от срока беременности. Специальный раздел посвящен оценке плаценты, околоплодных вод и допплерометрии кровотока в маточных артериях и различных сосудах плода.
Методические рекомендации предназначены для врачей ультразвуковой диагностики и акушеров-гинекологов.
Книга "Ультразвуковая оценка плаценты, пуповины и околоплодных вод" - М. В. Медведев

В методических рекомендациях подробно представлены основные критерии ультразвуковой оценки плаценты, пуповины и околоплодных вод. Особое внимание уделено диагностическим возможностям пренатальной эхографии в обнаружении патологических изменений и врожденных пороков плаценты и пуповины
Методические рекомендации предназначены для врачей ультразвуковой диагностики и акушеров-гинекологов.
Книга "Новые решения ультразвуковой диагностики аденомиоза" - Н. А. Алтынник, М. В. Медведев
В методических рекомендациях подробно представлены основные критерии морфологического ультразвукового анализа матки (MUSA) и современные решения пошаговой ультразвуковой диагностики аденомиоза в зависимости от его формы и распространения. Особое внимание уделено новым диагностическим критериям прямых и косвенных ультразвуковых признаков аденомиоза на основании консенсусного решения экспертов MUSA.
Книга "Нейросонография плода" - М. В. Медведев, О. И. Козлова
В методических рекомендациях подробно представлены основные методические подходы к нейросонографии плода в зависимости от срока беременности. Особое внимание уделено диагностическим возможностям нейросонографии в обнаружении патологических изменений и врожденных пороков головного мозга у плода.
Методические рекомендации предназначены для врачей ультразвуковой диагностики и акушеров-гинекологов.