Лекция для врачей "УЗИ седалищного нерва. УЗИ тазобедренных суставов у взрослых." (отрывок из книги "Ультразвуковая диагностика в травматологии и ортопедии" - Еськин Н. А.)
Седалищный нерв
Седалищный нерв — самый крупный нерв у человека (рис. 6.34). Он выходит из таза через большое седалищное отверстие под грушевидной мышцей. На уровне верхней части головки тазобедренного сустава седалищный нерв и сосудистый пучок располагаются непосредственно на задней колонне вертлужной впадины. При поперечном сканировании заднего отдела тазобедренного сустава седалищный нерв иногда бывает трудно определить из-за большой мышечной массы и глубины его расположения. У менее полных пациентов седалищный бугор является главным ориентиром для визуализации других мягкотканных структур.
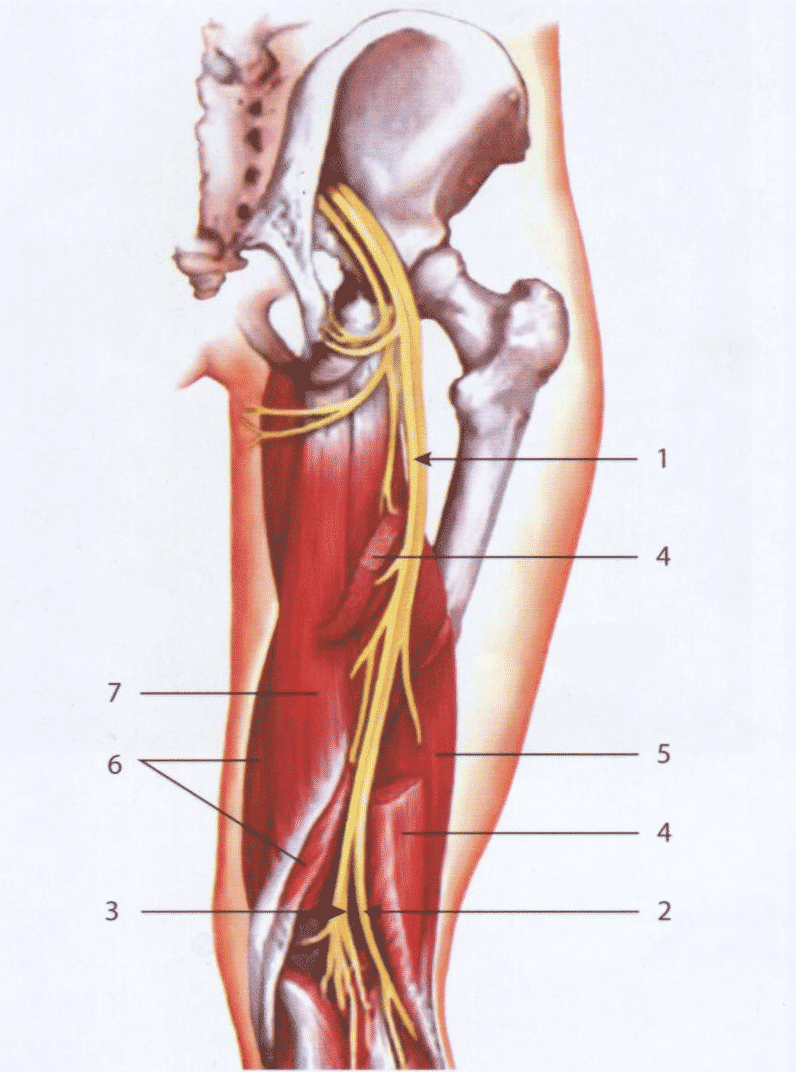
Рис. 6.34. Схема анатомического расположения седалищного нерва в норме: 7 - седалищный нерв; 2 - малоберцовый нерв; 3 - большеберцовый нерв; 4 - длинная головка двуглавой мышцы бедра; 5- короткая головка двуглавой мышцы; б - полуперепончатая мышца; 7 - полусухожильная мышца.
На уровне шейки бедра седалищный нерв отделен от костей вертлужной впадины близнецовой мышцей. Непосредственно к нижней близнецовой мышце прилежит квадратная бедра, которая находится более поверхностно к запирательному отверстию. В этом месте седалищный нерв располагается в треугольнике, верхней границей которого является большая ягодичная мышца, внутренней — квадратная мышца бедра и в середине - седалищный бугор с местом прикрепления полуперепончатой мышцей и длинным сухожилием двуглавой мышцы. Далее нерв спускается снаружи от седалищного бугра под большой ягодичной мышцей и длинной головкой двуглавой мышцы. Седалищный нерв в верхней трети бедра лежит латерально от сухожилия двуглавой мышцы и медиально — полусухожильной и полуперепончатой мышцами, непосредственно под широкой фасцией. В средней трети бедра он прикрыт длинной головкой этой мышцы, а ниже находится в промежутке между полуперепончатой и двуглавой мышцами бедра.
В подколенную ямку нерв вступает у ее верхнего угла, образованного расходящимися латерально головкой двуглавой и медиально полусухожильной и полуперепончатой мышцами. Здесь, а нередко и выше седалищный нерв делится на два крупных ствола - большеберцовый и общий малоберцовый нервы.
УЗИ нервов прежде всего зависит от их размера и направления. Нервы менее анизотропны, чем сухожилия, и поэтому не требуется адекватная ориентация датчика при их исследовании.
Как и все периферические нервы, седалищный нерв является образцом фасцикулярной ткани с гипоэхогенными параллельными линиями, разделенными гиперэхогенными полосами (рис. 6.35).
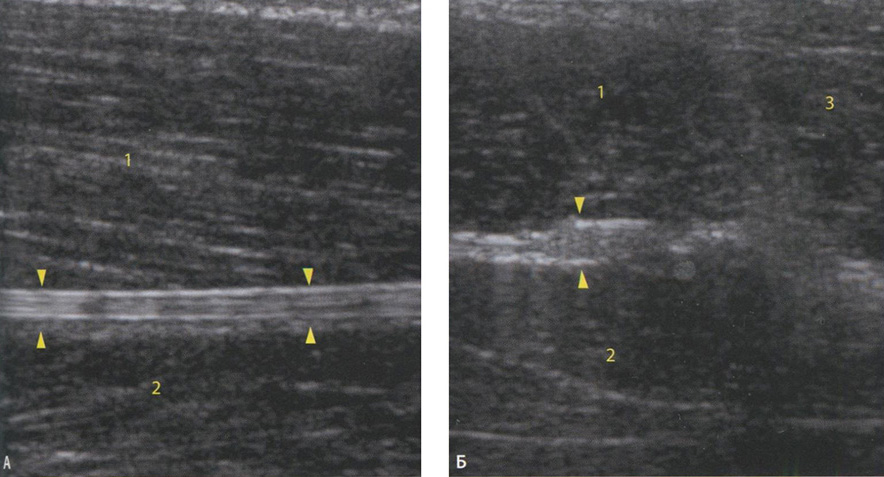
Рис. 6.35. Сонограммы седалищного нерва в норме: А - продольный срез седалищного нерва (головки стрелок), который визуализируется как гиперэхогенная линейная структура с гипоэхогенными полосами: 1 - длинная головка двуглавой мышцы; 2 - полуперепончатая мышца; 3 - полусухожильная мышца. Б-поперечный срез нерва, который выглядит как округлое сотоподобное гиперэхогенное образование с мелкими гипоэхогенными включениями.
Гипоэхогенные полосы соответствуют нейронным пучкам, а гиперэхогенные полосы являются внутрифасцикулярным эпиневрием. При поперечных ультразвуковых срезах нерв выглядит как сотоподобное образование с гипоэхогенными включениями с гиперэхогенной оболочкой - по типу «соль-перец».
Повреждение нерва при травмах происходит при его перерастяжении, прямом ушибе нерва или проникающем ранении и не зависит от наличия дегенеративных изменений. При незначительных повреждениях нерв может сохранять нормальный ультразвуковой внешний вид, независимо от клинических признаков и нарушений функции. Отсутствие нарушения ультразвуковой структуры нерва указывает на быстрое восстановление его функции. При острых травмах изменения нервов более существенны. Ультразвуковая картина нерва в месте травмы определяется как гипоэхогенная зона, с характерными нечеткими или плохо очерченными границами. В зависимости от степени повреждения и травмирующего агента меняется сонографическая картина. Если имеется полное повреждение нерва и слишком большой диастаз между концами нерва - неврома развивается из проксимального конца нерва. Нередко при УЗИ определялись несколько зон повреждения нерва (рис. 6.36).
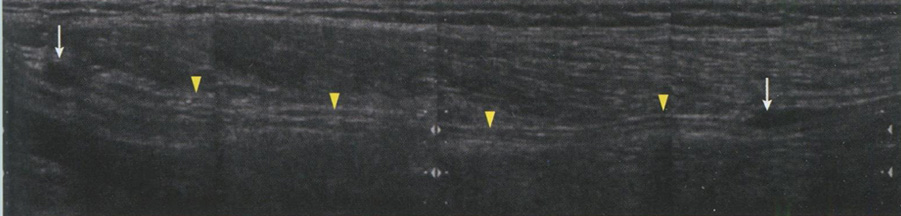
Рис. 6.36. Сонограмма огнестрельного повреждения седалищного нерва в верхней трети бедра с образованием невромы в виде гипоэхогенного округлого образования (желтая стрелка) и малоберцового нерва с образованием невромы (белая стрелка). Головками стрелок обозначена нормальная эхоструктура неповрежденного нерва.
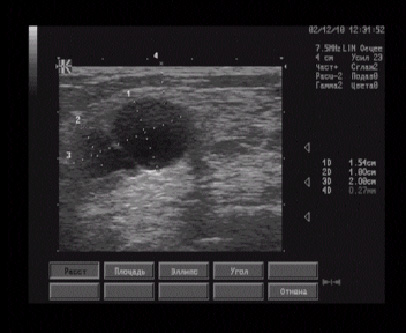
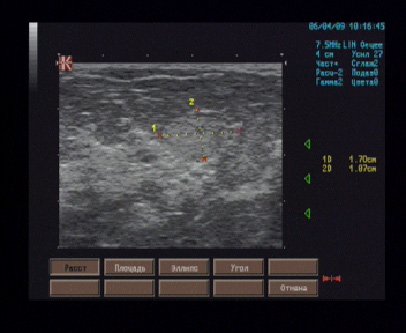
Наиболее частые причины компрессии седалищного нерва - перелом тазового кольца (рис. 6.37), седалищной кости (рис. 6.38) или травма задней группы мышц бедра (рис. 6.39, 6.40), в результате которых образовывалась гематома, приводящая к сдавлению нерва. Нередко для сонографической визуализации патологии седалищного нерва использовался ультразвуковой датчик 3,5 МГц. Это было необходимо при исследовании тучных пациентов или при больших гематомах, которые пропитывали окружающие мышцы.
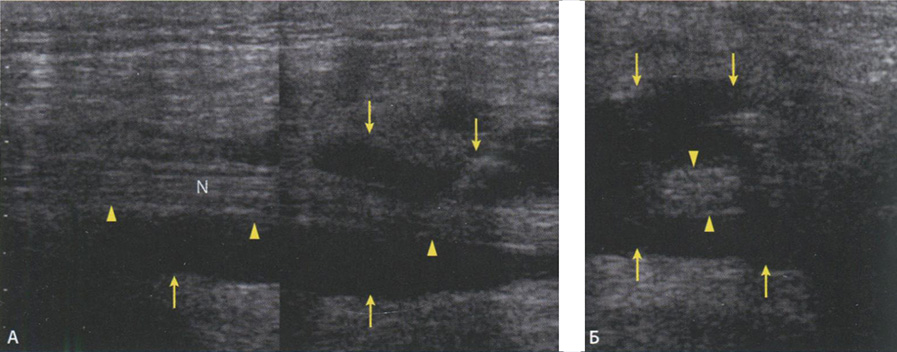
Рис. 6.37. Сонограммы сдавления седалищного нерва (головки стрелок) гематомой, образовавшейся в результате перелома костей тазового кольца. Исследование выполнено на 4-е сутки после травмы. Седалищный нерв со всех сторон окружен гипоэхогенным жидкостным содержимым (стрелки) в виде обруча: А - продольный срез; Б - поперечный срез.
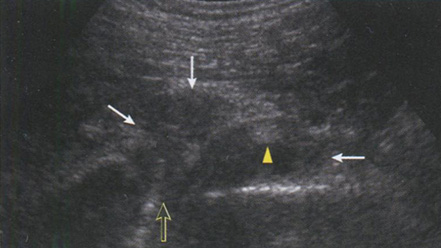
Рис. 6.38. Поперечная сонограмма сдавления седалищного нерва на уровне седалищной кости с использованием ультразвукового датчика 3,5 МГц. Пациент с переломом седалищной кости (черная стрелка) в результате падения с высоты с образованием гематомы (белые стрелки), которая сдавливает седалищный нерв (головка стрелки).
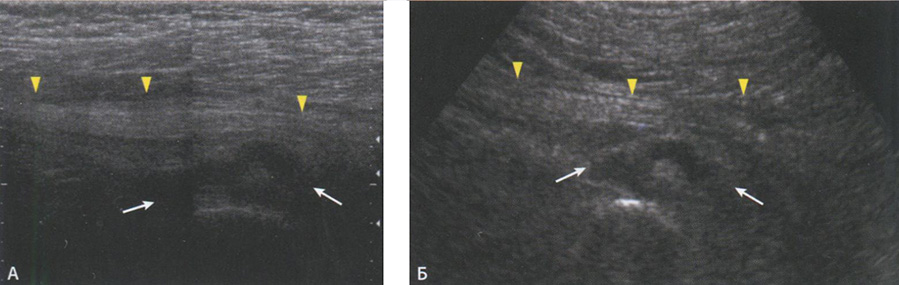
Рис. 6.39. Сонограммы сдавления седалищного нерва гематомой на уровне седалищной кости: А - сонограмма седалищного нерва (головки стрелок), который поддавливает гематома (стрелки), с использованием линейного мультичастотного датчика 5-12 МГц; Б - продольная сонограмма того же пациента с использованием датчика 3,5 МГц.
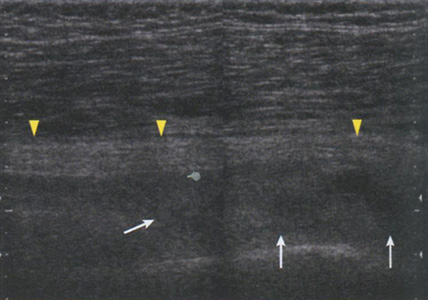
Рис. 6.40. Продольная сонограмма седалищного нерва (головки стрелок), который поддавливает полуорганизовавшаяся гематома (стрелки) на уровне проксимального отдела бедра, которая образовалась в результате повреждения двуглавой мышцы бедра.
Вы читали отрывок из книги "Ультразвуковая диагностика в травматологии и ортопедии" - Еськин Н. А.
Купить книгу "Ультразвуковая диагностика в травматологии и ортопедии" - Еськин Н. А.

Книга "Ультразвуковая диагностика в травматологии и ортопедии"
Автор: Еськин Н. А.
В представленном издании рассмотрены вопросы ультразвукового исследования в травматологии и ортопедии в норме и при патологии, определены показания к проведению исследований, описана ультразвуковая семиотика заболеваний и повреждений костно-мышечной системы с подробными протоколами ультразвуковых исследований. Издание хорошо иллюстрировано, все иллюстрации снабжены подробными комментариями.
Купить книгу "Ультразвуковая диагностика в травматологии и ортопедии" - Еськин Н. А.
Содержание книги "Ультразвуковая диагностика в травматологии и ортопедии"
ГЛАВА 1. УЛЬТРАЗВУКОВОЕ ИССЛЕДОВАНИЕ ПЛЕЧЕВОГО СУСТАВА
1.1. Нормальная анатомия и эхографическая картина плечевого сустава
1.2. Диагностика заболеваний плечевого сустава
Литература
ГЛАВА 2. УЛЬТРАЗВУКОВОЕ ИССЛЕДОВАНИЕ ЛОКТЕВОГО СУСТАВА И КИСТИ
2.1. Нормальная анатомия локтевого сустава и кисти
2.2. Патология локтевого сустава
2.3. Ультрасонография патологии кисти и запястья
Литература
ГЛАВА 3. УЛЬТРАЗВУКОВОЕ ИССЛЕДОВАНИЕ ПОПЕРЕЧНОПОЛОСАТОЙ МУСКУЛАТУРЫ В НОРМЕ И ПРИ ПАТОЛОГИИ
Литература
ГЛАВА 4. УЛЬТРАЗВУКОВАЯ ДИАГНОСТИКА ТАЗОБЕДРЕННЫХ СУСТАВОВ У ДЕТЕЙ ДО 1 ГОДА
4.1. Нормальное развитие тазобедренного сустава
4.2. Анализ патологических состояний тазобедренных суставов
Литература
ГЛАВА 5. УЛЬТРАСОНОГРАФИЧЕСКОЕ ИССЛЕДОВАНИЕ
У ДЕТЕЙ СТАРШЕ 1 ГОДА С ЗАБОЛЕВАНИЯМИ И ПОВРЕЖДЕНИЯМИ ТАЗОБЕДРЕННЫХ СУСТАВОВ
Литература
ГЛАВА 6. УЛЬТРАЗВУКОВОЕ ИССЛЕДОВАНИЕ ТАЗОБЕДРЕННЫХ СУСТАВОВ У ВЗРОСЛЫХ
6.1. Передний отдел сустава
6.2. Ультрасонография паховой области
Литература
ГЛАВА 7. УЛЬТРАЗВУКОВОЕ ИССЛЕДОВАНИЕ КОЛЕННОГО СУСТАВА
7.1. Эхографическая картина коленного сустава и окружающих его тканей в норме
7.2. Заболевания и повреждения коленного сустава
7.3. Нестабильность коленного сустава
Литература
ГЛАВА 8. УЛЬТРАЗВУКОВОЕ ИССЛЕДОВАНИЕ ГОЛЕНИ И СТОПЫ
8.1. Нормальная анатомия и сонографическая картина голени и голеностопного сустава
8.2. Ультразвуковое исследование патологии голеностопного сустава и стопы
Купить книгу "Ультразвуковая диагностика в травматологии и ортопедии" - Еськин Н. А.