Местный иммунитет полости рта и микробиота биопленок. Лекция для врачей
Лекция для врачей "Местный иммунитет полости рта и микробиота биопленок" (отрывок из книги "Микробиология, вирусология, иммунология полости рта. Учебник" - В. Н. Царев)
Местный иммунитет полости рта и микробиота биопленок
Понятие о местном иммунитете полости рта
Местный иммунитет полости рта — совокупность врожденных и приобретенных механизмов защиты и регуляции клеточно-молекулярных взаимодействий, действующих в секретах и тканях челюстно-лицевой области, а также в биопленке полости рта.
С точки зрения иммунной защиты у полости рта много общего с другими слизистыми оболочками организма. Однако уникальность ротовой полости — в одновременном присутствии и постоянных поверхностей (коронок зубов), и сменяемых слизистых оболочек. Выступающая из слизистой оболочки коронка зуба прерывает ее целостность формированием манжеты из слущивающегося кератинизированного эпителия, плотно прилегающего к поверхности эмали.
Эпителий свободной десны переходит в соединительный эпителий, который связывает ее с поверхностью зуба с образованием десневой борозды. В норме жидкость десневой борозды (тканевый транссудат) промывает этот уязвимый для бактерий и их продуктов участок. Если под десной формируется зубная бляшка (поддесневая или субгингивальная), содержащая патогенные микроорганизмы, то в соединительном эпителии и подлежащей ткани развивается воспалительный процесс. При этом возрастающий ток жидкости активно приносит к бляшке иммунные компоненты — клетки и секреторные молекулы.
Факторы врожденного иммунитета
Барьерная функция слизистой оболочки
В полости рта кератинизированные участки слизистой оболочки ограничены деснами, твердым нёбом и частью спинки языка. И, хотя кератинизация препятствует проникновению микроорганизмов и их продуктов, это не означает, что некератинизированные участки лишены защиты. Эпителиальные клетки экспрессируют молекулы МНС-1. В последние годы было показано, что эпителий ротовой полости экспрессирует TLR-молекулы, распознающие консервативные патоген- ассоциированные молекулярные паттерны (РАМР — Pathogen-Associated Molecular Pattern), характерные для поверхностных молекул патогенных микроорганизмов и отсутствующие у клеток хозяина (рис. 13.1).
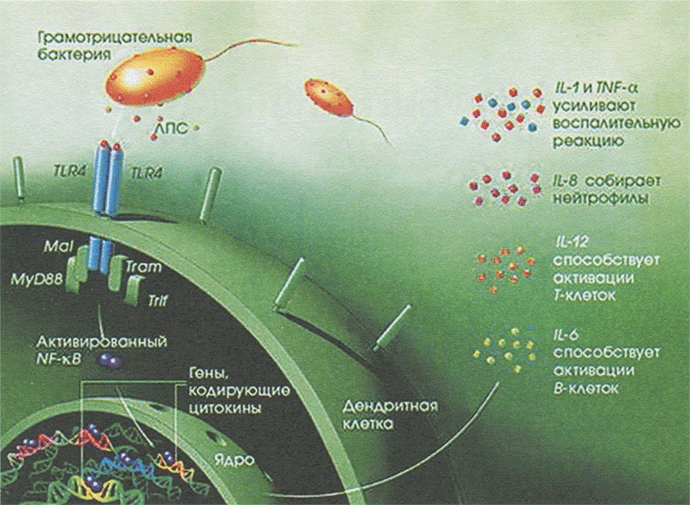
Рис. 13.1. Распознавание бактериальных липополисахаридов и индукция про- воспалительных цитокинов
К ним относят, например, ЛПС грамотрицательных бактерий, пептидогликан, флагеллин, пилин, бактериальную ДНК, маннаны грибов, двуспиральную РНК вирусов. В настоящее время идентифицировано более 10 TLR, способных распознавать различные РАМР. Контакт таких рецепторов с РАМР служит сигналом для эпителиоцитов к образованию цитокинов, хемокинов и противомикробных пептидов — β-дефензинов. Кроме того, эпителиальные клетки могут выделять
Дефензины
Дефензины — относительно небольшие (3-6 кДа) катионные пептиды, имеющие 3-4 дисульфидные связи. В зависимости от расположения этих связей и локализации серина подразделяются на α- и β-дефензины. Основные β-дефензины продуцируются клетками протоков слюнных желез. В микромолярных количествах дефензины проявляют активность в отношении бактерий, грибов и оболочечных вирусов.
Действие дефензинов сходно с таковым пептидного антибиотика грамицидина С: в бактериальных мембранах, богатых отрицательно за-ряженными фосфолипидами, дефензины образуют многомерные кольцевидные комплексы, что приводит к образованию пор, повышению проницаемости мембраны и в конечном счете к ее осмотическому разрушению. Меньшее содержание фосфолипидов в клетках высших эукариот (человека) обеспечивает им защиту от нежелательного действия этих пептидов.
Кроме того, β-дефензины вызывают активацию и дегрануляцию тучных клеток, способствуя выбросу гистамина и простагландина D2 — хемоаттрактанта для нейтрофилов, а также для незрелых дендритных клеток и Т-клеток памяти. Эта функция сближает дефензины с хемокинами — позволяет активировать воспалительные реакции и противоинфекционную защиту.
Кальпротектин
Кальпротектин — антибактериальный белок, образуемый клетками некератинизированного эпителия и способный хелатировать ионы кальция и цинка. Его антибактериальная и противогрибковая активность обусловлена способностью связывать цинк, лишая микроорганизмы этого важного иона. Высокие концентрации кальпротектина встречаются также в цитоплазме нейтрофилов, моноцитов и макрофагов, поэтому такие воспалительные экссудаты, как десневая жидкость, могут содержать высокие концентрации кальпротектина. Из десневой борозды он может попадать в слюну.
Вязкий муциновый слой
Муцины — гликопротеины с различными формами гликозилирования. Для полости рта характерны 2 основных муцина: высокомолекулярный полимер MG1 и низкомолекулярный гликопептид MG2. Ввиду наличия значительной углеводной части и нитевидной структуры MG1 имеет свойства вязкого эластичного геля, что наилучшим образом подходит для покрова слизистой оболочки. Вся внутренняя поверхность ротовой полости покрыта слизистой пленкой толщиной менее 0,1 мм, которая увлажняет и смазывает слизистую оболочку. Такая пленка — липкий, скользкий полупроницаемый гель, содержащий липиды, белки и ионы. Липиды расположены на поверхности по всему слизистому покрову. Муцин, липиды и сахариды служат также ловушками для свободных радикалов. Муцин постоянно расходуется или частично переваривается нормальной микрофлорой, поэтому его стабильно секретируют подчелюстная, подъязычная и малые слюнные железы. Слизистый слой эффективно улавливает частицы и небольшие молекулы и блокирует их проникновение через слизистую оболочку. За счет образования множества временных низкоаффинных связей с антибактериальными субстанциями хозяина, в том числе антителами (например, slgA), он обеспечивает их более длительное воздействие. Состав, скорость секреции и утрачивания слизи могут быстро и существенно изменяться в зависимости от диеты и воздействия на мукозальную поверхность различных патогенных или комменсальных микроорганизмов и токсинов.
Десквамация
Десквамация — важный компонент врожденной защиты хозяина. Эпителий кожи и слизистых оболочек постоянно слущивается. Показано, что скорость слущивания зависит от бактериальной нагрузки эпителия. Важность этого механизма в предотвращении бактериальной колонизации можно понять, сравнив в окрашенных по Граму мазках количество бактерий на буккальном эпителии и в биопленке на зубах (зубной бляшке) — необновляемой ткани ротовой полости.
Эпителиальные рецепторы для антител
На клетках буккального эпителия имеются рецепторы для секреторного компонента slgA — гликопротеина, ковалентно связанного с этими антителами. Соответственно, связанные такими антителами микроорганизмы будут удаляться при слущивании эпителия.
Приобретенная пелликула эмали
Поверхности зубов покрываются бесклеточной органической пленкой — приобретенной пелликулой эмали. Белки слюны, жидкости десневой борозды и бактерий полости рта в течение 1 мин селективно адсорбируются на чистой эмали и других доступных поверхностях зубов (например, корнях) и протезов. Пелликула формируется в течение 2 ч, но процесс ее созревания и стабилизации может занять несколько дней. К тому же компоненты пелликулы со временем могут подвергаться реорганизации. Следует отметить, что пелликула, по-видимому, не просто адсорбирована на эмали, а пенетрирует ее. На самоочищающихся поверхностях эмали пелликула имеет толщину 30-100 нм.
Ее основные компоненты: богатые пролином белки, цистатины, лизоцим, slgA, муцин MG1, лактоферрин, статерин и амилаза слюны; IgG, IgM и компонент СЗ-комплемента из десневой жидкости, а также фермент стрептококков глюкозилтрансфераза.
Основные функции пелликулы — защита эмалевых поверхностей от трения зубов о зубы или слизистую оболочку и противодействие деминерализации под влиянием бактериальных кислот и кислых пищевых продуктов. Защите способствует наличие в пелликуле молекул, способствующих смазыванию поверхностей зубов (например, муцина MG1) и их реминерализации (пролинсодержащие белки, статерин, цистатины). С другой стороны, приобретенная пелликула служит субстратом для инициальной адгезии первых бактерий, формирующих зубную бляшку. Бактерии начинают прикрепляться к пелликуле уже через несколько часов после ее образования, несмотря на действие нескольких врожденных антибактериальных факторов, а также slgA-, IgG- и, возможно, IgM-антител.
В действительности эти иммунные молекулы, по-видимому, могут служить лигандами для прикрепления бактерий. Однако следует учитывать, что пелликула способствует селективному прикреплению безвредных бактерий и подавляет адгезию микроорганизмов, потенциально опасных для эмали.
Однако некоторые из них, например Streptococcus mutans, образующие внеклеточные гликозилтрансферазы с высокой аффинностью к поверхности эмали, внедряются в пелликулу. Указанные ферменты обеспечивают in situ синтез из сахарозы адгезивных полимеров гликана, которые при участии гликансвязывающих белков обеспечивают прикрепление S. mutans. Обычно у этой бактерии невысокая аффинность к пелликуле, и она не может эффективно конкурировать с первичными стрептококками за места связывания на поверхности зуба. В связи с этим «сахарозный» механизм адгезии S. mutans к зубу можно рассматривать как следствие нарушения экологических процессов, приводящее к развитию заболевания.
Взаимодействие с микрофлорой полости рта
В норме эндогенная микрофлора — важный многофункциональный компонент системы естественной антиинфекционной защиты слизистых оболочек организма. Комменсалы конкурируют с экзогенными бактериями за питательные вещества и рецепторы. Они также вырабатывают антибактериальные вещества, например бактериоцины. Кроме того, некоторые компоненты эндогенных микроорганизмов, например ЛПС, являются иммуностимуляторами — способствуют выработке перекрестно реагирующих (нормальных) антител и поддержанию экспрессии молекул МНС-И макрофагами и другими вспомогательными клетками. Значение нормальной микрофлоры можно оценить, изучив состояние больных после лечения пероральными антибиотиками широкого спектра действия. В результате подавления нормофлоры у них происходит колонизация слизистых оболочек устойчивыми бактериями и грибами (чаще Candida albicans), которые раньше вытеснялись или во многом подавлялись представителями комменсальной микрофлоры.
Секреция слюны и защитные факторы ротовой жидкости
Парные большие слюнные железы (околоушная, подчелюстная, подъязычная), наряду с множеством мелких желез по всей слизистой оболочке полости рта, за сутки образуют от 0,5 до 1,5 л слюны. При этом доля подчелюстной железы в среднем составляет 65%, околоушной — 23%, подъязычной — 4%, малых желез — 8%, хотя пропорции могут изменяться в зависимости от условий стимулирования. Для целостности твердых и мягких тканей полости рта важна адекватность слюноотделения. Негативное влияние сниженного слюноотделения можно наблюдать у лиц после радиоактивного облучения области головы и шеи, нарушающего функции слюнных желез, или у больных после приема лекарственных средств, уменьшающих скорость слюноотделения. Слюна — гипотонический водный раствор, по осмотическому давлению близкий к плазме. Ее среднее значение pH 6,7(±1). Наряду с неорганическими в ней содержатся органические вещества. Основные неорганические вещества слюны — электролиты (бикарбонат, хлорид, калий, натрий). Общая концентрация белка невелика — 2-3 г/л. В слюне содержатся пищеварительный фермент амилаза, гликопротеины — любриканты слизистой оболочки, кислые пролин- и тирозинсодержащие (статерин) белки — стабилизаторы ионов кальция и фосфата, а также множество специфических и неспецифических защитных факторов организма хозяина.
Муцины
Ввиду низкой вязкости в слюне функционирует преимущественно MG2, главное назначение которого состоит в агрегации микроорганизмов и их удалении из полости рта. Этому способствуют лектиноподобные взаимодействия между углеводными остатками молекулы MG2 и белковых рецепторов на поверхности бактерий. Например, слюна подчелюстной и подъязычной желез склеивает клетки некоторых стрептококков полости рта за счет сиаловой кислоты в боковых цепях муцинового гликана. В агрегации бактерий различных родов и видов, по-видимому, участвуют различные углеводы. Склеивание слюной бактерий полости рта — высокоэффективный способ ее очищения; вместе с тем, если муцины покрывают слизистую оболочку, такие взаимодействия могут способствовать прикреплению и удержанию бактерий на тканях.
Агглютинин
Близкий к муцину МС2-агглютинин слюны — высокогликозилированный белок, способный агглютинировать широкий круг бактерий полости рта. Оба эти соединения очень липкие и имеют тенденцию к образованию комплексов с другими белками слюны, например с slgA и лактоферрином. Слюнной агглютинин идентичен гликопротеину gp340 из суперсемейства богатых цистеином рецепторов-«мусорщиков».
Белок эбнеровских желез. Этот ингибитор цистеиновых протеаз попадает в слюну из эбнеровских желез, расположенных у основания желобо- и листовидных сосочков спинки языка. Являясь многофункциональным, он может устранять продукты переокисления, обладает нуклеазной и соответственно потенциальной противовирусной активностью.
Гистатины
Это небольшие (7-38 аминокислотных остатков), многофункциональные, богатые гистидином нейтральные или основные пептиды. Среди их функций — регуляция роста кристаллов фосфата кальция, нейтрализация токсичных молекул, хелатирование, подавление цитокиновой и протеазной активности. Они проявляют также выраженную бактерицидную и фунгицидную активность, могут подавлять склеивание разнородных бактериальных клеток и опосредованную бактериями гемагглютинацию. В слюне обнаружено не менее 12 различных гистатиновых полипептидов. Гистатин 1 (длиной 38 аминокислотных остатков) и гистатин 3 (32 остатка) — продукты двух разных генов, а остальные представители этого семейства белков являются их производными (в результате усечения и/или протеолиза). Гистатин 5 — 24 N-концевые кислоты гистатина 3. На указанные три гистатина (1, 3 и 5), попадающие в слюну преимущественно с секретом околоушной железы, приходится около 80% всех гистатиновых белков слюны. Предполагают, что антибактериальный эффект гистатинов обусловлен повышением проницаемости мембраны в результате образования ионных каналов, что характерно для катионных белков. Противогрибковую активность гистатина 5 объясняют его способностью связываться с мембранными белками дрожжей и высвобождать клеточную АТФ, которая активирует грибковые АТФ-рецепторы. Не исключены и другие механизмы микробицидного действия.
Цистатины
Это суперсемейство белков — ингибиторов цистеиновых протеиназ. Поскольку многие инвазивные микроорганизмы применяют в ходе инфекции эти ферменты, цистатины можно считать важными факторами защиты макроорганизма. К тому же они, по всей видимости, участвуют в регуляции воспаления, подавляя протеолитическую активность клеток хозяина и способствуя активации цитокинов, что поддерживает целостность эпителиального барьера. По структуре и функциям можно выделить 3 семейства цистатинов: представителей 1-го выявляют внутри клеток; цистатины 2-го семейства (S, SA, SN, С и D) секретируются в слюну; 3-е семейство цистатинов представлено высокомолекулярными кининогенами. Среди последних лишь цистатин С обнаружен во всех секретах организма, остальные, по-видимому, встречаются только в слюне. Цистатины слюны состоят не менее чем из 9 изоформ, представляющих кислые, нейтральные и щелочные молекулы. По сравнению с гистатинами, цистатины крупнее (-14 кДА) и секретируются главным образом подчелюстной и подъязычной слюнными железами.
Ингибитор секретируемой протеазы лейкоцитов (ИСПЛ). Этот небольшой (12 кДа) катионный кислототолерантный негликозилированный белок, вырабатываемый серозными ацинарными и эпителиальными клетками, — обычный компонент слюны и других секретов. Его предполагаемая функция включает защиту мукозального эпителия от действия эластазы и катепсина В, выбрасываемых нейтрофилами при дегрануляции. Он проявляет также бактерицидные, фунгицидные свойства и противовирусную активность в отношении ВИЧ типа 1 (подавляет в соответствующих концентрациях инфекционность ВИЧ-1). ИСПЛ состоит из двух высокогомологичных доменов, причем С-концевой домен имеет сайт подавления протеазы, N-концевой отвечает в целом за антибактериальную активность, а для реализации противовирусной активности требуется вся молекула. Противовирусная активность, по- видимому, проявляется на уровне клетки-мишени: ИСПЛ не влияет на связывание ВИЧ-1 с ней, но, вероятно, препятствует поступлению вируса в клетку и/или его «раздеванию». Механизм антибактериального действия ИСПЛ остается нерасшифрованным.
Тромбоспондин
Тромбоспондин 1 (TSP1) — высокомолекулярный трехмерный гликопротеин матрикса, который секретируется подчелюстной и подъязычной слюнными железами. Показано, что он в соответствующих концентрациях in vitro подавляет инфицирование вирусом ВИЧ-1 мононуклеаров периферической крови, трансформированных промоноцитов и Т-клеток. Предполагаемый механизм — связывание сайтов С2 и СЗ вирусного гликопротеина gpl20, необходимого для взаимодействия с СП4+-клетками.
Хромогранин А. Этот белок слюны (76-аминокислотный N- концевой пептид), называемый еще вазостатином-1, проявляет антибактериальную и противогрибковую активность.
Лизоцим — основной белок массой 14,6 кДа, содержащийся во всех основных биологических жидкостях. В высоких концентрациях он присутствует в слюне, слезной жидкости, носовом и бронхиальном секретах. В слюну лизоцим поступает из слюнных желез и десневой борозды. У него несколько механизмов бактерицидного действия. Функционируя как мурамидаза, лизоцим разрывает связь между N-ацетилмурамовой кислотой и N-ацетилглюкозамином пептидогликана бактериальной клеточной стенки, способствуя развитию осмотического шока и гибели клетки. Он может также вызывать лизис, активируя аутолизины клеточной стенки. Показано также, что лизоцим проявляет бактерицидную активность без лизиса. Вместе с тем in vitro к лизоциму чувствительны немногие комменсальные бактерии полости рта, за исключением условий, когда pH более 10,5 или при добавлении солей, детергентов. Следовательно, in vivo бактериолиз может происходить только при колебаниях pH и ионной силы раствора, как, например, в зубной бляшке. Помимо бактерицидного действия и бактериолиза, лизоцим может эффективно агрегировать микроорганизмы и подавлять их адгезию к поверхности зубов и слизистой оболочки. В условиях in vitro показан синергизм действия лизоцима и других неспецифических факторов защиты (лактоферрина, пероксидазной системы слюны), а также slgA.
Пероксидазы. Во многих, если не во всех, секретах макроорганизма присутствуют пероксидазы. Пероксидазная активность слюны складывается из активности пероксидаз, образованных в слюнных железах, миелопероксидаз нейтрофилов и пероксидаз эозинофилов, поступающих из десневой борозды. Пероксидазы слюны катализируют переокисление тиоцианата (SCN ) и галоидов (Вr- и I-) Н2О2 с образованием, помимо прочих продуктов, гипотиоцианита (OSCNT). Ион SCNT- — нормальный компонент проточной или цельной слюны, жидкости десневой борозды или зубной бляшки, а Н2О2 образуется при аэробном метаболизме глюкозы у некоторых комменсальных бактерий ротовой полости. Окисляя ферменты гликолитического пути, содержащие чувствительные тиоловые группы, OSCNT может подавлять рост и выработку кислоты различными бактериями ротовой полости, включая стрептококки, лактобактерии и грибы. В кислой среде ион SCN переходит в незаряженную форму — HOSCN, которая быстро проходит через клеточную стенку, цитомембрану и поступает в цитозоль. В клетке нарушается важный для гликолиза баланс НАДН-НАДФН посредством пентозного шунта или с участием НАД-зависимой глицеральдегид-3- фосфатдегидрогеназы. Могут повреждаться также белки клеточной мембраны или цитозоля. Н2О2 очень токсична для эукариотических клеток, поэтому ее восстановление содержащейся в слюне пероксидазой до Н2О важно для защиты слизистой оболочки. Этот фермент сохраняет активность после адсорбции на гидроксиапатите и может функционировать в связке «эмаль-бляшка». Вместе с тем в его контакте с бактериями нет необходимости, поскольку OSCNT легко диффундирует. Имеются доказательства синергического взаимодействия пероксидазы слюны с лизоцимом, лактоферрином и slgA.
Лактоферрин
Этот многофункциональный железосодержащий белок (массой 78 кДа) синтезируют эпителиоциты желез и нейтрофилы. Его обнаруживают в слюне и большинстве секретов, омывающих слизистые оболочки организма. Лактоферрин существует в трех формах: железистого лактоферрина (занят 1 из 2 сайтов связывания железа), насыщенного лактоферрина (заняты оба сайта) и в форме, свободной от ионов железа (аполактоферрин). Для правильного связывания железа требуется участие бикарбоната. Ввиду того что лактоферрин замедляет рост бактерий и грибов in vitro, возможно, он играет роль в защите слизистой оболочки хозяина. Антибактериальные свойства двух гликопротеинов — лактоферрина секретов и трансферрина плазмы — обусловлены их способностью связывать железо, лишая проникшие микроорганизмы этих важных для метаболизма ионов. За счет этого лактоферрин проявляет бактериостатическую активность в отношении широкого круга бактерий и грибов.
Вместе с тем лактоферрин обладает прямым бактерицидным действием на многие микроорганизмы, и, хотя этот эффект зависит от связывания железа, он необратим даже после добавления ионов железа. Лактоферрин тесно связывается с оболочками грамположительных и грамотрицательных бактерий (возможно, нарушая структуру цитомембраны за счет переокисления липидов). Аполактоферрин гидролизуется пепсином с образованием 25-аминокислотного негликозилированного катионного пептида — лактоферрицина, который обладает выраженной антибактериальной активностью в отношении грамположительных и грамотрицательных бактерий, но не связывает железо. Механизм этого действия не ясен, но лактоферрицин может активировать аутолизины клеточной стенки и/или вызывать деполяризацию бактериальных цитомембран. Лактоферрин образует комплекс с slgA, стабилизированных дисульфидными связями, и, вероятно, с slgA и комплементом, что может способствовать антибактериальному эффекту в отношении некоторых бактерий.
Значение slgA для врожденного иммунитета
Антигенсвязывающие домены некоторых slgA слюны кодируются генами зародышевой линии VH или мутантными VH с нейтральной мутацией (как это бывает при индуцированной антигеном селекции). Такие slgA полиреактивны, т.е. взаимодействуют с широким кругом антигенов бактерий и макроорганизмов (аутоантител). Предполагается, что эти полиспецифические антитела защищают слизистую оболочку до развертывания выработки специфических slgA, т.е. выдвигается гипотеза о функционировании на поверхности слизистой оболочки компонентов двух различных систем иммунитета. Одна из них примитивная, состоящая из Т-независимых самообновляющихся В-лимфоцитов (названных В1-клетками), образующая полиреактивные slgA-антитела к антигенам комменсалов, пищевых продуктов и тканей хозяина. Другая — Т-зависимая система вторичных лимфоидных тканей слизистых оболочек, где IgA-продуценты проходят этап соматического гипермутирования и созревания аффинности. В результате такие клетки продуцируют моноспецифические антитела.
Значение субпопуляции γδ-Т-клеток для врожденного иммунитета
В эпителии находится популяция внутриэпителиальных лимфоцитов (ВЭЛ), многие из них несут у8-Т-клеточный рецептор (TCR). γδ-Т-лимфоциты экспрессируют очень ограниченные по разнообразию TCR и способны реагировать на антигены без клональной экспансии.
По-видимому, такие лимфоциты распознают антиген не как пептид, представляемый молекулами МНС, а непосредственно, подобно активным центрам антител. Функции ВЭЛ до конца не выяснены. Вероятно, они включают распознавание антигенов, экспрессируемых инфицированными или стрессированными эпителиоцитами. γδ-Т-лимфоциты могут играть роль в поддержании целостности эпителия путем секреции факторов роста и удаления поврежденных или инфицированных эпителиоцитов.
Секреция жидкости десневой борозды и защитные факторы десневой жидкости
Функция жидкости десневой борозды — промывание ранимой десневой борозды для удаления микроорганизмов, их продуктов и других вредных веществ. Край десны хорошо васкуляризован — он снабжается кровью и со стороны периодонтальной связки, и со стороны слизистой оболочки. Повторяющиеся капиллярные участки состоят из прекапиллярной артериолы, артериальных и венозных капилляров и посткапиллярной венулы. В норме жидкость десневой борозды — тканевый транссудат, поступающий в десневую борозду через межклеточное пространство в зоне соединительного и желобкового эпителия. Воспаление десен ведет к повышению проницаемости этой широкой капиллярной сети, расположенной непосредственно под указанными эпителиальными клетками. Это способствует усилению тока жидкости и изменению ее характера на плазмоподобный воспалительный экссудат с высоким содержанием иммуноглобулинов и клеток воспаления. Показано, что при тяжелом гингивите с верхних передних зубов можно за 15 мин собрать до 40 мкл десневой жидкости, т.е. за 1 сут в рот поступает 2-3 мл десневой жидкости. Учитывая, что концентрации IgG, IgA и IgM в плазме составляют соответственно 10, 3 и 3 мг/мл, это означает поступление в полость рта за 24 ч 20-30 мг IgG и по 6-9 мг IgA и IgM. Однако немногие иммуноглобулины сохраняют при этом функциональную целостность (см. ниже). Помимо источника указанных антител, десневая борозда — главный источник поступления в полость рта лейкоцитов (90% их представлено нейтрофилами, 3% — моноцитами и 2% — лимфоцитами). В смывах со здоровой десневой борозды В-лимфоцитов в 3 раза больше, чем Т-лимфоцитов, а количество нейтрофилов — 105 клеток/мл, что в 3 раза меньше, чем при гингивите. Нейтрофилы сохраняют способность к фагоцитозу и в десневой борозде, и в зубных бляшках.
Жидкость зубной бляшки и защитные факторы, циркулирующие в биопленке
С помощью конфокальной сканирующей лазерной микроскопии установлено, что в норме биопленки бляшек на гладкой поверхности зубов имеют открытую разветвленную структуру с дискретным расположением биомассы. В целом архитектура бляшки — неравномерно распределенные клетки, внеклеточный матрикс и заполненные жидкостью каналы, часть из которых простирается от эмали до слюнной стороны бляшки. Циркулирующая в этих каналах жидкость (так называемая бляшечная жидкость) составляет до 1/3 объема бляшки. Посредством бляшечной жидкости сообщаются слюна, эмаль, цемент, жидкость десневой борозды и соединительный эпителий; в ней проявляются эффекты врожденной и специфической защиты от кариеса и периодонтального заболевания.
Сравнение неорганических и органических компонентов бляшечной жидкости со слюной и десневой жидкостью показывает, что первая не является простой смесью слюны и десневой жидкости. В бляшечной жидкости значительно больше, чем в слюне, общего IgA, IgG, IgM, компонента комплемента СЗ, лактоферрина, лизоцима и пероксидазы. Эти компоненты не только присутствуют в жидкости, но также связаны с биомассой (их можно элюировать кислыми буферами). Однако в исследовании защитных факторов бляшечной жидкости показано, что в течение нескольких дней формирования бляшки они массово разрушаются протеазами бактерий и хозяина.
Дополнительный материал к лекции
Кандидоз слизистой оболочки полости рта (фото, диагностика и лечение)
Герпетический стоматит у детей и взрослых. Лечение и профилактика
Книга "Микробиология, вирусология, иммунология полости рта. Учебник"
Автор: В. Н. Царев

Издание учебника, переработанное и дополненное в связи с изменением образовательной программы по специальности “Стоматология” согласно стандарту ФГОС 3+, включает сведения об основных этапах становления микробиологии, вопросы специальной терминологии. В нем рассмотрены вопросы таксономии, экологии и биологии микробов, населяющих слизистую оболочку полости рта человека, общие принципы взаимоотношений человека с микроорганизмами.
Изложены физико-химическое обоснование эффективности современных методов стерилизации и дезинфекции применительно к нуждам практической стоматологии, принципы антибактериальной и иммуномодулирующей терапии в стоматологии. Подробно представлен материал по иммунологии полости рта. Обновлено и расширено описание возбудителей основных инфекционных заболеваний человека, вызывающих патологические проявления в полости рта. Отдельные главы учебника посвящены вопросам формирования микробной биопленки, развитию кариеса зубов, заболеваний пародонта, слизистой оболочки полости рта и их осложнениям местного и системного характера.
Учебный материал, иллюстрированный таблицами, схемами, фотографиями и дополненный нормативными документами, изложен авторами в оригинальной и простой концепции, которая помогает студентам усвоить основы общей и специальной микробиологии, иммунологии и вирусологии.
Издание предназначено студентам стоматологических факультетов медицинских и фармацевтических вузов.
Содержание книги "Микробиология, вирусология, иммунология полости рта. Учебник" - В. Н. Царев
Раздел 1. Общая микробиология
Часть 1. Введение в микробиологию
Глава 1. Предмет, задачи и история медицинской микробиологии, вирусологии и иммунологии.
1.1. Предмет, задачи и методы медицинской микробиологии
1.2. Открытие и первые исследования мира микробов
1.3. Предмет, задачи и методы медицинской вирусологии
1.4. Предмет, задачи, методы и история медицинской иммунологии
1.5. Вклад отечественных ученых в микробиологию полости рта
1.6. Важнейшие достижения микробиологии, вирусологии, иммунологии
Глава 2. Общие принципы организации микробной клетки и других инфекционных агентов
2.1. Классификация мира микробов и основные признаки живого
2.2. Прокариотическая, или бактериальная, клетка
2.3. Эукариотическая микробная клетка
2.4. Доклеточные формы инфекционных агентов
Глава 3. Физиология микробов
3.1. Метаболизм бактерий
3.2. Ферменты бактерий
3.3. Питание бактерий
3.4. Дыхание у бактерий
3.5. Рост и размножение
Глава 4. Генетика бактерий и вирусов
4.1. Наследственность и геном бактерий
4.2. Основные понятия и термины
4.3. Репликация ДНК и деление бактериальной клетки
4.4. Характеристика основных форм изменчивости
4.5. Фенотипическая изменчивость бактерий. Модификации
4.6. Генотипическая изменчивость. Мутации
4.7. Генетические рекомбинации
4.8. Бактериофаги и их роль в изменчивости бактерий
4.9. Мобильные генетические элементы
Часть 2. Общие вопросы микробиологии и особенности микробиоты полости рта человека
Глава 5. Принципы классификации микробов полости рта
5.1. Морфологический принцип
5.2. Биохимический принцип
5.3. Молекулярно-генетический принцип
Глава 6. Характеристика облигатно-анаэробной микробиоты полости рта: таксономия, экология, роль в патологии челюстно-лицевой области
6.1. Грамотрицательные (споронеобразующие) анаэробные бактерии
6.2. Грамположительные споронеобразующие анаэробные бактерии
6.3. Грамположительные спорообразующие анаэробные бактерии
Глава 7. Характеристика факультативно-анаэробной и аэробной микробиоты полости рта: таксономия, экология, роль в патологии челюстно-лицевой области
7.1. Грамположительные факультативно-анаэробные и аэробные бактерии
7.2. Грамотрицательные факультативно-анаэробные и аэробные бактерии
Глава 8. Характеристика эукариотических микробов полости рта: таксономия, экология, роль в патологии челюстно-лицевой области
8.1. Грибы
8.2. Простейшие
Глава 9. Микроэкология полости рта
9.1. Полость рта — экологическая ниша для сообщества микробов
9.2. Основные биотопы полости рта и методы их исследования
9.3. Факторы, способствующие колонизации полости рта микроорганизмами
9.4. Факторы, препятствующие колонизации полости рта микробами
9.5. Формирование микробиоты полости рта в процессе жизни
Глава 10. Микробиоценоз и учение о биопленках
10.1. Пространственно-временная модель формирования микробиоценоза полости рта
10.2. Формирование зубной бляшки
10.3. Особенности зубной бляшки при патологии
10.4. Формирование зубного камня
10.5. Механизмы кворум-сенсинга между микроорганизмами в биопленке полости рта
Глава 11. Принцип деконтаминации в стоматологии
11.1. Принцип деконтаминации в стоматологии
11.2. Физико-химические основы деконтаминации
11.3. Молекулярные основы воздействия на грамположительные и грамотрицательные бактерии
11.4. Физические факторы деконтаминации
11.5. Химические факторы деконтаминации
11.6. Асептика и антисептика
11.7. Основные методы и реагенты, применяемые для дезинфекции и стерилизации
11.8. Предстерилизационная обработка
11.9. Современные методы стерилизации
Заключение
Тестовые задания
Часть 3. Иммунология и иммунные явления в полости рта.
Глава 12. Основы инфекционной иммунологии
12.1. Роль воспаления в развитии иммунного ответа
12.2. Фагоцитоз
12.3. Факторы врожденного иммунитета
12.4. Антигены
12.5. Иммунный ответ и иммунная реактивность
12.6. Иммунная система человека
12.7. Кооперация клеток в процессе иммунного ответа
Глава 13. Местный иммунитет полости рта и микробиота биопленок
13.1. Понятие о местном иммунитете полости рта
13.2. Факторы врожденного иммунитета
13.3. Клеточные и молекулярные факторы адаптивного иммунитета полости рта
13.4. Иммунное регулирование резидентной микробиоты полости рта
Заключение
Тестовые задания
Часть 4. Методы микробиологического исследования, применяемые в стоматологии
Глава 14. Общие правила и нормативы микробиологического исследования различных биотопов полости рта
14.1. Правила и нормативы микробиологического исследования
14.2. Получение исследуемого материала из полости рта
Глава 15. Микроскопический метод исследования
15.1. Фазово-контрастная, или темнопольная, микроскопия
15.2. Световая иммерсионная микроскопия
15.3. Иммунофлуоресцентная микроскопия
15.4. Сканирующая микроскопия
Глава 16. Бактериологический (культуральный) метод исследования с применением техники анаэробного культивирования
16.1. Основные этапы бактериологического исследования
16.2. Принципы исследования микробиоты полости рта
16.3. Особенности идентификации клинически значимых групп микрофлоры полости рта
Глава 17. Молекулярно-биологический метод
17.1. Принципы индикации и идентификации микробов молекулярно-биологическим методом
17.2. Выделение бактериальной ДНК из клинического материала
17.3. Полимеразная цепная реакция
17.4. Гибридизация ДНК
17.5. Клонирование и секвенирование гена 16S рибосомной РНК
Глава 18. Прочие методы лабораторного и экспериментального исследований
18.1. Иммуноферментное определение антител
18.2. Основные методы оценки иммунного статуса пациента
18.3. Экспериментальные методы изучения адгезии микробов к стоматологическим материалам
Часть 5. Принципы антибактериальной и иммуномодулирующей терапии в стоматологии
Глава 19. Антибактериальные препараты и проблема устойчивости (резистентности) микробиоты
19.1. Антибиотики и антибактериальная терапия.
19.2. Классификация антибиотиков
19.3. Принятие решения о назначении антибиотика
19.4. Принципы применения антибиотиков
19.5. Антибиотикорезистентность бактериальных штаммов и ее преодоление
19.6. Способы определения чувствительности бактериальных культур к антибиотикам
19.7. Стратегия предотвращения развития резистентности и распространения резистентных штаммов
Глава 20. Принципы антибактериальной профилактики и терапии в стоматологии
20.1. Основные показания к проведению антибактериальной химиотерапии при стоматологических заболеваниях
20.2. Выбор антибактериального препарата
20.3. Клиническое применение антибиотиков
20.4. Применение антибиотиков для лечения инфекций
20.5. Противогрибковые антибиотики и химиопрепараты (антимикотики)
20.6. Ступенчатая антибактериальная терапия
20.7. Комбинированная антибиотикотерапия
20.8. Оценка эффективности антибактериальной терапии
20.9. Побочные действия антибактериальных препаратов
Глава 21. Принципы иммуномодулирующей терапии в стоматологии.
21.1. Иммунодефицитные состояния в стоматологической практике
21.2. Иммунотропная терапия в стоматологической практике
21.3. Местное применение иммуномодуляторов в стоматологической практике
Раздел 2. Клиническая микробиология полости рта
Часть 6. Микробиота и иммунные процессы при кариесе зубов
Глава 22. Характеристика бактериальных факторов кариесогенности и кариесорезистентности
22.1. Кариесогенная микрофлора
22.2. Кариеслимитирующая микрофлора
22.3. Локализация кариозного процесса зубов
22.4. Клинические аспекты кариеса зубов. Эндодонтическое лечение
22.5. Молекулярная биология кариеса зубов
Глава 23. Биопленка зубной поверхности и патогенез кариеса зубов
23.1. Особенности биопленки зубной поверхности
23.2. Адгезия и колонизация S. mutans
23.3. Стрессовые ответы микробов в биопленке и их роль в патогенезе кариеса
23.4. Геномика бактерий полости рта и достижения в изучении кариеса зубов
Глава 24. Экспериментальные модели развития кариеса зубов
24.1. Модели кариеса на грызунах
24.2. Перспективы моделирования кариеса
Глава 25. Иммунология кариеса зубов и перспективы создания вакцины
25.1. Секреторные иммуноглобулины — доминирующие иммуноглобулины слюны
25.2. Проблема выбора потенциальных антигенов для создания вакцины и систем их доставки
25.3. Проблема перекрестно реагирующих антител
25.4. Перспективы создания вакцины против кариеса
Часть 7. Микробиота и иммунные процессы при заболеваниях пародонта
Глава 26. Характеристика пародонтопатогенной микробиоты
26.1. Porphyromonas gingivalis (десневая порфиромонада)
26.2. Aggregatibacter actinomycetemcomitans (по старой номенклатуре — Actinobacillus actinomycetemcomitans)
26.3. Tannerella forsythia (по старой номенклатуре — Bacteroides forsythus)
26.4. Treponema denticola (трепонема зубная)
26.5. Prevotella intermedia (превотелла средняя)
26.6. Eikenella сorrodens (эйкенелла разъедающая)
26.7. Fusobacterium nucleatum (веретенообразная палочка)
26.8. Filifactor alocis (нитепродуцент десневой)
Глава 27. Этиология и патогенез гингивита
Глава 28. Этиология и патогенез пародонтита
Глава 29. Иммунные явления при заболеваниях пародонта
29.1. Вирулентные свойства бактерий и их способность уклоняться от иммунной защиты
29.2. Роль отдельных факторов иммунной защиты: нейтрофилы и антитела
29.3. Несостоятельность факторов защиты десневой борозды
29.4. Несостоятельность факторов доиммунной защиты (врожденного иммунитета)
29.5. Несостоятельность факторов приобретенного иммунитета
29.6. Th1-зависимая выработка антител при агрессивном пародонтите
29.7. Роль клеток иммунной системы в резорбции кости
Глава 30. Использование лабораторных животных для изучения патогенеза пародонтита
30.1. Модели на приматах и грызунах
30.2. Модели на мышах
30.3. Модели на крысах
Глава 31. Значение генетических факторов восприимчивости к инфекциям пародонта.
31.1. Роль генетической предрасположенности к инфекции
31.2. Современные представления о генетических факторах риска разрушения тканей пародонта
Заключение
Тестовые задания
Часть 8. Микробиота и иммунные процессы при одонтогенной инфекции
Глава 32. Характеристика возбудителей инфекции пульпы и корневых каналов зуба
32.1. Возбудители инфекции пульпы и корневых каналов зуба
32.2. Патогенез инфекции пульпы и корневых каналов зуба
32.3. Стратегия лечения инфекции пульпы и корневых каналов зуба
Глава 33. Этиология и патогенез одонтогенной инфекции
33.1. Возбудители одонтогенной инфекции
33.2. Патогенез одонтогенной инфекции
33.3. Состав микрофлоры одонтогенных очагов
33.4. Варианты иммунной реактивности пациентов и иммунобактериологические параллели в развитии одонтогенной инфекции
33.5. Современный взгляд на этиологию актиномикоза
33.6. Микробиота при неодонтогенных процессах и травмах челюстно-лицевой области
Глава 34. Микробиота полости рта как этиологический фактор при системных заболеваниях организма
34.1. Значение хронических очагов инфекции в полости рта в развитии общей соматической патологии
34.2. Роль микробиоты полости рта в развитии инфекционного эндокардита
34.3. Синдром диссеминированного внутрисосудистого свертывания крови
34.4. Иммунокомплексные синдромы
34.5. Аутоиммунные синдромы
34.6. Стоматогенное воспаление и развитие атеросклероза
Заключение
Тестовые задания
Часть 9. Микробиота и иммунные процессы при заболеваниях слизистой оболочки полости рта
Глава 35. Заболевания бактериальной этиологии с поражением слизистой оболочки полости рта
35.1. Стоматиты
35.2. Гонорея
35.3. Дифтерия
35.4. Листериоз
35.5. Скарлатина
35.6. Сифилис
35.7. Невенерические трепонематозы
35.8. Боррелиозы (возвратные тифы и лихорадки)
35.9. Лептоспирозы (род Leptospira)
35.10. Туберкулез
35.11. Лепра (проказа)
35.12. Пиодермия
35.13. Риккетсиозные инфекции
35.14. Лихорадка Ку
35.15. Хламидийные инфекции
Глава 36. Заболевания грибковой этиологии с поражением слизистой оболочки полости рта
36.1. Кандидоз слизистой оболочки полости рта
36.2. Candida-ассоциированный пародонтит
36.3. Другие системные микозы с проявлениями в полости рта
Глава 37. Заболевания вирусной этиологии с поражением слизистой оболочки полости рта
37.1. Герпес-вирусные инфекции
37.2. Энтеровирусная инфекция
37.3. Корь
37.4. Папилломавирусная инфекция
37.5. Проявления ВИЧ-инфекции в полости рта
37.6. Ящур
Заключение
Тестовые задания
Приложения
Приложение 1. Перечень нормативно-правовых актов и документов, использованных при составлении учебника
Приложение 2. Порядок ликвидации аварии, связанной с проливом или разбрызгиванием крови (биологических жидкостей)
Приложение 3. Состав аптечки экстренной помощи («Анти-СПИД»)
Приложение 4. Перечень дезинфекционных средств, рекомендуемых к применению в стоматологических учреждениях
Предисловие к книги "Микробиология, вирусология, иммунология полости рта. Учебник" - В. Н. Царев
Микробиология полости рта — это раздел медицинской микробиологии, включающий закономерности функционирования бактериального сообщества полости рта и организма человека во всем многообразии их взаимодействия между собой и внешним миром микробов. В последние годы изучению так называемой нормальной (резидентной) микробиоты (по-старому — микрофлоры) посвящается все больше и больше исследований.
Микробиота полости рта — совокупность разнообразных микроскопически малых живых существ, способных вступать в симбионтные отношения между собой и человеком как биологическим видом.
Микробиота полости рта крайне разнообразна и сложна для изучения. И чем больше мы познаем этот мир, тем больше вопросов возникает у исследователей. Несомненное преобладание представителей бактерий с анаэробным типом дыхания в составе бактериального сообщества полости рта требует специальных условий для культивирования и идентификации этих микроорганизмов, что существенно осложняет диагностику вызываемых ими заболеваний. Не менее сложны и многогранны механизмы неспецифической и иммунной защиты, контролирующие процессы бактериальной колонизации, формирование биопленок и т.п.
Все это определяет необходимость изучения студентами стоматологических факультетов медицинских вузов такого важного раздела, как микробиология, вирусология и иммунология полости рта, что послужило основанием для выделения микробиологии полости рта как отдельной учебной дисциплины.
В настоящем учебнике, который представляет собой первое в отечественной практике издание такого рода, изложен материал по микробиологическим аспектам отдельных направлений стоматологии: терапевтической стоматологии, пародонтологии и эндодонтии, хирургической и ортопедической стоматологии, что позволит использовать его для модульного обучения студентов на соответствующих кафедрах стоматологических факультетов медицинских вузов.
Большое внимание в соответствующих разделах учебника уделено особенностям физиологических защитных механизмов и иммунных явлений в полости рта, и особенно — основным принципам антибактериальной и иммуномодулирующей химиотерапии, которым не уделяется достаточного внимания в традиционных учебниках для медицинских вузов.
Авторы настоящего издания стремились обобщить основные сведения о микробиоте полости рта в норме и при патологии, используя как собственный опыт, накопленный на кафедре микробиологии, вирусологии, иммунологии Московского государственного медико-стоматологического университета им. А.И. Евдокимова, так и опыт одноименных кафедр Первого Московского государственного медицинского университета им. И.М. Сеченова (Сеченовского Университета), Омского государственного медицинского университета, Ставропольского государственного медицинского университета, Ростовского государственного медицинского университета, Тверского государственного медицинского университета, Северо-Осетинской государственной медицинской академии, других вузов России, данные современной иностранной литературы.
Все замечания и пожелания в отношении структуры и содержания учебника по микробиологии и вирусологии полости рта, характеру изложения материала и иллюстрациям будут с благодарностью приняты авторами.
В. Н. Царев, доктор медицинских наук, профессор, заслуженный работник высшей школы РФ
Купить книгу медицинскую литературу по заболевания слизистой полости рта в интернет-магазине медицинской книги shopdon.ru









































































0 комментариев