Лонг-ковид: что такое лонг-ковид и как с ним бороться? Часть 1. Лекция для врачей
Лекция для врачей "Лонг-ковид: что такое лонг-ковид и как с ним бороться?". Лекцию для врачей проводят Горелов Александр Васильевич член-корреспондент РАН, д м.н., профессор, заместитель директора по научной работе ФБУН «Центральный НИИ эпидемиологии» Роспотребнадзора, Малявин Андрей Георгиевич д.м.н., профессор, главный внештатный специалист-пульмонолог М3 РФ по ЦФО, профессор кафедры фтизиатрии и пульмонологии ЛФ МГМСУ им. А.И. Евдокимова
Поражение дыхательной системы при LONG-COVID инфекции. Часть 2
Поражение сердечно-сосудистой системы при Long-COVID инфекции. Часть 3
Поражение эндокринной системы при Long-COVID инфекции. Часть 4
Поражение почек при Long-COVID. Часть 5
Ревматизм. Long-COVID инфекции. Часть 6
Неврологические заболевания. Long-COVID инфекции. Часть 7
Психиатрия. Long-COVID инфекции. Часть 8
Детский мультисистемный воспалительный синдром, ассоциированный с COVID-19. Часть 9
Мультисистемный воспалительный синдром у взрослых, ассоциированный с COVID-19. Часть 10
Медицинская реабилитация при Long-COVID инфекции Часть 11
Методические рекомендации. «Особенности течения LONG-COVID инфекции. Терапевтические и реабилитационные мероприятия». Часть 1
Авторы:
Российское научное медицинское общество терапевтов
Национальное научное общество инфекционистов
Союз реабилитологов России
Главный редактор:
Мартынов А.И., академик РАН, профессор, Президент РНМОТ
Заместители главного редактора:
Горелов А.В., член-корреспондент РАН, профессор, Президент ННОИ
Малявин А.Г., профессор, Генеральный секретарь РНМОТ
Термин «долгий COVID» (Long COVID) был введен пациентами и закрепился в традиционных СМИ и социальных сетях. Elisa Perego из Ломбардии весной 2020 г. была первой, кто использовал термин LongCovid в Твиттере для описания своей длительной болезни, резюмируя свои собственные симптомы. В июне 2020 г. этот термин перешел из социальных сетей в печать, после того, как доктор Jake Suett присоединился к группе поддержки пациентов.
В октябре 2020 года была предложена Классификация Национального Института Здоровья Великобритании (National Institute for Health and Care Excellence - NICE, в соглашении с Scottish Intercollegiate Guidelines Network и The Royal College of General Practitioners 30 октября 2020) (COVID-19 rapid guideline: managing the long-term effects of COVID-19 NICE guideline [NG188]Published date:18 December 2020; https://www.nice.org.uk/guidance/ng188):
- острый COVID-19 (до 4-х недель от начала заболевания);
- продолжающийся симптоматический COVID-19 (от 4 до 12 недель);
- постковидный синдром (свыше 12 недель, не объясним альтернативным диагнозом, меняется со временем, рецидивирует, затрагивает различные органы и системы).
Довольно скоро были внесены дополнения в Международный классификатор болезней, травм и причин смерти МКБ-10:
Постковидный синдром — возникает у лиц после коронавирусной инфекции с подтвержденным заражением SARS-CoV-2, либо у лиц с подозрением на коронавирусную инфекцию, обычно через 3 месяца после начала COVID-19, с симптомами, которые длятся не менее 2 месяцев и не могут быть объяснены альтернативным диагнозом (ВОЗ, 06.10.2021 г. https://www.who.int/publications/i/item/WHO-2019-nCoV-Post_COVID- 19_condition-Clinical_case_definition-2021.1).
Термин «долгий ковид» («Long Covid») включает период симптоматики от 4-х недель и более (нередко используется как синоним постковидного синдрома или 2-го и 3-го вариантов течения COVID-19 по классификации NICE, 2020). Некоторые исследователи разделяют постковидный синдром и лонг-ковид, считая первый осложнениями излеченного COVID-19, а второй - хронической персистенцией вируса в организме.
Преложены новые коды МКБ-10 (не для кодирования причины смерти и в России пока не рекомендованы МЗ РФ для применения)
U08.9 — личный анамнез COVID-19 неуточненный. Этот дополнительный код используется для записи более раннего эпизода COVID-19 подтвержденного или вероятного, который влияет на состояние здоровья человека.
U09.9 — состояние после COVID-19. Постковидный синдром. Этот код позволяет установить связь с COVID-19. Его нельзя использовать в случаях, когда COVID-19 все еще присутствует
U10.9 - код для мультисистемного воспалительного синдрома у взрослых, связанного с COVID-19, детского воспалительного мультисистемного синдрома (PIMS) с COVID-19, а также синдрома Кавасаки, ассоциированного во времени с COVID-19.
До настоящего момента неясно, в каких случаях длительное течение инфекции связано с неполноценной элиминацией и возможной персистенцией вируса в организме пациента, а в каких случаях это связано с особенностями протекания воспалительного процесса. По крайней мере уже сейчас известна особенность протекания воспалительного процесса, связанная с большой длительность экссудативной фазы, достигающей максимума к концу 2 недели заболевания.
Таким образом, сложилась ситуация, когда врачи разных специальностей сталкиваются с клиническими проявлениями длительного течения инфекции и до настоящего времени не обеспечены методическими подходами к ведению таких пациентов. Дополнительная сложность связана с тем, что по понятным причинам еще не проведены полноценные клинические исследования, однозначно свидетельствующие об эффективности тех или иных лечебных подходов. Поэтому в условиях реальной клинической практики в настоящее время превалирует симптоматический или синдромно-патогенетический подход с опорой на имеющиеся данные об эффективности лечебных воздействий, используемых при сходных симптомах в терапии других нозологий. По мере накопления научных данных во многих случаях такой подход может обрести полноценную доказательную базу. По инициативе Российского научного медицинского общества терапевтов в содружестве с Национальным научным обществом инфекционистов и Союзом реабилитологов России предпринята попытка обобщить имеющийся материал и представить его в виде методических рекомендаций.
Особенности инфекционного процесса при LONG-COVID инфекции
Лонг-ковид и постковидный синдром: определения
До настоящего времени мировое научное сообщество так и не выработало единых подходов к определению терминов «лонг-ковид» и «постковидный синдром», хотя эти понятия появились более года назад, спустя несколько месяцев после начала пандемии. ВОЗ также пока находится на этапе представления протокола, который разработан для продвижения в вопросах, касающихся формулировки определения постковидного синдрома. Но поток пациентов, обращающихся с долговременными последствиями COVID-19 к разным специалистам становится все больше, и российское медицинское сообщество нуждается хотя бы во временных, но четких определениях терминов, а также рекомендациях по ведению этих пациентов.
Согласно многим публикациям, под термином «лонг-ковид» принято считать клинические проявления заболевания, длящиеся более 4-х, но менее 12 недель с начала болезни, а хронический ковид или «постковидный синдром» - как период, выходящий за рамки 12 недель с момента развития заболевания (Рис.1).
Многие исследователи склонны считать, что положительный тест на COVID-19 (в качестве лабораторного подтверждения диагноза) не является обязательным условием для постановки «лонг-ковида» и постковидного синдрома, так как нередко встречаются ложноотрицательные результаты.
Предполагается, что вирус, отвечающий за репликацию, исчезает максимум через месяц после возникновения симптомов, оставляя после себя долговременные последствия. Тем не менее, сейчас многие исследования сосредоточены на поиске резервуаров вируса, в которых предположительно вирус может сохраняться в течение длительного времени. Это не означает, что вирус в резервуаре обязательно способен к репликации, но длительное сохранение мРНК или ее фрагментов в клетках организма человека может способствовать развитию хронического воспалительного процесса и дисрегуляции иммунной системы. В частности, даже через несколько месяцев после заражения в биоптатах кишечника людей, перенесших COVID-19, обнаружена мРНК вируса SARS-CoV-2, а также вирусный белок, на который может реагировать иммунная система.
Тем не менее, в настоящее время использование противовирусных препаратов не рекомендовано для больных с лонг-ковидом и постковидным синдромом. Исключение могут представлять лишь пациенты, у на протяжении нескольких месяцев сохраняется положительный результат ПЦР на SARS-CoV-2 в назофарингеальных мазках. Как правило, это пациенты с онкологической патологией, заболеваниями системы крови, ВИЧ-инфекцией.
У этой группы пациентов может быть эффективным использование иммунотерапии для достижения клиренса вируса, а противовирусная терапия не приносит ожидаемого эффекта.
Патофизиологические процессы, лежащие в основе лонг-ковида и постковидного синдрома.
Выделяют несколько механизмов, оказывающих влияние на развитие лонг-ковида и пост-ковидного синдрома: иммунная дисрегуляция и аутоиммунные механизмы, синдром системного воспалительного ответа, нарушение гемостаза и васкулопатия; прямое цитотоксическое действие вируса на клетки и длительная вирусная персистенция; вегетативная, нервная, эндокринная и метаболическая дисфункция; дисбаланс в функционировании пептидов, образующихся в результате действия ACE1 и ACE2 рецепторов, а также последствия состояния пациента, находившегося в критическом состоянии.
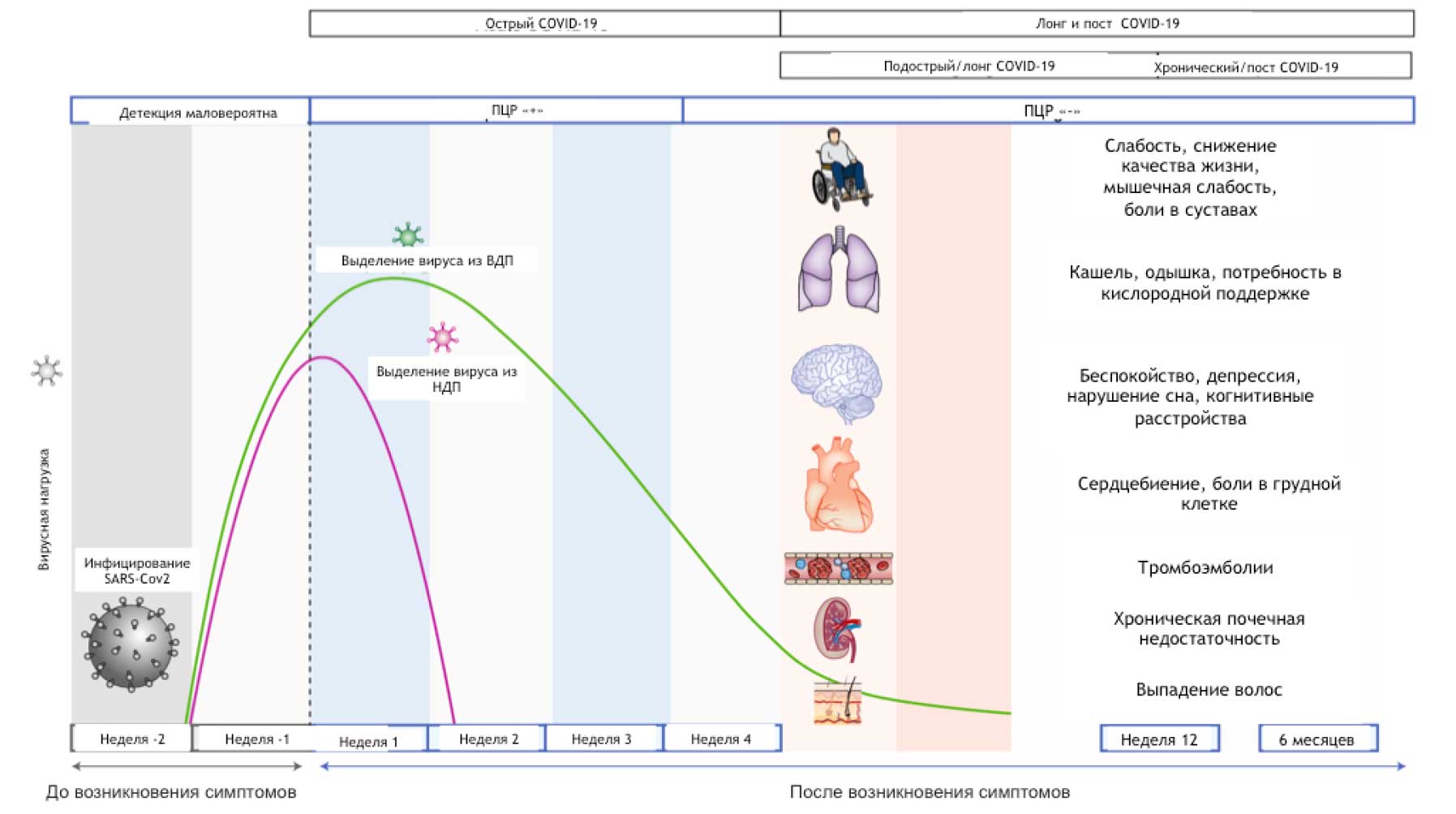
Рис.1. Временная шкала COVID-19, лонг-ковида и постковидного синдрома (Источник: Nalbandian A, Sehgal K, Gupta A, Madhavan MV, McGroder C, Stevens JS, Cook JR, Nordvig AS, Shalev D, Sehrawat TS, Ahluwalia N. Post-acute COVID-19 syndrome. Nature medicine. 2021 Apr;27(4):601-15)
Совокупное и в разной степени выраженное влияние этих механизмов и приводит к разнообразным клиническим проявлениям, отмечающимся у пациентов после перенесенного COVID-19.
• Патофизиология синдрома, связанного с последствиями состояния пациента, нуждавшегося в интенсивной терапии, является многофакторной и включает повреждение сосудов микроциркуляторного русла, метаболические изменения, связанные с критическим состоянием и неподвижностью. Кроме этого, выжившие после СОУЮ-19, могут подвергаться повышенному риску вторичных инфекций, вызванных бактериальными, грибковыми (аспергиллез легких) или другими патогенами.
- Повреждение респираторного тракта обусловлено вирусозависимыми (включая поражение вирусом SARS-CoV-2 клеток альвеолярного эпителия и эндотелиальных клеток) и вирусо-независимые механизмами (такими как иммунологическое повреждение, включая периваскулярное воспаление), которые совместно способствуют разрушению эндотелиальноэпителиального барьера и экстравазации богатого белками экссудата в альвеолярное пространство.
- Механизмы, обусловливающие сердечно-сосудистые осложнения при лонг-ковиде и постковидном синдроме, включают прямое воздействие вируса на клетки, снижение уровня активных АСЕ2 рецепторов, воспаление и иммунологический ответ, влияющий на структурную целостность миокарда, перикарда и проводящей системы сердца, гибель кардиомиоцитов и фиброзножировые замещение десмосомных белков, играющих важную роль в межклеточном сцеплении.
- Механизмы, способствующие развитию патологии нервной системы при COVID-19, могут быть также объяснены непосредственным воздействием вируса и нейровоспалением, тяжелым системным воспалением, микрососудистым тромбозом и нейродегенерацией. Пока нет убедительных доказательств инфицирования нейронов SARS-CoV-2. Однако SARS-CoV-2 может вызывать изменения в паренхиме головного мозга и сосудах, возможно, воздействуя через гематоэнцефалический барьер и вызывая воспаление в нейронах, васкуляризирующихся сосудами головного мозга.
- Эндокринные проявления после перенесенного COVID-19 могут быть последствиями прямого повреждения вирусом SARS-CoV-2, дисрегуляции иммунной системы и воспаления, а также ятрогенных осложнений. Ранее существовавший диабет может впервые манифестировать во время острой фазы COVID-19 и, как правило, лечится безинсулиновыми препаратами, даже если изначально развивался диабетический кетоацидоз. Нет конкретных доказательств длительного повреждения 0-клеток поджелудочной железы при COVID-19.
- Патология почек. SARS-CoV-2 был выделен из почечной ткани, и острый некроз канальцев является основной находкой, отмеченной при биопсиях почки. COVID-19-ассоциированная нефропатия характеризуется коллапсирующим вариантом очагового сегментарного гломерулосклероза с инволюцией клубочкового аппарата в дополнение к острому повреждению канальцев и, как полагают, развивается в ответ на активацию интерферона и хемокинов. Ассоциация с аллелями риска APOL1 предполагает, что SARS- CoV-2 действует как триггер у предрасположенных к этой патологии пациентов [2]. Тромбы в сосудах микроциркуляторного русла почек также могут потенциально способствовать развитию их повреждения.
- Патология желудочно-кишечного тракта. COVID-19 обладает потенциалом для воздействия на микробиом кишечника, включая обогащение условно-патогенными микроорганизмами и истощение полезных комменсалов. Способность микробиоты кишечника изменять течение респираторных инфекций (ось кишечник-легкие) была признана ранее при гриппе и других респираторных инфекциях. В настоящее время проводятся исследования по оценке долгосрочных последствий COVID-19 для желудочно-кишечного тракта, включая синдром раздраженного кишечника и диспепсию.
- Мультисистемный воспалительный синдром. Заболеваемость COVID-19 в эпицентрах весной 2020 года и выявление с интервалом после весеннего пика примерно через месяц проявлений мультисистемного воспалительного синдрома у пациентов с уже отрицательным результатом ПЦР, но положительными тестами на антитела, позволяют предполагать, что он является результатом искаженной реакциии приобретенного иммунитета, а не острой вирусной инфекции.
Диффузное повреждение альвеол с последующей организацией и очаговым фибропролиферативным диффузным поражением ткани легких наблюдается в поздние сроки COVID-19. Нередко отмечаются очаги пролиферации миофибробластов и фиброзно-кистозного перерождения легких. Этот процесс может быть спровоцирован провоспалительными цитокинами - интерлейкином-6 (IL-6) и трансформирующим фактором роста-β (ТСЕ-β) и в дальнейшем предрасполагать к бактериальной колонизации и последующей вторичной инфекции. Свой вклад в поражение легких при лонг-ковиде и постковидном синдроме вносят также последствия микротромбоза и макротромбоза легочных сосудов, эндотелиальная дисфункция и тромботическая микроангиопатия, наблюдающиеся у 20-30% пациентов с COVID-19 на фоне гипоксии, гипервоспаления и гиперкоагуляции, активации комплемента, тромбоцитов, взаимодействия тромбоцитов с лейкоцитами, высвобождения провоспалительных цитокинов. Риск тромботических осложнений в период лонг-ковида и постковидного синдрома вероятно обусловлен продолжительностью и тяжестью гипервоспалительного состояния.
Выздоровевшие пациенты могут испытывать устойчиво повышенную потребность в препаратах, улучшающих метаболизм миокарда. Это может быть связано со снижением сердечного резерва, применением кортикостероидов и нарушением регуляции ренин-ангиотензин-альдостероновой системы (РААС). Фиброз или рубцевание миокарда и возникающая в результате этого кардиомиопатия могут привести к суправентрикулярной тахиаритмии.
COVID-19 может также способствовать развитию аритмии из-за повышенного катехоламинергического состояния, связанного с провоспалительными цитокинами IL-6, IL-1 и фактором некроза опухоли-а, которые могут продлевать потенциалы действия желудочков путем модуляции экспрессии ионных каналов кардиомиоцитов. Кроме этого, любая вирусная инфекция сама по себе приводит к синдрому постуральной ортостатической тахикардии и синусовой тахикардии в результате адренергической модуляции.
Кроме того, уровни иммунной активации напрямую коррелируют с когнитивно-поведенческими изменениями. Хроническое вялотекущее воспаление головного мозга наряду со сниженной способностью реагировать на новые антигены и накоплением Т-клеток памяти (признаки иммуносенсибилизации при старении и повреждении тканей), может играть роль в развитии стойких симптомов COVID-19. Другие предполагаемые механизмы включают дисфункциональный лимфодренаж из периваскулярного пространства, а также проникновение вирусов во внеклеточные пространства обонятельного эпителия, их пассивную диффузию и аксональный транспорт через обонятельный тракт.
Биомаркеры повреждения головного мозга, такие как повышенные уровни легкой цепи нейрофиламентов в периферической крови, были обнаружены у пациентов с COVID-19 с более тяжелой и длительной инфекцией, что предполагает возможность хронического повреждения нейронов.
Пост-ковидный «мозговой туман» у тяжелобольных пациентов с COVID-19 может быть связан с декондиционированием или посттравматическим стрессовом расстройством. Однако сообщения о «мозговом тумане» после легкой формы болезни предполагают, что дисфункция вегетативной нервной системы также может влиять на его развитие. Следует отметить, что долгосрочные когнитивные нарушения после перенесенного критического состояния встречаются у 20-40% пациентов.
Есть данные, что экспрессия ACE2 и трансмембранной сериновой протеазы (TMPRSS2), участвующей в проникновении SARS-CoV-2 в клетки на β-клетках и первичный дефицит инсулина, вероятно, наряду с резистентностью к инсулину, опосредованы такими факторами, как воспаление или реакция на инфекционный стресс. До сих пор нет доказательств того, что диабет, связанный с COVID-19, может регрессировать после острого COVID-19, а также того, что его течение при лонг-ковиде и постковидном синдроме чем-то отличается от течения диабета у больных, не болевших COVID-19.
COVID-19 также повышает риски деминерализации костей, связанные с системным воспалением, иммобилизацией, воздействием кортикостероидов, недостаточностью витамина D и прекращением приема антирезорбтивных или анаболических средств при остеопорозе в острый период болезни.
Понимание патофизиологии мультисистемного воспалительного синдрома может быть частично получено из патогенеза развития болезни Кавасаки и синдрома токсического шока, с возможными механизмами повреждения, связанными с иммунными комплексами, активацией комплемента, образованием аутоантител и массивным высвобождением цитокинов, связанных со стимуляцией суперантигенами Т-клеток.
Таким образом, патологическое воздействие вируса SARS-CoV-2 на организм человека многогранно и отражается на его функционировании даже после перенесенного острого СОУЮ-19. У одних пациентов проявления лонг-ковида и постковидного синдрома практически не выражены, у других, даже перенесших инфекцию в легкой форме, отмечаются долговременные последствия, влияющие на трудоспособность и качество жизни. Подход к лечению лонг-ковида и постковидного синдрома должен включать комплексные методы воздействия на организм, ориентированные на снижение выраженности или устранение органной дисфункции и реабилитационные мероприятия, основанные на понимании патофизиологии этих состояний.
Персистенция вируса и системное воспаление как возможные механизмы патогенеза LONG-COVID инфекции
Длительная персистенция SARS-CoV-2 в организме человека
Длительный период персистенции и выделения описан для целого ряда респираторных вирусов, включая SARS-CoV и MERS-CoV. Для SARS-CoV-2 также с самого начала пандемии описаны случаи персистенции вируса в дыхательных путях, что подтверждалось положительными результатами теста на РНК вируса методом амплификации нуклеиновых кислот. В одном из ранних исследований, проведенных Zhou F. и соавт. (2020), средняя продолжительность выделения вируса составила 20 дней у выживших пациентов, однако у умерших в стационаре больных вирус выделялся вплоть до летального исхода. Максимальный период выделения SARS-CoV-2 составил в этом исследовании 37 дней.
В более поздних исследованиях медиана продолжительности выделения вируса составила 31 день от начала заболевания, при минимальной продолжительности 18 дней, максимальной 48 дней. В работе Carmo А. и соавт. (2020) в группе из 94 пациентов с положительным ПЦР-тестом среднее число дней между первым и последним положительным тестом составило 32.55 ± 9.6. Vibholm L.K. и соавт. (2021) показали, что РНК SARS-CoV-2 может обнаруживаться в мазках со слизистой рото- и носоглотки вплоть до 105 дней после клинического выздоровления. Одновременно у пациентов обнаруживался более высокий уровень активности специфических CD8 T-лимфоцитов, что позволяет предположить продолжающуюся стимуляцию иммунного ответа в условиях персистенции вируса.
Li N. и соавт. (2020) проанализировали данные 22 пациентов с лабораторно подтвержденной коронавирусной инфекцией COVID-19. У всех пациентов отмечалось клиническое выздоровление, положительная динамика по данным КТ органов грудной клетки, отсутствие необходимости в продолжении терапии. Однако, во всех случаях было выявлено длительное, в течение более чем 50 дней после выздоровления, обнаружение РНК SARS-CoV-2 в мазках из верхних дыхательных путей. Средний период выделения вируса составил 76 дней, максимальный - 112 дней. Опубликованы результаты исследований, в которых описаны случаи длительного, вплоть до 4 месяцев, обнаружения SARS-CoV-2 в материале из верхних дыхательных путей в количественном ПЦР-тесте. В исследовании Salmon-Ceron D. и соавт. (2020) ПЦР-тест мазков из носоглотки на SARS-CoV-2 RT-PCR через два месяца после начала заболевания был положительным у 11 из 43 пациентов и у трех пациентов оставался положительным через 3 месяца от начала заболевания.
Хотя SARS-CoV-2 преимущественно передается воздушно-капельным путем и клинически проявляется поражением органов дыхания, следует помнить о том, что ввиду широкого распространения рецепторов ACE-2 в организме новая коронавирусная инфекция COVID-19 является системной инфекцией. Вовлечение ЖКТ в патологический процесс определяет значимость передачи вируса через фекалии. В систематическом обзоре 55 исследований (1348 пациентов), получены данные об обнаружении вируса почти в половине образцов кала. Более того, положительный результат ПЦР-теста образцов кала (медиана 19 дней) определялся достоверно дольше чем положительный ПЦР- тест респираторных образцов. В другом мета-анализе более чем в половине образцов фекалий вирус обнаруживался в течение периода до 70 дней от начала заболевания и в течение 33 дней после того, как он уже не определялся в респираторных образцах.
В исследованиях Park S.K. и соавт. (2020), Wu Y. и соавт (2020) показано, что SARS-CoV-2 может выделяться с фекалиями в течение периода до 4 месяцев, независимо от наличия или отсутствия у пациента симптомов со стороны желудочно-кишечного тракта. Показано присутствие РНК и белков SARS-CoV-2 в течение 4 месяцев после начала заболевания в тонком кишечнике 50% пациентов с COVID-19 при отсутствии каких-либо симптомов. Инфекционность вируса, выделяемого с фекалиями, к настоящему времени до конца не определена, однако присутствие вируса в фекалиях пациентов с COVID-19 свидетельствует о значимости фекально-орального пути передачи вируса.
Таким образом, к настоящему времени в ряде исследований показана возможность длительной персистенции SARS-CoV-2 в организме человека, что может быть причиной ряда иммунных реакций, способствующих развитию долгого ковида.
Факторы, способствующие персистенции вируса
Предположительно длительному выделению вируса могут способствовать несколько факторов. Одним из таких факторов ряд авторов считает тяжесть заболевания в остром периоде. Так в одном исследовании показано, что медиана продолжительности обнаружения вируса в образцах из дыхательных путей у больных с тяжелым течением острого периода COVID-19 (21 день, 14-30 дней) была значимо дольше, чем у пациентов с легким течением болезни (14 дней, 10-21 день; p = 0.04). Эти данные коррелируют с данными о более длительном выделении вируса у пациентов, находившихся в ОРИТ, в сравнении с пациентами, госпитализированными в инфекционные отделения. Кроме того, вирусная нагрузка у пациентов с тяжелым течением заболевания была значимо выше (по данным одного из исследований в 60 раз выше), чем у пациентов с легким течением заболевания, что позволяет предположить прямую корреляцию между степенью вирусной нагрузки и тяжестью течения болезни.
По данным ряда исследований, предполагаемыми предикторами длительного выделения SARS-CoV-2 с сохраненной активностью из респираторного тракта являются высокая вирусная нагрузка, длительность заболевания менее 7 дней, отсутствие нейтрализующих антител и снижение иммунного ответа организма-хозяина, однако значимыми независимыми факторами риска определены только высокая вирусная нагрузка - >7 Log10 копий РНК/мл в образцах из дыхательных путей и отсутствие SARS-CoV-2 нейтрализующих антител. Эти результаты получены в группе госпитализированных пациентов с тяжелым течением COVID-19, что ограничивает их экстраполяцию на популяцию в целом. В недавнем ретроспективном анализе Marks М., и соавт. (2021) изучены данные негоспитализированных пациентов и показано, что основным предиктором инфекционности является высокая вирусная нагрузка.
Другие потенциальные факторы риска включают лихорадку (t > 38.5°C), применение кортикостероидов и сроки госпитализации. В частности, в одной из работ показано, что тяжелое течение болезни, прогрессирование инфильтративных изменений в легких по данным КТ более чем на 50% в течение 24-28 ч прямо коррелировало с длительным выделением вируса. Однако при проведении многофакторного регрессионного анализа эта зависимость не была столь очевидной [24]. В другом исследовании, включавшем 113 госпитализированных пациентов, медиана выделения РНК SARS-CoV-2 составила 17 дней (от 13 до 22 дней). Длительное выделение (более >15 дней) наблюдалось у 76 пациентов (67.3%), прямая корреляция отмечалась с мужским полом, нахождением на ИВЛ и сроками госпитализации (p= 0.002).
Инфекционность персистирующего SARS-CoV-2
Длительное выделение вируса не является, однако, свидетельством сохранения его инфекционности. Средний период инфекционности дикого штамма вируса составляет примерно 8 дней от начала заболевания. Van Kampen J.J.A. и соавт. (2021) показали, что вероятность выделения живого вируса из дыхательных путей в период более двух недель от начала заболевания составляет <5%. В настоящее время имеется лишь одно сообщение о выделении живого вируса в мазке из носоглотки через 18 дней от начала заболевания, что подтверждает резкое снижение инфекционности вируса после второй недели заболевания. Скорее всего, выделение вирусной РНК не является значимым предиктором инфекционности, и такая длительная персистенция может быть связана с субоптимальным иммунологическим клиренсом SARS-CoV-2.
Cтановится все более очевидным, что риск для окружающих, связанный с контактами с реконвалесцентами COVID-19, является незначительным. В одном из исследований у медицинских работников, имевших положительный тест в течение периода до 55 дней после появления симптомов, живой вирус в мазках из носо-и ротоглотки выделен не был. В другом исследовании у 48 пациентов с положительным тестом на РНК SARS-CoV-2 более 14 дней от начала заболевания, также не было выявлено живого вируса. Однако в работе Jeong H.W. и соавт. (2020) показано, что живой вирус может обнаруживаться в период более 15 дней в слюне, моче и кале.
Таким образом, очевидно, что период инфекционности SARS-CoV-2 скорее всего варьирует в зависимости от целого ряда факторов. Одним из наиболее значимых факторов длительной персистенции и сохранения инфекционности является состояние иммунной системы пациента.
Персистенция вируса у иммунокомпроментированных пациентов
Анализ данных исходов COVID-19 у пациентов с различными сопутствующими заболеваниями показал, что онкологические заболевания легких и крови, трансплантация органов, первичные иммунодефициты являются факторами риска тяжелого течения COVID-19, внутрибольничных инфекций, летальных исходов, связанных с COVID-19. В ряде работ сообщается о высокой вероятности персистенции, реактивации или реинфекции SARS-CoV-2 у иммунокомпроментированных пациентов. И хотя длительное выделение вирусной РНК в ПЦР-тесте у симптомных и бессимптомных пациентов описано уже в достаточно большом числе исследований, выделить вирус с подтвержденной инфекционностью у пациентов с сохранной иммунной системой в период более 2 недель после начала заболевания пока не удалось. При этом имеется несколько сообщений о выделении активного вируса иммунокомпроментированными пациентами в течение недель и даже месяцев после начала заболевания. В ряде случаев у этих пациентов отмечался даже рецидив симптомов, проводились повторные курсы лечения ремдесивиром, что, в конечном итоге, приводило к элиминации вируса. Самый длительный период выделения жизнеспособного вируса в мазке из носоглотки - ~8 месяцев, зафиксирован у пациента с неходжкинской лимфомой. Объяснением подобных фактов может быть то, что вирусная нагрузка у иммунокомпроментированных пациентов может отличаться от таковой у пациентов с сохранным иммунитетом.
Имеющиеся к настоящему времени данные о длительной персистенции и выделении инфекционного вируса сложно экстраполировать на популяцию в целом и обобщать по нескольким причинам: эти исследования не были тщательно спланированы для изучения факторов риска персистенции и реинфекции SARS-CoV-2; во всех описанных случаях имело место атипичное течение заболевания, обычно протекающего в острой форме; SARS-CoV-2 эволюционирует медленно, что является дополнительной возможностью для диверсификации квазивидов SARS-CoV-2.
Однако, учитывая, что SARS-CoV-2 является пандемической инфекцией, вполне возможно влияние иммунного ответа организма-хозяина на эволюцию вируса и селекцию штаммов с измененными свойствами, вызывающих хроническую персистирующую инфекцию. Этот аспект инфекции SARS CoV-2 требует проведения крупномасштабных исследований, направленных на понимание механизма, лежащего в основе персистенции вируса, с целью разработки методов лечения и профилактики. Учитывая накапливающиеся данные о появлении новых вариантов SARS-CoV-2, их заразности и их влиянии на эффективность вакцин тяжесть заболевания, было бы также интересно исследовать взаимосвязь между эволюцией вируса внутри хозяина и механизмами ухода от иммунного ответа у разных групп пациентов в контексте персистенции вируса, инфекционности и реинфекции.
Персистенция вируса и возможность рецидива или реинфекции
Имеются сообщения об обнаружении вируса SARS-CoV-2 в респираторных образцах у пациентов, перенесших COVID-19, после получения одного или двух отрицательных результатов ПЦР-теста. В этой связи возникают вопросы, связано ли это с погрешностями забора материала, ограниченной чувствительностью теста, персистенцией вируса, рецидивом или реинфекцией. Хотя имеющиеся данные ограничены, имеется ряд исследований, в которых таких пациентов наблюдали в течение определенного времени после выписки из стационара и не выявили заражения членов их семей, что позволило предположить выделение неактивного вируса. Однако имеется несколько сообщений о выделении у выздоровевших пациентов другого штамма вируса, что может говорить о реинфекции или мутации исходного штамма.
Невозможно дать окончательный ответ на вопрос, насколько обнаружение положительного теста после отрицательного свидетельствует о реинфекции. Однако в одном из исследований из 87 пациентов с повторным положительным тестом после отрицательного живой вирус или вирус, генетически отличный от исходного, был получен только в 14% случаев, а у большинства пациентов выделялся неактивный вирус. Суммируя результаты имеющихся исследований можно предположить, что длительное выделение вируса у большинства пациентов скорее всего не связано с реинфекцией. Одним из возможных объяснений данного факта может быть предположение о том, что вирус может изолироваться в организме (например, в экзосомах) и затем периодически выделяться, как это описано для таких вирусов как ВИЧ или ВЭБ. Наконец, сохраняется возможность реактивации латентного вируса, как это описано для вирусов герпеса. Этот феномен был описан у пациента с COVID-19, который одновременно получал лечение по поводу острого лимфолейкоза.
Исходя из вышеизложенного, для разработки адекватных мероприятий по контролю пандемии COVID-19 представляется крайне важным изучение причин, по которым у ряда пациентов вирус персистирует и выделяется в течение длительного времени.
С учетом высокой вероятности персистенции вируса при Long-COVID-19 представляется вполне обоснованным использование уже за пределами острого периода препаратов прямого противовирусного действия, таких как РНК- зависимый ингибитор РНК-полимеразы фавипиравир. В проведенных в нескольких странах клинических исследованиях доказано угнетение репликации вируса COVID-19 и последовательный регресс клинической симптоматики в остром периоде. В некоторых клиниках России успешно используют повторное назначение фавипиравира при затянувшемся COVID-19.
Альтернативный подход может быть связан с использованием в таких ситуациях иммуномодулирующих средств. В этом плане представляется перспективным использование Ингавирина. В доклинических и клинических исследованиях показана эффективность препарата имидазолилэтанамида пентандиовой кислоты (Ингавирин) в отношении вирусов гриппа типа А и В, аденовируса, вируса парагриппа, респираторно-синцитиального вируса, коронавируса, метапневмовируса, энтеровирусов и риновируса. Механизм действия препарата реализуется на уровне инфицированных клеток за счет активации факторов врожденного иммунитета, подавляемых вирусными белками. Ингавирин® повышает экспрессию рецептора интерферона-а первого типа на поверхности эпителиальных и иммунокомпетентных клеток, активирует синтез антивирусного эффекторного белка МхА (ранний фактор противовирусного ответа, ингибирующий внутриклеточный транспорт рибонуклеопротеиновых комплексов вирусов) и фосфорилированной формы протеинкиназы В, подавляющей трансляцию вирусных белков. Помимо противовирусного действия, Ингавирин® оказывает противовоспалительный эффект, обусловленный подавлением продукции фактора некроза опухоли (ФНО-α), интерлейкинов, снижением активности миелопероксидазы, и проявляет регенеративное действие. Проведенное клиническое исследование подтвердило эффективность препарата в острый период. Исходя из механизма действия, включающего снижение вирусной нагрузки, логично предположить целесообразность назначения Ингавирина при Long-COVID-19. Требуются дальнейшие исследования.
Хроническое воспаление
Ввиду того, что в достаточно большом числе исследований показана возможность длительной персистенции SARS-CoV-2 в организме человека, возникло предположение о возможной роли активации иммунной системы в патогенезе долгого COVID-19. В частности, опубликован обзор данных, согласно которым Т-клеточная дисфункция может способствовать развитию долгого ковида, патофизиология которого очень сходна с аутоиммунными заболеваниями. Это подтверждается результатами аутопсии пациентов, умерших от COVID-19, у которых в легких и других органах были обнаружены инфильтраты с высокой концентрацией CD8þ T-лимфоцитов, которые являются одними из важнейших медиаторов аутоиммунных реакций.
Достаточно неожиданно у 15-20% пациентов с COVID-19 были выявлены нарушения функции щитовидной железы. Учитывая тесную связь щитовидной железы и Т-клеточно-опосредованных аутоиммунных реакций, необходимо иметь ввиду возможную роль патологии щитовидной железы в патогенезе долгого ковида.
B-лимфоциты также могут играть определенную роль в иммунопатогенезе долгого COVID-19. Так при анализе образцов крови пациентов, госпитализированных с новой коронавирусной инфекцией COVID-19, антифосфолипидные антитела были выявлены в 52% случаев. В дальнейшем в ходе исследования была подтверждена роль этих антител в гиперактивации нейтрофилов и более тяжелом течении заболевания. В других работах у 1050% пациентов с COVID19 были выявлены аутоантитела против интерферонов, нейтрофилов, соединительной ткани и др. Кроме того, уже очевидно, что при тяжелом течении COVID-19 развивается лимфопения (т.е. снижение уровня B- и T-лимфоцитов), что приводит к избыточной воспалительной реакции. Связано это с тем, что именно лимфоциты, особенно Т-лимфоциты, играют важную роль в разрешении воспаления, связанного с инфекцией. В подтверждение этого имеются результаты мета-анализа, согласно которым лимфопения и повышенное содержание провоспалительных нейтрофилов являются независимыми факторами риска тяжелого течения COVID-19 и летальности. Таким образом, неразрешенная избыточная воспалительная реакция может играть определенную роль в развитии долгого ковида. Показано также, что при низких уровнях T- и B-лимфоцитов создаются благоприятные условия для персистенции SARS-CoV-2, что может, в свою очередь, поддерживать активацию иммунной системы при долгом COVID-19. Кроме того, к настоящему времени описано достаточно большое число случаев мультисистемного воспалительного синдрома (MIS), развивающегося у детей и взрослых через 2-6 недель после острого периода инфекции. Интересно, что у этих пациентов в остром периоде могло быть достаточно легкое или даже бессимптомное течение заболевания, а впоследствии наблюдался рост уровней маркеров воспаления (СРБ, ИЛ-6, ферритина, Д-димера), лимфопения и тяжелые нарушения со стороны сердечно-сосудистой, нервной систем, желудочнокишечного тракта. Отсроченное развитие мультисистемного воспалительного синдрома подтверждает значимость дисрегуляции адаптивного иммунитета. Таким образом, возможно неразрешившееся воспаление может быть одним из факторов развития долгого ковида как у взрослых, так и у детей, и объясняет такие характерные его симптомы как миалгия, артралгия, утомляемость. При этом необходимо иметь ввиду, что хроническая усталость является не только признаком воспаления, но и нарушений мозгового кровообращения, дисфункции вегетативной нервной системы, что также может иметь значение в патогенезе долгого ковида.
Другой причиной длительного воспалительного процесса может быть патология желудочно-кишечного тракта. Известна способность SARS-CoV-2 эффективно размножаться в клетках желудка и кишечника ввиду высокой экспрессии рецепторов ACE2, что у 10-20% пациентов приводит к гастроинтестинальной форме клинической манифестации COVID-19. Важно понимать, что те же симптомы со стороны органов пищеварения (тошнота, рвота, диарея и др.) наблюдаются у пациентов с долгим ковидом. Нарушение микробиоты ЖКТ наблюдается при новой коронавирусной инфекции в течение периода до 30 дней от начала заболевания и коррелирует с тяжестью заболевания и уровнями воспалительных маркеров. Учитывая тесную взаимосвязь между ЖКТ и иммунной системой, это также может играть определенную роль в поддержании хронического воспаления.
Для подавления клнических проявлений хронического воспаления, существенно влияющих на качество жизни пациентов, можно использовать нестероидные противовоспалительные препараты и парацетамол. При этом представляется приоритетным использование фиксированных комбинаций парацетамола с адреномиметиками и антигистаминными препаратами (парацетамол+цитеризин+фенилэфрин, Терафлю), поскольку в этом случае наблюдается синергизм действия препаратов и достигается возможность комплексного действия сразу на несколько симптомов (слабость, озноб, лихорадка, миалгия, артралгия, кашель, заложенность носа, ринорея, чихание).
У пациентов с COVID-19, как правило, развивается эндотелиальная дисфункция, в результате прямого вирусного поражения эндотелиоцитов. Эндотелиальная дисфункция приводит к нарушению микроциркуляции и способствует формированию гипоксии в различных органах и тканях. Со стороны ЦНС обычно отмечается усугубление симптоматики уже имеющейся хронической ишемии мозга, либо возникновение когнитивных нарушений и астенического синдрома de novo. Пациентам с признаками когнитивных нарушений и сопутствующего астенического синдрома рекомендуется применять терапию, направленную на устранение эндотелиальной дисфункции и улучшение микроциркуляции. С этой целью целесообразно применять депротеинизированный гемодериват крови телят, который обладает подтвержденным эндотелиопротективным действием, способствует улучшению реологии эритроцитов и увеличению количества функционирующих капилляров. Согласно последним клиническим данным, прием препарата по 2 таблетки 3 раза в день не менее 45 дней способствует регрессу когнитивных нарушений и сопутствующего астенического синдрома.

























































































0 комментариев