Саркопения у больных, получающих заместительную почечную терапию. Реабилитация больных на гемодиализе. Лекция для врачей
Лекция для врачей "Саркопения у больных, получающих заместительную почечную терапию. Реабилитация больных на гемодиализе" (отрывок из книги "Реабилитация больных на гемодиализе" - Смирнов А. В.)
Саркопения у больных, получающих заместительную почечную терапию
Определение саркопении
Термин «саркопения», означающий в буквальном переводе «дефицит или снижение массы скелетной мускулатуры», ввел в обращение I.H. Rosenberg в 1989 году [Rosenberg, 1989]. Впоследствии к определению саркопении было добавлено понятие о снижении мышечной силы (мощности) — динапения, поскольку зависимость между массой мышцы и ее работоспособностью не является линейной и снижение мышечной массы не всегда приводит к снижению силы мышц. Динамика этих состояний также может различаться: снижение мышечной силы может происходить быстрее, чем снижение мышечной массы, и наоборот. В частности, у больных молодого возраста, получающих лечение хроническим гемодиализом, функциональные показатели мышц оказались достоверно хуже, чем в контрольной группе, в то время как мышечная масса не была снижена [Marcus, 2015].
В настоящее время наиболее употребляемым определением саркопении является определение Европейской рабочей группы по саркопении у пожилых людей (EWGSOP). В соответствии с ним под саркопенией понимают синдром, характеризующийся прогрессирующей генерализованной потерей массы, силы и работоспособности скелетной мускулатуры и повышающий риск неблагоприятных исходов, таких как низкое качество жизни, инвалидизация и смерть [Cruz-Jentoft, 2010]. Диагноз саркопении требует обязательного наличия первого критерия (снижение массы мышц), а также одного из двух последующих критериев (снижение мышечной силы или работоспособности). Данное определение позволяет классифицировать саркопению по степени тяжести: пресаркопения — имеется только снижение массы мышц; саркопения — снижение массы мышц сочетается с наличием одного из двух последующих критериев; тяжелая саркопения — присутствуют все три критерия [Cruz-Jentoft, 2010].
Существует ряд синдромов, в большей или меньшей степени совпадающих с понятием саркопении. К таковым в первую очередь относится кахексия — комплексный метаболический синдром, обусловленный наличием тяжелого заболевания и характеризующийся потерей мышечной массы, обычно в сочетании с потерей жировой ткани [Evans, 2008]. Кахексия обычно ассоциирована с воспалением, инсулинорезистентностью, анорексией и повышенным катаболизмом. Таким образом, у большинства больных с кахексией имеется саркопения, но большинство пациентов с саркопенией не кахектичны.
В англоязычной литературе широко используется термин «frailty», которому в отечественных статьях соответствует «синдром старческой астении». Как следует из названия, это гериартрический синдром, отвечающий как минимум трем из нижеследующих характеристик: непреднамеренная потеря веса, истощение, слабость, низкая физическая активность и сниженная скорость ходьбы. Согласно определению 2016 года старческая астения — ассоциированный с возрастом синдром, характеризующийся угасанием (decline) совокупности физиологических систем и снижением резервов организма и приводящий к увеличению риска неблагоприятных исходов (госпитализация, инвалидность, смерть) при воздействии стрессорных факторов [Argiles, 2016]. Понятия старческой астении и саркопении, тем самым, также частично перекрываются: у большинства пожилых астеничных людей имеется саркопения, а некоторые пожилые люди с саркопенией астеничны. Некоторые авторы рассматривают старческую астению как вторичный по отношению к саркопении синдром [Fried, 2001].
Использование термина «недостаточность питания» (malnutrition) ограничено ситуациями, когда имеется вызванная той или иной причиной (анорексия, гастроинтестинальная обструкция, нарушение переваривания, мальабсорбция) недостаточность поступления питательных веществ с пищей [Jeejeebhou, 2012].
Понятие о белково-энергетической недостаточности (БЭН) было сформулировано в 2007 году как одновременное истощение запасов белка и энергии в организме пациентов с хронической болезнью почек (ХБП), приводящее к снижению не только мышечной массы, но и жировой ткани, и в конечном счете — к кахексии [Obi, 2015]. Таким образом, термин БЭН в строгом понимании, во-первых, может быть использован только в применении к нефрологическим больным и, во-вторых, является более широким понятием, чем саркопения.
Наиболее близким к понятию «саркопения» в рассматриваемом нами контексте является термин «уремическая миопатия». Уремическая миопатия впервые описана в 1967 году, причем авторы выделяли два ее паттерна: первый, тесно ассоциированный с невропатией и с преимущественным поражением дистальной скелетной мускулатуры; и второй, с преимущественным поражением проксимальных мышц [Serratrice, 1967]. Преимуществом данного термина является то, что он подчеркивает связь между поражением мышц и уремией. В связи с этим в настоящее время рядом авторов предложен термин «уремическая саркопения» [Fahal, 2014].
Вышеотмеченные понятия и синдромы являются частично перекрывающимися. Например, у пациента старческого возраста, страдающего онкологическим заболеванием и получающего лучевую и заместительную почечную терапию, кахектический фенотип обусловлен как собственно кахексией, так и недостаточностью питания (анорексия, мальабсорбция вследствие лучевого поражения кишечника), белково-энергетической недостаточностью на фоне лечения гемодиализом, а также исходной астенией. При этом у данного больного неизбежно будет присутствовать снижение мышечной массы и функции, то есть саркопения. Таким образом, преимущественное использование того или иного термина должно определяться конкретной клинической ситуацией.
Методы диагностики саркопении
В соответствии с принятым определением для диагностики саркопении необходима оценка как размеров и массы мышц, так и мышечной функции. Референтным методом определения мышечной массы является нейтронный активационный анализ, сущность которого заключается в изучении состава вещества на основе активации его атомных ядер при помощи внешнего излучения. Данный метод используется в медицинских исследованиях с 80-х годов XX века, однако и по сей день количество нейтронных облучателей во всем мире не превышает нескольких десятков, что значительно ограничивает его клиническое применение [Carrero, 2016].
Существенно более широко применяют компьютерную и магниторезонансную томографию (КТ и МРТ), которые позволяют определить площадь поперечного сечения и объем мышц данного региона, а также плотность мышцы и содержание жира. Данные методы обладают высокой точностью, однако являются сравнительно дорогостоящими, а также сопряжены с лучевой нагрузкой (КТ) или противопоказаны пациентам, имеющим имплантированные металлические предметы (МРТ).
Биоимпедансометрия (БИМ) основана на различии электропроводности жировой ткани и тощей массы тела. БИМ обладает приемлемой точностью, сравнительно малозатратна и удобна в применении. Существует несколько режимов БИМ: одночастотный, мульти частотный и биоимпедансная спектроскопия, когда используется весь набор частот от 0 до 1000 кГц [Carrero, 2016]. Однако необходимо помнить, что при БИМ непосредственно измеряется только распределение воды в организме (общее количество воды, внутри- и внеклеточная вода), а все остальные показатели являются расчетными. В силу этого у пациентов с выраженным истощением или, наоборот, ожирением погрешность измерения может существенно увеличиваться. На точность влияет также техника проведения измерений, например, положение электродов, значение комнатной температуры и температуры тела пациента. У гипергидратированных больных мышечная масса при БИМ завышается, поэтому у больных, получающих лечение гемодиализом, измерения рекомендуется проводить в течение 2 часов после сеанса диализа, а у пациентов на перитонеальном диализе — со слитым диализатом [Carrero, 2016; Beaudart, 2016]. БИМ позволяет рассчитать широко используемый в исследованиях индекс массы скелетной мускулатуры (ИМСМ, SMMI): отношение расчетной обшей массы скелетной мускулатуры тела в килограммах к квадрату роста в метрах, а также индекс тощей массы тела (ИТМ, LBM1); отношение тощей массы тела (масса тела без жировой и костной ткани, то есть масса скелетной мускулатуры, паренхиматозных органов и общего количества воды в организме) к квадрату роста в метрах.
«Золотым стандартом» определения размеров и массы мышц и диагностики саркопении в настоящее время является двухэнергетическая рентгеновская абсорбциометрия (ДРА). Метод основан на измерении интенсивности пропущенного через ткани организма потока рентгеновских лучей, которая меняется в зависимости от толщины, плотности и химического состава данной ткани. ДРА первоначально применяли только для оценки минеральной плотности костей, но по мере совершенствования методики стало возможным использовать ДРА и для определения жировой и безжировой массы тела. Лучевая нагрузка при использовании ДРА не превышает таковую при стандартной рентгенографии легких. ДРА используют в качестве эталона для проверки расчетных формул на основе антропометрических показателей, калиперометрии и биоимпедансометрии [Carrero, 2016]. Результаты ДРА, как и биоимпедансометрии, зависят от степени гидратации организма.
Данные ДРА позволяют рассчитать показатель аппендикулярной массы скелетной мускулатуры (АММ), то есть сумму тощей массы верхних и нижних конечностей, которая достаточно точно совпадает с их мышечной массой. На основе АММ рассчитывается так называемый индекс аппендикулярной скелетной мускулатуры (АСМИ, ASMI) — отношение АММ (в кг) к квадрату роста (в метрах). Используется также АСМИ с поправкой на индекс массы тела (ИМТ), то есть отношение АСМИ к ИМТ.
Использование антропометрических и калиперометрических показателей в силу их значительной погрешности не рекомендовано EWGSOP для диагностики саркопении, хотя некоторые из них (например, окружность мышц плеча или голени) часто используются в локальных исследованиях [Cruz-Jentoft, 2010].
Первоначальные тонкие изменения в мышцах, обуславливающие нарушение их функции, могут не сопровождаться снижением мышечной массы и, соответственно, не диагностироваться инструментальными методами [Stenvinkel, 2016]; поэтому необходимы функциональные тесты, которые могут служить для измерения различных показателей: силы, мощности, работоспособности (выносливости) мышц. Наиболее точным методом является применение изокинетических динамометров, но это достаточно громоздкая и дорогостоящая аппаратура; поэтому в клинических исследованиях обычно используют кистевые динамометры. Измерение силы хвата кисти при соблюдении стандартных условий измерения показало хорошую корреляцию с силой мышц ног и окружностью голени [Beaudart, 2016].
В силу доступности и простоты методики в клинических условиях для диагностики саркопении наиболее часто применяют сочетание биоимпедансометрии и измерения силы хвата [Ren, 2016]. Однако у больных на гемодиализе использование кистевых динамометров может быть затруднено наличием артериовенозной фистулы и специфических осложнений, например, синдрома запястного канала.
EWGSOP рекомендует использовать так называемый короткий комплексный тест физической работоспособности (short physical performance battery, SPPB), включающий в себя тесты на удержание равновесия, подъем со стула и скорость ходьбы [Guralnik, 1994]. Альтернативой являются другие тесты, позволяющие оценить силу и работоспособность мышц, например, проба с подъемом по лестнице или тест с 6-минутной ходьбой [Beaudart, 2016].
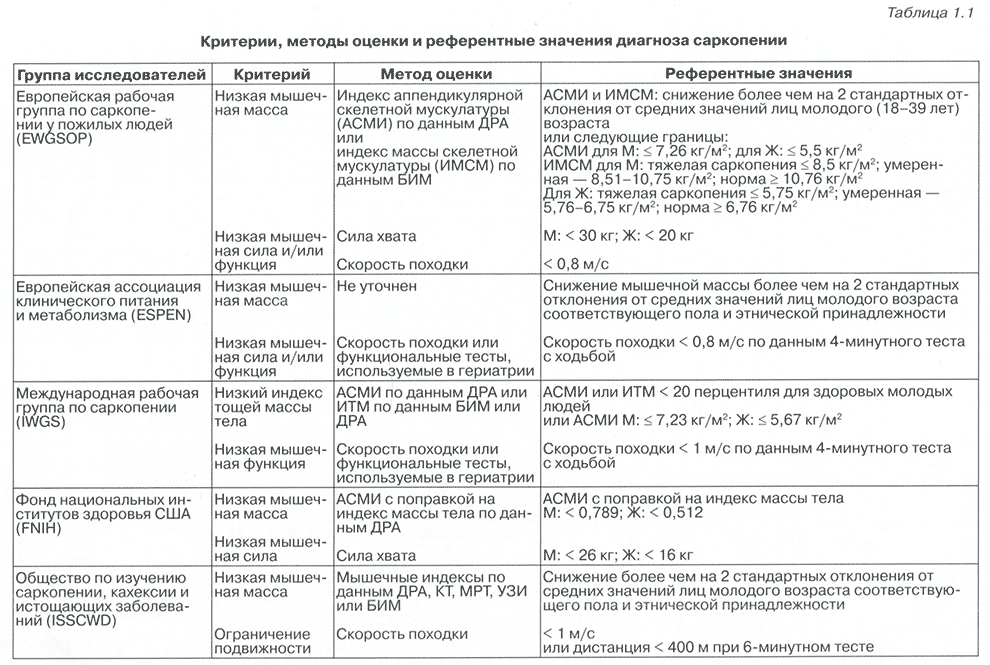
В табл. 1.1 представлены используемые в настоящее время разными авторами критерии, методы оценки и референтные значения диагноза саркопении.
Таблица 1.1 Критерии, методы оценки и референтные значения диагноза саркопении
В настоящее время не существует надежного общепринятого биомаркера саркопении, несмотря на то что идентифицирован целый ряд молекул, принимающих непосредственное участие в метаболизме мышечной ткани. Так, известными «позитивными», ассоциированными с повышенной или нарастающей мышечной массой маркерами являются костные морфогенетические белки (BMPs), нейротрофический фактор мозга (BDNF), фоллистатин, иризин, а «негативными» — TGF-β, миостатин, активины, GDF-15. На роль маркеров мышечной функции претендовали также С-терминальный фрагмент актина с молекулярной массой 14 кДа и мышцеспецифичный тропонин Т [Argiles, 2016]. Имеющиеся к настоящему времени результаты исследований этих маркеров мышечного метаболизма, так же как и активинов и n-терминального пропептида проколлагена III, не позволяют однозначно рекомендовать их в качестве достоверного маркера массы и силы мышц [Beaudart, 2016]. Очевидной является необходимость дополнительных, более масштабных исследований этой проблемы и поиска новых биохимических маркеров.
Таким образом, необходимо отметить, что на сегодняшний день не существует общепринятых критериев диагноза саркопении как в обшей популяции, так и у больных с ХБП в частности. Так, по данным разных исследований частота саркопении у больных на гемодиализе колебалась от 4 до 74% в зависимости от выбранного метода измерения и референтных значений [Carrero, 2016]. Для нашей страны дополнительной сложностью является отсутствие популяционных исследований, подобных Национальным исследованиям здоровья и питания (NHANES), и, соответственно, отсутствие референтных значений для данного региона. Стандартизации по возрасту, полу и этнической принадлежности недостаточно, поскольку существуют и региональные особенности: в исследовании PURE, которое включало измерение силы хвата у 140 тысяч людей в 17 странах, выявлены достоверные региональные различия этого показателя [Carrero, 2016].
Возможным выходом является оценка динамики изменения мышечной массы. Одним из уже предложенных критериев является снижение массы мышц на 5% за 3 мес. или на 10% за 6 мес. независимо от использованного метода [Carrero, 2016]. Суррогатным показателем риска саркопении у больных, получающих заместительную почечную терапию (ЗПТ), особенно у пациентов с анурией, может также служить динамическое снижение уровня креатинина сыворотки и (в еще большей степени) повышение отношения додиализного уровня мочевины к креатинину крови (индекс Н. Oksa) [Oksa, 1987; Tufan, 2015; Greenhall, 2016].
Распространенность и этиология саркопении
Распространенность саркопении в общей популяции четко коррелирует с возрастом. В организме здорового молодого человека скелетные мышцы составляют примерно 40% от общей массы тела и содержат примерно 50% от общего количества белка [Greenhall, 2016]. Мышечная масса, как правило, начинает снижаться с шестого десятилетия жизни со скоростью 0,5—1% в год. К 70-летнему возрасту площадь поперечного сечения мышц обычно уменьшается примерно на треть, а мышечная сила — на 40% [Bowen, 2015].
Хроническая болезнь почек является фактором риска развития саркопении, и по мере прогрессирования ХБП выявляемость саркопении увеличивается. По данным К. Hirai et al. (2016), у пациентов с ХБП Cl саркопения выявляется в 4,3% случаев, при ХБП С2 — в 6,3%, при ХБП 3—5 стадии саркопения имеется у 15,4% больных [Hirai, 2016]. У больных, находящихся на лечении хроническим гемодиализом (ГД), распространенность саркопении существенно выше, чем на додиализной стадии, достигая, по некоторым данным, 1/3 от общей популяции диализных больных [Kim, 2013]. Риск саркопении среди больных на ГД увеличивается с возрастом пациента. Согласно данным Ren et al. саркопению имели 13,7% пациентов в общей группе (15% у мужчин и 11,8% среди женщин), 18% больных старше 50 лет и 33,3% больных старше 60 лет [Ren, 2016]. По данным другого исследования, у пожилых больных на ГД распространенность саркопении достигает 45-63% [Lamarca, 2014].
Помимо возраста факторами риска саркопении у больных на ГД являются продолжительность диализного лечения, наличие сахарного диабета и низкий уровень фосфатов в крови [Ren, 2016].
Потеря мышечной массы у больных на гемодиализе может достигать 1—3 кг в год [Fitschen, 2016]. Однако мышечная дисфункция у больных, получающих ЗПТ, связана не только с потерей мышечной массы, но и с нарушением функции мышц [Carrero, 2016]. По данным N. Isoyama et al. распространенность саркопении у больных на ГД (средний возраст 53 года) составила 20%; при этом снижение массы мышц по данным ДРА выявлено у 24% пациентов, а снижение мышечной силы (силы хвата) — у 15% [Isoyama, 2014].
Саркопения уменьшает качество жизни у больных на ГД и увеличивает вероятность госпитализации [Yamada, 2016]. Саркопения и снижение силы мышц (по результатам измерения силы хвата, скорости походки, 6-минутного теста) являются независимыми предикторами смертности у больных с ХБП, в том числе получающих ЗПТ. При этом более значимым фактором риска смерти является сила мышц, а не мышечная масса [Rhee, 2014; Hirai, 2016].
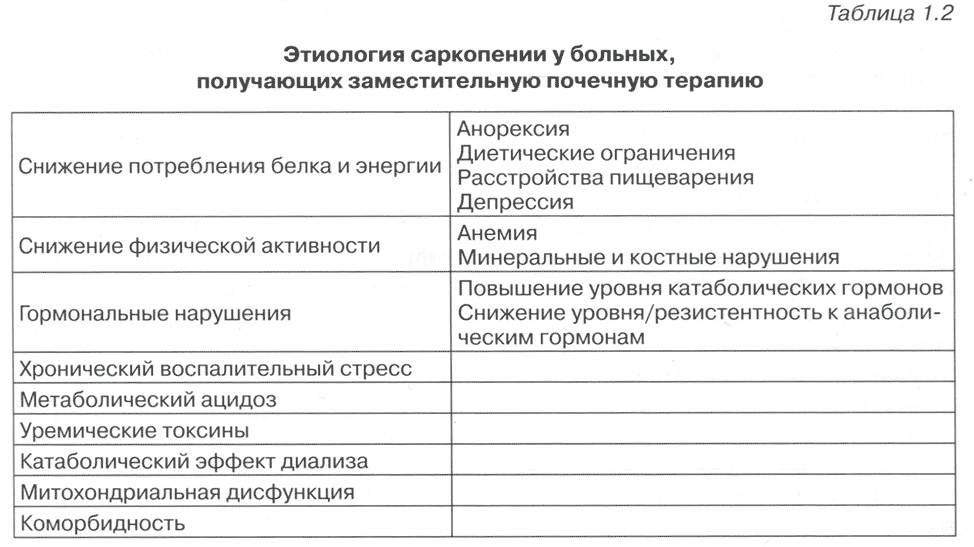
Этиология саркопении у больных, получающих заместительную почечную терапию, является многофакторной (табл. 1.2).
Таблица 1.2 Этиология саркопении у больных, получающих заместительную почечную терапию
Снижение аппетита является частой проблемой у больных, получающих ЗПТ Причинами анорексии могут быть изменения вкуса, вызванные уремией гастроинтестинальные нарушения, депрессия. У больных с ХБП, как правило, повышен уровень лептина, являющегося ингибитором аппетита [Fahal, 2014]. У больных на перитонеальном диализе (ПД) к этому добавляются механические проблемы, связанные с присутствием диализата в брюшной полости, и повышение нагрузки глюкозой.
Наиболее частыми причинами снижения физической активности у больных, получающих ЗПТ, являются анемия, остеопатия и сопутствующие заболевания/ осложнения, в первую очередь, кардиоваскулярные поражения. Так, наличие сердечной недостаточности не только уменьшает мобильность пациентов, но также приводит к нейрогуморальным нарушениям, в том числе к повышению уровня глюкокортикостероидов и ангиотензина в крови. Ангиотензин II в эксперименте усиливает протеолиз в мышцах посредством активации трансформирующего фактора роста-β (TGF-β) |Fahal, 2014]. Показано, что под влиянием ангиотензина II уменьшается пул сателлитных клеток, моноядерных миогенных стволовых клеток, расположенных на поверхности мышечного волокна под его базальной мембраной [Avin, 2015]. Сателлитные клетки активируются в ответ на повреждение или физические упражнения и начинают делиться, превращаясь сначала в фибробласт, а затем в зрелую мышечную клетку. Активация сателлитных клеток сопровождается экспрессией белка MyoD, а при их дифференцировке происходит экспрессия миогенина [Shefer, 2006; Motohashi, 2014]. У мышей с ХБП отмечена уменьшенная экспрессия MyoD и миогенина в ответ на повреждение мышц [Wang, 2009]. Помимо этого активация ренин-ангиотензиновой системы поддерживает и усиливает оксидативный стресс вследствие активации NADPH-оксидаз. Оксидативное повреждение белков миофибрилл снижает их чувствительность к кальцию, уменьшая их способность к сокращению [Rubattu, 2013]. Применение лосартана улучшало восстановление мышцы после повреждения [Burks, 2011].
Костно-мышечная система функционирует как единое целое, и при наличии костного поражения неминуемо страдают и мышцы; поэтому диализная остеопатия является важным фактором развития саркопении. Верно и обратное: саркопения предрасполагает пациента к сидячему образу жизни, что способствует прогрессированию остеопороза. Показано, что наличие нарушений функции мышц (по данным функциональных тестов) при ХБП связано с увеличением риска переломов [Jamal, 2006]. Нарушения метаболизма витамина D также увеличивает риск саркопении. Миоциты имеют рецепторы витамина D [Bischoff, 2001]. Дефицит витамина D у людей с нормальной функцией почек приводит к удлинению фазы релаксации мышечного сокращения, независимо от уровня кальция, фосфата и паратгормона в крови [Fahal, 2014]. При биопсии мышц у этих пациентов выявляются такие же изменения, как при ХБП: атрофия волокон 2-го типа, отложение гранул гликогена и липофусцина [Fahal, 2014; Greenhall, 2016]. В эксперименте применение агонистов рецепторов витамина D увеличивает экспрессию промиогенных факторов и подавляет экспрессию миостатина [Garcia, 2011]. У больных, получающих лечение перитонеальным диализом и имеющих дефицит витамина D, назначение препаратов витамина D приводило к увеличению массы мышц [Taskapan, 2011].
Мышечная ткань находится в тесной метаболической связи с жировой тканью. При истощении собственных запасов гликогена и липидов мышцы могут увеличить поступление источников энергии, необходимых для сокращения, либо путем увеличения транслокации транспортеров глюкозы на мембране миоцитов, либо за счет интенсификации липолиза в других тканях. Во время физических нагрузок мышца выделяет субстанции, обладающие эндокринными эффектами, в том числе и в отношении жировой ткани — миокины. Термин «миокин» — гормон, высвобождаемый мышцей в кровоток и оказывающий эффект на другие ткани — предложил В.К. Pedersen в 2003 году [Pedersen, 2003]. Со временем данный термин стал трактоваться более свободно и означать также любой секретируемый мышцей белок, не обязательно поступающий в циркуляцию и обладающий не только эндокринным, но и паракринным или аутокринным действием. В настоящее время список миокинов, в дополнение к интерлейкинам, включает также иризин, мионектин, вещества из семейств FGF и TGF, среди которых наиболее изученным на сегодняшний день является миостатин, продуцируемый не только мышечной, но и жировой тканью (см. ниже). С другой стороны, адипокины (гормоны жировой ткани) способны прямо или косвенно влиять на метаболизм мышц. Возможно также, что имеет место взаимная регуляция уровня миостатина и адипокинов: использование «ложного» циркулирующего рецептора миостатина ActRIIB (препарат АСЕ-031) привело к 51% росту уровня адипонектина и к 28% снижению лептина [Buehring, 2013]; при этом известно, что при ХБП содержание лептина в крови, как правило, повышается, а адипонектина — понижается [Briffa, 2013; Nashar, 2014]. Сочетание саркопении с ожирением, нередко встречающееся у пациентов мужского пола, получающих ЗПТ, считают наиболее неблагоприятным метаболическим паттерном саркопении, поскольку оно существенно увеличивает риск смерти [Greenhall, 2016; Lee, 2016].
В общем смысле саркопения обусловлена дисбалансом катаболизма и анаболизма белков скелетных мышц. Известны четыре протеолитические системы, участвующие в процессе катаболизма мышечных белков: лизосомальная (аутофагическая), каспазная, кальпаиновая и убиквитин-протеасомная. Показано, что активность аутофагии с возрастом снижается [Коошап, 2013]. Предполагается также, что и убиквитин-протеасомная система (УПС) не является основным фактором развития старческой саркопении, поскольку как экспрессия убиквитиновых ЕЗ-лигаз MuRF-I и MAFbx, так и общая пептидазная активность УПС существенно не изменяются к старости [Bowen, 2015]. Экспрессия кальпаинов (кальций-зависимых цистеиновых протеаз), напротив, в пожилом возрасте увеличивается.
В отличие от старческой саркопении активацию убиквитин-протеасомной системы считают одной из основных причин истощения мышц у больных с ХБП. Убиквитин, белок с молекулярной массой 8,5 кДа, способен с помощью убиквитинлигаз ковалентно присоединяться к лизиновым остаткам белка-мишени. Белки, помеченные полиубиквитиновыми цепями, подвергаются дальнейшей деградации с помощью протеасом [Jackman, 2004]. Экспрессия и активность мышцеспецифичных убиквитиновых ЕЗ-лигаз, атрогина-1 и MuRF-1 регулируется транскрипционными факторами FoxO и NFKB [Lecker, 2006]. Воспаление активирует убиквитин-протеасомную систему. Известна тесная связь между воспалением, оксидативным стрессом и активацией протеолиза в мышцах. Уже на ранних стадиях ХБП повышается содержание в крови таких маркеров воспаления, как С-реактивный белок (СРБ), интерлейкин-6 (IL-6) и фактор некроза опухоли-альфа (TNF-α). При этом показано, что мышечная масса у больных на ГД обратно коррелирует с содержанием в циркуляции IL-6 и СРБ [Kaizu, 2003]. Про- воспалительные цитокины способствуют развитию атрофии мышц не только за счет активации катаболизма, но и вследствие замедления анаболических процессов. Цитокины (TNF-α, интерлейкины 6 и Iβ) активируют фактор транскрипции NFкβ и ингибируют Akt/mTOR-сигнальный путь, что приводит к уменьшению синтеза и увеличению деградации белков мышц [Mitch, 20011. Экспрессия атрогина-1 повышается в условиях воспаления и оксидативного стресса [Enoki, 2016]. У больных с ХБП отмечено повышенное содержание и других маркеров активации УПС: фрагмента актина молекулярной массой в 14 кДа и убиквитинизированного С-концевого фрагмента актина [Du, 2004; Fahal, 2014]. Показано также, что апрегуляция УПС и каспазы-3 происходит под влиянием ангиотензина II [Du, 2004; Boivin, 2010; Avin, 2015]. УПС активируется также в условиях метаболического ацидоза и уремии. Индоловые белковосвязанные уремические токсины (индоксилсульфат, индолиуксусная кислота, индоксилглюкуронид) являются лигандами арилгидрокарбонового рецептора, функционирующего как компонент убиквитинлигазного комплекса [Sallee, 2014]. При этом диета с высоким содержанием белка, рекомендуемая больным, получающим ЗПТ, способствует увеличению образования и накопления в организме индоксилсульфата [Sallee, 2014]. Низкомолекулярные водорастворимые уремические токсины (мочевая кислота, щавелевая кислота) способны индуцировать окислительный стресс.
Во время сеанса гемодиализа происходит усиление протеолиза в мышцах. Применение изотопных методик (введение аминокислот, меченных изотопами) показало, что во время ГД общий уровень протеолиза увеличивается на 10%, а уровень протеолиза в мышцах — на 133% [Ikizler, 2002]. Точные механизмы этого явления требуют уточнения, однако известно, что во время процедуры гемодиализа происходит потеря аминокислот с диализатом и активация воспаления.
Ключевым анаболическим гормоном является инсулин, который стимулирует гипертрофию мышц путем повышения секреции инсулиноподобного фактора роста-1 (IGF-1). Предполагается, что анаболический эффект системы инсулин/ IGF-1 заключается в большей степени в замедлении протеолиза, чем в стимуляции синтеза белка [Nitta, 2016]. Инсулинорезистентность характерна для больных с ХБП [Мак, 1992]. Более высокая степень инсулинорезистентности у больных на ГД, не страдающих сахарным диабетом, коррелирует с более выраженным протеолизом [Siew, 2007]. Известно также, что больные с диабетом 2-го типа, получающие лечение ГД, имеют большую скорость потери мышечной массы, чем недиабетики [Pupim, 2005]. Применение росиглитазона, агониста рецепторов, активирующих пролиферацию пероксисом (PPARy), снижающего инсулинорезистентность, подавляло протеолиз в мышцах лабораторных животных [Wang, 2006]. Саркопения может усугублять течение сахарного диабета, поскольку мы-шечная ткань потребляет большое количество глюкозы, и снижение мышечной массы может привести к нарушениям метаболизма углеводов.
Уремия, провоспалительные цитокины, метаболический ацидоз, ангиотензин II действуют по общему механизму, нарушая функционирование системы инсулин/IGF-l через Р13-киназа/Ак1-сигнальный путь [Nitta, 2016]. Показано, что при ХБП развивается не только инсулинорезистентность, но и резистентность к IGF-I, что подавляет действие гормона роста (соматотропина), поскольку IGF-1 вырабатывается в печени под действием соматотропина и опосредует его эффекты [Rabkin, 2005; Fahal, 2014]. Назначение рекомбинантного гормона роста больным на ГД приводило к увеличению тощей массы тела [Hansen, 2000; Feldt- Rasmussen, 2007].
Физиологическим антагонистом IGF-I является миостатин, белок из семейства TGF-β, источниками которого являются скелетная мускулатура, миокард и жировая ткань. Миостатин индуцирует апоптоз миоцитов и ингибирует дифференциацию миобластов в миоциты. Существует концепция, которая рассматривает миостатин и IGF-I как работающие в едином механизме «тормоз» и «акселератор» [Chien, 2013]. У мышей, нокаутных по миостатину, увеличивается количество быстрых мышечных волокон, активно использующих анаэробный гликолиз, и уменьшается количество медленных, использующих кислородный метаболизм. Мышечная масса у таких животных возрастает на 25% по сравнению с обычными (wild-type) мышами, но удельная (на грамм мышечной ткани) мышечная сила снижается на 50% [Amthor, 2007]. Ингибиция миостатина (либо мембранных рецепторов активина П В, с которыми связывается миостатин, инициируя общий для TGF-семейства SMAD-зависимый механизм трансдукции сигнала) приводит к интенсификации β-окисления жирных кислот, биогенеза митохондрий, образования бурого жира и гликогена, увеличению термогенеза, повышению чувствительности тканей к инсулину [Breitbart, 2011]. При этом не до конца ясно, связано ли повышение чувствительности к инсулину непосредственно с действием миостатина или обусловлено ростом мышечной массы. Уровень миостатина закономерно снижается с возрастом и повышается при бездействии мышц и воспалении [Zhang, 20111. Физическая нагрузка снижает уровень циркулирующего миостатина [Buehring, 2013].
Уровень циркулирующего миостатина закономерно повышается по мере снижения скорости клубочковой фильтрации и клиренса креатинина [Zhang, 2011; Yano, 2015]. Причина этого не вполне ясна, хотя известно, что TNF-α стимулирует экспрессию миостатина, а при ХБП происходит нарастание уровня циркулирующих провоспалительных цитокинов [Zhang, 2011].
Сведения относительно роли миостатина у больных, получающих ЗПТ, на сегодняшний день представлены в единичных статьях. У больных на ГД уровень циркулирующего миостатина оказался ниже, чем в контроле (практически здоровые люди), независимо от транспортных характеристик мембраны диализатора [Нап, 2011]. Однако при использовании высокопроницаемых (high-flux) диализных мембран возможно удаление миостатина: молекулярная масса активного димера миостатина составляет 25 кДа, а эти мембраны способны пропускать молекулы массой до 60 кДа. Это доказывается тем, что при диализе с применением мембран high-flux уровень миостатина в крови снижался на 36%, а при использовании мембран с обычной проницаемостью (low-flux) — повышался на 25% даже после коррекции на гемоконцентрацию [Нап, 2011]. Преддиализный уровень миостатина оказался ниже у больных, получавших диализ на мембранах high-flux, причем показатели силы кистевого хвата в этой группе были достоверно выше.
Уровень циркулирующего миостатина у больных на ПД зависел от возраста, пола, тощей массы тела и приема агонистов рецепторов витамина D [Yamada, 2016]. Авторы высказывают предположение, что уровень циркулирующего миостатина у больных, получающих ЗПТ, зависит, в первую очередь, от массы скелетной мускулатуры. Вследствие этого определение референтных значений уровня миостатина в крови для всей популяции этих пациентов является трудновыполнимой задачей, и, по-видимому, более важна динамика этого показателя у каждого конкретного больного.
Саркопения может быть обусловлена и нарушением баланса половых гормонов. У мужчин, получающих ЗПТ, как правило, снижен уровень тестостерона, обладающего анаболическим действием [Carrero, 2011]. У женщин часто снижен уровень эстрогенов, также влияющих на мышечную силу: показано, что сила мышц у женщин максимальна в той фазе менструального цикла, когда максимальна концентрация эстрогенов в крови [Fahal, 2014].
ХБП ассоциирована с дисфункцией митохондрий. Митохондрии непосредственно участвуют не только в синтезе АТФ, но и в целом ряде других синтетических процессов, поэтому митохондриальная дисфункция приводит не только к энергетической, но и к белковой недостаточности. Митохондриальная дисфункция стимулирует апоптоз и оксидативный стресс. Исследование генома мо- нонуклеаров периферической крови у больных с ХБП 4-5 стадии, получающих как консервативное лечение, так и ЗПТ, выявило апрегуляцию 44 генов, 11 из которых (25%) кодируют белки, участвующие в процессе окислительного фосфорилирования [Granata, 2009]. Активность 4-го комплекса дыхательной цепи у этих больных была достоверно ниже, чем у здоровых лиц из контрольной группы. Процедура гемодиализа приводит к усугублению дисфункции митохондрий: количество лимфоцитов периферической крови, на мембране митохондрий которых отсутствует электрохимический потенциал, к концу сеанса гемодиализа существенно и достоверно возрастает [Rai, 2007]. Существенных аномалий митохондрий мышц у диализных больных при световой и электронной микроскопии не выявляется, однако при исследовании биоптатов отмечается снижение активности митохондриальных ферментов (цитохром с-оксидазы, цитрат-синтетазы) [Adey, 2000].
Необходимо также упомянуть о существовании концепции так называемого ускоренного старения (accelerated aging) у больных, получающих заместительную почечную терапию [Кооглап, 2013]. Саркопения тесно связана с возрастными изменениями и является одним из общих для старения и почечной дисфункции патофизиологических синдромов.
Методы коррекции саркопении
Безусловно, необходимым условием успешной коррекции саркопении у больных на ГД является обеспечение адекватного диализного лечения. Хорошо известно, что недостаточная эффективность ЗПТ приводит к развитию белковоэнергетической недостаточности. Однако до настоящего времени не проведено ни одного крупного рандомизированного проспективного исследования, посвященного влиянию дозы диализа и вида ЗПТ на саркопению. В исследовании НЕМО не было выявлено преимуществ более высокой дозы диализа перед обычным режимом в отношении нутриционного статуса. Не было также найдено существенных различий при использовании высокопроницаемых и обычных диализных мембран [Nitta, 2016]. В другом исследовании применение ежедневного режима гемодиализа не сопровождалось улучшением нутриционного статуса пациентов по сравнению со стандартным трехразовым диализом [Chertow, 2010]. Данные о влиянии конвекционных методов ЗПТ на нутриционный статус и состояние мышц также неоднозначны.
Медикаментозная терапия саркопении на сегодняшний день разработана не-достаточно. Традиционно для коррекции кахексии и БЭН использовали анаболические стероиды. Так, применение 100 мг нандролона в неделю в течение 24 недель у больных на гемодиализе привело к увеличению тощей массы тела в два раза [Johansen, 2006]. Однако лечение стероидами сопряжено с возникновением целого ряда побочных эффектов: повышение риска сердечно-сосудистых осложнений, эректильная дисфункция, гинекомастия. Помимо этого, лечение анаболиками увеличивает преимущественно мышечную массу, но не силу.
Имеется опыт применения стимулятора аппетита мегестрола ацетата для борьбы с анорексией у больных с ХБП. Пероральное применение мегестрола ацетата по 160 мг в течение 2 мес. привело к достоверному увеличению индекса массы тела и уровня альбумина сыворотки [Boccanfuso, 2000]. Однако мегестрол относится к группе стероидных прогестинов и имеет все характерные побочные эффекты этих препаратов: импотенция, гипогонадизм, повышенный риск тромбоэмболических осложнений. Таким образом, назначение стероидов, по-видимому, может осуществляться только по особым показаниям.
Длительное применение гормона роста также сопряжено с развитием осложнений, среди которых задержка жидкости, артралгии и усугубление инсулинорезистентности. Помимо этого, назначение препаратов соматотропина, как и анаболических стероидов, приводило к достоверному увеличению тощей массы тела, но не оказывало влияния на функциональные показатели мышц [АН, 2014]. Возможной альтернативой представляется использование рилизинг-пептида гормона роста (GHRP-2), который действует как агонист грелина. Длительное интраназальное применение GHRP-2 у пациентов с нервной анорексией способствовало улучшению аппетита и увеличению массы тела при отсутствии каких-либо побочных эффектов [Haruta, 2015].
Ингибиторы АПФ (иАПФ) могут реализовать благоприятный эффект в отношении мышц несколькими путями: улучшение функции эндотелия, метаболической функции мышц, противовоспалительный эффект, стимуляция ангиогенеза; иАПФ улучшают биогенез митохондрий и повышают уровень IGF-I [de Cavanagh, 2003; Maggio, 2006]. Длительный прием иАПФ пожилыми людьми с артериальной гипертензией показал меньшую скорость снижения силы мышц и большую массу мышц нижних конечностей у этих пациентов по сравнению с принимавшими другие антигипертензивные препараты [Onder, 2002]. Однако достоверные сведения относительно влияния иАПФ на массу и функцию мышц у больных с ХБП в настоящее время отсутствуют.
Назначение омега-3 полиненасыщенных жирных кислот (в том числе эйкозапентаеновой кислоты) пациентам с прогрессирующей потерей мышечной массы на фоне раковых заболеваний приводило к стабилизации и (в ряде случаев) увеличению тощей массы тела [Babcock, 2000]. Эйкозапентоеновая кислота обладает противовоспалительными свойствами, ингибируя ядерный транскрипционный фактор NFкβ И уменьшая продукцию TNF-αa [Babcock, 2000; Magee, 2008]. Smith et al. показали, что назначение эйкозапентаеновой кислоты не оказывало влияния на базальный уровень синтеза белка в мышцах, но существенно повышало синтез протеинов в условиях гипераминоацидемии и гиперинсулинемии [Smith, 2011].
Урсоловая кислота, пентациклическое тритерпеновое соединение, содержится во многих продуктах растительного происхождения, употребляемых в пищу (например, в кожуре яблок), и, по-видимому, является активным компонентом ряда народных противодиабетических травяных сборов [Wang, 2010]. Экспериментально показано, что урсоловая кислота вызывает увеличение мышечной массы лабораторных животных, причем эффект зависит от присутствия инсулина и IGF-1 [Kunkel, 2011]. Предполагается, что урсоловая кислота ингибирует тирозиновую фосфатазу РТР1 В, что препятствует инактивации рецепторов инсулина и IGF-1 и способствует развертыванию анаболического эффекта этих гормонов [Sakuma, 2012].
Предлагалось применять в качестве средства для борьбы с потерей мышечной массы аминокислоты с разветвленной цепью или их производные, в частности, метаболит лейцина β-гидрокси-β-метилбутират. Применение этого препарата у больных на ГД в течение 6 мес., однако, не привело к изменениям в составе тела, силе мышц, плотности костей, физической активности и качестве жизни [Argiles, 2016; Fitschen, 2016].
В настоящее время на стадии клинических испытаний находится ряд препаратов, снижающих уровень циркулирующего миостатина или подавляющих его активность. Полученные данные неоднозначны. Применение препарата растворимого ложного (decoy) рецептора ActRllB (АСЕ-031) у здоровых женщин в постменопаузе привело к значимому росту мышечной массы (на 3—5% через 1—2 мес.), но не к увеличению мышечной силы [Attie, 2013]. Попытка применения рекомбинантных антител к миостатину (MYO-029) у пациентов с различными типами мышечной дистрофии не дала клинического эффекта [Krivickas, 2009]. Целесообразность прямой коррекции уровня циркулирующего миостатина, применения ингибиторов или блокаторов рецептора миостатина у больных на ГД требует дополнительных исследований.
На сегодняшний день наилучшей стратегией профилактики и лечения саркопении у больных, получающих ЗПТ, представляется сочетание физических упражнений с адекватной нутриционной поддержкой [Yu, 2016]. При этом интенсификация питания сама по себе, без сочетания с физическими нагрузками, приводит к увеличению мышечной массы только у молодых людей с низкой коморбидностью, но малоэффективна у прочих пациентов на диализе [Franch, 2009]. Показано, что высокая пищевая нагрузка приводит к увеличению как синтеза, так и деградации белка. Важным моментом, однако, является то, что деградации при этом подвергаются преимущественно «старые», подвергшиеся посттрансляционной модификации белки (например, гликозилированные, окисленные или нитрозилированные) [Kopple, 1997].
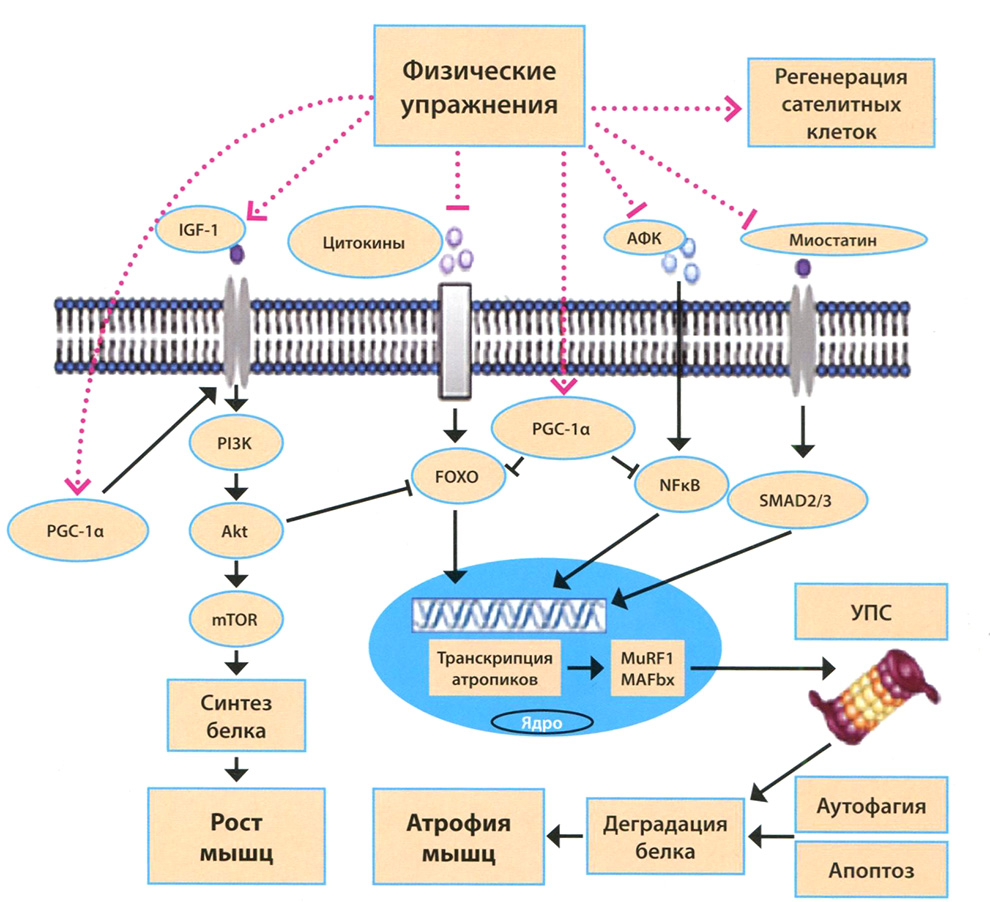
Рис. 1.7. Сигнальные пути реализации эффекта физических упражнений (noT.S. Bowen et al., 2015)
АФК — активные формы кислорода; УПС — убиквитин-протеасомная система; IGF-1 —инсулиноподобный фактор роста-1; PGC-1α — коактиватор 1 альфа рецептора активатора пероксисом; PI3K — фосфоинозитид-3-киназа; FOXO — транскрипционный фактор семейства forkhead box класса О; NFKB — ядерный фактор транскрипции каппа-В; SMAD2/3 —транскрипционные модуляторы группы SMAD; Akt — протеинкиназа В; mTOR — протеинкиназная субъединица сигнальных комплексов mTORCI и 2; MuRF1, MAFbx —убиквитиновые ЕЗ-лигазы
Эффект физических упражнений у больных на ГД в виде увеличения количества мышечных волокон и массы мышц был показан и подтвержден гистологически еще около двух десятилетий назад [Kouidi, 1998]. Физические упражнения способны противодействовать целому ряду этиологических факторов саркопении, в том числе активации УПС, воспалению, активации ренин-ангиотензино- вой системы, митохондриальной дисфункции. При физической нагрузке происходит стимуляция анаболических процессов в мышцах и снижается экспрессия миостатина. К настоящему времени известно, что при физических нагрузках активируется целый ряд сигнальных путей в клетках (рис. 1.7). Так, повышение внутриклеточного кальция активирует кальций/кальмодулинзависимую протеинкиназу II (СаМК II), механическое растяжение мышцы — митоген-активируемые протеинкиназы (МАРК) и c-Jun-N-терминальную киназу (JNK), изменения соотношений NAD/NADH и АМФ/АТФ — сиртуины и АМФ-активируемую протеинкиназу (АМРК). В результате происходит стимуляция PPARα- и PGClα- сигнальных путей, что приводит к индукции биогенеза митохондрий, увеличению утилизации жирных кислот и в конечном счете — к гипертрофии и гиперплазии мышечной ткани [Bowen, 2015; Baskin, 2015].
Хорошо известно положительное влияние аэробных упражнений на кардиореспираторную систему [Konstantinidou, 2002; Chen, 2013]. Однако анаболическим действием на мышцы в большей степени обладают резистивные нагрузки. Инсулинорезистентность при диабете и метаболическом синдроме коррелирует с преобладанием «быстрых» мышечных волокон. Резистивные упражнения увеличивают количество «медленных» волокон, что способствует преодолению инсулинорезистентности [Chen, 2013]. Представляется целесообразным проводить резистивные упражнения непосредственно во время сеанса гемодиализа, когда скорость катаболизма в мышцах достигает пика. Существуют данные о том, что подобная схема приводит к увеличению силы и поперечного сечения мышц [Johansen, 2012], а также повышению содержания в мышцах мРНК, IGF-1 и увеличению тощей массы тела [Kopple, 2007]. Kirkman et al. в рандомизированном контролируемом исследовании показали, что применение интрадиализных резистивных упражнений приводит к достоверному увеличению объема и силы мышц даже без дополнительной нутритивной супплементации [Kirkman, 2014]. Важной особенностью этого исследования было постепенное возрастание нагрузок. Однако ряд других рандомизированных контролируемых исследований по применению резистивных упражнений у больных на гемодиализе не дал однозначных результатов как в отношении размеров и массы мышц, так и в отношении мышечной силы [Cheema, 2007; Dong, 2011].
Таким образом, несмотря на то что благоприятный эффект физических упражнений для пациентов, получающих заместительную почечную терапию, в настоящее время не подлежит сомнению, проблема выбора характера, интенсивности и регулярности физических нагрузок для этой категории пациентов требует дальнейшего изучения.
Заключение
Саркопения — синдром, характеризующийся прогрессирующей генерализованной потерей массы, силы и работоспособности скелетной мускулатуры, имеет широкую распространенность у больных, получающих заместительную почечную терапию.
Диагностические критерии саркопении у пациентов, получающих диализное лечение, требуют дальнейшего уточнения.
Саркопения уменьшает качество жизни, увеличивает вероятность госпитализации и является независимым предиктором смертности у больных, получающих заместительную почечную терапию.
Этиология саркопении у больных, получающих заместительную почечную терапию, является многофакторной.
В соответствии с этим лечебные мероприятия, направленные на коррекцию саркопении, должны быть разнонаправленными, однако физические нагрузки на сегодняшний день представляются наилучшей стратегией профилактики и лечения саркопении. В связи с этим оценка уровня физической активности и лечебная физкультура являются необходимой частью курации больных, получающих заместительную почечную терапию.
Вы читали отрывок из книги "Реабилитация больных на гемодиализе" - Смирнов А. В.
Книга "Реабилитация больных на гемодиализе"
Автор: Смирнов А. В.

В руководстве отражены современные представления о причинах и механизмах нарушения физического функционирования пациентов с хронической болезнью почек, получающих лечение программным гемодиализом. Уделено большое внимание патогенезу формирования белково-энергетической недостаточности и саркопении, как основным факторам нарушения физического состояния больных. Представлены возможности диагностики основных вариантов белково-энергетической недостаточности. Намечены возможные направления их коррекции. Впервые в отечественной научной медицинской литературе детально освещены возможности и методики регулярных физических тренировок в столь сложной когорте пациентов, имеющих изменения практически всех основных систем организма.
Для больных, которые не могут выполнять физические нагрузки в тренирующем режиме, специально разработана, опробована на репрезентативной выборке, обоснована и подробно рассмотрена новая реабилитационная методика, не применявшаяся ранее в нефрологии — накожная билатеральная электростимуляция мышц нижних конечностей. Приведены собственные данные длительного наблюдения за больными, которые подтверждают возможности представленных методик не только в плане улучшения физической работоспособности, но и в отношении улучшения адекватности диализа и качества жизни.
Для нефрологов и врачей других специальностей.
Глава 1. Факторы ограничения жизнедеятельности и физической работоспособности пациентов с терминальной почечной недостаточностью
1.1. Белково-энергетическая недостаточность и воспалительный стресс
1.2. Саркопения у больных, получающих заместительную почечную терапию
Глава 2. Методология оценки нарушений функций организма и ограничения жизнедеятельности при терминальной почечной недостаточности
2.1. Методы оценки нарушений функций организма
2.1.1. Виды нарушений функций организма человека
2.1.2. Оценка ограничения жизнедеятельности
2.2. Оценка качества жизни пациентов с терминальной почечной недостаточностью
Приложение. Опросник KDQOL-SF™ 1.3
Глава 3. Антропометрические и лабораторные методы оценки физического состояния больного
3.1. Антропометрические и лабораторные методы диагностики белково-энергетической недостаточности
3.1.1. Диетическая оценка
3.1.2. Субъективная глобальная оценка
3.1.3. Функциональные тесты
3.1.4. Лабораторная оценка
3.1.5. Антропометрические показатели и показатели состава тела
3.1.6. Основные принципы лечения белково-энергетической недостаточности питания у пациентов, получающих лечение хроническим гемодиализом
Приложения. Нормативы потребления основных питательных веществ у пациентов, получающих лечения хроническим гемодиализом
A. Потребление белка
Б. Калорийность диеты
B. Потребления основных минералов
3.2. Биоимпедансометрия
3.3. Тест с 6-минутной ходьбой
Глава 4. Физическая реабилитация пациентов с ХБП
4.1. Общие принципы применения дозированных физических нагрузок и их эффективность
4.2. Влияние дозированных физических нагрузок в междиализный период на функциональное состояние организма пациентов с ХБП, получающих лечение гемодиализом
4.2.1. Влияние дозированных физических нагрузок на показатели пищевого статуса
4.2.2. Влияние дозированных нагрузок на динамику физической работоспособности
4.2.3. Влияние дозированных физических нагрузок на состояние сердечно-сосудистой системы
4.2.4. Динамика артериального давления по результатам суточного мониторирования
4.2.5. Динамика пульсового давления по результатам суточного мониторирования
4.2.6. Влияние дозированных физических нагрузок на структурно-функциональные особенности миокарда левого желудочка
4.2.7. Влияние дозированных физических нагрузок на выраженность анемии
4.2.8. Влияние дозированных физических нагрузок на дислипидемию
4.2.9. Влияние дозированных ФН на состояние дыхательной системы
4.2.10. Причины нерегулярности занятий лечебной гимнастикой
4.2.11. Кумулятивная выживаемость больных на фоне дозированных физических нагрузок
4.2.12. Интердиализные тренировки: механизмы действия и возможные ограничения
Приложения
Примерный комплекс упражнений I двигательного режима
Примерный комплекс упражнений II двигательного режима
Примерный комплекс упражнений III двигательного режима
4.3. Дозированные физические нагрузки на велотренажере
4.4. Накожная билатеральная электростимуляция мышц (НБЭМ) нижних конечностей
Приложения
Опросник оценки выраженности ограничений жизнедеятельности
Бартел, адаптированный для пациентов с ХБП
Шкала Борга для оценки восприятия тяжести физической нагрузки и выраженности одышки и усталости
Рекомендации по организации и выполнению дозированных
физических нагрузок на велотренажере во время сеанса ГД
Рекомендации по выполнению накожной билатеральной электростимуляции мышц нижних конечностей во время сеанса ГД































































































0 комментариев