Поражение сердечно-сосудистой системы при Long-COVID инфекции. Часть 3. Лекция для врачей
Методические рекомендации. «Особенности течения LONG-COVID инфекции. Терапевтические и реабилитационные мероприятия». Часть 3. "Поражение сердечно-сосудистой системы при Long-COVID инфекции"
Лонг-ковид: что такое лонг-ковид и как с ним бороться? Часть 1
Поражение дыхательной системы при LONG-COVID инфекции. Часть 2
Поражение эндокринной системы при Long-COVID инфекции. Часть 4
Поражение почек при Long-COVID. Часть 5
Ревматизм. Long-COVID инфекции. Часть 6
Неврологические заболевания. Long-COVID инфекции. Часть 7
Психиатрия. Long-COVID инфекции. Часть 8
Детский мультисистемный воспалительный синдром, ассоциированный с COVID-19. Часть 9
Мультисистемный воспалительный синдром у взрослых, ассоциированный с COVID-19. Часть 10
Медицинская реабилитация при Long-COVID инфекции Часть 11
Поражение сердечно-сосудистой системы при Long-COVID инфекции
Актуализация проблемы - эпидемиологические данные. В течение последнего года накапливаются данные наблюдательных исследований, показывающие высокую частоту кардио-респираторных симптомов и увеличение риска развития и декомпенсации сердечно-сосудистой патологии у пациентов в отдаленном периоде после перенесенной коронавирусной инфекции.
Так в наблюдательном ретроспективном когортном исследовании, проведенном в Великобритании, было проанализировано состояние здоровья почти 48 тысяч человек, которые были госпитализированы по поводу COVID-19.
Оценка проводилась в течение 140 дней после выписки из стационара в сравнении с контрольной группой (пациенты госпитализированные в этот же период по другим причинам), сопоставимой по демографическим и клиническим характеристикам. За время наблюдения в группе пациентов, перенесших коронавирусную инфекцию 29,4% пациентов были госпитализированы снова, а 12,3% – умерли. Риск повторной госпитализации и смерти в течение года после COVID-19 был в 3,5 и 7,7 раз выше, чем в контрольной группе.
Согласно подсчетам, на 1000 человек, выписанных из больницы после COVID-19, в течение года диагностируется 66 новых случаев тяжелых осложнений со стороны сердечно-сосудистой системы. Среди пациентов после перенесенной коронавирусной инфекции в сравнении с контрольной группой в 3 раза чаще развиваются новые случаи МАСЕ (major adverse cardiovascular events- сердечная недостаточность, инфаркт миокарда, инсульт, аритмия).
В недавно опубликованной в журнале Ланцет исследовании на основе регистра Щвеции показано увеличение риска развития инфаркта миокарда (ИМ) и нарушения мозгового кровообращения (НИМК) через 1-4 недели после COVID- 19. Инциденты ИМ и НМК были изучены в когорте пациентов (86742 человек) в сравнении с контрольной группой, сопоставимой по полу, возрасту, социально- экономическим факторам и клиническому статусу. При проведении когортного анализа показано увеличение более чем в 3 раза риска развития НМК и ИМ через 2 недели после COVID-19 в равнении с контрольной группой: ИМ - 3.41 (1.58–7.36), НМК - 3.63 (1.69–7.80). Таким образом, было сделано заключение - COVID-19 является независимым фактором риска развития инфаркта миокарда и инсульта и острые сердечно-сосудистые осложнения могут представлять собой существенное клиническое проявление COVID-19, и долгосрочные последствия могут стать проблемой для будущего.
Многочисленные наблюдательные исследования показали высокую частоту кардио-респираторных симптомов у пациентов после перенесенной коронавирусной инфекции. Так в Китайском исследовании было показано, что через 6 месяцев после перенесенного COVID-19 5-29% пациентов сообщали о боли в грудной клетке, одышке или сердцебиениях.
В обзоре Mandeep Garg et al. 2021 показан значительный разброс частоты встречаемости различных кардио-респираторных жалоб в отдаленном периоде после перенесенной инфекции (3-4 недели и более) - одышка встречается у 7,7 - 89,5% пациентов, боль в грудной клетке - у 13,1-73,1% респондентов и сердцебиения в 11,2-54,9% случаев.
Кардио-респираторные жалобы, сердечно-сосудистые заболевания могут развиваться как у пациентов после перенесенного тяжелого и среднетяжелого COVID-19, так и у малосимптомных и бессимптомных лиц. Пациенты с манифестирующей сердечно-сосудистой патологией в остром периоде коронавирусной инфекции, как правило, находятся под наблюдением и в этой ситуации быстрее происходит корректировка терапевтических стратегий.
Пациенты с дебютом кардио-респираторной симптоматики после COVID-19 требуют особого внимания и своевременной оценки для исключения/подтверждения сердечно-сосудистых осложнений.
Факторы риска развития и патогенез долгосрочных сердечно-сосудистых осложнений COVID-19 Среди предикторов долгого ковида традиционно обсуждаются следующие: возраст пациентов, тяжесть течения заболевания в острой фазе, степень отклонения лабораторных показателей, коморбидный фон и т.д. (Рис 1).
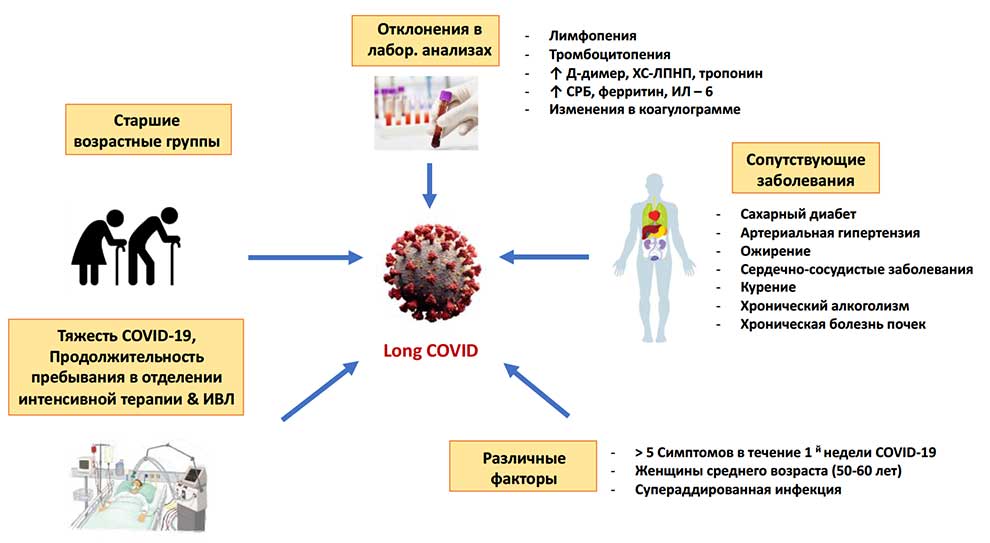
Рис. 1. Предикторы/факторы риска Long-COVID
COVID-19 - ассоциированные сердечно-сосудистые осложнения в остром периоде предопределяют и долгосрочные сердечно-сосудистые расстройства (Рис 2)
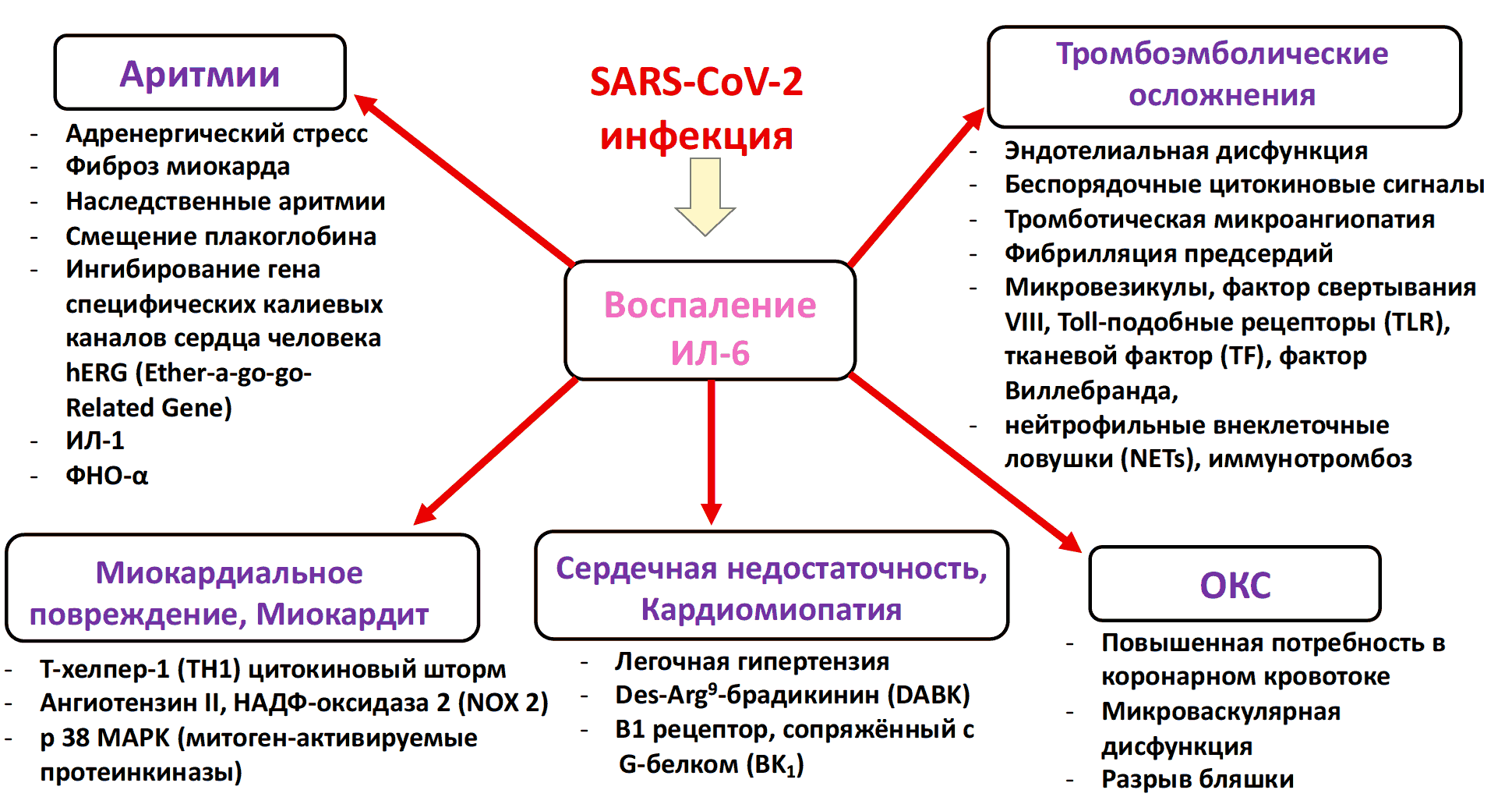
Рис. 2. Патофизиологические механизмы COVID-19 ассоциированных сердечно-сосудистых расстройств
Обсуждаются следующие патофизиологические механизмы поражения сердечно-сосудистой системы при COVID-19:
- Дисрегуляция иммунной системы (хроническое воспаление, аутоиммунные реакции);
- Дисрегуляция РААС;
- Сосудистое повреждение, эндотелиопатия;
- Гиперкоагуляция с тромбообразованием в микрососудах.
Механизмы поражения иммунной системы при COVID-19
Специфический цитокиновый профиль этого заболевания включает: индукцию выработки интерферона, интерлейкина 2 и 7, стимуляцию активности гранулоцитов и продукцию фактора некроза опухоли, что приводит к неконтролируемому внутрисосудистому гипервоспалению с нарушением ангиогенеза и гиперкоагуляции. COVID-19 может быть триггером развития вторичных заболеваний ассоциированных с иммуносупрессией и присутвием вируса, а также аутоиммунными реакциями. Описаны иммунные паттерны, связанные с прогрессированием и тяжестью заболевания у пациентов с COVID-19.
Лонгковид может отличаться по характеру иммунной активации или по генерации аутоантител. Нарушение регуляции иммунного ответа также влияет на физиологические функции эндотелия сосудов (развитие эндотелиита) и лежит в основе многих осложнений при COVID-19, главным образом тромбоэмболического характера. Соответственно, сохранение эндотелиальных воспалительных механизмов может способствовать появлению хронических симптомов.
Ренин-ангиотензин-альдостероновая система и COVID-19 25
Патогенез поражения сердечно-сосудистой системы при коронавирусной инфекции связан с экспрессией рецепторов ангиотензин-превращающего фермента 2 (АПФ2) в клетках сердечно-сосудистой системы, особенно в сосудистом эндотелии. АПФ2 жизненно важен для сердечно-сосудистой и иммунной систем для поддержания гомеостаза. Предполагается, что ключевые механизмы развития сердечно-сосудистых осложнений и недавно описанного длительного COVID связаны с прямыми последствиями взаимодействия вирусного S-белка с АПФ2, с понижением активности АПФ2 (downregulation) и развивающемся в результате повреждением иммунной и сердечно-сосудистой систем. АПФ2 принадлежит - ключевая роль в регуляции метаболизма ангиотензина II (АII) и брадикинина. Снижение активности AПФ2 (downregulation) связано с развитием цитокинового и брадикининового шторма.
Подавление эффектов АПФ2 приводит к увеличению уровня АII с развитием системной вазоконстрикции, воспаления и фиброза. Значение дисрегуляции РААС и кинин-калликреиновой системы (ККС) в развитии сердечно-сосудистых осложнений коронавирусной инфекции не вызывает сомнений.
Эндотелиопатия с гиперкоагуляцией
Не вызывает сомнений роль сосудистого повреждения и гиперкоагуляции в патогенезе острой инфекции SARS-CoV-2. При этом для обозначения этого патологического состояния используются различные термины: микротромбоваскулит, эндотелиит, дисфункция эндотелия с микротромбозом и т.д. Однако остается не до конца ясным значение этих нарушений в патогенезе синдрома длительного COVID-19.
Большой интерес представляет исследование, опубликованное в Journal of Thrombosis and Haemostasis, которое показывает роль длительно существующей дисфункции эндотелия с активацией эндотелиальных клеток и гиперкоагуляции при лонг COVID-19.
Было обследовано 50 пациентов в среднем через 68 дней после выписки из стационара или после регресса симптомов SARS-CoV-2. Показано статистически значимое увеличение показателей теста генерации тромбина (эндогенный тромбиновый потенциал, максимальное количество тромбина) в сравнении с контрольной группой. Также выявлено увеличение плазменного уровня фактора VIII и фактора Виллебранда (синтезируется в эндотелии и мегакариоцитах, стабилизирует циркулирующий фактор VIII, является маркером дисфункции эндотелия) и растворимого тромбомодулина в группе реконвалесцентов COVID-19.
Впервые продемонстрировано, что устойчивая эндотелиопатия сохраняется до 10 недель после острой инфекции SARS-CoV-2. Эти результаты представляют интерес, учитывая решающую роль, которую играет эндотелиопатия в патогенезе острого COVID-19. Однако потребуются дальнейшие клинические испытания с достаточной мощностью, чтобы определить, играет ли эта устойчивая активация эндотелиальных клеток и гиперкоагуляция роль в стратификации пациентов с повышенным риском тромботических событий после разрешения острой инфекции SARS-CoV-2, которые могут извлечь выгоду из тромбопрофилактики после выписки и/или патогенеза синдрома длительного COVID-19.
Повреждение сердечно-сосудистой системы осуществляется посредством различных механизмов, которые могут быть причиной манифестации сердечно-сосудистой патологии в отдаленный период после перенесенной коронавирусной инфекции.
Механизмы миокардиального повреждения: вирусный миокардит, повреждение кардиомиоцитов на фоне гипервоспалительного синдрома и цитокинового шторма; инфаркт миокарда 1 и 2 типа (Т1ИМ и Т2ИМ); микрососудистая дисфункция на фоне эндотелиопатии, микротромбоза; тромботические события (ТЭЛА с формированием острого и хронического легочного сердца).
Подъем тропонина, отмечается примерно у 20–30% госпитализированных пациентов, сильно коррелирует со смертностью, увеличивая риск смерти в 2–5 раз в зависимости от степени повышения. По мере изучения сердечно-сосудистых расстройств при COVID-19 было показано, что миокардиальное повреждение в основном является инфарктом миокарда 2 типа (T2MI) в условиях повышенной потребности в кислороде из-за системного воспаления. Острый коронарный синдром и миокардит как варианты повреждения миокарда встречаются реже.
Обсуждаются следующие механизмы коронарной микрососудистой дисфункции при COVID-19, которые продолжают играть важную роль в прогрессировании и дебюте симптомов в отдаленном периоде после перенесенной инфекции: дисрегуляция РААС и ККС; системное гипервоспаление и протромботический статус; пневмония/ОРДС с системной гипоксией; эндотелиопатия (Рис 3)
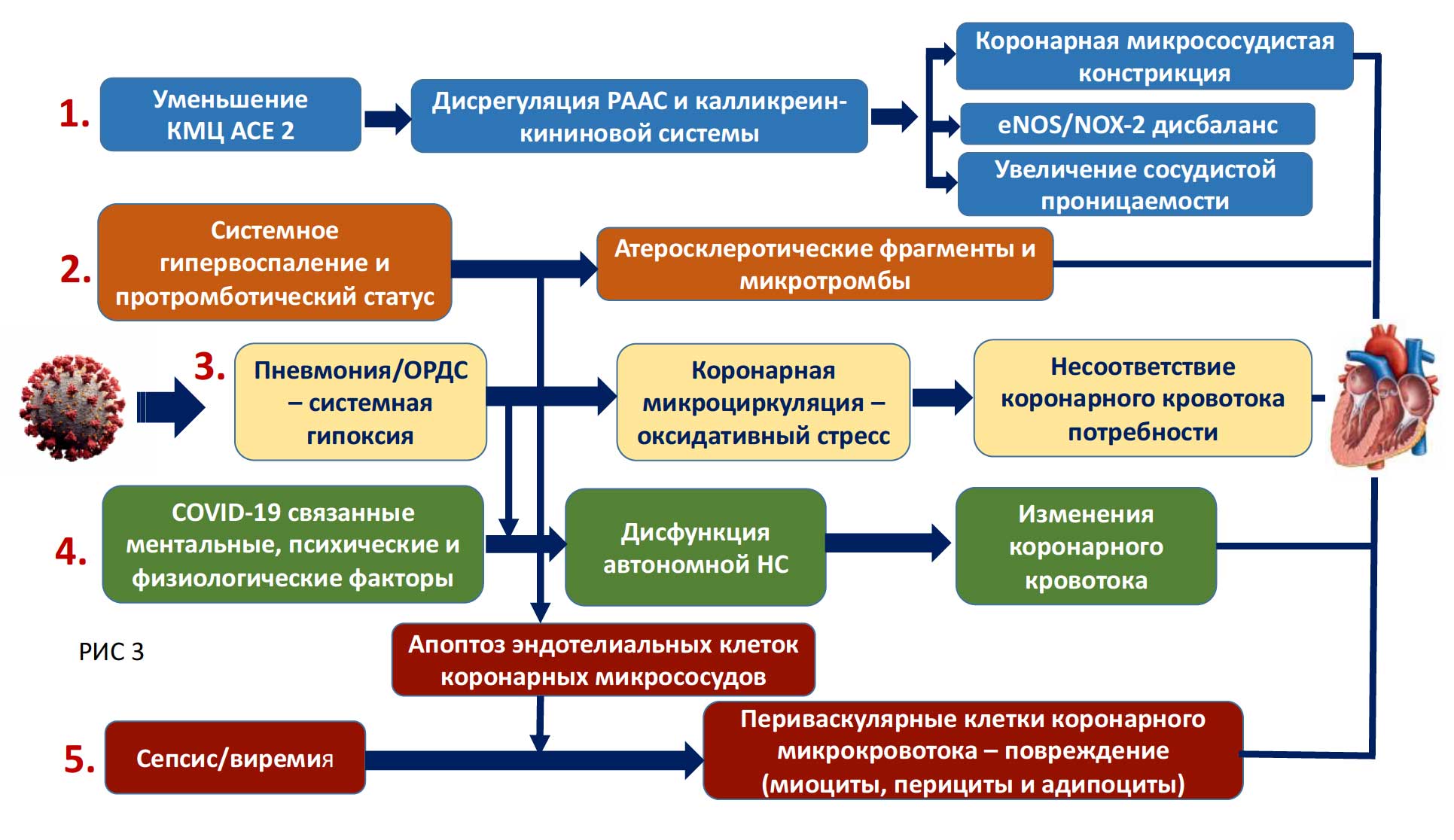
Рис. 3. Механизмы коронарной микрососудистой дисфункции
Основываясь на данных аутопсии миокардит при остром COVID-19 был относительно редким осложнением (менее 4.5%) и в большинстве случаев имел лимфоцитарный характер. Вирусные включения встречаются редко, что подтверждает воспалительный, а не вирусный характер повреждения.
Однако необходимо отметить, что крупных исследованием с эндомиокардиальной биопсией не проводилось. Не диагностированное в период острой инфекции миокардиальное повреждение в отдаленном периоде приводит к формированию сердечной недостаточности и дебюту аритмий.
Клиническая картина синдрома длительного COVID-19 - сердечно-сосудистые расстройства
Манифестация после перенесенной коронавирусной инфекции Кардиальные симптомы, такие как сердцебиения, боль и дискомфорт в грудной клетке (стеснение в груди), плохая переносимость физической нагрузки, головокружение, высокая ЧСС в состоянии покоя могут стать клинической дилеммой. Эти симптомы проявляются как у госпитализированных пациентов, так и после легких форм заболевания. Нет четкой связи сердечно-сосудистых симптомов при долгом COVID-19 с ранее существовавшей сердечно-сосудистой патологией. Клиницисты должны четко дифференцировать две клинически ситуации – кардиореспираторные симптомы как неспецифическое проявление синдрома длительного COVID-19 или манифестация патологии сердечно-сосудистой системы.
Спектр патологии сердечно-сосудистой системы после перенесенной коронавирусной инфекции достаточно широк: сердечная недостаточность, аритмии, внезапная сердечная смерть, коронарная болезнь сердца, коронарная микрососудистая дисфункция с коронарной недостаточностью, формирование аневризм коронарных артерий и аорты, гипертония, лабильная ЧСС и реакция АД на физическую активность, ускорение процессов атерогенеза, венозный и артериальный тромбоэмболизм и т. д.
Миокардит, перикардит
Пристальное внимание клиницистов к диагностике миокардита после перенесенной коронавирусной инфекции COVID-19 было связано с публикацией нескольких исследований в середине 2020 года, которые выявили тревожно высокую распространенность изменений при визуализации миокарда и наводили на мысль о высокой частоте повреждения миокарда и воспаления.
В последующих исследованиях с анализом контрольных групп, применением методики взвешивания, с использованием метода слепой оценки МРТ несколькими независимыми радиологами и применением валидированных критериев диагностики был сделан вывод, что высокая частота миокардита после перенесенного COVID-19 была переоценена.
Результаты более поздних, более масштабных исследований предполагают, что миокардит встречается относительно редко и вряд ли будет частой причиной развития симптоматики долгого COVID-19 особенно в случаях бессимптомного или легкого течения COVID-19 в остром периоде. Кроме того, отек миокарда, который относительно часто встречается у пациентов, выздоровевших после тяжелой формы COVID-19, по-видимому, имеет ограниченные клинические последствия, особенно при отсутствии других клинических признаков, таких как систолическая дисфункция, повышение уровня сердечных биомаркеров или аномалии ЭКГ.
Необходимы дальнейшие исследования для разработки протоколов скрининга миокардита у пациентов, перенесших коронавирусную инфекцию, пошаговый подход для диагностики, основанный на симптомах и экономически эффективных методах кардиодиагностики.
Крайне мало работ, посвященных анализу случаев перикардита и/или перикардиального выпота после перенесенной коронавирусной инфекции. Перикардит присутствовал всего у 0,3% спортсменов, которые систематически наблюдались после COVID-19 в одном исследовании, в другой работе признаки перикардита были обнаружены в одного из 59 спортсменов, перенесших COVID-19. Puntmann et al. сообщили, что у 20% пациентов был перикардиальный выпот >1 см на МРТ против 7% в контрольной группе. В двух исследованиях Kotecha et al. и Moulson et al. Каждый сообщалось о 5% случаев перикардиальным выпотом, в основном небольшого размера. В целом, похоже, что небольшие перикардиальные выпоты могут быть относительно распространены у пациентов после COVID-19, но перикардит, особенно с симптомами, встречается реже.
Демаскированная коронарная болезнь сердца
По данным различных исследований до 20–30% пациентов, госпитализированых с COVID-19, демонстрируют повышение уровня тропонина, чаще всего в результате Т2ИМ. T2ИМ не следует игнорировать после разрешения острого COVID-19. В исследовании, проведенном до пандемии коронавирусной инфекции, среди 2122 пациентов с повышением тропонина во время госпитализации 5-летняя смертность от всех причин составила 62,5% у лиц с T2ИМ по сравнению с 36,7% у людей с инфарктом миокарда 1 типа (T1ИМ).
У пациентов, госпитализированных с COVID-19, повышение тропонина было связано с 3–6 раз большей вероятностью истории коронарной болезни сердца.
Пациенты после перенесенного COVID-19 имеют в 3 раза более высокую вероятность серьезного неблагоприятного сердечно-сосудистых событий в течение 5 месяцев после выписки по сравнению с контрольной группой сопоставимой по возрасту, полу и фактором риска.
Из всего вышесказанного следует сделать вывод – пациенты, имеющие во время острого периода COVID-19 повышение тропонина, а также лица с факторами сердечно-сосудистого риска смогут потребовать более тщательного мониторинга и диагностического поиска при развитии кардиореспираторной симптоматики в отдаленном постковидном периоде для выявления лиц с субклинической ишемической болезнью сердца и своевременного назначения терапии.
Аритмии
Изучению аритмических событий у пациентов госпитализированных с COVID-19 посвящено достаточное количество работ. Показано увеличение риска развития различных аритмий, доминирующими являются следующие – фибрилляция предсердий (ФП), суправентрикулярная и желудочковая экстрасистолия, желудочковая тахикардия, брадиаритмии. Обсуждаются механизмы аритмогенеза в острый период инфекции: миокардиальное повреждение (некроз, апоптоз, воспалительный процесс, ишемия и т.д.), ионный дисбаланс, активация симпатической нервной системы, гипоксемия.
Связь между перенесенной инфекцией и аритмиями в постковидный период у госпитализированных и негоспитализированных больных практически не исследовалась.
Лишь в одном исследовании ретроспективный анализ электронных медицинских карт показал увеличение в 1.7 раз аритмических событий в группе не госпитализированных пациентов в сравнении с контрольной группой, но вызывает сомнение с чем связаны обнаруженные изменения – истинное увеличение событий или более тщательное проведение обследования в группе перенесенной коронавирусной инфекции.
Однако с точки зрения здравого смысла и общеклинических диагностических алгоритмов представляется целесообразным проведение диагностического поиска дебюта аритмий или рецидива аритмии, диагностированной в остром периоде, в отдаленном периоде при наличии жалоб пациента на сердцебиения, прекардиальный дискомфорт, одышку.
Тромбоэмболические последствия
Известно, что острая инфекция SARS-CoV-2, особенно в ее тяжелой форме, связана с повышенным риском венозных тромбоэмболических осложнений (ВТЭ). Долгосрочный риск ВТЭ изучен в меньшей степени. В ретроспективном наблюдательном когортном исследовании 163 пациентов, из которых 42 (26%) нуждались в поступлении в отделение интенсивной терапии, кумулятивная частота ВТЭ в течение 30 дней после выписки составила 0,6% (95% ДИ, 0,2%-4,6%). Совокупная частота всех тромбозов (включая тромбоэмболию легочной артерии, тромб левого желудочка, окклюзию центральной артерии сетчатки, тромбоз артериовенозного шунта для диализа и ишемический инсульт) составила 2,5% (95% ДИ 0,8 -7,6%), а 30-дневные кумулятивные показатели больших и небольших кровотечений составили 0,7% и 2,9% соответственно [37]. Эти показатели сопоставимы с постгоспитальными показателями ВТЭ и частоты кровотечений, 0,3% -2,5% и 0,7% -2,0% соответственно, которые наблюдались у пациентов с сопоставимыми формами острых заболеваний, не связанных с COVID-19.
В другом исследовании, проведенном на 102 пациентах, Engelen et al. сообщают о низкой частоте ВТЭ (<1%) в среднем через 44 дня после госпитализации из-за COVID-19.
Однако отсутствие больших ТЭ событий после перенесенной коронавирусной инфекции не исключает текущий процесс на уровне эндотелия и микрососудистого русла с эндотелиопатией, микротромбозами и нарушениями тканевой перфузии. Все более актуальной становится разработка алгоритмов антикоагулянтной терапии для различных групп пациентов после перенесенной коронавирусной инфекцией, в том числе с синдромом длительного COVID-19.
Барорецепторная дисфункция и ортостатические расстройства
Системное сосудистое повреждение при COVID-19 – приводит к нарушению автономной регуляции (функционирования автономной нервной системы), в том числе повреждению барорецеторной и хеморецепторной функции с вариабельностью АД и ЧСС, нарушением сосудистого артериального тонуса и венозного возврата. Клинически это может проявляться сердцебиениями, постуральными изменениями АД и ЧСС, нарушением сна и переносимости физической нагрузки. COVID-19 индуцированная дисавтономия может быть серьезной манифестацией диффузного сосудистого повреждения.
К ортостатическим расстройствам (ОР), относятся: ортостатическая гипотензия, вазовагальный синкоп, синдром постуральной ортостатической тахикардии. Отмечается учащение развития этих состояний после перенесенной коронавирусной инфекции. Некоторые исследователи относят ОР к частым проявлениям долгого COVID-19.
Синдром постуральной ортостатической тахикардии (ПОТ) – это устойчивое увеличение ЧСС >30 уд/мин у взрослых (старше 19 лет) и >40 уд/мин у детей/подростков (12-19 лет) при переходе из положения лежа в положение стоя, продолжающееся в течение 10 минут в отсутствие ортостатической гипотонии (снижение систолического АД >20 мм рт. ст. или диастолического АД >10 мм рт. ст.) сопровождающееся симптомами - головокружение, ощущение сердцебиения, тремор, дискомфорт в грудной клетке, одышка, существующее как минимум в течение 3 месяцев.
Ортостатическая гипотензия - снижение САД ≥ 20 мм рт. ст. и ДАД ≥ 10 мм рт. ст. после трех минут ортостаза. Патогенез ОР после перенесенной коронавирусной инфекции до конца не ясен.
Предполагаются следующие механизмы развития: дисрегуляция РААС и кинин-калликреиновой системы с влиянием на внутрисосудистый объем жидкости, формирование постинфекционной автономной нейропатии в результате воздействия гипоксении, воспаления, токсических воздействий с продолжающимся аутоиммунным и воспалительным повреждением нервной системы. COVID-19-индуцированная автономная дисфункция может быть связана с выработкой аутоантител к альфа и бета рецепторам сосудов.
Гиперактивация симпатической нервной системы (СНС) с высоким уровнем катехоламинов может приводить к парадоксальной вазодилатации с падением АД. Снижение активности СНС и активация вагуса приводит к гипотензии, головокружениям и, в конечном счете, к синкопу. Факторы риска: длительный постельный режим со снижением сердечного выброса, мозгового кровотока; гиповолемия, повреждение барорефлекса, снижение активности СНС
Для диагностики должны выполняться ортостатические пробы. Необходимо провести общеклиническое обследования для исключения вторичного характера состояния (клинический и биохимический анализ крови, ЭКГ), дополнительные методы обследования: холтеровское мониторирование ХМЭКГ, тест с физической нагрузкой, эхокардиография. Очень важен тщательный сбор анамнеза, оценка потребления соли и воды, прием провоцирующих препаратов (альфа-адреноблокаторов, блокаторов кальциевых каналов, ингибиторов обратного захвата серотонина, трициклических антидепрессантов и фенотиазина).
Основанных на доказательствах специфических методов лечения данной патологии не существует. В доступных согласительных документах обсуждаются нефармакологические и фармакологические стратегий, которые мы можем применять и синдроме длительного COVID-19. Терапевтические стратегии изложены в разделе терапия.
Тактика ведения пациентов с сердечно-сосудистыми расстройствами после перенесенной коронавирусной инфекции
Диагностические стратегии. При развитии кардио-респираторной симптоматики после перенесенной коронавирусной инфекции большое значение приобретает применение диагностического алгоритма для исключения дебюта/обострения сердечно-сосудистых заболеваний с целью предупреждения развития осложнений и жизнеугрожающих событий. Миокардиальное повреждение, ишемия, нарушения ритма могут проявляться в отсроченном периоде неспецифическим клиническим паттерном: слабость, плохая переносимость физической нагрузки, дыхательный дискомфорт, боли в области сердца и т.д. И у пациентов без сердечно-сосудистой патологии в анамнезе эти жалобы могут рассматриваться как симптомы астенического характера при синдроме длительного COVID-19.
Поэтому обследование необходимо разработать алгоритм лабораторно-инструментального обследования пациентов. План лабораторно-инструментального обследования и алгоритм диагностики представлены в Таблице 1 и на Рисунке 4.
Таблица 1
План лабораторно-инструментального обследования у пациентов с кардио-респираторными симптомами

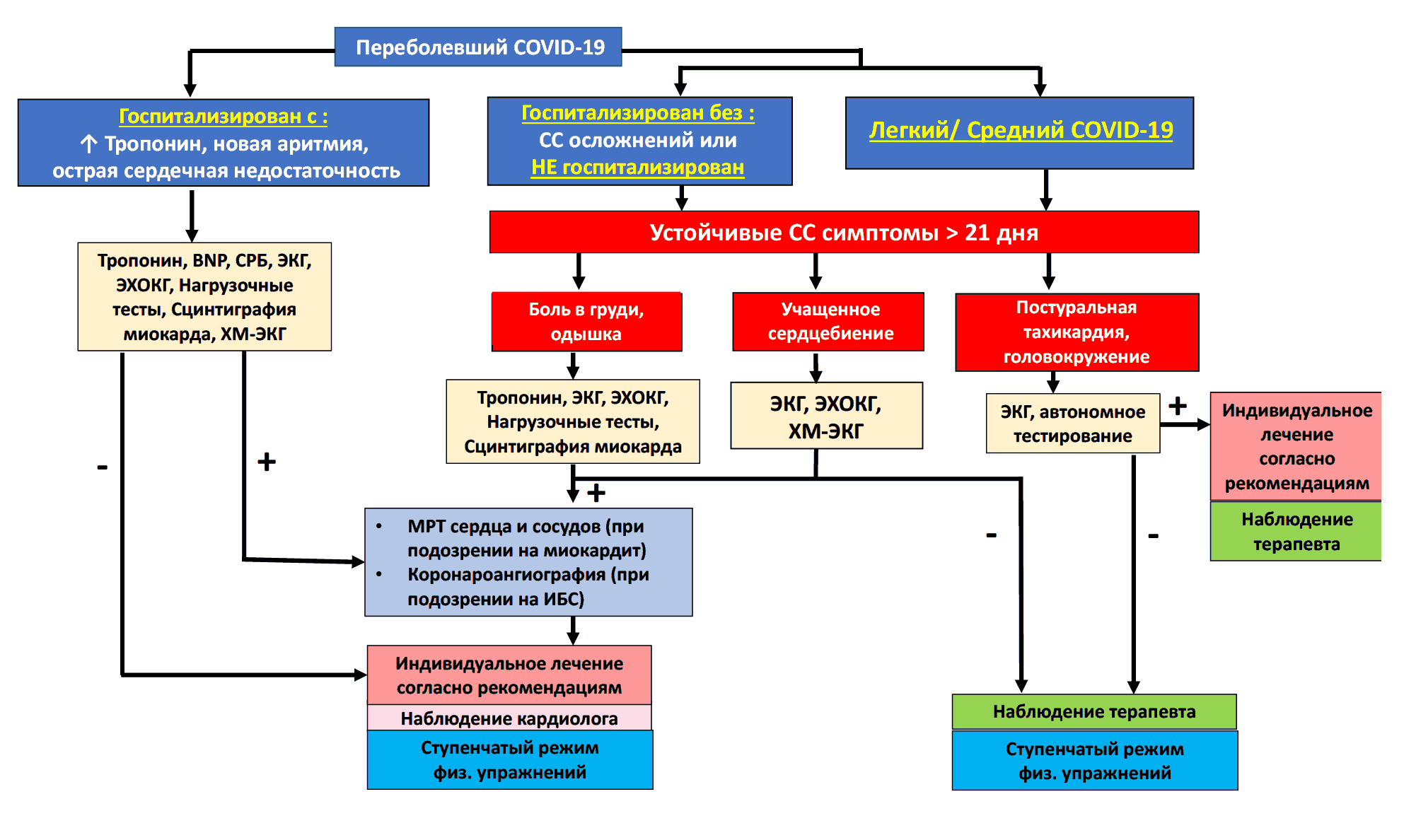
Рис. 4. Диагностический алгоритм
Терапевтические стратегии
До сих пор не разработаны специфические терапевтические стратегии ведения пациентов с синдромом длительного COVID-19. Наибольшие исследовательские усилия по праву были сосредоточены на профилактике и лечении острой фазы заболевания.
Необходимы крупномасштабные, тщательные спланированные исследования для понимания механизмов развития, факторов риска, прогноза, клинических групп пациентов с разработкой потенциальных терапевтических вмешательств при долгом COVID-19.
Однако с точки зрения понимания патофизиологических механизмов и существующих алгоритмов терапии в кардиологии можно сформулировать ряд терапевтических стратегий.
При ведении пациентов с длительным COVID-19 важно контролировать факторы риска, включая артериальное давление, уровень липидов, глюкозы и ожирение. Кроме того, клиницисты должны рекомендовать изменение образа жизни и отказ от курения и алкоголя, модификацию физической активности и питания. В настоящее время имеются четкие доказательства того, что управление факторами риска, такими как артериальное давление, дислипидемия и уровень глюкозы, может привести к снижению микрососудистых и макрососудистых осложнений. Существуют также доказательства пользы многофакторных вмешательств для почечных, сердечно-сосудистых и летальных исходов, и, по нашему мнению, эти стратегии могут аналогичным образом применяться к людям с синдромом длительного COVID-19.
При дебюте, обострении сердечно-сосудистых заболеваний в постковидный период необходимо планировать терапевтические вмешательства в строгом соответствии с современными рекомендациями по ведению сердечно-сосудистой патологии. Этот постулат не вызывает сомнений.
Особое внимание следует обращать на применение методов терапии, способных потенциально повлиять на предполагаемые патогенетические механизмы при COVID-19 (воспаление, эндотелиопатия, микрососудистая дисфункция, тромбообразование).
В настоящее время проводится ряд исследований по различных видов терапии пациентов с синдромом длительного COVID-19. Проводятся исследования по следующим терапевтическим направлениям: montelukast (NCT04695704), naltrexone плюс NAD+ (NCT04604704), leronlimab (NCT04678830), ruconest (NCT04705831), LYT-100), пищевые добавки ADAPT-232 (NCT04795557) и Niacine (NCT04809974), одно по гипербалической оксигенации (NCT04647656) и одно по контролируемым физическим упражнениям (NCT04718506) из общего числа 5273 исследований по COVID-19.
Так же в фазе клинических испытаний находится противофибротический и противовоспалительный препарат Deupirfeidone. В Соединенном Королестве продолжается исследование HEAL-COVID по профилактика долгого COVID-19.
Пациенты госпитализированные с коронавирусной инфекцией после выписка из стационара распределяются в группы апиксабана или аторвастатина.
Как только будет исключено наличие сердечно-сосудистых заболеваний и необходимость в специфической терапии, лечение должно быть сосредоточено на симптоматическом принципе и физической и психической реабилитации.
Физические упражнения. Хорошо известно, что структурированные программы реабилитации после сердечных заболеваний приводят к уменьшению смертности, повторных госпитализаций, улучшению функционального статуса и качества жизни. Учитывая, что физические упражнения, как было показано, полезны при различных патологиях, с которыми синдром длительного COVID-19 имеет общие черты как с точки зрения симптомов, так и его возможных патогенетических механизмов, стоит рассмотреть потенциальный благоприятный эффект, который они могут оказать на выздоровление этих пациентов. Рисунок 5 иллюстрирует потенциальные преимущества физических упражнений в отношении наиболее частых клинических проявлений постковидного синдрома.
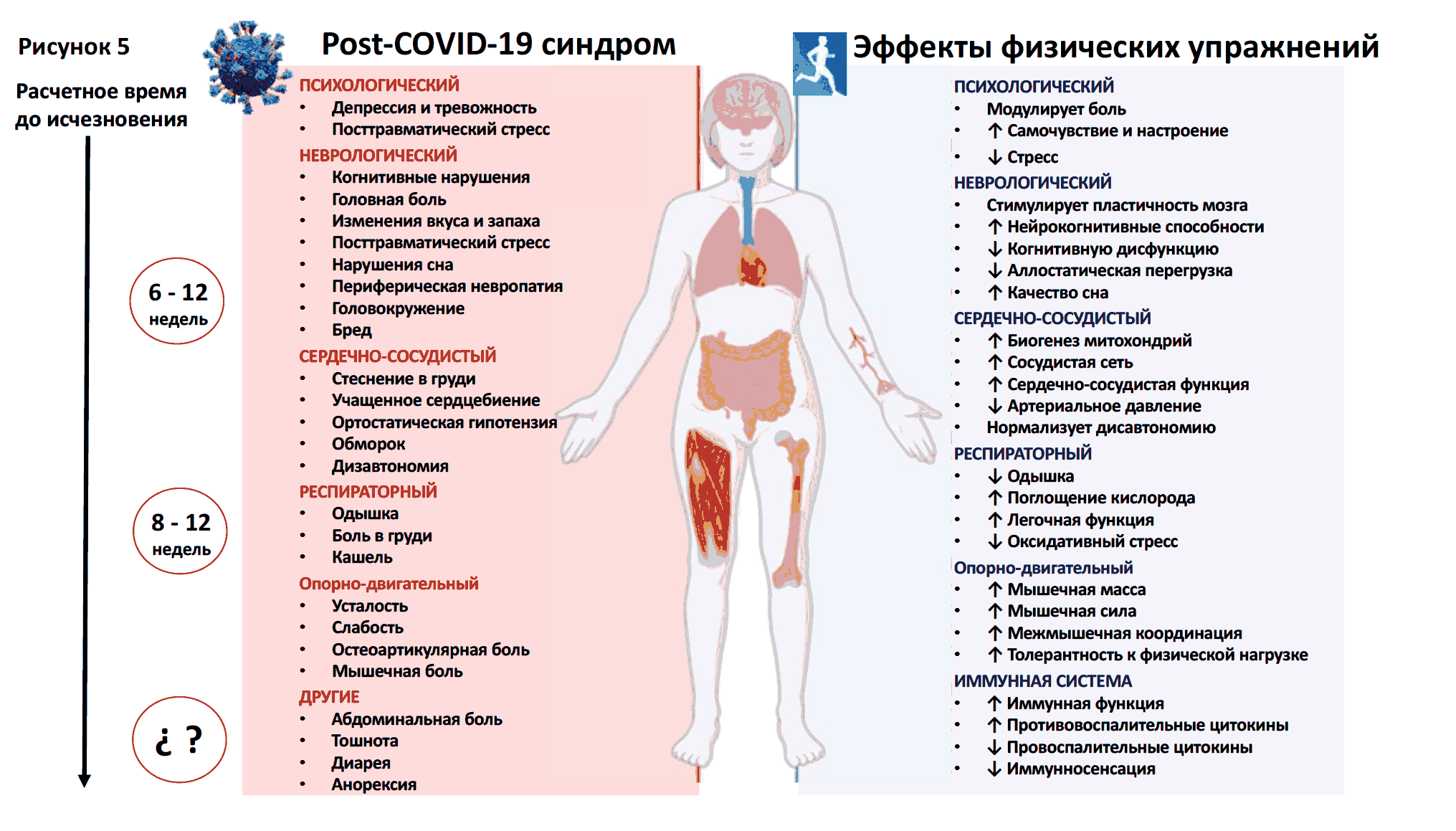
Рис. 5. Потенциальные преимущества физических упражнений
Существует достаточно доказательств того, что индивидуальные и контролируемые физические упражнения могут быть эффективной мультисистемной терапией синдрома длительного COVID-19, которая соответствует разнообразию случаев и симптомов. Необходимо дальнейшее изучение влияния лечения на основе физических упражнений, чтобы дать практические рекомендации, какой тип упражнений следует предпочтительно назначать, их интенсивность и стратегии контроля.
На данный момент не разработаны специфические терапевтические стратегии, влияющие на патогенез постковидных сердечно-сосудистых нарушений. Однако в арсенале терапевтов и кардиологов находится достаточное количество средств, влияющих на ключевые патогенетические механизмы COVID-19 – эндотелиальная дисфункция, воспаление, гиперкоагуляция, автономная дисфункция, дисрегуляция РААС.
Терапия ортостатических расстройств
Терапия ОР основываются на анализе опубликованных рекомендаций, согласительных документах, и собственном мнении авторов, имеющих опыт в ведении подобных расстройств у постковидных пациентов.
Физические упражнения: С аэробными и силовыми элементами. Всем пациентам рекомендуются умеренные физические нагрузки лучше в не в положении стоя (плаванье, ЛФК, гребля, горизонтальный велотренажер).
Водно-солевой режим. Объем жидкости 2-3 литра воды в день, отказ от кофеина и алкоголя), применение одной-двух чайных ложек солевых добавок в день помогает поддерживать объем плазмы и избегать гиповолемии.
Избегать провоцирующих факторов. Пациенту следует рекомендовать осторожно подниматься из лежачего или сидячего положения и избегать усугубляющих факторов, таких как длительное стояние, теплая среда и обезвоживание. Кроме того, пациентам можно посоветовать небольшие и частые, а не большие приемы пищи, чтобы избежать спланхнической вазодилатации. Кроме того, рекомендуются сон с приподнятым изголовьем, использование компрессионного белья, увеличивающего венозный возврат к сердцу. Отмена препаратов, прием которых может быть связан с развитием ортостатической тахикардии и гипотонии.
Фармакологическими средствами, использование которых возможно при синдроме ОР, являются: мидодрин (альфа-адреномиметик), пиридостигмин (ингибитор холиннэстеразы), флудрокортизон (минералокортикоид – повышение объема внеклеточной жидкости), ивабрадин (ингибитор If-каналов синусного узла), клонидин (альфа-адреномиметик), неселективные β- адреноблокаторы в невысоких дозах, физиологический раствор. Подбор лекарственной терапии осуществляется в соответствии с предполагаемым механизмом развития ОР.
Антитромботическая и дезагрегантная терапия
С учетом патогенеза органных повреждений при COVID-19 и значении сосудистой дисфункции и гиперкоагуляции в отдаленном периоде после перенесенной коронавирусной инфекции антитромботическая терапия имеет огромное значение.
Следует рассмотреть несколько клинических сценариев.
1. Наличие показаний к длительной терапии антикоагулянтами и/или дезагрегантами: ФП, ТГВ/ТЭЛА в анамнезе, протезы клапанов, тромбофилии, периферический атеросклероз, НМК в анамнезе, ИБС, ОКС, стентирование в анамнезе. Необходимо продолжить прием препаратов или инициировать терапию в соответствии с текущими рекомендациями. Пересмотреть показания для пролонгации терапии.
У пациентов с имеющимися ССЗ определяющими показаниями к приему ацетилсалициловой кислоты (АСК) и других дезагрегантов следует рассмотреть возможность продолжения приема препаратов во время коронавирусной инфекции и после перенесенного заболевания
2. Нет показаний к терапии антитромботической терапии. Текущие рекомендации позволяют пролонгировать терапию антикоагулянтами до 45 дней после выписки в соответствии с рассчитанным тромботическим риском. В соответствии с текущими рекомендациями Минздрава – «Продленная профилактика ТГВ (вплоть до 30-45 дней после выписки) может назначаться пациентам при наличии одного из следующих признаков: возраст старше 60 лет, госпитализация в ОРИТ, активное злокачественное новообразование, ТГВ/ТЭЛА в анамнезе, сохраняющееся выраженное ограничение подвижности, концентрация D-димера в крови, в 2 и более раза превышающая верхнюю
границу нормы. «Профилактику ТГВ нижних конечностей/ТЭЛА стоит рассматривать для больных со среднетяжёлой формой COVID-19, которые лечатся дома и имеют высокий риск венозных тромбоэмболических осложнений, низкий риск кровотечений. Длительность применения антикоагулянтов при амбулаторном лечении COVID-19 не ясна, и, по-видимому, может продолжаться вплоть до 30 суток в зависимости от динамики клинического состояния пациента и сроков восстановления двигательной активности».
Нет оснований пролонгации применения антикоагулянтов более 30 для амбулаторных пациентов и более 45 дней после выписки из стационара с целью тромбопрофилактики, без четких показаний. С точки зрения некоторых исследователей анализ клинического статуса пациентов: гиперкоагуляционное состояние, повышение СРБ, Д-димера, фибриногена позволяют не использовать унифицированную стратегию длительности применения АК после у пациентов с синдромом длительного COVID-19.
С учетом отсутствия клинических показаний для пролонгации терапии оральными антикоагулянтами в долгосрочной перспективе могут быть использованы эндотелийкорректоры и антикоагулянты с альтернативными механизмами действия, не требующие контроля гипокоагуляции и имеющие низкий риск кровотечений (сулодексид).
Сулодексид занимает особое место между вазопротекторами, гепаринами, антиагрегантами и активаторами фибринолиза. Эффекты сулодексида связаны также с восстановлением гликокаликса, защитного барьера эндотелия, расположенного на его поверхности. Улучшение целостности гликокаликса не только восстанавливает барьерную функцию эндотелия, но также позволяет эндотелиоцитам модулировать генерацию ключевых воспалительных молекул, включая ИЛ1β, ИЛ6, ИЛ8 и ФНОα, а также подавлять ответ эндотелия на эти молекулы.
Важная характеристика препарата – низкий риск кровотечений, так как его антитромботическая активность при пероральном приеме является результатом многофакторного действия препарата на сосудистую стенку (ангиопротектор), профибринолитического действия и ингибирование адгезии тромбоцитов без антикоагулянтного действия. Не требует рутинного контроля показателей коагуляции.
В соответствии с европейскими рекомендациями по ведению острого легочного эмболизма препарат рекомендуется к применению для продленной профилактики венозных тромбэмболических осложнений при невозможности применения оральных антикоагулянтов.
Помимо теоретического обоснования применения препарата в острый период COVID-19 и в постковидном период доступны результаты клинического исследования препарата у амбулаторных пациентов с коронавирусной инфекцией - «Сулодексид в лечении пациентов с COVID-19 ранней стадии: рандомизированное контролируемое исследование». Раннее использование сулодексида у пациентов с COVID-19 снизило количество госпитализаций и потребность в кислородной поддержке.
В инструкции по применению сулодексида есть показание «ангиопатии с повышенным риском тромбообразования», «микроангиопатии (нефропатия, ретинопатия, невропатия)», что позволяет использовать препарат в постковидном периоде и у пациентов симптомами длительного ковида.
Блокаторы РААС и антагонисты минералокортикоидных рецепторов
Путем активации ангиотензином II НАДФ (никотинамиддинуклеотидфосфата) и НАД-зависимых синтаз стимулируются процессы оксидативного стресса, развивается эндотелиальная дисфункция, системное воспаление. Блокада РААС ведет к снижению уровня системного воспаления, снижению проницаемости сосудов, уменьшению экспрессии провоспалительных цитокинов, уменьшению молекул адгезии, снижением образования активных форм кислорода.
Использование антагонистов ангиотензиновых рецепторов типа 1 (AРА) и ингибиторов ангиотензин-превращающего фермента (ИАПФ) в настоящее время является основой лечения гипертонии и связанных с ней расстройств, и есть доказательства того, что использование ИАПФ и АРА, несмотря на первоначальные опасения, может восстановить гомеостаз РААС при тяжелом течении COVID-19. Предполагается, что терапевтические средства, влияющие на дисрегуляцию РААС и кинин-калликреиновой системы могут рассматриваться для ослабления длительных симптомов COVID.
Статины
Описаны следующие плейотропные эффекты статинов: противовоспалительный эффект - снижение уровня С-реактивного белка, продукции провоспалительных цитокинов и циклооксигеназы-2, участвующей в воспалительной реакции, торможение нейтрофильной инфильтрации и притока макрофагов; антиоксидантный эффект - снижение уровня оксидантов, вызывающих оксидативный стресс; иммуномодулирующий эффект - снижение концентрации провоспалительных цитокинов а-ФНО, ИЛ-8, Т-хелперов, макрофагов, количества молекул гистосовместимости II класса (МНС-II), ответственных за развитие Th1-иммунного ответа; эндотелийпротективный эффект - повышение уровня оксида азота в крови, снижение активности процессов перекисного окисления липидов и адгезии лейкоцитов; антиадгезивный эффект - снижение уровня молекул межклеточной ICAM и сосудистой адгезии VCAM-1, уменьшение матриксных металлопротеиназ, адгезии нейтрофилов и миграции моноцитов в стенку сосуда; ремоделирующий эффект - ингибирование процессов фиброобразования, уменьшение выработки и высвобождения матриксных металлопротеиназ 2, 9, следовательно, уменьшение разрушения паренхимы легких; антитромботический эффект – уменьшение активации тромбоцитов и ингибиторов активатора плазминогена, повышение тканевых активаторов плазминогена, повышение экспрессии и активности на эндотелии белка тромбомодулина; торможение злокачественной трансформации клеток в легких.
Данные эффекты статинов обусловлены их воздействием на сигнальные молекулы Ras, Rho, Rac, именно благодаря снижению статинами активации этих молекул, ингибированием ядерного фактора NF-KB и активацией рецепторов, активируемых пероксисомными пролифераторами (PPAR-a и PPAR-гамма рецепторов), происходит уменьшение экспрессии клетками молекул адгезии, уменьшение экспрессии хемокинов (CCL2 и CXCL8), уменьшение синтеза цитокинов, протеиназ, уменьшение воспаления.
Таким образом, происходит уменьшение как системного, так и легочного воспаления через ингибирование миграции нейтрофилов и макрофагов в легочную ткань, снижение уровня провоспалительных цитокинов в легочной ткани, ингибирование синтеза цитокинов в легких.
Также статины тормозят высвобождение матриксных металлопротеиназ 2 и 9, уменьшают развитие эмфиземы, ингибируют процессы фиброзирования, снижают воспалительный ответ на легочную инфекцию, тормозят процессы эпителиально-мезенхимального перехода клеток, ведущего к развитию рака легких, стимулируют фагоцитоз нейтрофилов альвеолярными макрофагами, что уменьшает количество нейтрофилов у больных ХОБЛ, снижая тем самым уровень воспаления, ингибируют фактор роста эндотелия сосудов (VEGF).
Таким образом, статины могут оказывают действие на ключевые воспалительные и ремоделирующие процессы у пациентов с острым COVID-19 и в постковидном периоде.
Проведены исследования, подтверждающие положительные эффекты статинов с острый период COVID-19. Показано снижение уровня СРБ, ИЛ-6 и улучшение выживаемости в группе пациентов госпитализированных с COVID-19, принимающих статины в сравнении с контрольной группой.
Не проводились исследования по применению статинов в постковидный период. Таким образом, в посковидном периоде, у пациентов с симптоматикой долгого ковида необходимо рассчитывать сердечно-сосудистый риск, пересматривать терапевтически стратегии для определения показаний к назначению препаратов с эндотелий-регулирующими, противовоспалительными эффектами (статины, блокаторы РААС).
Учитывая неблагоприятное влияние COVID-19 на контроль АД, необходимо продолжение антигипертензивной терапии у пациентов с АГ в соответствии с клиническими рекомендациями. Выбор гипотензивного препарата у пациента после перенесенной COVID-19 инфекции помимо влияния на уровень АД должен учитывать наличие противовоспалительного и эндотелий- протективного эффекта, который имеется у телмисартана. Согласно международным и российским клиническим рекомендациям по лечению АГ, большинству пациентов рекомендована стартовая комбинированная терапия.
Предпочтительно назначение фиксированных комбинаций, для улучшения приверженности пациентов к терапии, например, телмисартан+ГХТЗ (например, Телзап Плюс), телмисартан+амлодипин (например, Телзап АМ).
Учитывая неблагоприятное влияние COVID-19 инфекции на эндотелиальную функцию, целесообразно решение вопроса о назначении статинов после перерасчета сердечно-сосудистых рисков (SCORE).
Необходимо назначение или коррекция доз статинов для достижения целевых значений ХС-ЛПНП с целью вторичной профилактики. При недостижении целевых значений ХС-ЛНП на монотерапии статинами необходимо рассмотреть вопрос об интенсификации липидснижающей терапии с помощью добавления эзетимиба. Целесообразно сделать выбор в пользу фиксированных комбинаций, которые способствуют повышению приверженности к терапии. Примером такой комбинации является препарат Зенон, который объединяет в одной таблетке молекулы розувастатина и эзетимиба.
Миокардиальная цитопротекция
Коронарная микрососудистая дисфункция, ИМ 2 типа в условиях повышения потребности миокарда в кислороде – основные механизмы миокардиального повреждения при COVID-19.
В связи с этим особый интерес представляет миокардиальная цитопротекция. В отличие от традиционных методов лечения, направленных на непосредственное улучшение коронарного кровообращения, в основе принципа действия современных цитопротекторов лежит их свойство увеличивать способность миокарда переносить ишемию, не теряя или быстро восстанавливая при этом свою функциональную активность. В соответствии с рекомендациями к препаратам метаболического действия, которые можно использовать при ишемии миокарда, относят триметазидин и ранолазин.
Однако на фоне выраженной эндотелиальной дисфункции, нарушения митохондриального синтеза, повреждения и нарушения функции клеточных мембран особый интерес представляют препараты, непосредственно восполняющие энергодефицит. В связи с этим наиболее перспективным в данном направлении является фосфокреатин (ФК) —N-фосфорил(N-метил)- гуанидиноуксусная кислота. Фосфокреатин (ФК) участвует в реакции фосфорилирования аденозинди-фосфата (АДФ), обеспечивая восстановление саркоплазматического АДФ до АТФ, который, в свою очередь, обеспечивает энергией укорочение миофибрилл.
В доступной литературе опубликовано большое количество работ применению экзогенного ФК при лечении ХСН на фоне ИБС (уменьшение частоты госпитализаций, улучшение клинических симптомов и сердечной функции, регресс ремоделирования левого желудочка) в комплексной терапии миокардитов и/или повреждения миокарда. Препарат успешно используется при развитии миокардита на фоне COVID-19.Также обосновано применение экзогенного фосфокреатина для укрепления скелетной мускулатуры, лечения мышечной гипотрофии и реабилитации.
Для эффективного восстановления после перенесенного COVID-19 требуются препараты, способные напрямую восстановить энергопотребление и следующий за этим каскад восстановительных процессов в отношении репарации мембран, процессов синтеза, электролитного баланса не только на уровне кардиомиоцитов, на и скелетной мускулатуры. Представляется целесообразным использование фосфокреатина у пациентов с миокардиальной и коронарной микросососудистой дисфункцией, а также с симптомами долгого ковида для оптимизации энергообмена и ускорения процессов реабилитации.
Заключение
Таким образом, тактика стратегия ведения сердечно-сосудистых заболеваний в постковидном периоде - современная диагностика дебюта или декомпенсации сердечно-сосудистой патологии, грамотное, в соответствии с текущими рекомендациями, ведение сердечно-сосудистой патологии с акцентом на использование терапевтических вмешательств, влияющих на патофизиологические механизмы долгого ковида.

























































































0 комментариев