Эпилепсия у взрослых женщин и мужчин. Лекция для врачей
Лекция для врачей "Эпилепсия у взрослых женщин и мужчин" (отрывок из книги "Эпилепсия у детей и взрослых женщин и мужчин. Руководство для врачей" - Карлов В. А.)
Эпилепсия у женщин
Эпилепсия и женщина. Эпилепсия у женщин отличается от эпилепсии у мужчин, поскольку у женщин возникает ряд специфических женских аспектов проблемы, а именно:
• биологический — репродуктивная функция и связанные с ней менструальный цикл, беременность, роды, материнство;
• психологический — осознание себя как женщины, особенности восприятия болезни;
• социальный — осознание своей ответственности как матери, формирование и выстраивание отношений в семье, участие в жизни общества;
• «женские» аспекты проблемы эпилепсии, которые возникают уже в раннем детстве и сопровождают женщину в течение всей жизни. Они требуют соответствующей мотивации в действиях врача.
Не случайно эпилепсии у женщин за последние 2—3 десятилетия уделяется повышенное внимание. Этому в значительной мере способствовали особенности современной эпохи: кроме репродуктивной функции, женщины играют все большую роль в продуктивной и социальной сфере. Немаловажное значение имеет также появление современных АЭП с высокой эффективностью и лучшей переносимостью, в результате чего женщины продолжают учиться, выполнять квалифицированную работу, проявлять социальную активность, т.е. полностью интегрированы в обществе и не чувствуют себя ущербными либо обделенными. Наконец, улучшение методов диагностики и наблюдения за больными с использованием проспективных программ международного со трудничества позволяет в настоящее время вести несколько регистров по беременности (Европейский EURAP, Британский, Североамериканский, Австралийский), насчитывающих в совокупности более 10000 наблюдений, а это, в свою очередь, является основой для разработки рационального алгоритма ведения беременных.
Следует сразу подчеркнуть, что менструальные нарушения — аменорея, олигоменорея, менометроррагия — наблюдают у 1/3 женщин с эпилепсией по сравнению с 12—14% случаев в общей популяции, а ановуляторный цикл — у 1/3 женщин против 8-10%. Смертность женщин с эпилепсией составила 3,8% материнской смертности, в то время как распространенность эпилепсии среди беременных — 0,3-0,4%.
На кафедре нервных болезней лечебного факультета МГМСУ им. А. И. Евдокимова вопросы эпилепсии изучаются более 50 лет. В последнее время основными направлениями, разрабатываемыми совместно с сотрудниками лаборатории клинической биохимии РОНЦ им. Н. Н. Блохина РАН, являются изучение специфики диагностики, особенностей клинической картины и разработка вопросов терапии эпилепсии с учетом возрастно-половых особенностей [Карлов В. А., Власов П. Н. и др., 1993—2017]. Чрезвычайно плодотворным оказалось сотрудничество кафедры неврологии с Московским областным НИИ акушерства и гинекологии под руководством чл.-корр. РАН проф. В. И. Краснопольского по вопросам ведения и динамического наблюдения за беременностью, родоразрешения у пациенток с сопутствующей эпилепсией, вопросам гемостазиологии, терапии резистентных форм эпилепсии с учетом влияния на гормональный фон половых стероидов; изучаются особенности течения эпилепсии в климактерическом периоде. Более 10 лет продолжается активное сотрудничество с кафедрой репродуктивной медицины и хирургии ФДПО МГМСУ им. А. И. Евдокимова (зав. кафедрой акад. РАН Л. В. Адамян) по исследованию репродуктивного здоровья женщин, страдающих эпилепсией, дифференцированному выбору методов контрацепции, планированию и ведению беременности и родов. Нейропсихоэндокринный аспект активно изучают проф. В. В. Калинин и Е. В. Железнова (2010). Совершенствование организации помощи и фармакогенетические исследования проводятся в Красноярске под руководством проф. Н. А. Шнайдер и соавт. (2014).
Специфика эпилепсии у женщин обусловлена рядом структурно-функциональных особенностей гипоталамо-гипофизарно-половой системы с суточным и месячным циклическим ритмом, сопровождающимся многообразными изменениями в организме женщины, присущими только ей физиологическими периодами жизни (беременность, роды, лактация). Чрезвычайно актуальными являются вопросы социальной адаптации: финансовая независимость, рациональное трудоустройство, возможности профессионального роста, вопросы создания семьи, показатели качества жизни и многие другие. При постановке диагноза и динамическом наблюдении важен учет нейрофизиологических и психологических особенностей. Одно из приоритетных направлений при эпилепсии у женщин по праву занимает лекарственная терапия, так как учет только соответствия назначаемого препарата форме эпилепсии и виду эпилептических припадков явно недостаточен.
Лекарственный аспект проблемы многообразен и включает взаимодействие нескольких совместно назначаемых противоэпилептических препаратов между собой, с гормональными контрацептивами, влияние препаратов на менструальный цикл, на показатели фертильности. Учитывая это обстоятельство, в последние годы активно изучаются проблемы взаимодействия АЭП и здоровья женщины. Вопросы ведения беременности у больных эпилепсией включают специфику лекарственного протокола, прогноз рождения здорового ребенка, вероятность развития у него эпилепсии, профилактику возможных осложнений со стороны матери и ребенка. И здесь приходится принимать во внимание то, что женщина «начинается» уже с первых лет жизни; это имеет существенное значение в выборе АЭП.
Для женского пола характерны некоторые специфические синдромы. Так, приблизительно в 1,5 раза чаше у девочек наблюдается такой феномен, как фотосенситивность, являющийся не только одним из проявлений эпилепсии, но и самостоятельным заболеванием (стимулзависимая, фотосенситивная, телевизионная эпилепсия). Преимущественно у девочек встречаются половозависимые формы эпилептических синдромов, такие как синдромы Айкарди, Ретта, синдром узелковой перивентрикулярной гетеротопии. Циклически текущей формой эпилепсии у женщин является синдром катамениальной эпилепсии.
Соотношение больных эпилепсией мужского и женского пола в популяции несколько смещено в сторону преобладания мужчин (табл. 32.1), однако в развивающихся странах Африки и Латинской Америки преобладает эпилепсия у женщин.
Таблица 32.1. Распространенность (на 100000) эпилепсии и припадков по полу
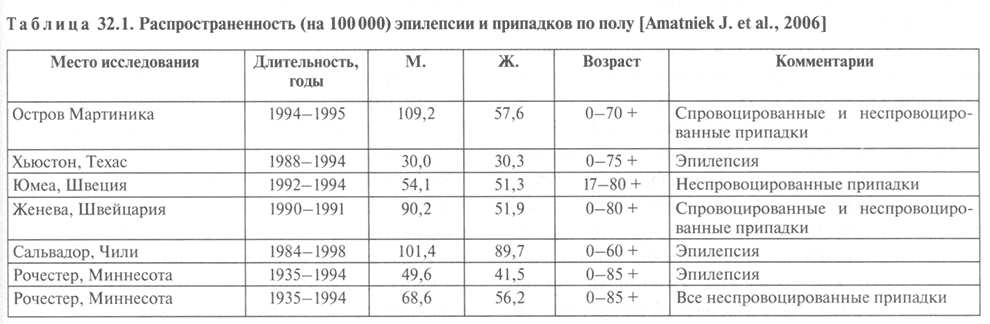
Так, распространенность эпилепсии среди городского населения в Нигерии у лиц старше 7 лет составила 5,1 на 1000 мужчин и 6,5 на 1000 женщин. Используя сходный протокол исследования, выявили преобладание эпилепсии у женщин в странах Латинской Америки. Это, вероятно, связано с тем, что женщины и их здоровье учитываются при обращении в медицинские учреждения по факту родов, а случаи эпилепсии у мужчин просто не регистрируются.
Вместе с тем в пубертатном (один из пиков заболеваемости у девочек приходится на 10—14 лет) периоде и до 30 лет, а также в возрасте более 70 лет существенно преобладает распространенность эпилепсии у женщин. Пубертатный пик заболеваемости объясняется многими факторами:
- биологическими (бурный рост организма, сопровождающийся сопутствующей вегетативной дистонией пубертатного периода);
- психологическими (юношеский максимализм, отрицание авторитетов — врача и старших родственников, недоверие к проводимой терапии);
- гормональными (мощные циклические ежемесячные воздействия стероидных женских половых гормонов на организм при недостаточности гомеостатических механизмов и противоэпилептической системы);
- сменой стиля жизни (депривация сна, посещение дискотек, употребление алкоголя и психотропных препаратов; см. гл. 17).
Преобладание больных эпилепсией женщин в возрасте старше 70 лет связано не только с абсолютным доминированием в популяции этого возраста женщин. С возрастом проявляется и прогрессирует сосудистая патология головного мозга, кумулируются экзогенные и эндогенные влияния на мозг пациента, присоединяется разнообразная соматическая патология (см. гл. 27).
Эпилептические припадки, как таковые, могут оказывать отрицательное влияние на гормональный статус организма женщины, вызывать затруднение становления менструального цикла, дисменорею, мастопатию, поликистоз яичников и другие нарушения. Подобное воздействие оказывают и антиэпилептические препараты. Резюмируя, можно выделить основные аспекты данной проблемы: менархе и эпилепсия, катамениальная эпилепсия, терапия эпилепсии у женщин, эпилепсия и здоровье женщины, беременность и эпилепсия, эпилепсия и менопауза.
Синдром катамениальной эпилепсии
В неврологии одним из самых ярких примеров циклической периодичности заболевания является катамениальная (менструальная) эпилепсия. Сразу же расставим терминологические акценты: поскольку термин «катамениальная эпилепсия» не входит в классификацию эпилепсии и эпилептических синдромов, правомернее было бы обозначать припадки, развивающиеся в менструальный период, «менструальными эпилептическими припадками» и отечественной литературе применяется термин «катамениальная» (дословный перевод термина «катамениальная» с английского означает «менструальная») эпилепсия, поэтому оба термина будут употребляться в качестве синонимов.
На тесную взаимосвязь течения эпилепсии и менструальной функции обращали внимание еще древние ученые. Гиппократ указывал, что задержка месячных может способствовать развитию припадков; Гален отмечал, что регулярные месячные предотвращают эпилепсию у женщин. Первое клиническое исследование взаимосвязи эпилепсии с менструальным циклом проведено: по его данным, из 82 наблюдавшихся больных женщин у 46 (56%) частота припадков возрастала во время менструации.
В последующие годы к проблеме катамениальной эпилепсии обращались многие авторы, однако в силу целого ряда объективных и субъективных причин (отсутствие четких критериев специфичности патологии, ограниченность технических возможностей, разрозненность изучаемых признаков заболевания и др.) полученные результаты исследований оказались чрезвычайно вариабельными и порой даже противоречивыми. Многие проведенные ранее работы не сопоставимы между собой, так как в них изучались отдельные признаки патологии и отсутствовал комплексный подход.
Эпилепсия у мужчин
Известно, что эпилепсия несколько чаще возникает у лиц мужского пола, чем женского. В основном это объясняется большей подверженностью мужского пола травматизму: в связи с большей массой тела плода при родах, выбором профессий значительного травматического риска (водители транспорта, строительные рабочие и др.), значительным армейским травматизмом, а также связанным с ролью тестостерона, в частности стимулирующего более агрессивное поведение.
В принципе схема управления балансом половых гормонов у мужчин та же, что и у женщин: кора — гиппокамп — подкорка (амигдала) — гипоталамус — гипофиз — гонады. На всех сегментах этой сложной оси осуществляется обратная связь, поэтому выделение тех или иных гормонов может иметь пульсирующий характер. Это особенно актуально для выделяемого гипоталамусом гонадотропин-рилизинг-гормона (GRH), который контролирует секрецию передней долей гипофиза фолликулстимулирующего гормона (FSH) и лютеинизирующего гормона (LG); FSH и LH контролируют также секрецию гонадами эстрогенов, прогестерона и тестостерона. Конечно, главным мужским гормоном является тестостерон, хотя небольшая его порция продуцируется надпочечниками. В онтогенезе выделяют три периода активации продукции тестостерона: в период фетального развития и у новорожденных он необходим для маскулинизации гениталий, в пубертате, а также в третьем и четвертом десятилетиях жизни, где он регулирует сперматогенез и секретируется в наибольшем количестве. Тестостерон существует в трех формах: 40—50% его жестко связано с глобулинами, 50—55% — с альбуминами и только несколько процентов находится в свободной форме. В связи с этим индукция глобулинсвязывающего гормона под влиянием энзиминдуцирующих АЭП рассматривается как фактор риска развития репродуктивно-эндокринной дисфункции у мужчин. Активными метаболитами являются дегидротестостерон (DHT) и эстрадиол. Последний оказывает действие, противоположное тестостерону, т.е. понижает сексуальное желание и возбуждение, а также потенцию и подавляет секрецию LH. Высокий уровень эстрадиола сопровождается снижением продукции тестостерона, что ведет к гипогонадотропному гипогонадизму, в то время как снижение уровня только самого тестостерона сопровождается компенсаторным повышением секреции LH, что не ведет к увеличению уровня тестостерона — гипергонадотропный гипогонадизм.
Принципиальных гормональных отличий по сравнению с женщинами у мужского пола два:
1. LG стимулирует секрецию тестостерона клетками Лейдена, a FSH — сперматогенез клетками Сертоли. Однако у клеток Сертоли есть и другая задача: выделение ингибина В, который по механизму обратной связи регулирует секрецию FSH. Что касается третьего гормона гипофиза — пролактина, то у мужчин он контролирует в тестикулах уровень предшественников тестостерона, тем самым влияя на его продукцию. Кроме того, он потенцирует чувствительность клеток Лейдена к LG, а также действие тестостерона на предстательную железу и семенные пузырьки.
2. Цереброгипофизарная ось у мужчин работает в тоническом режиме в отличие от женщин, у которых имеет место циклическая организация вызревания фолликулов, в связи с чем указанная система действует в фазическом режиме: фолликулярная — менструальная — овуляторная стадии менструального цикла.
Все звенья корково-амигдалярно-гипоталами-ческигонадной оси функционируют по принципу отрицательной обратной связи. Например, активация тестостеронсекретирующей функции происходит под влиянием снижения уровня тестостерона. Низкий уровень тестостерона при наличии высокого уровня LH свидетельствует о неспособности яичек к достаточной выработке тестостерона, поэтому отношение тестостерон/LH является маркером тестикулярной функции.
До 60% мужчин с эпилепсией страдают нарушениями сексуальных функций: преобладающий синдром — гипосексуальность, которая характеризуется потерей сексуального желания, уменьшением сексуальной активности и снижением сексуального возбуждения. Отмечаются снижение эректильной функции, преждевременная эякуляция и проблемы фертильности с редукцией качества спермы вследствие гипогонадизма и гиперпролактемии.
A. G. Herzog (2008) приводит данные о больных эпилепсией мужчинах, оцененных по шкале S-score (шкала сексуального функционирования). 76% больных, имевших низкий уровень по этой шкале, показали снижение содержания биоактивного тестостерона по сравнению с контролем. Снижение биоактивного тестостерона с возрастом также преобладало при эпилепсии.
G. Montouris, G. L. Morris (2005) квалифицировали причины сексуальных дисфункций у лиц мужского пола как лекарственные (психотропные, антигипертензивные и другие препараты), медицинские (сосудистые, эндокринные, системные, урогенитальные заболевания), неврологические (поражение спинного мозга, коры большого мозга, невропатии) и психогенные (психиатрические, интрапсихические, экстрапсихические).
Очевидно, что у больных эпилепсией специфическими могут быть два фактора: припадки и АЭП.
Начнем с припадков — аспект, который не столь прост, поскольку a priory дезорганизующее влияние на гормональный баланс могут оказывать как сами приступы, так и эпилептиформные разряды на ЭЭГ. М. Molaie и соавт. (1986) показали изменения концентрации пролактина в плазме крови у больного эпилепсией со СПП под влиянием интериктальных эпилептиформных разрядов на ЭЭГ во время сна. Работа представляет значительный интерес, так как повышение уровня в сыворотке крови пролактина рассматривается как некий маркер эпилепсии. Это привело авторов к мысли о том, что продукция тестостерона может нарушаться иным способом, нежели под действием припадков как таковых, поскольку в большинстве исследований обнаружено увеличение уровня пролактина в крови после судорожных припадков и у 33% пациентов со сложными парциальными припадками (СПП). В других исследованиях было найдено его повышение, хотя и не столь значительное, при судорожных псевдоэпилептических приступах, анализируя данные литературы, заключают, что эпилептиформные разряды могут ассоциироваться с повышением концентрации пролактина в крови.
J. Bauer и соавт. (2000) на основании изучения динамики уровня тестостерона в крови у пациентов до и после височной лобэктомии (см. далее) пришли к выводу о прямом влиянии интериктальных разрядов на гормональный статус больных эпилепсией. По-видимому, в механизме нестабильного повышения уровня пролактина в крови основное значение имеет конвульсивный припадок как таковой, тем более что при абсансах повышение уровня пролактина в крови не найдено, однако и влияние эпилептиформных разрядов также весьма вероятно.
Антиэпилептические препараты (АЭП) могут оказывать существенное влияние на функциональное состояние репродуктивной системы у мужчин, что является доказанным в отношении ферментиндуцирующих антиэпилептических препаратах. Особенно ценное исследование было проведено на здоровых добровольцах: после приема в течение 7 дней карбамазепина (КМЗ) по 400 мг/сут отмечалось достоверное снижение уровня тестостерона, его свободной фракции и метаболитов, в то время как уровень связывающего гормоны глобулина (SHBG) повышался. При переводе пациентов с КМЗ на ОКЗ, обладающий минимальным ферментиндуцирующим влиянием, гормональные изменения исчезали. Этими же авторами было показано снижение концентрации в сыворотке крови у больных эпилепсией мужчин андрогенов под влиянием КМЗ и фенитоина. КМЗ и его комбинация с фенитоином вызывали повышение концентрации SHBG. В отличие от этого монотерапия вальпроатом не сопровождалась подобными изменениями гормонов, хотя, по данным исследования, проведенного J. Rattya и соавт. (2001), вальпроаты повышают концентрацию в сыворотке крови андростендиона. J. Dana-Haeri и соавт. (1982) установили уменьшение уровня свободного тестостерона под влиянием ферментиндуцирующих АЭП, однако обширное исследование В. К. Toon и соавт. (1983), изучавших содержание в сыворотке крови общего и свободного тестостерона, LH, FSH, пролактина и SHBG в большой популяции мужчин с различными формами эпилепсии, в течение длительного времени получавших КМЗ, вальпроаты, ФБ, примидон и этосуксимид, выявило повышение уровня всех указанных факторов. В то же время повышение уровня SHBG коррелировало с повышением связанного тестостерона и снижением его свободной фракции. Такие же отношения были выявлены между уровнем пролактина и свободного тестостерона. В результате авторы пришли к выводу о том, что длительное применение АЭП может приводить к тестикулярной недостаточности, потере ответа на повышение уровня LH, нарушению сперматогенеза.
Обычным результатом, по данным исследований, проведенных у мужчин с эпилепсией, являются обнаружение прогрессирующего повышения под влиянием ферментиндуцирующих АЭП уровня связывающего половые гормоны глобулина (SHBG) и резкое снижение свободной фракции тестостерона в сыворотке крови, что особенно детально было проанализировано J. I. Isojarvi и соавт. (1989, 1990). У 2/3 пациентов после 5 лет лечения наблюдалось снижение потенции. Подобные данные были получены также в исследованиях В. Stoffel-Wagner и соавт. (1998), касающихся уровня свободного тестостерона и SHBG. A. G. Herzog и соавт. (1992) выдвинули концепцию, согласно которой уровень свободного тестостерона снижается за счет не только увеличения связывающего тестостерон SHBG, но и активизации ароматазы, которая превращает свободный тестостерон в эстрадиол. Это подтверждается исследованиями G. Murialdo и соавт. (1994): уровень эстрадиола у мужчин, получавших фенитоин, был выше по сравнению с нелечеными и здоровыми мужчинами. Хронически низкий уровень тестостерона может приводить к тестикулярному поражению и гипогонадизму [Stoffel- Wagner В. et al., 1998[.
Р. Christensen, М. Lund (1975) пришли к выводу, что длительное употребление АЭП сопровождается падением уровня тестостерона с одновременным повышением уровня LG, что указывает на тестикулярную недостаточность, неспособность адекватного ответа тестикул на повышение уровня LG.
По сравнению со здоровыми мужчинами и больными эпилепсией с нормальной потенцией у больных эпилепсией мужчин с сексуальными расстройствами обнаружены достоверное повышение уровня сывороточного эстрадиола и снижение свободного тестостерона. По данным A. G. Herzog и соавт. (1995), такая обратная корреляция между пропорцией эстрадиол/свободный тестостерон была особенно выражена у пациентов, получавших фенитоин. Предполагается значение этих изменений в механизме гипосексуальности.
Следует иметь в виду, что повышение уровня эстрадиола стимулирует синтез SHBG, ведет к увеличению связанного тестостерона и снижению его свободной фракции в сыворотке крови.
Необходимо отметить, что, с одной стороны, повышение уровня эстрадиола выявлено у нелеченых мужчин, больных эпилепсией, а с другой — у них же спустя 2 мес. от начала лечения КМЗ отмечена нормализация концентрации этого показателя. В то же время, по данным других исследователей, не были выявлены достоверные различия уровня свободного тестостерона в группах больных, получавших и не получавших АЭП, в том числе КМЗ, однако J. Bauer и соавт. (2004) на большом клиническом материале (200 пациентов) подтвердили влияние ферментиндуцирующих АЭП, в частности КМЗ, на снижение отношения тестостерон/LH по сравнению с пациентами, находившимися на лечении вальпроатами, и заключили, что КМЗ может усиливать отрицательный эффект височно-долевой эпилепсии на продукцию тестостерона. Они также установили повышение уровня FSH у пациентов под влиянием лечения КМЗ.
Наше исследование было проведено на пациентах пубертатного возраста, поскольку формирование гормонального статуса происходит именно в этом возрасте и можно полагать повышенную уязвимость этого процесса к таким мощным воздействиям, каковыми являются эпилепсия и АЭП.
Были обследованы 70 лиц мужского пола в возрасте 14—18 лет. Из них:
- детей и подростков в дебюте заболевания эпилепсией до назначения АЭП;
- подростков с риском развития эпилепсии;
- клинически здоровых испытуемых соответствующего возраста, физического и полового развития (контрольная группа).
Учитывая изменения, происходящие в пубертатном периоде, все больные были разделены на две группы. Пациенты в возрасте 14—16 лет были отнесены к раннему пубертатному периоду — 8 человек (32%), в возрасте 17—18 лет — к позднему пубертатному периоду — 17 человек (68%). Таким образом, большинство обследованных больных были в позднем пубертатном периоде.
Все пациенты с дебютом эпилепсии имели не менее двух неспровоцированных эпилептических припадков; длительность заболевания не более 1 года.
Повторно обследованы 19 больных эпилепсией [все пациенты получали в качестве монотерапии КБЗ]. Помимо клинического обследования, применяли необходимые методы исследования:
- ЭЭГ-исследование: обзорная запись фоновой ЭЭГ на 16-канальном элекгроэнцефалографе с функциональными нагрузками;
- КТ или МРТ головного мозга, ЭхоЭС, УЗДГ, офтальмоскопия;
- исследование иммуноферментным методом базальной концентрации гипофизарных гормонов: LG, FSH и пролактина, а также половых стероидных гормонов: общего тестостерона, эстрадиола-17β, прогестерона;
- оценка тяжести приступов: шкала NHS3.
Были диагностированы следующие формы эпилепсии: симптоматическая — у 19 больных, криптогенная — у 5, идиопатическая — у 1 больного. У 10 больных приступы были сложными парциальными (СПП, ФПНО, Лига, 2017), генерализованными судорожными (ГСП) — у 8 больных, либо имело место сочетание СПП с ГСП — у 6 больных; у 1 больного — сочетание абсансов и ГСП. Распределение больных эпилепсией по типу эпилептического припадка с учетом локализации очага представлено в табл. 33.1.
Таблица 33.1. Распределение больных по типу эпилептического припадка с учетом расположения эпилептического очага
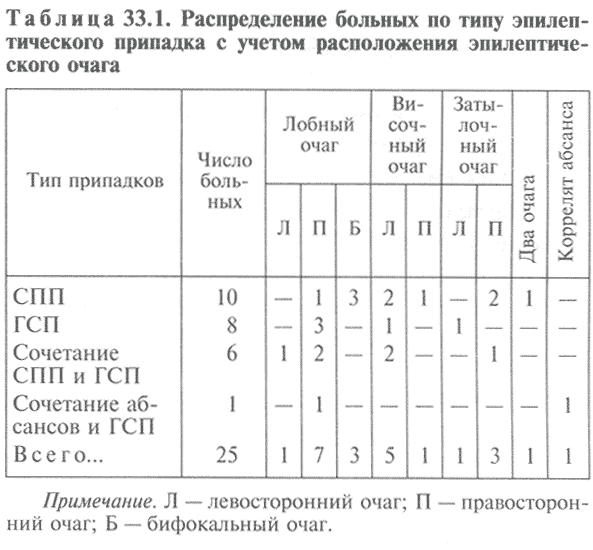
Среди больных с установленной локализацией эпилептического очага (22) преобладали больные с лобным очагом — 11, в том числе на ЭЭГ у 1 пациента выявлено сочетание лобного очага и типичного абсанса, а у 3 — двусторонние лобные очаги. У 6 больных определен височный очаг, у 4 — затылочный.
У 1 пациента было обнаружено 2 очага различной локализации. У 3 больных обзорная ЭЭГ не выявила эпилептической активности, вместе с тем у 2 из них была межполушарная асимметрия за счет преобладания амплитуды (по одному случаю в левом и правом полушариях).
По хронотипу зафиксированы припадки бодрствования у 23 пациентов, у 1 пациента были приступы только сна, 1 страдал асинхронными приступами. Интересно, что среди больных с лобным очагом преобладали правополушарные (отношение правополушарных к левополушарным 7:1) и было 3 больных с билатеральными очагами, а среди больных с височными очагами в основном были левополушарные (отношение правополушарных к левополушарным 1:5).
Данные ЭЭГ-исследования. В нашем исследовании средняя амплитуда a-ритма у больных эпилепсией до назначения АЭП практически не отличалась от амплитуды a-ритма у здоровых и лиц с риском развития эпилепсии. Это, вероятно, объясняется преобладанием в структуре эпилепсии парциальных (фокальных, МПЭЛ, 2017) форм (92% случаев), в том числе лобной и височной эпилепсии, при которой амплитуда, как правило, не превышает нормальные показатели.
На фоне проводимого противоэпилептического лечения у больных эпилепсией амплитуда а-ритма снизилась на 1/3.
По нашим данным, среди больных эпилепсией не выявлено существенного замедления а-ритма как до лечения, так и на фоне проводимой терапии. Этот показатель был сходен и в группе лиц с риском развития эпилепсии.
Выявленная дезорганизованность, сглаженное или атипичное зональное распределение а-ритма указывают на недостаточность активирующих влияний.
У 40% здоровых лиц в фоне регистрировались рассеянные Ө-волны с амплитудой, не превышающей фон (не более 15% от общей записи), что соответствует критериям нормальной ЭЭГ. Эти данные отличались от результатов обследования больных эпилепсией и лиц с риском ее развития. Так, у больных эпилепсией до назначения лечения диффузные 0-волны, занимающие более 15% записи, регистрировались в 60% случаев; у 16% больных выявлены диффузные острые волны; а очаговая активность в виде локальных пароксизмов Ө-волн — у 24% пациентов. На фоне проводимой терапии и положительной клинической динамики диффузные Ө-волны регистрировались у 31,57% больных по амплитуде, не превышающей фон.
У лиц с риском развития эпилепсии получены следующие данные: 50% обследуемых имели в фоне диффузные 0-волны, 30% — локальные изменения в виде 0-волн в лобных отведениях.
Таким образом, основные характеристики корковой активности больных эпилепсией и лиц с риском ее развития в данных группах обследуемых были сходны.
Фотостимуляция вызывала пароксизмы билатеральносинхронных острых и медленных волн (12%), комплексов пик—волна (4%) только у больных эпилепсией до лечения.
Гипервентиляция у всех обследуемых вызывала замедление и нарастание амплитуды а-ритма, а в группе больных эпилепсией и у лиц с риском развития эпилепсии приводила к нарастанию амплитуды 0-ритма, появлению б-волн, большей выраженности истинно эпилептиформных феноменов.
Исследование гонадотропных гормонов у больных эпилепсией (LH, FSH, пролактин). В группе больных эпилепсией как в позднем пубертатном периоде, так и в раннем отмечена тенденция к снижению уровня пролактина до назначения препаратов, однако различие оказалось недостоверным. На фоне проводимого лечения КБЗ выявлено достоверное снижение уровня пролактина в группе больных в позднем пубертатном периоде по сравнению с исходными данными и показателями контрольной группы. В группе больных эпилепсией в раннем пубертатном периоде тенденция к гипопролактинемии оказалась недостоверной. Анализ тенденции изменения уровня пролактина во всей группе выявил достоверное снижение уровня пролактина в группе больных, принимавших КБЗ, по сравнению с контролем, однако тенденция к гипопролактинемии у больных эпилепсией на фоне лечения по сравнению с исходными данными оказалась недостоверной.
У больных эпилепсией, как в позднем пубертатном периоде, так и раннем, до лечения отмечена тенденция к снижению уровня LH, FSH, которая оказалась недостоверной. Анализ данных гормональных показателей выявил также аналогичную тенденцию у всех больных в целом. На фоне проводимого лечения показатели гормональных исследований больных и контрольной группы практически не отличались. В группе лиц позднего пубертатного периода уровень LH повышался на фоне лечения, но не был выше по сравнению с контролем; FSH у больных до лечения был несколько выше по сравнению с контрольными данными и больными, получавшими лечение. В группе больных раннего пубертатного периода и в целом у всех больных выявлена следующая тенденция: уровень LH снижался в группе больных по сравнению с исходными данными и был выше по сравнению с контрольными данными; концентрация FSH была выше у больных раннего пубертатного периода по сравнению с исходными данными и контрольными показателями.
Исследование половых стероидных гормонов у больных эпилепсией (общего тестостерона, эстрадиола-17β, прогестерона). В группе больных эпилепсией позднего пубертатного периода отмечено достоверное увеличение уровня общего тестостерона по сравнению с контролем. На фоне проводимого лечения выявлено достоверное снижение гормона в данной группе. Таким образом, показатели здоровых лиц и больных эпилепсией на фоне лечения КБЗ практически не различались (недостоверное снижение общего тестостерона в группе больных эпилепсией, принимающих КБЗ). В группе больных раннего пубертатного периода изменения уровня общего тестостерона оказались недостоверными: на фоне лечения уровень данного гормона снижался и выявлялась тенденция к его снижению по сравнению с контрольными показателями. Анализ изменения концентрации общего тестостерона у всех больных выявил тенденцию к увеличению общего тестостерона у больных эпилепсией до лечения по сравнению с контрольной группой: на фоне проводимой терапии концентрация общего тестостерона достоверно снижалась по сравнению с исходными данными и выявлялась тенденция к снижению у больных на фоне лечения по сравнению с контрольными данными.
Результаты исследования показателей эстрадиола- 17β свидетельствуют о том, что в группе больных раннего пубертатного периода, как и в целом у всех больных, изменений концентрации данного полового стероида не отмечалось, поскольку тенденция к снижению уровня гормона до лечения оказалась недостоверной; а в группе позднего пубертатного периода данный показатель был несколько выше. На фоне лечения уровень эстрадиола-17β в группе больных эпилепсией практически не отличался от показателей у здоровых лиц: в группе больных позднего пубертатного периода выявлена тенденция к увеличению показателей по сравнению с исходными данными и контролем; в группе раннего пубертатного периода и в целом у всех больных выявлена тенденция к снижению эстрадиола-17β по сравнению с исходными данными и контролем. Тем не менее, учитывая пути метаболизма общего тестостерона, следует иметь в виду, что увеличение концентрации данного гормона ведет не к повышению уровня эстрогена, а, возможно, к увеличению фракции свободного тестостерона. Таким образом, повышение уровня общего тестостерона у больных эпилепсией в дебюте заболевания до назначения лечения имеет, видимо, компенсаторный характер, поскольку тестостерон обладает противосудорожным эффектом, повышая порог пароксизмальной активности.
Уровень прогестерона в группе больных позднего пубертатного периода и в целом у всех больных оказался выше контрольных показателей, однако эти данные были недостоверными. На фоне лечения отмечено достоверное снижение уровня гормона, но по сравнению с контролем показатели были несколько выше. Изменения в группе больных эпилепсией раннего пубертатного периода также недостоверны: снижение не только уровня прогестерона у больных эпилепсией до лечения, но и по сравнению с исходными данными и контролем.
Исследование гонадотропных гормонов (LH, FSH, пролактин) у лиц с риском развития эпилепсии. Тенденция к снижению уровня пролактина в группе лиц с риском развития эпилепсии оказалась недостоверной. Не выявлено достоверных различий в уровне концентрации LH. Уровень FSH в группе лиц с риском развития эпилепсии оказался достоверно ниже нормального значения.
Исследование половых стероидных гормонов (общего тестостерона, эстрадиола-17β, прогестерона). В анализируемой группе обследуемых увеличение уровня общего тестостерона и снижение уровня эстрадиола-17β были недостоверны, однако концентрация прогестерона, обладающего противосудорожным эффектом, оказалась достоверно выше нормального значения. Следовательно, можно предположить, что указанные гормональные изменения у лиц с риском развития эпилепсии являются компенсаторными, которые не позволяют реализоваться факторам риска в заболевание.
Мы также проанализировали соотношения различных гормональных показателей: LH/FSH, FSH/ общий тестостерон, LH/эстрадиол-17β. У лиц с риском развития эпилепсии и в группе больных как раннего, так и позднего пубертатного периода, а также у всех больных эпилепсией в целом не выявлено достоверных различий по сравнению с группой контроля.
При анализе гормональных показателей в группе больных эпилепсией с учетом локализации очага было обнаружено, что у пациентов с лобной локализацией очага на фоне приема АЭП снижена концентрация пролактина и общего тестостерона по сравнению с контролем. В группе больных височной эпилепсией все показатели достоверно не отличались от контрольных данных. Возможно, это связано с малочисленностью группы больных с височной локализацией очага, а также с тем, что указанные группы составили больные как раннего, так и позднего пубертатного периода.
Анализ гормональных показателей с учетом латерализации эпилептического очага не выявил из-менений в группе больных эпилепсией с левополушарным очагом как до лечения, таки на фоне приема АЭП. В группе больных с правополушарным очагом на фоне приема АЭП по сравнению с контролем выявлено достоверное снижение уровня пролактина и эстрадиола-17р. По данным литературы, также большие изменения выявляются при правополушарной лимбической эпилепсии. Это можно объяснить влиянием правого полушария на вегетативно-висцеральную и гормональную функции.
Как указывалось ранее, важнейшими факторами, влияющими на гормональный статус больных эпилепсией, могут быть припадки и АЭП.
Наша работа принципиально отличается от большинства исследований, посвященных изучению роли гормональных изменений в эпилептогенезе, тем, что оба этих фактора в стартовых исследованиях были исключены.
Полученные нами данные показывают, что гормональные изменения у лиц мужского пола с риском развития эпилепсии в пубертате предшествуют появлению эпилептических припадков и могут рассматриваться как факторы риска и антириска эпилепсии. Можно полагать, что изменения в гипофизарно-гонадном статусе, в частности достоверное увеличение концентрации прогестерона — гормона с антиконвульсивной активностью, носят компенсаторный характер.
Увеличение у пациентов в дебюте заболевания эпилепсией концентрации общего тестостерона — другого гормона с антиконвульсивным действием — свидетельствует о том, что соответствующие гормональные изменения оказываются недостаточными для полноценного противодействия эпилептогенезу.
В то же время исследования в группе больных с дебютом эпилепсии, продолженные после начала лечения, подтвердили данные литературы о снижении под влиянием терапии ферментиндуцирующими АЭП (в данном случае карбамазепином) уровня общего тестостерона в сыворотке крови.
Таким образом, очевидно, что действие фермент- индуцирующих АЭП не связано с повышением уровня гормонов, обладающих противоэпилептическим влиянием. Более того, они дают антиэпилептический эффект вопреки их отрицательному действию на уровень тестостерона. Согласно данным литературы, подобного не установлено для АЭП, не обладающих ферментиндуцирующими свойствами. Естественно, можно полагать значимость влияния указанного побочного действия АЭП в развитии сексуальной дисфункции у мужчин при пролонгированном лечении.
Исследований, подобных нашим, в литературе не было. Результаты этих исследований были опубликованы нами более 20 лет назад, однако в поздней аналогичной работе ссылок на наши данные нет также изучали гормональный статус пациентов мужского пола в пубертате, но все они получали различные АЭП, влияние которых на гормональный статус весьма вероятно, и оно было обнаружено в нашей работе в отношении КМЗ (влияние вальпроатов не изучалось).
В последующие годы все большее распространение получают АЭП новых поколений, в связи с чем их влияние на уровень половых гормонов имеет практический интерес. Некоторые данные об ОКЗ были приведены ранее. Кстати, они были подтверждены в более поздних исследованиях. В настоящее время ОКЗ можно считать препаратом выбора при СЭ у мужчин.
Что касается ламотриджина, то A. G. Herzog и со-авт. (2004), изучившие три группы мужчин с парциальной эпилепсией: получавших ферментиндуцирующие АЭП, ламотриджин и не получавших АЭП, — в группе больных, получавших ламотриджин, не обнаружили разницы по сравнению с контрольной группой, в то время как в группе больных, получавших ферментиндуцирующие АЭП, имели место более низкий уровень SHBG и более высокое соотношение свободного тестостерона к эстрадиолу. В более поздней работе они сообщили о том, что ферментиндуцирующие АЭП по сравнению с ламотриджином связаны с более благоприятным профилем уровня стероидного баланса (ниже уровень д-гидроэпиандростерона сульфата и выше отношение андростендиона к эстрадиолу), однако издержками являются снижение биодоступности тестостерона и сексуальной функции подтвердили, что у пациентов, леченных КМЗ, было более значительное повышение SHBG и свободного тестостерона по сравнению с пациентами, получавшими вальпроаты и новые АЭП — ламотриджин, топамакс и левитирацетам.
В ряде исследований изучали сперматогенез. Наиболее обстоятельное исследование провели J. I. Isojarvi и соавт. (2004), установившие, что карбамазепины или парциальные эпилепсии могут снижать концентрацию, изменять морфологию и подвижность сперматозоидов, а вальпроаты или генерализованные эпилепсии — их морфологию и подвижность, окскарбазепин — только морфологию. Тем не менее височно-долевая эпилепсия как таковая может сочетаться с изменениями уровня GRH и тестостерона, чем можно объяснить изменения спермы.
Если исследования профиля половых гормонов и качества спермы не представляют серьезных ме-тодологических трудностей, то этого никак нельзя сказать об изучении сексуальных возможностей и сексуального поведения. Как справедливо подчеркивают G. Montouris и G. L. Morris (2005), пациенты стесняются обсуждать эту тему, а врачи также считают это для себя неудобным. Согласно проведенному авторами изучению данных литературы, нарушения сексуального желания и возбуждения наблюдались у 66% мужчин, больных эпилепсией.
G. Luef (2005) в своем сжатом обзоре заключает, что АЭП оказывают неблагоприятное влияние на мужскую половую сферу, действуя непосредственно на кору большого мозга и опосредованно через гормональную поддержку сексуального поведения.
Вероятно, здесь имеет место значение трех составляющих: эпилептогенного очага, АЭП и психоэмоциональных факторов.
М. Morrell (1997) отмечает роль кортикального механизма — органического поражения или эпилептиформной активности, что особенно относится к лимбическим структурам. При этом, помимо нарушений функций половых гормонов, могут иметь значение расстройства нейротрансмиттерных систем: ГАМКергической, опиоидной и серотонинергической.
Отмечено отсутствие спонтанной утренней эрекции, недостаточной эрекции при половом возбуждении, аноргазмии.
В этом плане особенно интересно исследование G. Murialdo и соавт. (1995), поскольку наблюдались мужчины, находившиеся на монотерапии и достигшие устойчивой клинико-ЭЭГ-ремиссии, так что непосредственное участие припадков и эпилептиформных разрядов можно было исключить. При сравнении двух групп пациентов с нормальной и сниженной сексуальностью (импотенцией) значительная разница была только по содержанию эстрадиола, хотя снижение уровня SHBG по сравнению со здоровыми имело место в обеих группах наблюдений. В другом исследовании, где изучали гормональный профиль и на основании индивидуального интервью оценивали сексуальное поведение, было выявлено, что гипосексуальность напрямую связывается с низким уровнем тестостерона. Е. Tauboll (2007) связал снижение у мужчин либидо, потенции и трудности достижения оргазма напрямую с гипогонадизмом. У мужчин, больных эпилепсией, тщательное интервьюирование выявило снижение сексуального желания и возбуждения. В более поздней работе G. Sare и соавт. (2007) этот фактор зафиксировали у 48% мужчин, больных эпилепсией. М. Morrell и соавт. (1994) было найдено уменьшение генитальной вазоконгестии в ответ на сексуальные стимулы у мужчин и женщин с височной эпилепсией. Вероятное значение церебрального компонента отмечено в работах R. Hierons, М. Saunders (1996). Импотенцию отмечали у 12 из 15 больных эпилепсией мужчин, причем у 3 ее возникновению за несколько мес. предшествовало появление припадков. Автор указывает на непосредственную роль передней части височной доли. В другом исследовании подчеркивается значение иктальной активности в медиальных височных структурах: сексуальная мотивация была утрачена после начала припадков и возобновилась после височной лобэктомии.
Естественно, что имеют значение и другие факторы — локализация эпилептического очага и сами припадки, как это было показано еще в 1967 г. указанными авторами на больных, перенесших хирургическое лечение, и позже подтверждено другими учеными.
Поскольку старая кора (гиппокамп) и подкорка (миндалина) являются структурами, стоящими на вершине церебрально-гипофизарно-гонадной оси, а мезиальная височная эпилепсия — это та эпилепсия, при которой эпилептогенные очаги находятся в этих и соседних структурах, возникает закономерный вопрос о сексуальной функции и уровне половых гормонов у больных височной мезиальной эпилепсией и невисочной эпилепсией.
В исследованиях J. Bauer (2004) установлено, что расположение очага в височной доле сочетается с более низким уровнем общего и свободного тестостерона по сравнению с экстратемпоральным очагом. Именно на модели височной эпилепсии наиболее очевидны нарушения биодоступности тестостерона, снижение концентрации гонадотропин-стимулирующего гормона, ответа LG на GRH, а также пролактина.
В ряде исследований показано влияние АЭП на сперматогенез. J. 1. Isojarvi и соавт. (2004) выявили уменьшение объема тестикул у больных генерализованной эпилепсией, получающих вальпроат, в то время как у пациентов с парциальной эпилепсией, леченных КМЗ, этого фактора не было. В этой же группе больных генерализованной эпилепсией было обнаружено изменение морфологии и подвижности сперматозоидов, а в группе больных парциальной эпилепсией, принимающих КМЗ, тестикулярный объем не отличался от контроля.
Указанные гормональные нарушения лежат в основе сексуальной дисфункции у мужчин, больных эпилепсией, они имеют место в 1/3—2/3 случаев.
Непосредственный механизм снижения потенции был исследован Sh. A. Hamed и соавт. (2015) с помощью дуплексной ультразвуковой сонографии. Кроме того, оценено васкулярное состояние полового члена в двух группах мужчин: больных эпилепсией и в группе контроля. Артериальная недостаточность и ее сочетание с венозной была установлена почти поровну у 84,62% больных. При этом была выявлена корреляция с длительностью заболевания и со степенью тревоги. Предполагается роль как эпилепсии, так и системного атеросклероза [Hamed Sh.A. et al., 2015].
Несомненна также роль социальных и психических факторов, в частности низкой самооценки в связи с болезнью и оценкой своих возможностей. Более того, S. Duncan (2005), не найдя существенных различий между больными эпилепсией и здоровыми мужчинами в возрасте 18—60 лет по уровню свободного тестостерона, эстрадиола и андростендиона, полагает, что психоэмоциональное состояние является главным фактором, влияющим на сексуальные нарушения у мужчин при эпилепсии.
Irina Moos (2014) в докладе «Я не вполне мужчина» справедливо подчеркнула, что сексуальность оказывает большое влияние на идентификацию, самосознание и соматические ощущения мужчин, больных эпилепсией.
Интересно, что у больных эпилепсией мужчин встречаются оргазминдуцируемые припадки. A. Sengupta и соавт. (2010) опубликовали уникальное наблюдение, поскольку во время оргазма была записана ЭЭГ и обнаружен очаг в левой гемисфере (см. гл. 18).
Естественно, встает вопрос, возможна ли медикаментозная коррекция этих нарушений заместительной терапией, т.е. применением тестостерона. В литературе есть данные о положительном эффекте такого лечения, в частности при внутримышечном введении тестостерона, однако, по другим данным, улучшение недостаточно действенно, чтобы обойтись одним тестостероном. Причиной является активация превращения тестостерона в эстрадиол, поэтому более результативно применение сочетания тестостерона с ингибитором ароматазы — фермента, метаболизирующего тестостерон в эстрадиол. Показана достаточная эффективность такого сочетания при использовании тестолактона, при этом у пациентов увеличивалось содержание в крови тестостерона и снижалось содержание эстрадиола. В другой публикации сообщалось о пациенте, у которого под влиянием только одного ингибитора ароматазы (в данном случае летрозола) улучшилась потенция, при этом уровень тестостерона повышался также, как LH и FSH, aSHBG снижался. Следует помнить, что виагра и родственные ей препараты метаболизируются в печени с помощью цитохрома Р450, поэтому их применение в сочетании с ферментиндуцирующими АЭП нецелесообразно.
Есть еще один аспект эпилепсии, который привлекает достаточное внимание в отношении женщин и практически не исследован у мужчин: отношение к своей болезни и оценка пациентом влияния эпилепсии на его статус. Пробел в известной степени восполнило исследование, проведенное в Великобритании. Был разработан подробный опросник — 1200 вопросов. В исследовании приняли участие 373 пациента, ответы которых были проанализированы. Главными факторами неудовлетворенности в связи с влиянием эпилепсии и лечения были запрет на вождение автомобиля; изменение типа работы с уменьшением заработка; отрицательное влияние на память. Интересно, что большинство мужчин ответили, что болезнь не мешает им быть хорошими родителями, а также отношениям с партнерами. При этом соответственно 37 и 24% опрошенных ответили, что данный вопрос не относится к ним, так как они одиноки. Эти цифры соответствуют общедемографическим данным.
Таким образом, на первом и втором местах оказались традиционно социальные мужские приоритеты — автомобиль и работа.
Купить медицинскую литературу по неврологии в интернет-магазине медицинской книги shopdon.ru
Дополнительный материал к лекции
Лечение эпилепсии у взрослых и детей. Кетогенная диета
Книга "Эпилепсия у детей и взрослых женщин и мужчин. Руководство для врачей"
Автор: Карлов В. А.

В руководстве представлены результаты 60-летней работы автора в области детской и взрослой неврологии и эпилептологии. Впервые эпилептология представлена в возрастном континууме. Рассмотрен гендерный аспект эпилепсии, особенно важный у женщин. Представлены аспекты сущности эпилепсии, механизмов противоэпилептической защиты и пароксизмальности мозга. В течение 30 лет изучался патогенез абсансных припадков, впервые было показано их очаговое происхождение.
На базе представления о стимулсенситивных припадках рассмотрено взаимоотношение между затылочным и лобным центрами зрительной функции, динамика концепции эпилептического статуса с учетом его пятидесятилетнего изучения; впервые обнаружены и изучены альтернативные взаимоотношения между судорожными эпилептическими припадками и дисфорией, значение коморбидности у больных эпилепсией с внезапной необъяснимой смертью.
Особое внимание уделено современной стратегии и тактике лечения эпилепсии, включая альтернативные методы. Рассмотрены социальные и биоэтические аспекты эпилепсии, предложен алгоритм этического сопровождения лечения различных уязвимых групп пациентов с эпилепсией.
Руководство предназначено для научных работников и практикующих врачей — неврологов, эпилептологов, психиатров, педиатров, а также других специалистов, имеющих отношение к эпилепсии.
Купить медицинскую литературу по неврологии в интернет-магазине медицинской книги shopdon.ru
Содержание книги "Эпилепсия у детей и взрослых женщин и мужчин. Руководство для врачей" - Карлов В. А.
Глава 1. Основные факторы риска эпилепсии
Глава 2. Генетика эпилепсии
Глава 3. Патофизиология эпилепсии
Глава 4. Нейрофизиологические методы исследования
4.1. Электроэнцефалография (ЭЭГ)
4.2. ЭЭГ в диагностике и контроле эпилепсии
4.3. ЭЭГ и нейровизуализация эпилептогенного фокуса — метод многошаговой дипольной локализации (МДЛ)
4.4. Вызванные потенциалы мозга (ВП) в диагностике и контроле за лечением эпилепсии
4.5. Транскраниальная магнитная стимуляция: применение в эпилептологии
4.6. Магнитная энцефалография
Глава 5. Церебральные дисгенезии, их МРТ-диагностика
Глава 6. Эпилептический припадок и эпилепсия: классификация, дефиниции, сущность эпилепсии
Глава 7. Вокруг эпилептического припадка
Глава 8. Эпилепсия у детей. Ранние постнатальные энцефалопатии
8.1. Детская эпилептология как особый раздел неврологии и педиатрии
8.2. Органическая патология головного мозга
8.2.1. Интранатальные поражения
8.2.2. Перинатальные поражения
8.3. Нарушения обмена веществ
8.3.1. Неонатальные судороги при врожденных дефектах метаболизма
8.3.2. Неонатальные судороги при нарушениях баланса глюкозы и электролитов
8.4. Факоматозы
8.5. Хромосомные аномалии
8.6. Медикаментозно-индуцируемые неонатальные судороги
8.7. Самолимитирующиеся судороги
8.7.1. Самолимитирующиеся неонатальные судороги (доброкачественные неонатальные судороги)
8.7.2. Самолимитирующаяся семейная неонатальная эпилепсия (доброкачественные семейные неонатальные судороги)
8.8. Неонатальные эпилепсии с паттернами супрессия—вспышка
8.8.1. Ранняя миоклоническая энцефалопатия (ЕМЕ)
8.8.2. Отахара синдром
8.8.3. (Тяжелые) эпилепсии младенчества
8.8.3.1. Тяжелая эпилепсия с множественными фокусами спайков
8.8.3.2. Младенческая эпилепсия с мигрирующими фокальными припадками
Глава 9. Эпилептический инфантильный спазм и синдром Веста
Глава 10. Фебрильные припадки, генетическая эпилепсия с фебрильными припадками плюс (GEFS+) и FIRES синдром
Глава 11. Эпилепсия с преобладанием приступов падения
11.1. Синдром Леннокса—Гасто
11.2. Псевдосиндром Леннокса—Гасто (псевдо-Леннокса синдром)
11.3. Эпилепсия с миоклоноатоническими (ранее миоклоноастатическими) припадками
Глава 12. Самокупирующиеся или фармакореактивные (доброкачественные) эпилепсии детского возраста
12.1. Детская затылочная эпилепсия с ранним началом (синдром Панайотопулоса)
12.2. Самокупирующаяся эпилепсия с центральновисочными спайками (ECES)
12.3. Атипичные синдромы, родственные самокупирующейся парциальной эпилепсии с центрально-височными спайками
12.4. Самокупирующаяся эпилепсия с аффективными симптомами
12.5. Затылочная эпилепсия детей с поздним началом (тип Гасто)
Глава 13. Ландау—Клеффнера синдром
Глава 14. Абсансные формы эпилепсии
14.1. Абсанс
14.2. Абсансная эпилепсия раннего детского возраста
14.3. Детская абсансная эпилепсия
14.4. Юношеская абсансная эпилепсия
Купить медицинскую литературу по неврологии в интернет-магазине медицинской книги shopdon.ru
Глава 15. Эпилепсии с преимущественно миоклоническими феноменами. Миоклонические эпилепсии
15.1. Миоклонические эпилепсии раннего детского возраста
15.1.1. Драве синдром
15.1.2. Самолимитирующаяся миоклоническая
эпилепсия раннего детского возраста
15.2. Эпилепсия с миоклоническими абсансами
15.3. Миоклония век с абсансами (эпилептический миоклонус век)
15.4. Периоральный миоклонус с абсансами
15.5. Юношеская миоклоническая эпилепсия
15.6. Прогрессирующие миоклонус-эпилепсии
15.6.1. Болезнь Унферрихта—Лундборга
15.6.2. Болезнь Лафоры
15.6.3. Цероидный нейрональный липофусциноз
15.6.4. Сиалидозы
15.6.5. Миоклонус-эпилепсия, сочетающаяся с митохондриальной энцефаломиелопатией
15.6.6. Лечение прогрессирующих миоклонус - эпилепсий
Глава 16. Эпилептическая энцефалопатия
Глава 17. Эпилепсия с дебютом у подростков
Глава 18. Стимулсенситивная эпилепсия
18.1. Фотосенситивная эпилепсия
18.1.1. Припадки, вызываемые световыми мельканиями. Чистая фотосенситивная эпилепсия
18.1.1.1. Бытовые факторы провокации
18.1.1.2. Телевизионная эпилепсия и эпилепсия видеоигр
18.1.1.3. Фотосенситивная эпилепсия со спонтанными припадками
18.1.1.4. Фотосенситивные припадки самовызывания
18.1.2. Визуальные припадки, индуцированные несветовыми мельканиями
18.1.2.1. Патгернсенситивные припадки
18.1.2.2. Припадки, индуцированные закрытием глаз
18.1.3. Самоиндуцированные припадки
18.1.4. Лечение фотосенситивной эпилепсии
18.2. Стимулсенситивные припадки, вызываемые незрительными воздействиями
18.2.1. Припадки, вызываемые мышлением (thinking-эпилепсия)
18.2.2. Припадки, вызываемые испугом (startleэпилепсия)
18.2.3. Припадки, вызываемые звуком (soundэпилепсия)
18.2.4. Эпилепсия, вызываемая музыкой
18.2.5. Эпилепсия ходьбы
18.2.6. Эпилепсия чтения
18.2.7. Эпилепсия еды
18.2.8. Эпилептические припадки, индуцируемые смехом. Эпилептические припадки смеха
18.2.8. Эпилепсия горячей воды
18.2.10. Эпилепсия оргазма
18.3. Фотосенситивность и проблема взаимоотношения затылочной и лобной коры
Глава 19. Височная эпилепсия
19.1. Учение о височной эпилепсии
19.2. Методы нейровизуализации при височной эпилепсии
19.3. Лимбическая эпилепсия
19.4. Неокортикальная (латеральная) височная эпилепсия
19.4.1. Аутосомно-доминантная эпилепсия со слуховыми проявлениями ADEAF
19.4.2. Другие семейные височные эпилепсии
Глава 20. Лобно-долевая эпилепсия
20.1. Учение о лобно-долевой эпилепсии
20.2. Префронтальная эпилепсия
20.3. Эпилепсия с гиперкинетическими припадками сна (ранее аутосомно-доминантная ночная лобная эпилепсия)
Глава 21. Эпилепсия проекционной сенсомоторной коры (джексоновская эпилепсия)
21.1. Джексоновская эпилепсия, вызванная резидуально-органической патологией
21.2. Джексоновские припадки при опухолях головного мозга
21.3. Джексоновские припадки при артериальных и венозных аневризмах лобно-теменной области
21.4. Джексоновские припадки при хронической ишемии мозга
21.5. Джексоновские припадки дисметаболического происхождения
Глава 22. Структурная заднекорковая эпилепсия
22.1. Теменная эпилепсия
22.2. Затылочная эпилепсия
Глава 23. Эпилепсия Кожевникова и энцефалит Расмуссена
Глава 24. Эпилепсия с генерализованными тонико-клоническими припадками пробуждения GTCA (эпилепсия с припадками «вокруг сна»)
Глава 25. Идиопатическая эпилепсия взрослых
Глава 26. Эпилептические припадки с поздним началом. Развивающийся и стареющий мозг, цереброваскулярные заболевания и эпилепсия
26.1. Эпилептические припадки с поздним началом
26.2. Развивающийся и стареющий мозг, цереброваскулярные заболевания и эпилепсия
Глава 27. Расстройства психики при эпилепсии
27.1. Иктальные психические нарушения
27.2. Основные интерпароксизмальные расстройства
27.3. Постпароксизмальные психотические состояния
27.4. Изменение личности
27.5. Нарушение познавательных функций
27.6. Неотложная терапия
27.7. Нейропсихологические состояния, ассоциированные с эпилепсией: депрессия и тревога
Глава 28. Головная боль, мигрень и эпилепсия
28.1. Головная боль
28.2. Мигрень-эпилепсия
Глава 29. Эпилептический статус
29.1. Эпидемиология
29.2. Дефиниция и классификация
29.3. Эпилептический статус судорожных припадков
29.4. Эпилептический статус миоклонических припадков
29.5. Эпилептический статус бессудорожных припадков
29.6. Эпилептический статус у детей
29.7. Эпилептический статус de novo
Глава 30. Внезапная необъяснимая смерть больных эпилепсией
Глава 31. Качество жизни больных эпилепсией
Глава 32. Эпилепсия у женщин
32.1. Синдром катамениальной эпилепсии
32.2. Фармакогормональные аспекты и сопутствующая патология женской половой сферы
32.3. Эпилепсия и беременность
32.4. Эпилепсия и менопауза
Глава 33. Эпилепсия у мужчин
Глава 34. Анти эпилептические препараты (АЭП)
34.1. Классические (старые) АЭП и бензодиазепины
34.2. Базовые АЭП
34.3. Антиэпилептические препараты новых поколений, АЭП «на выходе» и вспомогательного действия
34.3.1. АЭП новых поколений
34.3.2. АЭП в разработке
34.3.3. АЭП вспомогательного действия
Глава 35. Клиническая фармакология АЭП
Глава 36. Взаимодействие АЭП как клиническая проблема
Глава 37. Побочные эффекты АЭП
Глава 38. Проблема терапевтического лекарственного мониторинга и замены АЭП
Глава 39. Фармакотерапия эпилепсии
39.1. Основные принципы стратегии и тактики
39.2. Проблемы терапии при первом эпилептическом припадке, назначения и отмены АЭП при медикаментозной ремиссии эпилептических припадков
Глава 40. Антиэпилептические препараты и эпилептические припадки
Глава 41. Фармакорезистентность и толерантность при эпилепсии
Глава 42. Немедикаментозные методы лечения
42.1. Хирургия эпилепсии
42.2. Кетогенная диета
42.3. Стимуляция головного мозга
42.3.1. Глубокая стимуляция мозга
42.3.2. Транскраниальная магнитная стимуляция (ТМС)
42.4. Вагус-стимуляция
42.5. Последовательность применения альтернативных методов лечения эпилепсии у детей
Глава 43. Пароксизмальный мозг
Глава 44. Современность и эпилепсия.
Социальные и биоэтические аспекты эпилепсии
Приложение: инсуларная эпилепсия
Купить медицинскую литературу по неврологии в интернет-магазине медицинской книги shopdon.ru


























































































0 комментариев