Миопатия: электромиография в диагностике и ЭМГ-признаки различных форм
Лекция для врачей "Миопатия: электромиография в диагностике и ЭМГ-признаки различных форм" (отрывок из книги "Электромиография в диагностике нервно-мышечных заболеваний" - Гехт Б. М., Касаткина Л. Ф., Самойлов М. И., Санадзе А. Г.)
Электромиография в диагностике миопатий
Существующие классификации заболеваний мышц в связи с отсутствием достаточно обоснованных представлений об этиологии и патогенезе этих страданий во многом, а порой и полностью, противоречивы. Следует уточнить, что в данном разделе приводится анализ большой группы патологических состояний, обусловленных первичным страданием мышечного субстрата (например, прогрессирующие мышечные дистрофии), изменением свойств мембраны мышечных волокон (миотония и миоплегия), воспалительным заболеванием мышц (полимиозит).
Все первично-мышечные поражения характеризуются близкими, но не идентичными изменениями ПДЕ (потенциалов двигательных единиц). Изучение параметров ПДЕ при различных формах миопатий выявило общие закономерности их изменений, заключающиеся в уменьшении их средней длительности, снижении амплитуды и появлении большого количества полифазных потенциалов (рис. 1.19). Однако только первая из отмеченных особенностей свойственна почти всем формам миопатий. Уменьшение длительности определенного количества или большинства ПДЕ наблюдается почти во всех мышцах больных с первично-мышечными заболеваниями. Гистограмма распределения ПДЕ по длительности смещается в сторону меньших величин (1 и 2 ЭМГ-стадии). В тяжелых случаях степень снижения длительности может достигать 80 %, а длительность отдельных ПДЕ может соответствовать длительности ПД (потенциала действия) одного мышечного волокна (2–3 мс).
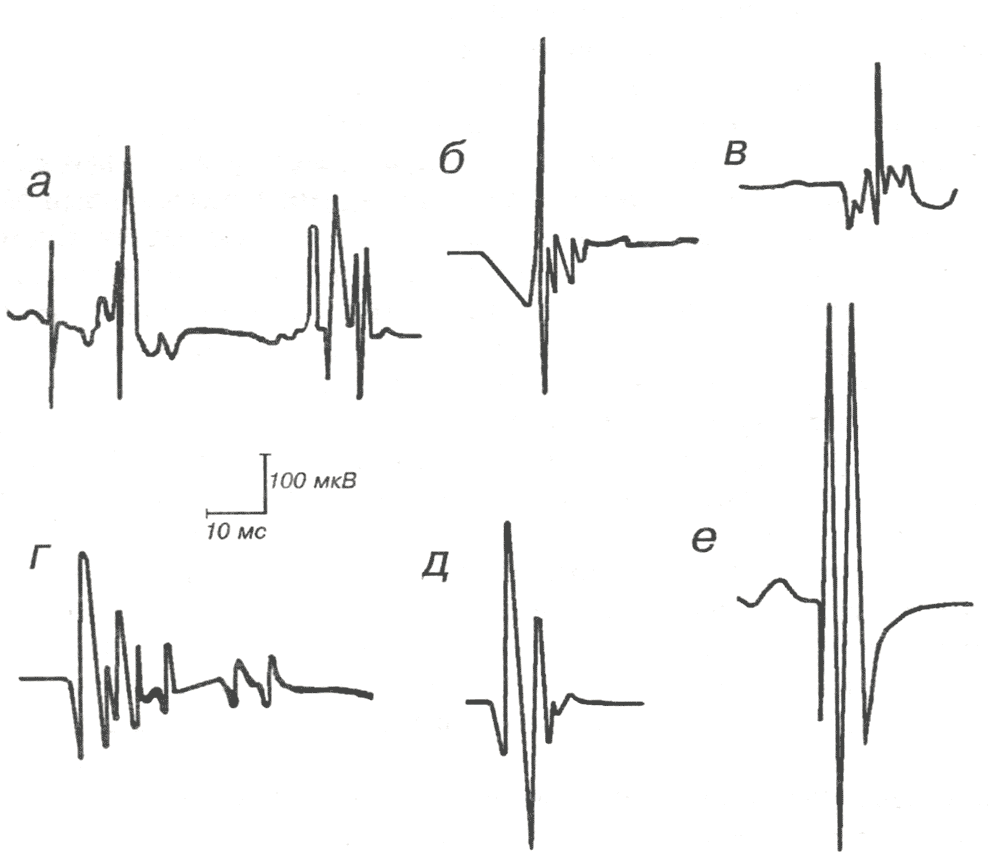
Рис. 1.19. Полифазные ПДЕ, регистрируемые при миопатиях:
а — при воспалительных миопатиях; б, в, г — при прогрессирующих мышечных дистрофиях; д, е — при полимиозите на фоне лечения кортикостероидными препаратами.
Первично-мышечные заболевания характеризуются выпадением мышечных волокон из состава ДЕ (двигательной единицы), вследствие чего происходит уменьшение средних величин амплитуды и длительности ПДЕ, увеличение числа полифазных ПДЕ (Kugelberg, 1947, 1949), значительно сокращается время нарастания основного компонента. Однако наши данные показали, что у больных с первично-мышечными заболеваниями в ряде случаев выявлялись ПДЕ повышенной амплитуды и увеличенной длительности.
При первично-мышечных заболеваниях наименьшая величина длительности ПДЕ, выявленная у обследованных нами больных, составила 18 % (2,0 мс), наибольшая — 270 % (30,0 мс), что в 2,7 раза больше нормы. Средняя нормализованная длительность находилась на нижних границах нормы, составляя 88,6 ± 25,8 % с разбросом величин в отдельных мышцах от 29 до 154 %. В отдельных мышцах максимальная величина длительности ПДЕ составляла всего 41 % (4,6 мс), в других мышцах минимальная длительность ПДЕ составляла 102 % (11 мс).
Среднее число ПДЕ, по длительности превышающее нормальные величины, составило всего 8,3 ± 13,0 %, но в одной мышце оно составило 50 %.
Амплитуда ПДЕ в мышцах больных с первично-мышечными заболеваниями колебалась в очень широких пределах — от 36 мкВ до 13,5 мВ, причем эта максимальная амплитуда была зафиксирована в одной мышце больного с полимиозитом на фоне длительного лечения преднизолоном, у которого минимальная амплитуда ПДЕ в этой мышце была 520 мкВ. Средняя амплитуда ПДЕ составила 560 ± 99 мкВ, то есть находилась в верхних границах нормы. Число ПДЕ в мышце, амплитуда которых была более 1 мВ, составило 11,6 ± 16,0 %, но в некоторых мышцах оно доходило до 75 %.
Число полифазных ПДЕ у больных с первично-мышечными заболеваниями в среднем было равно 48,1 ± 23,6 %, однако имелись мышцы, где 95 % ПДЕ были полифазны.
Наименьшая нормализованная длительность отдельных ПДЕ (18 %) у больных с первично-мышечными заболеваниями была выявлена при силе 1–2 балла, наибольшая величина (270 %) — при силе 3 балла, хотя при всех показателях силы мышцы в отдельных мышцах выявлялись ПДЕ, максимальные величины которых более чем в два раза превышали нормальные значения (222–225 %). Средние величины нормализованной длительности постепенно снижались со снижением силы мышцы от 99,6 ± 15,8 % при силе мышцы 5 баллов до 66,6 ± 27,1 % при снижении силы до 1–2 балла, и различие было статистически высоко достоверно (р < 0,001). Точно так же и статистически достоверно снижались при падении силы мышцы минимальные и максимальные величины (р < 0,01 и р < 0,001). Такая же тенденция наблюдалась и в разбросе минимальных величин длительности ПДЕ, начиная с силы мышцы 4 балла, когда разброс минимальных величин с падением силы снизился почти вдвое от начальной величины.
Такова же была и динамика числа увеличенных по длительности ПДЕ в мышце: при хорошей силе (4–5 баллов) их среднее число составило 10 %, при силе 1–2 балла оно упало до 3,2.
Наименьшая амплитуда ПДЕ выявлялась при силе мышцы 1–2 балла, наибольшая — при силе мышцы 3 балла. Средние величины амплитуды ПДЕ несколько снизились при ухудшении функционального состояния мышцы от 616 [?NUM-1] при силе мышцы 5 баллов до 458 [?NUM-2] при силе мышцы 1–2 балла, причем различие не было статистически достоверным (р > 0,1). Статистически достоверными были лишь различия в минимальных величинах, которые при падении силы до 1–2 баллов снизились вдвое по сравнению с величиной, отмеченной при силе мышцы 5 баллов.
Максимальные величины увеличились при силе мышцы 3 балла, при дальнейшем снижении силы они снизились и стали меньше первоначальной величины. Такая же тенденция наблюдалась и в разбросе величин.
Среднее число ПДЕ в мышце, амплитуда которых превышала 1000 мкВ, при силе мышцы 5 баллов составило 15 %, а при силе мышцы 1–2 балла — 10 %, но в нескольких мышцах (6,1 %) их число составило 50–75 %.
Наибольшее количество полифазных ПДЕ (56 %) отмечено при силе 3 балла.
Таким образом, при анализе параметров ПДЕ у больных с первично-мышечными страданиями было выявлено, что при данной форме патологии имелись ПДЕ резко сниженной длительности и амплитуды, ПДЕ нормальных параметров и небольшое число ПДЕ, амплитуда и длительность которых были повышены. В основном такие ПДЕ выявлялись у больных с полимиозитом на фоне длительного приема кортикостероидных препаратов, но и при миопатиях имелись ПДЕ, амплитуда которых превышала максимально допустимые величины нормальных значений.
Относительно спонтанной активности, выявляемой в данной группе патологических процессов, можно сказать, что имеется большое разнообразие интенсивности и форм спонтанной активности. При заболеваниях мышц регистрируются практически все известные в патологии формы спонтанной активности: ПФ (потенциалы фибрилляции), ПОВ (положительные острые волны), фасцикуляции, миотонические и псевдомиотонические разряды, а также другие виды спонтанной активности, специфические для эндокринных миопатий. О механизмах их развития при основных клинических синдромах будет сказано в соответствующих разделах, так как генез большинства из них неоднороден и требует в каждом случае специального анализа. Следует лишь отметить, что в отличие от денервационных процессов ПОВ выявляются чаще, чем ПФ, амплитуда их в большинстве случаев невысокая — от 20 до 150 мкВ (см. рис. 1.8, а, б, л). Псевдомиотонические разряды, как правило, также состоят из ПОВ. Исключение составляют воспалительные заболевания — полимиозиты, состав и выраженность спонтанной активности при которых близки к наблюдаемым при денервационных расстройствах.
При максимальном произвольном напряжении мышцы при миопатиях регистрируется интерференционный тип ЭМГ (электромиографии), характеризующийся увеличением частоты и уменьшением амплитуды потенциалов.
При изучении МПДЕ (макропотенциалов двигательных единиц) и плотности мышечных волокон в ДЕ у больных с миопатиями было выявлено определенное количество МПДЕ как нормальной, так и сниженной амплитуды (Hilton-Brown, Stalberg, 1983; Horowitz, Schmalbruch, 1994), однако плотность волокон в ДЕ была значительно увеличена во всех мышцах (Stalberg, 1977; Касаткина, 1996). Не было выявлено корреляции между плотностью волокон и амплитудой МПДЕ. Как можно объяснить эти два противоречивых факта, отмечаемых в одной и той же мышце? Одним из объяснений может служить тот факт, что при миопатиях имеет место «усыхание» мышечных волокон и тем самым — более тесное их расположение в ДЕ, что повышает плотность волокон в ДЕ, хотя идет параллельный процесс их утраты. Другим объяснением является эффект расщепления волокон в отдельных участках ДЕ и их регенерация с последующей реиннервацией, что повышает плотность волокон в одном участке ДЕ, тогда как в другом ее участке мышечные волокна активно выпадают из ее состава (Stalberg, 1977). В зависимости от способности волокон к регенерации их общее число в ДЕ не увеличивается, а сохраняется приблизительно на первоначальном уровне, поэтому амплитуда МПДЕ не повышается, несмотря на увеличение плотности волокон в ДЕ. Снижение силы в этих мышцах может свидетельствовать о патологии сократительных свойств мышцы.
Эти результаты оказались несколько неожиданными и не согласовывались со снижением длительности и амплитуды ПДЕ, что считалось типичным признаком миопатии. Несоответствие между сниженными параметрами ПДЕ и нормальными величинами амплитуды МПДЕ может объясняться изменениями при миопатиях характеристик проведения импульса в объемном проводнике. Концентрический игольчатый электрод охватывает значительно более ограниченную площадь отведения из-за фиброза, который влияет на макросигнал в значительно меньшей степени, так как макроэлектрод проходит через многие фасции.
Миопатии — прогрессирующие мышечные дистрофии
Изменение параметров ПДЕ при миопатиях связано с вовлечением в процесс отдельных мышечных волокон ДЕ — стохастическим поражением разной глубины — от легких изменений до грубых некрозов волокон, причем нарушения сократительных свойств ДЕ в пораженных мышцах всегда весьма значительны и, по мнению ряда авторов, наблюдаются даже раньше, чем обнаруживаются другие клинические признаки заболевания, и могут быть выявлены у здоровых членов семей больных миопатией. Выключение функций и генерации потенциалов разрушающимися мышечными волокнами в различных отделах мышцы приводит к уменьшению длительности сначала отдельных, а затем все большего числа ПДЕ. Появляются также полифазные потенциалы вследствие того, что в зоне основного распределения мышечных волокон данной ДЕ их количество оказывается недостаточным для формирования полноценного ПДЕ. Наряду с этим снижается и амплитуда потенциала. Гистограмма распределения ПДЕ по длительности смещена влево (1 и 2 ЭМГ-стадии).
В связи с уменьшением способности ДЕ развивать достаточную силу для поддержания даже минимального усилия больной миопатией должен рекрутировать большое число ДЕ. Этим определяется вторая особенность ЭМГ этих больных: при минимальном произвольном напряжении мышцы трудно выделить отдельные ПДЕ, так как одновременно рекрутируется несколько ДЕ, что нередко затрудняет их анализ. Отмечается четкая связь между клинически выявляемым поражением мышцы и выраженностью изменений ее электрической активности. Первым и наиболее часто выявляемым даже в клинически интактных мышцах электромиографическим признаком патологии является полифазия. Как известно, высокая степень полифазии может быть выявлена также при поражении аксонов и мотонейронов. Однако полифазные ПДЕ при миопатии отличаются от полифазных потенциалов при денервационных синдромах амплитудой, длительностью и своеобразной формой. Полифазные потенциалы при миопатии имеют сниженную амплитуду и длительность, однако могут выявляться потенциалы нормальной и даже несколько увеличенной длительности, но при этом они имеют большое число фаз, амплитуда одного из пиков может быть значительно выше остальных. При невропатиях, а тем более нейронопатиях, полифазные ПДЕ увеличены как по амплитуде, так и по длительности, количество фаз в потенциале значительно меньше, чем в полифазном потенциале при миопатии.
В последние годы появляется все больше данных, свидетельствующих о наличии спраутинга и соответствующих ему явлений компенсаторной иннервации при прогрессирующих мышечных дистрофиях. На это указывает увеличение плотности мышечных волокон в ДЕ при прогрессирующей мышечной дистрофии, одной из причин увеличения которой является феномен «расщепления» волокон, столь типичный для данной формы миопатии. Возможно также, что регистрируемое с помощью электрода для записи потенциалов отдельных мышечных волокон увеличенное количество потенциалов в комплексе обусловлено регенерацией фрагментов частично некротизированных мышечных волокон. Увеличение плотности мышечных волокон может быть связано и с компенсаторным возрастанием числа волокон в ДЕ за счет их реиннервации соседними аксонами. Вместе с тем увеличение плотности мышечных волокон в ДЕ должно было сопровождаться повышением амплитуды потенциалов этих ДЕ, чего, как правило, при миопатии не наблюдается. Такое противоречие можно объяснить резким снижением амплитуды спайков комплекса потенциалов отдельных мышечных волокон, наблюдаемым у больных миопатией, при их регистрации соответствующим электродом (Stalberg, 1983; Hilton-Brown, Stalberg, 1986).
Наличие компенсаторной иннервации при прогрессирующей мышечной дистрофии подтверждается и результатами изучения джиттера. В одних случаях наряду с нормальными величинами джиттера и межспайковых интервалов в комплексах выявляются очень низкие величины, что может быть обусловлено наличием рядом лежащих расщепленных волокон. В других случаях наблюдалось увеличение межспайковых интервалов и джиттера, а также феномен блокирования, то есть периодическое выпадение отдельных спайков из комплекса потенциалов мышечных волокон данной ДЕ (Stalberg, Ekstedt, 1973; Stalberg, 1974, 1977). Последнее свидетельствует о наличии формирующихся, но еще не обладающих достаточными функциональными возможностями, ветвлений аксонов (Hilton-Brown, Stalberg, 1986).
Выше упоминалось о большей, чем в норме, степени рекрутирования ДЕ при минимальном усилии. При увеличении напряжения мышцы также вовлекается большее, чем в норме, число измененных ДЕ, что приводит к формированию типичного «миопатического» паттерна ЭМГ — низкоамплитудной «насыщенной» ЭМГ с большим числом потенциалов на одинаковом отрезке времени. При этом степень насыщенности ЭМГ и уменьшение средней амплитуды более выражены в клинически более пораженных мышцах.
При анализе ЭМГ произвольного максимального усилия методом Виллисона отмечается увеличение числа пересечений потенциалами средней линии и уменьшение средних значений амплитуды потенциалов за секунду времени (Rose, Willison, 1967; Fuglsang-Frederiksen, Mansson, 1976; Fuglsang-Frederiksen et al., 1976; Гехт и др., 1984). Наиболее отчетливо эти признаки миопатической ЭМГ выявляются при величинах нагрузки, составляющих 30 % от максимальных величин.
Существенное отличие наблюдается также при изучении динамики частоты и амплитуды интерференционной ЭМГ, зарегистрированной с помощью игольчатых электродов при первично-мышечных и денервационных страданиях в процессе утомления. При первых частота нарастает, а амплитуда ЭМГ падает, при последних, наоборот, частота уменьшается, а амплитуда нарастает. Спектральный анализ суммарной ЭМГ при прогрессирующих мышечных дистрофиях также выявляет относительное преобладание высоких частот.
Спонтанная активность, регистрируемая при прогрессирующих мышечных дистрофиях, весьма выражена. Она наблюдается даже в начальных стадиях процесса: наряду с ПФ выявляются ПОВ и разряды высокой частоты. Интенсивность спонтанной активности варьирует при различных формах заболевания. Наибольшая ее выраженность отмечается при быстропрогрессирующих формах миодистрофии (например, при миопатии Дюшена и Эрба). Выраженность спонтанной активности увеличивается по мере углубления тяжести поражения мышцы, прогрессирующего снижения амплитуды и длительности ПДЕ, нарастания числа полифазных потенциалов. Однако даже в далеко зашедших случаях болезни не выявляется тех высокоамплитудных «гигантских» ПОВ, которые характерны для поздних стадий денервационного процесса. Это своеобразие спонтанной активности обусловлено мозаичным характером разрушения отдельных мышечных волокон, лежащих среди сохранившихся или даже гипертрофированных волокон, разделенных соединительной тканью (Schmalbruch, 1982; Osame et al., 1982; Vrbova, 1983).
Митохондриальная миопатия
После появления первых работ о миопатии, связанной с нарушением структуры и функции мышечных митохондрий (Ernster et al., 1959; Luft et al., 1962; Van Wijngaarden et al., 1967), был проявлен большой интерес к этой патологии. Под термином «митохондриальная миопатия» объединяется группа различных мышечных заболеваний, при которых у больных обнаруживаются измененные митохондрии. Наиболее часто митохондриальные миопатии проявляются страданием глазодвигательных мышц с вовлечением или без клинического вовлечения скелетной мускулатуры. Нередко наряду с мышечными расстройствами выявляли признаки вовлечения в патологический процесс также различных структур центральной нервной системы (Shy et al., 1966; Mechler et al., 1981).
При электромиографическом обследовании больных получены противоречивые данные. Одни авторы выявили при митохондриальной миопатии изменения параметров ПДЕ, свидетельствующие о первично-мышечном процессе (Palmucci et al., 1978; Scelsi et al., 1981; Levy et al., 1983), другие подчеркивали отсутствие изменений ПДЕ (Domzal et al., 1978), третьи указывали на неврогенные черты (Markesbery, 1979).
Нами обследовано 27 больных, у которых наличие митохондриальной миопатии было подтверждено данными световой и электронной микроскопии (Гехт и др., 1987). В большинстве обследованных мышц наблюдалось снижение средней длительности ПДЕ различной степени, в некоторых случаях оно было значительным (до 60 %). Средняя амплитуда ПДЕ могла быть как сниженной, так и нормальной, отдельные ПДЕ имели амплитуду до 2,5 мВ, число полифазных потенциалов было увеличено. Особенность митохондриальных миопатий — наличие спонтанной активности, главным образом ПФ, которые выявлялись даже в тех мышцах, где не было уменьшения длительности ПДЕ, тогда как низкоамплитудные ПОВ регистрировались только в пораженных мышцах.
Выявленные электромиографические изменения соответствовали морфологическим изменениям — скопление крупных, аномальных митохондрий во всех исследованных мышцах, в то время как некрозы мышечных волокон — только в клинически пораженных мышцах, то есть там, где регистрировались ПОВ. У 5 человек ЭМГ-изменения указывали на наличие невритических расстройств: увеличение длительности и амплитуды отдельных ПДЕ, а также числа полифазных потенциалов повышенной амплитуды, наличие ПФ, ПОВ, а в ряде случаев — фасцикуляций. У 5 больных отмечено умеренное уменьшение СРВ (скорости распространения возбуждения) при нормальных величинах М-ответа, что позволило предполагать наличие у этих больных демиелинизирующей полиневропатии.
Снижение длительности ПДЕ, а также спонтанную активность мышечных волокон и «миопатический паттерн» интерференционной ЭМГ наблюдали и другие исследователи в клинически интактных мышцах больных с окулярной миопатией и хронической прогрессирующей наружной офтальмоплегией — «офтальмоплегия плюс» (Danta et al., 1975).
Врожденные (конгенитальные) непрогрессирующие формы миопатий
К врожденным непрогрессирующим формам миопатии относится большая группа клинических синдромов, характеризующихся главным образом наблюдаемыми сразу после рождения ребенка генерализованными амиотрофиями, нередко сочетающимися с другими аномалиями скелета, кожи, внутренних органов. В зависимости от распределения амиотрофий, выраженности сопутствующих симптомов, а также на основании выявляемых при гистологическом, гистохимическом и ультраструктурном анализе морфологических изменений выделяются отдельные клинические формы заболевания (Dubowitz, Brooke, 1973; Гехт, Ильина, 1982): болезнь центрального стержня, миотубулярная миопатия, немалиновая миопатия, миопатия с избирательной атрофией волокон I типа. У больных описаны изменения, не типичные для упомянутых выше прогрессирующих мышечных дистрофий: уменьшение длительности потенциалов без явления полифазии и без значительного снижения их амплитуды.
Спонтанная активность при данной группе патологических процессов характеризуется появлением ПФ средней выраженности и низкоамплитудных ПОВ.
Миопатии при эндокринно-обменных заболеваниях и патологии щитовидной железы
Нервно-мышечные расстройства — одни из наиболее ярких, а порой и характерных проявлений заболеваний желез внутренней секреции и обмена веществ. Патологическая же утомляемость — нередко первая и наиболее характерная жалоба больного при нейроэндокринных страданиях. Патогенез этих клинических синдромов очень сложен и при большинстве заболеваний включает нарушение функции мембраны мышечных волокон, энергообеспечения сократительного акта, а в ряде случаев — и структурные изменения мышечных волокон. Комбинации этих механизмов переплетаются весьма сложно при различных заболеваниях, в связи с чем велико и многообразие вариантов нервно-мышечных страданий, наблюдаемых при эндокринно-обменных заболеваниях. При многих эндокринно-обменных заболеваниях наряду с нарушением функции мышц имеет место также поражение аксонов чувствительных и двигательных нервов. При определенной комбинации клинических симптомов они имитируют характерные неврологические синдромы, в том числе и первичные заболевания мышц.
Миопатии при заболеваниях щитовидной железы
Двигательные нарушения и, в частности, нарушения функции мышц — непременное проявление практически всех заболеваний щитовидной железы. Однако в ряде случаев эти нарушения выступают на первый план, значительно обгоняя другие проявления заболевания. Они наблюдаются при гиперфункции щитовидной железы (тиреотоксические миопатии — острая и хроническая), а также гипотиреозе (гипотиреоидная миопатия и миопатия с мышечными гипертрофиями).
Тиреотоксическая миопатия
Электромиографические признаки поражения мышц, по данным различных авторов, наблюдаются более чем у 50 % больных тиреотоксикозом, а ряд авторов выявил их у 100 % больных (Ramsay, 1965, 1974; Ludin et al., 1969; Buchthal, 1970).
В отдельных случаях на фоне острого тиреотоксикоза быстро развиваются мышечная слабость, бульбарные нарушения и амиотрофии с угасанием сухожильных рефлексов, высокой возбудимостью мышц к механическому раздражению. При электромиографическом обследовании выявляется значительное уменьшение длительности ПДЕ с большим числом полифазных потенциалов. Крайне высока спонтанная активность мышечных волокон, причем наблюдаются в основном ПФ. Могут выявляться также редкие фасцикуляции. Этот вариант миопатии описывается как острая тиреотоксическая миопатия (Joasoo et al., 1970; Ramsay, 1974; Engel et al., 1982). Однако значительно чаще в клинике встречается хронический вариант тиреотоксической миопатии, при котором тиреотоксикоз сочетается с медленным развитием проксимальных амиотрофий с характерными для миопатии электромиографическими признаками: уменьшением амплитуды и длительности ПДЕ и высоким процентом полифазных потенциалов (Ramsay, 1965, 1968; Hayard et al., 1973; Tajima et al., 1984).
Своеобразные мышечные нарушения развиваются при так называемой апатетической форме тиреотоксикоза: у пожилых людей при отсутствии выраженных вегетативных и соматических признаков тиреотоксикоза появляется слабость глазодвигательных мышц, мимической мускулатуры, бульбарные нарушения, реже — слабость преимущественно проксимальных мышц конечностей (Laney, 1926; McGee et al., 1959; Thomas et al., 1991; Зефирова и др., 1986). При исследовании игольчатыми электродами в проксимальных мышцах регистрируются сниженные по амплитуде и длительности ПДЕ и единичные ПФ.
Работая в тесном сотрудничестве с эндокринологами и клинически обследовав несколько сотен больных с явными признаками мышечных расстройств, мы не видели острой тиреотоксической миопатии. В тех случаях, когда на основании клинических данных предполагался этот диагноз, электромиографическое обследование мышц и изучение мышечных биопсий свидетельствовало о сочетании тиреотоксикоза с каким-либо другим нервно-мышечным заболеванием, нередко сопровождавшим тиреотоксикоз: миастенией, пароксизмальным параличом, полимиозитом. С другой стороны, электромиографическое обследование мышц больных с тиреотоксикозом часто выявляло признаки субклинически протекающего поражения мышц.
Hausmanowa-Petrusewicz (1967) при обследовании 25 больных с тиреотоксикозом без клинических признаков поражения мышц отметила нормальные параметры ЭМГ у 15, миопатические изменения у 6, повышенное число полифазных потенциалов у 2 больных. По данным Puvanendran с соавторами (Puvanendran et al., 1979), из 48 обследованных больных уменьшение длительности ПДЕ и увеличение «насыщенности» ЭМГ максимального произвольного напряжения зарегистрировано у 47 больных, в то время как клинические и энзимологические признаки патологии — только у 33 и 17 больных соответственно. Необходимо помнить, что при тиреотоксикозе помимо миопатических черт возможны и другие изменения мышц, связанные с вовлечением в процесс мотонейронов спинного мозга, — тиреотоксические энцефаломиелопатии (Bassi et al., 1978) и невропатии (Feibel, Campa, 1976; Bastron, 1984), что отражается и на параметрах регистрируемых ПДЕ.
Мы наблюдали увеличение длительности отдельных ПДЕ (причем не только в дистальных мышцах) у многих больных с тиреотоксикозом. Имеются и морфологические данные о наличии денервационной перестройки в мышцах больных с тиреотоксикозом (Korenyi-Both et al., 1981).
При нормализации функции щитовидной железы электромиографические изменения исчезают значительно позднее, чем вегетативные и соматические признаки тиреотоксикоза, что может служить критерием полноты клинического выздоровления.
Известно, что тиреотоксикоз в высоком проценте случаев сочетается с миастенией, и при стимуляционной электромиографии выявляется типичный для миастении декремент амплитуды М-ответа при стимуляции частотой 3/с (Ramsay, 1974; Гехт, Ильина, 1982). Вместе с тем некоторые работы указывают на возможность поражения нервно-мышечной передачи при тиреотоксикозе, более близком к наблюдаемому при миастеническом синдроме Ламберта—Итона (Norris, 1966; Kissel et al., 1970; Puvanendran et al., 1979). У ряда больных имеется положительная реакция на введение АХЭ-препаратов, хотя с помощью стимуляционной электромиографии не удается выявить нарушения нервно-мышечной передачи (собственные наблюдения). Вопрос о возможности нарушения нервно-мышечной передачи при тиреотоксикозе и формах такого нарушения остается пока не решенным.
Мышечные нарушения при гипотиреозе
Несмотря на то, что слабость, утомляемость и боли в мышцах — обязательные признаки гипотиреоза, вопрос об электромиографических критериях этих расстройств весьма дискутабелен. На основании клинического анализа при гипотиреозе выделяют миопатии с мышечными гипертрофиями (синдром Гоффманна и синдром Дебре—Семолайна) и атрофическую форму миопатии.
Миопатии с мышечными гипертрофиями — типичная черта гипотиреоза взрослых. В сочетании с затруднением акта расслабления при произвольном движении они получили название синдрома Гоффманна. При гипотиреоидной миопатии некоторые авторы находили уменьшение длительности ПДЕ и увеличение полифазии (Astrom et al., 1961; Ramsay, 1974), другие отмечали нормальные параметры биопотенциалов (Rao et al., 1980).
Повышение плотности мышц, болезненность при пальпации в некоторых случаях гипотиреоза симулируют клиническую картину полимиозита (Зефирова и др., 1978; Cabili et al., 1982). Однако при игольчатой электромиографии отмечались крайне незначительные изменения параметров ПДЕ, минимальная спонтанная активность или ее отсутствие (Ramsay, 1974; Hochberg et al., 1976).
Наш опыт длительного наблюдения и многократного электромиографического обследования 96 больных гипотиреозом, а также патоморфологическое исследование мышечных биоптатов у них, свидетельствуют о сложности патогенеза мышечных расстройств при гипотиреозе, включающем несколько независимых компонентов: нарушение сократительного акта, отек мышц, вторичные изменения мышц денервационного характера, связанные с обязательными для гипотиреоза невропатиями, обусловленными компрессией и замедлением СРВ по двигательным аксонам периферических нервов.
Нарушения сократительного акта — ранний и обязательный симптом гипотиреоза. Они заключаются в увеличении времени сокращения и расслабления мышцы, а также увеличении силы вызванного одиночного сокращения. Специальный анализ показал, что изменения сократительных свойств мышцы обусловлены перестройкой функционирования сократительных механизмов и электромеханической системы мышц (Ludin, Gubser, 1975; Гехт и др., 1984, 1988).
Электромиографические признаки миопатии мы выявляли крайне редко. Аналогичные данные приводят и другие авторы (Scarpalezos et al., 1973; Ludin, Gubser, 1975). В некоторых случаях отмечалось уменьшение длительности ПДЕ, не сопровождавшееся полифазией и спонтанной активностью мышечных волокон, а назначение адекватной заместительной терапии препаратами щитовидной железы, как правило, нормализовывало длительность ПДЕ.
Один из самых характерных симптомов гипотиреоза — компрессионная невропатия, встречавшаяся наиболее часто: у 18 из 26 обследованных больных выявлялись карпальные туннельные синдромы. В ряде случаев симптомы компрессии нервов служили первым признаком гипотиреоза.
Причиной изменения длительности ПДЕ и появления ПФ у больных гипотиреозом могут быть нарушения проводящей функции аксонов периферических нервов (Shirabe et al., 1975; Rao et al., 1980; Pollard et al., 1989). Мы наблюдали равномерное снижение СРВ на проксимальных и дистальных отрезках нервов у 85 % обследованных больных с тяжелым гипотиреозом. При исходно нормальных величинах СРВ после назначения заместительной терапии отмечалось увеличение СРВ на 5–10 м/с.
В некоторых случаях нарушение проведения сочетается с тяжелыми невропатиями. Ряд авторов считает, что нарушение проведения по аксонам двигательных нервов — основной механизм расстройств двигательных функций при данном заболевании (Dyck, Lambert, 1970; Scarpalezos et al., 1973).
Следует также иметь в виду, что гипотиреоз, особенно связанный с аутоиммунным тиреоидитом, может сочетаться с другими аутоиммунными заболеваниями, в том числе полимиозитом, миастенией, синдромом Ламберта—Итона и др.
В связи с нередким при гипотиреозе нарушением функции расслабления мышцы, напоминающим миотонию (псевдомиотоническая форма гипотиреоидной миопатии), в литературе обсуждается вопрос о близости механизмов и электромиографических феноменов, наблюдающихся при гипотиреозе и миотонии. Некоторые авторы находили миотонические и псевдомиотонические разряды в мышцах больных гипотиреозом (Waldstein et al., 1958; Venables et al., 1978). Другие считают, что миотонические феномены при гипотиреозе являются электрически безмолвными, то есть не сопровождаются типичным миотоническим разрядом (Lambert et al., 1951; Ludin, Gubser, 1975; Ludin, 1980).
По нашим данным, базирующимся на изучении 6 больных с псевдомиотонической формой гипотиреоидной миопатии, у 4 из них не регистрировалось типичных миотонических электрофизиологических феноменов, а у 2 были обнаружены типичные миотонические разряды.
Представляется важным то обстоятельство, что по мере заместительной гормональной терапии миотонические разряды исчезали параллельно с улучшением клинического состояния больных и уменьшением других мышечных расстройств, свойственных гипотиреозу. Более того, обследование 9 ближайших родственников больных не обнаружило миотонических феноменов ни у одного из них. Следует добавить, что нарушения движений у этих больных клинически больше напоминали гипотиреоидные, а не миотонические.
Миопатии при гиперфункции коры надпочечников (стероидные миопатии) и гипокортицизме (аддисонизм)
Патогенетические механизмы развития мышечных расстройств, а также клиника и электромиографические изменения при всех формах гиперкортицизма (центральной, надпочечниковой и медикаментозной) практически идентичны. Различие состоит только в относительно меньшей выраженности двигательных нарушений при гипофизарно-диэнцефальной форме страдания.
Как правило, гиперкортицизм сопровождается развитием стероидной миопатии. Электромиографическое исследование пораженных мышц выявляет уменьшение амплитуды и длительности ПДЕ, пропорциональное степени поражения мышцы (Yates, 1963; Moser et al., 1974; Гехт, Ильина, 1982). Число полифазных потенциалов при стероидной миопатии относительно невелико (до 30 %), а спонтанная активность мышечных волокон очень умеренна даже при тяжелой степени поражения мышц.
В процессе регресса мышечных расстройств по мере уменьшения количества вводимых кортикостероидных препаратов или после хирургического лечения опухолей надпочечников наблюдается постепенная нормализация электромиографических данных — увеличивается до нормальных величин длительность ПДЕ и исчезают ПФ, если они до этого выявлялись (Buchthal, 1970; Moser et al., 1974; собственные наблюдения).
В связи с тем, что для лечения тяжелых коллагенозов (полимиозит, дерматомиозит, красная волчанка и др.) применяются большие дозы кортикостероидных препаратов, следует отметить, что электромиографические изменения, типичные для основного заболевания, могут маскировать возникающие стероидные миопатии. Однако характер распространения мышечных нарушений и их генерализованность способствуют электромиографической и клинической дифференциации этих состояний.
При аддисонизме, несмотря на наличие значительных генерализованных мышечных расстройств (слабости и утомляемости), электромиографические изменения весьма скудны. Выявляется лишь очень умеренное снижение длительности ПДЕ без полифазии и спонтанная активность мышечных волокон (Buchthal, Rosenfalck, 1963). В одном из наших наблюдений при большой степени обездвиженности, связанной с гипокортицизмом, мы обнаружили только небольшое снижение длительности ПДЕ при отсутствии полифазии и умеренные ПФ.
Миопатии при заболеваниях гипофиза (акромегалия, питуитарный гигантизм)
Нарушение функции мышц относится к наиболее ранним и выраженным изменениям при акромегалии, которые могут предшествовать развитию других клинических симптомов. Изменения мышц, как правило, развиваются на фоне характерных для акромегалии изменений скелета и выраженного увеличения объема мышц. Увеличение силы мышц при этом наблюдается крайне редко и только в дебюте заболевания. Khaleeli с соавт. (Khaleeli et al., 1984) провели исследование мышечной силы 6 больным акромегалией и компьютерную томографию этих мышц. Они показали, что у больных акромегалией имеется снижение силы даже в клинически и томографически сохранных мышцах. Это совпадает с данными других авторов, показавших, что слабость при акромегалии возникает в малоизмененных мышцах (Lundberg et al., 1970; Mastaglia et al., 1972). Такое же явление отмечено при питуитарном гигантизме (Lewis, 1972). Это согласуется с экспериментальными данными о функциональной неэффективности мышечной гипертрофии, обусловленной избытком гормона роста (Bigland, Jehring, 1952). При клиническом обследовании 20 больных акромегалией мы выявили снижение силы преимущественно проксимальных мышц у 10 больных, повышенную утомляемость мышц у 6 больных, повышенную возбудимость мышц при перкуссии у 6 больных, снижение рефлексов у 5 больных. Несомненные атрофии мышц были только у 3 больных.
При игольчатой электромиографии у большинства больных акромегалией с миопатическим синдромом отмечается уменьшение длительности и амплитуды ПДЕ, появляются полифазные ПДЕ. При обследовании 8 больных мы обнаружили снижение длительности и увеличение числа полифазных ПДЕ у 5 больных в проксимальных мышцах. Вместе с тем у 3 больных в дистальных и у 1 больного в проксимальных мышцах наблюдалось увеличение длительности ПДЕ, характерное для невропатии. Невропатический процесс при акромегалии отмечается достаточно часто. Наиболее типичен для акромегалии карпальный тоннельный синдром (Shiller, Kobb, 1954; List, 1982). Pickett с соавторами (Pickett et al., 1975) признаки карпального тоннельного синдрома нашел у 8 из 17 больных, в то время как миопатические изменения — только у 4 больных. При обследовании 10 больных акромегалией у 9 больных мы обнаружили увеличение резидуальной латенции по срединному нерву, свидетельствующее о наличии карпального синдрома. При акромегалии возможно развитие и генерализованного страдания периферических нервов (Stewart, 1966). При специальном обследовании 11 больных с акромегалией у 5 больных было выявлено распространенное страдание нервов, характеризующееся незначительным снижением СРВ по двигательным аксонам (Low et al., 1974). В работе Bugarski-Prokophyevic с соавторами (Bugarski-Prokophyevic et al., 1982) полиневропатия у больного с акромегалией со снижением СРВ по двигательным аксонам и увеличением резидуальной латенции была подтверждена также биопсией n. suralis, показавшей признаки аксональной дегенерации. Полиневропатия может наблюдаться и при питуитарном гигантизме (Prezio et al., 1961; Lewis, 1972). Хирургическое лечение акромегалии, приводящее к улучшению состояния больных, не влечет за собой исчезновения электрофизиологических признаков невропатии (Pickett et al., 1975).
Пароксизмальные миоплегии, периодический паралич
Как известно, группа пароксизмальных миоплегий включает фамильный гипокалиемический паралич, симптоматическую гипокалиемическую миоплегию при тиреотоксикозе и гиперкалиемический наследственный паралич.
В период приступа при любой форме миоплегии при прямой и непрямой стимуляции мышц выявляется резкое повышение порога или даже невозбудимость мышц.
При непрямой стимуляции мышцы одиночными супрамаксимальными стимулами регистрируется потенциал резко сниженной амплитуды. Вместе с тем электрофизиологические исследования в период приступа позволяют дифференцировать эти состояния.
При гипокалиемических формах электромиографическое обследование выявляет биоэлектрическое молчание и отсутствие спонтанной активности (Buchthal, Rosenfalck, 1963). При гиперкалиемических формах обездвиженность сопровождается наличием высокой возбудимости мембраны мышечных волокон, обилием ПФ, резко усиливающимися при шевелении введенного в мышцу игольчатого электрода. Возможно появление миотонических разрядов и «странных» разрядов высокой частоты (Gamstoip, 1962; Heuser et al., 1974).
Вне приступа при гипокалиемических формах патологии эти изменения, как правило, не выявляются, хотя отдельные авторы отмечают миопатические изменения ПДЕ (Dyken et al., 1969).
Снижение длительности ПДЕ может наблюдаться в случаях гипокалиемического тиреотоксического паралича (Milikan, Haines, 1953; Ramsay, 1966). У всех трех больных с тиреотоксическим пароксизмальным параличом, которых мы наблюдали вне приступа, отмечалось снижение длительности ПДЕ преимущественно в проксимальных мышцах. Возможно, что это связано с сопутствующей тиреотоксической миопатией. При исследовании больных с гиперкалиемической формой миоплегии в межприступный период могут быть также выявлены нормальные параметры ЭМГ или умеренно выраженные миопатические изменения и спонтанная активность мышечных волокон (Buchthal, 1958; Gamstorp, 1962; Heuser et al., 1974).
Заболевания мышц, сопровождающиеся нарушением расслабления и судорогами
Выделение данной группы патологических состояний в отдельный раздел обусловлено информативностью электромиографической диагностики этих состояний, клиническая идентификация которых весьма сложна. К ним относятся различные формы миотонии, нейромиотонии, гликогенозы, при которых судороги являются одним из основных симптомов заболевания, а также весьма обобщенная категория патологических состояний мышц, определяемая одним названием — «крампи»-синдром. Сведения об этих процессах весьма неодинаковы по глубине и объему исследований, что, конечно, сказывается на приводимых ниже данных (Appel, 1985; Авакян и др., 1986).
Миотония Томсена
Миотония — одно из наиболее частых и хорошо изученных патологических состояний этой группы. Основной симптом заболевания — нарушение расслабления мышцы — миотоническая задержка. При исследовании электрической активности мышцы с использованием накожного или игольчатого электродов миотоническая судорога представляется в форме интерференционной ЭМГ, амплитуда которой значительно уменьшается по мере уменьшения напряжения мышцы (см. рис. 1.9). Этим она отличается от «молчащей судороги», наблюдаемой при ряде других патологических процессов, в частности при болезни Мак-Ардля. Характерная особенность миотонической задержки — ее уменьшение по мере повторения заданного усилия, что соответствует и уменьшению длительности судорожного сведения мышц.
Другая особенность ЭМГ мышц больных миотонией — наличие миотонических разрядов, характеристики и механизмы которых описаны выше. При миотонии миотонические разряды являются весьма стабильным проявлением патологического процесса и обнаруживаются не только в пораженных, но и в клинически интактных мышечных группах. Миотонические разряды могут быть также в мышцах родственников больных, страдающих миотонией, и служат признаком наличия субклинической формы заболевания. Наряду с миотоническими разрядами в мышцах больных миотонией иногда регистрируются и отдельные ПФ, по своим параметрам не отличающиеся от регистрируемых при других заболеваниях.
ПДЕ при миотонии Томсена имеют нормальную длительность и амплитуду. ЭМГ произвольного максимального усилия, за исключением описанной выше «миотонической задержки», не изменена, СРВ и величины латенции не нарушены.
При исследовании М-ответа мышцы, в основном при высокочастотной стимуляции, наблюдается значительное отклонение от нормы. Особенно выражены изменения амплитуды М-ответов при стимуляции частотой 15–25 имп/с (Brown, 1973).
М. В. Лукьянов и Н.А. Ильина (1966) при обследовании большой группы больных миотонией Томсена описали 3 типа реакции на стимуляцию нерва:
- 1-й тип соответствует нормальному (не было получено декремента при стимуляции редкими частотами);
- 2-й тип — при стимуляции редкими частотами не было декремента амплитуды, а при стимуляции высокими частотами определялось быстрое падение амплитуды М-ответа;
- 3-й тип — определялся декремент амплитуды М-ответа при стимуляции редкими и высокими частотами, отмечено значительное падение амплитуды после тетанизации с постепенным ее восстановлением в течение нескольких минут.
Декремент амплитуды М-ответа при стимуляции нерва высокими частотами связан с попаданием последующих стимулов в фазу рефрактерности, что вызвано ауторитмической активностью мышечных волокон. Падение амплитуды и увеличение длительности вызванного электрического ответа мышцы, а также нарушение сократительных ее свойств, связанных с нарушением возбудимости мембраны мышечных волокон, отмечено также McComas (1977).
Парадоксальная миотония Эйленбурга, врожденная парамиотония
Электрофизиологические нарушения неодинаковы на различных фазах парамиотонических состояний, которые характеризуются периодами мышечного напряжения и последующего вялого пареза (паралича), возникшего после мышечной активности или охлаждения.
В период покоя, вне охлаждения, отмечаются нормальные параметры ПДЕ, обычная для здоровой мышцы ЭМГ максимального произвольного усилия и периодические, в отличие от миотонии, разряды спонтанной активности мышечных волокон миотонического типа. После произвольного сокращения мышцы (различной для каждого больного) возникает ее напряжение, иногда — мышечная судорога, вслед за которой наблюдается парез мышцы. В период напряжения наблюдаются описанные выше миотонические феномены. В период паралича отмечается отсутствие спонтанной и произвольной активности, а также отсутствие (или резкое снижение) вызванных электрического и механического ответов мышцы (Lehmann-Horn et al., 1983).
Все клинические и электрофизиологические феномены, описанные выше, значительно легче формируются при охлаждении. Механизмы формирования парамиотонических проявлений связаны с повышенной возбудимостью мембраны мышечных волокон и нарушением функционирования контрактильных элементов мышцы (Burke et al., 1974).
Дистрофическая миотония
Своеобразие электрофизиологических изменений, выявляемых при дистрофической миотонии, обусловлено сложностью патогенеза данного заболевания, при котором клинически выявляются миопатические, миотонические и невритические расстройства.
Миотонические феномены проявляются типичными миотоническими разрядами, отличающимися от выявляемых при миотонии Томсена своей большой продолжительностью (Ricker, Meinck, 1972) и наличием ПФ и ПОВ, чаще выявляемых в дистальных мышцах конечностей (Ludin, 1980).
ПДЕ, как правило, снижены по длительности, увеличивается число полифазных потенциалов, гистограмма распределения ПДЕ по длительности смещена в сторону меньших величин. При исследовании мультиэлектродом выявляется уменьшение площади ДЕ (Buchthal, Rosenfalck, 1963).
Относительно электрофизиологических критериев состояния периферических нервов имеются противоречивые данные. Ряд авторов наблюдали уменьшение СРВ по дистальным нервам нижних конечностей и уменьшение числа функционирующих ДЕ (Ballanthyne, Hansen, 1974, 1975; Panayiotopoulos, Scarpalezos, 1976). Вместе с тем другие авторы при использовании электрофизиологических и морфогистохимических методов исследования не выявили признаков невропатии и денервационных изменений мышечных волокон (Pollock, Dyck, 1976; Drachman, Fambrough, 1976).
Нейромиотонии
К нейромиотониям относятся несколько клинически близких состояний, в основе которых лежит непроизвольное напряжение одной или нескольких (возможно многих), обычно рядом лежащих, мышц. Судороги, как правило, резко болезненны и сопровождаются электромиографическими признаками, характерными для произвольного напряжения мышц, однако больные не могут расслабить напряженную мышцу.
Исследование игольчатыми электродами выявляет спонтанную активность мышечных волокон (ПФ и ПОВ) и фасцикуляции, или комплексы ПДЕ (Coers et al., 1981). Иногда регистрируются сдвоенные или строенные потенциалы сложной, но постоянной формы. При исследовании ПДЕ, которое бывает затруднено из-за возникающих при попытке произвести произвольное движение судорог, отмечают нормальные или увеличенные по длительности и амплитуде потенциалы. У двух наблюдаемых нами больных с нейромиотонией в наиболее пораженных мышцах мы обнаружили очень крупные потенциалы длительностью до 35 мс и амплитудой до 5 мВ. После лечения диазепамом параметры ПДЕ приблизились к нормальным величинам, что дает возможность предположить наличие при этом заболевании стойкой синхронизации ПДЕ. Дифференциация между отдельными формами нейромиотонии проводится на основании исследований спонтанной активности ДЕ в период сна и после введения больным диазепама и новокаина (Isaacs, 1961, 1967; Black et al., 1972; Blank et al., 1974; Ильина и др., 1979). При синдроме спонтанной активности ДЕ (собственно нейромиотонии) и синдроме Шварца—Джампеля не удается отметить уменьшения спонтанной активности во сне и после введения диазепама. Блокада периферического нерва новокаином лишь частично уменьшает напряжение мышцы. Кураризация мышцы и, в меньшей степени, назначение дифенилгидантоина и карбамазепина уменьшают судорогу.
При синдроме «каменеющего человека» (stiff man syndrome) мышечное напряжение уменьшается во время сна, при анестезии барбитуратами, новокаиновых блокадах периферического нерва, а также кураризации. В одном из случаев нейромиотонии, возникшем на фоне эозинофильного фасциита, мы наблюдали значительное улучшение симптоматики и уменьшение электрофизиологических проявлений страдания после лечения больной большими дозами преднизолона по схеме через день.
«Крампи»-синдром
Помимо мышечных тонических судорог, возникающих при нейромиотонии, в клинической практике нередко наблюдают судорожные сведения икроножных мышц, мелких мышц стопы или кисти. Причиной их может быть переутомление в условиях ишемии, сосудистая патология, нарушение нисходящих пирамидных влияний (при боковом амиотрофическом склерозе). Вне «крампи» электрофизиологическая патология мышцы (изменения ПДЕ, суммарной электрической активности и СРВ) не отмечается. При сопутствующих ишемических невропатиях могут быть выявлены характерные изменения ПДЕ и СРВ. В период судороги регистрируется ЭМГ, соответствующая ЭМГ максимального произвольного напряжения мышцы.
Болезнь Мак-Ардля
Одним из основных проявлений данного заболевания, в основе которого лежит генетически обусловленный дефицит фосфорилазы в мышцах, является болезненная мышечная судорога, возникающая в мышце при ее напряжении. Особенность судороги мышцы при болезни Мак-Ардля — ее биоэлектрическое молчание, так называемая «молчащая судорога», что указывает на неучастие электрогенных структур мышцы в ее возникновении (McArdle, 1951; Dyken et al., 1967; Гехт и др., 1985). При исследовании ПДЕ в большинстве случаев описаны нормальные их параметры и отсутствие спонтанной активности. Однако есть отдельные случаи, когда в мышцах больных были отмечены миопатические черты: уменьшение амплитуды и длительности ПДЕ, увеличение числа полифазных потенциалов.
Характерно для данного клинического синдрома падение вызванного М-ответа при супрамаксимальной непрямой стимуляции мышцы частотой 18 имп/с в течение 100 с, на 75 % по отношению к исходному потенциалу, что сопровождается проявлением болезненной судороги и снижением мышечной силы (Dyken et al., 1967). Предложен и другой диагностический тест: повторная непрямая супрамаксимальная стимуляция мышцы частотой 50 имп/с в течение 1,5 с с интервалом в 2 с, что также приводит к появлению болезненной судороги (Ricker et al., 1977).
Мышечные судороги при тетании по своим электрофизиологическим проявлениям во время болевого непроизвольного напряжения, как и «крампи», не отличаются от ЭМГ максимального произвольного напряжения той же мышцы. Характерный признак тетании — наличие вне приступа судорог спонтанной активности групп мышечных волокон, состоящей из 2–5 потенциалов, по форме напоминающих ПФ, но имеющих большую длительность — до 7 мс — так называемые дуплеты, триплеты, мультиплеты.
При скрытой тетании спонтанная активность может быть выявлена после гипервентиляции или ишемии мышцы соответствующей конечности. Наиболее информативно исследование мелких мышц кисти через 1–3 мин после прекращения ишемии. Активность сохраняется не менее 4 мин. По мнению Ludin (1980) появление дуплетов и триплетов в мелких мышцах кисти после ишемии может наблюдаться и у здоровых лиц и непатогномонично для тетании. Характерные для тетании дуплеты и триплеты выявлены и при симптоматической тетании у больных с различными вегетативными дисфункциями (Молдовану, Яхно, 1983).
Воспалительные заболевания мышц (полимиозиты)
Воспалительные заболевания мышц, объединяемые условно общим названием «полимиозит», не представляют собой единой нозологической формы. Разнообразие клинических проявлений этих страданий обусловлено тем, что в патологический процесс вовлекаются в различных сочетаниях структурные элементы мышцы — мышечные волокна, соединительная ткань, сосудистая система, нервные ветвления и терминали. Наряду с «первичными» полимиозитами, при которых поражение мышц является ведущим клиническим синдромом, имеется группа «симптоматических» полимиозитов, осложняющих течение какого-либо другого заболевания, например болезни соединительной ткани (системная красная волчанка, склеродермия и т. д.). Однако и в этих случаях мышечные расстройства составляют основу клинической картины, определяя ее тяжесть и прогноз. Воспалительные заболевания мышц могут протекать атипично, маскируясь по клинике и характеру течения под другие заболевания. Так описаны «псевдомиастенические», «псевдомиопатические», «псевдополиневропатические» формы полимиозитов.
Существуют несколько классификаций воспалительных заболеваний мышц. Наиболее близка к задачам клиники, с нашей точки зрения, классификация, предложенная И. Гаусмановой-Петрусевич, которая отражает всю сложность и многогранность данной проблемы. В соответствии с этой классификацией выделяются следующие формы полимиозита:
- Дерматомиозит, полимиозит как отдельная клиническая форма заболевания (термин «полимиозит» употребляется в двух значениях: как синоним понятия воспалительной реакции мышц и как название одной из нозологических форм, принадлежащих к группе «больших коллагенозов». В этом случае полимиозит представляет собой дерматомиозит без кожных проявлений).
- Воспалительные заболевания мышц (миозиты) при других клинически очерченных коллагенозах (склеродермия, узелковый периартериит, системная красная волчанка).
- Полимиозит при саркоидозе (гранулематозный полимиозит).
- Паразитарные миозиты.
- Ревматическая полимиалгия.
Диагностика воспалительных заболеваний мышц очень сложна и, согласно общепринятым критериям, обязательно должна базироваться, помимо клинических данных, на результатах электромиографического, патоморфологического и серологического обследований каждого больного. При отсутствии положительных результатов одного из обследований диагноз полимиозита представляется сомнительным (Cros et al., 1980; Гехт, Ильина, 1982).
При полимиозитах основным наиболее характерным ЭМГ-признаком заболевания является уменьшение амплитуды и длительности ПДЕ. При этом на самых ранних стадиях процесса, еще до значительных изменений длительности ПДЕ, регистрируется высокая степень полифазии — до 80 % ПДЕ полифазны. Нарастание процесса характеризуется появлением укороченных ПДЕ с нормальным (рис. 1.17, ПДЕ 1) и увеличенным (рис. 1.17, ПДЕ 2) числом фаз, а также псевдополифазных ПДЕ уменьшенной длительности и амплитуды (рис. 1.17, ПДЕ 6, 3). Число полифазных ПДЕ на этой стадии составляет среди потенциалов нормальной длительности около 20 %, а среди укороченных — до 30 %. Остальные ПДЕ псевдополифазны и укорочены при нормальном числе фаз. Регистрируются и ПДЕ, по своим параметрам приближающиеся к потенциалам одного мышечного волокна, длительностью 2–3 мс, однако амплитуда их резко снижена (рис. 1.17, ПДЕ 1). Дальнейшее прогрессирование процесса приводит к снижению числа полифазных ПДЕ и появлению значительного количества ПДЕ резко сниженной амплитуды и длительности. Следует отметить, что по ЭМГ-данным можно выделить, по меньшей мере, два типа полимиозита. При этом различия между ними проявляются на той стадии процесса, когда начинают формироваться признаки восстановления ДЕ и увеличивается сила мышц. При истинных полимиозитах (дерматомиозит, полимиозит при склеродермии) на данной стадии появляются низкоамплитудные полифазные ПДЕ нормальной и увеличенной длительности (рис. 1.17, ПДЕ 11, 20) и псевдополифазные ПДЕ (рис. 1.17, ПДЕ 12, 21). По мере улучшения число таких ПДЕ все больше увеличивается, но полного ЭМГ-благополучия, так же как и клинического выздоровления, достигнуть не удается. При другой форме полимиозитов, сочетающихся с тимомной миастенией, и ряде карциноматозных полимиозитов в период восстановления на фоне лечения регистрируются высокоамплитудные ПДЕ с нормальным или увеличенным числом фаз (рис. 1.17, ПДЕ 16, 25а). Выздоровление или наступление ремиссии сопровождается появлением изменений ПДЕ, подобных тем, которые описаны при полиневропатиях, то есть возникновением обычных или полифазных ПДЕ нормальной или несколько увеличенной амплитуды и длительности (рис. 1.17, ПДЕ 13, 14, 15, 16, 17, иногда 25а, 26а). Однако их амплитуда и длительность не бывают столь велики, как при невропатиях. При прогрессирующих мышечных дистрофиях развитие патологического процесса тоже проявляется увеличением числа укороченных трехфазных ПДЕ уменьшенной длительности (рис. 1.17, ПДЕ 1, 2, 3). Однако в далеко зашедших стадиях можно выявить отдельные укрупненные полифазные ПДЕ нормальной или увеличенной длительности (рис. 1.17, ПДЕ 11, 20), но их число весьма невелико.
Дерматомиозит — полимиозит
Несмотря на то, что в литературе долгое время существовали различные точки зрения о единстве или различии этих заболеваний, теперь общепризнано, что полимиозит — клиническая форма дерматомиозита без выраженных кожных проявлений.
ЭМГ-диагностика дерматомиозита базируется главным образом на результатах изучения ПДЕ и наличии спонтанной активности мышечных волокон (ПФ, ПОВ, «псевдомиотонических» разрядов). Большинство авторов отмечает частое выявление спонтанной активности мышечных волокон и считает ее наличие обязательным критерием диагностики полимиозита (Гехт, Ильина, 1982; Sandstedt et al., 1982).
В проведенном нами клиническом и электромиографическом исследовании более 800 мышц 105 больных с различными формами полимиозита, из которых у 56 больных проводилось морфогистохимическое исследование мышечных биоптатов, установлено, что только в 4 % исследованных мышц до проведения терапии кортикостероидами и/или иммунодепрессантами не регистрировалась спонтанная активность мышечных волокон. Отсутствие ПФ и ПОВ у 2 из 100 обследованных другой группой авторов больных специально оговаривается как исключительная особенность этих наблюдений.
Второй электромиографический критерий, типичный для дерматомиозита, — изменение параметров ПДЕ: значительное уменьшение их длительности, амплитуды и высокий процент полифазных ПДЕ (Lambert et al., 1954; Adams et al., 1962; Sandstedt et al., 1982).
Проведенное нами систематическое многолетнее изучение динамики спонтанной активности мышечных волокон и изменения ПДЕ больных с полимиозитом на разных стадиях развития болезни, в том числе на фоне лечения (рис. 1.20) и более или менее стойкой ремиссии, свидетельствует о том, что электромиографическая картина данного заболевания неоднородна на разных этапах его течения и изменяется в зависимости от активности процесса и эффективности проводимого лечения (Гехт и др., 1981, 1982; Касаткина и др., 1982; Никитин, 1983). Необходимо отметить, что при полимиозите, как правило, не изменена СРВ по чувствительным и двигательным нервам. Однако имеются сообщения, отмечающие некоторое увеличение концевой латенции и замедление СРВ по двигательным нервам, что позволило ряду авторов использовать термин «нейрополимиозит». Другими авторами изменение СРВ по чувствительным нервам выявлено всего у 2 из 31 больного с полимиозитом. При тяжелом поражении мышц может отмечаться снижение М-ответа. Нервно-мышечная передача интактна, но следует помнить о возможности сочетания миастении с полимиозитом.
Начало полимиозитического процесса в мышце сопровождается появлением ПФ, затем ПОВ и небольшого числа укороченных, чаще всего полифазных ПДЕ. Снижение средней длительности ПДЕ в начале болезни обычно не превышает 20 %. На стадии выраженных клинических проявлений заболевания отмечается нарастание спонтанной активности мышечных волокон по мере вовлечения в патологический процесс все большего их числа. В клинически пораженных мышцах регистрируются бурные ПФ, ПОВ, а в 40 % исследованных нами мышц выявлялись псевдомиотонические разряды (ПМР). Нарастание интенсивности ПФ и ПОВ обычно происходит параллельно.
При анализе биоптатов мышц на данной стадии процесса выявляется значительное число некротизированных мышечных волокон. Выпадение мышечных волокон из состава ДЕ приводит к уменьшению длительности потенциалов этих ДЕ. Более чем в половине исследованных мышц снижение средней длительности превышало 30 %. Некрозы мышечных волокон определяют также появление полифазных ПДЕ, которые регистрируются практически во всех исследованных мышцах. Число низкоамплитудных полифазных ПДЕ колеблется в пределах 40–70 %. Изменение параметров и типов ПДЕ происходит пропорционально нарастанию интенсивности спонтанной активности мышечных волокон.
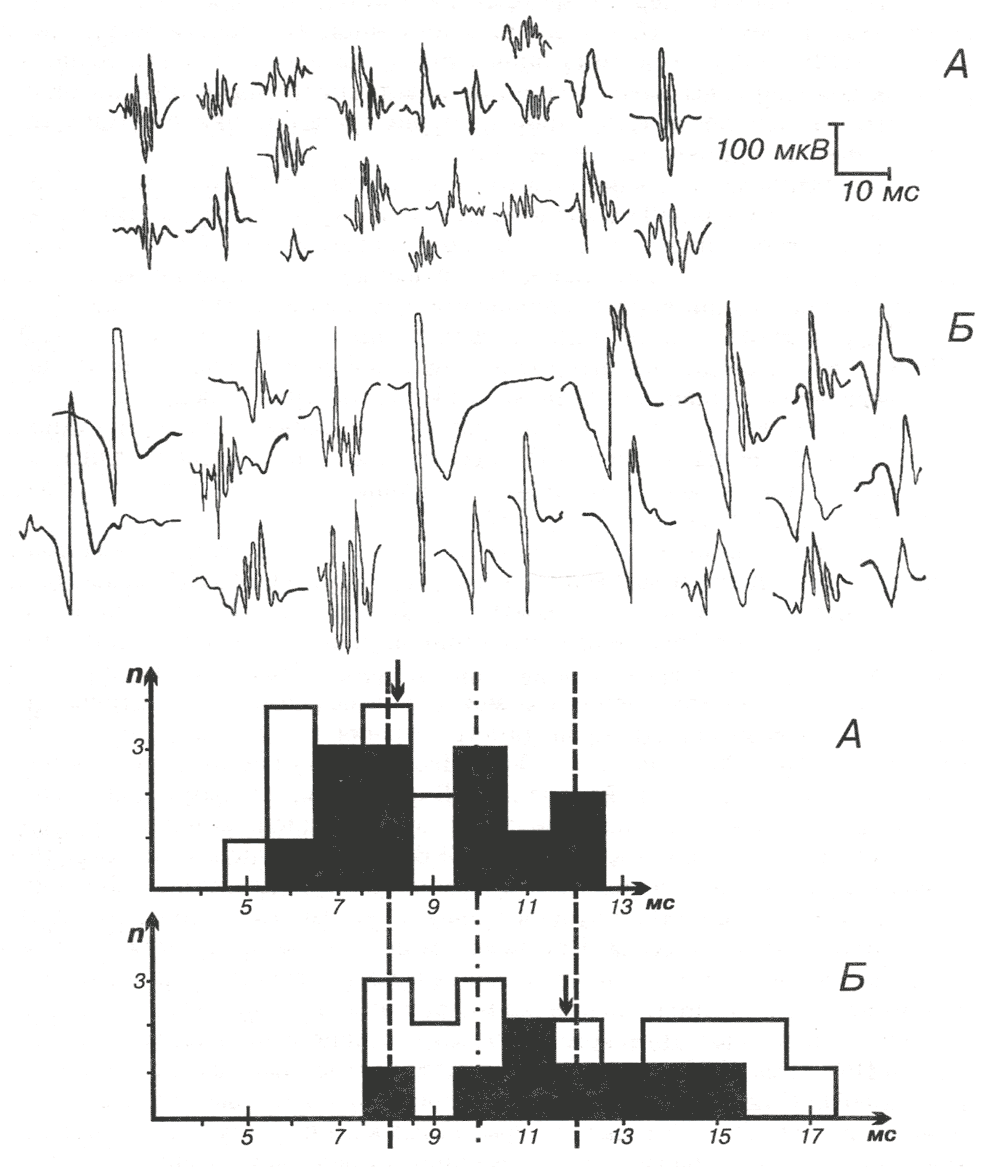
Рис. 1.20. Потенциалы различных ДЕ, зарегистрированные в дельтовидной мышце больного 22 лет с полимиозитом, распределение которых по длительности представлено на гистограммах.
А — 20 ПДЕ и гистограмма их распределения до лечения: длительность и амплитуда ПДЕ снижены.
Б — 20 ПДЕ и гистограмма их распределения на фоне эффективной терапии. По оси ординат — число ПДЕ; по оси абсцисс — длительность ПДЕ, мс. Прерывистые линии — нормальные границы распределения ПДЕ в здоровой дельтовидной мышце; прерывистая линия с точками — средняя длительность ПДЕ в здоровой дельтовидной мышце. Стрелки — средняя длительность ПДЕ в мышце больного до и после лечения; затемнено — полифазные ПДЕ.
Анализ изменений параметров и формы ПДЕ, выраженности спонтанной активности позволяет судить о функциональном состоянии мышц и тяжести патологического процесса: отмечена хорошая корреляция между числом полифазных, низкоамплитудных ПДЕ уменьшенной длительности, выраженностью спонтанной активности и степенью снижения силы исследуемой мышцы.
При большой давности процесса, его подостром течении, наряду с преобладающим числом ПДЕ уменьшенной длительности, в небольшом числе мышц (до 5–10 %) регистрируется ПДЕ с увеличенной длительностью (см. рис. 1.19, д, е). Однако средняя длительность ПДЕ в данных мышцах остается сниженной из-за наличия большого числа узких потенциалов. Появление таких ПДЕ связано с развитием коллатерального спраутинга в результате повреждения дистальных ветвлений аксонов. Признаки реиннервации прослеживаются также по увеличению плотности мышечных волокон в данных мышцах (Stalberg et al., 1986; Касаткина, Гехт, 1988) и при гистохимическом анализе мышечных биоптатов, в которых обнаруживаются начальные группировки мышечных волокон.
Поскольку дерматомиозит в 7–24 % всех случаев сочетается со злокачественными опухолями, особенно у мужчин старше 40 лет (50 %), нами проведено детальное электромиографическое обследование 5 больных (20 мышц), имеющих опухоли различной локализации в сочетании с полимиозитом. На разных стадиях развития и течения полимиозита на фоне диагностированного рака независимо от локализации опухоли не выявлено достоверных электромиографических отличий от полимиозита без опухоли. Аналогичные наблюдения приведены в литературе (Callen, 1987). Необходимо отметить, что наличие клинической слабости мышц у больных раком не означает обязательного развития воспалительного поражения мышц. При таких формах поражения мышц нет типичной ЭМГ-картины полимиозита. В этих случаях поражение мышц в виде избирательной атрофии мышечных волокон 2-го типа обнаруживается только при морфогистохимическом исследовании мышечных биоптатов (Engel et al., 1974). Результаты проведенного нами электромиографического обследования мышц 2 больных, у которых полимиозит развивался на фоне лечения D-пеницилламином основного заболевания соединительной ткани, достоверно не отличались от данных обследования при идиопатическом полимиозите на сопоставимых стадиях болезни. Доказательством индуцирования полимиозита D-пеницилламином является определенная временная связь между применением препарата и развитием мышечных расстройств, а также экспериментальные данные, свидетельствующие о влиянии D-пеницилламина на интимные аутоиммунные механизмы. Описываются также полимиозиты, спровоцированные приемом прокаинамида и фенитоина, по характеру клинической и электромиографической картины также не отличающиеся от истинного полимиозита (Fonfiveros et al., 1980).
Начало восстановления двигательной функции мышцы, наступающее при полимиозите, как правило, на фоне терапии преднизолоном и/или иммунодепрессантами, прежде всего характеризуется уменьшением спонтанной активности. Причем первоначально отмечается исчезновение псевдомиотонических разрядов. Затем происходит уменьшение интенсивности ПФ или полное их исчезновение и, в последнюю очередь, исчезновение ПОВ. На фоне эффективной терапии, приводящей к значительному увеличению или полной нормализации силы мышц, только в 11 % исследованных мышц мы выявляли псевдомиотонические разряды, и в 40 % — ПФ и ПОВ средней степени выраженности.
Параллельно с уменьшением спонтанной активности (или несколько позднее) отмечается нормализация длительности ПДЕ. В начальных стадиях ремиссии длительное время могут регистрироваться низкоамплитудные полифазные ПДЕ. По мере дальнейшего улучшения и восстановления силы мышц отмечается нормализация все большего числа ПДЕ, а в 25–35 % мышц на данной стадии процесса выявляются ПДЕ увеличенной длительности, причем большинство из них имеет нормальную форму (3 фазы) при нормальной или даже повышенной амплитуде, однако степень увеличения длительности не превышает 20 %, а гистограмма распределения ПДЕ по длительности соответствует 3 ЭМГ-стадии. По мере нарастания положительного эффекта лечения происходит также уменьшение числа полифазных ПДЕ, и в большинстве обследованных мышц они не превышают 30 %.
Период, предшествующий наступлению ремиссии, характеризуется уменьшением или исчезновением спонтанной активности, нормализацией длительности, амплитуды и числа фаз ПДЕ, появлением отдельных укрупненных потенциалов с повышенной амплитудой. В некоторых мышцах могут наблюдаться отдельные фасцикуляции редкой частоты.
Электромиографическая картина, наблюдаемая в мышце больных на фоне стойкой ремиссии, зависит от степени поражения мышц в наиболее тяжелый период заболевания. В тех мышцах, где ранее отмечались лишь небольшие изменения (снижение средней длительности ПДЕ не более чем на 30 %, полифазия — не более 30 % и умеренная спонтанная активность мышечных волокон), могут отмечаться признаки полного благополучия — отсутствие спонтанной активности мышечных волокон, нормализация структуры гистограмм распределения ПДЕ по длительности. В мышцах, где полимиозитический процесс был более тяжелым, в резидуальной стадии отмечается наличие определенного числа укрупненных ПДЕ.
Анализ электромиографических изменений состояния мышц на разных стадиях развития болезни и восстановления функции мышц при лечении кортикостероидными препаратами у 105 больных с различными формами полимиозита позволяет выделить ряд критериев объективной оценки эффективности проводимой терапии, приемлемых в качестве прогностических тестов при выборе и коррекции лечения.
Прогностически неблагоприятным считается процесс, характеризующийся значительным снижением длительности ПДЕ (более 40 %), регистрацией бурной спонтанной активности мышечных волокон и появлением ПОВ большой амплитуды (200 мкВ и более). Менее злокачественное течение может иметь процесс, при котором степень снижения ПДЕ составляет 20–30 %, число полифазных потенциалов — до 30 %, спонтанная активность мышечных волокон не имеет большой выраженности и представлена в виде ПФ и ПОВ малой амплитуды при отсутствии псевдомиотонических разрядов.
Купить книги по неврологии в интернет-магазине медицинской книги shopdon.ru
Книга "Электромиография в диагностике нервно-мышечных заболеваний"
Авторы: Гехт Б. М., Касаткина Л. Ф., Самойлов М. И., Санадзе А. Г.

Книга посвящена возможностям применения электромиографических методов при диагностике, изучении механизмов развития и мониторировании функций различных отделов периферического нейромоторного аппарата в процессе развития неврологических и нейросоматических заболеваний.
Приведены детальные методические рекомендации по определению параметров двигательных единиц скелетных мышц, скоростей проведения возбуждения по моторным и сенсорным волокнам нервов, параметров нервно-мышечной передачи. Приведены данные, характеризующие эти параметры в норме.
Подробно освещены проблемы использования электромиографии при проведении дифференциальной диагностики различных клинических синдромов, связанных с поражением мотонейронов, миелиновых и аксональных структур волокон периферических нервов, нарушениями состояния нервно-мышечной передачи и мышечных волокон.
Книга предназначена для широкого круга читателей — практических врачей — невропатологов, имеющих дело с различными нервно-мышечными заболеваниями, нейрохирургов, решающих проблемы восстановительной нейропластики, физиотерапевтов, ортопедов и травматологов, а также для физиологов и патофизиологов, изучающих различные стороны патологии периферического нейромоторного аппарата, научных работников, студентов и аспирантов.
Купить книги по неврологии в интернет-магазине медицинской книги shopdon.ru
Содержание книги "Электромиография в диагностике нервно-мышечных заболеваний" - Гехт Б. М., Касаткина Л. Ф., Самойлов М. И., Санадзе А. Г.
Глава 1. Электромиография в изучении двигательных единиц и мышечных волокон
1.1. Морфофункциональная организация двигательных единиц скелетных мышц
1.1.1. Распределение мышечных волокон в двигательных единицах мышцы
1.1.2. Территория двигательной единицы
1.1.3. Классификация двигательных единиц
1.1.4. Частота импульсации двигательных единиц
1.2. Электрическая активность двигательных единиц и мышечных волокон в норме и при различных формах патологии
1.2.1. Изучение двигательных единиц методом классической игольчатой электромиографии
1.2.1.1. Параметры потенциалов двигательных единиц
1.2.2. Электромиография отдельных мышечных волокон
1.2.2.1. Параметры потенциала мышечного волокна
1.2.3. Изучение двигательных единиц методом макроэлектромиографии
1.2.4. Изучение двигательных единиц методом сканирующей электромиографии
1.2.5. Потенциалы спонтанной активности мышечных волокон и двигательных единиц
1.2.5.1. Потенциалы фибрилляций и положительные острые волны
1.2.5.2. Миотонические разряды и комплексные повторяющиеся разряды
1.2.5.3. Потенциалы фасцикуляций
1.2.6. Реорганизация двигательных единиц в процессе развития компенсаторной иннервации
1.2.6.1. Механизмы компенсаторной иннервации
1.2.7. Электромиографические стадии денервационно-реиннервационного процесса
1.2.7.1. Сопоставление электромиографических стадий денервационно-реиннервационного процесса с морфо-гистохимическими исследованиями мышц
1.2.7.2. Спонтанная активность мышечных волокон и потенциалы фасцикуляций на различных электромиографических стадиях денервационно-реиннервационного процесса
1.2.8. Максимальный объем и эффективность компенсаторной иннервации
1.2.9. Типы потенциалов двигательных единиц, регистрируемые в мышцах больных при разных уровнях поражения периферического нейромоторного аппарата
1.3. Классификация и электромиографическая диагностика заболеваний, обусловленных патологией двигательных единиц и мышечных волокон
1.3.1. Электромиографическая диагностика заболеваний мотонейронов (нейронопатий)
1.3.1.1. Хронические прогрессирующие заболевания мотонейронов
1.3.1.2. Полиомиелит
1.3.1.3. Вторичные поражения мотонейронов спинного мозга
1.3.2. Электромиография в диагностике миопатий
1.3.2.1. Миопатии — прогрессирующие мышечные дистрофии
1.3.2.2. Митохондриальная миопатия
1.3.2.3. Врожденные (конгенитальные) непрогрессирующие формы миопатий
1.3.3. Миопатии при эндокринно-обменных заболеваниях и патологии щитовидной железы
1.3.3.1. Миопатии при заболеваниях щитовидной железы
1.3.3.2. Тиреотоксическая миопатия
1.3.3.3. Мышечные нарушения при гипотиреозе
1.3.4. Миопатии при гиперфункции коры надпочечников (стероидные миопатии) и гипокортицизме (аддисонизм)
1.3.5. Миопатии при заболеваниях гипофиза (акромегалия, питуитарный гигантизм)
1.3.6. Пароксизмальные миоплегии, периодический паралич
1.3.7. Заболевания мышц, сопровождающиеся нарушением расслабления и судорогами
1.3.7.1. Миотония Томсена
1.3.7.2. Парадоксальная миотония Эйленбурга, врожденная парамиотония
1.3.7.3. Дистрофическая миотония
1.3.7.4. Нейромиотонии
1.3.7.5. «Крампи»-синдром
1.3.7.6. Болезнь Мак-Ардля
1.3.8. Воспалительные заболевания мышц (полимиозиты)
1.3.8.1. Дерматомиозит - полимиозит
1.3.8.2. Миозиты, сочетающиеся с другими коллагенозами (симптоматические полимиозиты)
1.3.8.3. Псевдомиопатические формы воспалительных болезней мышц
1.3.8.4. Полимиозит при саркоидозе
1.3.8.5. Ревматическая полимиалгия
1.3.8.6. Паразитарные полимиозиты
1.3.9. Методика изучения двигательных единиц и спонтанной активности мышечных волокон при стандартной игольчатой электромиографии (рекомендации для практического врача)
1.3.9.1. Игольчатые электроды
1.3.9.2. Заземляющие электроды
1.3.9.3. Подготовка к исследованию
1.3.9.4. Подготовка больного к обследованию
1.3.9.5. Протокол исследования
1.3.9.6. Выбор игольчатого электрода для проведения исследования
1.3.9.7. Задачи исследования
1.3.9.8. Выбор мышц для исследования
1.3.9.9. Проведение исследования
1.3.9.10. Описание результатов обследования
1.3.9.11. Возможные артефакты при проведении исследования
1.3.9.12. Уход за игольчатыми электродами
Купить книги по неврологии в интернет-магазине медицинской книги shopdon.ru
Глава 2. Проводящая функция моторных, сенсорных и вегетативных аксонов периферических нервов в норме и патологии
2.1. Проводящая функция аксонов периферических нервов и механизмы нарушения проведения по аксону
2.1.1. Миелиновая оболочка и ее структура
2.1.2. Сальтаторное проведение возбуждения
2.1.3. Механизмы, лежащие в основе нарушения проведения в демиелинизированных волокнах
2.1.4. Замедление проведения и блок
2.1.5. Влияние экзогенных факторов и температуры на демиелинизированные волокна
2.1.6. Механизмы восстановления проведения в демиелинизированных аксонах
2.1.7. Механизмы формирования электрофизиологических феноменов, обусловленных патологией симпатических и парасимпатических волокон периферических нервов
2.2. Клинические проявления нарушений проводящей функции моторных, сенсорных и вегетативных аксонов периферических нервов
2.2.1. Аксонопатии
2.2.2. Миелинопатии
2.2.3. Потенциалы двигательных единиц и спонтанная активность мышечных волокон при аксональных и демиелинизирующих невропатиях
2.2.4. Клиническая электромиография в топической диагностике заболеваний периферической нервной системы
2.2.4.1. Топическая диагностика поражений корешков
2.2.4.2. Топическая диагностика поражения шейно-плечевого и пояснично-крестцового сплетений
2.2.4.3. Топическая диагностика поражения периферических нервов
2.3. Методы изучения скорости проведения возбуждения по моторным, сенсорным и вегетативным аксонам периферических нервов
2.3.1. Исследование скорости распространения возбуждения по двигательным и чувствительным волокнам нервов
2.3.1.1. Определение скорости распространения возбуждения по двигательным волокнам нерва
2.3.1.2. Метод оценки диапазона скоростей распространения возбуждения по двигательным аксонам нерва (с использованием F-волны)
2.3.1.3. Метод измерения скорости распространения возбуждения по проксимальным участкам двигательных аксонов с использованием «метода коллизии импульсов»
2.3.1.4. Определение скорости распространения возбуждения по наиболее дистальным немиелинизированным участкам аксонов (резидуальная латентность)
2.3.1.5. Сопоставление скоростей распространения возбуждения по различным участкам нерва (коэффициенты: проксимально-дистальный, краниокаудальный и асимметрии)
2.3.2. Определение скорости распространения возбуждения по чувствительным волокнам нервов
2.3.2.1. Исследование скорости распространения возбуждения по чувствительным аксонам ортодромным методом
2.3.2.2. Исследование скорости распространения возбуждения по чувствительным аксонам антидромным методом
2.3.3. Методы исследования скорости распространения возбуждения по эфферентным волокнам симпатических аксонов и функции парасимпатических волокон блуждающего нерва
2.3.4. Исследование вызванного кожного симпатического потенциала
Купить книги по неврологии в интернет-магазине медицинской книги shopdon.ru
Глава 3. Электромиографические характеристики функционального состояния нервно-мышечной передачи в норме и патологии
3.1. Морфофункциональная организация нервно-мышечного синапса в норме и патологии
3.2. Механизмы нарушений нервно-мышечной передачи
3.3. Методы исследования функционального состояния нервно-мышечной передачи
3.3.1. Вызванные электрические ответы мышцы (М-ответы) в исследовании нервно-мышечной передачи
3.3.1.1. Схема проведения диагностических исследований при изучении функционального состояния нервно-мышечной передачи (рекомендации для практического врача)
3.3.1.2. Параметры М-ответа, вызванные одиночным супрамаксимальным стимулом
3.3.1.3. Изменение параметров М-ответа при низкочастотной стимуляции мышцы
3.3.1.4. Изменение параметров М-ответа при высокочастотной стимуляции мышцы
3.3.2. Посттетанические феномены в изучении состояния нервно-мышечной передачи
3.3.2.1. Посттетаническое (постактивационное) облегчение
3.3.2.2. Значение феномена «заблокированное» в диагностике синаптических болезней
3.3.2.3. Посттетаническое (постактивационное) истощение (депрессия)
3.3.3. Фармакологические и функциональные пробы в изучении состояния нервно-мышечной передачи
3.3.3.1. Длительная стимуляция на фоне ишемии
3.3.3.2. Двухступенчатый тест
3.3.3.3. Генерализованная кураре-проба
3.3.3.4. Локальная кураре-проба
3.3.3.5. Температурные пробы
3.3.3.6. Тензилоновая проба
3.3.3.7. Прозериновая проба
3.3.3.8. Амиридиновая проба
3.3.3.9. Гуанидиновая проба
3.3.3.10. Проба с введением хлористого кальция
3.3.3.11. Последовательность применения функциональных и фармакологических проб
3.4. Электромиография в диагностике заболеваний, связанных с патологией нервно-мышечной передачи
3.4.1. Потенциалы двигательных единиц и мышечных волокон при миастении
3.4.1.1. Электромиограмма произвольного усилия
3.4.1.2. Изменение потенциалов двигательных единиц при миастении
3.4.1.3. Изменение параметров макропотенциалов двигательных единиц у больных с нарушением нервно-мышечной передачи
3.4.1.4. Плотность мышечных волокон в двигательных единицах мышц больных с нарушением нервно-мышечной передачи
3.4.1.5. Спонтанная активность мышечных волокон и двигательных единиц в мышцах больных с нарушением нервно-мышечной передачи
3.4.1.6. Потенциалы отдельных мышечных волокон и джиттер при миастении
3.4.2. Вызванные электрические ответы мышцы (М-ответы) в диагностике миастении
3.4.3. Диагностика миастенического синдрома Ламберта-Итона
3.4.3.1. Потенциалы двигательных единиц и мышечных волокон при миастеническом синдроме Ламберта-Итона
3.4.3.2. Вызванные электрические ответы мышцы (М-ответы) в диагностике миастенического синдрома Ламберта-Итона
3.4.4. Диагностика миастенического синдрома при ботулизме
3.4.4.1. Потенциалы двигательных единиц мышечных волокон при ботулизме
3.4.4.2. Вызванные электрические ответы мышцы (М-ответы) в диагностике миастенического синдрома при ботулизме
3.4.5. Электромиографическая диагностика миастении с чертами миастенического синдрома типа Ламберта-Итона
3.4.6. Электромиографическая диагностика миастенического синдрома, сочетающегося с гипотонией и недоразвитием синаптического аппарата мышцы
3.4.7. Электромиографическая диагностика конгенитальных миастенических синдромов
3.4.7.1. Миастенический синдром, связанный с нарушением ресинтеза и мобилизации ацетилхолина
3.4.7.2. Миастенический синдром с дефицитом ацетилхолинэстеразы
3.4.7.3. Миастенический синдром, связанный с медленным закрытием ионных каналов
3.4.7.4. Миастенический синдром, связанный с дефицитом ацетилхолиновых рецепторов
Купить книги по неврологии в интернет-магазине медицинской книги shopdon.ru
Глава 4. Исследование функционального состояния проводящей функции пирамидных систем и проксимальных сегментов нервов методом магнитной стимуляции
4.1. Возможности применения методики магнитной стимуляции в клинической практике
4.2. Физические основы формирования возбуждения и трансформации магнитного импульса в стимулируемых тканях
4.3. Устройство и техническая характеристика магнитного стимулятора
4.4. Магнитные койлы: свойства и характеристики
4.5. Методика магнитной стимуляции
4.6. Преимущества и недостатки метода магнитной стимуляции. Определение места стимуляции нервных структур магнитным импульсом
4.7. Безопасность, противопоказания и меры предосторожности
4.8. Фасилитация двигательного ответа при магнитной стимуляции
4.9. Время проведения возбуждения по центральным и периферическим проводящим путям. Использование минимальной латентности F-волны
4.10. Время проведения возбуждения по наиболее проксимальным участкам периферического нерва. Корешковая задержка
4.11. Клинические аспекты применения метода магнитной стимуляции
Приложение 1. Электромиографическая терминология
Приложение 2. Нейромиоанализатор НМА-4-01 «Нейромиан»
I. Исследование потенциалов двигательных единиц
II. Исследование чувствительных нервов
III. Исследование двигательных нервов
IV. Интерференционная миография
V. Декремент
VI. F-волна
VII. Н-рефлекс
VIII. Парная стимуляция
Купить книги по неврологии в интернет-магазине медицинской книги shopdon.ru


























































































0 комментариев