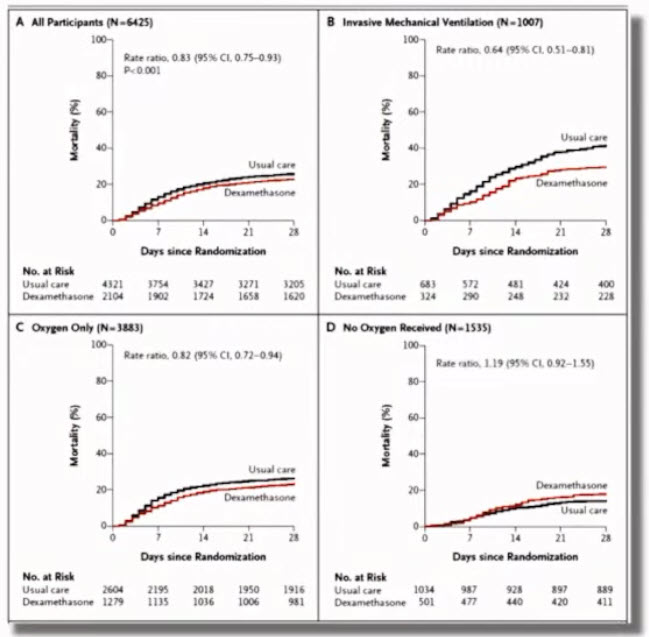
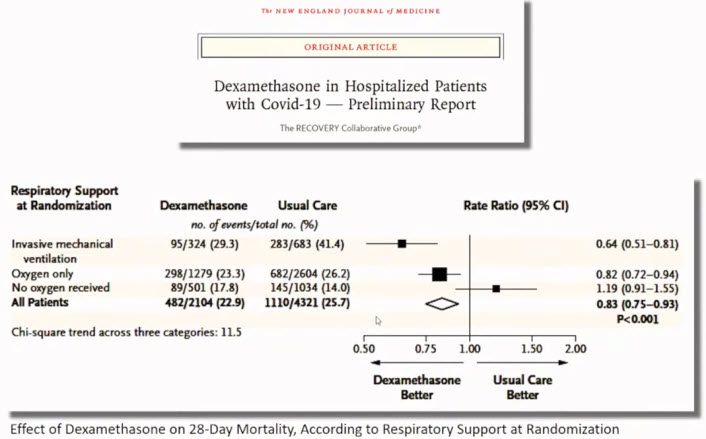
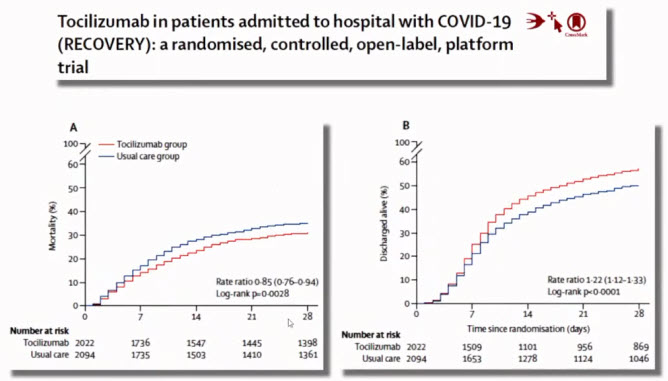
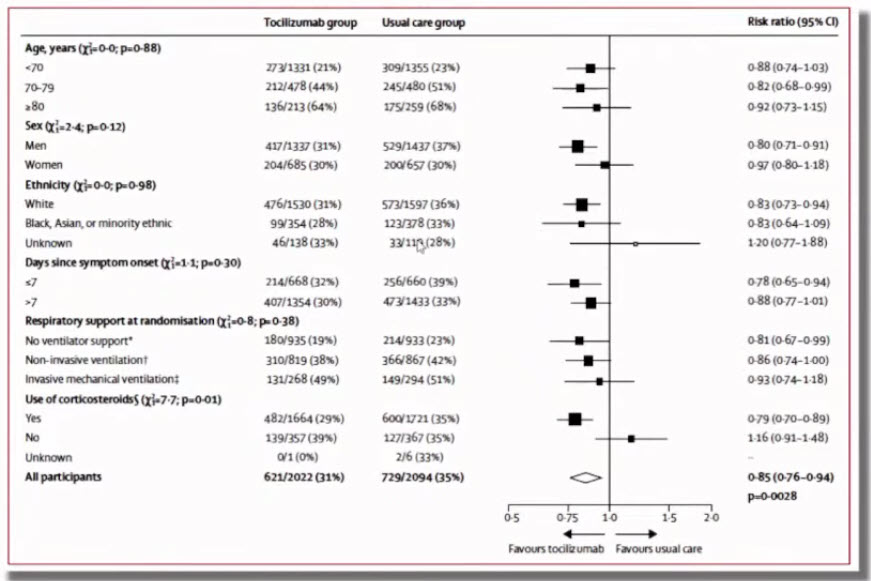
Лекция для врачей "Вакцинопрофилактика COVID-19: современные возможности (COVID-19 у пациента пульмонологического профиля)". Часть 2. Лекцию для врачей проводит Зырянов Сергей Кенсаринович доктор медицинских наук, профессор, заведующий кафедрой общей и клинической фармакологии ФГАОУ ВО «Российский университет дружбы народов»
На лекции для врачей рассмотрены следующие вопросы:
- Пока пандемия не отступает...
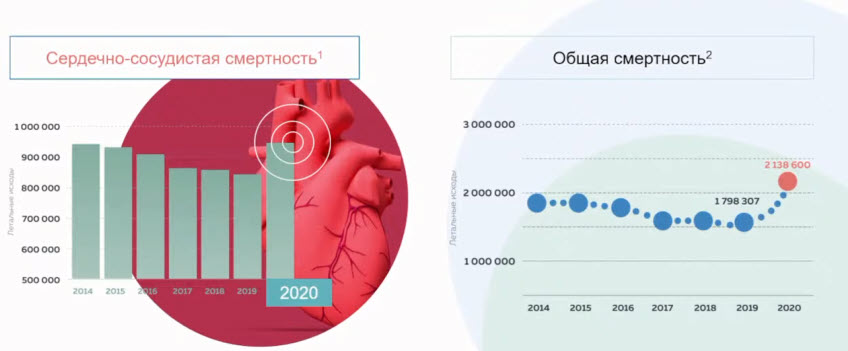
- Существенный прирост летальных исходов, связанных с сердечно-сосудистыми заболеваниями в 2020 году
- Патогенез SARS-CoV-2: что мы знаем сегодня
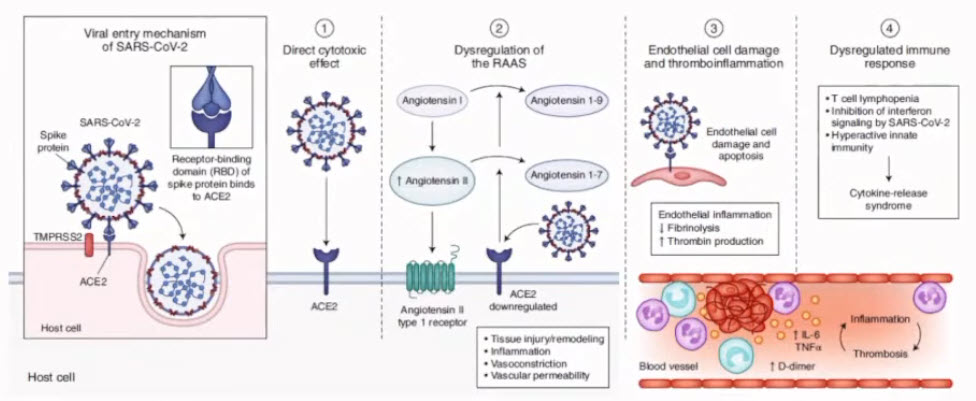
- Массовая вакцинация - это единственный эффективный способ остановить пандемию и альтернативы ей не существует. Позволить человеческой популяции приобрести коллективный иммунитет естественным путем означает, что COVID-19 должны переболеть более 75-80 % всех людей, после чего коэффициент передачи инфекции снизится до уровней, при которых пандемия прекратится самостоятельно
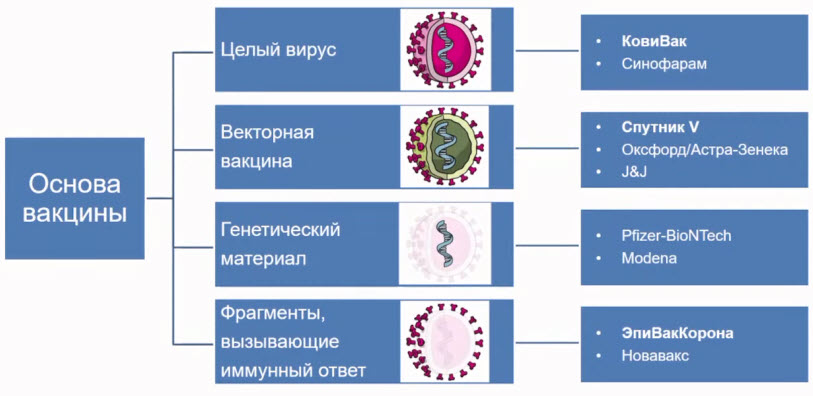
- Виды вакцин против SARS-CoV2
- Исследуемый препарат: «Гам-КОВИД-Вак» раствор для внутримышечного введения
- Состав на 1 дозу (0,5 мл):
- Компонент I содержит:
- Действующее вещество: рекомбинантные аденовирусные частицы 26 серотипа, содержащие ген белка S вируса SARS-CoV-2, в количестве (1,0±0,5) х 1011 частиц доза
- Вспомогательные вещества: Трис (гидроксиметил) аминометан —1,21 мг, натрия хлорид - 2.19 мг, сахароза -25,0 мг, магния хлорида гексагидрат -102,0 мкг, ЭДТА динатриевая соль дигидрат - 19,0 мкг, полисорбат - 80- 250 мкг, этанол 95% - 2,5 мкл, вода для инъекций до 0,5 мл.
- Компонент II содержит:
- Действующее вещество: рекомбинантные аденовирусные частицы 5 серотипа, содержащие ген белка S вируса SARS-CoV-2, в количестве (1,0±0,5) х 1011 частиц доза
- Вспомогательные вещества: Трис (гидроксиметил) аминометан —1,21 мг, натрия хлорид- 2.19 мг, сахароза -25,0 мг, магния хлорида гексагидрат -102,0 мкг, ЭДТА динатриевая соль дигидрат - 19,0 мкг, полисорбат - 80- 250 мкг, этанол 95% - 2,5 мкл, вода для инъекций до 0.5 мл.
- Вспомогательные вещества: Трис (гидроксиметил) аминометан —1,21 мг, натрия хлорид - 2.19 мг, сахароза -25,0 мг, магния хлорида гексагидрат -102,0 мкг, ЭДТА динатриевая соль дигидрат - 19,0 мкг, полисорбат - 80- 250 мкг, этанол 95% - 2,5 мкл, вода для инъекций до 0,5 мл.
- Компонент II содержит:
- Действующее вещество: рекомбинантные аденовирусные частицы 5 серотипа, содержащие ген белка S вируса SARS-CoV-2, в количестве (1,0±0,5) х 1011 частиц доза
- Вспомогательные вещества: Трис (гидроксиметил) аминометан —1,21 мг, натрия хлорид- 2.19 мг, сахароза -25,0 мг, магния хлорида гексагидрат -102,0 мкг, ЭДТА динатриевая соль дигидрат - 19,0 мкг, полисорбат - 80- 250 мкг, этанол 95% - 2,5 мкл, вода для инъекций до 0.5 мл.
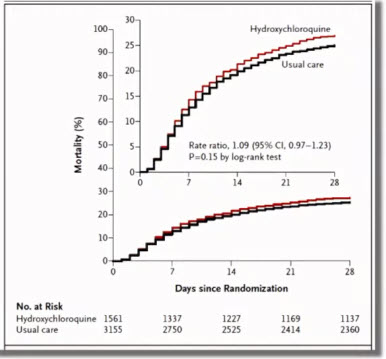
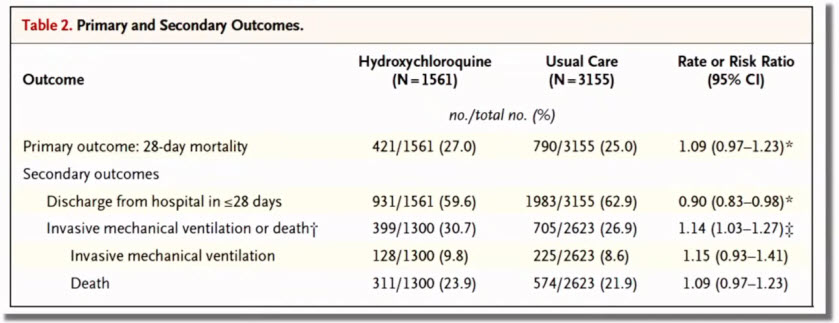
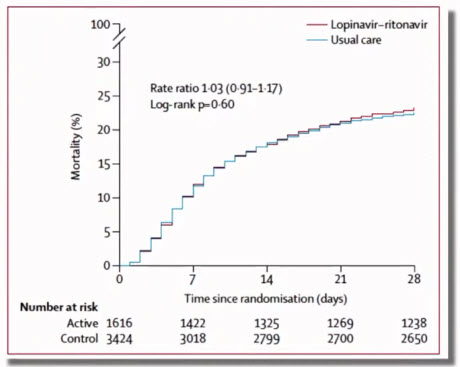
- Профиль безопасности и переносимости вакцин на основе аденовирусных векторов
- Профиль безопасности - благоприятный: риски незначительные и оправданы потенциальной пользой; переносимость - хорошая
- Типичные для всех вакцин на основе вирусных векторов поствакцинальные нежелательные явления:
- системные: озноб, лихорадка, головная боль, артралгия, миалгия, астения, общее недомогание, иногда - гриппоподобный синдром, аллергические реакции, лабораторные отклонения и др.
- местные: гиперемия, болезненность, местное повышение температуры, уплотнение/инфильтрация, отечность увеличение регионарных лимфатических узлов и др.
- Степень тяжести нежелательных явлений: легкая или средней степени
- Отсутствие серьезных нежелательных явлений
- Разрешение в течение 1-2-х суток самопроизвольно и/или после проведения симптоматической терапии антигистаминными, противовоспалительными и жаропонижающими лекарственными препаратами
- Доклиническое изучение безопасности комбинированной векторной вакцины Гам-КОВИД-Вак
- В ходе доклинических исследований в возрастающих дозах, в том числе с использованием высшей дозы, запланированной для клинического использования у человека, показано:
- Отсутствие острых токсических эффектов у проиммунизированных животных (мыши, кролики, макаки резус, приматы мармозета - наиболее восприимчивы к инфекционным болезням человека, игрунки обыкновенные)
- Отсутствие ADE эффекта - антителозависимого усиления инфекции (приматы и сирийские хомячки - виды, чувствительные к инфекции SARS CoV2)
- Отсутствие аллергизирующих свойств компонентов вакцины в тестах общей анафилаксии и конъюнктивальной пробы (морские свинки альбиносы)
- Отсутствие иммунотоксичности на клеточный и гуморальный иммунитет, активность перитонеальных макрофагов (мыши)
- Отсутствие эмбриотоксического и тератогенного действия у вакцин, разработанных на платформе аденовирусных векторов (26 и 5 серотипов)
- В ходе доклинических исследований в возрастающих дозах, в том числе с использованием высшей дозы, запланированной для клинического использования у человека, показано:
- Клиническое изучение безопасности в рамках I фазы комбинированной векторной вакцины Гам-КОВИД-Вак
- Поствакцинальные осложнения, обусловленные действием вакцины:
- 1) Общие (чаще: гипертермия, артралгия, миалгия, астения, повышение или снижение АД, снижение аппетита, отклонения в лабораторных показателях - ОАК, БАК, иммунологическом статусе-повышение/снижение Т и В-лимфоцитов, CD4 и CD8 лимфоцитов, JgE и JgM; реже - головная боль, сердцебиение, диарея, боль в ротоглотке, заложенность носа, першение в горле, ринорея, крапивница (1 доброволец), отклонения в ОАМ ) и местные (чаще: боль и отечность в месте вакцинации после первого введения, гиперемия и гипертермия после второго введения: реже - уплотнение в месте вакцинации, зуд)
- 2) Отмечались у добровольцев в 1-2-е сутки после вакцинации
- 3) Связь с введенной вакциной от сомнительной до определенной
- 4) Степень тяжести легкая (преобладающее количество) и средняя степень тяжести
- 5) Отсутствие тяжелых и серьезных осложнений, исключения добровольцев из исследования по причине безопасности
- 6) Завершение выздоровлением без последствий в течение 3-х суток самопроизвольно или с применением симптоматических средств
- Поствакцинальные осложнения, обусловленные действием вакцины:
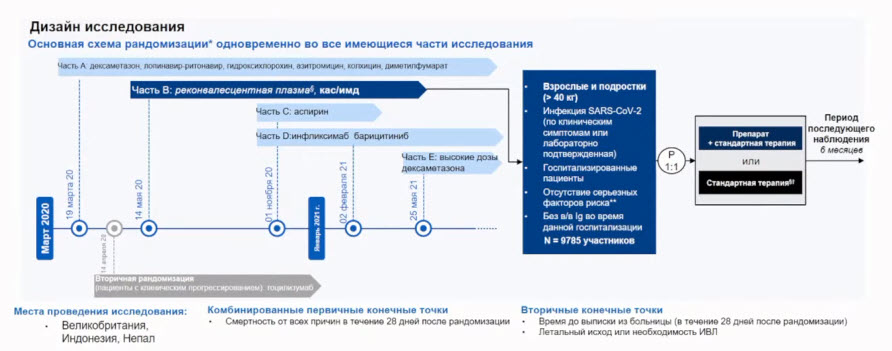
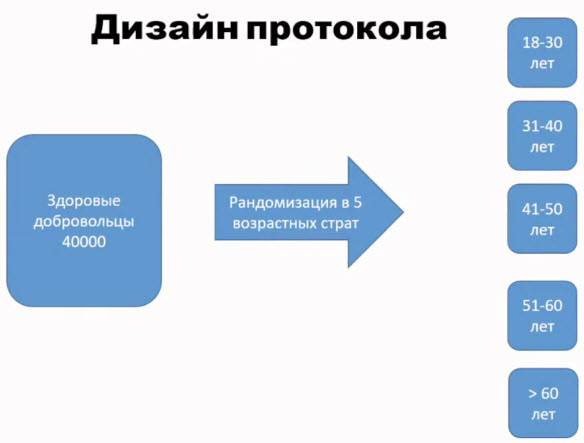
- Протокол клинического исследования

- Дизайн протокола
- Цели и конечные точки исследования
- Первичная цель
- Продемонстрировать превосходство «Гам-КОВИД-Вак. Комбинированная векторная вакцина для профилактики коронавирусной инфекции, вызываемой вирусом SARS-CoV-2», в сравнении с плацебо, основываясь на доле субъектов исследования с коронавирусной болезнью (COVID-19), развившейся до 6-ти месяцев после получения второй дозы ИЛП/плацебо и подтвержденной методом полимеразной цепной реакции (ПЦР)
- Первичная конечная точка
- Доля субъектов исследования с заболеванием COVID-19, развившимся до 6-ти месяцев после получения второй дозы ИЛП плацебо и подтвержденной методом ПЦР после планового завершения вакцинации. Профилактическая эффективность исследуемой вакцины должна быть ≥50% по сравнению с плацебо, при этом нижняя граница доверительного интервала точечной оценки по первичной переменной эффективности должна быть >33%
- Первичная цель
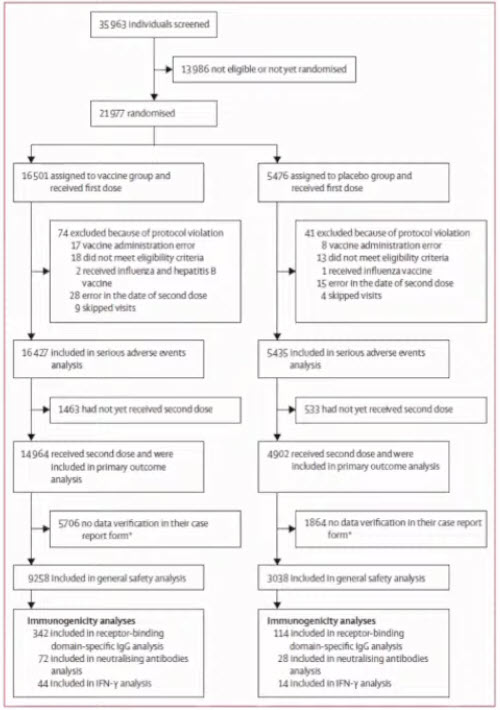
- Safety and efficacy of an rAd26 and rAd5 vector-based heterologous prime-boost COVID-19 vaccine: an interim analysis of a randomised controlled phase 3 trial in Russia
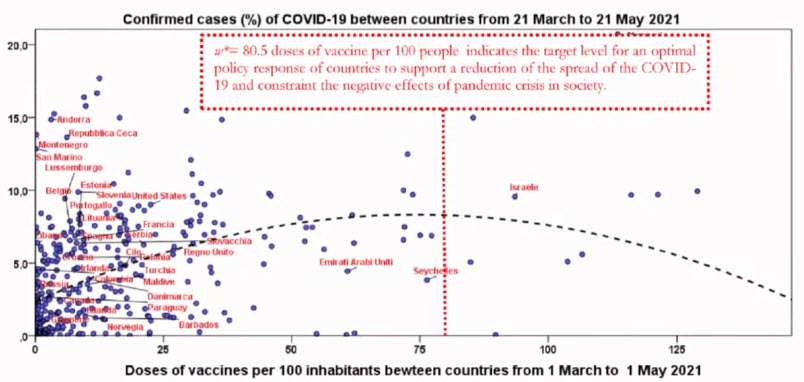
- Optimal levels of vaccination to reduce COVID-19 infected individuals and deaths: A global analysis
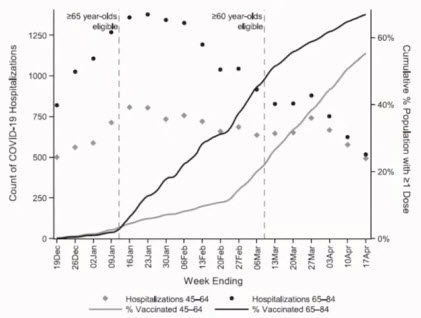
- Reduced COVID-19 hospitalizations among New York City residents following age-based SARS-CoV-2 vaccine eligibility: Evidence from a regression discontinuity design
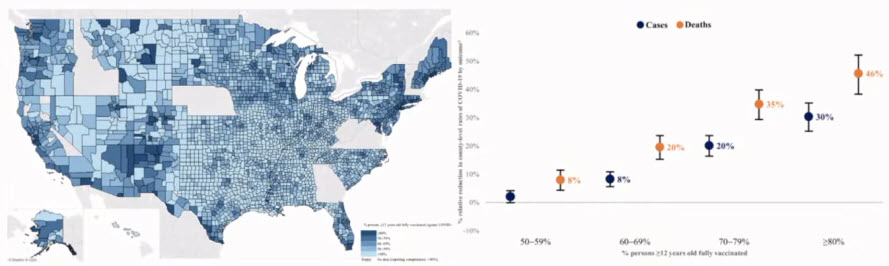
- County-level vaccination coverage and rates of COVID-19 cases and deaths in the United States: An ecological analysis
- Как работает массовая вакцинация против SARS-CoV2
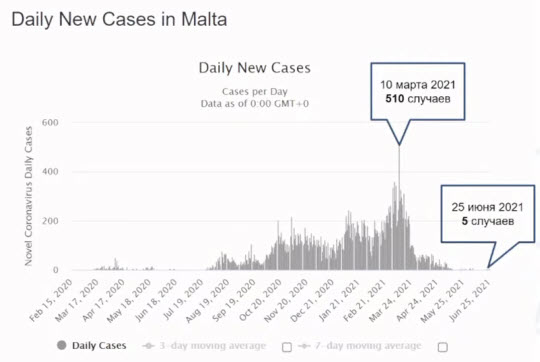
- Мальта
- Население - 502 000 человек
- Полный курс вакцинации получило 69% населения (на 25.06.2021)
- За июнь 2021 от COVID-19 скончался 1 человек
- Мальта
- Новые варианты вируса SARS-COV2, которые вызывают беспокойство
- Для всех вариантов характерно:
- Ускорение передачи
- Повышение тяжести течения
- Различное влияние на ранее приобретенный иммунитет
- Для всех вариантов характерно:
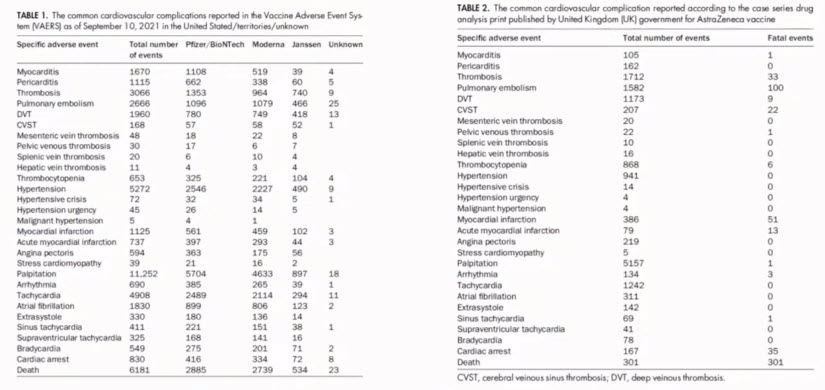
- Clinical Cardiovascular Adverse Events Reported Post-COVID-19 Vaccination: Are They a Real Risk?
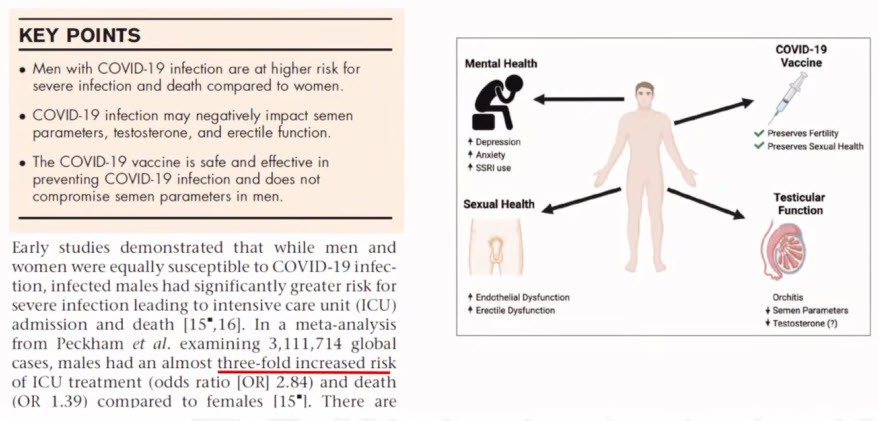
- The adverse impact of COVID-19 on men’s health
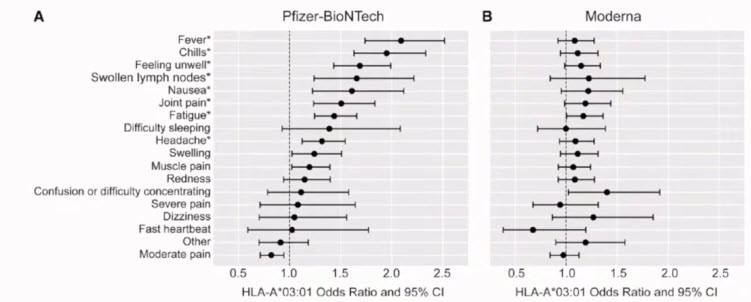
- HLA-A*03:01 is associated with increased risk of fever, chills, and stronger side effects from Pfizer-BioNTech COVID-19 vaccination
- The significant immune escape of pseudotyped SARS-CoV-2 variant Omicron
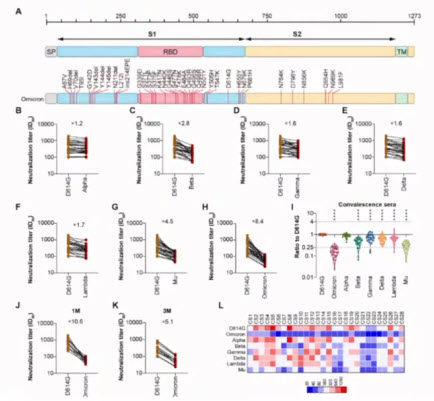
- Omicron variant showed lower neutralizing sensitivity than other SARS-CoV-2 variants to immune sera elicited by vaccines after boost
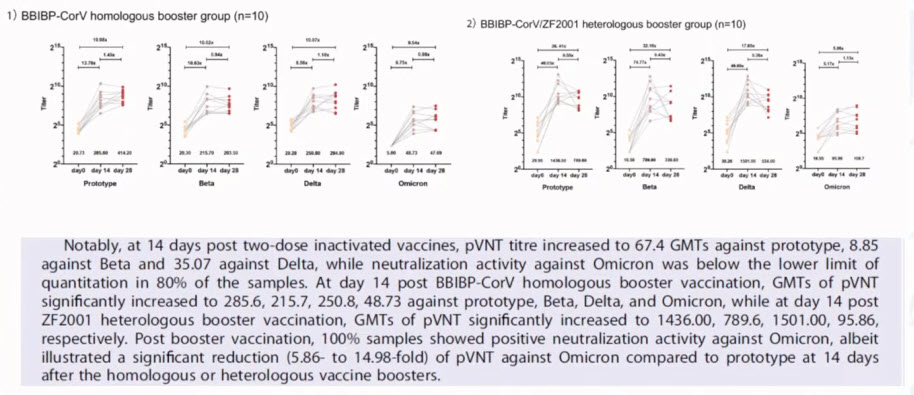
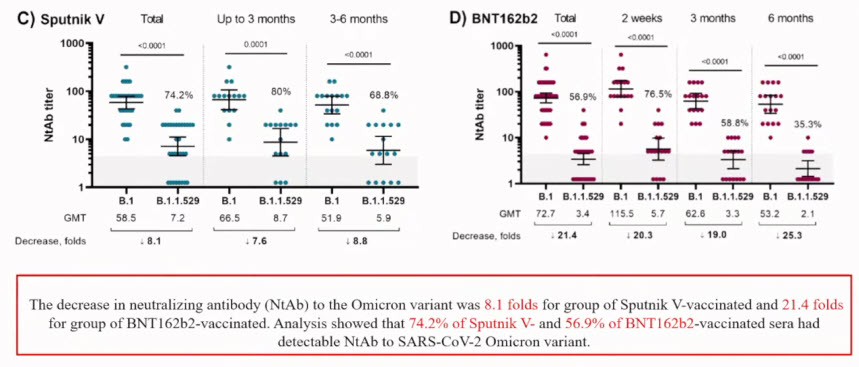
- Retention of Neutralizing response against SARS-CoV-2 Omicron variant in Sputnik V vaccinated individuals
Для просмотра лекции передвиньте ползунок времени 00 час 31 мин 50 сек