"УЗИ. Дифференциальная диагностика желтух у детей". Лекцию для врачей проводит врач УЗИ, врач функциональной диагностики, стаж 50 лет, высшая категория, профессор Михаил Иванович Пыков
Дополнительный материал
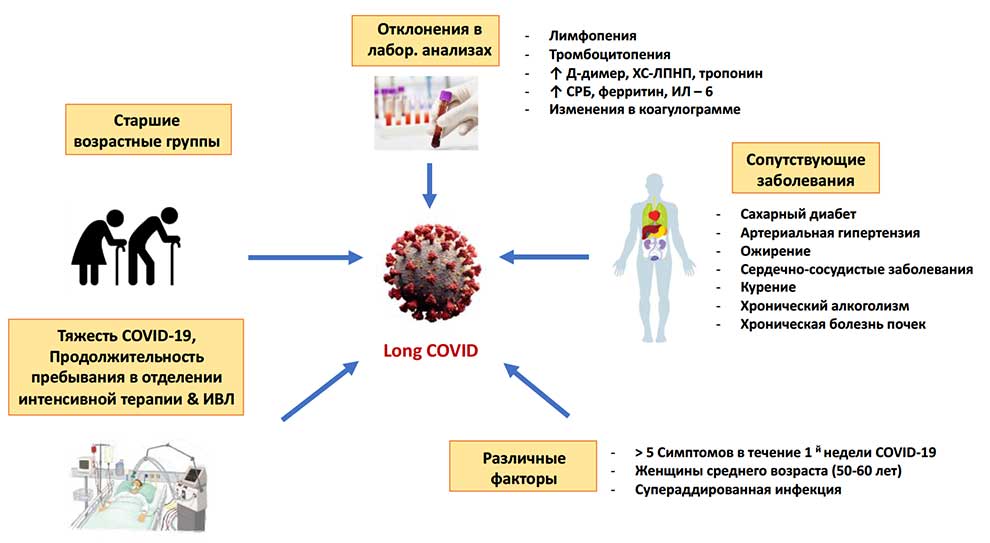
Дифференциальная диагностика синдрома желтухи у детей
Список сокращений
АлАТ — аланинаминотрансфераза
АсАТ — аспартатаминотрансфераза
ВГ — вирусный гепатит
ГГТП — гаммаглютамилтранспептидаза
ЛДГ — лактатдегидрогеназа
УДФ — уридин-5-дифосфат
ЦМВ — цитомегаловирус
ЩФ — щелочная фосфатаза
Обмен билирубина в организме
Основной источник билирубина — гемоглобин. Он превращается в билирубин в клетках ретикулогистиоцитарной системы, главным образом в печени, селезенке, костном мозге при участии ферментов гемоксигеназной системы (рис.).
За сутки распадается примерно 1 % эритроцитов и из их гемоглобина образуется до 300 мг билирубина. Приблизительно 20 % билирубина образуется не из гемоглобина зрелых эритроцитов, а из других гемсодержащих веществ (распадающихся в костном мозге эритробластов, незрелых ретикулоцитов, миоглобина и др.) — этот билирубин называется шунтовым, или ранним.
В результате ряда превращений образуется непрямой (неконъюгированный, или свободный, т. е. не дающий прямую реакцию с диазореактивом, так как связан с белком альбумином) билирубин, который плохо растворим в воде и транспортируется кровью в печень в комплексе с альбумином.
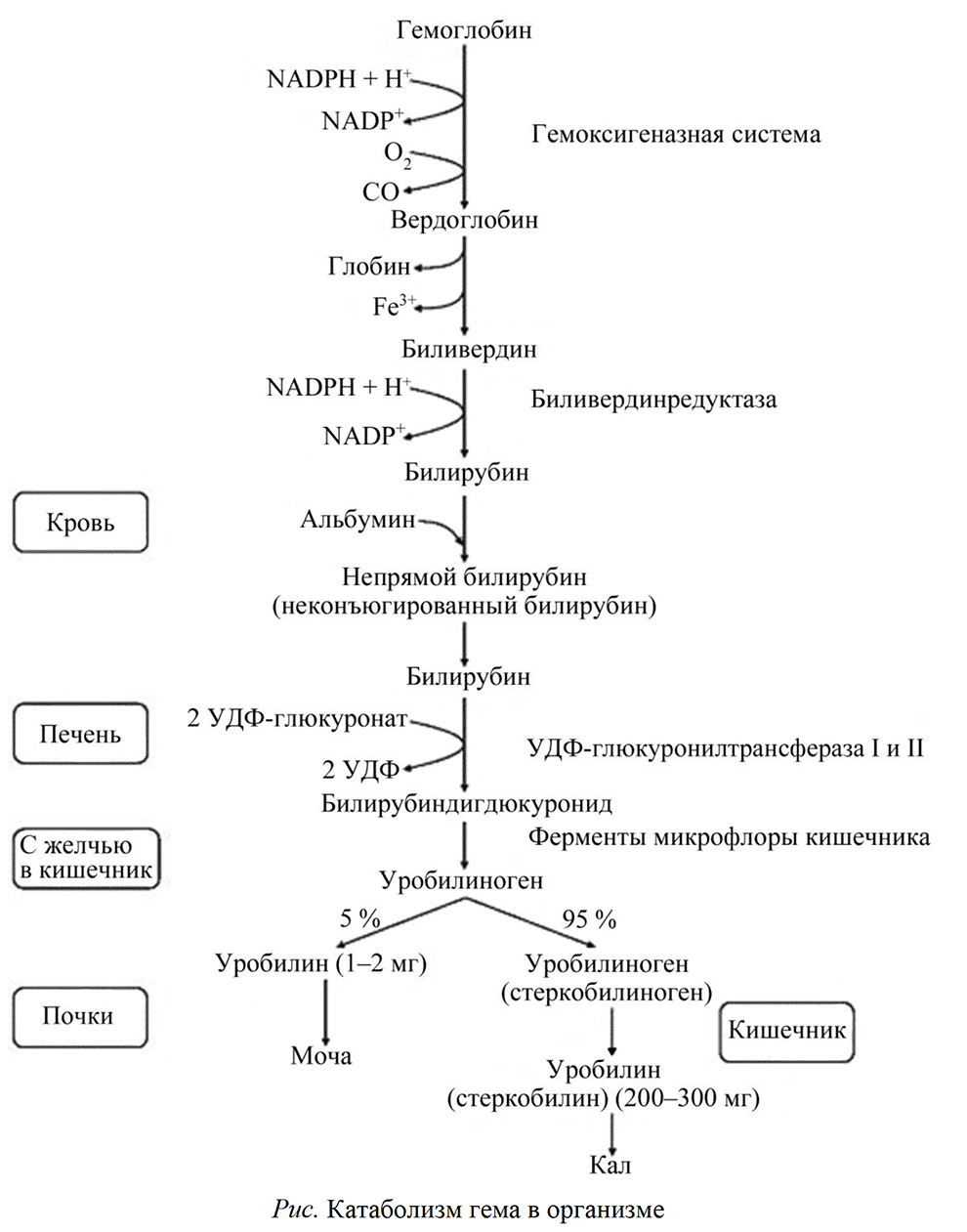
Билирубин поступает в гепатоциты по принципу облегченной диффузии с помощью белков-переносчиков лигандина и протеина Z. В печени он конъюгирует с глюкуроновой кислотой под действием ферментов эндоплазматического ретикулума УДФ-глюкуронилтрансферазы I, катализирующей синтез билирубинмоноглюкуронида и УДФ-глюкуронилтрансферазы II, образующей билирубиндиглюкуронид. В результате реакций конъюгации получается прямой (конъюгированный, или связанный) билирубин.
Синтез УДФ-глюкуронилтрансфераз индуцируют некоторые лекарственные препараты, например фенобарбитал.
По механизму активного транспорта прямой билирубин в составе желчи поступает в двенадцатиперстную кишку. В кишечнике ферментами микрофлоры он гидролизуется с образованием билирубина и глюкуроновой кислоты. Билирубин в результате нескольких реакций восстановления превращается в бесцветные тетрапирролы — уробилиногены. В результате окисления они превращаются в уробилин, который выводится из организма в виде стеркобилина (200-300 мг/сут), являясь пигментом кала. Небольшая часть уробилиногенов всасывается из кишечника и с кровью воротной вены транспортируется в печень, оттуда поступает в кровь, затем в почки и, окисляясь в пигмент желтого цвета уробилин, удаляется с мочой (3-4 мг/сут).
Нормальное содержание билирубина в крови: общий — 5,1-21,5 мкмоль/л; непрямой — 4-16 мкмоль/л (80-85 % от общего); прямой — 1-5 мкмоль/л (15-20 % от общего).
Повышение уровня общего билирубина в крови (гипербилирубинемия) свыше 30 мкмоль/л приводит к связыванию его эластическими волокнами кожи и конъюнктивы, что проявляется желтушным окрашиванием. При полном блоке желчных протоков ежедневно происходит повышение уровня билирубина на 30-40 мкмоль/ч (до уровня 150 мкмоль/л, далее скорость снижается).
Интенсивность желтухи зависит от кровоснабжения органа или ткани. Сначала обнаруживается желтое окрашивание склер, несколько позднее — кожных покровов. Накапливаясь в коже и слизистой, билирубин в сочетании с другими пигментами прокрашивает их в светложелтый цвет с красноватым оттенком. В дальнейшем происходит окисление билирубина в биливердин, и желтуха приобретает зеленоватый оттенок. При длительном существовании желтухи кожные покровы приобретают черновато-бронзовую окраску. Итак, осмотр больного позволяет решить вопрос о длительности желтухи.
Определение и классификация желтух
Желтуха — это клинический синдром, характеризующийся желтушным окрашиванием кожных покровов, слизистых оболочек и склер (в желтый цвет окрашиваются все ткани, экссудаты и транссудаты, не меняют свой цвет только слюна, слезы и желудочный сок), обусловленным повышенным накоплением билирубина в сыворотке крови (гипербилирубинемия), а также других жидкостях и тканях организма.
Выявление желтухи не представляет трудностей, так как это хорошо заметный признак, обращающий на себя внимание не только медицинских работников, но и самого пациента и окружающих его людей. Всегда значительно сложнее выяснить ее причину, потому что желтуха наблюдается при многих заболеваниях, как инфекционных, так и неинфекционных, что требует от врачей проведения дифференциальной диагностики широкого спектра патологий и может приводить к запоздалой постановке диагноза.
У пациентов с анемией и светлой кожей желтуху обнаруживают раньше, в то время как у смуглых больных она дольше остается незамеченной. Осмотр необходимо проводить в хорошо освещенном помещении, лучше при дневном свете.
В зависимости от первичной локализации патологического процесса, приводящего к развитию желтухи, и механизма возникновения выделяют следующие виды желтух: гемолитическая, печеночная, механическая.
Гемолитическая (надпеченочная) желтуха является следствием ускоренного гемолиза эритроцитов при генетических дефектах глюкозо-6-фосфатдегидрогеназы, пируваткиназы или белков плазматической мембраны эритроцитов, отравлении сильными окислителями, переливании несовместимых групп крови. При этом образование непрямого билирубина в крови возрастает в 2-3 раза по сравнению с нормой, так как потенциальная способность гепатоцитов связывать билирубин ограничена. В моче и кале повышено содержание уробилина и стеркобилина соответственно.
Различают следующие типы гемолитической желтухи:
- гемолитическая болезнь новорожденных — проявляется уже при рождении ребенка, с первых часов жизни и может быть обусловлена несовместимостью по резус-фактору, реже по системе АВО или другим группам;
- врожденные гемолитические желтухи: Минковского-Шоффара (микросфероцитарная), обусловленные дефектами эритроцитарных ферментов (например, глюкозо-6-фосфатдегидрогеназы эритроцитов) и др.;
- приобретенные гемолитические анемии: при малярии, рассасывающиеся массивные гематомы, интоксикации, отравления и др.
Повышенный гемолиз независимо от его этиологии всегда приводит к характерной клинической триаде: анемия, желтуха с лимонным оттенком, спленомегалия.
Печеночная (паренхиматозная) желтуха обусловлена поражением гепатоцитов и/или печеночных протоков. По ведущему механизму можно выделить несколько вариантов печеночных желтух. Она может быть связана с нарушением захвата, экскреции и регургитации билирубина. Это наблюдается при остром и хроническом гепатитах (печеночноклеточная желтуха). В других случаях нарушаются только экскреция билирубина и его регургитация. Подобный тип отмечается при холестатическом гепатите, первичном билиарном циррозе печени, идиопатическом доброкачественном возвратном холестазе, печеночно-клеточных поражениях (холестатическая печеночная желтуха). В основе желтух может лежать нарушение конъюгации и захвата билирубина. Это отмечается при энзимопатической желтухе при синдромах Жильбера, Криглера-Найяра. Печеночная желтуха может быть связана с нарушением экскреции билирубина, например при синдромах Дабина-Джонсона и Ротора.
Механическая (подпеченочная) желтуха — осложнение патологических процессов, нарушающих отток желчи на различных уровнях желчевыводящих протоков (опухоли, заболевания желчевыводящих путей, камни, паразитарные заболевания, структурные аномалии печени и желчных протоков). В крови повышается концентрация непрямого и прямого билирубина, который поступает в мочу, придавая ей коричневый цвет. В моче и кале отсутствуют уробилин и стеркобилин, поэтому кал больных ахолический (бесцветный).
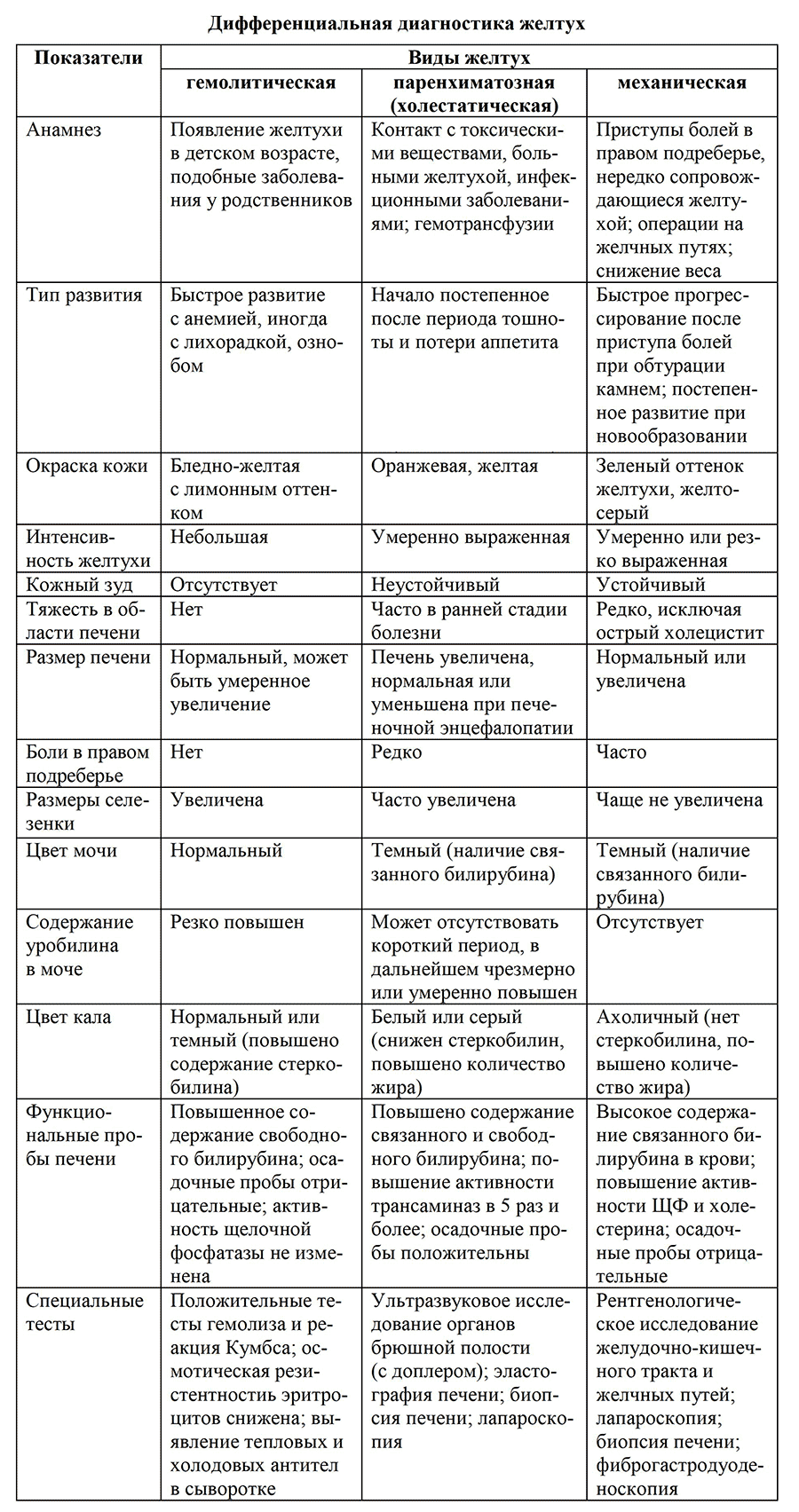
Дифференциальная диагностика желтух
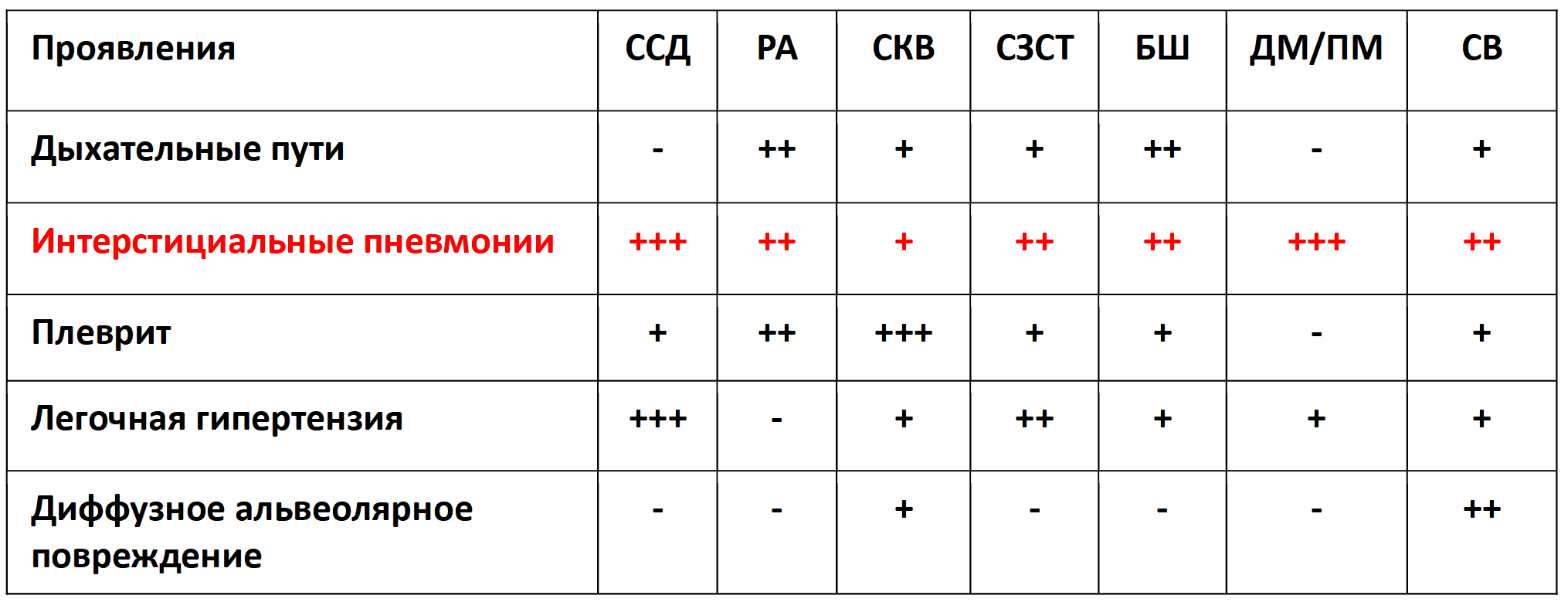
В дифференциации синдрома желтухи ведущая роль отводится анамнезу, эпидемиологической ситуации, наследственности, клинической картине и результатам лабораторно-инструментального обследования (табл.).
Другие клинико-биохимические синдромы при поражении печени
Холестаз — синдром, характеризующийся нарушением или полным прекращением выделения в кишечник компонентов желчи, накоплением их в протоках и попаданием в кровь. Проявляется клинико-биохимическими изменениями, синдромами холемии и ахолии.
Биохимические маркеры холестаза: повышение в крови прямого билирубина, холестерина, а также повышение активности экскреторных ферментов (ЩФ, ГГТП), выявление желчных пигментов в крови.
Раздражение чувствительных нервных окончаний кожи желчными кислотами приводит к кожному зуду. Появление желчных кислот в моче приводит к уменьшению поверхностного натяжения и ее вспениванию.
Ахолия — синдром, обусловленный нарушением поступления желчи в кишечник при обтурации желчевыводящих путей. При этом наблюдается расстройство кишечного пищеварения. Из-за отсутствия в кишечнике желчных кислот не активируется липаза, не эмульгируются жиры, не образуются растворимые комплексы желчных кислот с жирными кислотами, в связи с чем 60-70 % жиров не переваривается, не всасывается и удаляется из организма вместе с калом (стеаторея). Нарушается проникновение ферментов в химус и переваривание белков, что приводит к креаторее. Нарушается всасывание жирорастворимых витаминов (ретинола, токоферола, филлохинона), приводящее к развитию авитаминозов. Без филлохинона (витамин К1) не образуется протромбин, снижается свертывание крови, что обусловливает повышенную кровоточивость. Утрачивается бактерицидное действие желчи, что приводит к дисбактериозу. Отсутствие желчных кислот приводит к нарушению моторики кишечника и появляется запор. Однако нередко в связи с усилением гнилостных и бродильных процессов в кишечнике и снижением бактерицидных свойств желчи появляется диарея. Кал обесцвечен, так как не образуется стеркобилин.
В зависимости от уровня поражения гепатобилиарной системы выделяют заболевания, проявляющиеся внепеченочным и внутрипеченочным холестазом, дифференциальная диагностика между которыми основана на сочетании трех признаков: стойкости ахолии кала, уровня ГГТП крови и ультразвуковой визуализации желчного пузыря натощак.
Внепеченочный холестаз характеризуется постоянным характером ахолии стула, повышением сывороточного уровня фермента ГГТП, а также отсутствием визуализации желчного пузыря при ультразвуковом исследовании натощак. Причинами развития синдрома в детском возрасте может быть: атрезия внепеченочных желчных протоков, киста общего желчного протока, «желчные пробки» и/или камни общего желчевыводящего протока.
Внутрипеченочный холестаз характеризуется непостоянным характером ахолии стула и визуализацией желчного пузыря при ультразвуковом исследовании. При этом сывороточный уровень ГГТП может быть как повышенным, так и в пределах нормы. Причиной развития внутрипеченочного холестаза может быть: семейный внутрипеченочный холестаз; метаболические нарушения (дефицит альфа-1-антитрипсина, галактоземия, фруктоземия, тирозинемия, митохондриальная недостаточность, неонатальный гемохроматоз); инфекционные заболевания (вирусные, бактериальные, вызванные простейшими); эндокринные нарушения; хромосомные нарушения; холестаз, связанный с полным парентеральным питанием, токсическим действием лекарственных препаратов и др. (синдром Алажиля, перинатальный склерозирующий холангит, идиопатический неонатальный гепатит).
Синдром цитолиза связан с повреждением печеночной клетки и повышением проницаемости клеточных мембран. Он может быть обусловлен прямым цитопатическим действием микроорганизма, когда клетка повреждается в процессе его репликации (как, например, при ВГ А), или явиться результатом иммуноопосредованных механизмов (как при ВГ В), при этом происходит дезорганизация структуры клеточных мембран, что ведет к повышению проницаемости как мембран гепатоцитов, так и внутриклеточных органелл. Характеризуется печеночно-клеточной интоксикацией и повышением в сыворотке крови активности АлАТ, АсАТ, ЛДГ.
Мезенхимально-воспалительный синдром (синдром поликлональной гаммапатии) связан с поражением купферовских клеток, скоплением серозного экссудата в пространстве Диссе, пролиферацией лимфоидных клеток по портальным трактам. Проявляется гепато- и/или спленомегалией, неспецифической интоксикацией, тяжестью или болью в правом подреберье. В сыворотке крови регистрируется повышение общего белка, глобулинов, β- и γ-глобулинов, IgA, IgG, IgM, увеличение тимоловой пробы.
Недостаточность белково-синтетической функции печени проявляется геморрагическим синдромом и отечно-асцитическим синдромом. В сыворотке крови определяется снижение общего белка, альбумина, протромбинового комплекса, холестерина, фибриногена А, холинэстеразы.
Желтухи при инфекционных заболеваниях
Вирусные инфекции. Наиболее часто желтуха наблюдается при вирусных гепатитах.
Вирусный гепатит А (ВГ А) — острая циклическая инфекция с преимущественно фекально-оральным механизмом заражения, реализуемым водным, пищевым и контактно-бытовым путями передачи. Возбудитель (вирус гепатита А) — РНК-содержащий энтеровирус 72-го типа. Болезнь чаще встречается в виде вспышек в коллективах. ВГ А свойственно сезонное повышение заболеваемости в летне-осенний период.
Инкубационный период составляет от 2 до 7 недель.
Преджелтушный (продромальный) период составляет от 3 до 7 дней. Наиболее характерными его вариантами течения являются гриппоподобный или смешанный в сочетании с диспепсическими симптомами. В этот период отмечается повышение температуры тела, озноб, головная боль, слабость, снижение аппетита вплоть до анорексии, тошнота, рвота, боли в животе. Пациенты предъявляют жалобы на чувство тяжести в правом подреберье.
Активность аминотрансфераз (АлАТ и АсАТ) в сыворотке крови повышается за 5-7 дней. До появления желтухи моча становится темной (цвета пива), обесцвечивается кал, появляется субиктеричность склер.
Желтушный период длится обычно 7-15 дней. Желтуха нарастает быстро, как правило, достигая максимума в течение недели. С появлением желтухи ряд симптомов преджелтушного периода ослабевает, температура нормализуется, дольше всего сохраняется слабость и снижение аппетита, сохраняется чувство тяжести в правом подреберье и кожный зуд. Размеры печени увеличены, она имеет гладкую поверхность, несколько уплотненную консистенцию.
В периферической крови обнаруживается лейкопения, реже — нормальное количество лейкоцитов, характерен относительный лимфоцитоз, иногда моноцитоз.
Свойственно выявление всех основных синдромов поражения печени: цитолиза, внутрипеченочного холестаза, поликлональной гаммапатии (мезенхимально-воспалительного синдрома) и недостаточности белково-синтетической функции печени (при тяжелых формах заболевания).
Гипербилирубинемия обычно умеренна и непродолжительна (уровень билирубина не превышает 90 мкмоль/л). На 2-й неделе желтухи, как правило, отмечается снижение уровня билирубина с последующей его полной нормализацией. Закономерно повышение активности АлАТ и АсАТ, коэффициент де Ритиса (отношение показателя АсАТ к АлАТ) в 5 и более раз завышен по сравнению с верхней границей нормы.
Показатели цитолиза слабо коррелируют с тяжестью заболевания. Для объективной оценки тяжести течения заболевания следует оценивать как уровень билирубина, особенно его свободной фракции, так и выраженность интоксикации.
Период реконвалесценции характеризуется быстрым исчезновением клинических и биохимических признаков гепатита. Из функциональных печеночных проб быстрее других нормализуется билирубин в сыворотке крови, несколько позднее — показатели АлАТ и АсАТ.
Для раннего выявления инфекции используется определение антигена ВГ А (Ag ВГ А) в фекалиях. Анти-ВГ А IgM появляются в крови еще в периоде инкубации, за 3-5 дней до возникновения первых симптомов, и продолжают циркулировать на всем протяжении клинического периода болезни и позже в течение 4-6 месяцев. Обнаружение анти-ВГ А IgM однозначно свидетельствует об инфицировании вирусом ВГ А и используется для диагностики заболевания и выявления источников инфекции в очагах. Анти-ВГ А класса IgG появляются в крови больных с 3-4-й недели заболевания и свидетельствуют об окончании активного инфекционного процесса, титр их нарастает и достигает максимума через 3-6 месяцев. Анти-ВГ А IgG могут сохраняться длительно (в течение многих лет).
Вирусный гепатит Е (ВГ Е). Механизм передачи — фекально-оральный. Из путей передачи ведущее место принадлежит водному. ВГ Е встречается чаще в виде эпидемий и вспышек, но описана и спорадическая заболеваемость. Наиболее часто инфекция регистрируется в азиатских странах (Туркмения, Афганистан, Индия). Восприимчивость к ВГ Е всеобщая, однако заболевание регистрируется чаще всего в возрастной группе 15-29 лет.
В целом клиническая симптоматика ВГ Е схожа с таковой при ВГ А, но имеет более высокую частоту среднетяжелых и тяжелых форм.
Инкубационный период в среднем составляет около 40 дней (от 2 до 8 недель).
Преджелтушный период. Заболевание начинается постепенно, отмечаются слабость, снижение аппетита, иногда тошнота, рвота в течение нескольких дней, боли в правом подреберье и эпигастральной области, которые могут достигать значительной интенсивности и в ряде случаев являются ведущим симптомом заболевания. Повышение температуры наблюдается редко. После выявления желтухи самочувствие не улучшается. Одним из ведущих симптомов заболевания являются боли в правом подреберье.
Желтушный период. Желтушность кожи нарастает в течение 2-3, иногда 10 дней, достигая значительной интенсивности. Характерна гепатомегалия, а у 25 % больных — спленомегалия. Желтуха сохраняется в течение 1-3 недель, в среднем 14 дней.
Особым симптомом при ВГ Е является гемоглобинурия, указывающая на наличие гемолиза эритроцитов. Гемоглобинурия отмечается у пациентов с тяжелой формой и при развитии печеночной недостаточности. Еще одно грозное осложнение течения болезни — геморрагический синдром, проявляющийся желудочно-кишечным, маточным и другими кровотечениями. ВГ Е наиболее тяжело протекает у беременных женщин и довольно часто заканчивается летальным исходом (15-20 %).
Лабораторными маркерами заболевания являются антитела к вирусу гепатита Е анти-ВГ Е IgM и анти-ВГ Е IgG.
Вирусный гепатит В (ВГ В). Возбудитель — вирус гепатита В (ДНК-содержащий вирус). Основными источниками инфекции при ВГ В являются лица с бессимптомными и/или клинически выраженными острыми и хроническими формами болезни. Основной механизм передачи инфекции — гемоконтактный. Пути передачи: половой, вертикальный и парентеральный.
Инкубационный период: минимальный — 6 недель, максимальный — 6 месяцев, в среднем — 60-120 дней.
Преджелтушный период. Заболевание начинается постепенно. Больные жалуются на снижение аппетита вплоть до анорексии, слабость, тошноту, часто бывает рвота, запоры, сменяющиеся поносами. Нередко беспокоит чувство тяжести, иногда боли в эпигастрии, в правом подреберье. У 20-30 % пациентов наблюдаются артралгии, зуд кожи и различные сыпи. Может иметь место акродерматит и другие внепеченочные проявления: полиартрит, гломерулонефрит, апластическая анемия. К концу продрома может выявляться гепато- и спленомегалия, повышается активность индикаторных ферментов (АлАТ, АсАТ) в сыворотке крови. В периферической крови у большинства пациентов наблюдается лейкопения без существенных изменений в лейкоцитарной формуле.
Желтушный период, как правило, длителен, характеризуется выраженностью и стойкостью клинических симптомов болезни, которые нередко имеют тенденцию к нарастанию. Желтуха достигает своего максимума ко 2-3-й неделе заболевания. Сохраняются жалобы на слабость, анорексию, тошноту, рвоту (выраженность их зависит от тяжести болезни). Размеры печени увеличены, отмечается болезненность ее при пальпации.
В периферической крови в остром периоде обнаруживаются лейкопения, реже — нормальное число лейкоцитов, характерен относительный лимфоцитоз. Иногда обнаруживают плазматическую и моноцитарную реакцию. В остром периоде СОЭ уменьшается до 2-4 мм/ч, в периоде уменьшения желтухи может увеличиваться до 18-24 мм/ч.
Гипербилирубинемия выраженная и стойкая, нередко на 2-3-й неделе желтухи уровень билирубина крови более высок, чем на первой. Наблюдаются все синдромы поражения печени. Нарушение ее белково-синтетической функции является важным показателем тяжести болезни.
Период реконвалесценции более длителен, чем при гепатите А. Наблюдается медленное исчезновение клинико-биохимических симптомов заболевания.
Лабораторные специфические маркеры:
- НВsАg выявляется как при острой, так и хронической инфекции, появляется в позднем инкубационном периоде, свидетельствует о продолжающейся инфекции;
- НВsАg циркулирует в сочетании с НВsАg у пациентов с острым или хроническим ВГ В, свидетельствует об активной репликации вируса. Длительное сохранение при остром ВГ В может являться прогностическим критерием хронизации процесса;
- анти-НВс класса IgM (ранние антитела к сердцевинному антигену ВГ В) определяются у 100 % пациентов с острым ВГ В, у 30-50 % — с хроническим. Данный маркер отражает активность репликации вируса и инфекционного процесса, сохраняется в течение 4-6 месяцев после перенесенной острой инфекции;
- анти-НВс класса IgG появляются у пациентов с острым ВГ В в период ранней реконвалесценции и сохраняются пожизненно, а также обнаруживаются при всех формах ВГ В;
- анти-НВс выявляются либо у пациентов с ВГ В в остром периоде (наряду с НВsАg и анти-НВе IgM), либо в реконвалесценции вместе с анти-HBs и анти-НВс, а также у пациентов с хроническим ВГ В;
- анти-НВс-антитела к поверхностному антигену вируса свидетельствуют о наличии иммунитета, выявляются в период поздней реконвалесценции у пациентов после острого ВГ В (сохраняются пожизненно) или после иммунизации вакциной;
- ДНК вируса свидетельствует о его репликации, выявляется при остром и хроническом процессе.
Вирусный гепатит D (ВГ D). Возбудителем является РНК-содержащий вирус, который нуждается при репликации в хелперной функции вируса гепатита В. ВГ D встречается только у лиц, инфицированных ВГ В, и протекает в виде острой коинфекции или суперинфекции, что увеличивает риск развития тяжелой и фульминантной форм заболевания.
Инкубационный период в случае коинфекции (при одновременном заражении ВГ В и ВГ D) составляет от 40 до 200 дней. Заболевание характеризуется коротким продромальным периодом с выраженной лихорадкой, болями в правом подреберье, мигрирующими болями в крупных суставах и двухволновым течением желтушного периода.
Для желтушного периода характерны: субфебрильная температура, сохраняющиеся боли в правом подреберье, уртикарные высыпания, гепатоспленомегалия, при тяжелом течении — развитие отечно-асцитического и геморрагического синдромов.
Острая коинфекция ВГ В/ВГ D диагностируется при наличии у пациента маркеров активной репликации ВГ В (HBsAg, HBeAg, HBV-DNA, IgM анти-HBc), и BГ D (HDVAg, IgM анти-HDV, HDV-RNA). Причем в первые 2 недели заболевания в крови больных определяются HDVAg и HDV-RNA, с 10-15 дня болезни — IgM анти-HDV, а с 5-9 недели — IgG анти-HDV.
Вирусный гепатит С (ВГ С) — это вирусная инфекция из условной группы трансфузионных гепатитов, характеризующаяся безжелтушным, легким и среднетяжелым течением в острой фазе и частой склонностью к хронизации, развитию циррозов печени и первичных гепатокарцином. Вирус гепатита С — мелкий РНК-содержащий вирус, выделяют несколько его генотипов.
Инкубационный период острого ВГ С составляет от 2 до 24 недель (в среднем 7-9 недель). По клинико-биохимическим признакам заболевание сходно с острым ВГ В, однако протекает более легко и отличается сравнительно быстрым развитием болезни. При этом у 50-80 % инфицированных лиц заболевание хронизируется, из которых у 20 % формируется цирроз печени.
Острый ВГС в подавляющем большинстве случаев (до 95 %) протекает бессимптомно. Манифестные формы занимают малый удельный вес.
Преджелтушный период соответствует таковому при остром ВГ В, отличаясь большим полиморфизмом симптоматики.
Желтушный период имеет легкое или среднетяжелое течение, для него характерно 10-15-кратное увеличение активности аминотрансфераз.
Диагноз острого ВГ С устанавливается при выявлении анти-ВГ С с последующим обнаружением РНК вируса.
Острый герпетический гепатит наблюдается редко и является одним из частых проявлений тяжелой генерализованной герпетической инфекции. Генерализации герпетической инфекции предшествует резкое подавление иммунитета (прием иммунодепрессантов, цитостатиков, длительный прием больших доз кортикостероидов, лучевая терапия, развитие синдрома приобретенного иммунодефицита и др.). Изолированных герпетических гепатитов не бывает, обычно наблюдается поражение и других органов и систем (герпетический энцефалит, пневмония и другие в сочетании с гепатитом). Болезнь протекает тяжело (летальность около 30 %).
Острый цитомегаловирусный гепатит. Врожденная ЦМВ-инфекция сопровождается гипербилирубинемией, которая встречается в 65 % случаев при клинически манифестной инфекции и может быть связана с поражением клеток печени и желчных путей, а также с повышенным гемолизом эритроцитов. ЦМВ-гепатит характеризуется гепатоспленомегалией, синдромом цитолиза с преобладанием активности АсАТ в сочетании с холестазом и затяжной желтухой. Интенсивность желтухи нарастает в течение 2-3 недель и затем медленно снижается на протяжении 2-6 месяцев. Кроме того, врожденная ЦМВ-инфекция характеризуется поражением центральной нервной системы (судороги, гипертензионно-гидроцефальный синдром, кальцинаты в головном мозге), органов слуха (нейросенсорная тугоухость 1-4-й степени) и зрения (хориоретинит, атрофия зрительного нерва), легких и почек. Приобретенная ЦМВ-инфекция у детей достаточно часто протекает в виде мононуклеозоподобного синдрома с поражением печени и повышенным уровнем аминотрансфераз, желтуха наблюдается редко.
Для лабораторного подтверждения ЦМВ-инфекции, особенно у новорожденных, определяют ДНК ЦМВ методом качественной и количественной полимеразной цепной реакции в крови, моче, слюне, спинномозговой жидкости. Широко применяется метод иммуноферментного анализа, который информативен у детей старше года и взрослых.
Желтушная форма инфекционного мононуклеоза вызывается вирусом Эпштейна-Барр. При инфекционном мононуклеозе данной этиологии часто развивается гепатит, который может протекать в желтушной и безжелтушной форме. При остром гепатите имеются все признаки, характерные для вирусных гепатитов, желтуха печеночного генеза, гепатомегалия, повышение активности сывороточных ферментов — АлАТ, АсАТ, ЩФ и др. Главное же отличие заключается в поражении ряда органов и систем, что не характерно для вирусных гепатитов. Клиническая симптоматика при инфекционном мононуклеозе настолько характерна (лихорадка, тонзиллит, генерализованная лимфаденопатия, появление атипичных мононуклеаров в периферической крови), что позволяет исключить это заболевание из желтух иной этиологии.
Для подтверждения диагноза инфекционного мононуклеоза используют серологическую диагностику с антигенами вируса Эпштейна-Барр для обнаружения антител класса IgM, абсолютным подтверждением служит выявление ДНК вируса методом полимеразной цепной реакции.
Аденовирусный гепатит с синдромом желтухи встречается чаще у детей 2-3 лет, у старших — в безжелтушной форме. Наряду с гепатолиенальным синдромом, который встречается у 1/3 детей, протекает с наличием катарального синдрома (кашель, насморк с выраженным экссудативным компонентом) и развитием конъюнктивита. Боли в животе отсутствуют, цвет мочи почти не изменяется. Показатели билирубина, аминотрансфераз, тимоловой пробы в сыворотке крови изменяются незначительно. Заболевание может иметь волнообразное течение.
Бактериальные инфекции. Синдром желтухи имеет место и при бактериальных инфекциях. Отличием от вирусных гепатитов являются резко выраженный инфекционный синдром, лихорадка с ознобами, поражение различных органов и систем, лейкоцитоз со сдвигом влево и увеличенная СОЭ в периферической крови, положительные результаты бактериологического исследования крови (гемокультура).
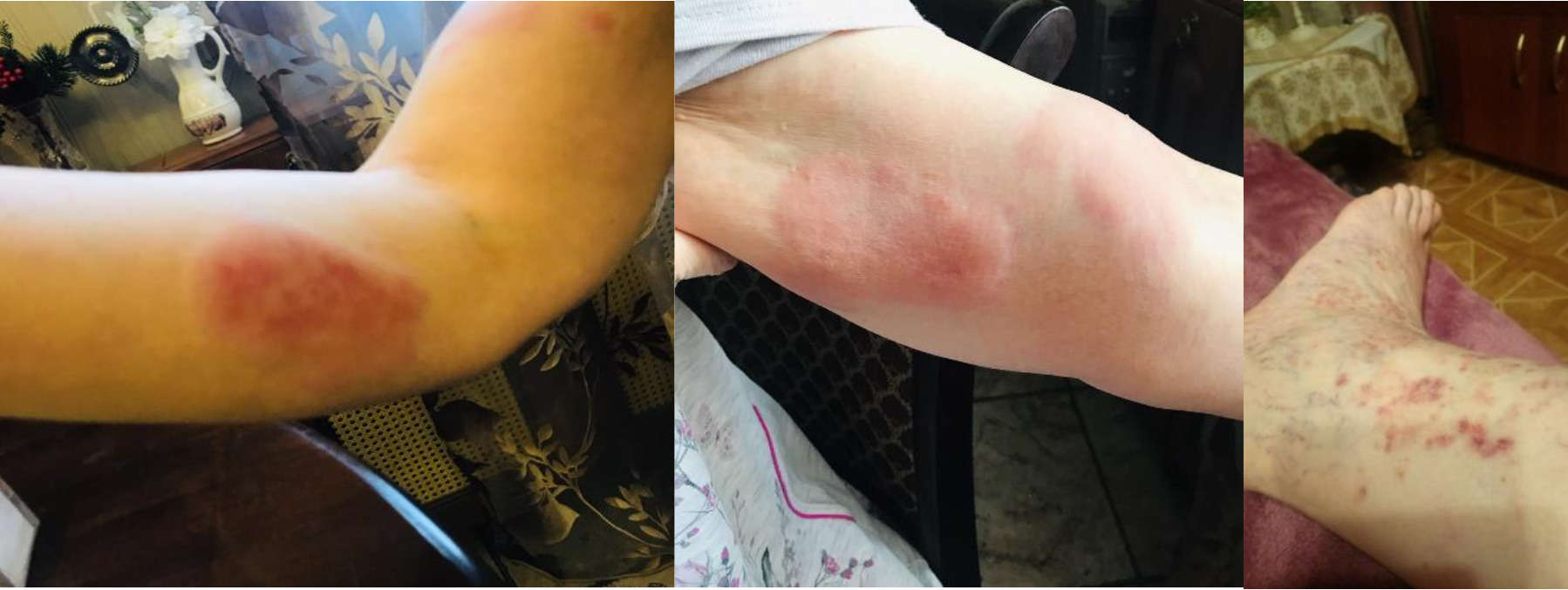
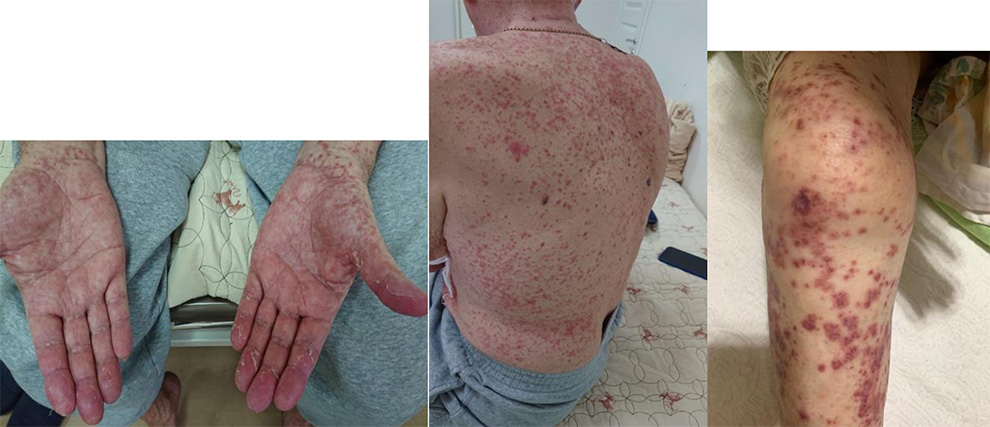
При среднетяжелой и тяжелой формах иерсиниоза (желтушные формы псевдотуберкулеза и кишечного иерсиниоза) желтуха мало отличается от других желтух инфекционной природы. Важными дополнительными диагностическими признаками являются «скарлатиноподобная» экзантема на коже туловища или экзантема по типу «перчаток», «носков», «капюшона», мезаденит и терминальный илеит, высокая лихорадка с большими суточными размахами.
Для лабораторного подтверждения диагноза используют выделение возбудителей из испражнений, мочи, крови и серологические методы (реакция агглютинации, реакция непрямой гемагглютинации), хотя эти методы лабораторной диагностики являются ретроспективными.
При сальмонеллезе желтуха может наблюдаться при генерализованных формах болезни. Как и при других бактериальных желтухах, наблюдаются высокая лихорадка (39-40 °С), гепатоспленомегалия, а также биохимические проявления печеночной желтухи (повышение содержания билирубина, активности АлАТ). Сальмонеллез подтверждается выделением сальмонелл из испражнений, содержимого желудка, пищевых продуктов, крови. Серологические исследования при сальмонеллезе малоинформативны.
Желтушный лептоспироз — инфекционное заболевание, вызываемое лептоспирами. Человек заражается через кожу, контактируя с водой, загрязненной выделениями животных, в которых содержится возбудитель. Лептоспирозом можно заболеть и при контакте с влажной почвой, при разделке мяса, а также при употреблении в пищу сырую воду, инфицированные продукты (молоко, мясо). Лептоспироз поражает печень, почки, головной мозг, приводит к выраженной интоксикации, может вызывать нарушения свертываемости крови и кровотечения. Степень поражения печени может варьироваться от незначительной (клинически практически незаметной) до печеночной недостаточности. Самым явным симптомом поражения печени является желтуха. Приблизительно на 4-6-й день от начала заболевания (в тяжелых случаях — на 2-е-3-и сутки) желтеют склеры, а потом желтый оттенок приобретает и кожа. Желтуха может держаться от одной до нескольких недель, связана она как с непосредственным поражением клеток печени, так и с повышенным распадом эритроцитов. В крови повышается содержание билирубина, моча становится темной, слегка обесцвечивается кал, печень увеличивается в размерах, становится болезненной при ощупывании в области правого подреберья. Наряду с увеличением печени возможно увеличение и селезенки. Может появиться незначительный зуд кожи. В целом тяжесть течения лептоспироза соответствует выраженности желтухи: чем ярче желтуха, тем неблагоприятнее протекает заболевание. Гипербилирубинемия может достигать до 200 мкмоль/л. В это же время у пациентов часто наблюдается полиморфная экзантема, которая может носить скарлатиноподобный, краснушный, кореподобный характер и располагаться на туловище и конечностях; нередко развивается геморрагический синдром. При распознавании заболевания важно учитывать эпидемиологические данные (профессия, сезонность, контакт с грызунами). Для диагностики используют результаты бактериологического исследования.
Сепсис. Характеризуется наличием первичного очага, проникновением возбудителей в кровь, формированием вторичных очагов. В клинической картине сепсиса частым компонентом является септическое (токсическое) поражение печени. Желтуха, как правило, умеренная и не соответствует резко выраженной тяжести инфекционного процесса. Активность АлАТ ниже, чем при острых гепатитах вирусной природы, и превышает верхнюю границу нормы в 2-3 раза. Подтверждением сепсиса может быть повторное выделение одного и того же микроорганизма из крови и очагов поражения.
Паразитарные инфекции. Для амебиаза характерны территории эндемического распространения. Желтуха при амебиазе может быть следствием амебного гепатита (в остром периоде болезни) или проявлением амебного абсцесса печени (период поздних внекишечных осложнений). Диагностическое значение имеют следующие данные: наличие в течение последних месяцев затяжного кишечного заболевания, возможно, с примесью слизи и крови в испражнениях, боли в области печени постоянного характера, которые усиливаются при пальпации, неравномерность увеличения печени, изменение ее эхогенности при ультразвуковом исследовании, выявление амеб при паразитоскопии «свежих» испражнений.
Лямблиоз — протозойная инвазия, протекающая преимущественно с поражением тонкой кишки (кишечная форма), реже — гепатобилиарной системы (гепатобилиарная форма) и сопровождающаяся у части пациентов аллергическими и неврологическими симптомами. Желтуха встречается при билиарной форме лямблиоза. В большинстве случаев наблюдаются приступы легкой, скоропроходящей желтухи, являющейся результатом задержки желчи или развивающегося вторично холангита. Желтуха застойного или же застойно-паренхиматозного характера, печень увеличена. Кроме того, у пациента отмечаются периодические боли и тяжесть в правом подреберье, субфебрильная температура, часто экзантема по типу крапивницы.
Сходная клиническая картина наблюдается и при фасциолезе (инвазия из группы трематодозов с преимущественным поражением печени и желчевыводящей системы), при котором желтуха появляется как результат закупорки желчных путей или вторичного их инфицирования (возникает картина бактериального холецистохолангита или холангиоге - патита с болевым и диспепсическим синдромами, нарушением функций печени). Инвазия начинается остро с общих симптомов: подъема температуры, слабости, головной боли, недомогания. На этом фоне появляются желтуха, кожный зуд, высыпания на коже, крапивница, боли в животе, тошнота, рвота, гепатоспленомегалия, что сопровождается высокой эозинофилией (до 80-85 %), лейкоцитозом и нередко анемией. При пальпации печень увеличена, плотна, болезненна. При интенсивной и длительной инвазии возможны цирротические изменения в печени.
Желтуху механического происхождения вследствие сдавливания желчных путей можно наблюдать при эхинококкозе печени. Данный паразитоз имеет повсеместное распространение в мире и представляет собой хроническое паразитарное заболевание, поражающее животных и человека, вызываемое цепнем Echinococcus granulosis (эхинококк), характеризующееся поражением внутренних органов, чаще печени и легких, с образованием эхинококковых кист и развитием серьезных нарушений функций пораженных органов.
Поражение печени занимает более 60 % всех случаев эхинококкоза. Развитие инфекции условно можно разделить на несколько этапов.
Первый этап в подавляющем большинстве случаев проходит незаметно. Происходит внедрение паразитов в ткань печени с постепенным формированием защитной капсулы. В некоторых случаях пациенты могут чувствовать тяжесть в правом подреберье после обильного приема жирной пищи.
Второй этап наряду с проявлением общей симптоматики, описанной выше, характеризуется появлением симптомов поражения печени. Пациенты теряют аппетит, постепенно снижается вес, появляются тошнота или рвота, тяжесть в правом подреберье и боль в верхней части живота со смещением ее в правое подреберье после приема пищи или после повышенной физической нагрузки, отмечается расстройство стула в виде периодически появляющейся. При обследовании пациента можно обнаружить значительное увеличение, болезненность и плотность печени.
Третий этап характеризуется появлением осложнений, связанных с разрывом эхинококковой кисты и распространением яиц гельминтов по всему организму. Наиболее часто встречающимися осложнениями могут быть: нагноение кисты; разрыв кисты; сдавление большой кистой окружающих тканей, в том числе внутрипеченочных желчных протоков (с развитием механической или обтурационной желтухи). При этом пациент весь желтый с зеленоватым оттенком, постоянно ощущает зуд кожных покровов, и моча становится цвета крепкого чая или пива.
Желтуху механического происхождения можно встретить при аскаридозе при проникновении аскарид в желчные пути. Характерным в этом случае является наличие желтухи с приступообразными болями, болезненностью в области печени и увеличением печени. Хотя и очень редко, при аскаридозе может наблюдаться желтуха как проявление хронического гепатита, вызванного многократными и массивными инвазиями при миграции личинок сквозь печень.
Диагностированию желтух, вызванных кишечными паразитами, помогают некоторые дополнительные исследования: наличие эозинофилии в гемограмме, выявление паразитов или их яиц в кале или в дуоденальном соке, серологические исследования, кожные пробы, ультразвуковое исследование.