Синусовая тахикардия аномальная. Клиническая аритмология. Лекция для врачей
Лекция для врачей "Синусовая тахикардия аномальная. Клиническая аритмология" (отрывок из книги "Клиническая аритмология и электрофизиология" - Исса З. Ф.)
Анатомия и физиология синусового узла
Синусовый узел представляет собой субэпикардиальную структуру, имеющую форму «полумесяца» или «головастика», расположенную латерально в пределах эпикардиальной бороздки пограничной борозды правого предсердия (ПП) на стыке трабекулярного ушка ПП спереди и гладкостенного устья верхней полой вены сзади. Эндокардиальная сторона пограничной борозды отмечена пограничным гребнем crista terminalis. Начинаясь эпикардиально на стыке верхней полой вены и ушка ПП, синусовый узел идет вниз и влево вдоль пограничной борозды, заканчиваясь субэндокардиально почти у нижней полой вены. У взрослых синусовый узел имеет длину от 8 до 22 мм, ширину и толщину от 2 до 3 мм. Правый диафрагмальный нерв часто проходит в непосредственной близости от синусового узла, где он лежит на фиброзном перикарде, непосредственно перекрывающем латеральный и переднелатеральный квадранты соединения верхней полой вены и ПП (см. рис. 8.1).
Синусовый узел обычно является главным водителем ритма. Его пейсмейкерная функция определяется низким максимальным диастолическим мембранным потенциалом и крутой фазой 4 спонтанной деполяризации. Важно отметить, что пейсмейкерная активность не ограничивается одной клеткой синусового узла; скорее, клетки синусового узла функционируют как электрически связанные генераторы, которые разряжаются синхронно из-за взаимного возбуждения. Существующие на сегодняшний день данные свидетельствуют об «иерархии пейсмейкеров» внутри синусового узла. С более высокой частотой синусовый импульс возникает в верхней части (голова) синусового узла, тогда как импульс с более медленной частотой возникает в нижней части (по направлению к хвосту). Иерархия определяет изменение частоты сокращений сердца (в ответ на физиологические стимулы) через динамический краниокаудальный сдвиг места «ведущего пейсмейкера».
Примечательно, что синусовый узел функционально изолирован от окружающих кардиомиоцитов предсердий, за исключением ограниченного числа различных проводящих путей (участков выхода), которые позволяют передавать синусовые импульсы в миокард предсердий, вероятно, ответственных за различные вариации морфологии и полярности зубца Р, обычно наблюдаемые при разной частоте синусового ритма. Нервные и гормональные факторы влияют как на место активации водителя ритма, вероятно, через смещение точек начальной активности, так и на места выхода из структуры синусового узла.
Патофизиология
Синусовая тахикардия представляет собой физиологический ответ на активацию симпатической нервной системы и/или снижение активности парасимпатических влияний. Аномальная синусовая тахикардия — это непароксизмальная тахиаритмия, характеризующаяся стойким увеличением частоты синусового ритма в состоянии покоя, не связанным с уровнем физического, эмоционального, патологического или фармакологического стресса или несоответствующая им, либо ненормальным увеличением частоты сердечных сокращений (ЧСС) в ответ на минимальную нагрузку или изменение положения тела. Аномальная синусовая тахикардия не является ни реакцией на патологический процесс (например, сердечную недостаточность, гипертиреоз или воздействие лекарств), ни результатом ухудшения физического состояния. Решающее значение для этого определения имеет наличие сопутствующих симптомов.
Механизмы, лежащие в основе аномальной синусовой тахикардии, плохо изучены и остаются спорными. Возможные механизмы включают усиленный автоматизм, нарушение вегетативной реактивности синусового узла, изменение внутренней регуляции синусового узла и симпатовагусный дисбаланс с чрезмерным повышением симпатической активности и/или сниженным влиянием блуждающего нерва на синусовый узел. Было высказано предположение о первичном нарушении функции синусового узла, о чем свидетельствует более высокая собственная ЧСС (после блокады мускариновых и бета-адренорецепторов), по сравнению с контролем, или притупленный ответ на аденозин с меньшим удлинением длительности цикла синусового ритма, чем в контрольной группе (с вегетативной блокадой и без нее). Кроме того, в качестве возможных причин аномальной синусовой тахикардии рассматриваются гиперчувствительность бета-адренорецепторов, пониженная чувствительность а-адренорецепторов и М2-мускариновых рецепторов, дисрегуляция ствола головного мозга, угнетение эфферентного кардиовагального рефлекса, центральные и периферические ноцицептивные эффекты, стимуляция гипоталамо-паравентрикулярного ядра, а также нарушение чувствительности барорефлекса. В некоторых случаях причинами аномальной синусовой тахикардии могут быть хроническая стимуляция бета-рецепторов аутоантителами и вегетативный неврит или автономная нейропатия. Степень, в которой каждый из этих механизмов способствует развитию тахикардии и связанных с ней симптомов, неизвестна, но лежащие в основе механизмы, вероятно, многофакторны и сложны.
В последнее время развитие аномальной синусовой тахикардии связывают с каналопатией клеток синусового узла. В когорте пациентов с аномальной синусовой тахикардией была идентифицирована мутация гена HCN4 (который кодирует белок, участвующий в формировании каналов If), ассоциирующаяся с увеличением его активности. Мутации HCN могут быть связаны с аномальной синусовой тахикардией в связи с повышенной чувствительностью к циклической аденозинмонофосфат-зависимой активации.
У некоторых пациентов аномальная синусовая тахикардия может сочетаться с такими расстройствами как синдром хронической усталости и нейрокардиальными обмороками, у некоторых может наблюдаться психологический компонент гиперчувствительности к соматическому воздействию. У части пациентов аномальная синусовая тахикардия сочетается с такими лабораторными показателями и клиническими признаками как гиперадренергический синдром, идиопатическая гиповолемия, ортостатическая гипотензия и пролапс митрального клапана. Возможно, возникновение аномальной синусовой тахикардии является результатом ряда несвязанных расстройств (подобно тому, как желудочковая тахикардия является проявлением многих не связанных между собой причин).
Эпидемиология и течение заболевания
Подавляющее большинство пациентов с аномальной синусовой тахикардией — молодые женщины (средний возраст 38 ± 12 лет), хотя она также встречается и среди пожилых людей. Аномальная синусовая тахикардия по неизвестным причинам в непропорционально большом количестве поражает людей, работающих в сфере здравоохранения. Распространенность аномальной синусовой тахикардии (симптоматической или бессимптомной) в популяции людей среднего возраста оказалась выше, чем предполагалось ранее (до 1,2% по результатам одного из исследований).
Несмотря на хронический характер течения заболевания и длительные симптомы, естественное течение и прогноз в целом благоприятны. Аномальная синусовая тахикардия редко ассоциируется с тахикардиомиопатией, возможно, из-за часто наблюдаемого ночного замедления сердечного ритма.
Клиническая картина
Клинические проявления аритмии очень вариабельны: от полного отсутствия симптомов, обнаруживаясь при обычном медицинском осмотре, до пациентов с короткими пароксизмальными эпизодами сердцебиения и лиц с хроническими, непрекращающимися симптомами, приводящими к потере трудоспособности. Наиболее заметными симптомами являются учащенное сердцебиение, усталость и снижение переносимости физических нагрузок. Также аномальная синусовая тахикардия может ассоциироваться с множеством других симптомов, таких как дискомфорт в груди, одышка, ортостатическая непереносимость, головокружение, дурнота, предобморочные состояния и обмороки. Симптомы могут возникать внезапно или прогрессировать незаметно, но обычно сохраняются в течение месяцев или лет. Важно отметить, что симптомы могут не всегда коррелировать с периодами тахикардии или могут быть несоразмерны тяжести тахикардии. На самом деле, успешное лечение тахикардии может не привести к улучшению симптомов. Нередкими бывают сопутствующие психические расстройства, но их связь с аномальной синусовой тахикардией неясна.
Обследование
Аномальная синусовая тахикардия — это клинический синдром, не имеющий четкого определения, с разнообразными клиническими проявлениями. Не существует «золотого стандарта» для постановки окончательного диагноза аномальной синусовой тахикардии, и диагноз устанавливается после исключения других причин симптоматической тахикардии. Клиническое обследование с использованием рутинных методов позволяет исключить причины вторичного развития тахикардии, но, как правило, не помогает в постановке диагноза аномальной синусовой тахикардии.
Тщательный сбор анамнеза и физикальное обследование необходимы для исключения конкретных физиологических, психологических и патологических причин синусовой тахикардии (список 16.1). Необходимо измерить артериальное давление и ЧСС в положении лежа на спине, сидя, сразу после принятия вертикального положения и затем через 2 и 5 мин. В зависимости от клинического контекста дополнительное обследование может включать эхокардиографию, общий анализ крови, исследование функции щитовидной железы, определение уровня глюкозы в крови натощак, метанефринов в моче и суточной экскреции натрия с мочой. Также должна быть рассмотрена необходимость обследования на предмет злоупотребления наркотиками (скрининговый анализ мочи и крови на содержание наркотических веществ) и психических заболеваний.
Список 16.1 Причины аномальной синусовой тахикардии

Список 16.2 Признаки аномальной синусовой тахикардии

Синдром аномальной синусовой тахикардии характеризуется следующими признаками: (1) относительным или абсолютным увеличением ЧСС, непропорционально физиологической потребности (ЧСС в дневное время в состоянии покоя более 100 уд/мин при среднесуточной ЧСС более 90-95 уд/мин по данным 24-часового холтеровского мониторирования или чрезмерное учащение сердечного ритма в ответ на минимальное физическое или эмоциональное напряжение); (2) электрическая ось и морфология зубца Р во время тахикардии аналогичны тем, которые наблюдаются во время нормального синусового ритма; (3) отсутствие вторичных причин синусовой тахикардии; и (4) выраженные симптомы, включающие сердцебиение, утомляемость, одышку и беспокойство во время тахикардии и отсутствие этих симптомов при нормальной частоте синусового ритма (список 16.2).
Холтеровское мониторирование
Данные амбулаторного холтеровского мониторирования обычно демонстрируют среднюю ЧСС от 90 до 95 уд/мин (рис. 16.1). Однако у некоторых пациентов в состоянии покоя наблюдается физиологическая или нормальная ЧСС (менее 85 уд/мин) с усиленным (аномальным) учащением пульса в ответ на минимальную физиологическую нагрузку или умеренно повышенная ЧСС в состоянии покоя (более 85 уд/мин) с усиленным (аномальным) учащением сердечного ритма в ответ на минимальную нагрузку. Важно отметить, что количественное определение «аномальности» ЧСС произвольно, в связи с чем оценка воспроизводимости корреляции ЧСС и физической активности может быть сложной задачей.
Пробы с физической нагрузкой
ЭКГ с физической нагрузкой обычно показывает раннее и чрезмерное увеличение ЧСС в ответ на минимальную нагрузку (ЧСС более 130 уд/мин в течение 90 сек после нагрузки; протокол Брюса) с быстрым достижением максимальной ЧСС. Эта реакция отличается от ухудшения физического состояния хроническим течением и наличием сопутствующих симптомов.
Провокация изопротеренолом
Провокация изопротеренолом помогает продемонстрировать гиперчувствительность синусового узла к бета-адренергической стимуляции. Изопротеренол вводят внутривенно болюсно с интервалом в 1 мин, начиная с дозы 0,25 мкг, удваивая дозу каждую минуту до тех пор, пока не будет достигнуто либо увеличение ЧСС на 35 уд/мин выше исходного уровня, либо максимальная ЧСС, составляющая 150 уд/мин. У пациентов с аномальной синусовой тахикардией целевая ЧСС достигается при дозе изопротеренола 0,29 ± 0,1 мкг (против 1,27 ± 0,4 мкг в контрольной группе).
Оценка вегетативной нервной системы
Оценка вегетативных сердечно-сосудистых рефлексов может включать оценку собственной ЧСС, изменения ЧСС при глубоком дыхании, перемене положения тела из горизонтального в вертикальное и маневре Вальсальвы, чувствительности барорефлекса, кардио-вагального ответа (теста с погружением лица в холодную воду), а также реакции артериального давления в положении стоя и при устойчивом хвате (пациент в положении полулежа в течение 5 мин осуществляет хват руками, поддерживая изометрическое сокращение мышц верхних конечностей на уровне примерно 30% от максимального. — Прим. науч. ред. перев.). Часто аномальная синусовая тахикардия ассоциируется с выраженным нарушением чувствительности барорефлекса (показателя рефлекторной активности блуждающего нерва) в состоянии покоя и во время ортостатического стресса, что свидетельствует о нарушении функции эфферентного парасимпатического пути. Пациенты с аномальной синусовой тахикардией менее восприимчивы к тесту с погружением лица в холодную воду (модификация рефлекса ныряния), демонстрируя неспособность к существенному снижению ЧСС. Однако клиническая ценность таких тестов сомнительна, и поэтому их рутинное использование не рекомендуется.
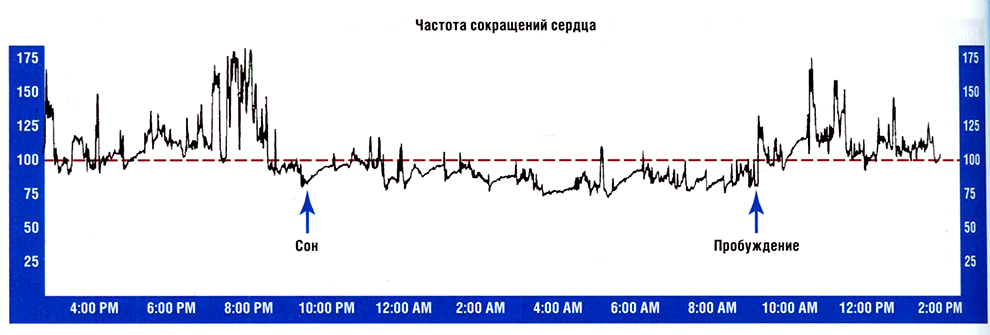
Рис. 16.1 Тренд частоты сердечных сокращений (ЧСС) при 24-часовом мониторировании электрокардиограммы, демонстрирующий аномальную синусовую тахикардию при повседневной активности и при пробуждении.
Электрофизиологическое исследование
Проведение инвазивного электрофизиологического исследования (ЭФИ) может быть рассмотрено при подозрении на другие аритмии или принятии решения о катетерной аблации. Важно понимать, что решение о модификации синусового узла для лечения аномальной синусовой тахикардии принимается на основе клинических данных, и оно должно быть принято до начала проведения самого ЭФИ. Диагноз аномальной синусовой тахикардии и подходы к ее лечению должны быть определены до того, как пациент будет доставлен в электрофизиологическую лабораторию.
Дифференциальная диагностика
Синдром постуральной ортостатической тахикардии
Синдром постуральной ортостатической тахикардии (СПОТ) — это мультисистемное расстройство вегетативной нервной системы, связанное с аномальной реакцией на вертикальное положение тела. СПОТ характеризуется наличием симптомов ортостатической непереносимости (т.е. появлением симптомов в положении стоя, облегчающихся в положении лежа), связанных с чрезмерным увеличением ЧСС (на 30 уд/мин или более от исходного уровня, или более 120 уд/мин) при переходе из горизонтального в вертикальное положение продолжительностью более 30 сек при отсутствии ортостатической гипотензии (определяется как падение систолического артериального давления более чем на 20 мм рт. ст.). Для подростков (от 12 до 19 лет) необходимый прирост ЧСС для установления СПОТ составляет не менее 40 уд/мин.
Обычно СПОТ проявляется симптомами гипоперфузии головного мозга (например, головокружениями, предобмо-рочными состояниями, нарушениями зрения, когнитивными нарушениями, помрачением сознания) и симпатической гиперактивностью (например, сердцебиением, болью в груди, тревогой, тремором), что может привести к существенному ограничению жизнедеятельности. Лишь небольшая часть пациентов с СПОТ сообщают о явных обмороках. Важно отметить, что до постановки диагноза СПОТ должны быть исключены хронические изнурительные состояния (например, продолжительный постельный режим), прием лекарств, снижающих сосудистый или вегетативный тонус, а также расстройства, способные вызывать тахикардию (например, обезвоживание, анемия).
Патофизиологические механизмы ортостатической непереносимости при СПОТ гетерогенны и включают нарушение регуляции периферического сосудистого сопротивления, гиперадренергические реакции, хроническую гиповолемию и ухудшение физического состояния. Пациенты с СПОТ часто имеют высокий уровень норадреналина в плазме, также часто наблюдается низкий объем циркулирующей крови.
СПОТ в зависимости от механизма развития подразделяется на несколько подтипов, включая нейропатический и гиперадренергический. Нейропатический СПОТ, вероятно, вызван частичной первичной дизавтономией (вегетативная дисфункция), возможно, связанной с аутоиммунным процессом, или периферической вегетативной денервацией, возникшей вторично по отношению к другим заболеваниям (например, диабету, рассеянному склерозу, амилоидозу, саркоидозу, системной волчанке, алкоголизму, химиотерапии). При этой форме нарушается периферическая вазоконстрикция в ответ на ортостатический стресс вследствие периферической вегетативной нейропатии, что приводит к скоплению крови в периферических венах нижних конечностей и мезентериальной сосудистой сети и, как следствие, состоянию «функциональной» гиповолемии (уменьшению центрального кровотока) и церебральной гипоперфузии. Это, в свою очередь, запускает симпатический рефлекс, вызывая компенсаторное увеличение как ЧСС, так и сократимости миокарда. Гиперадренергический СПОТ связан с чрезмерной симпатической активностью, которая может быть первичной (например, недостаточность транспортера обратного захвата норадреналина, вследствие генетических мутаций) или вторичной (вызванной гиповолемией или лекарствами). Большинство пациентов с гиперадренергическим СПОТ демонстрируют повышенный ответ на инфузию изопротеренола и чрезвычайно высокие уровни норадреналина в плазме (более 600 нг/мл) в вертикальном положении.
Аномальная синусовая тахикардия имеет несколько общих характеристик с СПОТ. И при аномальной синусовой тахикардии, и при СПОТ, по-видимому, имеется аномальная вегетативная модуляция, связанная с преувеличенной реакцией синусового ритма на ортостатический стресс и множеством сердечных и некардиальных симптомов, которые могут быть изнурительными. Кроме того, оба синдрома встречаются преимущественно у молодых женщин. Тем не менее, между этими двумя состояниями существуют важные различия (табл. 16.1). Очень важно дифференцировать аномальную синусовую тахикардию и СПОТ, поскольку лечение аномальной синусовой тахикардии (включая катетерную аблацию синусового узла) редко улучшает, и может даже ухудшать симптомы у пациентов с СПОТ. С другой стороны, лечение СПОТ может быть бесполезным при аномальной синусовой тахикардии. Если в положении ортостаза все клинические показатели остаются в норме, но все же сохраняется подозрение на СПОТ, может тилт-теста, поскольку он позволяет проводить оценку жизненно важных показателей в течение более продолжительных периодов, чем простой ортостатический тест.
ТАБЛИЦА 16.1 Сравнение аномальной синусовой тахикардии и синдрома постуральной ортостатической тахикардии

Наджелудочковые тахикардии
Наджелудочковые тахикардии (НЖТ), особенно синоатриальная реципрокная тахикардия или эктопические ПТ, возникающие вблизи синусового узла, потенциально могут имитировать аномальную синусовую тахикардию. Кроме того, аномальная синусовая тахикардия наблюдается после проведения катетерной аблации НЖТ, в частности после аблации в области треугольника Коха (медленные и быстрые пути АВ-узла или АВ ДПП), что, как предполагается, является результатом развития вегетативной дисфункции после аблации вследствие потери парасимпатической регуляции. Поэтому, чтобы уточнить причину сердцебиения после проведения катетерной аблации (аномальная синусовая тахикардия или рецидивирующая НЖТ), необходимо внимательно оценить состояние пациента. К счастью, постаблационная форма расстройства имеет тенденцию быть преходящей, с исчезновением симптомов у большинства пациентов в течение 3-4 мес после вмешательства.
НЖТ обычно проявляется пароксизмальными эпизодами тахикардии, характеризующимися внезапным началом и завершением. Также может наблюдаться феномен разогрева и охлаждения в течение нескольких ударов, особенно при автоматической предсердной тахикардии (ПТ). Напротив, аномальная синусовая тахикардия не является пароксизмальной и характеризуется плавным увеличением и уменьшением ЧСС с изменениями вегетативного тонуса или в начале и в конце тахикардии, соответственно.
Аденозин и вагусные маневры либо не имеют эффекта, либо приводят к резкому прекращению НЖТ, в отличие от постепенного замедления ЧСС при аномальной синусовой тахикардии. Однако автоматические ПТ могут реагировать на эти вмешательства временным замедлением частоты ритма с последующим постепенным ее возобновлением.
Диагностическую проблему может представлять непрекращающаяся ПТ. Эти ПТ могут поддерживаться часами или днями, а частота пульса при тахикардии может варьироваться в зависимости от уровня вегетативного тонуса. Тем не менее, частота ПТ обычно остается высокой даже во время ночного сна. Аномальная синусовая тахикардия, напротив, демонстрирует более выраженную изменчивость частоты ритма в течение суток. Кроме того, непрекращающиеся ПТ обычно возникают из очагов, расположенных далеко от синусового узла (чаще всего они исходят из ушек предсердий и легочных вен); поэтому зубец Р при тахикардии обычно имеет морфологию, заметно отличающуюся от синусового зубца Р, что облегчает диагностику. Кроме того, хотя при НЖТ могут наблюдаться как длинные, так и короткие интервалы RP, аномальная синусовая тахикардия неизменно ассоциируется с длинными интервалами RP (т.е. интервал RP длиннее, чем интервал PR). При подозрении на НЖТ может быть рассмотрено проведение ЭФИ.
Принципы лечения
Консервативное лечение, базирующееся на мультидисциплинарном подходе — основа терапии пациентов с аномальной синусовой тахикардией. Забота и внимание, эффективное общение и обучение пациентов являются фундаментальными аспектами терапии. Также важно с пониманием относиться к жалобам пациентов, избегать пренебрежительного отношения и недооценки влияния аномальной синусовой тахикардии на качество жизни пациента.
Пациентам, вероятно, полезно понимание базовой патофизиологии, течения заболевания и прогноза при аномальной синусовой тахикардии. Кроме того, пациенты должны быть проинформированы об ожидаемом результате и потенциальных побочных эффектах различных доступных в настоящее время методов лечения. Пациентов следует поощрять и давать им возможность участвовать в процессе принятия решений.
Полезны изменение образа жизни, в том числе отказ от стимуляторов (наркотиков, алкоголя и кофеина) и соблюдение постоянного режима сна. Физические упражнения, особенно в сочетании с терапией фадреноблокаторами, потенциально могут улучшить качество жизни, хотя польза от них остается недоказанной.
Фармакологическая терапия
Лечение аномальной синусовой тахикардии в настоящее время обычно паллиативно и направлено на контроль симптомов. Цель большинства лечебных стратегий — снижение частоты пульса; однако контроль ЧСС может не облегчить симптомы, β-адреноблокаторы в большинстве случаев назначают в качестве терапии первой линии. Недигидропиридиновые блокаторы Са2+-каналов (верапамил и дилтиазем) являются приемлемой альтернативой в случаях, когда p-адреноблокаторы неэффективны или плохо переносятся. Также могут быть рассмотрены небольшие дозировки бензодиазепинов в комбинации с бета-адреноблокаторами. Однако использование всех этих схем ограничивается плохой долгосрочной толерантностью к лекарствам, разочаровывающим долгосрочным клиническим ответом и отсутствием убедительных доказательств их эффективности.
Ивабрадин представляет собой новый селективный ингибитор ионных каналов If, которые экспрессируются в основном в пейсмейкерных клетках синусового узла и обеспечивают его автоматизм. Селективность ивабрадина обеспечивает снижение ЧСС без какого-либо изменения сократимости миокарда, а также атриовентрикулярной и внутрижелудочковой проводимости. Блокада токов If, индуцируемая ивабрадином, зависит от дозы препарата и ЧСС, с более выраженным эффектом при высокой ЧСС, что ограничивает риск развития симптоматической брадикардии. Клинические исследования продемонстрировали, что ивабрадин является эффективным антиангинальным средством у пациентов с ишемической болезнью сердца и обладает значительными гемодинамическими преимуществами у пациентов с систолической сердечной недостаточностью и более высокой базовой ЧСС. Несколько небольших исследований также показывают, что ивабрадин снижает среднесуточную и максимальную ЧСС у пациентов с аномальной синусовой тахикардией, улучшает симптомы, повышает переносимость физической нагрузки и заметно улучшает качество жизни. Ивабрадин можно рассматривать как терапию второй линии у пациентов, невосприимчивых к бета-блокаторам и недигидропиридиновым блокаторам Са2+-каналов, или при их непереносимости. Ивабрадин также может использоваться в комбинации с бета-блокаторами. Однако для подтверждения этих результатов необходимы большие когортные исследования, а в долгосрочной перспективе предстоит оценить безопасность и эффективность ивабрадина.
Предложены методы лечения, направленные на увеличение объема циркулирующей крови (например, обильное потребление соли и жидкости, флудрокортизон, эритропоэтин), симпатолитические агенты (клонидин, резерпин), ингибиторы холинэстеразы (пиридостигмин) и фенобарбитал, но клинический опыт применения этих методов очень ограничен. Вариабельность ответа на различные методы лечения может указывать на то, что общий видимый фенотип аномальной синусовой тахикардии вызывают разные этиологические причины.
Катетерная аблация
Модификация синусового узла методом катетерной аблации остается важным методом лечения рефрактерных случаев аномальной синусовой тахикардии. Несмотря на высокую степень эффективности хирургических вмешательств (от 76 до 100%) в снижении частоты синусового ритма, долгосрочный клинический успех катетерной аблации при аномальной синусовой тахикардии остается низким (рецидивирование симптомов наблюдается от 27 до 45%, и во многих случаях это происходит несмотря на успешное снижение ЧСС), также имеется значительный риск осложнений. По этой причине процедуру следует рассматривать как крайнее средство лечения и только у тщательно отобранных пациентов с изнуряющими симптомами, напрямую связанными с синусовой тахикардией, когда изменение образа жизни и использование всех фармакологических методов лечения оказалось неэффективным, и нет доказательств других вегетативных аномалий (например, СПОТ).
Важно отметить, что, если жалобы (особенно на сердцебиение) сохраняются, несмотря на адекватный контроль ЧСС, достигнутый с помощью лекарств, не стоит ожидать дополнительной пользы от проведения модификации синусового узла. Кроме того, катетерная аблация синусового узла может привести к нежелательным гемодинамическим эффектам у пациентов с СПОТ. Модификация синусового узла может устранить «нормальную» рефлекторную синусовую тахикардию, необходимую для преодоления аномальных ортостатических изменений (неадекватная вазодилатация или неадекватная вазоконстрикция) у этих пациентов, что может привести к выраженной гипотонии. Поэтому перед рассмотрением необходимости выполнения модификации синусового узла чрезвычайно важно точно различать аномальную синусовую тахикардию и СПОТ.
Из-за существования вероятности получения неудовлетворительных результатов аблации (необходимость имплантации кардиостимулятора, проведения повторной процедуры, сохранение симптомов, несмотря на хороший контроль ЧСС) важно еще до выполнения процедуры обсудить с пациентом и его семьей вероятные исходы и последствия.
Хирургическая аблация
Описано несколько хирургических методов лечения аномальной синусовой тахикардии. Традиционно хирургическая аблация синусового узла выполняется посредством срединной стернотомии в условиях искусственного кровообращения. Также процедура может выполняться с использованием торакоскопического доступа или мини-торакотомии. Как традиционные, так и минимально инвазивные методы имеют ограниченную клиническую эффективность и высокий риск развития симптоматической брадикардии, требующей постоянной кардиостимуляции. Следовательно, эти терапевтические подходы не рассматриваются, за исключением крайних случаев и только после того, как все другие терапевтические возможности исчерпаны.
Электрофизиологическое исследование
Цели проведения ЭФИ у пациентов с аномальной синусовой тахикардией состоят в том, чтобы исключить другие тахикардии, способные имитировать синусовую тахикардию, такие как, ПТ, возникающие вблизи верхней части crista terminalis или правой верхней легочной вены, а так-же убедиться в том, что при тахикардии, возникшей спонтанно или после инфузии изопротеренола, функционирование синусового узла соответствует его нормальной, но несколько преувеличенной физиологии.
Применение седации во время процедуры проблематично; чрезмерная седация может потенциально препятствовать возможности инициировать другие НЖТ, имитирующие аномальную синусовую тахикардию, а также создают неопределенность относительно того, какой должна быть конечная ЧСС после модификации синусового узла (см. далее); с другой стороны, процедура может длиться до нескольких часов, в течение которых движения пациента (без применения седативных препаратов) потенциально могут сделать недействительными результаты обширного и подробного картирования. Большинство оперирующих электрофизиологов используют седативные препараты.
Для активационного картирования в дополнение к катетерам, используемым для проведения рутинного ЭФИ (в области коронарного синуса, пучка Гиса и правого желудочка (ПЖ)), вдоль crista terminalis помещается мультиполярный (20-полюсный) crista-катетер. Crista-катетер располагается на crista terminalis с суперомедиальной стороны, начинающейся на стыке верхней полой вены и ушка ПП, с продолжением вдоль crista terminalis в направлении соединения нижней полой вены и ПП в нижнелатеральном направлении. Контакт катетера с crista terminalis может быть улучшен с помощью длинного интродьюсера (рис. 16.2). Внутрисердечная эхокардиография также может использоваться для идентификации crista terminalis и направленного картирования расположения катетера, а также ра-диочастотной аблации (РЧА) (см. далее).
Индукция тахикардии
Программированная электростимуляция проводится до и после инфузии изопротеренола. Введение изопротеренола начинается со скоростью 0,5-1,0 мкг/мин и титруется каждые 3-5 мин до максимальной концентрации 6 мкг/мин. Атропин в дозе 1 мг можно вводить для оценки максимальной частоты синусового ритма.
Важно документировать невозможность индукции ПТ и других НЖТ во время программированной стимуляции. Аномальная синусовая тахикардия не может быть инициирована быстрой предсердной стимуляцией или экстрастимуляцией, но может быть спровоцирована адренергической стимуляцией. Начало аномальной синусовой тахикардии проявляется постепенным увеличением частоты синусового ритма, с постепенным смещением участка самой ранней активации предсердий вверх по crista terminalis.
В тех случаях, когда единственная документированная симптоматическая тахикардия, по-видимому, имеет синусовый механизм, следует с осторожностью оценивать релевантность таких обнаруженных электрофизиологических феноменов, как двойная физиология АВ-узла или АВ-узловые эхо-комплексы. Если целью катетерной аблации будут эти изменения, то ее проведение может быть связано со значительными рисками и отсутствием клинической пользы.
Особенности тахикардии
Последовательность активации предсердий во время аномальной синусовой тахикардии характеризуется краниокаудальной последовательностью активации вдоль crista terminalis, при этом место самой ранней активации предсердий смещается вверх по crista terminalis с большей скоростью и вниз по crista terminalis с меньшей скоростью. Самая ранняя активация предсердий всегда происходит вдоль crista terminalis (что подтверждается мультиполярным катетером, помещенным на crista terminalis), несмотря на изменение частоты тахикардии или вегетативной модуляции (изопротеренол и атропин).
В отличие от фокальной ПТ, аномальная синусовая тахикардия характеризуется постепенным увеличением и уменьшением ЧСС при изменении вегетативного тонуса или в начале и при прекращении тахикардии. Кроме того, адренергическая стимуляция воспроизводимо вызывает увеличение скорости аномальной синусовой тахикардии и краниальный сдвиг в активации предсердий вдоль crista terminalis, тогда как стимуляция блуждающего нерва вызывает замедление скорости аномальной синусовой тахикардии с каудальным сдвигом.
Исключение других механизмов аритмии
Существуют несколько ключевых моментов, которые могут помочь отличить синусовую тахикардию от синоатриальной реципрокной тахикардии и фокальной ПТ. Синоатриальная реципрокная тахикардия легко и воспроизводимо инициируется путем экстрастимуляции предсердий, а ПТ может быть инициирована с помощью экстрастимуляции предсердий, burst-стимуляции (стимуляции «залпа-ми») или адренергической стимуляции. Аномальную синусовую тахикардию, напротив, невозможно запустить с помощью программированной стимуляции. Кроме того, возникновение ПТ и синоатриальной реципрокной тахикардии сопровождается внезапным изменением частоты сокращения предсердий (хотя ПТ может разогреваться в течение нескольких комплексов), в отличие от постепенного увеличения ЧСС при аномальной синусовой тахикардии на протяжении некоторого времени — от секунд до минут. Кроме того, последовательность активации предсердий внезапно сдвигается в начале ПТ или синоатриальной реципрокной тахикардии в отличие от постепенного
краниального смещения самой ранней активации предсердий вверх по crista terminalis при адренергической стимуляции по мере увеличения ЧСС при аномальной синусовой тахикардии. Тогда как ЧСС во время фокальных ПТ при продолжении адренергической стимуляции может продолжать увеличиваться, это не связано с дальнейшим сдвигом в последовательности активации предсердий.
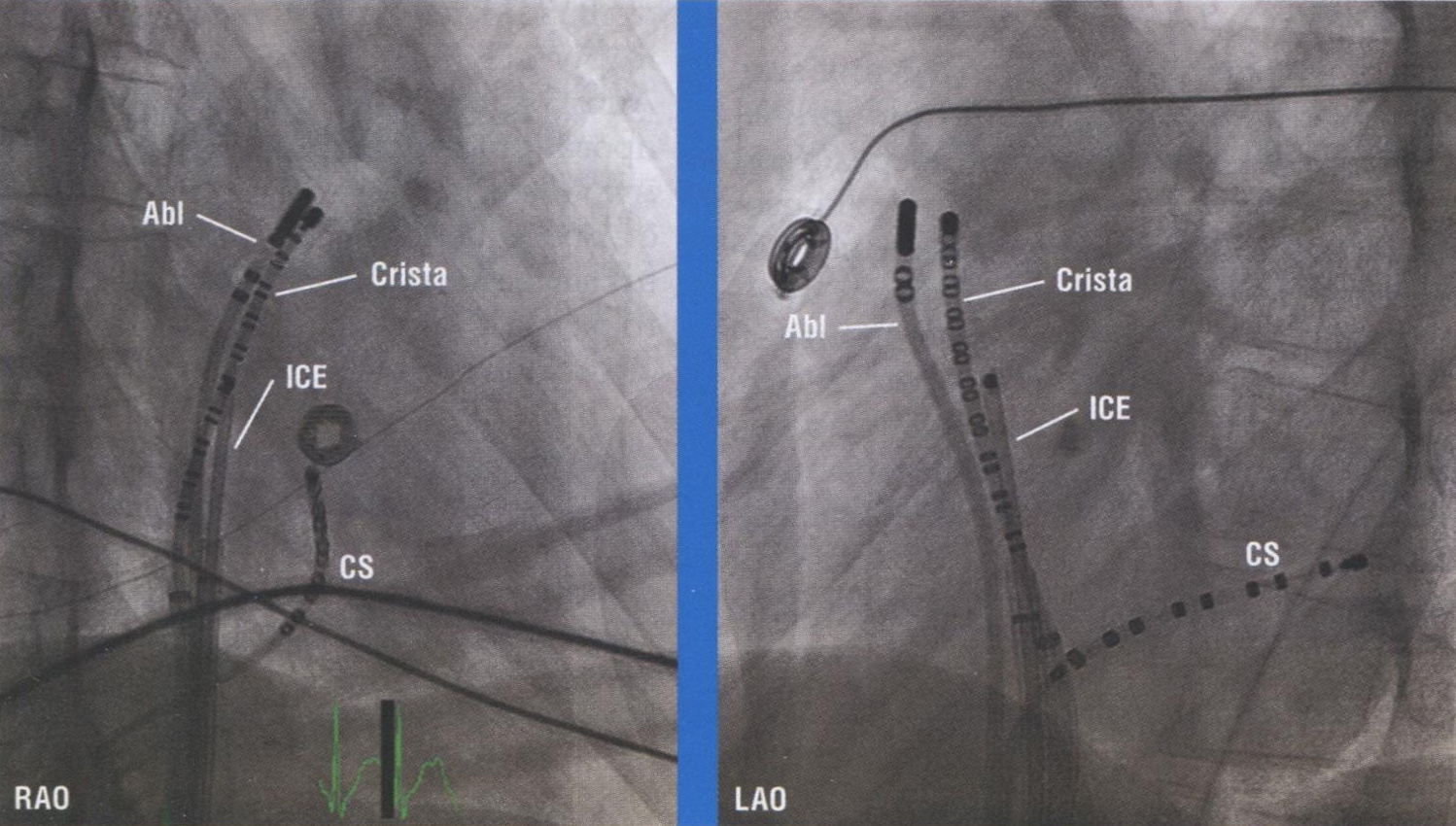
Рис. 16.2 Катетерная аблация аномальной синусовой тахикардии. Рентгеноскопия, правая передняя косая проекция (RAO) и левая передняя косая проекция (LAO) при модификации синусового узла. Мультиполярный катетер Crista помещается вдоль crista terminalis под контролем внутрисердечной эхокардиографии (ICE). АЫ — авиационный катетер; CS — катетер коронарного синуса.
Синоатриальная реципрокная тахикардия легко и воспроизводимо завершается с помощью программированной стимуляции в отличие от аномальной синусовой тахикардии. Прекращение фокальной ПТ и синоатриальной реципрокной тахикардии происходит внезапно, в отличие от постепенного замедления (охлаждения) скорости при аномальной синусовой тахикардии (рис. 16.3). Вагусные приемы приводят к резкому прекращению синоатриальной реципрокной тахикардии и либо к отсутствию эффекта, либо к резкому прекращению ПТ, в то время как постепенное замедление и смещение места происхождения тахикардии вниз по crista terminalis характеризует аномальную синусовую тахикардию. Внезапное прекращение тахикардии с помощью одного радиочастотного воздействия предполагает ПТ, потому что аномальная синусовая тахикардия происходит из обширной области, включающей верхнюю часть crista terminalis.
Аблация
Цель аблации
Понимание анатомии и физиологии синусового узла (см. главу 8) имеет решающее значение для определения цели аблации при модификации синусового узла. Область синусового узла представляет собой распределенный комплекс, характеризующийся дифференцировкой на участки, ответственные за разную частоту синусового ритма (т.е. существует анатомическое распределение генерации импульсов синусового ритма с различной частотой), что позволяет проводить целенаправленную аблацию для устранения самой быстрой частоты синусового ритма с частичным сохранением функции синусового узла.
Модификация синусового узла нацелена на его участок, генерирующий наибольшую частоту синусового ритма, как правило на верхнюю часть crista terminalis. Однако следует признать, что модификация синусового узла не является фокальной аблацией, а требует полного удаления краниальной части комплекса синусового узла (е-рис. 16.1). В идеале эта процедура устраняет области синусового узла, ответственные за более высокую частоту ритма, при сохранении некоторой хронотропной способности.
Следует отметить, что в то время как головка и проксимальная часть тела синусового узла обычно расположены субэпикардиально, находясь на 0,1-1,0 мм ниже жировой ткани терминальной борозды на поверхности эпикарда, оставшиеся части тела и хвоста узла проникают по направлению вниз и по диагонали в мышечную ткань crista terminalis, заканчиваясь субэндокардиально почти у нижней полой вены. Это имеет отношение к процедуре РЧА, т.к. манипуляции с верхней частью синусового узла (которая представляет собой цель аблации) при выполнении эндокардиальной аблации могут быть сложнее. С другой стороны, нижняя часть синусового узла, которую необходимо сохранить для эндокардиальной аблации, вероятно, будет более уязвимой.
Техника аблации
Crista terminalis не видна при рентгеноскопии и имеет различную конфигурацию у разных пациентов. Поэтому некоторые оперирующие электрофизиологи предпочитают использовать внутрисердечную эхокардиографию, чтобы идентифицировать crista terminalis, расположить кончик аблационного катетера таким образом, чтобы он плотно прилегал к crista terminalis, и оценить радиочастотное поражение (см. е-рис. 11.9). Системы трехмерного контактного картирования (CARTO, NavX, Rhythmia) или бесконтактное картирование также могут помочь очертить соответствующие анатомические структуры (верхнюю полую вену границы предсердия), определить протяженность участка самой ранней активации во время аномальной синусовой тахикардии, очертить участок расположения диафрагмального нерва (участки, в которых кардиостимуляция стимулирует диафрагму), и регистрировать участки аблации (рис. 16.4). Некоторые операторы определяют участок самой ранней активации во время базового ритма в состоянии покоя и маркируют этот участок как область, которую следует избегать во время последующих аблаций (е-рис. 16.2).
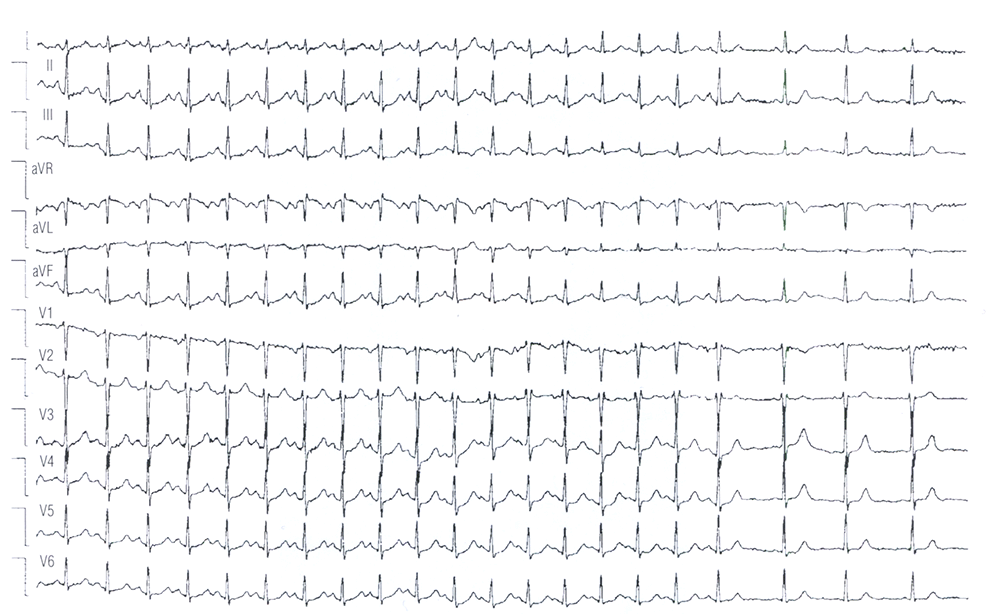
Рис. 16.3 Фокальная предсердная тахикардия. Электрокардиограмма в 12 отведениях, показывающая перинодальную фокальную предсердную тахикардию (или синоатриальную реципрокную тахикардию) с резким прекращением и восстановлением нормального синусового ритма. Обратите внимание сходство морфологии зубца Р во время тахикардии и при нормальном синусовом ритме.
Мультиполярный катетер помещается вдоль crista terminalis (под контролем внутрисердечной эхокардиографии или без нее). Для проведения РЧА используется стандартный аблационный катетер 4 или 8 мм или катетер с орошаемым кончиком. При проведении неорошаемой аблации мощность регулируется для достижения температуры кончика катетера от 50°С до 60°С или падения импеданса от 5 до 10 Ом, либо того и другого. При орошаемой аблации можно использовать мощность от 40 до 50 Вт, поддерживая температуру кончика электрода менее 43°С.
Радиочастотные воздействия наносятся в соответствии со временем самой ранней активации предсердий, обычно вдоль верхних областей crista terminalis, используя в качестве ориентира crista-катетер. Время локальной активации эндокарда, регистрируемое аблационным катетером на успешных участках, обычно предшествует началу поверхностной волны Р во время тахикардии на 25-45 мсек (рис. 16.5).
РЧА выполняется при максимальной адренергической стимуляции изопротеренолом (с парасимпатической блокадой атропином или без нее), чтобы выявить верхние части crista terminalis как места самой ранней активации предсердий. Медиальная часть crista terminalis, проходящая перед верхней полой веной, обычно является местом самой ранней активации для наибольшей частоты синусового ритма; этот участок должен быть подвергнут аблации в первую очередь. Затем удаляются все более низкие части crista terminalis, пока не будет достигнуто целевое снижение ЧСС. Каждый раз, когда наблюдается устойчивое изменение частоты синусового ритма или оси зубца Р, повторяется активационное картирование, чтобы идентифицировать новые участки с самой ранней активацией предсердий, на которые нацелена аблация (см. рис. 16.4). Этот метод часто требует выполнения аблации на участке, равном примерно 12 ± 4 х 19 ± 5 мм.
Подачу радиочастотной энергии на любом участке, вероятно, следует ограничить 30 сек, потому что это, как правило, близко расположенные воздействия, которые несут риск образования нагара при более длительных воздействиях. Перед каждым радиочастотным воздействием необходимо проводить стимуляцию с кончика аблационного катетера с высокой выходной мощностью (от 5 до 10 мА), чтобы убедиться в отсутствии диафрагмальной стимуляции во избежание повреждения диафрагмального нерва.
Ускорение синусового ритма с последующим заметным снижением частоты или появлением узлового ритма во время аблации является показателем успешного выбора участка аблации. Большинство пациентов демонстрируют ступенчатое уменьшение частоты синусового ритма во время аблации, что связано с перемещением участка самой ранней активации предсердий в краниокаудальном направле-нии вдоль crista terminalis (см. рис. 16.5). Однако нередко можно наблюдать резкое уменьшение частоты синусового узла в ответ на РЧА в месте самой ранней активации предсердий (рис. 16.6). Эхокардиографические характеристики повреждения, обнаруженные с использованием внутрисердечной эхокардиографии, также могут служить ориентирами для определения дополнительных радиочастотных воздействий. Эффективное радиочастотное повреждение имеет повышенную или измененную эхоплотность, полностью простираются до эпикарда с развитием тривиального линейного низкоэхогенного или анэхогенного интерстициального пространства, предполагающего трансмуральное радиочастотное поражение.
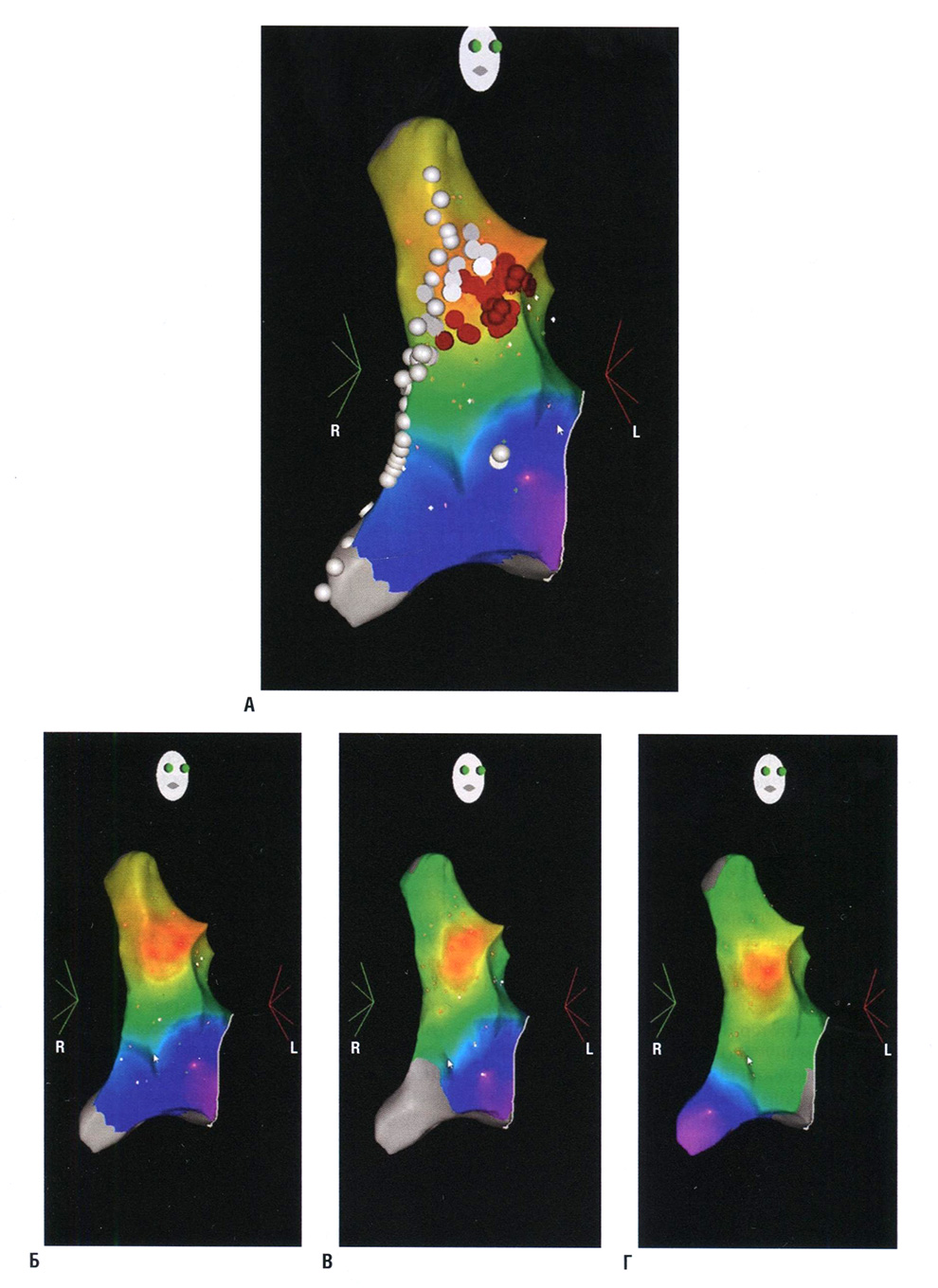
Рис. 16.4 Электроанатомическая карта аномальной синусовой тахикардии. (А) Правая передняя косая проекция правого предсердия, показывающая электроанатомическую (CARTO) активационную карту аномальной синусовой тахикардии. Белые точки указывают на захват диафрагмального нерва во время стимуляции с высокой мощностью; красные точки указывают на места аблации. (Б-Г) Успешная аблация с повторным активационным картированием, показывающим сдвиги места возникновения синусового зубца Р от верхней части crista terminalis (Б) исходно к более каудальным участкам (В, Г) вдоль crista terminalis в результате модификации синусового узла.
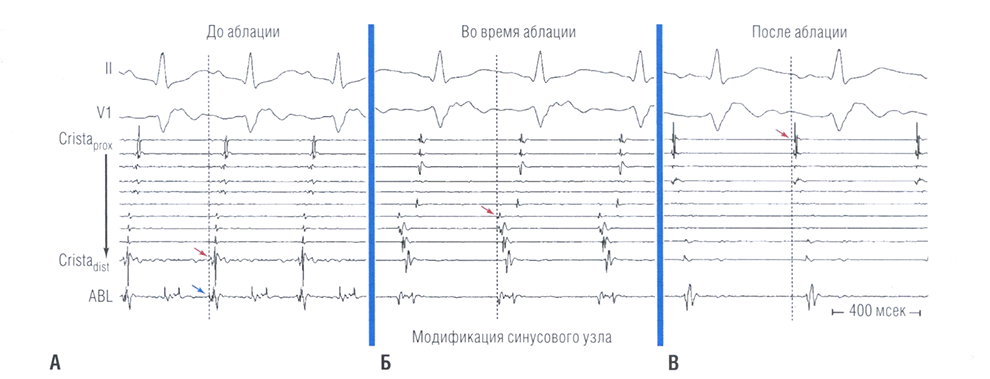
Рис. 16.5 Интракардиальные записи во время модификации синусового узла. (А) Перед аблацией (ABL) и при адренергической стимуляции наблюдается синусовая тахикардия, с самой ранней локальной активацией (красные стрелки), регистрирующейся наиболее дистальными (краниальными) электродами катетера Crista, непосредственно перед переходом верхней полой вены в правое предсердие. Обратите внимание, что локальная активация, регистрируемая аблационным катетером (синяя стрелка), предшествует возникновению зубца Р (вертикальная пунктирная линия) на 20-30 мсек. (Б) После аблации наиболее краниальной части синусового узла частота синусового ритма становится реже, а последовательность активации смещается в сторону более проксимальных (каудальных) электродов с 7 по 8 на катетере Crista. (В) После успешной модификации синусового узла частота синусового ритма (при постоянной адренергической стимуляции) снижается более чем на 30%, а последовательность активации предсердий смещается к более проксимальным (каудальным) электродам катетера Crista. Обратите внимание, что зубец Р теперь инвертирован во II отведении. Cristadisl — дистальная пара электродов катетера, расположенного в области crista terminalis; Cristaprox — проксимальная пара электродов катетера, расположенного в области crista terminalis.
Недавно в небольшой серии исследований была продемонстрирована возможность эпикардиальной аблации (через субксифоидальный перикардиальный доступ) для модификации синусового узла. Эпикардиальный доступ также может помочь снизить риск повреждения диафрагмального нерва во время эндокардиальной аблации. Введение физиологического раствора или размещение катетера с отклоняющимся электродом в перикардиальном пространстве может помочь физически вывести диафрагмальный нерв из зоны аблации (е-рис. 16.3).
Конечные точки аблации
Интраоперационно успех процедуры определяется следующими признаками: (1) резкое снижение ЧСС на 30 уд/мин или более во время радиочастотного воздействия или снижение максимальной частоты сердечных сокращений на 20-25% (или абсолютная ЧСС менее 120 уд/мин) во время введения изопротеренола и атропина; (2) стойкое уменьшение частоты синусового ритма в покое на 10% или более (или абсолютная частота синусового ритма в покое менее 90 уд/мин); (3) поддержание направленного вверх зубца Р (отрицательный зубец Р в отведении III); и (4) смещение места самой ранней активации предсердий вниз по crista terminalis, даже на фоне максимальной адренергической стимуляции.
Выполнение РЧА аномальной синусовой тахикардии часто бывает сложным и требует множественных радиочастотных воздействий; по результатам одного из исследований среднее число воздействий составляло 12 (находясь в диапазоне от 6 до 92). Устойчивость синусового узла к эндокардиальной катетерной аблации может быть частично объяснена особенностями его структуры, представляющей собой плотную матрицу соединительной ткани, в которую упакованы специализированные клетки синусового узла; охлаждающим эффектом артерии синусового узла; субэпикардиальным расположением узла; и толстым crista terminalis, особенно по отношению к узловой части каудальнее артерии синусового узла. Кроме того, длина синусового узла, отсутствие изолирующей оболочки, присутствие участков выхода из узла и каудальных фрагментов создают потенциал для множественных прорывов узлового волнового фронта.
Результаты аблации
Перед тем как приступить к аблации синусового узла по поводу аномальной синусовой тахикардии, и врач, и пациент должны иметь реалистичные ожидания и понимание целей аблации и потенциальных результатов. Относительно немногие пациенты смогут достичь желаемого облегчения симптомов и нормальной ЧСС в состоянии покоя и хронотропного ответа без необходимости имплантации постоянного кардиостимулятора. У некоторых пациентов, несмотря на достижение критериев успешно выполненной процедуры аблации, симптомы сохраняются. В части случаев аномальная синусовая тахикардия заменяется столь же (или даже более) беспокоящим ускоренным узловым ритмом частотой от 80 до 90 уд/мин с ретроградным проведением. У этих пациентов основной причиной потенциально может быть генерализованная дизавтономия.
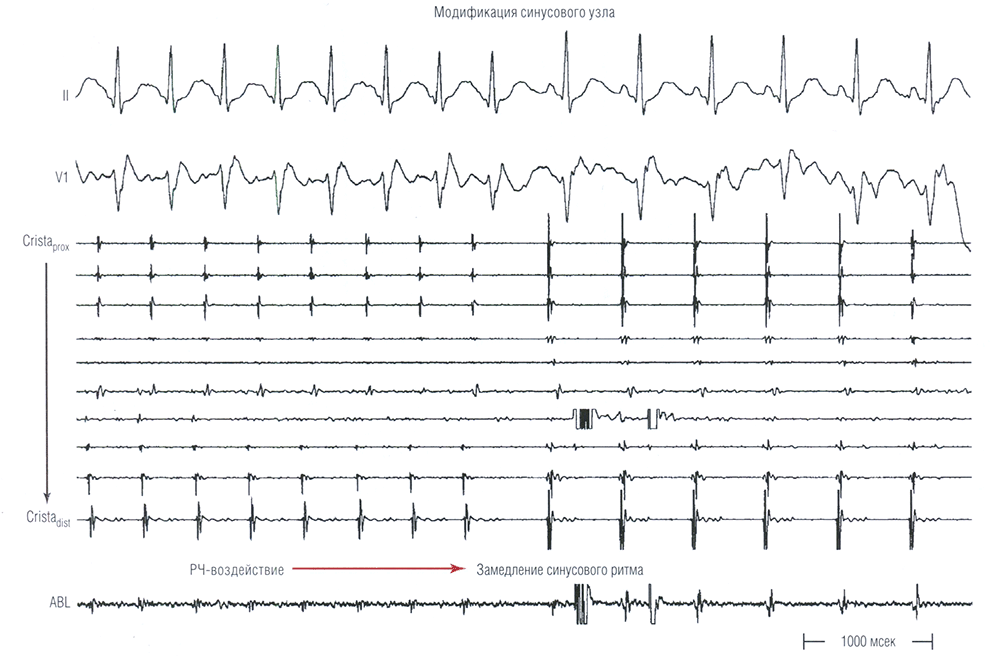
Рис. 16.6 Модификация синусового узла. Резкое снижение частоты синусового ритма наблюдается в ответ на радиочастотную (РЧ) аблацию (ABL) в очаге самой ранней активации предсердий. Cristadist — дистальная пара электродов катетера, расположенного в области crista terminalis; Cristaprox — проксимальная пара электродов катетера, расположенного в области crista terminalis.
РЧА в лучшем случае лишь умеренно эффективна для лечения пациентов с аномальной синусовой тахикардией. Хотя краткосрочные показатели успеха могут быть благоприятными (от 76 до 100%), долгосрочные результаты неутешительны, с показателями клинического успеха от 23 до 83%. Полная аблация синусового узла (направленная на всю crista terminalis), приводящая к возникновению узлового ритма, имеет лучший долгосрочный успех (72%), но требует установки кардиостимулятора.
Большинство рецидивов возникают через 1-6 мес после проведения процедуры и обычно связаны с рецидивом тахикардии после первоначально успешно выполненной аблации. Пациентам с плохо переносимыми симптомами может потребоваться повторная процедура. В некоторых случаях наблюдались симптомные рецидивы или сохранение симптомов при отсутствии документально подтвержденной аномальной синусовой тахикардии и сохраняющиеся доказательства успешного электрофизиологического результата. Постоянные симптомы, несмотря на снижение ЧСС, могут указывать на более глобальную дизавтономию, которая также влияет на синусовый узел.
Осложнения модификации синусового узла включают тампонаду сердца, синдром верхней полой вены, диафрагмальный паралич и дисфункцию синусового узла. Тампонада сердца встречается редко и обычно вызвана проникновением оставленного без присмотра в правом желудочке катетера у худощавых пациенток с быстрой и сильной сердечной деятельностью при инфузии высоких доз изопротеренола. Транзиторный синдром верхней полой вены может развиться из-за образования обширного поражения и отека на стыке верхней полой вены и ПП. В редких случаях это может вызвать стойкий стеноз верхней полой вены. Более целенаправленная аблация с использованием внутрисердечной эхокардиографии может помочь избежать этого осложнения.
Вероятность паралича диафрагмы, развивающегося вторично по отношению к повреждению правого диафрагмального нерва, должна быть сведена к минимуму, если аблационные воздействия ограничиваются только crista terminalis или располагаются непосредственно перед ней. Использование внутрисердечной эхокардиографии для проведения аблации делает это осложнение маловероятным, поскольку диафрагмальный нерв является задней структурой. Стимуляция с высокой выходной мощностью (более 10 мА за 2 мсек) с аблационного катетера в целевом месте без захвата диафрагмального нерва и не-прерывная стимуляция выше верхней полой вены для захвата диафрагмального нерва во время РЧА являются обнадеживающими методами, но их эффективность ни-когда не оценивалась; в действительности, были случаи, когда паралич диафрагмы развивался через несколько дней после аблации, несмотря на принятие всех выше-перечисленных мер.
Кроме того, следует подозревать повреждение диафрагмального нерва в случае возникновения икоты, кашля или уменьшения экскурсии диафрагмы во время воздействия. Раннее распознавание повреждения диафрагмального нерва во время радиочастотного воздействия позволяет немедленно прекратить его до начала развития стойкого повреждения и сопровождается быстрым восстановлением функции диафрагмального нерва. Если повреждение диафрагмального нерва препятствует аблации желаемых участков эндокарда, можно рассмотреть вопрос о введении физиологического раствора или размещении баллонного катетера в перикардиальном пространстве (через субксифоидный доступ) с целью смещения диафрагмального нерва от цели аблации. Устойчивый медленный узловой ритм, требующий установки кардиостимулятора, встречается редко. Такой узловой ритм обычно исчезает в течение нескольких дней с восстановлением синусового ритма.
Вы читали отрывок из книги "Клиническая аритмология и электрофизиология" - Исса З. Ф.
Купить книгу "Клиническая аритмология и электрофизиология" - Исса З. Ф.
Книга "Клиническая аритмология и электрофизиология"
Авторы: Исса З. Ф., Миллер Д. М., Зайпс Д. П.

Данное издание является дополнением к знаменитому руководству Ю. Браунвальда “Болезни сердца”. Большое количество иллюстраций и более 70 изображений позволят вам быть в курсе современных технологий и диагностических исследований, новой информации о молекулярной генетике. достижений в области аблации и многого другого. В книге подробно описаны новейшие методы диагностики и лечения пациентов с аритмией, типы аритмии описаны единообразно для быстрого ознакомления. Приведены клинические наблюдения, в частности наследственных каналопатий, фибрилаяции предсердий, желудочковой тахикардии, гипертрофической кардиомиопатия, аритмогенной кардиомиопатии и врождённых пороков сердца. Клинические методы ведения сложных пациентов основаны на принципах фундаментальной науки. Видеоизображения иллюстрируют основные методы картирования, рентгенограммы демонстрируют позиционирование электрофизиологического катетера, пункции межпредсердной перегородки и доступа к перикарду, криоаблации и процедур изоляции ушка левого предсердия.
Издание предназначено для широкого круга специалистов, занимающихся функциональными проблемами сердечно-сосудистых заболеваний и вопросами клинической практики.
Содержание книги "Клиническая аритмология и электрофизиология" - Исса З. Ф., Миллер Д. М., Зайпс Д. П.
1 Молекулярные механизмы электрической активности сердца
2 Ионные каналы сердца
3 Электрофизиологические механизмы нарушений ритма сердца
4 Электрофизиологическое исследование: необходимое оборудование и техника проведения,
5 Стандартные методы внутрисердечного картирования
6 Современные технологии навигации и картирования
7 Источники энергии для аблации
8 Дисфункция синусового узла
9 Нарушения атриовентрикулярного проведения
10 Нарушения внутрижелудочковой проводимости
11 Фокальная предсердная тахикардия
12 Типичное трепетание предсердий
13 Предсердная макрореентри тахикардия
14 Предсердные тахиаритмии у взрослых с врожденными пороками сердца
15 Фибрилляция предсердий
16 Аномальная синусовая тахикардия
17 Атриовентрикулярная узловая реципрокная тахикардия
18 Типичные атриовентрикулярные дополнительные пути проведения
19 Атипичные дополнительные пути проведения
20 Пароксизмальные наджелудочковые тахикардии
21 Тахикардия с широкими комплексами
22 Желудочковые аритмии при ишемической болезни сердца
23 Идиопатическая фокусная желудочковая тахикардия
24 Фасцикулярная желудочковая тахикардия
25 Желудочковая тахикардия при неишемической дилятационной кардиомиопатии
26 Реентри желудочковая тахикардия с вовлечением ножек пучка Гиса
27 Эпикардиальная желудочковая тахикардия
28 Аритмии при гипертрофической кардиомиопатии
29 Желудочковая тахикардия при аритмогенной дисплазии правого желудочка
30 Желудочковые аритмии у взрослых с врожденными пороками сердца
31 Желудочковые аритмии при наследственных каналопатиях
32 Осложнения катетерной аблации сердечных аритмий


























































































0 комментариев