Ранняя диагностика рака предстательной железы. Лекция для врачей
Лекция для врачей "Ранняя диагностика рака предстательной железы" (отрывок из книги "Робот-ассистированная урология: национальное руководство" - Пушкарь Д. Ю.)
Дополнительный материал к лекции
ПСА при раке предстательной железы. Лекция для врачей
Диагностики рака предстательной железы
Введение
За последние 170 лет рак предстательной железы (РПЖ) эволюционировал из крайне редко диагностируемого заболевания в одно из наиболее часто встречающихся онкологических заболеваний у мужчин; из клинически симптоматического заболевания в момент диагностики в асимптоматическую патологию, выявляемую при скрининге, и из зачастую летального заболевания в хроническую болезнь с полностью контролируемым течением.
РПЖ — одно из наиболее часто встречающихся злокачественных новообразований у мужчин среднего и пожилого возраста. За период с конца 1970-х до начала 1990-х годов частота раковых заболеваний предстательной железы почти удвоилась. В настоящее время во многих развитых странах рак предстательной железы занимает второе место среди причин смерти от раковых заболеваний среди мужчин. Выявляемость РПЖ по сравнению с любыми другими онкологическими заболеваниями прогрессивно увеличивается с возрастом. В структуре онкологических заболеваний в ряде стран рак предстательной железы выходит на 2-3- е место после рака легких и желудка, а в США и Швеции — на 1-е место. В США ежегодно диагностируется около 232 000 новых случаев РПЖ, в Европе — около 238 000 случаев. Каждый год около 30 350 американцев и около 85 200 европейцев умирают от этого заболевания.
По величине прироста в России (темп прироста — 31,4%) он занимает 2-е место после меланомы кожи (35,0%) и значительно превосходит злокачественные заболевания легких (5,0%) и желудка (10,2%) [5]. Внимание исследователей к проблеме РПЖ связано не только с увеличением общего количества больных, но и с ростом смертности от него.
Столь широкое распространение рака предстательной железы ставит его в ряд наиболее важных социальных проблем современности. Болезнь практически не возникает раньше 40 лет и становится все более частым явлением с каждым последующим десятилетием жизни. Существует настоятельная необходимость в разработке методов, которые могли бы обеспечить раннее выявление заболевания и значительно повысить эффективность лечения. Несмотря на многие усилия, по крайней мере в ближайшем будущем ожидать полного предотвращения развития рака или радикальных шагов в борьбе с болезнью на распространенных стадиях, к сожалению, не приходится. На данный момент способов полного излечения распространенного рака простаты нет. Ряд исследований показали, что, несмотря на успехи фармакологии в разработке антиандрогенных препаратов, за последние 50 лет применения гормональной терапии не было отмечено выраженного снижения смертности от рака простаты. Сократить число смертей от рака простаты возможно двумя способами — при ранней диагностике и эффективном лечении заболевания в его начальной стадии.
Сегодня рак простаты является предметом тщательного изучения: ведутся работы по уточнению его этиологии, механизмов развития и диагностики. Активно осуществляется поиск методов раннего обнаружения и определения стадии заболевания с помощью молекулярных, радиографических и клинических методов исследования. Многими исследованиями подтверждено, что выявляемость данного заболевания в начальной стадии значительно улучшается при использовании программ ранней диагностики и скрининга рака простаты, включающих в себя пальцевое ректальное исследование (ПРИ), ТРУЗИ и определение уровня простат-специфического антигена (ПСА).
Исторические факты изучения рака предстательной железы
РПЖ был впервые описан в монографии Thompson «Увеличенная предстательная железа» (The Enlarged Prostate), опубликованной в 1852 г. В то время специалисты не различали РПЖ и доброкачественную гиперплазию простаты. Сорок лет спустя von Recklinghausen отметил, что РПЖ может метастазировать в кости при наличии даже единичного пальпируемого образования в предстательной железе. Развитие микроскопии вскоре выявило факт гораздо большего распространения РПЖ, чем предполагалось до этого. Более того, стало ясно, что рак предстательной железы может являться причиной инфравезикальной обструкции, а также общей симптоматики (боль в костях, потеря массы тела, кахексия).
Длительное время единственной целью урологов в отношении больных РПЖ была паллиативная помощь. В начале прошлого века популярным методом лечения РПЖ являлся недавно открытый радон. Barringer предложил метод захвата радона в стеклянные флаконы, который потом внедрялся в предстательную железу. К сожалению, лишь 36 из первых пролеченных таким способом 352 пациентов прожили более 5 лет. Многим позже, в 1950 г. Flocks и соавт. провели перманентную брахитерапию с использованием в качестве радиоактивного источника зерна золота (Au198). Эффективность этого метода лечения так никогда и не была доказана.
Hugh Hampton Young первым предложил хирургический подход к лечению РПЖ. В основе лежала идея усовершенствования техники выполнения биопсии простаты и формирования доступа к имплантации зерен. Однако лишь незначительное количество мужчин были оптимальны для выполнения перинеальной простатэктомии. Еще в 1905 г. Young предположил, что тщательное выполнение ПРИ позволяет определить изменения в ткани простаты, выявляя тем самым онкологическое заболевание на ранних стадиях.
Мрачный прогноз у пациентов с раком простаты несколько прояснился после доклада Huggins и Hodges в 1941 г., посвященного гормонально зависимой природе РПЖ. Клиническую значимость билатеральной орхидэктомии в то время было невозможно оценить. Более того, повсеместное распространение данного варианта терапии РПЖ мгновенно сделало устаревшими все иные (хирургические и радиологические) методы лечения. В поздних 1950-х годах антиандрогенная терапия или орхидэктомия являлась терапией выбора у пациентов с клинически симптоматическим заболеванием. Поскольку средним периодом ответа на антиандрогенную терапию является 36 мес, большинство пациентов умирали от РПЖ.
В последующем были инициированы и проведены многочисленные исследования, направленные на поиски оптимального химиотерапевтического препарата для лечения РПЖ, однако заболевание оставалось по-прежнему резистентным. Наиболее значимым выводом и результатом проведенных исследований явились создание и валидация шкалы Глисона. Автор предложил морфологическую классификацию, состоящую из пяти шаблонов, основанных на степени дифференцировки злокачественных клеток. В настоящее время 1-й и 2-й варианты дифференцировки по шкале Глисона не используются. В 2014 г. на очередной конференции Международного консенсуса уропатологов принято решение о переносе крибриформной архитектоники клеток из варианта 3 в вариант 4, а также была проведена реорганизация шкалы Глисона в градирующие группы 1-5. Данные изменения позволили более четко формировать прогноз для различных групп пациентов.
В 1960 г. Bagshow ввел термин «лечебная терапия». При этом автор предложил применение дистанционной лучевой терапии для лечения локализованного РПЖ. Более того, была расценена прогностическая значимость диагностики метастатического варианта заболевания. Пациентам предлагалось выполнение тазовой лимфаденэктомии в качестве первого этапа перед началом основной терапии. К сожалению, рандомизированные исследования так и не были выполнены. К настоящему моменту несколько предложенных улучшений терапии привели к созданию лучевой терапии на принципах высокодозного облучения. Whitmore возродил применение брахитерапии в 1970 г., совместив выполнение расширенной лимфаденэктомии с имплантацией радиоактивных зерен в простату. Данная техника была заброшена для того, чтобы быть во-рожденной в четвертый раз в 1990 г., когда Ragde и Blasko применили ТРУЗИ для современного подхода к имплантации радиоактивных зерен в предстательную железу. Также в данный временной период были предложены и иные виды аблативного вмешательства (криотерапия и фокальная терапия высокоинтенсивным ультразвуком).
Walsh возродил радикальную простатэктомию в качестве «лечебной терапии» в 1980 г. Автор значимо улучшил результат выполнения вмешательства путем внедрения техники контроля дорсального венозного комплекса и идентификации сосудисто-нервных пучков, ответственных за сохранение эректильной функции и способности к удержанию мочи. Один из его резидентов (М. Menon), основываясь на результатах работы своего учителя, впервые выполнил и предложил современную технику проведения робот-ассистированной радикальной простатэктомии.
Общая характеристика и классификация рака предстательной железы
Как известно, РПЖ имеет мультифокальный рост и в 70% случаев локализуется в периферической зоне, в 25% — в центральной и около 5% случаев встречается в переходной зоне простаты. Как отмечено выше, заболевание редко встречается у мужчин моложе 50 лет. Вместе с тем многочисленные аутопсийные исследования у мужчин в возрасте 30-40 лет примерно в 20% случаев показали наличие микроскопических очагов латентного рака в простате. Поскольку такие микроскопические опухоли растут крайне медленно, клинически заболевание не проявляется. Со временем очаги латентного рака постепенно увеличиваются. Принято считать, что по достижении объема 0,5 см3 новообразование становится клинически значимым и требует проведения соответствующего лечения. Наиболее распространенной злокачественной опухолью простаты является ацинарная аденокарцинома.
Помимо ацинарной аденокарциномы простаты, выделяют следующие.
1. Протоковую аденокарциному.
2. Муцинозную (коллоидную) аденокарциному.
3. Перстневидно-клеточную аденокарциному.
4. Карциному с плоскоклеточной дифференцировкой.
5. Базально-клеточную карциному.
6. Уротелиальную карциному в простате.
7. Нейроэндокринные опухоли простаты:
— мелкоклеточную карциному;
— карциноид;
— крупноклеточную нейроэндокринную карциному.
8. Саркоматоидную карциному.
9. Лимфоэпителиомиоподобную карциному.
10. Недифференцированную карциному.
Основным методом диагностики рака предстательной железы является гистоморфологическая оценка биопсии простаты, включающая оценку архитектурных, цитологических и некоторых сопутствующих признаков. Среди наиболее распространенных морфологических признаков аденокарциномы простаты выделяют: нарушение архитектоники желез, крупные гиперхромные ядра, хорошо видимые ядрышки, фигуры митоза и апоптотические тельца, амфофильную цитоплазму, голубой муцин, наличие розового аморфного секрета и кристаллоидов. Оценку степени дифференцировки аденокарциномы простаты проводят согласно шкале Глисона. Первоначальная система градации, предложенная Дональдом Глисоном в 1965 г., претерпела несколько пересмотров. Наиболее значимыми были пересмотры 2005 и 2012 гг. (рис. 2.1).
Классификация аденокарциномы простаты по системе градации Глисона основывается на разнице в архитектонике железистых структур опухоли.
Выделяют пять степеней градаций (грейдов).
1. Грейд 1 представляет собой ограниченный узел, состоящий из плотно расположенных, одинаковых по форме (от круглых до овальных), хорошо сформированных желез с отсутствием или минимальной инфильтрацией ими окружающей стромы простаты. Использование этих строгих критериев достаточно редко и спорно в современной практике, требует выполнения иммуногистохимического типирования и достаточно часто описывается как атипичная аденоматозная гиперплазия. В настоящее время грейд 1 не используется в диагностике РПЖ.
2. Грейд 2 — узел с минимальной периферической инфильтрацией стромы, состоящий из мелких, одинаковой формы, менее тесно расположенных желез. Встречается также редко и, как правило, обнаруживается в переходной зоне простаты. Обычно грейд 2 связан с более высоким грейдом и может быть рассмотрен как вторичный паттерн в образцах, полученных после трансуретральной резекции простаты. В настоящее время грейд 2 не рекомендован для использования при биопсии простаты, так как в биопсийном материале данная архитектоника не может быть оценена в полном объеме и имеет низкую воспроизводимость среди патологов, а также низкую корреляцию с последующей оценкой образцов радикальной простатэктомии и может вводить в заблуждение врачей и пациентов предположением о низкой агрессивности опухоли.
3. Грейд 3 — наиболее распространенный паттерн. Представлен преимущественно более мелкими и хорошо сформированными, ограниченными стромой железами, которые проникают между доброкачественными протоками и ацинусами. Железы, как правило, меньше, чем в 1-м и 2-м грейдах. Включение мелких крибриформных структур в паттерн 3 длительное время являлось довольно спорным, так как большинство экспертов включали все крибриформные структуры в грейд 4. В 2012 г. данное решение о переносе всех крибриформных структур в грейд 4 было принято и утверждено к применению Международным обществом патологов.

Рис. 2.1. Гистологическая классификация РПЖ по Глисону: а — первоначальная шкала градации, предложенная Д. Глисоном; б — схема градации, утвержденная ВОЗ после пересмотра в 2005 г.; в — схема градации, утвержденная ВОЗ после пересмотра 2012 г.
4. Грейд 4 наиболее широко представлен сливающимися, плохо сформированными железами. Тангенциальный срез желез 3 паттерна может имитировать железы 4 паттерна, что важно помнить при оценке образцов простаты, что обычно является основной причиной завышения балла при оценке биопсийного материала. Наиболее распространены в 4-м грейде решетчатые железистые структуры правильной и неправильной формы. Кроме того, встречаются так называемые гипернефроматоидные железы, представленные солидными пластами желез, состоящих из клеток с оптически светлой цитоплазмой.
5. Грейд 5 характеризуется отсутствием железистой дифференцировки. Может быть представлен в виде солидных структур, шнуров клеток или единичных, в том числе перстневидных, опухолевых клеток. Также включает в себя солидные решетчатые или папиллярные структуры с центральным комедонекрозом.
Для того чтобы оценить степень дифференцировки опухоли по системе градации Глисона, в биопсии простаты суммируют наиболее распространенный и наиболее тяжелый паттерн (грейд). Если наименее высокий паттерн встречается менее, чем в 5% ткани, его не указывают в гистологическом заключении, но обязательно указывают более высокой паттерн, даже если он занимает менее 5% исследованного материала (рис. 2.2).
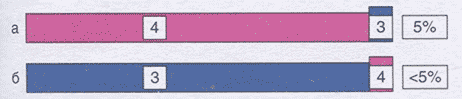
Рис. 2.2. Сумма баллов по системе градации Глисона 4+4=(а); сумма баллов по системе градации Глисона 3+4=7 (б)
Сумма баллов служит важным прогностическим критерием, позволяющим предположить скорость прогрессирования заболевания, метастазирования и прогнозировать выживаемость. Следует отметить, что для объективной оценки биопсийного материала и прогнозирования течения заболевания необходимым является количество взятых биоптатов не менее 10-12, размещение биоптатов в отдельные контейнеры (так называемое «картирование» биопсии предстательной железы) с последующей заливкой в блок не более двух биоптатов; при этом длина каждого биоптата должна быть не менее 1 см. Кроме того, существенным моментом является профессионализм лаборантов, обеспечивающий надлежащую заливку и микротомию биопсийного материала. Множество столбиков в одной кассете приводит к неравномерной заливке парафином биопсийного столбика и может привести к потере значительного количества материала для гистологического исследования (рис. 2.3).
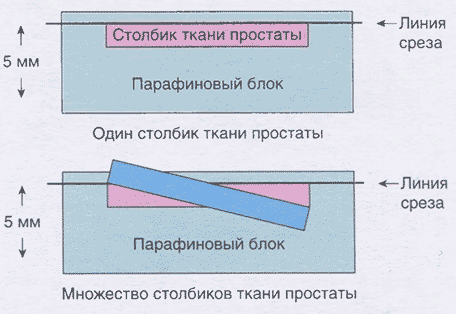
Рис. 2.3. При заливке нескольких столбиков в парафиновый блок отмечается неравномерное расстояние относительно горизонтальной линии среза, что приводит к значительной потере ткани во время микротомии
Несмотря на то что система градации Глисона претерпела ряд изменений, до сих пор существует множество вопросов как у клиницистов, так и у пациентов в отношении прогноза течения заболевания. Например, показатели Глисона ≤6 могут быть расценены клиницистами как высокодифференцированная опухоль, а показатель Глисона 8-10 как одинаково низкодифференцированная опухоль. Сумма баллов 3+4=7 не тождественна сумме баллов 4+3=7, имеющей худший прогноз. Многочисленные исследования показали, что опухоли с показателем Глисона 7 значительно более агрессивны, чем новообразования с показателем Глисона ≤6 баллов. Некоторым больным с опухолями, соответствующими степени дифференцировки по Глисону ≤6, выбирается тактика активного наблюдения, в то время как с показателем Глисона 7 большинство урологов выбирают тактику активного лечения.
В ноябре 2014 г. в Чикаго состоялся экспертный совет, на котором была предложена новая система гистологической градации рака простаты. В обсуждении приняли участие 67 уропатологов из 21 страны мира, а также 20 урологов и онкоурологов, которые поддержали данную инициативу.
Консенсусом предложено использование прогностических групп, выделенных на основании суммы баллов по системе градации Глисона и их корреляции с пятилетней выживаемостью без биохимического рецидива. В исследовании приняли участие 5 крупных научно-практических центров (University of Pittsburgh, Memorial Sloan Kettering Cancer Center, Cleveland Clinic Foundation, Karolinska University, Johns Hopkins University), в анализ вошли 21 226 пациентов (табл. 2.1).
Таблица 2.1. Безрецидивная биохимическая выживаемость в прогностических группах
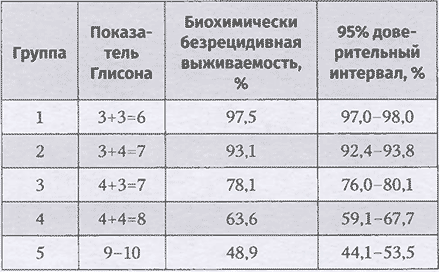
Таким образом, консенсусом предложено наряду с традиционной гистопатологической градацией опухоли по системе градации Глисона указывать прогностическую группу, которая будет соответствовать сумме баллов по шкале Глисона.
• Сумма баллов не более 6 — прогностическая группа I/V.
• Сумма баллов 3+4=7 — прогностическая группа II/V.
• Сумма баллов 4+3=7 — прогностическая группа III/V.
• Сумма баллов 8 (4+4/3+5/5+3) — прогностическая группа IV/V.
• Сумма баллов 9-10 (4+4/5+4/5+5) — прогностическая группа V/V.
Ниже представлена схема оценки первичной опухоли, согласно Международной классификации РПЖ по системе TNM, которая была дополнена и пересмотрена в 2010 г. (рис. 2.4), где Т1а — опухоль занимает ≤5% материала после ТУРП, T1b — >5% после ТУРП, T1e — опухоль выявлена при биопсии простаты, Т2а — опухоль занимает менее половины одной доли простаты, Т2Ь — одну долю простаты, Т2с — обе доли простаты, ТЗа — опухоль выходит за пределы капсулы простаты с одной или с обеих сторон либо определяется микроскопическая инвазия в шейку мочевого пузыря, ТЗЬ — определяется инвазия одного или обоих семенных пузырьков, Т4 — опухоль вовлекает окружающие структуры: стенку мочевого пузыря, наружный сфинктер уретры, прямую кишку, леваторы, мышцы тазового дна.
Дополнительный материал к лекции
ПСА при раке предстательной железы. Лекция для врачей
Диагностики рака предстательной железы
Купить книгу "Робот-ассистированная урология: национальное руководство" - Пушкарь Д. Ю.
Книга "Робот-ассистированная урология: национальное руководство"
Автор: Пушкарь Д. Ю.

Робот-ассистированная хирургия — молодое, стремительно развивающееся направление в современной медицине. Интеллектуальные технологии затрагивают все больше областей хирургической практики, и сегодня с уверенностью можно сказать, что робот-ассистированные технологии являются значимым прорывом, позволяющим оказывать наиболее качественную помощь пациентам в различных направлениях терапии. В настоящем руководстве не только представлена история развития данного направления, современные тенденции роботической урологии, но и раскрыто будущее этого перспективного метода.
Издание предназначено врачам различного профиля: урологам, хирургам, гинекологам и другим специалистам, также может использоваться в качестве учебного пособия для студентов медицинских вузов.
Купить книгу "Робот-ассистированная урология: национальное руководство" - Пушкарь Д. Ю.
Содержание книги "Робот-ассистированная урология: национальное руководство" - Пушкарь Д. Ю.
Часть I. Робот-ассистированная хирургия предстательной железы
Глава 1. История развития робот-ассистированной хирургии
Глава 2. Ранняя диагностика рака предстательной железы
Глава 3. Анатомические аспекты успешного выполнения функциональной робот-ассистированной радикальной простатэктомии
Глава 4. Различные техники выполнения робот-ассистированной радикальной простатэктомии
Глава 5. Робот-ассистированная тазовая лимфаденэктомия
Глава 6. Атлас трасперитонеальной робот-ассистированной радикальной простатэктомии
Глава 7. Особенности ассистенции при выполнении робот-ассиcтированной радикальной простатэктомии.
Опыт клиники урологии МГМСУ
Глава 8. Некоторые особенности анестезиологического пособия при выполнении роботической радикальной простатэктомии
Глава 9. Сальважная робот-ассистированная радикальная простатэктомия
Глава 10. Робот-ассистированная радикальная простатэктомия.
Сложные случаи
Глава 11. Робот-ассистированная радикальная простатэктомия у пациентов с раком предстательной железы высокого риска
Глава 12. Анатомия и физиология удержания мочи и эректильной функции
Глава 13. Сексуальная реабилитация пациентов после перенесенной робот-ассистированной радикальной простатэктомии
Глава 14. Удержание мочи и контролируемое мочеиспускание у пациентов после перенесенной робот-ассистированной радикальной простатэктомии
Глава 15. Онкологические и функциональные результаты радикальной простатэктомии
Глава 16. Гистоморфологические исследования до и после операции
Глава 17. Робот-ассистированная аденомэктомия (простатэктомия)
Часть II. Робот-ассистированная хирургия верхних мочевых путей
Глава 18. Робот-ассистированная адреналэктомия
Глава 19. Операции на почке. Сравнение робот-ассистированной и лапароскопической техники
Глава 20. Робот-ассистированная резекция почки
Глава 21. Робот-ассистированная нефруретерэктомия
Часть III. Робот-ассистированная радикальная цистэктомия
Глава 22. Робот-ассистированная радикальная цистэктомия
Глава 23. Робот-ассистированная расширенная лимфаденэктомия при раке мочевого пузыря
Глава 24. Робот-ассистированная радикальная цистэктомия с формированием механизма отведения мочи: осложнения и результаты
Глава 25. Сравнение робот-ассистированной и открытой техник выполнения радикальной цистэктомии
Часть IV. Робот-ассистированная реконструктивнопластическая хирургия
Глава 26. Робот-ассистированная сакрокольпопексия
Глава 27. Робот-ассистированная реимплантация мочеточника
Глава 28. Робот-ассистированная микрохирургия в урологии
Часть V. Роботическая программа
Глава 29. Создание успешной роботической программы
Глава 30. Некоторые вопросы обучения робот-ассистированной хирургии
Глава 31. Роботическая программа ГБУЗ «Московский клинический научный центр им. А.С. Логинова Департамента здравоохранения г. Москвы»
Глава 32. Робот-ассистированная хирургия
Перспективы и технологии
Глава 33. Нехирургические аспекты внедрения робот-ассистированной хирургии. Взгляд инженера
Купить книгу "Робот-ассистированная урология: национальное руководство" - Пушкарь Д. Ю.






















































































0 комментариев