ПСА при раке предстательной железы. Лекция для врачей
Лекция для врачей "ПСА при раке предстательной железы" (отрывок из книги "Робот- ассистированная урология: национальное руководство" - Пушкарь Д. Ю.)
Дополнительный материал к лекции
Диагностики рака предстательной железы
Ранняя диагностика рака предстательной железы
Современный взгляд на ПСА-скрининг рака предстательной железы
ПСА-скрининг имеет ряд положительных эффектов. У большинства мужчин уровень ПСА ниже порогового «нормального» значения. Скрининг может снизить риск развития метастатического рака простаты и смерти от этого заболевания у мужчин. Однако скрининг также может вызвать множество нежелательных эффектов, в том числе тревогу из-за повышенного значения ПСА и осложнений от проведенной в дальнейшем биопсии простаты, включая госпитализацию при инфекционных осложнениях или ректальном кровотечении. Одним из основных недостатков ПСА-скрининга является гипердиагностика, то есть выявление вялотекущего, медленно растущего рака простаты, который при отсутствии скрининга не был бы диагностирован в течение жизни. Рак предстательной железы с суммой баллов по шкале Глисона, равной 6, представляет собой опухоль низкой степени злокачественности, не требующей немедленного лечения. Рак простаты, при котором следует рассмотреть необходимость лечения, определяется степенью дифференцировки по системе градации Глисона ≥7. Гипердиагностика превращает здоровых мужчин в пациентов, что может существенно сказаться на психологическом благополучии и качестве их жизни. Во всем мире за последние два десятилетия большинство мужчин с раком простаты низкого риска подверглись хирургическому лечению и лучевой терапии. Такое чрезмерное лечение не приносит или почти не приносит пользы с точки зрения снижения показателей смертности, но приводит к важным и стойким побочным эффектам, в первую очередь к недержанию мочи и эректильной дисфункции. В последние годы произошел значительный сдвиг в алгоритмах лечения мужчин с раком простаты низкого риска. В настоящее время рекомендуется так называемое «активное наблюдение» в качестве первого варианта лечения, то есть тщательный мониторинг с повторными тестами и обследованиями и переход к активному лечению лишь при появлении признаков прогрессирования заболевания. Избегание чрезмерного лечения клинически не значимого рака простаты имеет решающее значение, так как активное хирургическое лечение, лучевая терапия или абляционная фокальная терапия могут оказать значительное влияние на качество жизни мужчин. Спустя много лет после радикальной простатэктомии или лучевой терапии по поводу РПЖ низкого риска у значительной части мужчин все еще сохраняется значительное ухудшение в одной или нескольких функциональных областях: сексуальной функции, функции мочеиспускания (недержание мочи) и кишечной функции. Ежегодный ПСА-скрининг мужчин в возрасте от 55 до 69 лет по сравнению с мужчинами того же возраста, не проходящих ПСА-скрининг, снижает продолжительность жизни на 23%, в первую очередь из-за ухудшения качества жизни от долгосрочных эффектов лечения. Несомненно, что многие из представленных выше тезисов являются спорными и находят многочисленную армию как противников, так и последователей. Исследования продолжаются, все более длительный период наблюдения за пациентами в масштабных исследованиях, инициированных более 15-20 лет назад, позволит сделать выводы, которые, возможно, наконец поставят точку в вопросе целесообразности обязательного ежегодного ПСА-скрининга. Единственное, в чем сегодня сомнений нет у большинства специалистов по всему миру, — это необходимость в ранней диагностике рака предстательной железы, ранней стратификации заболевания по степени риска и раннему лечению клинически значимых форм заболевания. В табл. 2.2 представлены современные рекомендации по ПСА-скринингу основных ведущих профессиональных ассоциаций США и Европы. Согласно текущим клиническим рекомендациям, необходимо совместное принятие решений до начала скрининга в возрастном диапазоне для скрининга от 45 до 70 лет. Есть некоторые незначительные различия в возрастных границах.
Важнейшими действующими лицами ПСА-скрининга являются врачи амбулаторного звена различных специальностей, далеко не всегда урологи. При этом для глубокого понимания целей и задач ПСА-скрининга им зачастую не хватает времени. Однако, учитывая важность данного звена, несомненным фактом остается необходимость в помощи указанным специалистам. Ряд публикаций посвящен разработке алгоритма работы с первичным пациентом врачами амбулаторного первичного звена. Данные алгоритмы построены на принципах «наименьшего вреда». Обобщая проанализированные работы, можно выделить следующие 7 шагов (этапов) работы с пациентом амбулаторными специалистами (табл. 2.3).
Таблица 2.2. Сводная таблица рекомендаций ПСА-скринингу рака предстательной железы
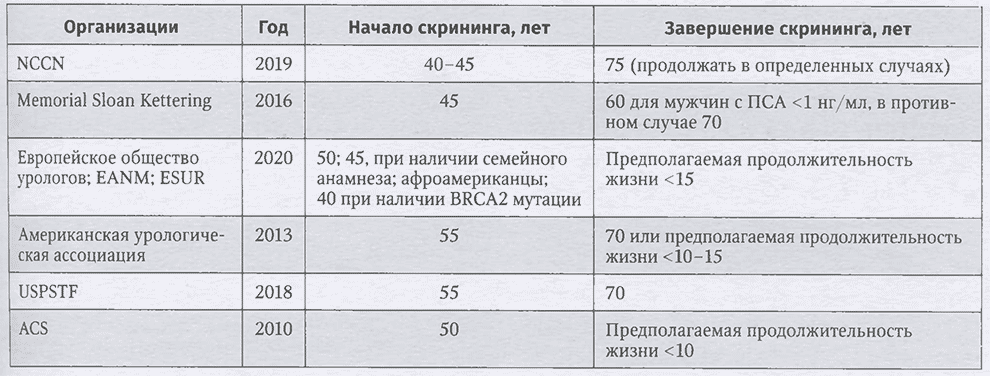
Таблица 2.3. Шаги (этапы) ПСА-скрининга рака предстательной железы для врачей первичного амбулаторного звена

Этап 1. Согласие пациента на скрининг рака предстательной железы
Несмотря на то что в нашей стране получение согласия на проведение ПСА-скрининга РПЖ не является обязательным, нам представляется разумным перенять эту часть программы у наших западных коллег и детально обговаривать предстоящие процедуры с пациентом. Скрининг РПЖ — это решение, которое имеет важные последствия. Целесообразно получить согласие пациентов при совместном принятии решения. Важнейший шаг — предупредить пациентов о том, что ПСА-скрининг может привести к выявлению РПЖ с низким риском и необходимости избегать агрессивного лечения в таких случаях. Важное значение имеет упор на активное наблюдение, как на оптимальную стратегию ведения РПЖ низкого риска.
Среди врачей первичного амбулаторного звена часто возникает вопрос, следует ли им более решительно поддерживать ПСА-скрининг для мужчин из групп повышенного риска (с семейным анамнезом или генетической предрасположенностью). Нет оснований полагать, что соотношение пользы и вреда при ПСА-скрининге варьирует в достаточной степени для групп повышенного риска, чтобы активно предлагать им ПСА-скрининг. Более того, попытки адаптировать ПСА-скрининг с учетом геномного риска, так называемые «шкалы полигенного риска», не показали клинических результатов для их применения в популяционном скрининге.
Этап 2. Отбор пациентов для скрининга рака предстательной железы (здоровые мужчины в возрасте от 45 до 70 лет)
Известно, что внедрение ПСА-скрининга привело к широкому распространению гипердиагностики. Менее признано, что гипердиагностика напрямую зависит от возраста пациента. Почти половина случаев гипердиагностики приходится на мужчин старше 70 лет. Что критически важно, ПСА-скрининг имеет сомнительную ценность для мужчин старше 70 лет: соотношение риска смертности от рака простаты для них, по данным ERSPC, составляет 1,18. Следовательно, прекращение скрининга в 70 лет будет иметь значительное влияние на снижение процента гипердиагностики, при этом не влияя на смертность. Обратите внимание, что прекращение скрининга означает: ПСА-тест обычно не рекомендуется бессимптомным мужчинам старше 70 лет с уровнем ПСА <3 нг/мл. Последующее наблюдение за мужчинами старше 70 лет с уровнем ПСА выше 3 нг/мл является вопросом клинической оценки, принимая во внимание возраст и общее состояние здоровья. Следует обратить внимание, что разумно прекратить ПСА-скрининг мужчинам до 70 лет, страдающим серьезными сопутствующими заболеваниями. Возраст на момент начала скрининга должен быть одинаковым практически для всех мужчин, так как ПСА является гораздо более сильным предиктором смертности от РПЖ, чем расовая принадлежность или семейный анамнез.
Этап 3. Частота и длительность скрининга
В клинических руководствах за рубежом можно встретить указание, что частота скрининговых манипуляций определяется уровнем ПСА и прекращается для мужчин старше 60 лет, если их уровень ПСА не выше среднего значения в 1 нг/мл.
Помимо всего прочего, при помощи ПСА возможно не только определить текущий риск РПЖ, но и прогнозировать дальнейшее развитие заболевания риска. Более того, поскольку рак простаты, как правило, прогрессирует медленно, интервалы скрининга можно безопасно увеличить для мужчин с низким уровнем ПСА. Имеются убедительные данные о том, что у мужчин с низким уровнем ПСА имеет место низкая вероятность развития агрессивного рака простаты в течение 8-10-летнего периода наблюдения. Для определения частоты скрининговых процедур удобно пользоваться внедренным «правилом светофора»:
• зеленый цвет (менее 1 нг/мл) — определяйте ПСА каждые 8-10 лет;
• желтый цвет (1-2,99 нг/мл) — определяйте ПСА каждые 2-4 года;
• красный цвет (≥3 нг/мл) — дальнейшее обследование.
До 90% случаев смерти от РПЖ к 85 годам приходится на мужчин, имевших в 60-тилетнем возрасте значение ПСА более 1 нг/мл. Также было показано, что мужчины с низким уровнем ПСА, которые продолжают проходить скрининг, имеют некоторый риск гипердиагностики, при этом не получают никакого преимущества в отношении показатели смертности. Учитывая данный факт, логично предположить, что мужчинам с уровнем ПСА ниже 1 нг/мл в возрасте 60 лет следует прекратить скрининг.
Этап 4. Повторное определение значения простат- специфического антигена
Временное повышение уровня ПСА, связанное с доброкачественными заболеваниями, — частое явление. В одной из опубликованных работ 44% мужчин с уровнем ПСА выше 4 нг/мл и 40% мужчин — выше 2,5 нг/мл вернулись к нормальному уровню ПСА в течение года. Исходя из этого представляется разумным рекомендовать повторное определение уровня ПСА через 4-6 нед после первого забора.
Этап 5. Дополнительное обследование до принятия решения о выполнении биопсии
Известно, что лишь сравнительно небольшое часть мужчин с умеренно повышенным уровнем ПСА будут иметь РПЖ высокого риска, который важно диагностировать. Как правило, на каждые 100 мужчин с уровнем ПСА более 3 нг/мл примерно 70; 20 и 10% будут иметь доброкачественное заболевание, РПЖ низкого риска (латентная форма) и заболевание высокого риска соответственно.
В настоящее время существует множество дополнительных диагностических методов (мпМРТ, биомаркеры РПЖ), позволяющих отбирать из общего числа мужчин с повышенным уровнем ПСА тех, кому следует выполнить биопсию простаты.
Некоторые из этих методов могут быть реализованы в учреждениях первичного амбулаторного звена.
Этап 6. Выбор медицинского учреждения (часть I)
Основным недостатком ПСА-скрининга является излишне агрессивное лечение с последующими функциональными осложнениями пациентов, которым могло бы быть предложено динамическое активное наблюдение. Мужчины с РПЖ низкого риска могут быть под активным наблюдением, которое включает мониторинг уровня ПСА, повторные биопсии через регулярные промежутки времени. Врач амбулаторного звена может выбирать клинический центр для направления пациента, учитывая в том числе данный довольно специфический факт.
Этап 7. Выбор медицинского учреждения (часть II)
Взаимосвязь опыта врача и эффективности проведенного лечения является одним из важнейших критериев оказания помощи онкологическим пациентам. Шанс излечения и вероятность побочных эффектов от проведенного лечения сильно коррелируют с опытом врача. В одном исследовании риск рецидива РПЖ был примерно вдвое ниже для больных, прооперированных хирургами, которые провели свыше 250 радикальных простатэктомий, по сравнению с пациентами, прооперированными хирургами, обладавшими опытом лишь 10 проведенных операций. Таким образом, врачи амбулаторного звена должны рекомендовать пациентам, которым требуется лечение от РПЖ, обращаться в крупные академические центры.
Дополнительный материал к лекции
Диагностики рака предстательной железы
Ранняя диагностика рака предстательной железы
Купить книгу "Робот- ассистированная урология: национальное руководство" - Пушкарь Д. Ю.
Книга "Робот-ассистированная урология: национальное руководство"
Автор: Пушкарь Д. Ю.

Робот- ассистированная хирургия — молодое, стремительно развивающееся направление в современной медицине. Интеллектуальные технологии затрагивают все больше областей хирургической практики, и сегодня с уверенностью можно сказать, что робот-ассистированные технологии являются значимым прорывом, позволяющим оказывать наиболее качественную помощь пациентам в различных направлениях терапии. В настоящем руководстве не только представлена история развития данного направления, современные тенденции роботической урологии, но и раскрыто будущее этого перспективного метода.
Издание предназначено врачам различного профиля: урологам, хирургам, гинекологам и другим специалистам, также может использоваться в качестве учебного пособия для студентов медицинских вузов.
Купить книгу "Робот- ассистированная урология: национальное руководство" - Пушкарь Д. Ю.
Содержание книги "Робот-ассистированная урология: национальное руководство" - Пушкарь Д. Ю.
Часть I. Робот-ассистированная хирургия предстательной железы
Глава 1. История развития робот-ассистированной хирургии
Глава 2. Ранняя диагностика рака предстательной железы
Глава 3. Анатомические аспекты успешного выполнения функциональной робот-ассистированной радикальной простатэктомии
Глава 4. Различные техники выполнения робот-ассистированной радикальной простатэктомии
Глава 5. Робот- ассистированная тазовая лимфаденэктомия
Глава 6. Атлас трасперитонеальной робот ассистированной радикальной простатэктомии
Глава 7. Особенности ассистенции при выполнении робот- ассистированной радикальной простатэктомии.
Опыт клиники урологии МГМСУ
Глава 8. Некоторые особенности анестезиологического пособия при выполнении роботической радикальной простатэктомии
Глава 9. Сальважная робот- ассистированная радикальная простатэктомия
Глава 10. Робот- ассистированная радикальная простатэктомия.
Сложные случаи
Глава 11. Робот- ассистированная радикальная простатэктомия у пациентов с раком предстательной железы высокого риска
Глава 12. Анатомия и физиология удержания мочи и эректильной функции
Глава 13. Сексуальная реабилитация пациентов после перенесенной робот-ассистированной радикальной простатэктомии
Глава 14. Удержание мочи и контролируемое мочеиспускание у пациентов после перенесенной робот ассистированной радикальной простатэктомии
Глава 15. Онкологические и функциональные результаты радикальной простатэктомии
Глава 16. Гистоморфологические исследования до и после операции
Глава 17. Робот- ассистированная аденомэктомия (простатэктомия)
Часть II. Робот- ассистированная хирургия верхних мочевых путей
Глава 18. Робот- ассистированная адреналэктомия
Глава 19. Операции на почке. Сравнение робот-ассистированной и лапароскопической техники
Глава 20. Робот- ассистированная резекция почки
Глава 21. Робот- ассистированная нефруретерэктомия
Часть III. Робот- ассистированная радикальная цистэктомия
Глава 22. Робот- ассистированная радикальная цистэктомия
Глава 23. Робот- ассистированная расширенная лимфаденэктомия при раке мочевого пузыря
Глава 24. Робот- ассистированная радикальная цистэктомия с формированием механизма отведения мочи: осложнения и результаты
Глава 25. Сравнение робот- ассистированной и открытой техник выполнения радикальной цистэктомии
Часть IV. Робот- ассистированная реконструктивнопластическая хирургия
Глава 26. Робот- ассистированная сакрокольпопексия
Глава 27. Робот- ассистированная реимплантация мочеточника
Глава 28. Робот- ассистированная микрохирургия в урологии
Часть V. Роботическая программа
Глава 29. Создание успешной роботической программы
Глава 30. Некоторые вопросы обучения робот- ассистированной хирургии
Глава 31. Роботическая программа ГБУЗ «Московский клинический научный центр им. А.С. Логинова Департамента здравоохранения г. Москвы»
Глава 32. Робот- ассистированная хирургия
Перспективы и технологии
Глава 33. Нехирургические аспекты внедрения робот-ассистированной хирургии. Взгляд инженера
Купить книгу "Робот- ассистированная урология: национальное руководство" - Пушкарь Д. Ю.






















































































0 комментариев