Патофизиологическая классификация тромбоцитопений
Лекция для врачей "Тромбоцитопеническая пурпура, болезнь Верльгофа, этиология, патогенез, клиника, лечение"
Тромбоцитопении и тромбоцитопатии
Тромбоцитопении - группа заболеваний, при которых наблюдается снижение количества тромбоцитов (норма 150х109/л) в связи с повышенным их разрушением или потреблением, а также недостаточным образованием. Повышенное разрушение тромбоцитов - наиболее частый механизм развития тромбоцитопении.
Классификация. Различают наследственные и приобретенные формы тромбоцитопении. При многих наследственных тромбоцитопениях наблюдают изменения различных свойств тромбоцитов, что позволяет рассматривать эти болезни в группе тромбоцитопатий (см. Тромбоцитопатии). Руководствуясь механизмом повреждения мегакариоцитов и тромбоцитов, приобретенные тромбоцитопении делят на иммунные и неиммунные. Среди иммунных тромбоцитопений различают аллоиммунные (несовместимость по одной из систем крови), трансиммунные (проникновение аутоантител матери, страдающей аутоиммунной тромбоцитопенией, через плаценту), гетероиммунные (нарушение антигенной структуры тромбоцитов) и аутоиммунные (выработка антител против собственных неизмененных антигенов тромбоцитов). В тех случаях, когда причину аутоагрессии против тромбоцитов выявить не удается, говорят об идиопатической аутоиммунной тромбоцитопении. Неиммунные тромбоцитопении могут быть обусловлены механической травмой тромбоцитов (при спленомегалии), угнетением пролиферации костномозговых клеток (при радиационном или химическом повреждении костного мозга, апластических анемиях), замещением костного мозга (разрастание опухолевых клеток), соматической мутацией (болезнь Маркиафавы-Микели), повышенным потреблением тромбоцитов (тромбоз - см. ДВС-синдром), недостатком витамина B12 или фолиевой кислоты (см. Анемии). Иммунные формы тромбоцитопении встречаются чаще неиммунных, причем среди первых наиболее часто наблюдается аутоиммуная форма, обычно у взрослых.
Патологическая анатомия. Для тромбоцитопении характерен геморрагический синдром с кровоизлияниями и кровотечениями. Кровоизлияния возникают чаще в коже в виде петехий и экхимозов, реже - в слизистых оболочках, еще реже - в паренхиме внутренних органов (например, кровоизлияние в мозг). Кровотечения возможны как желудочные и кишечные, так и легочные. Нередко отмечается увеличение селезенки в результате гиперплазии ее лимфоидной ткани, увеличение количества мегакариоцитов в костном мозге. Отдельные формы тромбоцитопении имеют свои морфологические особенности. Например, при некоторых аутоиммунных тромбоцитопениях наблюдается увеличение лимфатических узлов (лимфоаденопатия) и размеров тромбоцитов, а увеличение селезенки отсутствует. Геморрагии при тромбоцитопении могут приводить к развитию анемии (см. Анемии).
Тромбоцитопатии - большая группа заболеваний и синдромов, в основе которых лежат нарушения гемостаза, обусловленные качественной неполноценностью или дисфункцией тромбоцитов. По сути своей - это группа геморрагических диатезов с геморрагическими проявлениями на уровне сосудов микроциркуляции.
Классификация. Тромбоцитопатии делят на наследственные и приобретенные. Среди наследственных тромбоцитопатии выделяют ряд форм, руководствуясь типом дисфункции, морфологических изменений и биохимических нарушений тромбоцитов. Многие из этих форм рассматриваются как самостоятельные болезни или синдромы (например, тромбастения Гланцмана, связанная с мембранными аномалиями тромбоцитов; синдром Чедиака-Хигаси, развивающийся при недостатке в тромбоцитах плотных телец I типа и их компонентов).
Приобретенные тромбоцитопатии развиваются при разнообразных патогенных воздействиях и встречаются при многих болезнях и синдромах. Выделяют тромбоцитопатии: 1) при гемобластозах; 2) при миелопролиферативных заболеваниях и эссенциальной тромбоцитемии; 3) при В12-дефицитной анемии; 4) при циррозах, опухолях и паразитарных заболеваниях печени; 5) при гормональных нарушениях (гипотиреоз, гипоэстрогении); 6) при цинге; 7) при лучевой болезни; 8) при ДВС-синдроме и активации фибринолиза; 9) при массивных гемотрансфузиях; 10) лекарственные и токсические (при лечении нестероидными противовоспалительными препаратами, ацетилсалициловой кислотой, бруфеном, индометацином, некоторыми антибиотиками, транквилизаторами и др.; при алкоголизме).
Патологическая анатомия. Характеристика тромбоцитопатии сводится к морфологическим проявлениям геморрагического синдрома. При этом следует иметь в виду, что тромбоцитопатии могут протекать с более или менее выраженной тромбоцитопенией.
При решении вопроса о приоритетности тромбоцитопатии или тромбоцитопении в диагнозе следует руководствоваться следующими положениями (Баркаган З.С, 1985): 1) к тромбоцитопатиям относят все формы, при которых выявляются стабильные функциональные, морфологические и биохимические нарушения тромбоцитов, не исчезающие при нормализации их количества в крови; 2) для тромбоцитопатии характерно несоответствие выраженности геморрагического синдрома степени тромбоцитопении; 3) генетически обусловленные формы патологии тромбоцитов в подавляющем большинстве случаев относятся к тромбоцитопатиям, особенно если они сочетаются с другими наследственными дефектами; 4) тромбоцитопатию следует считать вторичной, если качественный дефект тромбоцитов непостоянен, ослабляется или полностью исчезает после ликвидации тромбоцитопении.
Идиопатическая тромбоцитопеническая пурпура довольно часто является причиной развития геморрагического синдрома у детей и подростков. И педиатру в короткие сроки необходимо найти ответ на вопросы: почему он возник? Каков механизм его развития? И главный вопрос: что делать?
Авторы: О.С. Третьякова Национальная медицинская академия последипломного образования им. П.Л. Шупика
Идиопатическая тромбоцитопеническая пурпура (ИТП), или болезнь Верльгофа (ранее — геморрагическая тромбоцитопения), — одно из первых идентифицированных геморрагических заболеваний человека. Впервые описано в 1735 году, еще задолго до того, как были обнаружены сами тромбоциты, ганноверским врачом Верльгофом. Причиной кровоточивости почти в 80 % случаев являются патологические изменения тромбоцитов (их функциональная несостоятельность и/или количественный дефицит). При этом лидирующая позиция в структуре патологии этих форменных элементов принадлежит количественному дефекту кровяных пластинок.
Термин «тромбоцитопения» подразумевает снижение количества тромбоцитов в периферической крови менее 150 х 10 9 /л. Процесс считается идиопатическим, если причину его выявить не удается. Примерно 95 % случаев всех тромбоцитопений (по данным Американского общества гематологов, 1996) относятся именно к этой группе. Понятие «пурпура» (лат. purpura — краска темно-багрового цвета) предусматривает наличие капиллярных геморрагий, точечных кровоизлияний и экхимозов.
Заболеваемость ИТП составляет 1,5–2,0 на 100 тыс. детского населения. Частота ИТП достигает 125 на 1 млн детского и взрослого населения в год.
Заболевание может возникать в любом возрасте, но чаще развивается в преддошкольном и школьном периоде. После 10-летнего возраста прослеживается отчетливое преобладание девочек, которые болеют в 2 раза чаще мальчиков.
Этиопатогенез
Итак, почему же возник геморрагический синдром?
Развитие ИТП может быть спровоцировано воздействием ряда факторов, которые нельзя однозначно назвать этиологическими. Действие провоцирующих факторов реализуется на фоне конституциональной предрасположенности организма. В роли провоцирующих факторов могут выступать вирусы, реже бактериальные агенты, профилактические прививки, лекарственные препараты, избыточная инсоляция, переохлаждение, физические и психические травмы, операции и т.д. Время с момента воздействия провоцирующих факторов до развития пурпуры в среднем составляет 2 недели. Однако примерно у трети больных ИТП начинается без видимой причины.
Механизм развития тромбоцитопении при ИТП заключается в повышенной деструкции тромбоцитов в периферическом русле. Причем степень развития тромбоцитопении определяется как скоростью разрушения кровяных пластинок, так и компенсаторными возможностями костного мозга. Динамическое равновесие этих двух процессов обеспечивает нормальное содержание тромбоцитов в периферической крови. Сдвиг в сторону ускорения процессов разрушения приводит к развитию тромбоцитопении.
Повышенное разрушение тромбоцитов при болезни Верльгофа вызвано реализацией иммунопатологического процесса. В настоящее время иммунный генез ИТП общепризнан, что подтверждается обнаружением антитромбоцитарных антител (АТ), высоким содержанием IgG на поверхности тромбоцитов, обнаружением лимфоцитов, сенсибилизированных к аутотромбоцитам, в крови больных. Пусковым моментом иммунопатологического процесса при ИТП является нарушение переваривающей способности макрофагов селезенки под влиянием провоцирующих факторов, приводящее к снижению нормальной дезинтеграции тромбоцитов в них. При этом на поверхность макрофагов поступают тромбоцитарные антигены, в норме на ней не появляющиеся, что приводит к контакту с лимфоцитами «скрытых» ранее от них тромбоцитарных антигенов.
Продолжительность жизни тромбоцитов при ИТП резко сокращается: с 7–10 дней до нескольких часов. Продукция же их в костном мозге остается нормальной или даже возрастает (гиперрегенераторная тромбоцитопения). Отшнуровка тромбоцитов от мегакариоцитов происходит гораздо быстрее, чем в физиологических условиях, однако при ИТП создается ошибочное впечатление о нарушении этого процесса. В большинстве случаев количество мегакариоцитов при тромбоцитопении увеличивается, резко ускоряется отщепление кровяных пластинок от них, значительно возрастает (в 2–6 раз по сравнению с нормой) число тромбоцитов, образующихся в единицу времени. Увеличение числа мегакариоцитов и гиперпродукция тромбоцитов связаны с ростом выработки тромбопоэтинов в ответ на снижение количества кровяных пластинок. Так как антитела могут быть направлены и против мегакариоцитов, то в такой ситуации этот росток представляется опустошенным (гипорегенераторная тромбоцитопения).
Роль селезенки в развитии ИТП не ограничивается нарушением переваривающей способности ее макрофагов, что играет роль пускового механизма в развитии иммунопатологического процесса при воздействии провоцирующих факторов. Помимо этого селезенка является местом продукции антитромбоцитарных антител, вырабатывающихся селезеночным пулом лимфоцитов, а также органом, где происходит деструкция тромбоцитов и поглощение их макрофагами. При ИТП создается порочный круг: с одной стороны, внутрисосудистый лизис тромбоцитов под влиянием антитромбоцитарных АТ наряду с их усиленной деструкцией в селезенке приводит к компенсаторной активации тромбоцитопоэза, в то время как гибель кровяных пластинок, на поверхности которых содержатся иммуноглобулины, приводит к активации В-лимфоцитов, в результате чего стимулируется выработка антитромбоцитарных антител, которые вновь вызывают разрушение оставшихся в кровотоке кровяных пластинок. Тромбоциты же, загруженные иммунными комплексами, фагоцитируются макрофагами и нейтрофилами. Последние выделяют фактор, активирующий тромбоциты (FAT). Действие этого фактора приводит к усилению агрегационной функции и секреторных процессов тромбоцитов, оставшихся в кровотоке, что вызывает снижение их функциональных свойств, т.е. к количественному дефекту тромбоцитов присоединяется и качественный — развивается тромбоцитопатия.
Получив ответ на вопрос о причинах развития геморрагического синдрома при ИТП, врачу предстоит ответить на следующий: каков же механизм его развития?
Развитие геморрагического синдрома при болезни Верльгофа преимущественно обусловлено нарушением ангиотрофической функции тромбоцитов. Известно, что компенсаторные возможности детского организма чрезвычайно высоки. Свидетельством этого является тот факт, что трофику сосудов поддерживают всего лишь 10–15 % циркулирующих в кровотоке тромбоцитов. Именно этого количества кровяных пластинок, а это 15–30 х 109/л тромбоцитов, достаточно для поддержания трофики сосудов и эффективного гемостаза. При тяжелой тромбоцитопении сосудистый эндотелий, лишенный тромбоцитарной подкормки, становится порозным, повышенно проницаемым, что приводит к возникновению спонтанных геморрагий. Наряду с нарушением ангиотрофической функции кровяных пластинок имеет место нарушение процессов свертывания (снижение потребления протромбина, нарушение ретракции кровяного сгустка) и активация системы фибринолиза. Вследствие тромбоцитопении и тромбоцитопатии при ИТП снижается содержание серотонина, секретируемого кровяными пластинками, физиологическая роль которого заключается в обеспечении вазоконстрикции мелких сосудов. Его дефицит в определенной мере поддерживает кровоточивость при небольших травмах.
В большинстве случаев геморрагический синдром в виде проявлений на коже и слизистых манифестирует при снижении числа кровяных пластинок в периферической крови менее 30–50 х 109/л. Кровоточивость же возникает достаточно поздно, обычно при снижении числа тромбоцитов менее 20–30 х 109/л. Серьезное спонтанное кровотечение (например, желудочно-кишечное) или геморрагический инсульт развиваются, как правило, при тромбоцитопении менее 10 х 109/л. Поэтому тромбоцитопения во врачебной практике довольно часто встречается в качестве лабораторного феномена и является случайной находкой, так как клинически при уровне тромбоцитов более 50 х 109/л практически себя не проявляет. Необходимо помнить, что наличие геморрагического синдрома при количестве тромбоцитов более 70 х 109/л требует исключения их качественного дефекта.
Классификация
Формы:
— гетероиммунная. Эта форма возникает при изменении антигенной структуры кровяных пластинок под влиянием различных воздействий (вирусов, новых антигенов, гаптенов). Имеет благоприятный прогноз: по окончании действия причинного фактора тромбоциты восстанавливают свои антигенные свойства и выработка антител прекращается. Имеет острое течение. У детей чаще развивается именно эта форма тромбоцитопенической пурпуры;
— аутоиммунная. Эта форма развивается в результате действия на тромбоциты аутоантител, вырабатывающихся против собственных неизмененных кровяных пластинок, мегакариоцитов, а также антигена общего предшественника тромбоцитов, эритроцитов, лейкоцитов — стволовой клетки. Имеет хроническое, рецидивирующее течение. Начальные пусковые звенья выработки аутоантител остаются неясными.
По течению:
1) острое (до 6 мес.);
2) хроническое (более 6 мес.):
— с рецидивами (редкими, частыми);
— непрерывно рецидивирующее.
По периодам:
1) обострения (криз);
2) ремиссии:
— клинические (отсутствие геморрагий при наличии лабораторной тромбоцитопении);
— клинико-гематологические (отсутствие клинических и лабораторных проявлений тромбоцитопении).
По тяжести:
1) легкая (кожный синдром);
2) средней тяжести (умеренно выраженный геморрагический синдром в виде кожных проявлений и кровотечений, количество тромбоцитов 50–100 х 10 9 /л);
3) тяжелая (длительные и обильные кровотечения, кожные проявления, количество тромбоцитов менее 30–50 х 109/л, постгеморрагическая анемия).
Выделение таких форм несколько условно, так как степень тромбоцитопении не всегда соответствует степени кровоточивости. Клинический интерес представляет классификация, предложенная W. Grosby (1975), подразделяющая пурпуру в зависимости от отсутствия или наличия кровотечения на «сухую» и «влажную», что соответствует легкой и среднетяжелой либо тяжелой формам ИТП.
Клиника
Заболевание у детей в большинстве случаев начинается остро, с выраженных клинических проявлений, чаще через 2 недели после воздействия провоцирующего фактора. Но у части больных (примерно у половины пациентов с хроническим течением) ИТП начинается исподволь. Причем первые признаки заболевания довольно часто остаются незамеченными либо объясняются травматизацией, так как дети физически очень активны и легко травмируются. Незамеченной остается неадекватность геморрагий перенесенному механическому воздействию. И только в последующем, при манифестации клинических проявлений заболевания, тщательный сбор анамнеза позволяет выявить наличие первых признаков заболевания в более ранние периоды жизни ребенка и их неадекватность травме.
Клинически ИТП проявляет себя кожным геморрагическим синдромом и кровотечениями из микроциркуляторного русла.
Кожный геморрагический синдром представлен экхимозами и петехиями. Для него характерны те же признаки, что и для геморрагического синдрома, возникающего при тромбоцитопениях иного генеза: спонтанность, несимметричность, полиморфность и полихромность.
Геморрагии возникают спонтанно (преимущественно ночью) или под влиянием легких ушибов, сдавлений. Они несимметричны, излюбленной локализации в отличие от геморрагического васкулита не имеют. Однако несколько чаще располагаются на конечностях и передней поверхности туловища (большая травматизация этих зон), а также на лбу (близость костных образований). Довольно часто геморрагии возникают в местах инъекций. Геморрагии не возникают на ладонях, подошвах. Кровоизлияния в слизистые оболочки отмечаются примерно у 2/3 больных. Это прежде всего слизистые ротовой полости (неба, глотки, миндалин), глаз (конъюнктива, склеры). Описаны кровоизлияния в стекловидное тело, сетчатку. Наличие геморрагий в области головы, особенно орбиты глаза, рассматривается как прогностически неблагоприятный признак, свидетельствующий о тяжести состояния и указывающий на высокий риск развития кровоизлияний в головной мозг.
Геморрагии при ИТП полиморфны, имеют характер петехий и экхимозов различных размеров (от 0,5 до 10 см и более в диаметре) и форм. Так как геморрагический синдром склонен к рецидивированию, то имеет место полихромность, обусловленная наличием геморрагий, находящихся на различных стадиях обратного развития: элементы в зависимости от давности их появления имеют разную окраску — от ярких пурпурных до сине-зеленых и желтых. Кожа больного приобретает сходство со шкурой леопарда — «шагреневая кожа». Обращает на себя внимание неадекватность геморрагий степени внешнего механического воздействия.
Кровотечения из микроциркуляторного русла . Как правило, кровотечения развиваются параллельно кожному геморрагическому синдрому. Наиболее типичны спонтанные носовые кровотечения, нередко упорные, обильные, рецидивирующие. Возможно также развитие десневых, маточных, реже желудочно-кишечных, почечных кровотечений. Иногда заболевание сопровождается минимальными проявлениями в виде кровоточивости десен.
Нередко заболевание проявляет себя длительным кровотечением после удаления зубов. Оно начинается сразу же после вмешательства, длительно (несколько часов, реже день) не купируется, однако после остановки, как правило, не возобновляется, чем и отличается от кровотечения при коагулопатиях, в частности гемофилии.
В тяжелых случаях возможны кровоизлияния в головной мозг, другие жизненно важные органы (в том числе и надпочечники), что может служить непосредственной причиной смерти. Частота их колеблется в пределах 1–3 %. Кровоизлияния в головной мозг развиваются у больных с «влажной» пурпурой, как правило, в первый месяц заболевания. Симптоматика кровоизлияния в головной мозг не является специфичной: головная боль, головокружение, рвота, судороги, менингеальный симптомокомплекс, коматозное состояние или сопор, гемипарезы, параличи. При этом число тромбоцитов у больных, как правило, не превышает 10 х 109/л.
У девочек пубертатного периода при ИТП менструации обильные, длительные (до 2–5 недель), нередко приводящие к анемизации, в тяжелых случаях возможно развитие длительных ювенильных маточных кровотечений, требующих активной лечебной тактики.
За исключением признаков повышенной кровоточивости, состояние больного с ИТП не страдает. Отсутствуют симптомы интоксикации, температура тела нормальная, лимфатические узлы не увеличены. При развитии постгеморрагической анемии могут появиться соответствующие жалобы и изменения со стороны сердечно-сосудистой системы. Эти нарушения быстро нормализуются после ликвидации анемии.
Отличительным признаком болезни Верльгофа от вторичных тромбоцитопений является отсутствие гепатоспленомегалии. Лишь у 10 % детей раннего возраста, больных ИТП, возможно незначительное увеличение (на 1–2 см) селезенки.
При гетероиммунной форме ИТП, для которой характерно острое течение, геморрагический синдром обычно удается купировать в течение месяца с довольно быстрой обратной динамикой клинических симптомов. Выздоровление нередко наступает уже через 2–3 месяца. Однако первые клинические проявления заболевания не позволяют отнести конкретный случай ИТП к определенной форме. По дебюту заболевания предсказать дальнейшее его течение трудно. Болезнь начинается остро и бурно не только во всех случаях гетероиммунной тромбоцитопении. Такое же начало отмечается примерно у половины больных аутоиммунной тромбоцитопенией. Однако при этой форме болезнь может начинаться и исподволь, постепенно, без выраженных острых клинических проявлений и, как правило, без видимой причины. Первый криз может принимать затяжной характер и, несмотря на проводимую терапию, клинико-лабораторные проявления могут удерживаться длительно. Иногда на фоне лечения глюкокортикоидами признаки болезни исчезают, число тромбоцитов нормализуется. Однако после их отмены (а в некоторых случаях на фоне снижения дозы кортикостероидов) или после какой-либо инфекции (провокации) вновь наступает обострение, заболевание принимает хроническое волнообразное течение, когда периоды улучшения вновь сменяются периодами обострения, и затягивается на многие годы. Получить полную клинико-гематологическую ремиссию при аутоиммунной форме бывает очень трудно.
Факторами риска хронического течения ИТП по Н.П. Шабалову (1998) являются:
— наличие указаний в анамнезе на частую упорную кровоточивость, наблюдаемую ранее чем за полгода до криза, по которому поставлен диагноз ИТП;
— отсутствие связи развития криза с действием какого-либо провоцирующего фактора;
— наличие у больного хронических очагов инфекции;
— лимфоцитарная реакция костного мозга (число лимфоцитов более 13 %);
— низкое содержание Т2 — лимфоцитов-супрессоров в периферической крови до начала гормональной терапии;
— выраженные упорные кровотечения в сочетании с генерализованной пурпурой на фоне проводимой терапии;
— возникновение ИТП у девушек в пубертатном возрасте.
Диагностика ИТП базируется на адекватной оценке жалоб, анамнеза, клинических проявлений, положительных результатов проб на резистентность капилляров (жгута, щипка, Кончаловского — Румпель — Лееде), изменений лабораторных показателей: снижение количества тромбоцитов периферической крови менее 150 х 10 9 /л, увеличение длительности кровотечения по Дюке более 4 мин, снижение ретракции кровяного сгустка менее 60–75 %, увеличение содержания мегакариоцитов в костном мозге более 54–114 в 1 мкл (либо снижение при длительно текущих кризах), обнаружение антитромбоцитарных антител, нарушение функциональных свойств тромбоцитов (снижение адгезии, нарушение агрегации к АДФ, тромбину, коллагену), увеличение размеров кровяных пластинок, их пойкилоцитоз, появление малозернистых «голубых» клеток.
Все же главным лабораторным признаком ИТП является тромбоцитопения. Однако для постановки диагноза и начала терапии однократного лабораторного выявления тромбоцитопении недостаточно. Необходимо проведение повторного (на протяжении недели с интервалом в 2–3 дня) исследования периферической крови с определением числа кровяных пластинок и обязательным изучением формулы крови. Общий анализ крови при ИТП практически не изменен. Однако в случаях обильных кровопотерь в анализе периферической крови выявляются признаки постгеморрагической анемии и ретикулоцитоз.
Выявление провоцирующего инфекционного фактора (в случаях гетероиммунных форм тромбоцитопении) базируется на обнаружении диагностически значимого повышения титра антител к тому или иному возбудителю (довольно часто к цитомегаловирусу, вирусу Эпштейна — Барр, парвовирусу В19, вирусам краснухи, кори, ветряной оспы и др.).
Дифференциальная диагностика
Во всех случаях подозрения на ИТП необходимо исключить вторичные (симптоматические) формы тромбоцитопений (табл. 1), а также тромбоцитопатии, геморрагический васкулит и т.д.
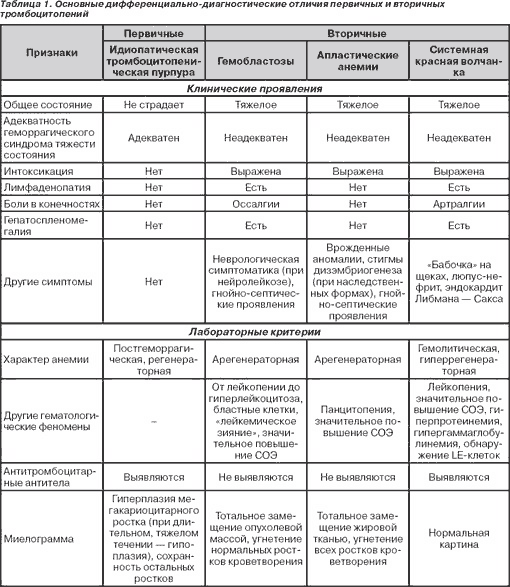
При геморрагическом васкулите (ГВ) кожный геморрагический синдром представлен петехиями, имеющими склонность к слиянию, располагающимися симметрично, имеющими излюбленную локализацию (разгибательные поверхности верхних и нижних конечностей, ягодицы). Помимо кожных проявлений, при ГВ довольно часто развивается поражение суставов (суставной синдром), желудочно-кишечного тракта (абдоминальный синдром), почек (почечный синдром). При этом страдает общее состояние ребенка: развиваются интоксикационный, болевой абдоминальный синдромы. Для ГВ характерны укорочение времени свертывания по Ли — Уайту, свидетельствующее о гиперкоагуляции, при нормальной длительности кровотечения, лейкоцитоз со сдвигом формулы влево, умеренное повышение СОЭ, диспротеинемия со значительной гипопротеинемией, гипоальбуминемией, увеличением α1-, β2-, β-глобулинов, повышение уровня гликопротеидов, положительный СРП, повышение уровня ЦИК.
Симптоматические тромбоцитопении развиваются при многих заболеваниях, в том числе при системной красной волчанке, гемобластозах, апластических анемиях, ДВС-синдроме, иммунодефицитных состояниях, хроническом гепатите, гемолитико-уремическом синдроме, инфекционных заболеваниях (сепсисе, ВИЧ- и ТОRCH-инфекциях, малярии и др.), перинатальной гипоксии и т.д. Клиническая картина при вторичных тромбоцитопениях обусловлена прежде всего течением основного заболевания. Практически при всех симптоматических тромбоцитопениях страдает общее состояние больного: выражен интоксикационный синдром, тяжесть состояния неадекватна геморрагическому синдрому, в патологический процесс вовлекаются внутренние органы и т.д. Так, при системной красной волчанке выявляются гепатоспленомегалия, лимфаденопатия, гиперкератоз, люпус-нефрит, эндокардит Либмана — Сакса, при лабораторном исследовании регистрируются лейкопения, значительное повышение СОЭ, гиперпротеинемия, гипергаммаглобулинемия, обнаруживаются LE-клетки. Апластические анемии помимо интоксикационного синдрома, геморрагических проявлений, присоединения гнойно-воспалительных процессов сопровождаются панцитопенией, резким повышением СОЭ. При наследственно обусловленных апластических анемиях регистрируются врожденные аномалии и/или стигмы дизэмбриогенеза. Течение лейкемии сопровождается гепатоспленомегалией, болями в костях (оссалгиями), лимфаденопатией, проявлениями нейролейкоза, наслоением гнойно-септических процессов, в периферической крови регистрируются лейкоцитоз за счет появления бластных клеток, «лейкемическое зияние», значительное повышение СОЭ.
Оценка состояния костного мозга — весьма важный этап в исключении вторичности тромбоцитопении и выборе тактики ее лечения. Так, при первичной тромбоцитопении регистрируется гиперплазия мегакариоцитарного ростка на фоне сохранных других ростков кроветворения. Однако при длительно текущем процессе, особенно аутоиммунной форме заболевания, может развиться истощение мегакариоцитарного ростка. В то же время при апластических анемиях выявляется гипоплазия (аплазия) костного мозга за счет вытеснения нормальных ростков кроветворения жировой тканью. В миелограмме при лейкемии регистрируется увеличение числа бластных клеток более 30 %, угнетение эритроидного и мегакариоцитарного ростков кроветворения с последующим вытеснением их опухолевой массой.
Имеются различия и в характере анемии при вторичных тромбоцитопениях. Ее возникновение при системной красной волчанке и гемолитико-уремическом синдроме обусловлено гемолизом, при гемобластозах и апластических анемиях — гипоплазией эритроидного ростка, при идиопатической тромбоцитопенической пурпуре — исключительно кровопотерей.
Тромбоцитопения как симптом может наблюдаться при инфекционных и гнойно-воспалительных заболеваниях, особенно у новорожденных и детей раннего возраста. Примечательно, что около 37 % новорожденных, заболевших в пери- либо неонатальном периоде, имеют лабораторно подтвержденную тромбоцитопению и у половины из них она сопровождается геморрагическим синдромом. Причем на долю тромбоцитопений, развивающихся на фоне инфекционно-воспалительных заболеваний, приходится около 65 % всех тромбоцитопений неонатального периода. Однако следует помнить, что на первый план, как и при всех вторичных тромбоцитопениях, выступают симптомы основного заболевания.
При проведении дифференциальной диагностики следует помнить, что развитие тромбоцитопении может быть вызвано не только воздействием внешних факторов, но и генетической детерминированностью.
Синдром Бернара — Сулье (синдром гигантских тромбоцитов) — врожденная тромбоцитопатия, сопровождающаяся кровоизлияниями в кожу, слизистые оболочки, внутренние органы, развитием носовых кровотечений. Помимо тромбоцитопении характерно наличие гигантских (напоминающих лимфоциты) тромбоцитов, увеличение времени свертывания. В тромбоцитах отсутствует гликопротеин, отвечающий за взаимодействие между фактором Виллебранда и мембраной тромбоцита, что приводит к нарушению адгезии кровяных пластинок к коллагену.
При уменьшении числа тромбоцитов у мальчиков в первые дни и месяцы жизни следует исключить возможность генетически обусловленной тромбоцитопении (синдром Вискотта — Олдрича), наследуемой по рецессивному типу, сцепленному с Х-хромосомой. Заболевание проявляется в виде экзематозных высыпаний на коже, повышенной кровоточивости, кровоизлияний во внутренние органы, повторных гнойных инфекций (чаще в виде гнойных отитов по причине иммунодефицита), спленомегалии. При синдроме Вискотта — Олдрича отмечается врожденный дефект тромбоцитов, что предопределяет их повышенную разрушаемость. В крови больных обнаруживается много мелких кровяных пластинок. Диагностическое значение имеет низкий уровень IgM, повышение уровня IgА и gЕ, нормальное или повышенное содержание IgG, нарушение агрегации тромбоцитов, лимфопения.
Синдром серых тромбоцитов (недостаточность α-гранул) характеризуется увеличением размеров тромбоцитов, их серой окраской, снижением количества a -гранул и тромбоцитспецифических белков этих же гранул. При тромбастении Гланцмана нарушена агрегационная функция тромбоцитов. Синдром семьи Фехтнер сопровождается макротромбоцитопенией, включениями в лейкоцитах, нефритом, глухотой. Для синдрома Чедиака — Хигаши характерно сочетание тромбоцитопении с дефектами пигментации волос, кожи, сетчатки глаза. У больных с ТАР-синдромом отсутствует радиальная кость, выявляется также тромбоцитопатия.
Для синдрома Мая — Хегглина характерна макротромбоцитопения, наличие крупных базофильных включений в нейтрофилах и эозинофилах (тельца Деле). При синдроме Эпстайна выявляется макротромбоцитопения в сочетании с синдромом Альпорта.
При синдроме Мошковица (тромботической тромбоцитопенической пурпуре) отмечается острое начало, геморрагический синдром вследствие тромбоцитопении потребления, лихорадка с ознобом, микроангиопатическая гемолитическая анемия, нарушение функции почек, ЦНС, ССС. Характерна неврологическая симптоматика: нарушения сознания, расстройства чувствительности, двигательные нарушения вплоть до судорог, комы. Механизм развития тромботической тромбоцитопенической пурпуры связан с наличием субстанций, влияющих на функцию эндотелия. Последний освобождает значительное количество мультимерных форм фактора Виллебранда, который разрушается до фрагментов, способных вызывать агрегацию тромбоцитов. Это приводит к образованию множественных тромбов в мелких артериолах и капиллярном русле. Причем тромбы практически полностью состоят из тромбоцитов, количество фибрина в них незначительное. Именно тромботические проявления обусловливают клинические проявления заболевания.
Однако, проводя дифференциальную диагностику, следует помнить, что подавляющую часть всех тромбоцитопений все-таки составляют приобретенные формы.
Диагноз ИТП — это диагноз исключения. Для его постановки необходимо отвергнуть все заболевания, сопровождающиеся развитием вторичной, симптоматической тромбоцитопении.
Таким образом, профессиональный подход к оценке клинической ситуации, трактовке данных дополнительных методов исследования, верификация диагноза с последующим выбором адекватной лечебной тактики являются залогом успешной борьбы не только с геморрагическим синдромом, но и с заболеванием, приведшим к его возникновению.
Современные подходы к диагностике и лечению тромбоцитопений новорожденных
Авторы: О.С. Третьякова Национальная медицинская академия последипломного образования им. П.Л. Шупика,
Тромбоцитопения — состояние, при котором количество тромбоцитов периферической крови снижено менее 150 х 109/л. В тоже время этим термином обозначается группа заболеваний и синдромов, объединенных общим признаком — наличием геморрагического синдрома, развивающегося в результате снижения числа кровяных пластинок в периферической крови ниже этой минимальной границы. Тромбоцитопения является очень частым гематологическим синдромом в периоде новорожденности. Частота тромбоцитопений у детей этого возраста составляет около 25%, большая часть из них носит вторичный характер. Так, 37% новорожденных, заболевших в пери- либо неонатальном периоде жизни, имеют лабораторно подтвержденную тромбоцитопению, причем у половины из них она сопровождается геморрагическим синдромом. Основными причинами, приводящими к тромбоцитопении в этом возрасте, являются инфекционно-воспалительные заболевания (64,8%), перинатальная гипоксия (14,0%), внутриутробные инфекции, в особенности вирусные (7,0%), иммунные формы (6,0%). Механизмы развития тромбоцитопений в неонатальном возрасте
1. Повышенное разрушение тромбоцитов вследствие:
а) иммунных механизмов: — изоиммунная тромбоцитопеническая пурпура (развитие заболевания связано с наличием иммунологического конфликта, обусловленного несовместимостью плода и матери по тромбоцитарным антигенам (чаще всего по PLA1-антигенам). Изосенсибилизация может быть как при повторной, так и при первой беременности. Встречается с частотой 1 случай на 5-10 тыс. новорожденных; — аллоиммунная форма возникает при несовместимости по одной из групповых систем крови, трансфузии ребенку чужих тромбоцитов при наличии к ним антител, проникновении антител к ребенку от матери, предварительно иммунизированной антигеном, отсутствующим у нее, но имеющимся у ребенка. Частота неонатальной алоиммунной тромбоцитопении составляет 1 случай на 2 тыс. новорожденных; — трансиммунная тромбоцитопеническая пурпура развивается у 30-50-75% детей, родившихся от матерей, страдающих аутоиммунной тромбоцитопенией (идиопатической тромбоцитопенической пурпурой, системной красной волчанкой, аутоиммунным тиреоидитом, синдромом Эванса и др.). Материнские аутоантитела проникают через плаценту и вызывают разрушение тромбоцитов плода. Эта форма развивается в период новонарожденности и имеет благоприятный исход, так как после рождения ребенка проникновение антител от матери к ребенку прекращается, что обеспечивает циркуляцию в крови нормального числа тромбоцитов;
б) механического разрушения (синдром Казабаха — Мерритта и пр.).
2. Повышенное потребление (ДВС-синдром, синдром Казабаха — Мерритта, тромбозы, искусственная вентиляция легких, гемолитико-уремический синдром и пр.). Так синдром Казабаха — Мерритта развивается в результате расходования тромбоцитов, фибриногена и других факторов свертывания крови на повышенное тромбообразование в крупных гемангиомах.
3. Недостаточная продукция — а(гипо)мегакариоцитозы. Среди них выделяют: — «чистые» или собственно амегакариоцитарные тромбоцитопении, не сочетающиеся с другими видами патологии; — гипомегакариоцитозы, сочетающиеся с синдромом отсутствия лучевой кости (ТАР-синдром) и другими костными и органными дефектами и дисплазиями; — панцитопении (типа синдрома Фанкони и др.), при которых а(гипо)мегакариоцитоз сочетается с аплазией других ростков кроветворения, а при ряде форм — с различными нарушениями пигментации и врожденными аномалиями скелета, глаз, ушей, сердца. К этой же группе могут быть отнесены и формы, связанные с инфильтрацией костного мозга, замещением его опухолевой тканью при врожденных гемобластозах, ретикулоэндотелиозах, мукополисахаридозах и врожденной гранулематозной болезни; — врожденная костномозговая дисфункция при синдромах Дауна и Вискотта — Олдрича.
Следует также учитывать, что многие тромбоцитопении в равной степени могут рассматриваться и как тромбоцитопатии, поскольку при них имеются качественные дефекты мегакариоцитов и тромбоцитов — мембранные нарушения, отсутствие тех или иных гранул, нарушения транспорта кальция, дисфункция сократительного аппарата и т.д.
Помимо этого, выделяют ряд токсических и лекарственных форм, связанных с употреблением беременными женщинами алкоголя, тиазидов, толбутамида, сульфаниламидов, фуразолидона, фенилбутазона, эстрогенов, гепаринотерапией и некоторыми другими лекарственными воздействиями. Часть из этих форм связана с влиянием препаратов на гемопоэз, часть — с изменением антигенных свойств тромбоцитов и их иммунным повреждением (гаптеновые формы).
Генез тромбоцитопений при внутриутробных инфекциях сложен и связан с недостаточной продукцией тромбоцитов костным мозгом, угнетением мегакариоцитарного ростка токсинами возбудителя, гиперспленизмом, ДВС-синдромом.
Патогенез геморрагического синдрома при тромбоцитопениях
Развитие геморрагического синдрома при тромбоцитопениях обусловлено преимущественно нарушением ангиотрофической функции тромбоцитов. Сосудистый эндотелий, лишенный тромбоцитарной подкормки, становится порозным, повышенно проницаемым, ломким, что приводит к возникновению спонтанных геморрагий и кровотечений из микроциркуляторного русла. Известно, что для поддержания трофики сосудов достаточно всего лишь 10-15% тромбоцитов от числа циркулирующих в периферической крови. Именно этого количества кровяных пластинок, а это 15-30 х 109/л, достаточно для поддержания эффективного гемостаза. Наряду с нарушением ангиотрофической функции тромбоцитов имеет место нарушение процессов свертывания (снижение потребления протромбина, нарушение ретракции кровяного сгустка) и активация системы фибринолиза.
Классификация тромбоцитопений у новорожденных
1. Первичные: — трансиммунная тромбоцитопеническая пурпура; — изоиммунная тромбоцитопеническая пурпура; — аллоиммунная тромбоцитопеническая пурпура.
2. Вторичные (симптоматические) тромбоцитопении выступают как симптом при многих инфекционных заболеваниях (в том числе при ТОRCH-инфекциях), иммунодефицитных состояниях (синдром Вискотта — Олдрича), синдроме Казабаха — Мерритта (гигантская гемангиома), гемобластозах, апластических анемиях и иных состояниях и заболеваниях периода новорожденности (недоношенность, ЗВУР, переношенность, острая асфиксия, респираторные расстройства, диабетическая фетопатия, холодовая травма, некротизирующий энтероколит и пр.).
Диагностические критерии
1. Анамнестические: — наличие у матери аутоиммунной тромбоцитопении (идиопатическая тромбоцитопеническая пурпура, системная красная волчанка, аутоиммунный тиреоидит, синдром Эванса и др.); — преморбидный фон (недоношенность, ЗВУР, переношенность и т.д.); — наличие основного заболевания (ВУИ, иммунодефицитные состояния, гигантская гемангиома и т.д.).
2. Клинические: — геморрагический синдром в первые дни жизни ребенка в виде кожных проявлений (петехии, экхимозы), кровотечений из микроциркуляторного русла (носовые, десневые и пр.), мелены. Для него характерны спонтанность, несимметричность, полиморфность и полихромность. При трансиммунной форме геморрагический синдром постепенно идет на спад, так как поступление антитромбоцитарных антител к ребенку от матери прекращается и разрушения тромбоцитов не происходит; — при вторичных тромбоцитопениях эти явления развиваются на фоне основного заболевания, характерным симптомом которых является гепатосленомегалия. Следует помнить, что характер и выраженность геморрагического синдрома у новорожденных при ТОRCH-инфекциях зависит не только от возбудителя, но и от гестационного возраста, в котором плод подвергся действию инфекционного агента. Характерным признаком синдрома Казабаха — Мерритта у новорожденных детей является истинная мелена; — при синдроме Вискотта — Олдрича присоединяются повторные гнойные инфекции (гнойные отиты), экзематозные сыпи, спленомегалия. Следует помнить, что это заболевание наследуется по рецессивному типу, сцепленному с Х-хромосомой (болеют мальчики).
3. Лабораторные: — тромбоцитопения; — увеличение продолжительности кровотечения по Дуке (больше 4 мин); — снижение ретракции кровяного сгустка; — нарушение функциональных свойств тромбоцитов: снижение адгезии, нарушение агрегации к АДФ, тромбину, коллагену; — наличие высоких титров специфических IgG, IgM и положительной ДНК-полимеразной цепной реакции при ТОRCH-инфекциях; — обнаружение антитромбоцитарных антител (при иммунных формах): 1) выявление материнских антител к тромбоцитам ребенка, большое количество иммуноглобулинов G на поверхности тромбоцитов матери (при трансиммунной тромбоцитопенической пурпуре); 2) наличие антитромбоцитарных антител в сыворотке крови матери при нормальном количестве иммуноглобулинов G на ее тромбоцитах, агглютинация тромбоцитов ребенка сывороткой крови матери (при изоиммунной тромбоцитопенической пурпуре); — лимфопения, снижение уровня IgМ, повышение IgА и Е, нормальный или повышенный уровень IgG, нарушение агрегации тромбоцитов (при синдроме Вискотта — Олдрича); — снижение уровней V, VIII коагуляционных факторов и фибриногена, анемия (при синдроме Казабаха — Мерритта); — анемия, лейкопения, которая сменяется гиперлейкоцитозом, «лейкемическое зияние», ускорение СОЭ. Миелограмма: увеличение количества бластов более 30%, угнетение мегакариоцитарного и эритроцитарного ростков (при гемобластозах); — панцитопения, отсутствие ретикулоцитов, ускорение СОЭ. В миелограмме тотальная аплазия костного мозга (апластические анемии).
Лечение
1. При иммунных формах: — вскармливание донорским молоком 2-3 недели, в дальнейшем прикладывание к груди под контролем количества тромбоцитов ребенка; — внутривенный иммуноглобулин: «Gamma-Venin» (Германия), «Sandoglobulin» (Швейцария), «Veinoglobuline» (Франция), «Gammonativ» (Швеция), «Polyglobin» (США) в/в капельно 0,4 г/кг/сутки 2-5 дней; — преднизолон (2 мг/кг/сутки, не более 2 недель); — переливание тромбоцитарной массы показано при жизнеугрожаемых кровотечениях, снижении числа тромбоцитов менее 10 х•109/л, увеличении длительности кровотечения в 2 и более раза в сравнении с нормой. Стандартной терапевтической дозой тромбоцитов для переливания считается доза, содержащая 4,0-5,0•х 1011 донорских тромбоцитов. Тем не менее оптимальной является доза, полученная при проведении индивидуального математического расчета в перерасчете на один с параметров: массу тела, объем циркулирующей крови, площадь тела.
Клиническим критерием эффективности трансфузии тромбоконцентрата является купирование геморрагического синдрома: прекращение кровотечения, отсутствие свежих геморрагий на коже и видимых слизистых оболочках. Лабораторные признаки — нормализация длительности кровотечения и повышение числа тромбоцитов периферической крови более чем 40,0 х•109/л.
Следует помнить, что при иммунных формах тромбоцитопений переливания тромбоконцентрата противопоказаны, за исключением кровотечений, которые представляют угрозу для жизни; — заменные трансфузии плазмы или плазмаферез в тяжелых случаях; — ингибиторы фибринолиза: ε — аминокапроновая кислота (0,05 г/кг 4 раза в сутки внутрь), ПАМБА (парааминометилбензойная кислота), амбен, трансэксамовая (трансэксаминовая) кислота (АМСА, циклокапрон); — дицинон (0,05 г 3 раза в сутки), адроксон. Эти медикаментозные средства можно применять в качества препаратов выбора при легком течении тромбоцитопений, которые сопровождаются лишь кожными проявлениями; — коррекция анемии (эритромасса).
2. При вторичных тромбоцитопениях: терапия основного заболевания.
Таким образом, многообразие причин, приводящих к развитию тромбоцитопений в неонатальном периоде, требует оперативности в проведении диагностического процесса, правильность которого обусловливает назначение адекватной терапии, что значительно улучшает прогноз заболеваний, сопровождающихся геморрагическим синдромом, вызванным патологией сосудисто-тромбоцитарного звена гемостаза.
Список литературы
1. Баркаган Л.З. Нарушение гемостаза у детей. — М.: Медицина, 199І. — С. 58-111.
2. Геморрагические заболевания новорожденных: Уч.-метод. пособие / Под ред. проф. П.С. Гуревича и доц. А.И. Осипова. — Воронеж, 1983. —45 с.
3. Кузьмина Л.А. Гематология детского возраста. — М.: МЕДпресс-информ, 2001. — С. 202-271.
4. Посібник з неонатології: Пер. з анг. / Під ред. Дж. Клоерті, Енн Старк. — К.: Фонд допомоги дітям Чернобиля, 2002. — 772 с.
5. Шабалов Н.П. Неонатология. — СПб., 1996. — Т. 2. — С. 161-168.
6. Amato M. et all. Treatment of neonatal thrombocytopenia // J. Pediatr. — 107: 650, 1985.
7. Blanchette V.C., Johnson J., Rand M. The management of alloimmune neonatal // Bailliere’s Clinical Haematology. — 2000. — 13: 365-90.
8. Burrows R.F. et all. Perinatal thrombocytopenia // Clin. Periatal. — 1995. — 22: 779.
9. Bussel J.B. et all. Fetal alloimmune thrombocytopenia // N. Engl. J. Med. — 1997. — 337: 23.
10. Christensen R.D. Hematologic problems of the neonate 282-301, 2000 W.B. Saunders Company.
11. Lokeshwar M.R., Bavdekar M. Neonatal thrombocytopenia.
12. Roberts I.A.G., Murray N.A. Review. Management of thrombocytopenia in neonates // Br J Haematol. — 1999. — 105: 864-70. 13. Wong W., Glader B. Approach to the newborn who has thrombocytopenia // NeoRewievs. — Vol. 5, №10, October 2004.
Тромбоцитопении новорожденных
ИЛЬНУР ИЛГИЗОВИЧ ЗАКИРОВ, канд. мед. наук, доцент кафедры педиатрии и неонатологии ГБОУ ДПО «Казанская государственная медицинская академия» Минздрава России, зав. пульмонологическим отделением Детской республиканской клинической больницы, тел. (843) 562-52-66, e-mail: zakirov.ilnur@inbox.ru
АСИЯ ИЛЬДУСОВНА САФИНА, докт. мед. наук, профессор, зав. кафедрой педиатрии и неонатологии ГБОУ ДПО «Казанская государственная медицинская академия» Минздрава России, тел. (843)562-52-66, e-mail: safina_asia@mail.ru
В статье изложены клинические аспекты тромбоцитопении у новорожденных детей. Представлены схемы диагностического поиска причин снижения тромбоцитов в крови. Рассмотрены наиболее частые нозологические формы тромбоцитопении в периоде новорожденности и подходы терапевтической тактики.
Определение. Тромбоцитопения объединяет различные нозологические формы и синдромы, при которых наблюдается снижение количества тромбоцитов менее 150*109/л и/или развивается геморрагический синдром [1]. В неонатальном периоде «нормативные» показатели тромбоцитов не отличаются от детей других возрастных групп, хотя на момент рождения младенцы часто демонстрируют «нормально» низкий уровень тромбоцитов — 100—200*109/л, с последующим снижение на 4—5-й день жизни до 50—100*109/л и с восстановлением уровня тромбоцитов на 7—10-й день. Естественно, «нормально» низкий уровень кровяных пластинок часто встречается у недоношенных детей, так как в данной группе пациентов нередко регистрируются негативные факторы, ухудшающие созревание тромбоцитов. Однако риск возникновения кровотечения у клинически стабильного недоношенного ребенка минимален, если число тромбоцитов превышает 50*109/л [7].
В периоде новорожденности тромбоцитопения регистрируется у 1—5% детей, но клинически тяжелые формы со снижением количества тромбоцитов менее 50*109/л встречаются только у 0,1—0,5% детей, и у половины из них развивается геморрагический синдром [5, 6].
Алгоритм диагностического поиска в случае выявления тромбоцитопении у новорожденного предусматривает:
1. Анамнестические данные. У матери — наличие аутоиммунной тромбоцитопении (идиопатическая тромбоцитопеническая пурпура, системная красная волчанка, аутоиммунный тиреоидит, синдром Эванса и др.), аномалий плаценты (хориоангиоматоз, отслойка, тромбоз), применение лекарственных препаратов. У новорожденного ребенка — отягощенный преморбидный фон (внутриутробная гипоксия плода, недоношенность, задержка внутриутробного развития, переношенность и т.д.); наличие основного заболевания (внутриутробная инфекция, иммунодефицитное состояние, гигантская гемангиома и т.д.).
2. Клинические данные. Геморрагический синдром в первые дни жизни ребенка в виде кожных проявлений (петехии, экхимозы), кровоточивости слизистых оболочек. Геморрагические проявления возникают спонтанно, характеризуются несимметричностью, по- лиморфностью и полихромностью. При трансиммунной форме геморрагический синдром постепенно идет на спад, так как поступление антитромбоцитарных анти¬тел к ребенку от матери прекращается и разрушения тромбоцитов не происходит. При вторичных тромбоцитопениях эти явления развиваются на фоне основного заболевания. Следует помнить, что характер и выраженность геморрагического синдрома у новорожденных при внутриутробных инфекциях зависит не только от возбудителя, но и от гестационного возраста, в котором плод подвергся действию инфекционного агента. Характерным признаком синдрома Казабаха—Мерритта у новорожденных детей является истинная мелена. При синдроме Вискотта—Олдрича присоединяются повторные гнойные инфекции (гнойные отиты), экзема, спленомегалия.
3. Тромбоцитопения. О наличии тромбоцитопении свидетельствует число тромбоцитов в периферической крови менее 150*109/л, увеличение продолжительности кровотечения, снижение ретракции кровяного сгустка менее 60%, гиперплазия мегакриоцитарного ростка (более 54—114 в 1 мкл) в костном мозге, снижение адгезии, нарушение агрегации к АДФ, тромбину, коллагену, отсутствие отклонений в лабораторных тестах, характеризующих коагуляционное звено гемостаза.
4. Другие лабораторные проявления:
- наличие высоких титров специфических IgG, IgM и положительной ДНК-полимеразной цепной реакции при TORCH-инфекциях;
- обнаружение антитромбоцитарных антител (при иммунных формах): 1) выявление материнских антител к тромбоцитам ребенка, большое количество IgG на поверхности тромбоцитов матери (аутоиммунная тромбоцитопения); 2) наличие антитромбоцитарных антител в сыворотке крови матери при нормальном количестве IgG на ее тромбоцитах, агглютинация тромбоцитов ребенка сывороткой крови матери (аллоимунная тромбоцитопения);
- лимфопения, снижение уровня IgМ, повышение IgA и IgE, нормальный или повышенный уровень IgG, нарушение агрегации тромбоцитов (при синдроме Вискотта—Олдрича);
- снижение уровней V, VIII коагуляционных факторов и фибриногена, анемия (при синдроме Казабаха— Мерритта).
5. Изменения в миелограмме. Увеличение количества бластных клеток (более 30%), угнетение мегакариоцитарного и эритроцитарного ростков (при гемобластозе); панцитопения, отсутствие ретикулоцитов, ускорение СОЭ, тотальная аплазия костного мозга (апластическая анемия) [2].
Причины снижения тромбоцитов в крови у ново-рожденных детей весьма вариабельны [8]. Это могут быть иммунопатологические процессы, вызывающие первичные тромбоцитопении, и вторичные (симптоматические) тромбоцитопении, возникающие на фоне различных заболеваний. В табл. 1 представлена классификация тромбоцитопении по времени начала клини¬ческих проявлений в перинатальном периоде [16].
Аллоиммунная тромбоцитопения (АТП). Причиной АТП является несовместимость антигенной структуры тромбоцитов матери и плода. По современным представлениям наиболее распространенными тромбоцитарными антигенами, обнаруживаемые у пациентов с АТП, являются HPA-1a и HPA-5b (Human Platelet Antigen — антиген тромбоцитов человека), которые регистрируются в около 80—90% случаев. К примеру, антиген HPA-1a был зарегистрирован у 98% женщин США, что позволяет примерно просчитать количество детей, относящихся к группе риска по развитию АТП. В действительности частота возникновения АТП во время беременности значительно ниже и составляет 1 на 1500—2000 случаев [13].
При АТП материнские антитела против тромбоцитов плода могут циркулировать с 17-й недели беременности, на 20-й нед беременности возможно развитие тромбоцитопении. Во время первой беременности геморрагический синдром, как правило, диагностируется после рождения ребенка в виде петехии, экхимозов, кровоточивости слизистых оболочек и внутричерепных кровоизлияний [8]. Частота возникновения внутричерепных осложнений составляет 10—30%, и примерно половина из них возникает еще внутриутробно. В данной группе новорожденных детей частота летальных исходов достигает 10%, неврологических осложнений — 25% [12].
В ходе последующих беременностей плод также подвержен риску развития заболевания в аналогичной или более тяжелой форме, если тромбоциты содержат целевой антиген. Реакция кроветворной системы плода на АТП бывает разной и может включать в себя компенсаторный экстрамедуллярный гемопоэз. В редких случаях развивается водянка плода. Также может появиться анемия плода без конфликта по резус-фактору или АВО-системе [4].
Диагностический поиск при АТП включает:
1. При сборе анамнеза обращают внимание на повторные выкидыши, мертворождения, геморрагический синдром у старших детей в раннем неонатальном периоде.
2. Объективный осмотр — дородовые или послеродовые внутричерепные кровоизлияния, мелена, легочное или пупочное кровотечение, гематомы в местах инъекций и т. д. Типична умеренная спленомегалия.
Классификация тромбоцитопении у новорожденных по времени возникновения (Roberts, Murray, 2003)
Время возникновения тромбоцитопении |
Наиболее частые причины |
Более редкие причины |
Внутриутробный период |
4.Аутоиммунная тромбоцитопения (ИТП, СКВ) |
2.Врожденные заболевания: синдром Вискотта— Олдрича |
Раннее проявление тромбоцитопении (<72 ч) |
1.Плацентарная недостаточность (например, ЗВУР, сахарный диабет).
|
|
Позднее проявление тромбоцитопении (>72 ч) |
|
1.Врожденная инфекция (например, ЦМВ, токсо- плазма, краснуха).
|
3. Низкие показатели тромбоцитов в момент рождения ребенка с последующим снижением в течение нескольких первых часов и дней после рождения.
4. Тромбоциты у матери остаются в пределах нормы. Через 2—3 неделе после того, как антитела выводятся из организма, концентрация тромбоцитов начинают возрастать, с полной нормализацией к 4—12-й недели жизни.
5. Возможно удлинение времени кровотечения. Показатели протромбинового времени (ПВ) и активированного частичного тромбопластинового времени (АЧТВ) не изменены.
6. Диагноз подтверждается постановкой реакции тромбоаглютинации тромбоцитов ребенка в сыворотке крови матери [3].
Терапевтическая тактика:
1. В первые 2—3 недели жизни ребенка кормить донорским молоком или молочными смесями.
2. Показаниями для назначения медикаментозной терапии является снижение тромбоцитов менее чем на 20—30*109/л, или наличие кровотечения. В остальных случаях применяют выжидательную тактику, поскольку заболевание заканчивается спонтанным выздоровлением через 3—4 мес.
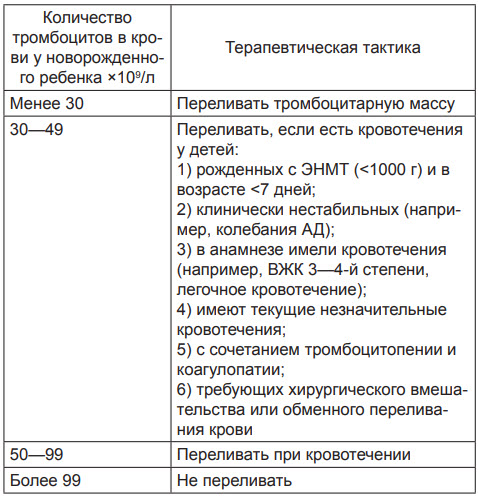
3. Если число тромбоцитов младенца находится < 30*109/л, а количество материнских тромбоцитов в пределах нормы, то методом выбора является срочное переливание отмытых (без аллоантител) тромбоцитов матери из расчета 10 мл/кг В качестве альтернативного выбора тромбоцитарной массы могут быть отмытые тромбоциты антигена HPA-1a негативного донора, но при индивидуальном подборе по антигенной совместимости [4] (табл. 2).
Показания для переливания тромбоцитарной массы у новорожденных детей
4. Если антиген-отрицательные тромбоциты отсутствуют, используется внутривенный иммуноглобулин (ВВИГ) из расчета 0,8 г/кг в сутки ежедневно в течение 5 сут или 1 г/кг в сут 1 раз в двое суток, 2—3 внутривенных вливаний.
5. Возможно использование системных кортикостероидов: преднизолон 1—2 мг/кг/сут. в течение 3—5 дней [14].
При организации профилактики АТП необходимо помнить:
1. Риск последующей беременности с развитием АТП составляет 100%, если отец является гомозиготным по реагирующим антигенам, и 50%, если он гетерозиготен по данным антигенам.
2. Наличие или отсутствие тяжелой формы тромбоцитопении и внутричерепного кровотечения у первого ребенка оказывает влияние и на результат последующих беременностей. Во время последующей беременности генотип плода можно также определить с использованием околоплодной жидкости или крови матери уже на 18-й недели беременности.
3. Дородовая терапия при последующих беременностях включает внутриутробное переливание тромбоцитов, использование ВВИГ и стероидов [4].
Иммунная тромбоцитопения. Аутоантитела к тромбоцитам, которые вступают в реакцию с собственными тромбоцитами пациента, а также и с тромбоцитами донора или плода, являются еще одной серьезной причиной возникновения доброкачественной тромбоцитопении у плода и новорожденного ребенка.
Трансиммунные тромбоцитопении (ТТП) встречаются у новорожденных от матерей, страдающих аутоиммунной тромбоцитопенической пурпурой (АТП), системной красной волчанкой (СКВ), лимфопролиферативными расстройствами, болезнью Грейвиса. Материнские антитела при этих заболеваниях направлены против собственных антигенных структур тромбоцитов — гликопротеинов Mb/IIIa или Ib/IX. В основе неонатальной тромбоцитопении лежит трансплацентарный переход материнских антитромбоцитарных антител к плоду. Риск возникновения трансиммунной неонатальной тромбоцитопении может достигать 35—75%. Нет четкой корреляции между тяжестью течения иммунной тромбоцитопении матери и степенью выраженности заболевания у новорожденного ребенка. Однако при выраженных клинических проявлениях АТП у матери риск развития ТТП у ребенка возрастает [10].
Клинические варианты течения ТТП в неонатальном периоде:
1. Бессимптомный — наличие только тромбоцитопении, повышение уровня тромбоцитов без лечения к 3-й недели жизни.
2. Ранняя манифестация геморрагического синдрома. Появление с первых суток жизни распространяющихся петехиальных элементов на коже, реже могут быть легочные, кишечные, почечные кровотечения, внутричерепные кровоизлияния. Пурпура у детей может высыпать на коже через несколько часов после рождения, но чаще через 2—3 дня. Чем позднее после рождения появилась кровоточивость, тем легче протекает болезнь. Длительность тромбоцитопении — около 1,5—2 мес, но с двухнедельного возраста тяжесть геморрагического синдрома резко ослабевает.
3. Поздняя манифестация заболевания на 7—20-е сутки жизни. Клинические проявления в виде кожных геморрагий развиваются параллельно снижению тромбоцитов. Протекает легко, но характерно длительное волнообразное течение до 2—3-месячного возраста с рецидивами геморрагических высыпаний [10].
Диагностические критерии ТТП:
1. Сбор анамнеза: мать страдает АТП или СКВ, или медикаментозной аллергией.
2. Клинические данные: кожный геморрагический синдром в первые минуты, часы жизни, чаще через 2—3 дня. Внутричерепные кровоизлияния, легочные, кишечные кровотечения наблюдаются крайне редко; чем позднее после рождения появляется кровоточивость, тем легче протекает болезнь.
3. Выраженная тромбоцитопения, достигающая низких цифр после рождения; держится до 1,5—2 мес.
4. Костномозговая пункция: число мегакариоцитов нормальное.
5. Иммунологические данные: обнаруживаются антитромбоцитарные антитела и IgG на поверхности тромбоцитов у матери.
Терапевтическая тактика:
1. Кормить донорским молоком или молочными смесями.
2. Медикаментозная терапия показана только при выраженном геморрагическом синдроме. Применяют иммуноглобулин человека нормальный для внутривен-ного введения (0,8 г/кг 1—3 раза) или преднизолон из расчета 1—2 мг/кг/сут. В тяжелых случаях схема лече¬ния полностью совпадает с таковой при аллоиммунной тромбоцитопении новорожденного [4].
Профилактика:
1. Мать с наличием тромбоцитопении или предыдущим диагнозом ИТП должна пройти обследование на наличие антител к тромбоцитам в сыворотке крови. Отсутствие антител в организме беременной женщины обычно говорит о наличии тромбоцитопении, вызванной другими факторами, и позволяет высказать предположение о том, что плод или новорожденный не находится в группе риска.
2. В то же время мать с наличием тяжелой формы тромбоцитопении и петехиями или другими признаками кровотечений, вызванных антителами, должна пройти такое же лечение, как и не беременная женщина с ИТП.
Гестоз у матери. Тяжелый гестоз матери может привести к развитию внутриутробной тромбоцитопении, и величина снижения тромбоцитов обычно коррелирует с тяжестью токсикоза. Среди новорожденных данная форма тромбоцитопении регистрируется у 1% детей, с увеличением частоты среди недоношенных детей. Количество тромбоцитов может снижаться к 4-му дню жизни до 50*109/л, с восстановлением до нормального уровня к 7—10-м сут. жизни. Механизм неонатальной тромбоцитопении, связанной с тяжелым поздним ток-сикозом, не ясен, хотя в последнее время данные ука-зывают на возможное нарушение созревания клеток- предшественников мегакариоцитопоэза [8].
Инфекционный процесс. При любых видах тромбоцитопении у новорожденных детей со снижением количества тромбоцитов менее 50*109/л необходимо исключать инфекционный процесс. При бактериальном сепсисе снижение тромбоцитов происходит за счет развития синдрома внутрисосудистого свертывания (ДВС); повреждения эндотелия сосудов с последующей агрегацией тромбоцитов и уменьшением трофической функции интимы сосудов; иммунного повреждения кровяных клеток; активации агрегации путем бактериального повреждения мембран тромбоцитов; кроме того, многие микроорганизмы способны прямо или опосредовано подавить активность костного мозга.
В перинатальном периоде вирусные инфекции мо-гут приводить к тяжелой тромбоцитопении в результате повреждения сиаловых кислот мембран тромбоцитов вирусной нейраминидазой, активацией внутрисосудистого свертывания, снижением продукции мегакариоцитов в костном мозге и вследствие спленомегалии [7, 8]. Тромбоцитопения иногда является начальным проявлением ВИЧ-инфекции, но это обычно происходит через несколько месяцев после рождения, и только в редких случаях — в неонатальном периоде.
Терапия тромбоцитопении при инфекционных заболеваниях
Специального лечения обычно не требуется. Необходима адекватная терапия основного заболевания. При тяжелых кровотечениях и уровня тромбоцитов менее 20*109/л показана заместительная терапия тромбоцитарной массы (10—30 мл/кг).
Хромосомные расстройства, такие как трисомия по 13-й, 18-й или 21-й хромосомам и синдром Шерешевского—Тернера проявляются неонатальной тромбоцитопенией. Эти нарушения признаны индивидуальными клиническими особенностями.
Синдром Казабаха—Мерритта — врожденный синдром, включающий ангиому смешанного типа и нарушение свертывания крови. Ангиома глубоко залегающая, больших размеров, может сопровождаться ассоциацией мелких более поверхностных ангиом. Локализация: грудь, шея, проксимальные отделы конечностей, голова. Синдром Казабаха—Мерритта описан у детей с множественными мелкими ангиомами, а также с висцеральными и ретроперитонеальными ангиомами в сочетании с ангиомой кожи. Ангиоматозные поражения обычно присутствуют с рождения. Наруше¬ние коагуляции крови выявляется в течение первых недель жизни ребенка или с рождения. Нарушение свертываемости крови проявляется кровотечениями как в полость кавернозных ангиом, так и в окружающие зоны в виде экхимозов и петехий. В результате быстрое увеличение размеров ангиомы может привести к сдавлению соседних органов и летальному исходу. Геморрагии при синдроме Казабаха—Мерритта являются следствием тромбоцитарной секвестрации и обеднения свертывающими факторами сосудистых структур ангиом [1].
Лекарственная тромбоцитопения. Многие лекарственные препараты способны вызвать нарушения в системе гемостаза. Гематологические нарушения, включая нейтропению, анемию, тромбоцитопению, развитие тромбозов и коагулопатии. Клиницисту не всегда удается провести дифференциальную диагностику причин гематологических расстройств. Учитывая широкое разнообразие вызываемых лекарствами побочных эффектов, врачи в дифференциальном плане всегда должны рассматривать применяемые лекарственные средства как потенциальные этиологические факторы гематологической дисфункции. Ниже представлен список некоторых лекарственных препаратов, способных вызвать тромбоцитопению: аллопуринол, аминоглутетимид, амфотерицин, антибиотики группы В-лактамов, вальпроевая кислота, ванкомицин, ганцикловир, гепарин, гепарины низкомолекулярные, гидроксихлорохин, гидрохлоротиазид, дезипрамин, диазепам, дигитоксин, дизопирамид, изониазид, имипенем-циластатин, интерферон, карбамазепин, пенициллин, прокаинамид, рифабутин, сульфаниламиды, тиклопидин, триметоприм, фенитоин, фенотиазины, флуконазол, фуросемид, хлоротиазид, циметидин [2].
Недостаточная продукция тромбоцитов — а(гипо)мегакариоцитозы. Среди них выделяют «чистые» или собственно амегакариоцитарные тромбоци-топении, не сочетающиеся с другими видами патологии; гипомегакариоцитозы, сочетающиеся с синдромом отсутствия лучевой кости (TAR-синдром) и другими костными и органными дефектами и дисплазиями; панцитопении (типа синдрома Фанкони и др.), при которых а(гипо)мегакариоцитоз сочетается с аплазией других ростков кроветворения, а в ряде форм — с различными нарушениями пигментации и врожденными аномалиями скелета, глаз, ушей, сердца [2]. К этой же группе могут быть отнесены и формы, связанные с инфильтрацией костного мозга, путем замещения его опухолевой тканью при врожденных гемобластозах, ретикулоэндотелиозах, мукополисахаридозах и врожденной гранулематозной болезни; врожденная костно-мозговая дисфункция при синдромах Дауна и Вискотта—Олдрича.
Врожденная амегакариоцитарная тромбоцитопения (САМТ) — тромбоцитопения у детей вследствие амегакариоцитоза. Этиология заболевания точно не установлена, наследуется по аутосомно-рецессивному признаку, с нарушением эмбриогенеза на 7—9-й недели гестации. Геморрагический синдром проявляется обычно в первые дни жизни ребенка и характеризуется кровоточивостью микроциркуляторного типа. При анализе крови определяются выраженная тромбоцитопения, часто анемия, нарушение агрегационной функции тромбоцитов. Костно-мозговая пункция выявляет гипоплазию или аплазию мегакариоцитарного аппарата. Прогноз заболевания неблагоприятный. Чаще всего причиной смерти бывает кровоизлияние в головной мозг.
САМТ подразделяется на:
- тип I характеризуется ранним началом заболевания с тяжелой панцитопенией, в том числе и тромбо- цитопенией, снижением активности костного мозга;
- тип II протекает более мягко и характеризуется скоротечным увеличением числа тромбоцитов почти до нормальных значений в течение первого года жизни, снижение мегакариоцитов в костном мозге проявляется ввозрасте 3 лет и позже [12].Тромбоцитопения с отсутствием радиальной кости (TAR-синдром)является редким аутосомно- рецессивным наследственным заболеванием. Частотазаболевания не превышает 1 на 100 000 новорожденных. Клиническая картинахарактеризуется тромбоцитопенией и агенезией радиальных костей. Отсутствиелучевых костей сопровождается наличием большого пальца, что отличаетTAR-синдром от других синдромов, проявляющихся отсутствием лучевых костей(синдром Холта—Орама, анемия Фанкони, синдром Робертса). К внескелетнымпроявлениям относятся врожденные пороки развития сердца (дефект межпредсерднойперегородки, или аномалия Фалло) и мочеполовой системы.Все дети с ТАR-синдромом рождаются с низким количествомтромбоцитов, что приводит к типичному геморрагическому синдрому по«синячковому» типу. Наиболее распространенными формами являются кровотечения износа, ротовой полости, легочные и желудочно-кишечные кровотечения. Наиболеетяжелые кровотечения на первом году жизни. К концу первого года жизниколичество тромбоцитов увеличивается, риск развития геморрагического синдромауменьшается [11].Анемия Фанкони (АФ) является генетической формойапластической анемии с различными врожденными аномалиями развития.Тромбоцитопения является частым гематологическим проявлением в периоденоворожденности, как правило, без развития клинических проявлений. Характернапренатальная гипотрофия (масса при рождении ниже 2500 г). У всех больныханемией Фанкони имеются врожденные аномалии развития: аплазия и гипоплазиябольшо¬го пальца на руках, полидактилия, микроцефалия, микроофтальмия,страбизм, гипоспадия, крипторхизм, врожденные пороки сердца. Отмечаетсябронзово-коричневая пигментация кожи. В периферической крови — панцитопения,нормохромная анемия, анизоцитоз, пойкилоцитоз, ретикулоциты не выше 2—3%о.Стойкая лейкопения. Тромбоцитопения достигает до единичных тромбоцитов в мазке. Скорость оседания эритроцитов ускоряется.
Диагностика причин снижения тромбоцитов у новорожденных детей
| Группа новорожденных детей |
Нозологические формы, протекающие с тромбоцитопенией |
| Новорожденные, в том числе и недоношенные дети, рожденные от матерей с отягощенным акушерским анамнезом и имеющие отклонения в состоянии здоровья на момент рождения |
Хроническая внутриутробная гипоксия плода. Тяжелый токсикоз у матери. Бактериальные инфекции ( в том числе сепсис). Врожденные вирусные инфекции (цитомегаловирус, краснуха и т.д.). ДВС-синдром. Респираторный дистресс-синдром. Персистирующая легочная гипертензия. Некротический энтероколит. Тромбозы в периоде новорожденности (ДВС-синдром, сосудистые катетеры). Обменное переливание крови. Опухоли (лейкоз, нейробластома или другие твердые опухоли) |
| Новорожденные с аномалиями развития |
TAR-синдром. Анемия Фанкони. Хромосомные нарушения в связи с трисомией 13-й, 18-й или 21-й хромосомами и синдром Шерешевского—Тернера. Синдром Казабаха—Мерритта |
| Дети, не имеющие отклонения в здоровье на момент рождения, с дебютом заболевания в постнатальном периоде |
Острые инфекции. Аутоиммунная тромбоцитопения. Аллоиммунная тромбоцитопения новорожденных. Амегакариоцитарная тромбоцитопения. Синдром Вискотта—Олдрича |
Синдром Вискотта—Олдрича. Данный синдром наследуется по рецессивному типу, сцепленному с Х-хромосомой, при этом имеет место дефект WASp гена, низкая экспрессия сиалогликопротеина CD43, нарушение созревания стволовой клетки. Болеют мальчики. Синдром Вискотта—Олдрича является комбинированным (Т- и В-клеточным) иммунодефицитным состоянием. Ключевые симптомы:
1) снижение концентрации IgM, нормальный уровень IgG, повышение концентрации IgA, IgE в сыворотке крови;
2) прогрессирующее с возрастом снижение числа и функций Т-клеток;
3) тромбоцитопения, экзема, повторные гнойные инфекции.
Заболевание в периоде новорожденности манифестирует геморрагическими проявлениями, обусловленными тромбоцитопенией. В более поздние возрастные периоды присоединяются экзема, повторные бактериальные инфекции, спленомегалия, иммунологические нарушения [9].
Итак, в данной статье были рассмотрены наиболее частые формы и причины развития тромбоцитопении в периоде новорожденности. В табл. 3 представлен обобщенный список синдромов и заболеваний, приводящих к развитию тромбоцитопении. Как видно, большинство случаев снижения тромбоцитов в неонатальном периоде носит вторичный характер, редко приводит к тяжелым геморрагическим осложнениям и требует коррекции основного заболевания.
Литература
1. Баркаган, З.С. Геморрагические заболевания и синдромы / З.С. Баркаган. — М.: Медицина, 1988. — 528 с.
2. Василевский, И.В. Вторичные (симптоматические) тром-боцитопении у детей и подростков / И.В. Василевский // Медицинская панорама. — 2009. — № 4. — С.5—10.
3. Головко, О.К. Клинические аспекты иммунных тромбоци-топений в неонатологии / О.К. Головко, Г.Л. Линчевский, О.В. Воробьева // Здоровье ребенка. — 2006. — № 2. — С.115—122.
4. Жибурт, Е. Переливание тромбоцитов детям / Е. Жибурт, С. Мадзаев // Медицинская газета. — 2013. — № 65. — С.8—9.
5. Масчан, А.А. Иммунно-опосредованные тромбоцитопении новорожденных: дифференциальный диагноз и принципы терапии / А.А. Масчан, А.Г. Румянцев // Вопросы гематологии/онкологии и иммунопатологии в педиатрии. — 2010. — Т. 9, № 3. — С.13—18.
6. Пшеничная, К.И. Врожденные тромбоцитопатии у детей: особенности диагностики, симптоматики и лечения: ав- тореф. дис. ... канд. мед. наук / К.И. Пшеничная. — СПб., 2002. — 28 с.
7. Рооз, Р. Неонатология: практ. рекомендации: пер. с нем. / Р Рооз. — М.: Медицинская литература, 2011. — 592 с.
8. Шабалов, Н.П. Неонатология: учеб. пособие / Н.П. Шаба- лов. — М.: МЕДпресс-информ, 2004. — 640 с.
9. Blanchette, V.S. Platelet disorders in newborn infants: diagnosis and management / V.S. Blanchette, M.L. Rand // Semin Perinatol. — 1997. — № 21. — Р53—62.
10. Bussel, J.B. Immune thrombocytopenia in pregnancy: autoimmune and alloimmune / J.B. Bussel // J. Reprod. Immunol. — 1997. — № 37. — Р35—61.
11. Homans, A. Thrombocytopenia in the neonate / А. Homans // Pediatr. Clin. North. Am. — 1996. — № 43. — Р.737—756.
12. Kaplan, C. Fotal and neonatal alloimmune thrombocytopenia / С. Kaplan // Orphanet Jornal of Rare Diseases. — 2006. — № 1. — Р 36—39.
13. Letsky, E.A. Guidelines on the investigation and management of thrombocytopenia in pregnancy and neonatal alloimmune thrombocytopenia. Material and Neonatal Haemostasis Working Party of the Haemostasis and Thrombosis Task Force of the British Society for Haematology / E.A. Letsky, M. Greaves // Br. J. Haematol. — 1996. — № 95 (1). — Р21—26.
14. Parralel randomized trials of risk-based therapy for fetal alloimmune thrombocytopenia / R.L. Berkowitz, E.A. Kolb, J.G. McFarland [et al.] // Am. J. Obstet. Gynecol. — 2006. — № 107 (1). — P91—96.
15. Philip, A.G. Increased nucleated red blood cell counts insmall for gestational age infants with very low birth weight / A.G. Philip, A.M. Tito // Am. J. Dis. Child. — 1989. — № 143. — Р164—169.
16. Roberts, I.G. Management of thromobocytopenia in neonates. Archives of Diseases in Childhood / I.G. Roberts, N. A. Murray // Fetal and Neonatal Edition. — 2003. — № 88. — Р359—364.
REFERENCES
1. Barkagan, Z.S. Gemorragicheskie zabolevaniya i sindromy / Z.S. Barkagan. — M.: Medicina, 1988. — 528 s.
2. Vasilevskii, I.V. Vtorichnye (simptomaticheskie) trombocitopenii u detei i podrostkov / I.V. Vasilevskii // Medicinskaya panorama. — 2009. — № 4. — S.5—10.
3. Golovko, O.K. Klinicheskie aspekty immunnyh trombocitopenii v neonatologii / O.K. Golovko, G.L. Linchevskii, O.V. Vorob'eva // Zdorov'e rebenka. — 2006. — № 2. — S.115—122.
4. Zhiburt, E. Perelivanie trombocitov detyam / E. Zhiburt,
S. Madzaev // Medicinskaya gazeta. — 2013. — № 65. — S.8—9.
5. Maschan, A.A. Immunno-oposredovannye trombocitopenii novorozhdennyh: differencial'nyi diagnoz i principy terapii / A.A. Maschan, A.G. Rumyancev // Voprosy gematologii/ onkologii i immunopatologii v pediatrii. — 2010. — T. 9, № 3. — S.13—18.
6. Pshenichnaya, K.I. Vrozhdennye trombocitopatii u detei: osobennosti diagnostiki, simptomatiki i lecheniya: avtoref. dis. ... kand. med. nauk / K.I. Pshenichnaya. — SPb., 2002. — 28 s.
7. Rooz, R. Neonatologiya: prakt. rekomendacii: per. s nem. / R. Rooz. — M.: Medicinskaya literatura, 2011. — 59 s.
8. Shabalov, N.P. Neonatologiya: ucheb. posobie / N.P. Shabalov. — M.: MEDpress-inform, 2004. — 640 s.
9. Blanchette, V.S. Platelet disorders in newborn infants: diagnosis and management / V.S. Blanchette, M.L. Rand // Semin Perinatol. — 1997. — № 21. — Р53—62.
10. Bussel, J.B. Immune thrombocytopenia in pregnancy: autoimmune and alloimmune / J.B. Bussel // J. Reprod. Immunol. — 1997. — № 37. — Р35—61.
11. Homans, A. Thrombocytopenia in the neonate / А. Homans // Pediatr. Clin. North. Am. — 1996. — № 43. — Р.737—756.
12. Kaplan, C. Fotal and neonatal alloimmune thrombocytopenia / С. Kaplan // Orphanet Jornal of Rare Diseases. — 2006. — № 1. — Р36—39.














































































0 комментариев