Диагностики рака предстательной железы. Лекция для врачей
Лекция для врачей "Диагностики рака предстательной железы" (отрывок из книги "Робот-ассистированная урология: национальное руководство" - Пушкарь Д. Ю.)
Дополнительный материал к лекции
ПСА при раке предстательной железы. Лекция для врачей
Ранняя диагностика рака предстательной железы
Факторы, влияющие на выявляемость рака предстательной железы
Возраст
Согласно данным исследований, проведенных в различных странах, было выявлено, что рак простаты редко встречается у мужчин младше 50 лет. С возрастом отмечается постепенный рост выявляемое РПЖ, достигая максимума к 80 годам. У мужчин старше 75 лет частота встречаемости РПЖ от 20 до 83 раз выше по сравнению с мужчинами возрастной категории от 50 до 54 лет. Согласно данным Национального института рака США, наибольший рост выявляемое РПЖ после внедрения ПСА-скрининга был отмечен у мужчин в возрасте от 50 до 59 лет, в то время как у пациентов старше 60 лет начиная с 1992 г. благодаря активному скринингу отмечается постепенное снижение выявляемое РПЖ.
Региональная зависимость заболеваемости раком предстательной железы
Рак предстательной железы — одно из немногих онкологических заболеваний, выявляемое которого отличается в различных регионах земного шара. A. W. Hsing и соавт. выделили 15 стран в зависимости от заболеваемости РПЖ. В группу стран высокого риска вошли: США, Канада, Швеция, Австралия и Франция. Средний риск развития РПЖ отмечен в большинстве других западноевропейских стран, и к странам низкого риска были отнесены государства азиатского региона. За период с 1988 по 1992 г., когда происходило широкое внедрение ПСА как метода скрининга РПЖ, выявляемость рака простаты в странах высокого риска составляла 48,1-137 случаев на 100 000 населения в год, в то время как в странах низкого риска выявлялось 2,3-9,8 случая РПЖ на 100 000 населения в год.
Генетические факторы
В США среди различных этнических групп наибольшая заболеваемость РПЖ отмечается у афроамериканцев, а затем по убывающей у белокожего населения, латиноамериканцев и выходцев из стран Азии. Региональные и этнические различия заболеваемости РПЖ обусловлены генетическими факторами и факторами внешней среды. Генетические факторы включают различия в генетической восприимчивости или в метаболизме у групп высокого и низкого риска развития РПЖ. Имеются данные, доказывающие, что расовые/этнические различия влияют на риск развития РПЖ отчасти из-за разницы в секреции андрогенов и их метаболизме. Активность 5-а редуктазы наиболее важна для превращения тестостерона в дегидротестостерон, который является основным андрогеном предстательной железы. R.K. Ross и соавт. выявили различия в активности 5-а редуктазы между западными и азиатскими мужчинами. N.M. Makridakis и соавт. связывают высокий риск развития как локализованного, так и распространенного рака простаты у афроамериканцев и латиноамериканцев с заместительной мутацией гена SRD5A2, который кодирует 5-а редуктазу. Кроме того, было отмечено, что у афроамериканцев по сравнению с белокожим населением значительно преобладает повторяемость короткой последовательности нуклеотидов СА GB андрогенных рецепторах. В настоящее время доказано, что наличие варианта гена CYP3A4 (запускающего оксидацию тестостерона) сочетается с высокой вероятностью обнаружения агрессивного рака простаты на поздних стадиях, высокой степенью дифференцировки по Глисону и высокими показателями ПСА. Наиболее важным является частота встречаемости варианта гена с аллелем G, который отличается у разных расовых и этнических групп и наиболее часто обнаруживается у афроамериканцев.
Факторы окружающей среды
Факторы окружающей среды, особенно различия в диете, также играют важную роль в риске развития рака простаты. Высокое содержание в пище жиров животного происхождения в западных странах является фактором риска развития РПЖ. В то же время было доказано, что азиатская диета, богатая соей, морепродуктами, рисом, грибами шиитаки, рыбой и зеленым чаем, оказывает некоторый защитный эффект и предотвращает развитие РПЖ. Роль диеты в РПЖ подтверждается рядом наблюдений за китайцами и японцами, постоянно проживающими в США, у которых уровень заболеваемости РПЖ гораздо выше, чем у коренных жителей Китая и Японии. Новые исследования подтверждают влияние факторов окружающей среды на рост заболеваемости РПЖ в странах низкого риска, где не проводится агрессивный скрининг, но отмечается влияние западного образа жизни в виде повышения потребления в пищу животных жиров с одновременным уменьшением физической активности.
Ожирение является еще одним фактором риска развития рака простаты, зачастую с более неблагоприятным прогнозом течения болезни. По данным длительного исследования было выявлено, что у мужчин, страдающих ожирением, чаще диагностируется метастатический рак простаты. Ученые пришли к выводу, что ожирение препятствует своевременной диагностике РПЖ. В этом исследовании участвовали 2144 мужчины из США, у которых за период с 1982 по 2003 г. был диагностирован рак простаты. Результаты исследования показали, что, даже если РПЖ диагностировался на ранних стадиях, мужчины с избыточной массой тела или страдающие ожирением имели в два раза больший риск смерти от рака простаты по сравнению с пациентами с нормальной массой тела, что доказывает связь между агрессивностью РПЖ и ожирением.
Проблемы диагностики рака предстательной железы
Радикальное оперативное лечение является «золотым стандартом» лечения локализованных форм РПЖ, поэтому весьма актуальны вопросы ранней диагностики.
Ни один из методов диагностики, существующих в настоящее время, не способен точно определить стадию рака предстательной железы. Неточность клинического стадирования такова, что примерно в 30% случаев РПЖ стадия опухоли, определенная как Т1/Т2, на самом деле является ТЗ/Т4. Положительный хирургический край (ПХК) обнаруживается в 10-20% случаев, клинически сталированных как Т1, и в 30-60% случаев классифицированных как Т2. В течение 5 лет после оперативного вмешательства у пациентов с негативным хирургическим краем имеется 20% вероятность прогрессии заболевания (биохимический и клинический рецидивы), в то время как у пациентов с позитивным хирургическим краем она составляет от 40 до 60%.
Методы визуализации, такие как ТРУЗИ, КТ, МРТ, не являются однозначными и не позволяют установить клиническую стадию РПЖ. Определение уровня ПСА в сыворотке крови и пальцевое ректальное исследование являются базовыми методами диагностики и скрининга РПЖ. ПРИ обладает низкой чувствительностью в диагностике и стадировании РПЖ, также отмечается незначительная корреляция результатов ПРИ с локализацией и степенью распространенности рака простаты.
С начала использования ПСА зарекомендовал себя наиболее точным маркером в диагностике, стадировании и осуществлении динамического мониторинга РПЖ. В 1997 г. по результатам исследования ERSPC (European Randomized Study of Screening for Prostate Cancer) было определено, что биопсия простаты необходима всем мужчинам с уровнем ПСА ≥3 нг/мл независимо от результатов ТРУЗИ и ПРИ. Многими муьтицентровыми рандомизированными исследованиями было доказано, что у мужчин с ПСА, находящемся в пределах от 4 до 10 нг/мл в случае диагностики РПЖ, опухоль не выходила за пределы органа. Это позволяло выполнить радикальное лечение. Тем не менее только у каждого четвертого мужчины с уровнем ПСА, находящимся в пределах от 4 до 10 нг/мл, диагностируется РПЖ, частота негативных биопсий составляет 70-80%. Низкая специфичность показателя ПСА свидетельствует о том, что его повышение может быть связано также с наличием доброкачественной гиперплазии предстательной железы (ДГПЖ) или простатита. С момента внедрения ПСА в широкую практику рак простаты стал выявляться у пациентов с отсутствием какой-либо симптоматики, особенно в относительно молодом возрасте. Это зачастую приводит к диагностированию клинически не значимого рака простаты, не угрожающего жизни и поэтому не требующего лечения. Эпидемиологические исследования показали, что РПЖ является медленно прогрессирующим заболеванием. Было подсчитано, что только один из восьми пациентов, выявленных в ходе скрининга, умирает от РПЖ при отсутствии специфического лечения. Гипердиагностика клинически не значимого РПЖ приводит к «ненужному» лечению, что грозит развитием инконтиненции, импотенции как побочных эффектов лечения и негативно отражается на качестве жизни пациентов. Более того, скрининг с использованием ПСА в ряде случаев может привести к пропуску агрессивных форм РПЖ, которые могли быть излечены в случае своевременной диагностики. Все это говорит о том, что необходимы поиск и внедрение новых биомаркеров, которые помогут более точно выявлять рак простаты на ранних стадиях.
Скрининг рака предстательной железы
Парадигма, со стороны которой исторически на РПЖ смотрят большинство урологов и онкологов, основана на точке зрения Halsted. Данная теория гласит о том, что заболевание возникает в одном месте, развивается локально и в итоге распространяется на лимфатические узлы и костную ткань. Многие специалисты сегодня остаются приверженцами данной теории и верят в необходимость ПСА скрининга и пользу от выполнения радикальной простатэктомии. Какие же мы имеем доказательства справедливости теории? Чтобы окончательно подтвердить справедливость, необходимо следующее: а) наличие инструмента скрининга, который способен выявлять клинически значимое заболевание на ранних стадиях и б) наличие воздействия, которое способно повлиять на естественное развитие заболевания. За последние 30 лет было проведено несколько рандомизированных и популяционных исследований, предоставивших критический взгляд на состоятельность парадигмы Halsted.
В 2004 г. были опубликованы результаты исследования, посвященного первому необходимому моменту. Это исследование Johanssen и соавт.. В работе приняли участие 223 пациента в Швеции с диагностированным локализованным раком простаты. Период наблюдения за пациентами составил 21 год. При прогрессе заболевания пациентам была предложена гормональная терапия или орхидэктомия. Авторы заключили, что в большинстве случаев РПЖ развивался крайне медленно. Лишь у 17% пациентов наблюдалась прогрессия заболевания в течение их жизни. При этом наиболее явным предиктором длительного наблюдения являлась степень дифференцировки опухоли.
В 2005 г. были подтверждены результаты вышеописанной работы. При этом авторы провели анализ 767 случаев выявленного локализованного рака простаты у пациентов в период с 1971 по 1984 г. Всего несколько человек умерли от рака простаты по Глисону 6 в течение 20 лет наблюдения. С другой стороны, около половины всех пациентов с опухолями по Глисону 7 и 75% с опухолями по Глисону 8-10 скончались за этот же период. Многие прожили менее 1-15 лет после установления диагноза.
Аутопсийные исследования свидетельствуют о том, что у многих мужчин менее 50 лет имеет место микрофокус рака предстательной железы. Ожидаемое количество микроскопического РПЖ у мужчин моложе 30 лет — около 5% и около 59% у мужчин 80 лет. Публикация Thompson и соавт. в 2004 г. касательно результатов исследования Prostate Cancer Prevention Trial (PCPT) указала на экстраординарное количество выявленного РПЖ у пациентов с нормальным значением ПСА. Спустя 7 лет наблюдения в данном исследовании частота выявления РПЖ в контрольной группе составила 24,4%, а в группе лечения — 18,4%, что в 4 раза выше предполагаемых в начале исследования значений. Кроме того, важным являлось распределение степеней дифференцировки опухолей по результатам биопсии. Авторы отметили, что среди пациентов со значением ПСА менее 4 нг/мл был выявлен 361 (84%) случай РПЖ по Глисону 6, 60 случаев опухоли по шкале Глисона 7 и семь случаев по Глисону 8-10. Данные результаты подтверждают тот факт, что значимое количество вновь выявленных случаев рака простаты являются медленно прогрессирующими, что соответствует результатам исследований, приведенных выше.
Неопределенность и многочисленные открытые вопросы, вызванные большой разницей между уровнем заболеваемости и смертности от рака простаты, побудили ученых инициировать проведение трех крупных рандомизированных исследований для оценки воздействия скрининга ПСА на смертность от рака простаты. Результаты двух из трех работ были опубликованы в журнале New England Journal of Medicine в 2009 r: The Prostate, Lung, Colorectal and Ovarian (PLCO) cancer screening trial, проведенное National Cancer Institute; и European Randomized Study of Screening for Prostate Cancer (ERSPC) при поддержке организации Europe Against Cancer и нескольких европейских агентств и учреждений здравоохранения. У обеих работ есть свои сильные и слабые стороны.
Исследование PLCO проводилось по общему протоколу. Набор мужчин был осуществлен с 1993 по 2001 г. в 10 центрах, расположенных в США. 76 693 мужчины прошли ежегодное тестирование ПСА в течение 6 лет и пальцевое ректальное исследование в течение 4 лет. Первичной конечной точкой исследования был показатель смертности от рака простаты. Результаты 15-летнего наблюдения были опубликованы в 2017 г. Всего было задокументировано 255 случаев смертей в активной группе (0,67% мужчин) и 244 случая смерти в контрольной группе (0,64% мужчин). Соотношение показателей смертности от рака простаты составило 1,04 при доверительном интервале 0,87-1,24, а коэффициент смертности от всех причин составил 0,977. Эти показатели указывают на отсутствие влияния скрининга ПСА и на общую смертность, и на смертность от рака простаты. Данное исследование подвергалось критике, потому что -86% мужчин в контрольной группе прошли тестирование на ПСА хотя бы один раз во время исследования, и лишь 46% мужчин из контрольной группы сдавали ПСА ежегодно (84% в группе вмешательства). Кроме того, некоторые мужчины с повышенным уровнем ПСА не направлялись на биопсию простаты.
Исследование ERSPC состояло из семи скрининговых исследований, в которых использовались разные контрольные группы, пороги значений скрининговых тестов, интервалы скрининга и разный возраст пациентов. Все центры включали основную возрастную группу мужчин в диапазоне 55-69 лет (n=162 387). В Финляндии, Швеции и Италии исследуемые мужчины идентифицированы из популяционных регистров и были рандомизированы до подписания письменного информированного согласия. В Нидерландах, Бельгии, Швейцарии и Испании исследуемые также были идентифицированы из популяционных регистров, но рандомизация проводилась только после получения согласия от предполагаемых участников. Финны составили -50%, а Голландцы -20% общего числа включенных пациентов. Только шведские и голландские испытания показали статистически значимое снижение показателей раково-специфической смертности.
Протокол скрининга, использованный в исследованиях, варьировал в зависимости от центра и календарного года. Первоначально исследования, проводимые в Бельгии и Голландии, опирались на комбинацию ПРИ, ТРУЗИ и ПСА. Позже большинство исследовательских центров полагались только на тест ПСА, за исключением Финляндии и Италии, где ПРИ использовалось для определения показаний к биопсии у мужчин со значением ПСА 2,5-3,9 нг/мл. Первоначально большинство центров в качестве порогового значения применяли уровень ПСА 4,0 нг/мл, но по мере продолжения исследования пороговое значение было снижено до 3,0 нг/мл. В большинстве случаев применялся 4-летний интервал скрининга. Лишь в Швеции скрининг проводился каждые 2 года. В отличие от PLCO, все скрининговые протоколы подразумевали выполнение последующего ТРУЗИ и биопсии простаты. Изначально во всех центрах проводилась секстантная биопсия. Позже протокол был изменен в пользу расширенной биопсии (10-18 точек).
В 2014 г. были опубликованы результаты 13-летнего наблюдения: 7408 случаев рака простаты в активной группе и 6107 в контрольной группе. Было зарегистрировано 355 летальных исходов (0,49%) в активной группе и 545 смертей (0,61%) в контрольной группе. Абсолютное снижение риска смертности составило 1,28 на каждую 1000 рандомизированных мужчин. Результаты исследования свидетельствуют о существенном снижении риска раково-специфической смертности. Однако имелись также данные о недостаточном абсолютном снижении риска раково-специфической смертности. Результаты исследования ERSPC многими учеными воспринимаются спорно. Некоторые национальные медицинские учреждения, например The USA Preventive Services Task Force, пришли к выводу, что польза от скрининга была недостаточной для нивелирования рисков и осложнений, связанных с лечением.
Результаты крупнейшего ПСА-скринингового исследования Коллегии американских патологов было опубликовано в 2018 г. В этом исследовании приняли участие 419 582 мужчины в возрасте 50-69 лет, проживающие в Великобритании. Наблюдение за пациентами завершилось в 2016 г. В активной группе мужчинам проводился ПСА- скрининг. У 6857 пациентов (11%) значение ПСА находилось в диапазоне от 3 до 19,9 нг/мл. В 5850 случаях была проведена биопсия простаты.
В данном исследовании при медиане наблюдения, равной 10 годам, 549 мужчин умерли от рака простаты в группе вмешательства и 647 мужчин в группе контроля [0,96 (95% доверительный интервал 0,85-1,08)]. Заболеваемость РПЖ была выше в активной группе (n=8054) по сравнению с контрольной группой (л=7853). Анализ причин увеличения заболеваемости в активной группе показал, что дополнительно выявленные случаи рака простаты представляли собой опухоли степени дифференцировки 6 баллов по шкале Глисона. Данные случаи преобладали в активной группе (1,7%) по сравнению с контрольной группой (1,1%). Доля опухолей высокой степени дифференцировки по шкале Глисона была невелика. Исследование Коллегии американских патологов показало, что ПСА-скрининг может выявить несколько дополнительных случаев рака простаты Глисон 3+4 в активной группе по сравнению с контрольной группой. Частота выявления случаев РПЖ Глисон 8 и более была редкой (0,7%) и не отличалась в обеих группах.
Основываясь на описанных выше исследованиях, можно говорить о том, что в настоящее время имеется достаточная доказательная база того, что при помощи ПСА-скрининга возможно диагностировать локализованный рак простаты. Однако большинство выявленных при скрининге случаев рака имели степень дифференцировки по шкале Глисона 6 (3+3). Кроме того, авторы сделали вывод, что диагностирование РПЖ высокой степени злокачественности по шкале Глисона относительно редкая ситуация и скрининговые процедуры оказывают на это крайне незначимое влияние.
Тем не менее программы скрининга рака предстательной железы получили широкое распространение, так как РПЖ является наиболее часто встречающимся онкологическим заболеванием среди мужчин в США и Европе. Целью скрининга является выявление пациентов с ранними стадиями рака простаты, отсутствием клинических проявлений, которым показано радикальное лечение. Появление ПСА в 80-е годы прошлого столетия привело к революции в ранней диагностике РПЖ. Тем не менее скрининг рака простаты имеет много сторонников и противников. Ранее в США каждый мужчина, начиная с 50 лет (лица с наследственной предрасположенностью или афроамериканцы с 40 лет), сдавал анализ крови на ПСА и обследовался ректально один раз в год до тех пор, пока ожидаемая продолжительность жизни не станет менее 10 лет. Сейчас ситуация изменилась коренным образом. В Скандинавских странах, а также в Великобритании, Австрии, Нидерландах нет агрессивной политики скрининга вследствие того, что недостаточно серьезных доказательств влияния скрининга на снижение смертности от РПЖ. Различия в системе здравоохранения и экономические факторы в разных странах также могут влиять на возможность выполнения скрининга РПЖ. В ряде стран, где отсутствует политика скрининга РПЖ (например, в Великобритании), в последние годы отмечено снижение смертности от этого заболевания. Причем уровень снижения смертности оказался сопоставимым с США, где проводится активная политика скрининга РПЖ.
Национальный институт рака США провел оценку данных выявляемое РПЖ за период с 1973 по 1999 г. Этот промежуток времени был разделен на две эры: «рге-ПСА» и «post-ПСА», которая началась в 80-х годов прошлого столетия. До внедрения ПСА-скрининга постепенный рост выявляемое РПЖ был связан с ростом количества ТУРП. После того как ТУРП стала рутинной операцией, выявляемое РПЖ стабилизировалась приблизительно на одном уровне. Обвальный рост выявляемое РПЖ произошел после широкого внедрения ПСА в качестве метода скрининга в конце 80-х годов прошлого столетия. Пик был достигнут в 1992 г., когда диагностировалось 237 случаев рака простаты на 100 000 населения в год. До 1995 г. отмечался постепенный спад выявляемое РПЖ и, начиная с 1996 г., выявляемое рака простаты находится примерно на одном уровне, который, тем не менее, выше уровня эры «рге-ПСА».
Ранняя диагностика рака простаты основывается на определении ПСА сыворотки крови. Тем не менее значимый рак простаты может быть выявлен в случае низкого уровня ПСА (≤3 нг/мл). В исследовании ERSPC процентное соотношение пациентов с выявленным в ходе скрининга раком простаты со степенью дифференцировки по Глисону ≥7 в образцах простатэктомии было сходным независимо от уровня ПСА. Более того, около 20% пациентов с уровнем ПСА ≤2,9 нг/мл имели опухоль, вышедшую за пределы простаты. Основным отличием между группами пациентов являлся объем опухолевого поражения, при уровне ПСА ≤2,9 нг/мл объем опухоли составлял 0,2 мл.
Гипердиагностика также является проблемой скрининга РПЖ, что может не зависеть от уровня ПСА, однако чаще встречается при низких значениях ПСА (менее 3 нг/мл). К примеру, в исследовании ERSPC приблизительно 15% мужчин с уровнем ПСА от 3,0 до 3,9 нг/мл, вероятно, имели клинически незначимые опухоли, критериями которых являются объем опухолевого узла <0,5 мл и сумма баллов по шкале Глисона от 4 до 5.
Другой проблемной стороной скрининга РПЖ является диагностика рака простаты на поздних стадиях. Например, по результатам канадского рандомизированного исследования было выявлено, что примерно 25% пациентов, подвергшихся скринингу, имели метастатический рак простаты в стадии ТЗ—Т4. Эти исследования наталкивают на мысль, что необходимы новые скрининговые тесты, обладающие большей специфичностью, которые могли бы точнее диагностировать пациентов с клинически значимым раком простаты.
Еще одним недостатком скрининга является то, что секстантная биопсия простаты может привести к пропуску до 25% случаев РПЖ, являющихся клинически значимыми. К примеру, по результатам одного из исследований частота выявления рака простаты по результатам повторной биопсии составила 10% у пациентов с уровнем ПСА от 4 до 10 нг/мл. При этом патоморфологические показатели оказались сходными при сравнении с опухолями, удаленными по результатам первичной биопсии. И только опухоли, выявленные по результатам третьей биопсии, имели более низкую сумму баллов по Глисону, меньший объем ракового поражения по сравнению с опухолями, выявленными в ходе первичной или повторной биопсии.
На данный момент уровень ПСА сыворотки крови, данные ПРИ и ТРУЗИ являются показанием для биопсии простаты с целью диагностики и стадирования РПЖ. Согласно последним представлениям, ПРИ и ТРУЗИ не являются обязательными методами скрининга РПЖ. В исследовании ERSPC изначально уровень ПСА ≥4 нг/мл и изменения по результатам ПРИ и/или ТРУЗИ являлись показаниями для биопсии простаты. Однако оказалось, что изменения по результатам ПРИ и/или уровне ПСА ≤1 нг/мл приводили к диагностированию РПЖ только в 2% случаев. В связи с этим данные ПРИ перестали учитываться в протоколе. Биопсии простаты стали выполняться всем пациентам с уровнем ПСА ≥3 нг/мл. Согласно данным этого исследования, включавшего около 8000 мужчин, было выяснено, что частота выявляемое™ РПЖ оказалась идентичной как в группе с пороговым значением ПСА 3 нг/мл, так и в группе с порогом нормы 4 нг/мл. Более того, морфологические характеристики рака простаты, выявленные у пациентов с порогом нормы 3 нг/мл, оказались сходными с морфологическими характеристиками больных, выявленных с помощью первоначальных критериев протокола (ПСА >4 нг/мл, изменения по данным ПРИ и/или ТРУЗИ).
Второе ключевое требование, необходимое для утверждения об эффективности ПСА-скрининга, — это доказательство, что раннее вмешательство изменяет естественное течение рака простаты.
В исследование SPCG4 (Scandinavian Prostate Cancer Group 4) с октября 1989 по февраль 1999 г. включены 695 пациентов с локализованным раком простаты с последующей рандомизацией в две группы: для проведения радикальной простатэктомии и активного наблюдения с возможным последующим выполнением оперативного лечения. Большинство пациентов имели клинически значимый рак простаты; лишь у 12% на момент включения в исследование заболевание соответствовало стадии Tie. Возраст пациентов <75 лет с ожидаемой продолжительностью жизни ≥10 лет и уровнем ПСА <50 нг/мл. Важно, что исследование было ограничено случаями высокодифференцированного рака простаты. Пациенты, перенесшие оперативное вмешательство, при появлении признаков местного рецидива получали антиандрогенную терапию. Мужчины с подтвержденными метастазами или повышением уровня ПСА также получали антиандрогенную терапию. По состоянию на декабрь 2017 г. из 695 пациентов умерли 553 (80%). Был отмечен 71 случай в группе радикальной простатэктомии (РП) и 110 случаев в группе ожидания РП смерти от рака простаты (р <0,001). Разница в абсолютном риске составила 11,7%. Среди тех, кому была проведена радикальная операция, степень дифференцировки по Глисону была самым сильным предиктором исхода. Пациенты с раком предстательной железы и суммой баллов по шкале Глисона ≥8 имеют риск смертности в 10 раз выше по сравнению с пациентами с суммой баллов по шкале Глисона ≤7. При экстракапсулярном распространении РПЖ риск смертности возрастает пятикратно, однако только треть мужчин с данным показателем фактически умерли от рака простаты. Авторы предположили, что локальное распространение процесса не оказывает выраженного влияния на раково-специфическую смертность. У пациентов с клинически значимым, локализованным РПЖ и проведенной РП средний прирост к продолжительности жизни составил 2,9 года. Эффект от операции среди мужчин в возрасте моложе 65 лет на момент постановки диагноза был выше по сравнению с мужчинами старше 65. Среди мужчин в возрасте ^65 лет на момент постановки диагноза относительный риск смерти по любой причине составил 0,86. Было предположено, что проведение оперативного лечения пожилым пациентам не сказывается положительно на продолжительности жизни, однако снижает риск смерти от РПЖ, в том числе при метастатических осложнениях.
В исследовании PIVOT в период с ноября 1994 г. по январь 2002 г. участвовал 731 пациент с локализованным РПЖ. Критерии отбора были аналогичны таковым исследования SPCG4. Однако около 50% случаев рака предстательной железы были выявлены при помощи ПСА. В 48% случаев РПЖ сумма баллов по шкале Глисона была 7 и более и в 66% случаев диагностирована опухоль промежуточного или высокого риска. Средний возраст пациентов при постановке диагноза — 67 лет (64 года в SPCG4), и многие из мужчин имели серьезные сопутствующие заболевания. Результаты исследования при медиане наблюдения в 18,6 года: 246 (68%) из числа 346 оперированных мужчин и 269 (73%) из 367 отобранных для наблюдения умерли. Относительный риск смерти от любой причины составил 0,92. Это соответствует изменению показателя общей смертности по любой причине с 4,0% через 5 лет до 5,7% через 22,1 года наблюдения. Аналогично результатам исследования SPCG4 мужчины в возрасте моложе 65 лет на момент постановки диагноза имели более низкий риск смерти от рака простаты спустя 18 лет наблюдения по сравнению с мужчинами в возрасте старше 65 лет (9,2 vs 4,4%). Авторы пришли к выводу, что мужчины с локализованным РПЖ и ожидаемой продолжительностью жизни более 20 лет могут потенциально ожидать увеличения данного показателя на 1 год после выполнения радикального оперативного лечения. Также наиболее вероятен умеренный эффект от оперативного лечения у более молодых и здоровых мужчин с РПЖ промежуточного риска. Мужчинам с РПЖ низкого риска стоит ожидать незначительный эффект от РП в отношении увеличения предполагаемой продолжительности жизни.
В исследование ProtecT с 1999 по 2009 г. рандомизированы 1643 мужчины с локализованным РПЖ. Данное исследование несколько отличается от SPCG4 и PIVOT. Во-первых, всем мужчинам, зарегистрированным для участия в исследовании, диагноз РПЖ выставлялся, исключительно опираясь на уровень ПСА (n=1643). Во-вторых, пациенты были разделены на три группы: группа хирургического вмешательства (n=553), дистанционной лучевой терапии (n=545) и активного наблюдения (n=545). В-третьих, возраст участников был несколько меньше. Лишь 17% пациентов были в возрасте старше 65 лет и 28% от 50 до 54 лет на момент постановки диагноза. В-четвертых, срок наблюдения на сегодняшний день составляет немногим более 10 лет. Поскольку набор пациентов был обусловлен исключительно результатами тестирования ПСА, это не могло не сказаться на частоте выявляемого РПЖ низкого риска. В 76% случаев было диагностировано заболевание с суммой баллов по шкале Глисона 6, в 21% — 7 баллов, лишь в 3% — 8-10 баллов. В 66% случаев отмечен РПЖ низкого риска и в 34% среднего/высокого риска. В четверти случаев опухоль была пальпируема при пальцевом ректальном исследовании, в оставшихся случаях была выставлена стадия заболевания T1c. Большинство пациентов согласились на методы лечения соответственно рандомизации (активное наблюдение 88%, хирургический 71% и лучевая терапия 74%) и получили лечение в 9-месячный период после рандомизации. Более половины (55%) пациентов из группы активного наблюдения перенесли операцию или облучение в течение периода наблюдения. Около половины из них перенесли радикальную простатэктомию, дистанционную лучевую терапию — 33% пациентов, брахитерапию — 8%, в 9% случаев применялась другая непротокольная лучевая терапия. Общая смертность в течение 10 лет наблюдения составила 10%. Отмечено лишь 17 смертей от рака простаты (1,0%). Раково-специфическая выживаемость составила 98,8% без значительного различия между тремя группами. У 204 мужчин (12,4%) в течение периода наблюдения отмечено прогрессирование заболевания. Данный показатель был выше в группе активного наблюдения. Авторы пришли к выводу, что раково-специфическая смертность при диагностировании заболевания во время ПСА- скрининга была низкой в течение 10 лет с момента постановки диагноза независимо от полученного лечения. Однако были существенные различия в функциональных результатах, что оказало существенное влияние на качество жизни пациентов.

Рис. 2.1. Гистологическая классификация РПЖ по Глисону: а — первоначальная шкала градации, предложенная Д. Глисоном; б — схема градации, утвержденная ВОЗ после пересмотра в 2005 г.; в — схема градации, утвержденная ВОЗ после пересмотра 2012 г.
4. Грейд 4 наиболее широко представлен сливающимися, плохо сформированными железами. Тангенциальный срез желез 3 паттерна может имитировать железы 4 паттерна, что важно помнить при оценке образцов простаты, что обычно является основной причиной завышения балла при оценке биопсийного материала. Наиболее распространены в 4-м грейде решетчатые железистые структуры правильной и неправильной формы. Кроме того, встречаются так называемые гипернефроматоидные железы, представленные солидными пластами желез, состоящих из клеток с оптически светлой цитоплазмой.
5. Грейд 5 характеризуется отсутствием железистой дифференцировки. Может быть представлен в виде солидных структур, шнуров клеток или единичных, в том числе перстневидных, опухолевых клеток. Также включает в себя солидные решетчатые или папиллярные структуры с центральным комедонекрозом.
Для того чтобы оценить степень дифференцировки опухоли по системе градации Глисона, в биопсии простаты суммируют наиболее распространенный и наиболее тяжелый паттерн (грейд). Если наименее высокий паттерн встречается менее, чем в 5% ткани, его не указывают в гистологическом заключении, но обязательно указывают более высокой паттерн, даже если он занимает менее 5% исследованного материала (рис. 2.2).
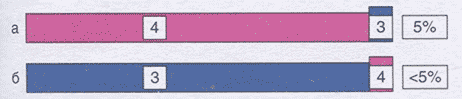
Рис. 2.2. Сумма баллов по системе градации Глисона 4+4=(а); сумма баллов по системе градации Глисона 3+4=7 (б)
Сумма баллов служит важным прогностическим критерием, позволяющим предположить скорость прогрессирования заболевания, метастазирования и прогнозировать выживаемость. Следует отметить, что для объективной оценки биопсийного материала и прогнозирования течения заболевания необходимым является количество взятых биоптатов не менее 10-12, размещение биоптатов в отдельные контейнеры (так называемое «картирование» биопсии предстательной железы) с последующей заливкой в блок не более двух биоптатов; при этом длина каждого биоптата должна быть не менее 1 см. Кроме того, существенным моментом является профессионализм лаборантов, обеспечивающий надлежащую заливку и микротомию биопсийного материала. Множество столбиков в одной кассете приводит к неравномерной заливке парафином биопсийного столбика и может привести к потере значительного количества материала для гистологического исследования (рис. 2.3).
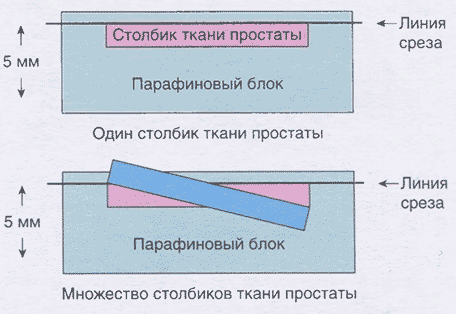
Рис. 2.3. При заливке нескольких столбиков в парафиновый блок отмечается неравномерное расстояние относительно горизонтальной линии среза, что приводит к значительной потере ткани во время микротомии
Несмотря на то что система градации Глисона претерпела ряд изменений, до сих пор существует множество вопросов как у клиницистов, так и у пациентов в отношении прогноза течения заболевания. Например, показатели Глисона ≤6 могут быть расценены клиницистами как высокодифференцированная опухоль, а показатель Глисона 8-10 как одинаково низкодифференцированная опухоль. Сумма баллов 3+4=7 не тождественна сумме баллов 4+3=7, имеющей худший прогноз. Многочисленные исследования показали, что опухоли с показателем Глисона 7 значительно более агрессивны, чем новообразования с показателем Глисона ≤6 баллов. Некоторым больным с опухолями, соответствующими степени дифференцировки по Глисону ≤6, выбирается тактика активного наблюдения, в то время как с показателем Глисона 7 большинство урологов выбирают тактику активного лечения.
В ноябре 2014 г. в Чикаго состоялся экспертный совет, на котором была предложена новая система гистологической градации рака простаты. В обсуждении приняли участие 67 уропатологов из 21 страны мира, а также 20 урологов и онкоурологов, которые поддержали данную инициативу.
Консенсусом предложено использование прогностических групп, выделенных на основании суммы баллов по системе градации Глисона и их корреляции с пятилетней выживаемостью без биохимического рецидива. В исследовании приняли участие 5 крупных научно-практических центров (University of Pittsburgh, Memorial Sloan Kettering Cancer Center, Cleveland Clinic Foundation, Karolinska University, Johns Hopkins University), в анализ вошли 21 226 пациентов (табл. 2.1).
Таблица 2.1. Безрецидивная биохимическая выживаемость в прогностических группах
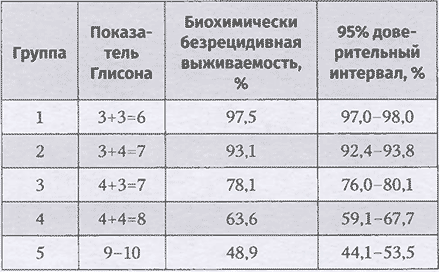
Таким образом, консенсусом предложено наряду с традиционной гистопатологической градацией опухоли по системе градации Глисона указывать прогностическую группу, которая будет соответствовать сумме баллов по шкале Глисона.
• Сумма баллов не более 6 — прогностическая группа I/V.
• Сумма баллов 3+4=7 — прогностическая группа II/V.
• Сумма баллов 4+3=7 — прогностическая группа III/V.
• Сумма баллов 8 (4+4/3+5/5+3) — прогностическая группа IV/V.
• Сумма баллов 9-10 (4+4/5+4/5+5) — прогностическая группа V/V.
Ниже представлена схема оценки первичной опухоли, согласно Международной классификации РПЖ по системе TNM, которая была дополнена и пересмотрена в 2010 г. (рис. 2.4), где Т1а — опухоль занимает ≤5% материала после ТУРП, T1b — >5% после ТУРП, T1e — опухоль выявлена при биопсии простаты, Т2а — опухоль занимает менее половины одной доли простаты, Т2Ь — одну долю простаты, Т2с — обе доли простаты, ТЗа — опухоль выходит за пределы капсулы простаты с одной или с обеих сторон либо определяется микроскопическая инвазия в шейку мочевого пузыря, ТЗЬ — определяется инвазия одного или обоих семенных пузырьков, Т4 — опухоль вовлекает окружающие структуры: стенку мочевого пузыря, наружный сфинктер уретры, прямую кишку, леваторы, мышцы тазового дна.
Дополнительный материал к лекции
ПСА при раке предстательной железы. Лекция для врачей
Ранняя диагностика рака предстательной железы
Купить книгу "Робот-ассистированная урология: национальное руководство" - Пушкарь Д. Ю.
Книга "Робот-ассистированная урология: национальное руководство"
Автор: Пушкарь Д. Ю.

Робот-ассистированная хирургия — молодое, стремительно развивающееся направление в современной медицине. Интеллектуальные технологии затрагивают все больше областей хирургической практики, и сегодня с уверенностью можно сказать, что робот-ассистированные технологии являются значимым прорывом, позволяющим оказывать наиболее качественную помощь пациентам в различных направлениях терапии. В настоящем руководстве не только представлена история развития данного направления, современные тенденции роботической урологии, но и раскрыто будущее этого перспективного метода.
Издание предназначено врачам различного профиля: урологам, хирургам, гинекологам и другим специалистам, также может использоваться в качестве учебного пособия для студентов медицинских вузов.
Купить книгу "Робот-ассистированная урология: национальное руководство" - Пушкарь Д. Ю.
Содержание книги "Робот-ассистированная урология: национальное руководство" - Пушкарь Д. Ю.
Часть I. Робот-ассистированная хирургия предстательной железы
Глава 1. История развития робот-ассистированной хирургии
Глава 2. Ранняя диагностика рака предстательной железы
Глава 3. Анатомические аспекты успешного выполнения функциональной робот-ассистированной радикальной простатэктомии
Глава 4. Различные техники выполнения робот-ассистированной радикальной простатэктомии
Глава 5. Робот-ассистированная тазовая лимфаденэктомия
Глава 6. Атлас трасперитонеальной роботассистированной радикальной простатэктомии
Глава 7. Особенности ассистенции при выполнении робот-ассиcтированной радикальной простатэктомии.
Опыт клиники урологии МГМСУ
Глава 8. Некоторые особенности анестезиологического пособия при выполнении роботической радикальной простатэктомии
Глава 9. Сальважная робот-ассистированная радикальная простатэктомия
Глава 10. Робот-ассистированная радикальная простатэктомия.
Сложные случаи
Глава 11. Робот-ассистированная радикальная простатэктомия у пациентов с раком предстательной железы высокого риска
Глава 12. Анатомия и физиология удержания мочи и эректильной функции
Глава 13. Сексуальная реабилитация пациентов после перенесенной робот-ассистированной радикальной простатэктомии
Глава 14. Удержание мочи и контролируемое мочеиспускание у пациентов после перенесенной робот- ассистированной радикальной простатэктомии
Глава 15. Онкологические и функциональные результаты радикальной простатэктомии
Глава 16. Гистоморфологические исследования до и после операции
Глава 17. Робот-ассистированная аденомэктомия (простатэктомия)
Часть II. Робот-ассистированная хирургия верхних мочевых путей
Глава 18. Робот-ассистированная адреналэктомия
Глава 19. Операции на почке. Сравнение робот-ассистированной и лапароскопической техники
Глава 20. Робот-ассистированная резекция почки
Глава 21. Робот-ассистированная нефруретерэктомия
Часть III. Робот-ассистированная радикальная цистэктомия
Глава 22. Робот-ассистированная радикальная цистэктомия
Глава 23. Робот-ассистированная расширенная лимфаденэктомия при раке мочевого пузыря
Глава 24. Робот-ассистированная радикальная цистэктомия с формированием механизма отведения мочи: осложнения и результаты
Глава 25. Сравнение робот-ассистированной и открытой техник выполнения радикальной цистэктомии
Часть IV. Робот-ассистированная реконструктивнопластическая хирургия
Глава 26. Робот-ассистированная сакрокольпопексия
Глава 27. Робот-ассистированная реимплантация мочеточника
Глава 28. Робот-ассистированная микрохирургия в урологии
Часть V. Роботическая программа
Глава 29. Создание успешной роботической программы
Глава 30. Некоторые вопросы обучения робот-ассистированной хирургии
Глава 31. Роботическая программа ГБУЗ «Московский клинический научный центр им. А.С. Логинова Департамента здравоохранения г. Москвы»
Глава 32. Робот-ассистированная хирургия
Перспективы и технологии
Глава 33. Нехирургические аспекты внедрения робот-ассистированной хирургии. Взгляд инженера
Купить книгу "Робот-ассистированная урология: национальное руководство" - Пушкарь Д. Ю.






















































































0 комментариев