Ультразвуковой скрининг при многоплодной беременности. Синдром фето-фетальной трансфузии и обратная артериальная перфузия. Лекция для врачей
Лекция для врачей "Ультразвуковой скрининг при многоплодии. Синдром фето-фетальной трансфузии и обратная артериальная перфузия". Лекцию для врачей проводит доктор медицинских наук, профессор кафедры акушерства, гинекологии и репродуктологии Н. Г. Павлова
На лекции рассмотрены следующие вопросы:
- Частота рождения двоен
- при индукции овуляции - 16 - 39%
- при ЭКО - до 23% зависит от числа перенесенных эмбрионов
- Варианты многоплодия
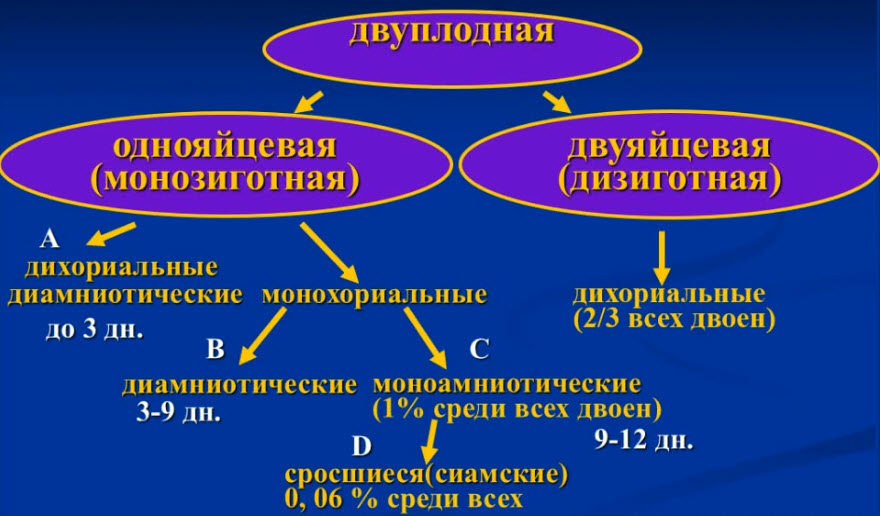
- Варианты многоплодия
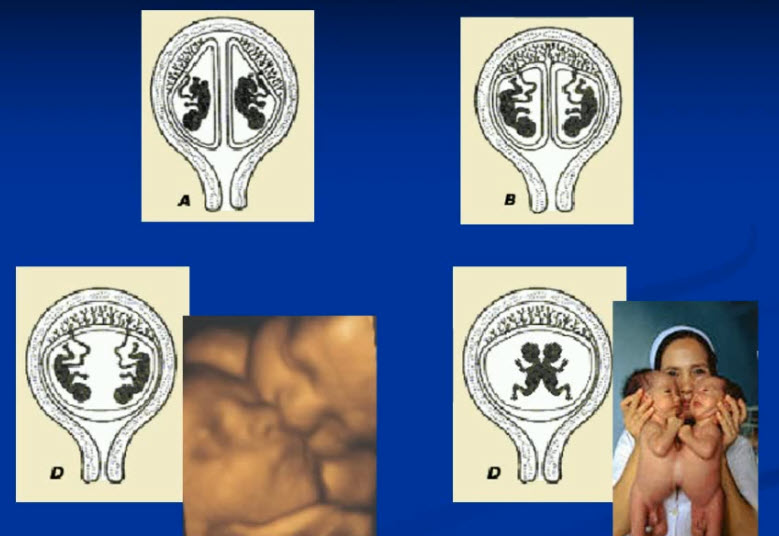
- Ксилоомфолопаги
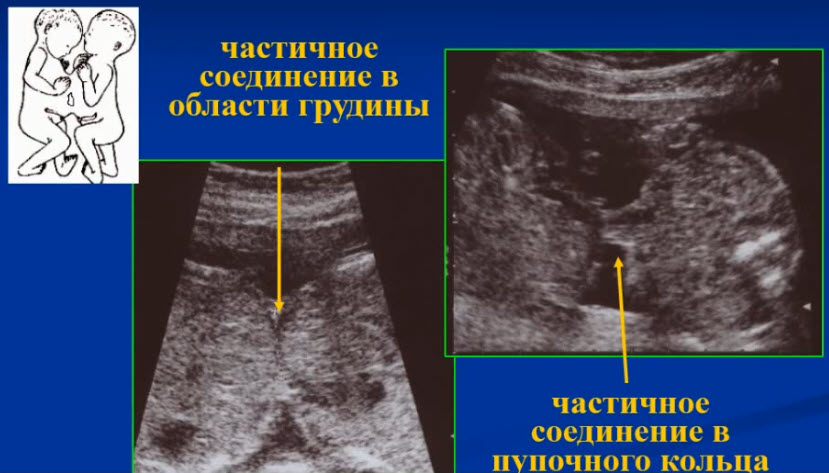
- Осложнения многоплодной беременности
- Преждевременные роды - в 7 - 10 раз выше, чем при одноплодии плацентарная недостаточность с развитием гипотрофии плодов
- Синдром фето-фетальной трансфузии (синдром многоводия-маловодия)- в 25% случаев монохориальных двоен - высокий уровень перинатальной смертности (20-132 на 1000 родившихся)
- Синдром обратной артериальной перфузии - 1%
- УЗИ в I триместре
- количество плодов
- хориальность
- амниональность
- количество желтых тел в яичниках
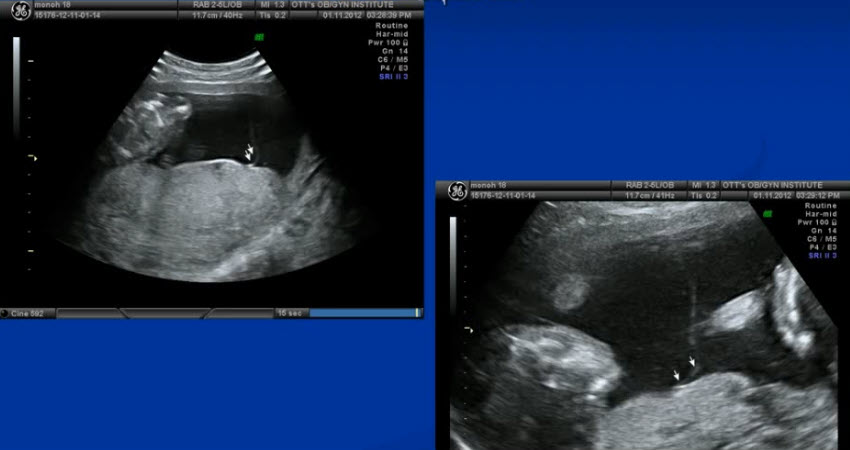
- Дихориальная двойня 11/12 недель
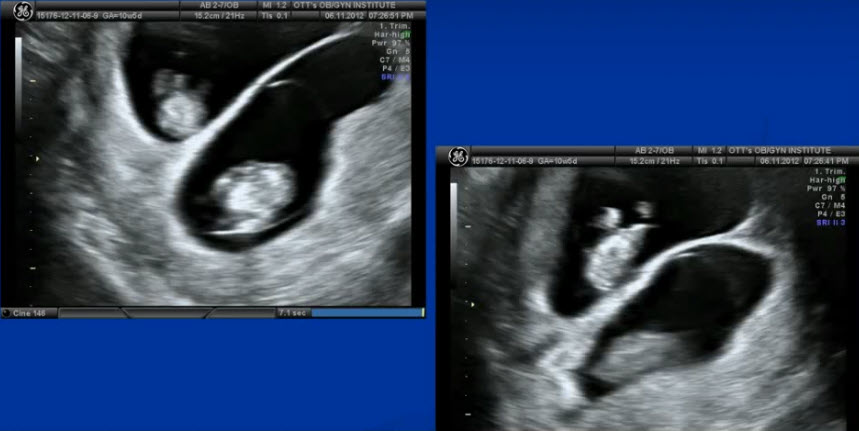
- Монохориальная двойня 18 недель
- Патогенез СФФТ (фето-фетальный трансфузионный синдром)
- Монохориальная плацента (артерио-венозные анастомозы)
- Диагностика СФФТ
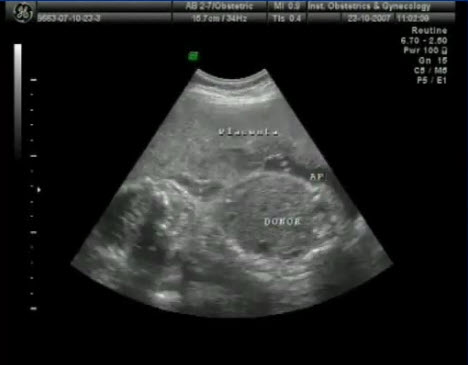
- Многоводие одного из плодов при маловодии или ангидрамнионе другого
- Диссоциация фотометрических параметров плодов одного пола
- Выраженные различия диаметров поперечного сечения пуповин реципиента и донора
- У донора - часто единственная артерия пуповины
- Диагностика СФФТ
- Увеличение размеров мочевого пузыря у плода-реципиента и уменьшение его размеров или невозможность визуализации у плода донора
- Наличие единой плаценты с зонами различной эхогенности
- Водянка одного из плодов или появление у него ультразвуковых признаков сердечнососудистой недостаточности возможно сочетание нескольких ультразвуковых признаков
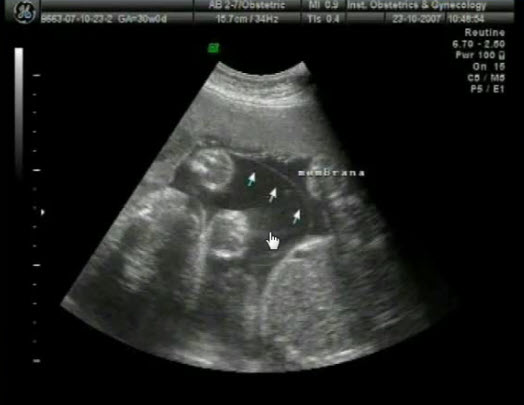
- СФФТ межамниотическая мембрана
- СФФТ диссоциация развития плодов
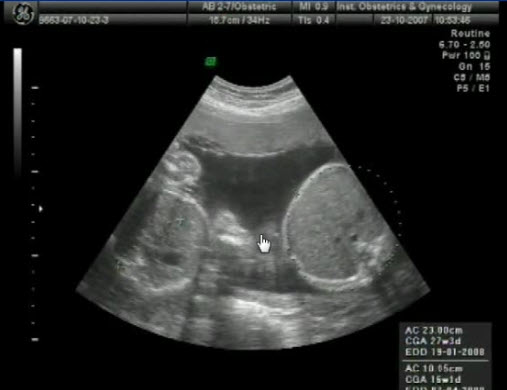
- Диссоциированное развитие плодов
- Различие по массе более 15%
- Возрастает в 5 раз риск перинатальной смертности
- Стадии синдрома фето-фетальной трансфузии (R.A.Quintero)
- I мочевой пузырь донора визуализируется, показатели кровотока в норме
- II мочевой пузырь донора не визуализируется, показатели кровотока в норме
- III критические показатели артериального или венозного кровотока у одного из плодов, реципиент может страдать также как донор
- IV водянка плода - реципиента
- V гибель обоих плодов
- Допплерометрия при СФФТ

- TAPS при многоплодной беременности
- TAPS или возврат TTTS после 26 недели - 4% TAPS: MCA РSV дон >1,5 МоМ, MCA PSVpeц < l,0 МоМ
- до 30-й недели — внутриутробные трансфузии после 30-й недели - родоразрешение
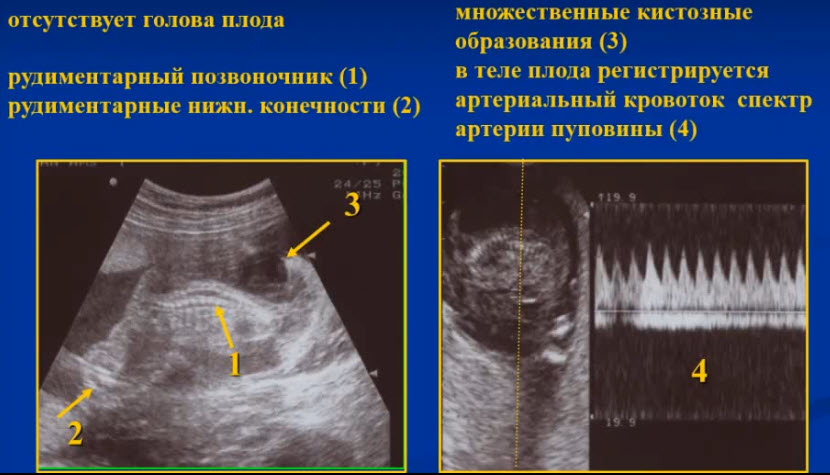
- Обратная артериальная перфузия (ОАП - TRAP) или акардиальная двойня или CHORIOANGIOPAGUS PARASITICUS
- В1% монохориальных двоен (1:35000 родов)
- Встречается при диамниотической и при моноамниотической двойне
- В 25% случаев ОАП - моноамниотическая двойня
- Патогенез ОАП. Предмет дискуссии - что первично?
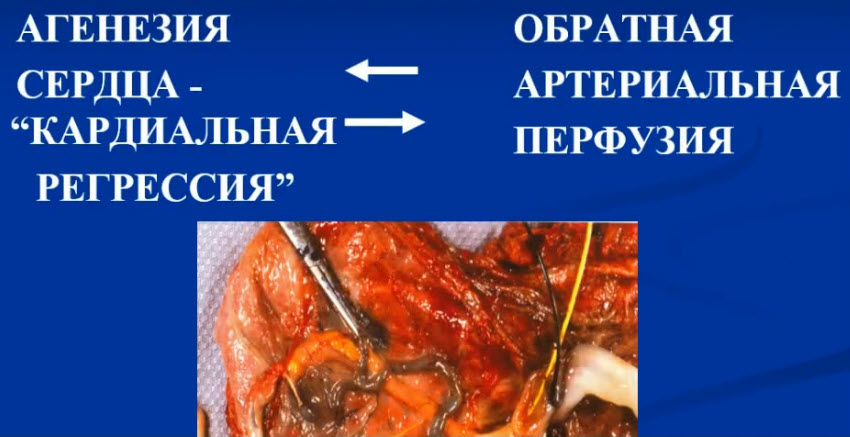
- ОАП-СФФТ монохориальные двойни, внутриплацентарные шунты от донора к реципиенту
- СФФТ
- Шунт через артериовенозные анастомозы
- Оба плода, как правило, не имеют пороков развития
- Сердечная недостаточность, в первую очередь, формируется у плода реципиента
- ОАП
- Шунт через артериовенозные анастомоз
- Плод - реципиент имеет серьёзные пороки развития сердечная
- Сердечная недостаточность, в первую очередь, формируется у плода донора
- СФФТ
- Схема кровообращения
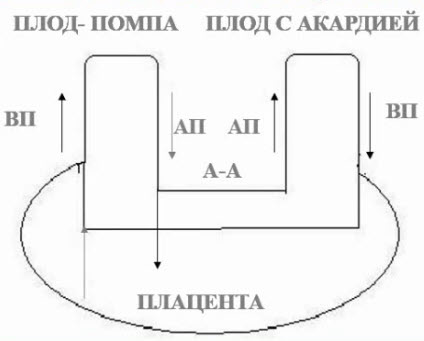
- Перинатальные исходы
- Зависят от соотношения масс акардиального и помпового плодов
- Чем больше масса акардиакуса, тем выше риск развития сердечной недостаточности (СН) у плода-помпы
- При массе плода-акардиакуса > 50 % от массы плода-помпы риск сердечной недостаточности у последнего до 90%
- При массе плода-акардиакуса < 25% -благоприятный исход без терапии
- Варианты акардиальных монстров
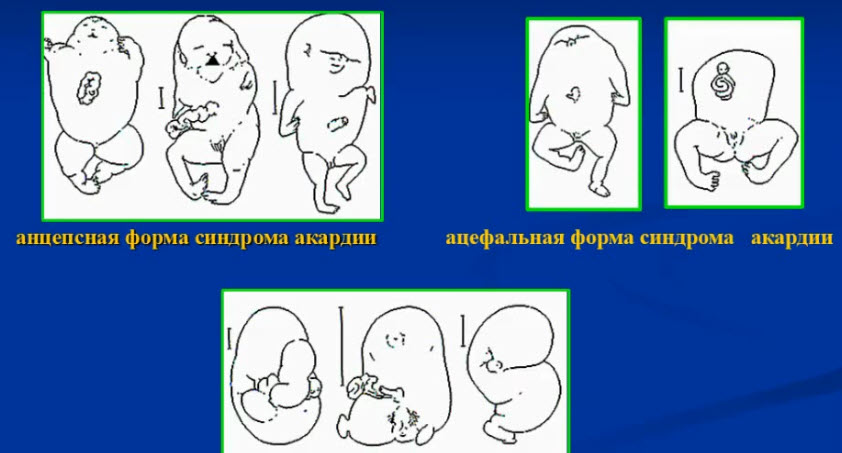
- Анцепсная форма синдрома акардии
- Лечение СФФТ
- сердечные гликозиды
- индометацин
- серийные амниоцентезы
- селективная лазерная коагуляция анастомозов
- окклюзия пуповины плода
- Способы прерывания кровотока акардиального плода
- Эмболизация
- Лигирование пуповины
- Интрафетальная абляция
- Моно- и биполярная коагуляция
- Небольшая продолжительность операции
- Не нарушается межамниотическая перегородка
- Снижение риска развития синдрома амниотических перетяжек и переплетения пуповин
- Исходы хирургического лечения ОАП (ДАННЫЕ ЛИТЕРАТУРЫ)
- Самое частое осложнение - Преждевременное излитие околоплодных вод 22 % случаев, в т.ч. в первые 4 недели - 59 %; в более отдалённые сроки 41% (А.С. Rossi ,V D’Addario, 2009)
- При окклюзии в 21 - 36 недель - выживаемость плода-помпы - 76% ( T.Y.Tan, W.Sepulveda, 2003)
- Наилучшие исходы при окклюзии в 17 -26 недель
Дополнительный материал
Условные сокращения
АА — артерио-артериальный
АВ — артерио-венозный
ВВ — вено-венозный
ИКСИ — интрацитоплазматическая инъекция сперматозоида
МСС — максимальная систолическая скорость
МХДА — монохориальная диамниотическая двойня
САП — синдром анемии-полицитемии
СМА — средняя мозговая артерия
ТАР — трансабдоминальная амниоредукция
УЗИ — ультразвуковое исследование
ФЛК — фетоскопическая лазерная коагуляция анастомозов
ФФТС — фето-фетальный трансфузионный синдром
Введение
Монохориальное многоплодие является беременностью высокого риска в отношении неблагоприятных перинатальных исходов. Ангиоархитектура единой для двух плодов плаценты определяет как характер специфических осложнений, так и походы к их коррекции. ФФТС — одно из самых серьезных состояний, встречающихся исключительно при монохориальном многоплодии. Процесс изучения ФФТС является хорошим примером достижений в перинатальной медицине — смена диагностических критериев от педиатрических к пренатальным, развитие пренатального прогнозирования и подходов к лечению и динамическому наблюдению. ФФТС развивается примерно в 10—15% монохориальных двоен, т.е. примерно с частотой 1—3 на 10 000 беременностей. Учитывая широкое использование вспомогательных репродуктивных технологий, распространенность двоен продолжает расти. В 2012 г. в США было зарегистрированы 3 952 841 роды с частотой рождения двоен 33,1 на 1000, или 130 839 беременностей двойней, среди которых у 2—3%, или 3238 двоен крайне высок риск ФФТС. Применение вспомогательных репродуктивных технологий, в особенности интрацито- плазматической инъекции сперматозоида (ИКСИ) и отсроченного переноса эмбриона, увеличивает риск монохориальной плацентации в 3—4 раза. Также риск развития ФФТС увеличивается с возрастом матери.
Целью настоящего пособия является представить современный взгляд на патофизиологию, диагностику, подходы к лечению и наблюдению беременности, осложненной ФФТС.
Патогенез фето-фетального трансфузионного синдрома
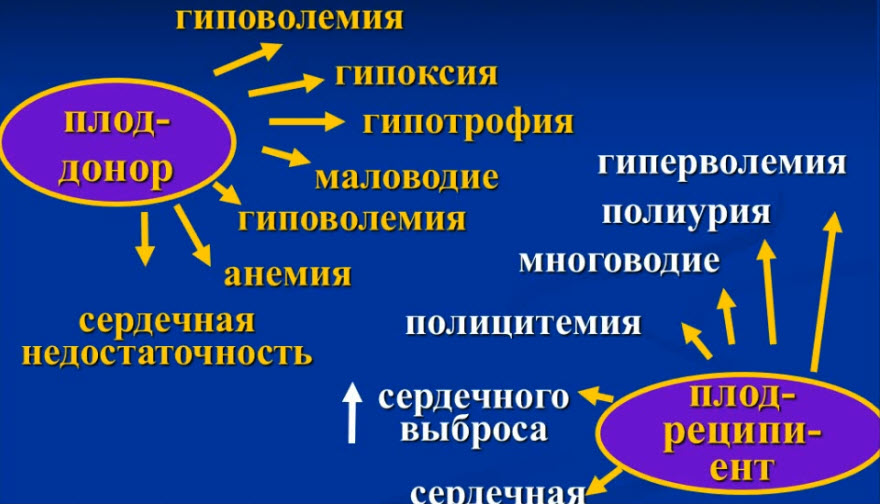
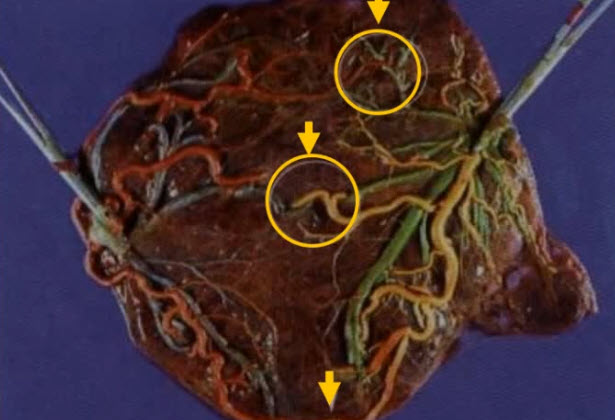
Большинство исследователей считают, что ФФТС и синдром анемии-полицитемии (САП) развиваются вследствие несбалансированного сброса крови по васкулярным анастомозам общей плаценты. При фето-фетальном трансфузионном синдроме выделяют три типа анастомозов: поверхностные артерио-артериальные (АА), поверхностные вено-венозные (ВВ) и глубокие артериовенозные (ЛВ). Поверхностные анастомозы являются прямым сообщением между двумя участками вхождения пуповин, их ветви видны визуально и соединяются на поверхности плацентарной пластинки. Этот тип анастомозов обеспечивает быстрый сброс крови между плодами в обоих направлениях в зависимости от разницы в давлении в артериальной и венозной системах. В большинстве случаев трансфузия крови между плодами по АВ-анастомозам обычно сбалансирована и только в 15% развивается ФФТС. В соответствии с гипотезой «асимметричной редукции плацентарных анастомозов», существует множество двунаправленных артерио-венозных сообщений на ранних сроках беременности, но с ее прогрессированием происходит спонтанное закрытие или разрыв этих анастомозов. Наиболее тяжелые случаи ФФТС связаны с наличием глубоких артерио-венозных анастомозов и отсутствием поверхностных артерио-артериальных и вено-венозных. В случае если котиледон снабжается артерией от одного плода из двойни и дренируется веной другого плода, есть потенциальный риск сброса крови от донора (с артериальной стороны) к реципиенту (с венозной стороны). В такой ситуации более вероятно преобладание однонаправленных артерио-венозных анастомозов, чем двунаправленных артерио-артериальных. В таком случае формируется дисбаланс между кровотоком по мелким сосудам плаценты от плода-донора к плоду-реципиенту, что приводит к диссоциации развития плодов и развитию ФФТС. Артерио-артериальные и вено-венозные сообщения, в свою очередь, оказывают протективное действие и могут компенсировать артериовенозный сброс путем шунтирования кровотока между плодом и реципиентом (Denbow и соавт.). Несмотря на то что анастомозы и, как следствие этого, сброс крови между плодами имеются при всех монохориальных двойнях, ФФТС обычно развивается только при диамниотических двойнях. Это вероятно связано с тем, что при моноамниотических беременностях больше двунаправленных поверхностных анастомозов, чем при диамниотических.
Нарушенная васкулярная анатомия и аномальный сброс крови не единственные факторы, приводящие к развитию ФФТС. В настоящее время активно обсуждаются теории развития ФФТС как следствие нарушения регуляции транспорта жидкости через плаценту и амниотические оболочки. Варна и соавт. в 2003 г. исследовали роль натриуретического пептида в регуляции объема амниотической жидкости при монохориальных двойнях, осложненных хроническим ФФТС. Их данные показали, что концентрация натриуретического пептида коррелирует с количеством околоплодных вод. Концентрации натриуретического пептида у реципиентов с многоводием были почти в 7 раз выше, чем у доноров с маловодием. В другом исследовании Варна и соавт. в 1999 г. исследовали роль потенциального вазоконстрикторного фактора эндотелина-1 при ФФТС. В исследовании было показано повышение уровня эндотелина-1 у реципиента при тяжелом ФФТС, при этом причину этого явления объяснить не удалось. По одной из гипотез причиной выработки эндотелина является гипоксия, вследствие нарушения газообмена в части плаценты, принадлежащей реципиенту.
Кроме того, важную роль могут играть изменения в работе ренин-ангиотензиновой системы, которая активирована у донора и подавлена у реципиента. Увеличение концентрации ренина и ангиотензина снижает почечный и плацентарный кровоток донора, приводя к олигурии, маловодию и замедлению роста плода. Более того, эндотелин-1 и сброс ренина по анастомозам плаценты может быть причиной гипертензивной кардомиопатии у реципиента. Учитывая вышесказанное, оценка этих вазоактивных факторов может иметь большое значение в понимании патогенеза ФФТС.
При монохориальных двойнях первичное нарушение развития донорской части плаценты приводит к повышению периферического сопротивления плацентарной циркуляции, что приводит к сбросу крови к реципиенту, таким образом, донор страдает от гиповолемии вследствие кровопотери и гипоксии вследствие плацентарной недостаточности. Реципиент пытается компенсировать гиперволемию полиурией, но так как белки крови, остающиеся в его кровеносном русле, повышают онкотическое давление это приводит к перераспределению жидкости через плаценту из материнского организма.
На фоне прогрессирования кардиальной дисфункции у реципиента часто развиваются асцит и генерализованный отек и антенатальная гибель плода, что приводит к гипотензии у плода-донора, вследствие сброса крови по внутриплацентарным анастомозам. Это может приводить к внутримозговым кровоизлияниям и ишемии вплоть до гибели донора. Подобная картина развивается и при гибели донора, у реципиента также развивается гипотензия вследствие сброса крови по открытым анастомозам, однако вследствие снижения преднагрузки это может даже улучшить состояние плода-реципиента и его кардиофункцию.
Другой причиной высокой смертности и заболеваемости, связанной с ФФТС, являются преждевременные роды, вызванные многоводием плода-реципиента или антенатальной гибелью одного из плодов, что может приводить к гибели или неблагоприятным неврологическим последствиям для плода или новорожденного. По данным разных авторов неврологические нарушения встречаются среди 18—26% выживших при ФФТС.
Клинические проявления фето-фетального трансфузионного синдрома
Принципиальным клиническим признаком ФФТС является сочетание гиперволемии у плода-реципиента и гиповолемии у плода-донора с последующим возможным присоединением вторичных кардиоваскулярных изменений. Следует принимать во внимание, что признаки гипо- и гиперволемии изменяются в течение беременности, поэтому клиническая картина в первом и втором триместрах может различаться.
В первом триместре мочепродукция плодов вносит небольшой вклад в количество околоплодных вод, соответственно сочетание гипо- и гиперволемии не так выражено, как при поздних сроках беременности. На ранних сроках беременности основными признаками дисбаланса околоплодных вод являются дискордантность толщины воротникового пространства, а также аномалии кровотока в венозном протоке и трикуспидальная регургитация. Во втором триместре ведущим симптомом является наличие полиурии реципиента и олигурии донора. Нарастающее многоводие и кардиоваскулярные проявления у плодов определяют риск преждевременных родов, поражения внутренних органов и мертворождения. Гиперволемия реципиента проявляется при ультразвуковом исследовании наличием увеличенного в объеме перерастянутого мочевого пузыря, с нарушенной функцией сократимости и увеличением максимального кармана амниотической жидкости. У плода реципиента снижается частота опорожнения мочевого пузыря вплоть до полного отсутствия его наполнения в течение 60 мин. Проявления кардиальной дисфункции — атриовентрикулярная регургитация и реверсивный кровоток в дуге аорты. Последующее повышение пульсационного индекса в венозном протоке и наличие пульсовых волн в вене пуповины сопровождают формирование отека плода.
В третьем триместре беременности на передний план выходит диссоциация роста плодов и околоплодных вод, повышение сократительной активности матки может прогрессивно ухудшать гемодинамику плодов. Симптомы со стороны матери обусловлены многоводием, которое приводит к перерастяжению стенки матки, укорочению шейки матки и преждевременным родам. Довольно редким осложнением может быть развитие синдрома зеркала, выражающегося в анасарке у матери на фоне генерализованного отека плода. В случае быстрого развития отечного синдрома у матери в сочетании с дыхательной и сердечно-сосудистой недостаточностью следует исключить ФФТС.
Кроме хронического течения, в 2,5% случаев описана острая форма ФФТС, характеризующаяся разницей уровней гемоглобина у плодов более 80 г/л без ретикулоцитоза или гиповолемическим шоком. Эта форма течения ФФТС более характерна для первородящих при родах через естественные родовые пути.
Диагностика фето-фетального трансфузионного синдрома
Для диагностики ФФТС необходимо соблюдение следующих ультразвуковых критериев:
1) монохориальность;
2) наличие максимального кармана амниотической жидкости <2,0 с с одной стороны амниотической мембраны и >8,0 см — на другой стороне.
После установления диагноза ФФТС его стадия определяется в соответствии с классификацией Quintero:
Стадия I: соблюдены критерии ФФТС без признаков более тяжелых стадий.
Стадия II: мочевой пузырь донора не визуализируется при 60-минутном ультразвуковом исследовании, допплеровские показатели в норме.
Стадия III: критические нарушения гемодинамики при допплерометрии (отсутствие или реверсный диастолический кровоток в артерии пуповины, реверсный кровоток в венозном протоке или пульсирующий в вене пуповины) у любого плода.
Стадия IV: отек плода.
Стадия V: гибель одного или обоих плодов.
Применение диагностических критериев и классификации по Quintero позволяет исследователям сравнивать результаты различных методов лечения и формировать прогноз перинатальной выживаемости после терапевтических вмешательств.
Наблюдение беременных с фето-фетальным трансфузионным синдромом
До определения типа плацентации все беременности двойней должны расцениваться как группа риска ФФТС. Определение хориальности наиболее достоверно на ранних сроках беременности. Хориальность может быть определена уже на 4-й неделе беременности при использовании трансвагинального датчика. К 8-й неделе беременности появляется возможность визуализировать амниотическую мембрану как линейную структуру. Таким образом, к 9-й неделе беременности можно достоверно оценить тип многоплодной беременности. Дифференциальная диагностика монохориальной и дихориальной беременности сложна в случае сращения хорионов. В конце I триместра можно визуализировать структуры оболочек в месте слияния их с хорионом. Дифференциальный диагноз основывают на Т- и лямбда-признаках. Монохориальные двойни требуют наиболее тщательного наблюдения, учитывая, что сроки развития и темпы прогрессирования ФФТС крайне вариабельны. Ранняя диагностика и соответствующее лечение ФФТС позволяют пролонгировать беременность и улучшить выживаемость плодов.
Начиная с 16 недель беременности показано проведение ультра-звукового исследования каждые 2 недели. Необходимо оценивать максимальный и минимальный карманы амниотических вод, размеры мочевых пузырей и динамику роста плодов. Еженедельное ультразвуковое исследование показано при подозрении на формирование ФФТС, первым признаком которого будет дисбаланс околоплодных вод. При подтверждении диагноза ФФТС выполнение допплерометрии и цервикометрии позволяет уточнить стадию и принять решение о выборе адекватных лечебных вмешательств. Ультразвуковые признаки, указывающие на высокий риск развития ФФТС, включают дискордантность величин толщины воротникового пространства, патологический кровоток в венозном протоке в сочетании с разнице в размерах плода более 25%.
В процессе наблюдения монохориальных двоен необходимо учитывать риск развития синдрома анемии-полицитемии, которому будет посвящен отдельный раздел данного руководства.
Хотя различие в предполагаемом весе плодов не входит в диагностические критерии ФФТС, до 20% беременностей с селективным замедлением роста одного из плодов впоследствии развиваются в ФФТС и при позднем развитии в 30% имеется значимая дискордантность в показателях гемоглобина к моменту родов.
Принимая во внимание повышенный риск анеуплоидий и врожденных аномалий всем МХДА показано детальное ультразвуковое исследование, включающее эхокардиографию, в II триместре беременности. В 10% случаев МХДА конкордантны по структурным аномалиям, кроме того, в 6% особенности развития могут быть выявлены у одного из плодов. Наиболее часто выявляются врожденные пороки сердца, ЦНС, а также урогенитальные аномалии и дисгенезии клоаки. Среди аномалий развития ЦНС распространены вентрикуломегалия, гидроцефалия и микроцефалия. Перивентрикулярная лейкомаляция может развиваться в том числе и после лазерной хирургии вследствие реперфузионных нарушений.
На исход монохориальной беременности, осложненной ФФТС прогностически неблагоприятно влияет также неравномерное расположение «экватора» плаценты и также оболочечное прикрепление пуповины, хотя эти особенности не являются непосредственной причиной ФФТС. Степень выраженности диссоциации роста плодов коррелирует с неравномерным разделением плаценты и аномалиями прикрепления пуповины. При монохориальных двойнях как при наличии ФФТС, так и при его отсутствии, оболочечное прикрепление пуповины коррелирует с повышением риска развития плода, малого к сроку гестации, выраженной диссоциации развития плодов, а также антенатальной гибели плода. При ФФТС малая площадь плаценты и оболочечное прикрепление пуповины чаще встречается у доноров и ухудшает прогноз в отношении их выживаемости. Учитывая вышеизложенное, при выявлении в I триместре аномалий прикрепления пуповины эти пациенты требуют тщательного наблюдения, Учитывая высокий риск развития у них раннего ФФТС с неблагоприятным прогнозом в отношении плодов. Также показано, что повышение скорости кровотока в среднемозговой артерии у плода-реципиента перед планируемым оперативным лечением, является неблагоприятным фактором в отношении его выживаемости.
Лечение фето-фетального трансфузионного синдрома
При выжидательной тактике перинатальная смертность при ФФТС достигает 95%. Для лечения ФФТС применяются фетоскопическая лазерная коагуляция анастомозов плаценты, амнио- редукция, селективная редукция одного плода из двойни или прерывание беременности. Факторами, влияющими на выбор тактики, являются срок беременности, длина шейки матки, а также технические возможности, ограничивающие проведение фетоскопии (локализация плаценты, места прикрепления пуповин и особенности анатомии матери).
Подходы к коррекции ФФТС I стадии в настоящее время являются предметом активных дискуссий, так как описаны случаи спонтанного разрешения или отсутствия прогрессии данного состояния у 90% больных. До получения данных рандомизированного исследования, сравнивающего результаты выжидательной тактики и лазерной терапии, при I стадии возможно применение консервативной тактики, амниоредукций или лазерной хирургии. При прогрессировании ФФТС или укорочении шейки матки в связи с нарастанием многоводия показано проведение ФЛК.
При выявлении ФФТС ГГ—ГУ стадии при сроке 16—26 нед. беременности показано проведение ФЛК. СЛК воздействует на причину развития синдрома путем абляции сосудистых анастомозов плаценты. Эта операция выполняется с помощью эндоскопов диаметром 3,3 мм, которые используются для прямой визуализации сосудов на поверхности плаценты. После выявления коммуникантных анастомозов выполняется их коагуляция с использованием лазерной энергии, которая проводится в амниотическую полость с помощью кварцевого волокна через операционный канал эндоскопа. Техника хирургического вмешательства претерпела несколько модификаций. Вначале пересекались все сосуды, пересекающие амниотическую мембрану. Учитывая, что в таком случае пересекаются также сосуды, не соединяющие системы циркуляции обоих плодов и не участвующие в развитии синдрома ФФТС, Quintero и соавт. разработали методику селективной лазерной коагуляции. При этом подходе коагулируются только коммуникантные сосуды, которые могут анатомически быть не связаны с амниотической перегородкой (рис. 6—8). По данным двух контролируемых нерандомизированных исследований, в которых сравнивались серийные амниоцентезы и селективная фотокоагуляция анастомозов плаценты, частота выживания хотя бы одного плода составила 79% и 83,1%. Сравнивая данные этих исследований, частота выживаемости в группе амниоредукции составила 64,4% (78/121) по сравнению с 81,5% (137/168) в группе лазерной терапии (p=0,001). Отдаленная неврологическая заболеваемость в этих группах варьировала от 4,2 до 5,6%.
На этапе дебатов о потенциальной эффективности двух подходов к лечению ФФТС группа Eurofetus провела рандомизированное контролируемое исследование, в котором сравнивали серийные амниоцентезы и лазерную селективную фотокоагуляцию анастомозов плаценты. Предварительный статистический анализ показал необходимость включения в исследование 172 пациенток, чтобы подтвердить значимые различия между двумя терапевтическими подходами. Однако после включения 142 пациенток статистический анализ показал перинатальную выживаемость хотя бы одного плода в группе амниоредукции 51% (36/70) по сравнению с 76% (55/72) в группе лазерной коагуляции, в связи с чем исследование было остановлено. Также была выявлена четырехнедельная разница в продолжительности беременности между двумя группами (29 и 33 нед, амниоцентез и лазер, соответственно, p=0,003). В группе амниоцентеза частота неврологических отклонений была значительно выше (14% и 6%, p=0,02). Эта разница сохранялась в течение 6-месячного наблюдения.
В последние годы научная группа Quintero предложила третью модификацию операции лазерной коагуляции. Эта техника предполагает пересечение артериовенозных анастомозов от донора к реципиенту в первую очередь, с последующей коагуляцией оставшихся коммуникантов (последовательная селективная лазерная коагуляция анастомозов или ПСЛК). Выполнение лазерной абляции в такой последовательности позволяет предотвратить сброс крови донора в систему гемоциркуляции реципиента во время операции. ПСЛК характеризуется повышением частоты выживаемости обоих плодов по сравнению с СЛК (74% и 57%, p=0,005). Частота выживаемости хотя бы одного плода из двойни такая же (91% и 88%).
Противопоказаний к применению ФЛК нет, хотя укорочение длины шейки матки менее 15 мм может повышать риск преждевременных родов и требовать постановки акушерского пессария с целью коррекции истмико-цервикальной недостаточности. Лазерная хирургия должна проводиться перед амниоредукцией, которая может провоцировать разрыв амниотической мембраны или приводить к ухудшению визуализации вследствие кровотечения в амниотическую полость. Эти осложнения снижают эффективность фетоскопического вмешательства.
Трансабдоминальная амниоредукция является терапией второй линии при отсутствии возможности выполнения ФЛК в силу срока беременности более 26 нед. или технических сложностей. Трансабдоминальная амниоредукция — технически простая процедура, которая заключается в дренаже избыточного количества амниотической жидкости плода-реципиента с помощью вакуумного аспиратора, присоединенного к игле 18-20 G. Объем удаляемой амниотической жидкости варьирует, обычно добиваются размера максимального кармана реципиента 6 см и менее . Проведение амниоредукции уменьшает количество амниотической жидкости у реципиента, таким образом снижая растяжение матки и риск преждевременных родов и недоношенности. Международный регистр пациентов, получавших лечение методом серийных амниоредукций, опубликован Mari и соавт.. Несмотря на то что нет уверенности в том, что все 223 пациентки соответствовали современным критериям ФФТС, перинатальная выживаемость как минимум одного плода в этом регистре составила 70,8%.
Сходные результаты были получены в ходе двух контролируемых нерандомизированных исследований, сравнивавших исходы серийных амниоцентезов и лазерной терапии, которые показали выживаемость хотя бы одного плода из двойни в группе амниоредукции 60,5% и 66,7% в группе лазерной терапии. Однако серийные амниоредукции являются паллиативной мерой, так как борются только с одним симптомом ФФТС, а именно с многоводием, и не воздействует на причину развития патологического состояния. Так как сосудистые анастомозы продолжают функционировать, физиологический стресс у плодов сохраняется, что клинически подтверждается высокой неонатальной смертностью среди выживших плодов. Данные в отношении отдаленных исходов развития нервной системы при лечении ФФТС методом амниоредукции показывают частоту церебрального паралича 5,8—22,5% и задержку развития 7,5—22,5%. В связи с этим в настоящее время амниоредук- ция считается методом выбора только при I стадии ФФТС или при сроке беременности более 24 нед, когда выполнение фетоскопиче- ской лазерной коагуляции технически может быть трудновыполнимо в связи с высоким риском развития кровотечения из коагулируемых анастомозов большого диаметра.
В последней публикации Общества Материнско-плодовой медицины (БМРМ), посвященной ФФТС, отмечено, что «фетоскопическая лазерная коагуляция анастомозов плаценты считается большинством экспертов наилучшим подходом к терапии II, III и IV стадий ФФТС при сроке менее 26 недель, однако мета-анализ не подтверждает его эффективность в отношении увеличения выживаемости плодов».
Селективный фетоцид применяется в случае выраженного селективного замедления роста одного плода с высоким риском его гибели, наличием аномалий развития или повреждения головного мозга одного плода из двойни. Наиболее часто применяется лазерная или биполярная коагуляция пуповины редуцируемого плода.
Подводя итог, современные данные подтверждают, что лазерная фетоскопия в специализированных центрах является терапией первой линии при ФФТС с 16-й по 26-ю неделю.
Исходы
Перинатальная смертность при ФФТС достигает без лечения 90— 95%. При использовании серийных амниоредукций перинатальная выживаемость достигала по данным различных исследований 68%. Перинатальная выживаемость при ФФТС после применения лазерной коагуляции анастомозов плаценты со временем улучшилась с 50% до 60—70%. К сожалению, риск потери беременности после этих процедур высок по-прежнему. Хотя риск антенатальной гибели плодов в группе ФФТС выше, чем при неосложненной многоплодной беременности, эта закономерность не прослеживается в отношении неонатальной смертности. ФФТС приводит к высокому риску внутриутробной гибели плода, однако прогноз для новорожденного зависит от степени недоношенности. Анализ неонатальной заболеваемости показывает, что новорожденные после ФФТС страдают более органоспецифическими проблемами. В группе ФФТС чаще встречается острая почечная недостаточность вследствие сниженной продукции мочи и высокий уровень креатинина в плазме крови. Как ни странно, но по данным некоторых авторов почечная недостаточность чаще встречается у реципиентов, чем у доноров. Во многом это можно объяснить тем, что при преждевременных родах часто развиваются серьезные кардиореспираторные проблемы, и в связи с этим вероятность развития острой почечной недостаточности у реципиента такая же, как у донора. В дальнейшем восстановление функции почек проходит обычно благоприятно.
Эхокардиография в неонатальном периоде выполняется только по показаниям, в основном при подозрении на персистирующий ductus arteriosus, в связи с чем пока нет полноценного представления о кардиофункции в постнатальном периоде. Гипотензия, требующая инотропной поддержки, случается в группе ФФТС достоверно чаще. Это косвенно подтверждает, что значимая кардиальная дисфункция встречается чаще. В этом случае целесообразно проведение рутинной оценки функции сердца для подбора оптимальной тактики лечения. Среди выживших при ФФТС высока частота отклонений при ультразвуковом исследовании головного мозга, вплоть до 28%. По данным Denbow и соавт., 35% пациентов с ФФТС имеют признаки антенатальных церебральных ишемических инсультов, приводя к кистам белого вещества, эхогенности базальных ганглиев, умеренной дилатации желудочков головного мозга. Клиническая значимость этих находок неясна, так же как и не описаны отдаленные исходы при их наличии. Относительно мало исследований посвящено отдаленным последствиям для плодов при ФФТС. При амниоредукциях частота повреждений головного мозга составляла до 25%.
Trespidi и соавт., которые предлагали тактику проведения агрессивных серийных амниоредукций, не описали продолжительность и протокол динамического наблюдения, но выявили до 15% серьезных отклонений, приведших в дальнейшем к инвалидности. Исследования, посвященные неврологическим последствиям при применении лазерной терапии ФФТС, выявили меньшую частоту повреждений головного мозга, с частотой не более 5%. Ville и соавт. сообщали о частоте инвалидности в связи с неврологическими отклонениями в возрасте до 1 года около 4,2%. Следует отметить, что почти 70% родов в этой группе произошло при сроке беременности более 32 недель. Лазерная коагуляция анастомозов прерывает сосудистые коммуникации между системами гемоциркуляции двух плодов, хотя при этом отмечается значительный риск внутриутробной гибели. Если это происходит с плодом-донором, то это последствие острой облитерации части плаценты плода, который и так находится в состоянии дефицита кровотока. Гибель обоих плодов происходит обычно при неполной коагуляции анастомозов, при которой вместо разобщения циркуляций происходит прогрессирование шунтирования крови от одного плода к другому. При проведении успешной коагуляции беременность следует пролонгировать, и это профилактирует развитие нарушений гемодинамики, приводящих к повреждению ткани головного мозга. С улучшением технологии выполнения лазерной коагуляции вероятно удастся снизить перинатальные потери при данном вмешательстве. С другой стороны, серийные амниоредукции, снижая количество околоплодных вод приводят к пролонгированию беременности, при этом не влияя никак на процесс шунтирования крови из циркуляции одного плода к другому. Hecher и соавт. сравнили эффект от серийных амниоредукций и лазерной коагуляции в двух европейских центрах. В группе лазерной коагуляции было значительно больше внутриутробных гибелей одного из плодов, но ниже частота гибели обоих плодов. В общем, выживаемость была сходной в обоих группах. Однако при дальнейшем наблюдении в группе амниоредукций было выявлено большее количество аномальных сканов головного мозга плода при нейросонографии (дефектов паренхимы, микроцефалии и перивентрикулярных кровоизлияний).
Как описано выше, частым осложнением при ФФТС является гибель одного плода из двойни. При этом в случае гибели плода-реципиента происходит сброс крови по закону сообщающихся сосудов от плода-донора, вызывая еще большую его анемизацию и гиповолемию, и, как правило, приводя к летальному исходу. При гибели плода-донора прогноз для реципиента более благоприятный. При ФФТС у реципиента часто развивается стеноз легочной артерии, что отражает наличие правожелудочковой сердечной недостаточности вследствие перегрузки объемом или увеличения постнагрузки. В случае гибели одного плода in utero у выжившего плода развивается острая анемия, вследствие того, что кровь от выжившего плода оттекает к мертвому по плацентарным анастомозам плаценты. Изменения гемодинамики выжившего плода можно описать как острую кровопотерю, которая происходит сразу после гибели другого плода.
Трансфузия крови от выжившего реципиента к донору уменьшает объем, перегружающий его кровеносную систему, приводящую к быстрому прогрессивному восстановлению функции сердца, поэтому ранняя гибель плода-донора может играть значительную роль в улучшении состояния гемодинамики реципиента при ФФТС. Описанный выше сценарий частично объясняет, почему перинатальный исход зависит от того, кто из плодов погибает первым, донор или реципиент. Baioria и соавт. наблюдали спонтанное разрешение многоводия и отека плода в 6 из 10 случаев выживания реципиента после гибели плода-донора. Альтернативным путем можно добиться благоприятного исхода для реципиента можно путем пересечения однонаправленных анастомозов в плаценте. Случаи внутриутробной гибели донора могут также быть в ситуации, когда имеет место тяжелый СЗРП у донора в сочетании с тяжелой кардиоваскулярной недостаточностью у реципиента или выраженным гемодинамическим дисбалансом между донором и реципиентом, приводящим к высокой смертности заболеваемости в случае выживания реципиента. По данным рандомизированных исследований заболеваемость выжившего при гибели одного плода из двойни при лечении ФФТС методом серийных амниоредукций выше (35%), чем при использовании лазерной коагуляции анастомозов плаценты (7%). Это можно объяснить предотвращением сброса крови к мертвому плоду путем коагуляции анастомозов. Выявление анемии или ишемических повреждений головного мозга у выжившего плода свидетельствует о неполной коагуляции анастомозов. При ФФТС стеноз легочной артерии часто развивается у плода реципиента вследствие наличия недостаточности правых отделов сердца из-за перегрузки объемом или постнагрузки. Признаки недостаточности правых отделов сердца (выраженный реверсный кровоток в предсердие и высокие значения пульсационного индекса в венозном протоке) быстро исчезают в случае гибели плода-донора. Благоприятный исход может быть достигнут с помощью ограничения кровотока по трансплацентарным анастомозам от донора к реципиенту, который может персистировать до гибели донора. Однако восстановление кардиальной функции плода-реципиента в такой ситуации требует гораздо большего времени, по сравнению со случаями, в которых происходит острая кровопотеря. Факт, что во многих случаях у плода при рождении не отмечается анемии, можно объяснить длительным временным промежутком с момента внутриутробной гибели одного плода до рождения. Если первым погибает плод-донор, сброс крови усугубляет уже имеющуюся анемию в результате фето-фетальной трансфузии, что приводит к его гибели или тяжелым ишемическим повреждениям головного мозга.
Описаны артерио-артериальные, артерио-венозные и веновенозные анастомозы плаценты, однако глубокие анастомозы практически всегда артерио-венозные. Соотношение различных типов анастомозов может играть роль в развитии ФФТС и перинатальном исходе монохориальной беременности. При беременностях, осложненных ФФТС выявлено примерно одинаковое количество артерио-венозных и вено-венозных анастомозов по сравнению с нормально протекающими беременностями, но меньшее количество артерио-артериальных. Вено-венозные анастомозы отсутствуют в 75% монохориальных двоен, независимо от наличия или отсутствия ФФТС и их связывают с снижением перинатальной выживаемости. Действительно, поверхностные вено-венозные анастомозы часто наблюдаются при гибели одного плода из двойни. Это позволяет предположить, что гибель одного плода из двойни чаще встречается при наличии вено-венозных анастомозов. Однако описанная частота вено-венозных анастомозов по данным ряда исследований составляет 18% случаев гибели одного плода из двойни. При этом предполагается, что частота таких анастомозов при монохориальном многоплодии составляет 20%. И поэтому до сих пор окончательно неясно, играют ли вено-венозные анастомозы или наличие глубоких артерио-венозных и/или артерио-артериальных анастомозов в развитии ФФТС, приводящего к гибели одного плода из двойни и выживанию второго.
Синдром анемии-полицитемии
Синдром анемии-полицитемии еще одно недавно описанное осложнение монохориального многоплодия, в патогенезе которого также ключевое значение имеют сосудистые анастомозы плаценты. Основным клиническим признаком этого состояния является дискордантность уровня гемоглобина при отсутствии дисбаланса околоплодных вод, в отличие от ФФТС. САП может развиваться спонтанно или ятрогенно после выполнения ФЛК. Частота развития спонтанного СП 3—5% монохориальных двоен, распространенность ятрогенных случаев — 2—13% среди всех ФЛК.
В отличие от случаев классического ФФТС, плацента при САП характеризуется более мелкими (менее 1 мм в диаметре) артерио-ве-нозными анастомозами и отсутствием артерио-артериальных анастомозов. В связи с этим происходит медленный трансфер крови от одного плода к другому при отсутствии значимого транспорта вазоактивных агентов. В случае ятрогенного развития САП сброс крови происходит по мелким резидуальным анастомозам, которые не были коагулированы при ФЛК. Относительно небольшие объемы сброса крови между плодами объясняют факт, что клинические проявления САП в отличие от ФФТС, как правило, выявляются после 26 недель беременности или спустя 1-5 недель после успешной ФЛК на фоне разрешения ФФТС.
Реже причиной спонтанного развития САП может быть тромбоз анастомозов, выполняющих «протективную» роль в обеспечении баланса циркуляции крови. Кроме того, важно дифференцировать САП от острого сброса крови во время родов, так как оба этих состояния клинически проявляются внешне бледными кожными покровами одного плода и плеторой у другого. В этом случае для хронического течения САП характерен дисбаланс ретикулоцитов и наличие мелких анастомозов при инъекционном окрашивании плаценты.
Диагноз САП основывается на выявлении признаков анемии у одного плода и полицитемии у другого. Для пренатального выявления САП применяют допплеровскую оценку скоростей кровотока в средней мозговой артерии. Повышение скорости кровотока более 1,5 МоМ у одного плода и снижение менее 1 МоМ у другого принято считать диагностическими критериями САП. Менее объективными ультразвуковыми признаками САП являются различия в толщине и эхогенности плацентарных территорий анемичного и полицитемичного плодов.
После родов диагноз САП основывается на сочетании различий в значении абсолютных уровней гемоглобина у плодов и наличии ретикулоцитоза у анемичного плода как подтверждения хронической природы процесса. Абсолютные значения гемоглобина менее 110 г/л у анемичного и более 200 г/л у полицитемичного плодов являются диагностическим критерием. Альтернативным подходом является выявление разницы в 80 г/л у плодов.
Классификация САП в некоторой мере сходна с классификацией ФФТС по Quintero, в том числе в интерпретации прогрессирования синдромов в зависимости от стадии (таблица).
Таблица
Классификации САП и ФФТС
| Стадия |
САП (Slaghekke и соавт.) |
ФФТС (Quintero и соавт.) |
Интерпретация |
| I |
МСС в СМА менее 1,0 МоМ у реципиента, МСС в СМА у донора более 1,5 МоМ |
Многоводие более 8 см и маловодие менее 2 см, с сохранением визуализации мочевого пузыря донора |
САП: умеренный дисбаланс уровня гемоглобин. ФФТС: умеренный дисбаланс околоплодных вод |
| II |
МСС в СМА менее 0,8 МоМ у реципиента, МСС в СМА у донора более 1,7 МоМ |
Отсутствие визуализации мочевого пузыря донора |
САП: нарастание дисбаланса уровня гемоглобина. ФФТС: прогрессирование дисбаланса околоплодных вод, начальные проявления кардиоваскулярной дисфункции |
| III |
Критические нарушения гемодинаики при допплерометрии |
Критические нарушения гемодинамики при допплерометрии |
Развитие кардиоваскулярной дисфункции у плодов |
| IV |
Отек плода |
Отек плода |
Развитие сердечной недостаточности |
| V |
Гибель одного или обоих плодов |
Гибель одного или обоих плодов |
Высокий риск вторичного поражения внутренних органов у выжившего плода |
Лечение САП зависит от срока гестации. До 30 нед. обсуждается внутриматочное переливание крови анемичному плоду с целью пролонгирования беременности. Быстрый рецидив анемии указывает на значимый сброс клеток крови между плодами, поэтому повторные гемотрансфузии опасны увеличением уровня полицитемии и вязкости крови у реципиента. В недавних сообщениях описана методика заменой гемотрансфузии у реципиента с возмещением изъятой крови изотоническим солевым раствором.
Патогенетически обоснованным вмешательством представляется ФЛК, однако его выполнение технически сложно в силу отсутствия многоводия у реципиента и малого диаметра коммуникантов, которые могут не визуализироваться на плацентарной поверхности. И поэтому как вариант обсуждается ФЛК с применением методики Соломон (полная дихорионизация плаценты непрерывной линией по сосудистому экватору плаценты) с предварительной амниоинфузией полости реципиента.
Выживаемость при выжидательной тактике при САП около 75%, при этом применение ФЛК или внутриматочной гемотрансфузии обеспечивает почти 100% выживаемость за счет пролонгирования беременности до достижения жизнеспособности плодов. Система стадирования при САП не позволяет формировать прогноз в отличие от ФФТС. Однако показано, что выживаемость при V стадии снижается до 33%, с учетом того, что гибель одного из плодов в трети случаев приводит к потере второго. Для новорожденных при САП характерны анемия у донора и полицитемия с повышенной вязкостью крови у реципиента. Последнее ведет к развитию респираторных нарушений, желтухе и периферической ишемии вплоть до некроза кожи. Смертность среди новорожденных незначительно выше, чем при неосложненной монохориальной двойне. Однако гемотрансфузия у плодов доноров требуется в 80% случаев и обменное переливание крови в 68% случаев у реципиентов. В отношении развития центральной нервной системы отдаленные исходы пока не изучены в достаточной мере.
Заключение
Монохориальное многоплодие представляет собой одну из самых неоднозначных клинических ситуаций в акушерстве и фетальной терапии. Большие усилия приложены к пониманию патофизиологических механизмов, обусловливающих развитие осложнений, так же как и к разработке инструментов и хирургических методик для их коррекции.
С развитием медицинской техники и пренатальной диагностики доступ к фетоплацентарной системе с помощью минимально инвазивных методик становится все важнее для оказания помощи еще не родившемуся пациенту. Внутриутробные вмешательства позволяют лечить аномальные состояния плода и плаценты, предотвращая развитие заболеваний в детском и взрослом возрасте. Это особенно важно при монохориальном осложненном многоплодии.















































0 комментариев