Тиреотропный гормон – ТТГ. Выбор лечения. Лекция для врачей
Лекция для врачей "Тиреотропный гормон – ТТГ. Выбор лечения." Лекцию для врачей проводит к.м.н. А. В. Ушаков.
От автора лекции книга "Гипотиреоз: искажение сущности" - А. В. Ушаков
После выхода в свет первого издания этой книги у меня появилось ещё одно важное доказательство истинной сущности гипотиреоза ― переход из гипотиреоза в гипертиреоз. Если ранее мне приходилсь наблюдать случаи появления гипотиреоза после гипертиреоза, то впервые в моей практике у пациентки произошло обратное.
Поэтому второе издание книги включило в себя новый раздел «Первичный гипотиреоз переходит в гипертиреоз (болезнь Грейвса)». В нём представлен не только случай из практики, но также обзор и анализ данных из нескольких десятков статей, в которых авторы описали такие же явления. Как видно, наш мир постоянно предоставляет нам нужные факты для понимания закономерностей природы. Накопление таких фактов в течение времени требует их совместной оценки для коррекции представлений и даже смены научной парадигмы, если новые знания показывают другую реальность и противоречат прежним гипотезам.
Эта книга не только доказывает ошибочность сохраняющихся прежних воззрений, но и открывает направление восстановительной эндокринологии.
Книга рекомендуется эндокринологам, сонологам и врачам любой специализации.
Купить медицинскую литературу по эндокринологии

Дополнительный материал
Гормоны щитовидной железы
Авторы: И. М. Скударнова, Н. В. Соболева, Н. В. Мычка
Список сокращений
ДТЗ — диффузный токсический зоб
ТГ — тиреоглобулин
ТПО — тиреоидная пероксидаза
ТТГ — тиреотропный гормон
ТХ — тиреоидит Хашимото
ЩЖ — щитовидная железа
Т3 — трийодтиронин
Т4 - тироксин
Введение
Щитовидная железа (ЩЖ) является самой большой эндокринной железой организма человека. Масса ЩЖ здорового взрослого человека составляет 18—20 г. Железа заключена в фиброзную капсулу и прикрепляется к передней и боковым поверхностям гортани рыхлой соединительной тканью. Две доли щитовидной железы, располагающиеся по обе стороны трахеи, соединяются между собой тонкой полоской ткани — перешейком.
Ткань ЩЖ заполнена преимущественно сферическими тиреоидными фолликулами (рис. 1). Каждый фолликул представляет собой слой кубовидных клеток (тиреоцитов), окружающих полость, заполненную коллоидом, главной составляющей которого является белок тиреоглобулин (ТГ). Клетки обращены внутрь полости апикальными поверхностями, на которых имеются микроворсинки, проникающие в коллоид. Между фолликулами располагаются кровеносные капилляры.
Тиреоглобулин служит исходным субстратом для синтеза гормонов тироксина (Т4) и трийодтиронина (Т3). Регуляцию синтеза и секреции Т3 и Т4 осуществляет тиреотропный гормон (ТТГ), вырабатывающийся в гипофизе.
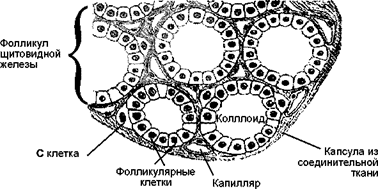
Рис. 1. Срез щитовидной железы
Формы нарушений функций щитовидной железы
Нарушения функциональной активности ЩЖ могут обнаруживаться у пациентов различными симптомами (табл. 1). Чаще всего у них изменяется самочувствие: появляется раздражительность, плаксивость, суетливость, чрезмерная потливость, нарушения сна, тремор конечностей при тиреотоксикозе; — вялость, медлительность, быстрая утомляемость, сонливость, ухудшение памяти, боли в пояснице — при гипотиреозе.
Как правило, клиническая картина стерта, и поражение ЩЖ протекает под маской других заболеваний. У одних пациентов могут преобладать неврологические симптомы, тогда как у других основным клиническим проявлением патологии ЩЖ может быть синдром артериальной гипертензии или боли за грудиной. Иногда ведущими становятся симптомы поражения желудочно-кишечного тракта — тошнота, метеоризм, запоры.
Нарушение функции тиреоидной системы приводит к целому ряду патологических состояний и заболеваний. В настоящее время к ним относят снижение фертильности, повышенную перинатальную смертность, мертворождение, врожденные аномалии развития детей и подростков, кретинизм, задержку психического и физического развития, ухудшение интеллектуальных способностей у взрослых, зоб эутиреоидный или с гипотиреозом. Все эти последствия йодного дефицита в организме человека связывают с недостаточной продукцией тиреоидных гормонов и компенсаторными реакциями, направленными на преодоление йодной недостаточности. У детей даже относительный дефицит тиреоидных гормонов приводит к более тяжелым последствиям, чем у взрослых (чем младше ребенок, тем тяжелее патология ЩЖ). Даже легкий недостаток йода при развитии плода отрицательно влияет на последующее нейропсихическое развитие ребенка.
Наиболее тяжелым проявлением дефицита йода является кретинизм — неизлечимая патология. Для него характерны: тяжелая умственная отсталость, низкорослость, деформация скелета, глухонемота. Выделяют неврологическую и микседематозную формы кретинизма. Первую объясняют недостаточностью тиреоидных гормонов в критическом периоде развития плода в начале второго триместра беременности. Микседематозную форму считают следствием хронического гипотиреоза на поздних этапах внутриутробной и ранних стадиях постнатальной жизни.
Таблица 1. Клинические характеристики гипер- и гипотиреоза

У пожилых людей при длительном недостатке йода в ткани ЩЖ нередко формируются очаги (или узлы), секретирующие тиреоидные гормоны автономно, т.е. независимо от ТТГ. Так развивается узловой или многоузловой токсический зоб; во многих случаях тиреотоксикоз индуцируется внезапным увеличением доступности йода в виде продуктов с высоким его содержанием или йодсодержащих лекарственных или диагностических препаратов.
Наиболее сложна для диагностики скрытая патология щитовидной железы — субклинический гипертиреоз и субклинический гипотиреоз.
Субклинический гипертиреоз - состояние повышенной функции ЩЖ, для которого характерна пониженная концентрация ТТГ в сыворотке крови, в то время как уровни тиреоидных гормонов в сыворотке крови находятся в пределах нормы. Выявить субклинический гипертиреоз, как правило, удается только по результатам лабораторных исследований, поскольку его клинические симптомы отсутствуют.
Исследования, проведенные в разных странах, показали, что частота встречаемости субклинического гипертиреоза особенно велика у пожилых женщин. Чаще всего он развивается на фоне длительно существующего многоузлового зоба, а также у больных с тиреотоксикозом, пролеченных тиреостатиками. Эти группы больных, несмотря на отсутствие классических симптомов гипертиреоза, нуждаются в периодическом измерении концентрации ТТГ и тиреоидных гормонов.
Известно, что самыми чувствительными к повышению или снижению содержания тиреоидных гормонов в организме являются сердечно-сосудистая и центральная нервная системы. При тщательном осмотре больных с субклиническим гипертиреозом у них часто выявляют нарушения этих систем, хотя ранее данные патологии связывали с атеросклерозом, цереброваскулярной болезнью, гипертонической болезнью и т.д.
У больных с нелеченым гипертиреозом возможна также повышенная резорбция костей. Субклинический гипертиреоз может сопровождаться развитием патологии печени, и это наблюдается чаще, чем при явном тиреотоксикозе. В большинстве случаев расстройства работы печени, обусловленные тиреотоксикозом, полностью обратимы после его раннего лечения.
Субклинический гипотиреоз - состояние пониженной функции ЩЖ, при котором наблюдается повышенная концентрация ТТГ, а уровни тиреоидных гормонов находятся в пределах нормы.
Тиреотропный гормон
Главным регуляторным гормоном щитовидной железы является тиреотропный гормон — гликопротеин с молекулярной массой 28 000 дальтон. Его молекула состоит из двух пептидных цепей (субъединиц), связанных нековалентно. Биологическая активность и специфичность ТТГ обусловлена его бета-субъединицей. Альфа- цепь ТТГ фолликулостимулирующего, лютеинизирующего, хорионического гонадотропинов и пролактина идентична. Нормальное функционирование фолликулярной клетки происходит благодаря постоянной стимуляции ТТГ, реализуемой через рецепторы на клеточной мембране.
Тиреотропный гормон вырабатывается базофилами передней доли гипофиза под контролем тиреотропного гипоталамического рилизинг-фактора, а также соматостатина, биогенных аминов и тиреоидных гормонов. Таким образом, продукцию гормона осуществляет система гипоталамус — гипофиз — щитовидная железа.
Функции ТТГ
Основной функцией ТТГ является регуляция синтеза и секреции тиреоидных гормонов. Когда система гипоталамус — гипофиз — щитовидная железа функционирует нормально, то снижение уровня тиреоидных гормонов приводит к повышению концентрации ТТГ и увеличению секреции Т3 и Т4, и, наоборот, при избыточном количестве тиреоидных гормонов происходит подавление секреции ТТГ по принципу обратной связи.
Тиреотропный гормон усиливает васкуляризацию щитовидной железы и поступление йода из плазмы крови в клетки ЩЖ, что стимулирует синтез тиреоглобулина, а также гормонов Т3 и Т4. Гипофизарная секреция ТТГ очень чувствительна к изменениям концентрации Т3 и Т4 в сыворотке крови. Снижение или повышение их содержания даже на 15—20% приводит к реципрокным сдвигам в секреции ТТГ и его реакции на экзогенный тиреотропин-рилизинг-фактор.
Секреция ТТГ подчиняется циркадным ритмам с акрофазой в ночные часы. Наивысших величин концентрация ТТГ в крови достигает к 2—4 часам ночи, высокий уровень в крови определяется также в 6—8 часов утра, минимальные значения ТТГ приходятся на 17—18 часов вечера. Нормальный ритм секреции нарушается при бодрствовании ночью. С возрастом концентрация ТТГ незначительно повышается, а количество выброса гормона в ночное время уменьшается.
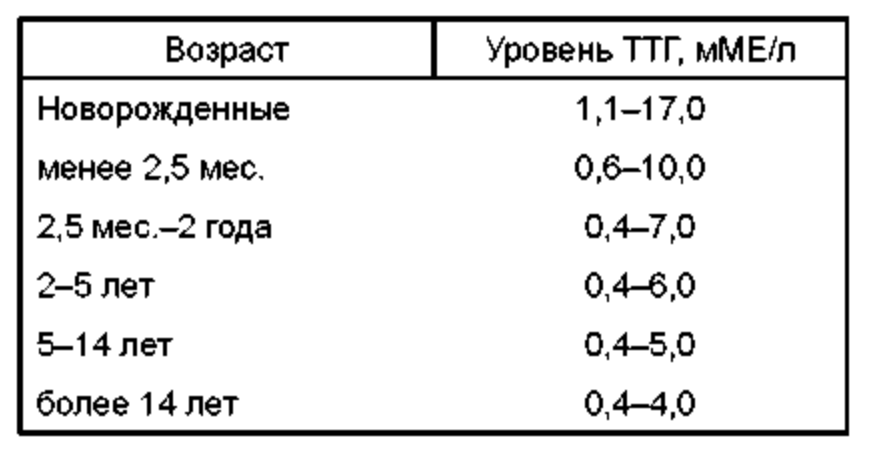
Показания к назначению анализа ТТГ
Количественное определение тиреотропного гормона — основной метод диагностики функционального состояния ЩЖ. Показаниями к проведению анализа ТТГ являются:
• выявление скрытого гипотиреоза;
• задержка умственного и полового развития у детей;
• зоб;
• сердечные аритмии; миопатия;
• идиопатическая гипотермия;
• депрессия;
• алопеция;
• бесплодие;
• импотенция и снижение либидо;
• контрольное исследование при выявленном диффузном токсическом зобе (ДТЗ) (1,5-2 года 1-3 раза/месяц);
• контрольное исследование при выявленном гипотиреозе (пожизненно 1—2 раза/год);
• гиперпролактинемия;
• скрининг врожденного гипотиреоза;
• наблюдение за состоянием больного после гормонозаместительной терапии.
Секреция тиреотропного гормона подавляется во время стандартной терапии или в течение постоперационной заместительной терапии. Повышенные или пониженные уровни ТТГ свидетельствуют о неадекватной доле препарата, неверно проводимой гормональной терапии или наличии антител к антигенам щитовидной железы. В ходе заместительной терапии при гипотиреозе оптимальный уровень ТТГ находится в пределах нижних значений референсных величин.
При подготовке к исследованию накануне забора крови для определения ТТГ у пациентов необходимо исключить физические нагрузки и курение. Взятие крови производится натощак (желательно, до 10 часов утра).
К повышению уровня ТТГ могут приводить:
• тиротропинома;
• базофильная аденома гипофиза (редко);
• синдром нерегулируемой секреции ТТГ;
• синдром резистентности к тиреоидным гормонам;
• первичный и вторичный гипотиреоз;
• ювенильный гипотиреоз;
• некомпенсированная первичная надпочечниковая недостаточ-ность;
• подострый тиреоидит и тиреоидит Хашимото (ТХ);
• эктопическая секреция при опухолях легкого;
• опухоль гипофиза;
• тяжелые соматические и психические заболевания;
• тяжелый гестоз (преэклампсия);
• холецистэктомия;
• отравление свинцом;
• чрезмерные физические нагрузки и гемодиализ.
Кроме того, это может быть связано с приемом противосудо-рожных средств (вальпроевая кислота, фенитоин, бензеразид), бета-адреноблокаторами (атенолол, метопролол, пропранолол), таких препаратов, как амиодарон (у эутиреоидных и гипотиреоидных больных), кальцитонина, нейролептиков (производные фенотиазина, аминоглютетимид), сульфата железа, фуросемида, иодидов, рентгеноконтрастных средств, ловастатина, метимазола (мерказолила), морфина, дифенина (фенитоина), преднизона, рифампицина.
К снижению уровня ТТГ могут приводить:
• токсический зоб;
• тиреотоксическая аденома;
• ТТГ-независимый тиреотоксикоз;
• гипертиреоз беременных;
• послеродовой некроз гипофиза;
• Т3-токсикоз;
• латентный тиреотоксикоз;
• транзиторный тиреотоксикоз при аутоиммунном тиреоидите;
• тиреотоксикоз вследствие самоназначения Т4;
• травма гипофиза;
• психологический стресс и голодание.
Концентрация ТТГ в крови пациента также может быть снижена при приеме анаболических стероидов, кортикостероидов цитостатиков, бета-адреномиметиков (добутамин, допексамин), допамина, амиодарона (гипертиреоидные больные), тироксина, трийодтиронина, карбамазепина, соматостатина и октреотида, нифедипина, средств для лечения гиперпролактинемии (метерголин, перибедил, бромкриптин).
Снижение уровня ТТГ во время беременности
На протяжении первой половины беременности уровень тиреотропного гормона может быть транзиторно снижен примерно у 20% женщин. Чаще всего выявляется умеренное снижение концентрации ТТГ до 0,1—0,4 мМЕ/л. Однако в ряде случаев, особенно при многоплодной беременности, синтез ТТГ может быть полностью подавлен. Наиболее низкие показатели содержания ТТГ в среднем приходятся на 10—12-ю неделю беременности. В отдельных случаях концентрация ТТГ может оставаться несколько сниженной вплоть до поздних сроков беременности.
Подавление уровня концентрации тиреотропного гормона у беременных женщин часто сопровождается рвотой (hyper emesis dravidarum), тем не менее, патогенетическая связь между этими явлениями вряд ли существует, поскольку при патологическом тиреотоксикозе (болезнь Грейвса) рвота во время беременности встречается с обычной частотой. При болезни Грейвса содержание ТТГ, как правило, снижено или полностью подавлено, а уровни тиреоидных гормонов в крови, наоборот, значительно повышены. В 50% случаев при этом заболевании наблюдают эндокринную офтальмопатию и увеличение щитовидной железы с характерным изменением ее эхоструктуры.
Для определения патологии ЩЖ во время беременности большое значение имеет оценка динамики содержания в сыворотке крови тироксина и тиреотропного гормона. Для первой половины беременности характерен нормальный или незначительно сниженный уровень ТТГ. При отсутствии патологии ЩЖ содержание тироксина и ТТГ в крови женщин с течением беременности постепенно приходит в норму.
Обнаружение на ранних сроках беременности высокого уровня ТТГ в сыворотке крови может рассматриваться как показание для назначения беременной женщине терапии L-тироксином.
Тироксин
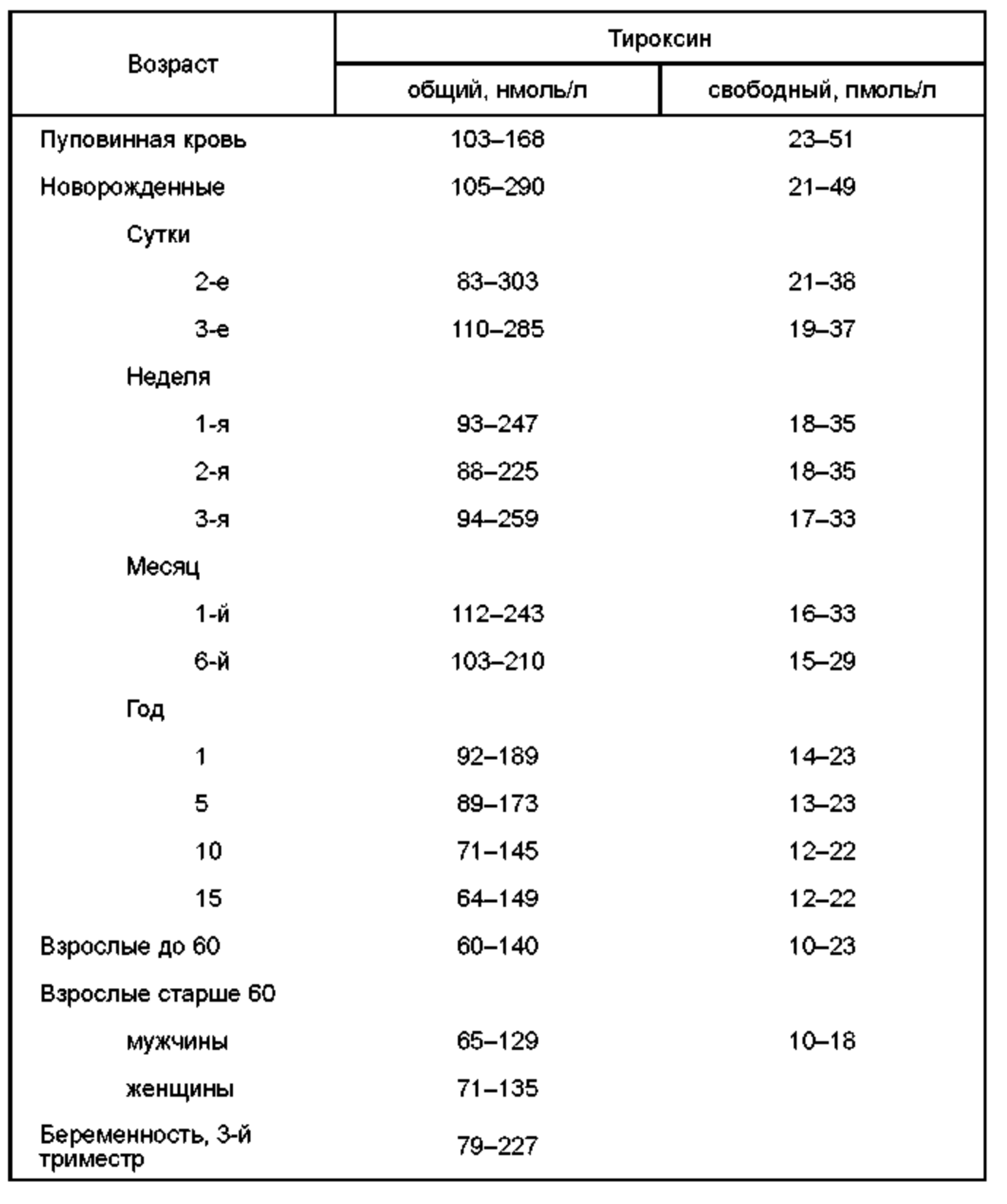
Тироксин (Т4, L-тироксин) — тиреоидный гормон с молекулярной массой 776,9 дальтон, содержащий 4 атома йода. Многостадийный биосинтез Т4 из тиреоглобулина происходит в ЩЖ. Основное количество органического йода в организме человека находится в виде тироксина (табл. 2). При этом большая часть Т4 (99,97%) циркулирует связанном с белками плазмы состоянии.
Концентрация тироксина в сыворотке крови — наиболее общепринятый показатель функции ЩЖ, позволяющий довольно четко разграничивать гипер-, гипо- и эутиреоз. Измерение концентрации тироксина в сыворотке крови показано при гипертиреозе — для дифференциации тиреоидита, автономной аденомы и аденокарциномы, при состояниях с повышенным уровнем тироксинсвязывающего глобулина (беременность, генетически обусловленное повышение), при остром гепатите и ожирении.
Низкое содержание Т4 в сыворотке наблюдается при гипотиреозе, состояниях с пониженным уровнем концентрации тироксинсвязывающего глобулина и физической нагрузке. Снижение концентрации Т4 происходит также при гемолизе.
Уровень Т4 в крови понижается при приеме аминосалициловой кислоты, андрогенов, ацетилсалициловой кислоты, холестирамина, клофибрата, кобальта, кортикостероидов, кортикотропинов, даназола, этинамида, лития, метамазола, митотана, оксифенбутазона, пенициллинафенотиазинов, фенилбутазона, фенитоина, йодида калия, пропилтиоурацила, резерпина, сульфаниламидов, трийодтиронина, вальпроевой кислоты.
Количественное определение свободного тироксина является более надежным параметром для оценки состояния ЩЖ, чем определение общего трийодтиронина.
Таблица 2. Нормальные величины концентрации тироксина в зависимости от возраста человека
Трийодтиронин
Трийодтиронин (3,3',5-трийодтиронин, Т3) — гормон щитовидной железы с молекулярной массой 651 дальтон, содержащий 3 атома йода (58% от общей массы молекулы). В ЩЖ синтезируется небольшая часть Т3, а основное его количество образуется путем ферментативного дейодирования Т4 в периферических тканях (печени, почках, сердечной мышце и других органах). Установлено, что наиболее интенсивно этот процесс идет в передней доле гипофиза.
Только 0,3% циркулирующего в сыворотке Т3 находится в свободной форме, преобладающая же его часть связана с сывороточными белками, однако эта связь гораздо слабее, чем у Т4.
В пересчете на 1 моль Т3 имеет в 4 раза более высокую биологическую активность и в 10 раз большую скорость метаболизма, чем Т4. Многие биологические эффекты гормонов ЩЖ реализуются через действие Т3.
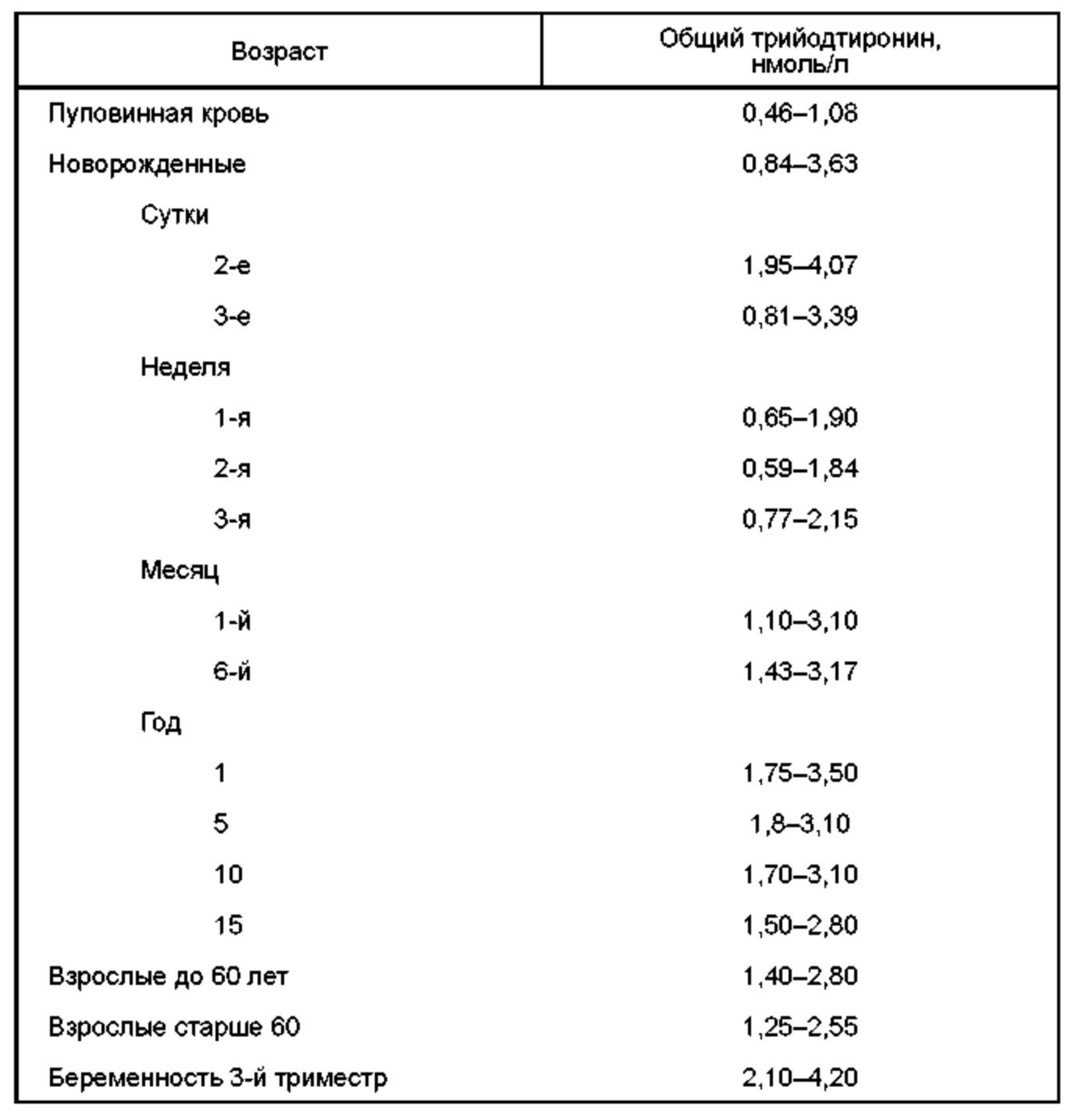
Концентрация общего Т3 в сыворотке крови примерно в 50 раз ниже уровня тироксина и составляет 1,2—3,0 нмоль/л. По данным некоторых авторов, у мужчин содержание Т3 в крови на 5—10% выше, чем у женщин. Концентрация Т3 в сыворотке крови новорожденных составляет 1/3 от содержания у взрослых, но уже в течение двух первых суток она возрастает до этого уровня. В раннем детском возрасте содержание Т3 несколько снижается, но в подростковом возрасте его уровень достигает концентрации, характерной для здорового взрослого человека (табл. 3). После 65 лет наблюдается более заметное снижение Т3 в сыворотке по сравнению со снижением Т4.
Если определение ТТГ и Т4 достаточно полно характеризует функциональную активность ЩЖ и показано широкому кругу пациентов, то анализ Т3 имеет четко очерченный круг показаний для выявления тиреоидной патологии, обусловленной недостатком этого гормона: дифференциальная диагностика Т3- токсикоза; тиреотоксикоза; рецидив тиреотоксикоза с симптоматическим повышением уровня концентрации Т3; острый тиреотоксикоз после подавляющей терапии L-тироксином. Установлено, что около 10% больных с клиническими признаками гипотиреоза имеют нормальный уровень концентрации Т3.
При определении Т3 в сыворотке крови необходимо учитывать изменения его концентрации после экзогенного введения гормонов ЩЖ. Повышенные концентрации Т3 в сыворотке крови наблюдаются при приеме эстрогенов, героина, метадона, пероральных контрацептивов. Понижение концентрации Т3 в крови пациентов отмечено при применении андрогенов, даназола, дексаметазона, пропранолола (при гипертиреозе) при приеме производных кумарина, салицилатов. Период биологической полужизни Т3 — 24 ч.
Таблица 3. Нормальные величины концентрации ТЗ в зависимости от возраста человека
Свободные Т4 И Т3
Лишь незначительная часть тироксина и трийодтиронина (0,3% Т3 и 0,03% Т4) находится в кровотоке в свободной форме, но именно они принимают непосредственное участие в реализации в организме человека множества регуляторных функций. Чаще всего в лабораториях определяют содержание общего Т3, общего Т4 и ТТГ. В случае субклинического гипертиреоза уровни концентраций общих Т3 и Т4 остается в норме, тогда как содержание свободного Т4 возрастает в несколько раз. У пациентов с явным гипотиреозом концентрация как общего, так и свободного Т4 понижена; при субклинической форме заболевания снижается только содержание свободной формы гормона. Поэтому определение концентрации свободного Т4 имеет большое значение для эффективной диагностики. Уровень свободного Т4 не зависит от концентрации тироксинсвязывающих белков, что позволяет использовать результат его анализа для адекватной оценки гормональной функции ЩЖ.
Измерение свободного Т4 часто используют для мониторинга лечения пациентов с тиреотоксикозом, поскольку она быстрее, чем ТТГ, реагирует на тиреостатическую терапию.
Как показывает клиническая практика, нередко возникают ситуации, когда эндокринологи считают полученный в лаборатории результат ошибочным и направляют пациентов на повторные исследования. Помимо собственно лабораторных ошибок, когда неправильно определяются концентрации гормонов, существуют объективные причины подобных расхождений: избыточная терапия тироксином, приводящая к снижению ТТГ при нормальном свободном Т4; прием трийодтиронина, когда ТТГ снижен, а свободный Т4 в норме; недостаточная терапия гормонами ЩЖ при отсутствии жалоб, когда уровень ТТГ повышен при нормальном свободном Т4; внетиреоидная патология; прием лекарственных препаратов, влияющих на связывание тироксина и секрецию ТТГ (глюкокортикоиды, аспирин, гепарин, дофамин, верапамил и т. и.); ТТГ-секретирующие опухоли; наличие тиреоидстимулирующих антител; тотальная резистентность тканей к гормонам ЩЖ, когда уровни ТТГ и свободного Т4 повышены при клиническом эутиреозе.
Содержание свободного Т3 в лабораторной практике стали определять только в последние годы, поэтому информации о его концентрации в крови при различных патологических состояниях ЩЖ пока недостаточно. Свободный Т3, являясь продуктом метаболического превращения Т4 вне ЩЖ. Если определение общего Т3 показано для оценки глубины патологического тиреоидного процесса, то анализ свободной фракции данного гормона позволяет выявить этап последовательного развития гипотиреоза и назначить больному адекватное лечение (табл. 4).
Таблица 4. Четыре стадии развития гипотиреоза

Тиреоглобулин
Тиреоглобулин — гликопротеин, в состав которого входят йодированные производные аминокислоты тирозина. ТГ синтезируется в тиреоцитах и секретируется в просвет фолликулов, где осуществляется синтез тиреоидных гормонов. В щитовидной железе ТГ выполняет функцию накопления йодпроизводных тирозина, использующихся по мере необходимости для синтеза тироксина. Секрецию ТГ контролирует тиреотропный гормон. Период полу-жизни ТГ в плазме крови 3—4 дня.
В норме в кровоток поступает лишь небольшая часть ТГ, около 10%. Однако при злокачественных опухолях ЩЖ эта ситуация резко меняется — опухолевые клетки выделяют в кровоток значительные количества ТГ. Этот эффект наблюдается у всех пациентов с метастазами дифференцированного рака щитовидной железы независимо от способности опухоли накапливать йод. Поэтому в клинической эндокринологии ТГ используют как маркер рака щитовидной железы.

Определение концентрации ТГ в сыворотке крови имеет большое значение для выявления метастазов карциномы щитовидной железы. Известно, что карцинома ЩЖ, а также ее метастазы при стимуляции ТТГ продуцируют тиреоглобулин. Снижение концентрации ТГ после радикального лечения больного свидетельствует об отсутствии у него метастазов. Нарастание содержания ТГ служит признаком генерализации процесса. Нормальные величины концентрации ТГ составляют 0—50 нг/мл.
Аутоантитела к различным компонентам щитовидной железы
При заболеваниях щитовидной железы аутоиммунного генеза ведущая роль в патологическом процессе принадлежит антителам, продуцируемым В-лимфоцитами человека к различным компонентам (антигенам) тиреоидной клетки. Аутоиммунная агрессия против ЩЖ может сопровождаться не только изменением функционального состояния тиреоцитов, но и их гибелью, приводящей к убыли ткани ЩЖ и развитию гипотиреоза. В литературе опубликованы данные о существовании аутоантител к ТТГ и его рецепторам, к Т4, ТГ и тиреоидной пероксидазе (ТПО). Наиболее полно изучены аутоантитела к ТГ и ТПО.
Аутоантитела к тиреоглобулину
Тиреоглобулин является сильным аутоантигеном, его молекула содержит около 40 антигенных детерминант и имеет эпитопы, общие с тиреоидной пероксидазой, а также с рядом нетиреоидных антигенов. Специфические иммуноглобулины класса М к ТГ часто обнаруживают в крови здоровых людей. Иммуноглобулины класса G (IgG) к ТГ обнаруживают при всех аутоиммунных тиреоидных заболеваниях. Ранее считали, что их появление обусловлено «утечкой» из железы ТГ, который воспринимается клетками иммунной системы как «чужеродный» антиген. В настоящее время показано, что ТГ постоянно присутствует в крови, однако корреляции между его концентрацией и наличием специфических IgG к ТГ не выявлено. Не обнаружено также различий в иммуногенности ТГ, выделенного из нормальной и пораженной болезнью Хашимото щитовидной железы. Тем не менее «нормальный» ТГ может отличаться от «патологического» по составу углеводных компонентов и степени йодирования, что может обуславливать его повышенную иммуногенность. Этим объясняют рост частоты аутоиммунных заболеваний ЩЖ при повышенном потреблении йода.
Патогенетическое значение антител к ТГ не установлено. Известно, что они не фиксируют комплемент и, по всей видимости, не обладают цитотоксической активностью. Однако показано, что пассивная иммунизация животных антитиреоглобулиновой сы-вороткой или имплантация им гибридомы, секретирующей антитиреоглобулиновые антитела, приводит к развитию тиреоидита. Недавно установлено, что антитиреоглобулиновые IgG обладают протеолитической активностью и способны расщеплять ТГ на мелкие фрагменты. В результате протеолиза ТГ происходит снижение синтеза тиреоидных гормонов, т.е. гипотиреоз, к которому, как правило, приводит аутоиммунный тиреоидит.
Антитела к ТГ обнаруживаются примерно у 60% больных ТХ и ДТЗ, а у больных раком ЩЖ и другими тиреоидными заболеваниями (узловым зобом, эутиреоидной струмой) эти антитела выявляются значительно реже и в низких титрах. Присутствие в крови антител к ТГ в высоких титрах (1:1000 и выше) является диагностическим критерием ДТЗ и ТХ. У больных ТХ титры антител к тиреоглобулину в процессе лечения обычно снижаются, но у некоторых из пролеченных пациентов аутоантитела к ТГ могут персистировать или появляться волнообразно с периодом около 2—3 лет. Частота выявления антител к ТГ в популяции разных стран колеблется от 2,0 до 17,8%.
Аутоантитела к тиреоидной пероксидазе
Тиреоидная пероксидаза — фермент, состоящий из 933 аминокислотных остатков. Молекулы ТПО встраиваются в мембрану ти-реоидной клетки таким образом, что их основная часть находится во внеклеточном пространстве. Фермент играет ключевую роль в синтезе тиреоидных гормонов. Связывание ТПО аутоиммунными антителами приводит к ее нейтрализации и тем самым к снижению функции железы.
Антитела к ТПО способны фиксировать комплемент и проявлять цитотоксические свойства в культуре тиреоцитов, что приводит к убыли клеток ЩЖ и может обуславливать появление гипотиреоза. Наличие аутоантител к ТПО коррелирует с лимфоидной инфильтрацией в ЩЖ независимо от формы ее поражения: ТХ, ДТЗ, многоузловой эутиреоидный зоб. При ТХ высокие титры антител к ТПО (1:1000 и выше) присутствуют чаще, чем при ДТЗ. Полагают, что титры антител к ТПО отражают выраженность аутоиммунной агрессии лучше, чем концентрация других антитиреоидных антител.
Высокие титры антител к ТПО свидетельствуют о процессе иммуногенного разрушения ткани ЩЖ. Таким образом, их наличие у обследуемых лиц является показателем снижения гормонпродуцирующей активности железы и прогностическим маркером развития гипотиреоза.
Определение антител к ТПО — диагностически более чувствительный тест для выявления аутоиммунной патологии ЩЖ, чем анализ аутоантител к ТГ. Оба теста применяют для дифференци-альной диагностики аутоиммунного и неаутоиммунного тиреотоксикоза со сходной клинической симптоматикой (тахикардия, потеря массы тела, состояние тревоги и т. д.). В случае одностороннего экзофтальма определение аутоантител к ТПО и ТГ в крови больного помогает отличить асимметричную эндокринную (инфильтративную) офтальмопатию от опухоли орбиты, позволяя избежать трудоемкого обследования.
Динамика определения титров антител в процессе лечения (в том числе хирургического) имеет высокую прогностическую ценность и зачастую определяет тактику ведения больного. У большинства пациентов с ДТЗ выявляют относительно низкие титры антител к ТГ и ТПО. Наличие высоких титров аутоантител, как правило, свидетельствует о рецидиве заболевания или о сочетании ДТЗ с хроническим струмитом, предрасполагающим у части больных к спонтанному развитию гипотиреоза.
Уровень антител к ТПО при консервативном лечении ТХ тиреоидными гормонами меняется незакономерно. Однако эти антитела персистируют в высоких титрах чаще в тех случаях, когда лечение не сопровождается уменьшением размера зоба. После хирургического вмешательства антитела к ТПО исчезают из крови оперированного больного тем скорее, чем больше был объем удаленной тиреоидной ткани.
Определение аутоантител к ТГ и ТПО дает возможность прогнозировать функциональные расстройства ЩЖ у больных с другими аутоиммунными эндокринными заболеваниями: сахарным диабетом, болезнью Аддисона, синдромом Шмидта и другими — и у членов семей с наследственными органоспецифическими аутоиммунными заболеваниями.
Некоторые аспекты лабораторного исследования тиреоидной функции
Количественное определение гормонов методом твердофазного ИФА является сложной процедурой, которую должны выполнять высококвалифицированные специалисты. Одним из решающих факторов в достижении точного определения содержания гормонов в анализируемых пробах является преаналитическая стадия анализа, которая включает в себя правильный забор крови у обследуемого пациента и правильное приготовление пробы для проведения лабораторных исследований.
Особенности приготовления проб для проведения анализа гормонов
При количественном анализе гормонов в лаборатории следует помнить, что: их концентрация может повышаться после приема пищи; содержание гормонов в крови подвержено влиянию суточных колебаний; ряд лекарственных препаратов влияет на концентрацию определяемых гормонов в крови, повышая или понижая их уровень; концентрация гормонов может изменяться на 10% и более в зависимости от горизонтального или вертикального положения тела пациента при заборе крови, а также от предшествующей физической нагрузки; на определение концентрации гормонов влияет гемолиз крови, который возможен при длительном венозном застое, энергичной аспирации крови шприцем, воздействии на кровь после забора высокой или низкой температуры.
Для определения концентрации гормонов ЩЖ обычно используют сыворотку венозной крови. При получении сыворотки нельзя допускать ее длительной экспозиции над форменными элементами крови, так как ряд гормонов может поглощаться и инактивироваться эритроцитами и лейкоцитами, что в конечном итоге может привести к изменению их концентраций в исследуемой пробе. Кроме того, биологический полураспад некоторых гормонов настолько мал, что хранение сыворотки более 24 ч при комнатной температуре может значительно повлиять на результаты их количественного определения.
Образец крови рекомендуется отстаивать при комнатной температуре в течение 1 ч для образования сгустка и затем центрифугировать со скоростью вращения 500—1000 g (1500—3000 об./мин) не более 15—20 мин. Высокая скорость вращения приводит к гемолизу сыворотки. Полученную сыворотку необходимо отделить от форменных элементов крови, перенести в пробирку и плотно закрыть ее крышкой. Липемическая или гемолизированная сыворотка не должна использоваться для анализа.
Хранение сывороток крови
Образцы сывороток следует хранить: при комнатной температуре не более 6—8 ч; при +4°С в течение недели; при минус 20°С не более 3 мес. В пробах сыворотки крови происходит огромное количество процессов. Быстро размножающиеся бактерии и ферментативный гидролиз могут кардинально изменить состояние и содержание всех компонентов. Опыт работы лаборатории ИФА гормонов и опухолевых маркеров ЗАО «Вектор-Бест» показывает, что сыворотки, имеющие антитела к ТГ или к ТПО в высоких титрах, не стабильны. В процессе хранения без замораживания в этих пробах значительно изменяется концентрация ТТГ, а также свободных Т3 и Т4. Поэтому, повторив анализ через неделю, невозможно получить те же самые значения. Вероятно, это связано со способностью данных аутоантител фиксировать комплемент.
Если анализ проводится не сразу, то наиболее эффективным средством замедления и предотвращения таких изменений является замораживание. Однако даже при минус 20°С биологическая система не стабильна, поскольку сохраняется активность ряда ферментов. Поэтому даже в замороженном виде срок хранения сыворотки ограничен.
Сыворотку непосредственно после получения помещают в пробирки с плотно закрывающимися крышками и быстро замораживают. При медленном замораживании в растворе могут образоваться кристаллы льда, которые способны разорвать молекулы некоторых анализируемых веществ, в частности белков. Замораживание проб сывороток удобно проводить в пластмассовых пробирках типа Эппендорф. Образцы замороженной сыворотки необходимо хранить в хорошо закрытых пробирках, так как потеря в образце влаги в замороженном состоянии может привести к концентрированию исследуемого вещества и получению в итоге ошибочного результата анализа.
При размораживании сывороток следует избегать теплового шока образцов, который может наступить при переносе пробы с температурой минус 20°С в комнатную температуру. Размораживание необходимо проводить медленно и постепенно. Накануне постановки анализа исследуемые сыворотки из морозильной камеры помещают в холодильник с температурой 4°С, где они размораживаются в течение всей ночи. На следующий день совместно с диагностическим набором их прогревают 1 ч до комнатной температуры. Перед постановкой анализа необходимо тщательно перемешать анализируемый образец, так как при размораживании проб в них может образоваться градиент концентрации сывороточных белков. Для получения правильных результатов анализа важно, чтобы набор реагентов и анализируемые образцы сывороток имели одинаковую (комнатную) температуру.
Нужно помнить, что в диагностическом наборе реагентов калибровочные и контрольные образцы разлиты в пластмассовые флаконы в объеме, не превышающем 1 мл. Поэтому если сыворотки, предназначенные для анализа, разлиты в стеклянные пробирки или флаконы в объеме, превышающем объем калибраторов, то для выравнивания их температуры потребуется больше времени. Температура исследуемых проб и калибраторов значительно сказывается на результатах определения свободных фракций Т3 и Т4, так как их анализ ведется при температуре, близкой к комнатной (26±1°С).
Размораживание и повторное замораживание отрицательно влияет практически на все биологические пробы. Существует ошибочное мнение, что такое воздействие не сказывается на уровне концентрации тиреоидных и стероидных гормонов, так как они находятся под «защитой» транспортных белков. Однако следует помнить, что под воздействием температурных перепадов белки, разрушаясь, перестают «защищать» гормоны, которые, освобождаясь, немедленно включаются в метаболическую цепь, что в конечном итоге приводит к неточным результатам их анализа. Поэтому повторное замораживание образцов применять не следует. Рекомендуется исследуемый образец сыворотки разделить на аликвоты, чтобы в случае необходимости повторить анализ была возможность использовать для его проведения пробу с одним циклом «замораживание-оттаивание».
Интерпретация результатов определения гормонов щитовидной железы
Результаты определения концентрации гормонов, полученные в разных лабораториях с использованием диагностических наборов различных производителей, могут значительно отличаться. Поэтому при проведении анализа в лаборатории необходимо сверять полученные результаты с нормальными диагностическими показателями, указанными для данного типа тест-системы, единицы измерения гормонов в которых могут быть различными. Для диагностики функциональной активности ЩЖ рекомендуется необходимо использовать диагностические наборы полного ряда тиреоидных гормонов, произведенные одной фирмой.
Многие клиницисты рекомендуют проводить скрининговое обследование пациентов по поводу патологии щитовидной железы, назначая им анализ на ТТГ, свободный Т4 и антитела к ТГ. Многолетний опыт работы лаборатории ИФА гормонов и опухолевых маркеров ЗАО «Вектор-Бест» показывает, что результатов этих анализов для надежного выявления наличия патологии ЩЖ у обследуемых лиц, как правило, недостаточно. Прежде всего потому, что скрининговым обследованием принято считать обследование большого количества условно здоровых лиц. В диагностических центрах нашей страны в основном проводят обследование лиц, обратившихся к специалистам по поводу того или иного недомогания. Поэтому такое скрининговое обследование может не выявить патологию ЩЖ.
Это хорошо иллюстрируют результаты обследования группы сотрудников ЗАО «Вектор-Бест», проведенного с использованием широкого спектра тиреоидных маркеров. Так, при нормальных значения ТТГ, свободного Т4, и антител к ТГ были выявлены отклонения по таким параметрам, как общий Т4, свободный Т3 и антитела к ТПО (табл. 5, выделены жирным шрифтом).
Развернутый анализ, алгоритм которого приведен на рис. 2, позволяет определить функциональное состояние и различную патологию ЩЖ, не выявляемую при узком скрининговом обследовании.
Таблица 5. Результаты анализа маркеров патологии ЩЖ у группы сотрудников предприятия
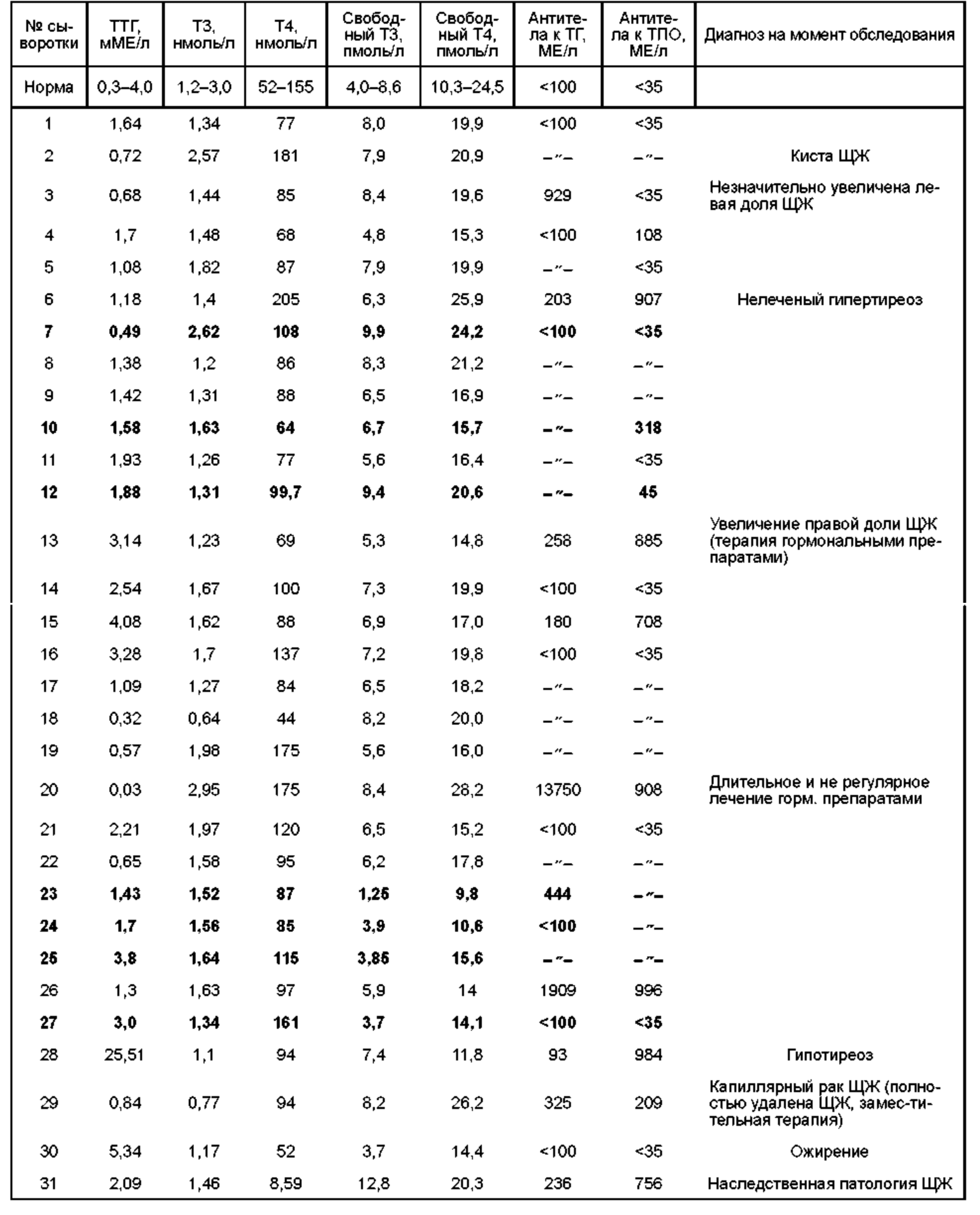
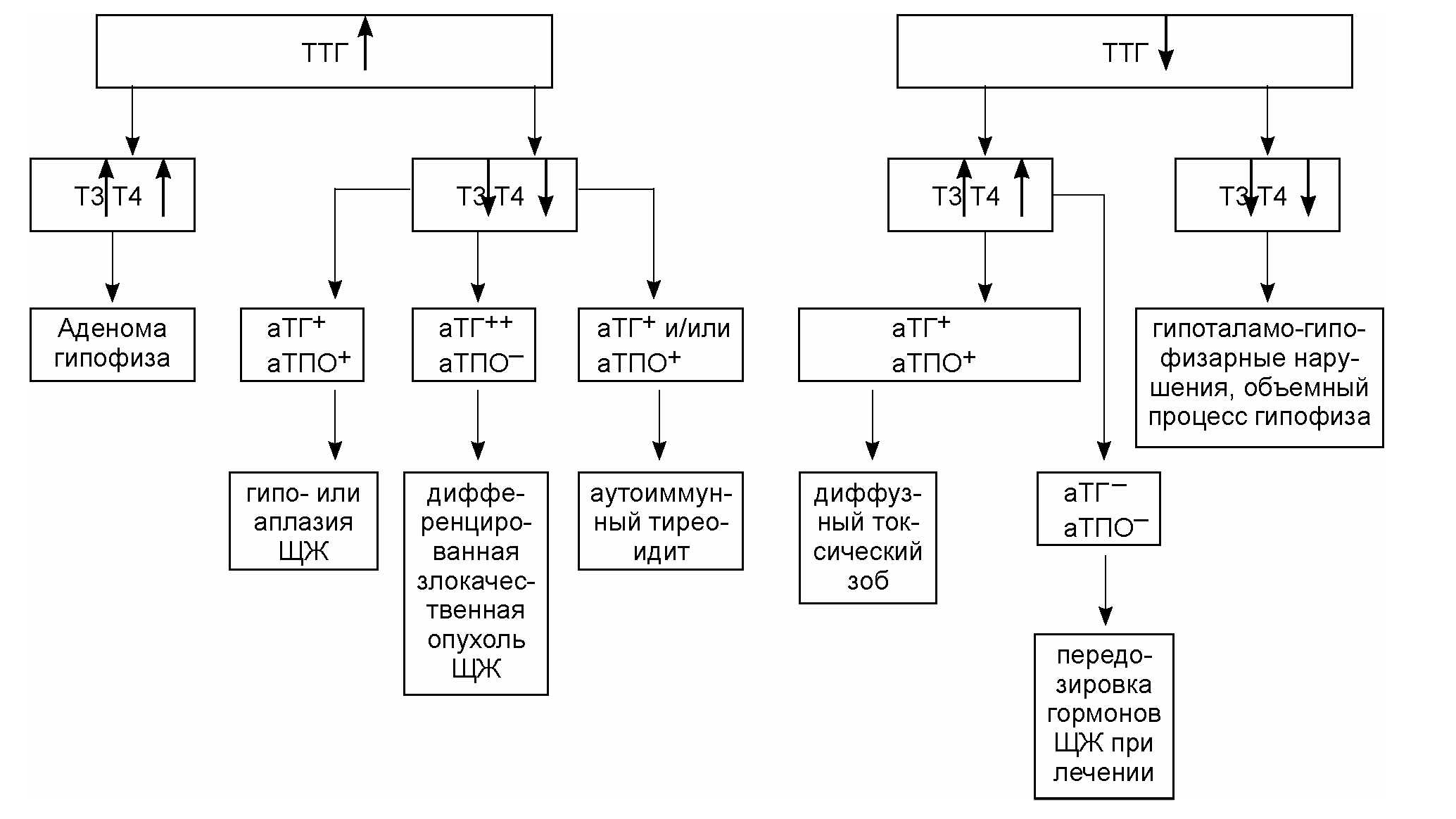
Рис. 2. Алгоритм интерпретации результатов анализа тиреоидных маркеров



































































































0 комментариев