Лизосомы и лизосомные болезни (лизосомные болезни накопления). Лекция для врачей
Лекция для врачей "Лизосомы и лизосомные болезни (лизосомные болезни накопления)" (отрывок из книги "Лизосомные болезни накопления: руководство для врачей - Захарова Е. Ю.")
Лизосомы. Структура и функции
Лизосомы - клеточные органеллы диаметром 0,2-2 мкм, окруженные одной мембраной. Они есть во всех клетках млекопитающих, за исключением эритроцитов. Обычно в клетке содержится несколько сотен лизосом. Одна из функций лизосом заключается в деградации макромолекул и органелл под действием примерно 40 различных ферментов - гидролаз. Наибольшую активность эти ферменты проявляют в кислой среде. В мембранах лизосом содержатся протонные насосы, поддерживающие рН внутренней среды лизосом в диапазоне 4,5-5, в то время как рН цитоплазмы составляет 7,0-7,3.
Лизосомы формируются из пузырьков (везикул), отделяющихся от аппарата Гольджи, и пузырьков (эндосом), в которые попадают вещества при эндоцитозе. Различают первичные и вторичные лизосомы. Первые образуются в области аппарата Гольджи, в них находятся ферменты в неактивном состоянии, вторые же содержат активные ферменты. Обычно ферменты лизосом активируются при кислом рН. Среди лизосом можно также выделить гетеролизосомы (переваривающие материал, поступающий в клетку извне - путем фаго или пиноцитоза) и аутолизосомы (разрушающие собственные белки или органоиды клетки).
Лизосомы являются основными координаторами очень сложной эндосомно-лизосомной системы, которую по-английски называют greater lysosomal system. Эндосомно-лизосомная система необходима для осуществления таких важных метаболических и физиологических процессов, как катаболизм нуклеиновых кислот, белков, глико- и липопротеинов, а также накопления, трансформации и выведения различных веществ, везикулярного транспорта и рециклизации рецепторов, аутофагоцитоза и апоптоза и реконструкции клеточных структур. Многие молекулы, проходящие через эндосомно-лизосомную систему (гликосфинголипиды, холестерин), являются частями специализированных микродоменов и «сигнальными платформами» в плазмолемме клетки, которые влияют на различные клеточные функции.
В эндосомно-лизосомной системе, координирующей процессы рециркуляции и катаболизма, кроме лизосом находятся транспортные везикулы, эндосомы, фагосомы и убиквитиновая система эндоплазматического ретикулума (ЭПР).
Эндосомы - мембранные внутриклеточные органеллы, один из типов везикул, образующихся при слиянии и созревании эндоцитозных пузырьков. Большинство эндосом, возникающих в результате эндоцитоза из плазматической мембраны, транспортируется внутрь клетки, где сливается с существующими эндосомами либо закисляется за счет активности вакуольной аденозитрифосфатазы (v-АТФазы). В процессе созревания эндосома проходит несколько последовательных стадий, постепенно превращаясь в лизосому. При этом часть изначального материала плазматической мембраны может вернуться обратно для повторного использования (рециркуляция). Многие мембранные рецепторы после связывания субстрата находятся в составе эндосом. Ранее это явление рассматривали как путь деградации или рециркуляции молекул-рецепторов. Однако сегодня ясно, что локализация рецепторов в эндосомах может играть особую роль в их способности к передаче сигнала. Так, например, известно, что рецептор эпидермального фактора роста способен к передаче сигнала сразу после связывания с субстратом на клеточной мембране, но максимальной активности он достигает только в эндосомах. Кроме того, активированные рецепторы на мембране и в эндосомах могут запускать разные сигнальные пути.
Выделяют три типа эндосом: ранние, или первичные, поздние, или мультивезикулярные тельца, и рециркулирующие. Они различаются по морфологии и по функциональным маркерам.
После того как эндоцитарные везикулы теряют оболочку, они сливаются с ранними эндосомами, которые, в свою очередь, в процессе созревания превращаются в поздние эндосомы, перед тем как слиться с лизосомами. Молекулы, которые будут подвергаться расщеплению, также сортируются в мелкие везикулы, «выпячивающиеся» по периметру мембраны внутрь эндосомы, формируя люминальные везикулы. Это приводит к образованию мультивезикулярной организации поздних эндосом (мультивезикулярных телец). В образовании аутолизосом (аутофагосом) принимают участие мембраны ЭПР.
Мультивезикулярные тельца обычно окружены одинарной мембраной, содержат в себе более мелкие, окруженные одинарной мембраной пузырьки. Они образуются в результате процесса, напоминающего микроаутофагию (см. ниже), но содержат материал, полученный извне. В мелких пузырьках обычно остаются и затем подвергаются деградации рецепторы наружной мембраны (например, рецепторы эпидермального фактора роста). По стадии формирования соответствуют ранней эндосоме. Описано образование мультивезикулярных телец, окруженных двумя мембранами, путем отпочковывания от ядерной оболочки.
Остаточные тельца (телолизосомы) - пузырьки, содержащие непереваренный материал (в частности, липофусцин). В нормальных клетках сливаются с наружной мембраной и путем экзо-цитоза покидают клетку. При старении организма или некоторых заболеваниях накапливаются в клетках.
Слияние поздних эндосом с лизосомами приводит к образованию гибридной структуры с промежуточными характеристиками. Лизосомы обладают большей плотностью, чем эндосомы, а такие гибридные структуры имеют промежуточную плотность.
Ферменты лизосом
Ферменты лизосом синтезируются в шероховатом ЭПР. После синтеза белковой цепи фермента происходит гликозилирование, то есть присоединение олигосахаридной цепи и образование вторичной и третичной структур. На этой стадии гликопротеин транспортируется в аппарат Гольджи с помощью транспортных везикул. На следующей стадии, типичной для лизосомных белков, концевые маннозные остатки (Man) фосфорилируются. Реакция протекает в две стадии:
1) на олигосахаридную цепь переносится глюкозо-N-ацетил-фосфат (GlcNAc-фосфат), эту реакцию катализирует GlcNAc-фосфотрансфераза;
2) GlcNAc отщепляется при участии другого фермента - GlcNAc-фосфогликозидазы.
В результате лизосомные ферменты приобретают концевой остаток маннозо-6-фосфата.
В мембранах аппарата Гольджи имеются молекулы-рецепторы, с которыми связываются ферменты лизосом через остатки маннозо-6-фосфата. Рецепторы маннозо-6-фосфата - интегральные мембранные белки. У человека известно два типа этих рецепторов:
1) с молекулярной массой 275 000 дальтон, связывающие по 2 моля маннозо-6-фосфата на субъединицу. Эти рецепторы также взаимодействуют с инсулиноподобным фактором роста II (IGF-II) и носят название маннозо-6-фосфат/IGF-II-рецепторов;
2) с массой 46 000 дальтон, связывающие по 1 молю маннозо-6-фосфата на субъединицу. После связывания фермента с рецептором происходит его перенос в лизосомы.
Регуляция работы лизосом
Лизосомы - динамичные структуры, реагирующие на изменения окружающей среды, за их управление отвечают множество генов. Гены, регулирующие работу лизосом, объединили в координированную сеть экспрессии и регуляции в лизосомах (coordinated lysosomal expression and regulation). Регуляцию генов этой сети осуществляет белок - транскрипционный фактор EB (transcription factor EB - TFEB). Многие компоненты этой системы связаны между собой на транскрипционном уровне. Сравнительно недавно стало понятно, что в регуляции работы лизосом принимает участие и комплекс mTORC1. На поверхности лизосомы происходит взаимодействие TFEB и mTORC1. В нормальных условиях mTORC1 связывается с TFEB и инактивирует его. Когда клетка испытывает стресс, mTORC1 перестает связывать TFEB, и этот белок перемещается в ядро и влияет на активность генов, участвующих в синтезе лизосомных белков, активируя таким образом процессы катаболизма в клетке (см. цв. вклейку, рис. 1.2). Возможно, что детализация молекулярных механизмов, осуществляющих регуляцию роста и пролиферации клеток, найдет свое приложение при разработке методов лечения как относительно распространенных, так и таких редких болезней, как ЛБН.
Внутри лизосомы находятся кислые гидролазы, а также активаторы ферментов, защитные и транспортные белки. Кислую рН в лизосоме поддерживает v-АТФаза (вакуольная АТФаза), встроенная в мембрану. Кроме того, мембрана содержит высокогликозилированные белки (например, LAMP), ионные каналы и другие переносчики, которые поддерживают ионный гомеостаз, участвуют в транспорте жиров, сахаров, нуклеозидов, аминокислот и других продуктов расщепления. В мембране на границе с цитозолем происходит связывание белковых комплексов, включая mTOR1, факторов транскрипции, таких как TFEB и TFE3, которые регулируют биогенез лизосом, аутофагию и энергетический обмен. Также с мембраной ассоциированы факторы, способствующие слиянию лизосом или контактам с другими органеллами, комплексы, которые связывают лизосомы с микротрубочками.
Патогенетические механизмы развития лизосомных болезней накопления (ЛБН)
Изначально ЛБН воспринимались исключительно как заболевания, связанные с нарушениями активности ферментов лизосом и накоплением нерасщепленных субстратов, но в последние годы стало очевидно, что патогенез их намного сложнее и далеко не все они являются ферментопатиями.
Для осуществления своей активности некоторые ферменты лизосом нуждаются в присутствии дополнительных факторов - белков-активаторов или белков - «сборщиков» мультиферментных комплексов, и наследственные дефекты этих белков уже известны. Другие лизосомные болезни накопления (ЛБН) связаны с нарушениями транспортных и трансмембранных белков, формирующих каналы. Также известны нарушения посттрансляционной модификации ферментов, что можно рассматривать как нарушения биогенеза лизосом. Да и сам механизм снижения активности фермента может быть разным - в некоторых случаях мутация затрагивает области фермента, необходимые для реализации его каталитической активности, в других происходят нарушения фолдинга (сворачивания) белков или страдает взаимодействие между субъединицами. Если в результате мутации нарушена пространственная конформация белка, он быстро разрушается в ЭПР, не достигнув места своего назначения - лизосомы (рис. 1.8).
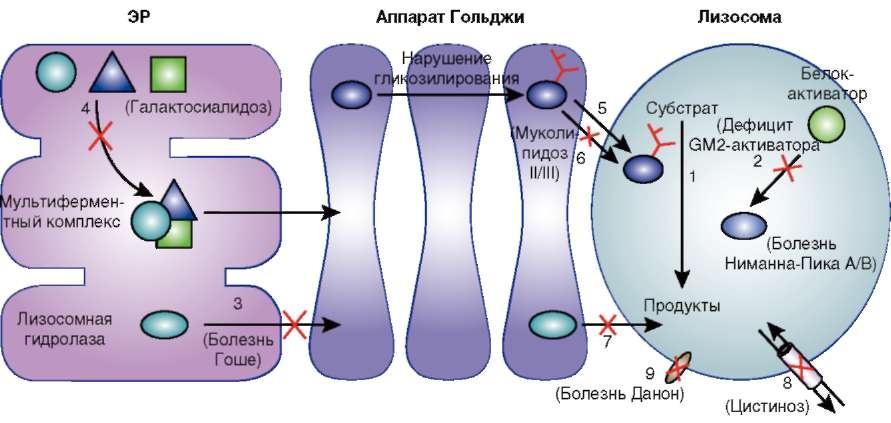
Рис. 1.8. Биохимические и клеточные основы патогенеза лизосомных болезней накопления (по Futerman A.H., G.v. Meer G., 2004): 1 - дефект лизосомного фермента, приводящий к снижению его активности; 2 - повреждение белка-активатора; 3 - нарушение транспорта фермента из эндоплазматического ретикулума (мутации, вызывающие нарушение конформации белка); 4 - нарушение образования мультиферментного комплекса, необходимого для транспорта фермента из эндоплазматического ретикулума; 5 - нарушение гликозилирования фермента в аппарате Гольджи; 6 - нарушение гликозилирования фермента в аппарате Гольджи ведет к неспособности фермента связаться с маннозо-6-фосфатными рецепторами и войти в лизосому; 7 - дефект транспорта фермента из аппарата Гольджи; 8 - дефекты лизосомных мембранных белков-переносчиков; 9 - дефекты лизосомных мембранных белков, выполняющих важную регуляторную роль в функционировании лизосом
Следствием снижения активности ферментов и нарушений работы других белков является внутриклеточное накопление нерасщепленных макромолекул и увеличение числа лизосом в различных тканях организма. Такое увеличение морфологически выявляется как наличие «пенистых» клеток в этих тканях, изменений структуры лизосом (тельца «зебры») при электронной микроскопии. Увеличение размеров и числа лизосом наблюдается при многих ЛБН и служит их морфологическим маркером. Накопление приводит к изменению нормального функционирования клеток и их гибели.
Болезнu накопления или болезни дефицита?
Изначальная концепция патогенеза ЛБН, рассматривающая их патогенез лишь в свете накопления токсичных для лизосомы и клетки негидролизованных субстратов, прошла существенные уточнения и дополнения. Очевидно, что «накопление» - это только вершина айсберга, и патогенез ЛБН гораздо более сложен и охватывает нарушение аутофагоцитоза, распределение жиров и их производных, гомеостаза кальция, активацию апоптотической гибели клетки и даже воспалительные реакции.
Накопление, сбережение и реутилизация
Реутилизация молекул более энергетически выгодна, чем полный цикл их синтеза de novo. Например, в кожных фибробластах человека 90% глюкозилцерамида образуется за счет реутилизации сфингоидного основания и только 10% синтезируется de novo. В цитозоле «строительные блоки» могут подвергаться дальнейшему расщеплению или использоваться вновь в биосинтетических путях. Участие в этих «путях сохранения» и ре-циклизации - одна из важнейших функций лизосом. Было показано, что лизосома, обеспечив расщепление макромолекул (гликосфинголипиды, углеводы и сиаловые кислоты), должна также вывести их из органеллы для использования в других компартментах клетки для синтеза. В этот «сберегательный» процесс вовлечено множество мембранных белков лизосом, которые выполняют функцию транспортеров, например сиалин, цистинозин, переносчик кобаламина, белок NPC1.
Один из примеров нарушения «сберегательных путей» - нарушения обмена кобаламина F. При этом заболевании наблюдаются мегалобластная анемия, задержка физического развития, неврологические нарушения. Причиной болезни является дефект транспортера кобаламина, поэтому кобаламин не может покинуть лизосому, что нарушает процесс его превращения в метилкобаламин и аденозилкобаламин, которые являются кофакторами большого числа метаболических реакций.
Другой пример - НПС, при которой дефект мембранного белка NPC1 нарушает внутриклеточное распределение холестерина. Это приводит к тому, что, с одной стороны, неэтерифицированный холестерин, гликосфинголипиды и ганглиозиды накапливаются внутри лизосом и эндоплазматических везикул, а с другой - наблюдается недостаточность холестерина в иных компартментах клетки. Снижение содержания холестерина в ЭПР, аппарате Гольджи и других органеллах приводит ко множественным негативным эффектам, влияющим на их функцию, вызывает накопление окисленных форм холестерина - оксистеролов и компенсаторное увеличение синтеза холестерина, что усиливает «порочный круг» и приводит к прогрессированию болезни.
Сходный феномен «внутриклеточного дефицита» наблюдается и при других ЛБН, например связанных с нарушениями катаболизма ганглиозидов. После синтеза в аппарате Гольджи и транспорта в плазмолемму сложные ганглиозиды захватываются путем эндоцитоза и расщепляются в лизосомах. «Сохранение» простых ганглиозидов (таких, как GM2 и GM3) и их обратный транспорт в аппарат Гольджи из лизосом необходимы для синтеза сложных ганглиозидов без их полного синтеза de novo из церамида. При болезни Зандгоффа, связанной с дефектом фермента гексозаминидазы, GM2-ганглиозид накапливается в лизосомах, и при этом нейроны одновременно испытывают недостаток предшественников ганглиозидов для их синтеза.
Недавние исследования патогенеза ЛБН демонстрируют нарушения процессов регуляции энергетического обмена. Таким образом, ЛБН, которые изначально расценивались как болезни накопления негидролизованных молекул, теперь становятся заболеваниями, связанными с дефицитом соединений, играющих важную роль в различных метаболических путях. Лизосомы - активные участники не только расщепления и утилизации, но и образования макромолекул и их полного цикла гомеостаза.
Активация сигналов апоптотической гибели клетки
Некоторые соединения, например такие, как галактозил-церамид при болезни Краббе, ГАГ при МПС, работают как лиганды для сигнал-передающих рецепторов (signal transduction receptors). Накопление этих молекул приводит к активации белков, участвующих в запуске каскадных реакций апоптотической гибели клетки.
Например, ГАГ сходны по своему строению с бактериальными липополисахаридами (компоненты микробной стенки) и могут активировать толл-подобный рецептор-4 (TLR4), что индуцирует воспаление и влияет на рост клеток соединительной ткани. Толл-подобный рецептор-4 (CD284) - мембранный белок, относится к группе рецепторов, участвующих в формировании иммунного ответа. Сигнал, передающийся в клетку через этот рецептор, функционально близок к рецептору интерлейкина-1 и является одним из древнейших в системе антибактериальной защиты организма.
Сходный феномен «внутриклеточного дефицита» наблюдается и при других ЛБН, например связанных с нарушениями катаболизма ганглиозидов. После синтеза в аппарате Гольджи и транспорта в плазмолемму сложные ганглиозиды захватываются путем эндоцитоза и расщепляются в лизосомах. «Сохранение» простых ганглиозидов (таких, как GM2 и GM3) и их обратный транспорт в аппарат Гольджи из лизосом необходимы для синтеза сложных ганглиозидов без их полного синтеза de novo из церамида. При болезни Зандгоффа, связанной с дефектом фермента гексозаминидазы, GM2-ганглиозид накапливается в лизосомах, и при этом нейроны одновременно испытывают недостаток предшественников ганглиозидов для их синтеза.
Недавние исследования патогенеза ЛБН демонстрируют нарушения процессов регуляции энергетического обмена. Таким образом, ЛБН, которые изначально расценивались как болезни накопления негидролизованных молекул, теперь становятся заболеваниями, связанными с дефицитом соединений, играющих важную роль в различных метаболических путях. Лизосомы - активные участники не только расщепления и утилизации, но и образования макромолекул и их полного цикла гомеостаза.
Активация сигналов апоптотической гибели клетки
Некоторые соединения, например такие, как галактозил-церамид при болезни Краббе, ГАГ при МПС, работают как лиганды для сигнал-передающих рецепторов (signal transduction receptors). Накопление этих молекул приводит к активации белков, участвующих в запуске каскадных реакций апоптотической гибели клетки.
Например, ГАГ сходны по своему строению с бактериальными липополисахаридами (компоненты микробной стенки) и могут активировать толл-подобный рецептор-4 (TLR4), что индуцирует воспаление и влияет на рост клеток соединительной ткани. Толл-подобный рецептор-4 (CD284) - мембранный белок, относится к группе рецепторов, участвующих в формировании иммунного ответа. Сигнал, передающийся в клетку через этот рецептор, функционально близок к рецептору интерлейкина-1 и является одним из древнейших в системе антибактериальной защиты организма.
На моделях животных МПС VI и VII типов было показано, что хондроциты секретируют провоспалительные цитокины, которые повышают активность металлопротеиназ и приводят к дегенерации хряща и активации толл-подобного рецептора-4. Активация этого рецептора вызывает повышение церамида в хондроцитах, что приводит к клеточной гибели и к пролиферации синовиальных клеток за счет повышения уровня сфингозин-1-фосфата.
При МПС I (синдроме Гурлер) накопление гепарансульфата вызывает изменение сигналов, запускаемых фактором роста фибробластов 2 и трансформирующим фактором роста-β, что вызывает нейродегенерацию и патологию костной ткани.
Апоптотическая гибель клетки происходит с повышенной скоростью при большинстве НЦЛ. Например, известно, что белки CLN5 и CLN8 являются активаторами церамид-синтазы, что обуславливает их роль в пути сфинголипид-активированной клеточной гибели при НЦЛ.
Лизосфинголипиды - биоактивные соединения, которые накапливаются при гликосфинголипидозах в нервной системе. При болезни Краббе повышенное накопление психозина и его взаимодействие с рецептором TDAG8 приводит к нарушению клеточного деления, что вызывает образование гигантских клеток со множеством ядер, которые являются характерным гистохимическим маркером болезни Краббе. Психозин также ингибирует протеинкиназу С - сигнальную молекулу, которая отвечает за реакцию Шванновских клеток и олигодендроцитов на факторы роста, поэтому избыток психозина делает эти клетки крайне чувствительными к апоптозу. Через активацию фосфолипазы А2 психозин повышает уровень арахидоновой кислоты и лизофос-фатидилхолина, что приводит к активации каспазы-3, запуску апоптотической гибели клеток и последующей демиелинизации в центральной и периферической нервной системе.
Антиапоптотические агенты, которые могут преодолевать гематоэнцефалический барьер (ГЭБ), могут быть следующим поколением лекарственных препаратов для лечения ЛБН и таких болезней, как хорея Гентингтона, болезнь Паркинсона и болезнь Альцгеймера.
Нарушения в составе и распределении липидов
Изменения содержания липидов в мембране клетки также могут влиять на ответ рецепторов и последующие сигнальные события. Это явление наиболее хорошо изучено при болезни НПС, когда происходит накопление холестерина в лизосомах, что вызывает изменение свойств мембран и снижение передачи сигнала от молекул инсулина. Нарушение распределения короткоцепочечных ацилпроизводных лактозилцерамида - важного компонента липидных слоев мембран - приводит к его накоплению в поздних эндосомах и/или лизосомах (в противоположность их нормальной локализации в аппарате Гольджи). Это характерно для GM1 и GM2 ганглиозидозов, МПС IV, метахроматичекой лейкодистрофии, болезни Фабри и болезни Ниманна-Пика типа А, В, С.
При НЦЛ 3 нарушение структуры белка CLN3 вызывает изменение количественных соотношений сфинголипидов в липидных слоях. При дефектах белка нарушается транспорт GalCer из аппарата Гольджи. Постоянный дефицит GalCer приводит к образованию церамида, который, в свою очередь, активирует каспазы и приводит к запуску апоптотической гибели клетки. В качестве терапевтического подхода на клеточных культурах с НЦЛ 3 применяли введение к дезоксирибонуклеиновой кислоте (ДНК) CLN3 или экзогенного GalCer, что позволило восстановить клеточный рост и подавить запуск апоптоза.
Воспалительная реакция
Активация воспалительных процессов происходит при многих из ЛБН, и они являются одним из компонентов патогенетического каскада при этих болезнях.
Болезнь Гоше - наиболее хорошо изученное в этом плане заболевание. Основной субстрат - гликозилцерамид и его производное - деацитилированный продукт гликозилсфингозин преимущественно накапливаются в макрофагах, что приводит к их активации и выбросу различных цитокинов (фактора некроза опухоли α, интерлейкина-1b и др) и хитотриозидазы (ХТ), что, в свою очередь, активирует другие клетки иммунной системы - нейтрофилы. Кроме активации макрофагов и выброса цитокинов у некоторых пациентов с болезнью Гоше наблюдаются поликлональные и моноклональные гаммапатии, представляющие собой высокий фактор риска развития миелоидных опухолей.
Другой пример - болезнь Фабри. Основной субстрат, накапливаемый при этом заболевании, - глоботриазилцерамид (Gb3). На мышиной модели было показано, что, с одной стороны, его накопление вызывает снижение количества инвариантных (тип 1) Т-киллеров в селезенке и других органах, а с другой - связывание Gb3 и его производных с TLR4 через активацию ядерного фактора каппа B (NF-кB) приводит к продукции провоспалительных цитокинов и вызывает активацию воспалительной реакции.
При ЛБН, протекающих с поражением нервной системы, наблюдается активация микроглии и выброс медиаторов воспаления из этих клеток. Активация глиальных клеток - компенсаторный ответ при инсультах, менингите или других воспалительных заболеваниях. При ЛБН продолжительное и возрастающее накопление макромолекул в нейронах приводит к постоянной активации глии и воспалительным реакциям, что вызывает гибель нейронов.
Воспалительные реакции, хотя они и вторичны при ЛБН, отвечают за прогрессирование нейродегенеративного процесса при многих ЛБН и, возможно, могут являться точкой приложения для разработки новых лекарственных препаратов.
Например, недавно был описан потенциальный терапевтический эффект ресвератрола на культурах клеток пациентов с болезнью Гоше. Он является растительным полифенолом с противовоспалительным, антиоксидантным и нейропротективным эффектом.
На мышиных моделях болезни НПС показан синергичный усиливающий эффект миглустата и таких веществ, как куркумин и ибупрофен. Нестероидный противовоспалительный препарат симвастатин на мышиной модели метахроматической лейкодистрофии продемонстрировал снижение нейровоспаления и даже восстановление миелинизации спинного мозга.
Баланс внутриклеточного кальция
Кальций является вторичным мессенджером и участвует в разных клеточных процессах, в том числе в аутофагии и эндоцитозе. При некоторых ЛБН показано нарушение образования эндосом, фагосом и лизосом и накопление ионов кальция. Большое число ЛБН характеризуются нарушением функции кальциевых каналов или насосов в ЭПР, вызванным накоплением нерасщепленных макромолекул. Например, при болезни НПС накопление сфингозина приводит к снижению концентрации ионов кальция в лизосомах, изменению рН, нарушению распределения холестерина, сфингомиелина и гликосфинголипидов. При НЦЛ корковые нейроны не могут восстановить деполяризацию из-за очень высокого уровня внутриклеточного кальция.
При болезни Гоше выход ионов кальция из ЭПР в цитозоль обусловлен накоплением гликозилцерамида, который активирует рианодиновые рецепторы, относящиеся к классу кальциевых каналов в возбудимых тканях животных и человека, таких как мышцы и нейроны. При GM1- и GM2-ганглиозидозах снижение захвата ионов кальция из цитозоля связано с ингибированием нерасщепленными макромолекулами АТФ-зависимого транспортера кальция (SERCA)1
Снижение экспрессии транспортера SERCA выявлено также в мозжечке модельных животных болезни Ниманна-Пика, тип А, при которой наблюдается накопление сфингомиелина.
Несмотря на то что кальций-зависимые механизмы еще не до конца изучены, очевидно, что гликосфинголипиды и фосфолипиды влияют на уровень кальция в ЭПР и цитозоле клетки. Рассматривается возможность создания органелл-специфических1 SERCA расположен на поверхности ЭПР и отвечает за активный транспорт ионов кальция из цитозоля в ЭПР. Он переносит ионы кальция из клетки во внеклеточную жидкость или внутриклеточные депо кальция - пузырьки ЭПР за счет энергии гидролиза АТФ, поддерживая тем самым низкую концентрацию ионов кальция в цитоплазме. При нарушении работы этого транспортера возрастает уровень ионов кальция в цитозоле клетки, что запускает различные кальций-идуцируемые клеточные процессы и в том числе усиливает апоптотическую гибель нейронов модуляторов кальциевых каналов для лечения ЛБН. На клеточных моделях показано, что препараты, оказывающие влияние на метаболизм ионов кальция - дилтиазем и верапамил, - могут иметь потенциальный положительный эффект при БГ, МПС IIIA и альфа-маннозидозе.
Нарушение регуляции аутофагии
Две основные системы клетки участвуют в деградации белков: протеосомная и лизосомная. Лизосомная система является основным механизмом клеточной деградации долгоживущих внутриклеточных компонентов: белков, жиров, белковых агрегатов, органелл и т.д.
Аутофагия1 (от греч. auto - само и phagos - поедать) - это процесс, в ходе которого цитоплазматические компоненты клетки транспортируются внутрь лизосом и подвергаются в них расщеплению. Благодаря этому процессу клетка способна быстро получить строительные блоки для обновления клеточных компонентов, поэтому он жизненно необходим для клеточного ответа на разные виды стресса. Аутофагия помогает клеткам в борьбе с бактериями и вирусами, участвует в дифференцировке клеток, играет основную роль в противодействии старению. Различают три типа аутофагии: микроаутофагию, макроаутофагию и шапероновую аутофагию (рис. 1.9). При микроаутофагии макромолекулы и обломки клеточных мембран захватываются лизосомой.
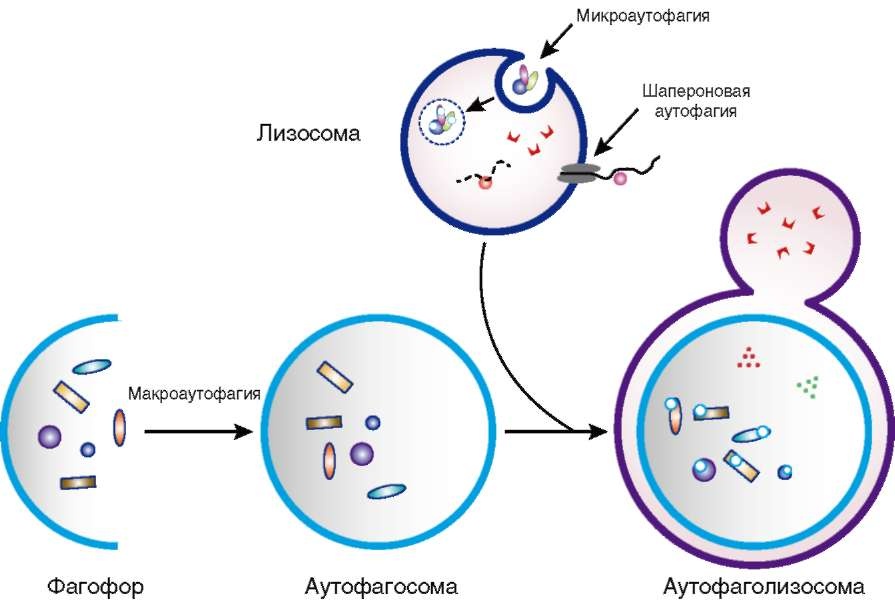
Рис. 1.9. Типы аутофагии
Наиболее подробно изучена макроаутофагия, при которой элементы цитоплазмы и целые органеллы поглощаются так называемыми аутофагосомами, или первичными аутофаговыми вакуолями (AV-I), имеющими двойную мембранную структуру. После слияния с лизосомами аутофагосомы формируют одномембранные структуры, называемые аутолизосомами, или поздними аутофаговыми вакуолями (AV-II), содержимое которых расщепляется, и получившиеся элементы возвращаются в цитоплазму для метаболических реакций.
*10 декабря 2016 г. в Стокгольме за открытие и исследование механизмов аутофагии была вручена Нобелевская премия по физиологии и медицине японскому ученому Есинори Осуми. Главное его достижение - открытие генов аутофагии, вовлеченных в этот процесс у дрожжей. В последующем оказалось, что эта группа включает около 30 генов, которые сохранились в ходе эволюции практически неизмененными у млекопитающих и у человека.
Макроаутофагия регулируется различными стимулами и сигнальными путями, и mTOR занимает центральное положение в большинстве из них. Путь Akt-mTOR негативно регулирует макроаутофагию, ингибируя синтез аутофагосом.
Третий тип аутофагии - шапероновая, при которой происходит направленный транспорт частично денатурировавших белков из цитоплазмы сквозь мембрану лизосомы, где они расщепляются. Этот тип аутофагии, описанный только у млекопитающих, индуцируется стрессом (например, при голодании или физических нагрузках). Она происходит при участии цитоплазматических белков-шаперонов и других вспомогательных белков. Белки цитоплазмы, которые содержат определенные пептидные мотивы (KFERQ), распознаются комплексом белков-шаперонов (в том числе белком теплового шока 73 кДа, HSP73 73) и направляются к лизосомной мембране, где они взаимодействуют с белками, связанными с мембраной лизосом, и служат рецептором для комплекса шаперон-белок, подлежащего переносу в лизосому.
Белок LAMP-2 отвечает за процесс слияния аутофагосомы и лизосомы. Показано, что повышение рН лизосом снижает способность к расщеплению макромолекул в лизосомах и блокирует аутофагосомное и эндоцитарное созревание. Регуляция аутофагии осуществляется различными факторами. Помимо mTOR к ним относятся аминокислоты, АТФ и разнообразные белки: c-myc, Atgl, Beclin-1, LAMP-2, гуанозинтрифосфатаза и др.
Нарушение процесса аутофагии может происходить на разных стадиях - при формировании и созревании аутофагосомы. Именно поэтому многие ЛБН можно также представить как «болезни аутофагии» или заболевания с дисрегуляцией аутофагии.
Нейрональный цероидный липофусциноз
Причиной НЦЛ являются мутации в генах, кодирующих различные по своей функции и локализации белки. Их нарушение затрагивает многочисленные биологические процессы в клетке, конечное фенотипическое проявление которых очень сходно, что и позволило объединить эти заболевания в один подкласс. Считается, что именно нарушение аутофагии является общим механизмом для НЦЛ. В исследовании на мышиных моделях с дефицитом CLN7, CLN5, CLN6 было обнаружено накопление аутофагосом и аутофагических субстратов в головном мозге животных. В фибробластах пациентов с НЦЛ 2 происходит снижение «аутофагического потока» из-за ингибирования образования аутофагосом, при НЦЛ 3 нарушается созревание аутофагосом. Аутофагосомы и митохондриальные белки накапливаются в культивируемых нейронах моделей мышей с другими формами НЦЛ.
Болезнь Гоше
Считается, что нарушение аутофагии является центральным событием в патогенезе неврологических нарушений при БГ. В нейронах и астроцитах мышиных моделей этого заболевания были выявлены изменения, характерные для нарушений аутофагии: накопление различных аутофагических «частиц», таких как митохондрии, убиквитинированные белковые агрегаты, нерастворимый альфа-синуклеин и белок p62.
Болезнь Помпе
Результаты экспериментальных и клинических исследований показали, что основную роль в патогенезе болезни Помпе играет не столько накопление гликогена в лизосомах с последующим их разрушением, сколько существенное нарушение процесса аутофагии. В мышцах нокаутных по гену GAA мышей присутствуют увеличенные эндосомы, лизосомы и аутофагические вакуоли, и также изменяется рН эндосом и их подвижность. Это указывает на блокирование «аутофагического потока».
В нормальных условиях аутофагосомы быстро разрушаются лизосомами, и их содержание подвергается рециркуляции. При болезни Помпе нарушается как образование аутофагосом, так и их слияние с лизосомами. Мышечная атрофия при болезни Помпе является следствием нарушения баланса между синтезом и деградацией белка, когда последняя начинает преобладать. Эффективность ФЗТ при болезни Помпе зависит от степени нарушения аутофагии, поскольку доставка в клетки рекомбинантного человеческого фермента зависит от этого процесса. На мышиных моделях применяли комбинацию ФЗТ в сочетании с подавлением аутофагии, что снижало уровень гликогена гораздо эффективнее, чем только применение фермента.
Болезнь Ниманна-Пика, тип С
На различных моделях НПС выявлено накопление аутофагосом и лизосом как in vivo, так и in vitro. Показано, что при этом заболевании останавливается многоступенчатый путь созревания аутофагосом. Также возможно, что накапливаемые при НПС субстраты влияют на процесс аутофагии: накопление холестерина нарушает созревание аутофагосом, накопление сфингозина приводит к истощению ионов кальция в лизосоме, что влияет на процесс аутофагии через кальциневрин или кальпаин.
Сложность патогенетического каскада ЛБН предполагает, что будет разрабатываться более сложная, «комбинированная» терапия для воздействия на различные звенья патогенеза этих заболеваний.
Вы читали отрывок из книги "Лизосомные болезни накопления: руководство для врачей" - Захарова Е. Ю.
Купить медицинскую литературу по неврологии в интернет-магазине shopdon.ru
Книга "Лизосомные болезни накопления: руководство для врачей". Является первой частью переработанной авторами монографии К.Д. Краснопольской «Наследственные болезни обмена веществ»
Автор: Захарова Е. Ю.

В последнее десятилетие значительно возрос интерес к наследственным болезням обмена веществ. Это связано прежде всего с появлением новых методов их диагностики и лечения. Данное издание посвящено лизосомным болезням накопления.
Руководство является первой частью переработанной авторами монографии К.Д. Краснопольской «Наследственные болезни обмена веществ». В него включены три дополнительные главы, а также обновлены разделы, касающиеся лечения и диагностики лизосомных заболеваний. С современных позиций отражены эпидемиология, патогенез, профилактика лизосомных болезней накопления, приведены детальные описания отдельных нозологических форм, а также клинические примеры, которые помогут врачам разных специальностей получить представление о динамике формирования клинических фенотипов этой группы наследственных болезней.
Предназначено врачам-генетикам, педиатрам, неврологам, лабораторным генетикам, неонатологам, а также будет полезным ординаторам, аспирантам, научным работникам и преподавателям медицинских академий и университетов.
Купить медицинскую литературу по неврологии в интернет-магазине shopdon.ru
Содержание книги "Лизосомные болезни накопления: руководство для врачей". Является первой частью переработанной авторами монографии К.Д. Краснопольской «Наследственные болезни обмена веществ»
Глава 1. Лизосомы и лизосомные болезни накопления
Лизосомы. Структура и функции
История открытия и изучения лизосомных болезней накопления
Классификация и эпидемиология лизосомных болезней накопления
Патогенетические механизмы развития лизосомных болезней накопления
Клинические проявления лизосомных болезней накопления
Лабораторная диагностика лизосомных болезней накопления
Глава 2. Лечение лизосомных болезней накопления
Основные подходы к терапии лизосомных болезней накопления и их ограничения
Трансплантация гемопоэтических стволовых клеток
Ферментная заместительная терапия
Фермент-индуцирующая терапия. Фармакологические шапероны
Субстрат-редуцирующая терапия
Выведение накапливаемых субстратов
Симптоматическая терапия
Генотерапия
Глава 3. Лизосомные болезни и распространенные заболевания
Синуклеинопатии
Болезнь Альцгеймера
Лобно-височная деменция
Ишемический инсульт
Аксональная нейропатия и мукополисахаридоз IIIB
Заикание и муколипидоз
Глава 4. Клинические проявления отдельных лизосомных болезней накопления
Вступление
Мукополисахаридозы
Сфинголипидозы
Нарушения белков-активаторов
Другие лизосомные болезни накопления
Нейрональные цероидные липофусцинозы
Купить медицинскую литературу по неврологии в интернет-магазине shopdon.ru


























































































0 комментариев