Кризы при миастении. Диагностика и алгоритм лечения. Часть 1. Лекция для врачей
Лекция для врачей "Кризы при миастении. Диагностика и алгоритм лечения". Лекцию для врачей проводит д.м.н.,проф. Д.М. Меркулова. Неврологический центр им Б М. Гехта ОАО «РЖД» ММА им. ИМ Сеченова Росздрава НИИ ОПП РАМН
Миастения. Схема лечения. Часть 2. Лекция для врачей
Дополнительный материал
Миастения (myasthenia gravis) - хроническое аутоиммунное нервно-мышечное заболевание, клинически проявляющееся в виде слабости и патологической мышечной утомляемости, обусловленными образованием аутоантител к различным антигенным мишеням периферического нейромышечного аппарата.
Течение заболевания сопровождается выраженной лабильностью клиники, нередко с нарушением витальных функций, в связи с этим возникает необходимость динамического наблюдения и индивидуально подобранного лечения у неврологов при выявлении достоверного диагноза миастении. Пациент должен быть информирован о течении его заболевания, в том числе о возможных вариантах и непредсказуемых моментах, обо всех методах лечения, возможностях его эффективности и осложнений.
За последние 20-30 лет произошло коренное изменение подходов к лечению и прогнозу миастении, основанное на понимании патогенетических механизмов данной патологии. Реализация комплексного мультидисциплинарного подхода в лечении больных миастенией позволяет существенно снизить летальность, продлить жизнь пациентов и улучшить ее качество, тогда как в 60-х годах двадцатого века средняя длительность жизни больных миастенией составляла 4-7 лет.
Понимание сути заболевания, основных звеньев его патогенеза, знание спектра современных терапевтических агентов и алгоритмов их применения позволяют улучшить качество оказания медицинской помощи больным с миастенией.
Эпидемиология
Частота миастении в настоящее время составляет 20 случаев на 100 000 населения. Считается, что число больных, у которых это заболевание не выявлено, в 2-3 раза больше. Соотношение мужчин и женщин равно 1:3. В пожилом возрасте соотношение выравнивается, мужчины болеют также часто, как и женщины. Дебют заболевания у женщин чаще происходит в фертильном возрасте (средний возраст заболевания 31,7 лет с двумя пиками заболеваемости - в 20-29 лет и старше 50 лет), у мужчин в 30-40 лет, при этом развитие миастении может произойти в любое время от первых дней жизни (миастения новорожденных) до пожилого возраста, 75 % больных миастенией заболевают в возрасте 15-30 лет (20 % - у людей старше 60 лет). Детская миастения составляет 10-24 % от всех заболевших. В 10 % случаев заболевание сочетается с аутоиммунным гипотиреозом, в 80 % случаев ассоциируется с гиперплазией тимуса, в 15% - с тимомой (из них в 30 % злокачественной), также может сопровождаться тиреотоксикозом, ревматоидным артритом, системной красной волчанкой. Заболевание приводит к инвалидизации в 60-70 % случаев, а при отсутствии эффективного лечения - и к гибели больных. Встречается миастения одинаково часто во всех странах мира. Миастения не является наследственным заболеванием. В последние годы во всем мире отмечен рост числа больных миастенией, что связано с общим нарастанием количества аутоиммунной патологии, увеличением длительности жизни больных миастенией и повышением квалификации врачей-неврологов, что ведет к улучшению диагностики этого заболевания. Удельный вес миастении среди нервно-мышечной патологии составляет 60%. Колебания распространенности этой болезни в различных регионах мира определяются в большей степени качеством диагностики заболевания, чем истинными эпидемиологическими различиями.
Этиопатогенез
Механизмы развития приобретенной миастении тесно связаны с патологическими изменениями тимуса. Происходит образованием антител и аутореактивных Т-клеток, поражающих органы-мишени - структуры синапса и непосредственно мышечную ткань. К антигенным мишеням относят: мышечный ацетилхолиновый рецептор (АХР), мышечно-специфическая тирозинкиназа, рианодиновый рецептор, титин-протеин и другие. Также при миастении обнаружены антитела к некоторым цитокинам, ганглиозидам миелина нервной ткани и другим белковым структурам.
Поражение описанных выше и некоторых других антигенных мишеней приводит к нарушению нервно-мышечной передачи, проявляющейся мышечной слабостью и патологической утомляемостью.
Перенос импульса от нерва к мышце происходит в нервно-мышечном синапсе. Потенциал действия, дошедший до нервного окончания, приводит к высвобождению в синаптическую щель кванта ацетилхолина, который содержится в везикулах нервных окончаний. На постсинаптической мембране молекулы ацетилхолина взаимодействуют с ацетилхолиновыми рецепторами, что приводит к временному открытию катионных каналов рецепторов и генерированию потенциала концевой пластинки. Когда он достигает критической величины, возникает потенциал действия, который распространяется вдоль мышечного волокна по поперечной тубулярной системе, вызывая высвобождение кальция в саркоплазму, взаимодействие актина и миозина и, вследствие этого, мышечное сокращение. Миастения - приобретенное расстройство нервно-мышечной передачи. Количество ацетилхолиновых рецепторов значительно снижено. Расстояние между нервным окончанием и постсинаптической мембраной увеличено, а складки постсинаптической мембраны, которые содержат рецепторы, оказываются более широкими, но менее глубокими, чем в норме (рис. 1). Снижение числа АХР ведет к уменьшению потенциала концевой пластинки, поэтому в вовлеченных мышцах не генерируется потенциал действия. Если нарушается передача импульсов достаточно большой части мышечных волоки, развивается клинически выраженная мышечная слабость. При повторном сокращении нарушение передачи распространяется на все большее количество синапсов, и сила мышцы прогрессивно уменьшается.
Следует отметить, что тимус является активным индуктором аутоиммунного процесса, в среднем, первые 3-5 лет развития болезни. В дальнейшем выработка аутоантител к ацетилхолиновым рецепторам становится функцией других органов ретикулоэндотелиальной системы (лимфоузлы брыжейки, селезенка и др.). Это имеет определенное значение в выборе тактики лечения больных в зависимости от сроков заболевания. Выработка антител генетически детерминирована, при миастении патологический процесс обусловлен, в основном, локусами НБА-В8, ЭК3, реже А2, В7, ЭК2.
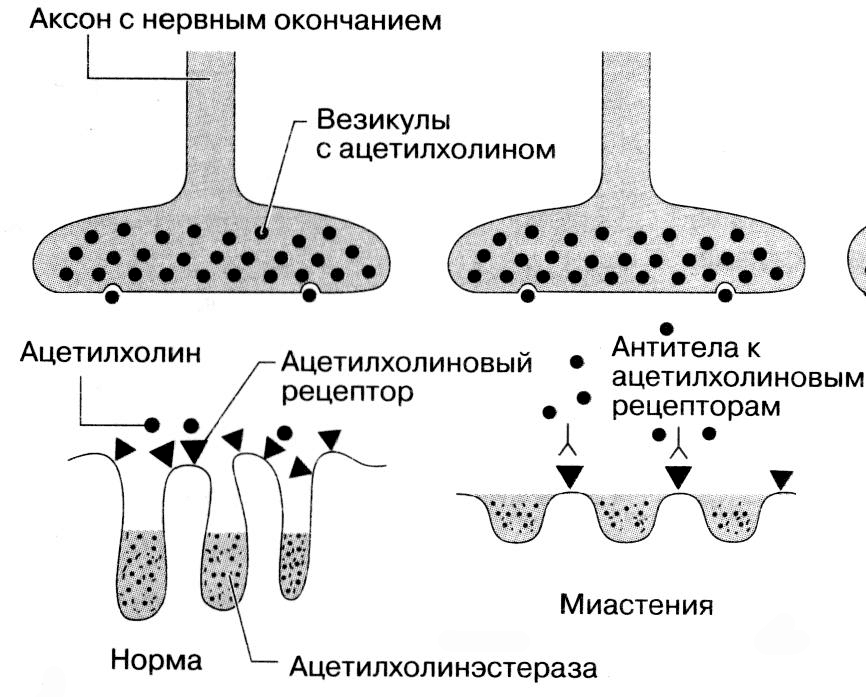
Рис. 1. Нервно-мышечный синапс в норме и при миастении. При миастении продукция антител к ацетилхолиновым рецепторам на постсинаптической мембране приводит к деструкции рецепторов. Процесс высвобождения ацетилхолина в синаптическую щель происходит нормально, но из-за уменьшенного числа рецепторов потенциал концевой пластины не достигает порогового значения, необходимого для возникновения потенциала действия.
Врожденная миастения обусловлена генетически-детерминированными дефектами в иммунной системе, а также дефектом генов различных белков, отвечающих за построение и работу нервно-мышечных синапсов. Неонатальная или транзиторная миастения - преходящее состояние, наблюдающееся у младенцев, родившихся от матерей, страдающих миастенией, и обусловленное переходом через плаценту материнских антител к ацетилхолиновым рецепторам в кровь ребенка при рождении.
Классификация
Предложены различные классификации миастении. Зачастую они сложны для использования в клинике. Поэтому для практических врачей представляют удобство классификации Б. М. Гехта, А. Г. Панова и соавторов, которые используются в нашей стране.
Клиническая классификация миастении (Гехт Б. М., 1965)
По степени генерализации:
1. Генерализованная
2. Локальная
По степени тяжести двигательных расстройств:
1. Легкая
2. Средняя
3. Тяжелая
По характеру течения:
1. Миастенические эпизоды
2. Стационарное течение
3. Прогрессирующее течение
4. Злокачественная форма
По степени компенсации при приеме АХЭП:
1. Полная
2. Достаточная для самообслуживания
3. Недостаточная для самообслуживания
Классификация миастении (Панов А. Г., Догель Л. В., Лобзин В. С., 1965)
Генерализованная форма миастении:
1. Без нарушения дыхания и сердечной деятельности
2. С нарушением дыхания и сердечной деятельности Локальные формы миастении:
1. Глоточно-лицевая форма:
- Без нарушения дыхания и сердечной деятельности
- С нарушением дыхания и сердечной деятельности
2. Глазная форма
3. Скелетно-мышечная форма
- Без нарушения дыхания и сердечной деятельности
- С нарушением дыхания и сердечной деятельности
Примеры формулировки диагноза:
Миастения. Генерализованная форма, прогрессирующее течение, средняя степень тяжести, достаточная компенсация на фоне АХЭП.
Миастения, локальная (глазная) форма, стационарное течение, легкая степень тяжести, хорошая компенсация на АХЭП.
Миастения, генерализованная форма с выраженными дыхательными нарушениями, прогрессирующее тяжелое течение с недостаточной компенсацией на АХЭП.
Клиническая картина
Для миастении типично хроническое течение с периодическими обострениями и ремиссиями и возможным развитием тяжёлых состояний, называемых кризами. Ведущий клинический симптом - слабость и патологическая мышечная утомляемость, усиливающаяся на фоне физических нагрузок и уменьшающаяся после отдыха или приёма антихолинэстеразных препаратов.
Клиническая картина миастении разнообразна и может включать в себя глазодвигательные, бульбарные нарушения, слабость жевательных, экстраокулярных, мимических, дыхательных мышц, слабость мышц шеи, туловища и конечностей. Распространенность патологического процесса на различные группы мышц может быть весьма вариабельной: от одностороннего птоза до вовлечения практически всех произвольных мышц.
Заболевание чаще начинается с глазных симптомов (птоз, диплопия). Особенностью является динамичность симптомов: утром птоз может быть меньше, чем вечером, двоение меняется по выраженности. Затем чаще присоединяется слабость проксимальных отделов мышц конечностей (трудно подняться по лестнице, подняться со стула, поднимать руки вверх). При этом на фоне физической нагрузки слабость отчётливо нарастает во всех группах мышц (после пробы с 10 приседаниями слабость увеличивается не только в мышцах ног, но и рук, усиливается птоз). Могут присоединяться бульбарные нарушения (на фоне длительного разговора или во время приёма пищи голос приобретает гнусавый оттенок, появляется дизартрия, трудно выговаривать «Р», «Ш», «С». После отдыха эти явления проходят). Далее бульбарные нарушения могут стать более выраженными (появляется нарушение глотания, поперхивания, попадание жидкой пищи в нос).
Птоз у больных миастенией характеризуется асимметрией, может наблюдаться то с одной, то с другой стороны в разные периоды времени и сопровождаться ретракцией противоположного верхнего века, усиливается при фиксации взора и движениях глазными яблоками в стороны.
Глазодвигательные нарушения асимметричны, не укладываются в зону иннервации III, IV, VI пар черепно-мозговых нервов. Характерен так называемый мышечный нистагмоид - отклонение глазных яблок в крайних отведениях при фиксации взора с возвращением на место. Диплопия при миастении усиливается при зрительной и физической нагрузке, на ярком свету, во второй половине дня, более выражена при взгляде вдаль (два одинаковых предмета на улице, раздвоение дороги, ступенек, два телевизора, и т.д.).
Слабость жевательных мышц проявляется в виде утомления при жевании, иногда до отвисания нижней челюсти, больные во время еды поддерживают челюсть и помогают себе при жевании рукой. Мимическая слабость более выражена в верхней половине лица - круговых мышц глаз, усиливается при повторном зажмуривании, возможен лагофтальм. Отмечается также затруднение при надувании щек, улыбка «рычания», реже - «поперечная» улыбка вследствие слабости круговой мышцы рта.
Бульбарный синдром характеризуется нарушениями глотания (поперхивание, попадание жидкой пищи в носовые ходы), гнусавостью, дизартрией, реже - охриплостью голоса и очень редко нарушениями модуляции голоса, напоминающими заикание. Эти нарушения могут достигать крайней степени выраженности - невозможность глотания и разговора, но встречаются также очень легкие формы бульбарного синдрома - дизартрия или гнусавость только при длительном чтении вслух и глотание со вспомогательными движениями - второй глоток, наклон или поворот головы. Бульбарные нарушения также носят динамичный характер - усиливаются при речевой, общей физической нагрузке, во время еды (особенно при приеме горячей пищи, питья).
Слабость мышц конечностей может быть «изолированной» (т.е. без других симптомов миастении) - так называемая туловищно-конечностная форма, а также сочетаться со слабостью произвольной мускулатуры другой локализации. Типичны для миастении слабость проксимальных мышц конечностей, преобладание слабости разгибателей над сгибателями (например, трехглавой над двуглавой мышцей плеча), усиление слабости при нагрузке (невозможность войти в транспорт после быстрой ходьбы или бега, падение при попытке пойти быстрее, подъеме по лестнице, при работе на приусадебном участке и т.п.), существенное уменьшение слабости утром и после отдыха. Наиболее поражаемые мышечные группы: дельтовидная мышца, трехглавая мышца плеча, подвздошно-поясничная мышца, но возможно также появление слабости после нагрузки (или усиление ее) в других мышечных группах: разгибателях кистей и стоп, реже - в двуглавых мышцах плеча, четырехглавых мышцах бедра, мелких мышцах кистей, т.е. может поражаться практически вся произвольная мускулатура конечностей. Слабость мышц туловища и шеи чаще встречается у больных пожилого возраста и выражается в согнутой позе за счет слабости мышц спины, свисающей голове за счет слабости задней группы мышц шеи. Наличие слабости мышц шеи даже в отсутствии бульбарного синдрома должно насторожить врача, так как часто следом за этим симптомом развиваются бульбарные и дыхательные нарушения.
Дыхательные расстройства при миастении связаны с несколькими причинами: ослаблением межреберной мускулатуры, диафрагмы, реже с западением надгортанника вследствие ослабления мышц гортани. Респираторные нарушения у больных миастенией характеризуются затруднением вдоха, ослаблением кашлевого толчка, скоплением густой, вязкой слюны, которую невозможно сплюнуть и, как правило, невозможно проглотить.
Внезапные нарушения витальных функций, называемые кризами, наблюдают у 10-15% пациентов. Кризы при миастении бывают миастенические, холинергические и смешанные. Миастенические кризы возникают при недостаточном лечении АХЭП. Холинергический криз развивается при передозировке АХЭП. Смешанный криз в клинической практике наблюдают чаще всего. В клиническом течении смешанных кризов выделяют 2 фазы - миастеническая и холинергическая, которые характеризуются клиническими проявлениями соответствующих кризов.
Необходимо отметить, что далеко не все кратковременные эпизоды изменения состояния следует рассматривать как криз, в связи с чем уместно дополнить выше приведенное определение следующим уточнением: под миастеническим кризом подразумевается состояние больного с миастенией, требующее интубации пациента вследствие дыхательных нарушений. При миастеническом кризе жизненная емкость легких падает до 1 л и меньше. В этом случае пациенты нуждаются в срочной госпитализации в блок интенсивной терапии для наблюдения, проведения ургентной терапии, включая искусственную вентиляцию легких (ИВЛ).
Таблица 1
| Миастенический криз | Холинергический криз |
Быстрое развитие (часы, минуты) |
Медленное развитие (сутки и более) |
Мидриаз |
Миоз |
Сухость кожи |
Гипергидроз |
Повышение АД, тахикардия |
Снижение АД, брадикардия |
Задержка при мочеиспускании |
Учащенное мочеиспускание |
Парез кишечника |
Усиление перистальтики, диарея |
Отсутствие фасцикуляций |
Наличие фасцикуляций |
Дыхательные нарушения |
Дыхательные нарушения |
6. ДИАГНОСТИКА
В пользу миастении свидетельствуют:
- выраженные колебания симптоматики в течение суток и изо дня в день;
- нарастание симптоматики на фоне физической нагрузки (например, усиление дисфагии во время еды, а дисфонии - во время беседы - феномен патологической утомляемости) и генерализация мышечной слабости (например, повторные сжимания и разжимания кистей вызывают слабость не только мышц предплечий, но и нарастание птоза = феномен Уолкер); уменьшение выраженности слабости после отдыха.
- избирательность вовлечения мышц (сгибатели шеи часто оказываются более слабыми, чем разгибатели, а на руках слабость более выражена в разгибателях предплечья), что позволяет отличить миастению от астении или истерии;
- сохранность сухожильных рефлексов, отсутствие нарушений чувствительности, тазовых расстройств и амиотрофий.
- быстро открывать и закрывать рот (у здорового до 100 движений за 30 сек.);
- лежа на спине приподнять голову и в течение 1 минуты смотреть на свой живот;
- постоять с вытянутыми руками 3 минуты;
- сделать 15-20 глубоких приседаний;
- патогномоничен феномен М. Уолкер: повторные сжимания и разжимания кистей вызывают слабость не только мышц предплечий, но и нарастание птоза.
Для объективизации феномена патологической мышечной утомляемости используются специальные пробы.
Необходимо попросить больного:
Диагностические критерии миастении
- 1.Фармакологический тест - проба с введением антихолинэстеразных препаратов. Используют неостигмина метилсульфат (при массе тела пациента 50-60 кг - 1,5 мл; 60-80 кг - 2 мл; 80-100 кг - 2,5 мл 0,05 % раствора) или пиридостигмина бромид (при массе тела пациента 50-60 кг - 10 мг; 60-80 кг - 20 мг; 80-100 кг - 30 мг). У детей доза указанных препаратов составляет 1,0 мл или 5 мг соответственно. Оценку результатов теста проводят в интервале от 40 мин до 1,5 ч после введения препарата. При полной и неполной компенсации двигательных нарушений (увеличение мышечной силы) пробу считают позитивной, при частичной - сомнительной, при отсутствии реакции - негативной.
- 2.Инструментальные исследования
Один из основных критериев диагностики миастении — нарушение нервномышечной передачи, выявляемое посредством электромиографии. Электромиографическое исследование нервно-мышечной передачи (декремент-тест) проводится всем пациентам с подозрением на миастению: проводится оценка амплитуды негативной фазы М-ответа (суммарного потенциала действия, возникающего в мышце при электрическом раздражении её двигательного нерва), величины декремента - уменьшения амплитуды пятого М-ответа по отношению к первому (в процентах) при низкочастотной (3 имп/с) непрямой супрамаксимальной стимуляции m. deltoideus и величины постактивационного облегчения - увеличения амплитуды первого М-ответа после максимального произвольного усилия в течение 30 с по отношению к первому М-ответу контрольной серии при стимуляции мышцы частотой 3 имп/с (в процентах). Исследование показывает снижение (декремент) амплитуды М-ответа более чем на 10%.
Проводится исследование величины декремента (или инкремента) амплитуды М-ответа при стимуляции мышцы частотой 50 имп/с в процентах по отношению 150-го М-ответа к 1-му («тетаническая стимуляция»), исследование изменения амплитуды М-ответа степени декремента при стимуляции частотой 3 имп/с сразу после окончания «тетанической серии» или после максимального произвольного усилия (в течение 10 с) по отношению к исходным данным (посттетаническое или постактивационное облегчение — ПТО, ПАО). Возможно проведение пробы с введением АХЭП с последующим исследованием ЭМГ.
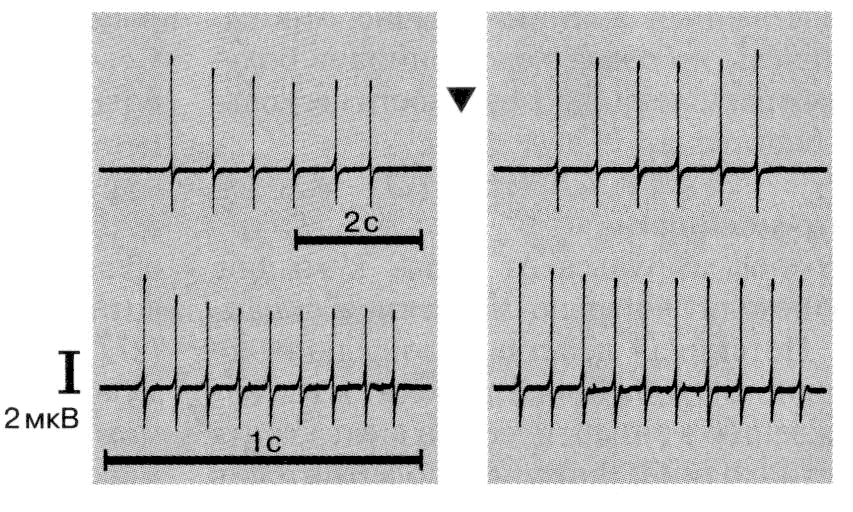
Рис. 3. Изменение ЭМГ у больного с миастенией. Суммарный потенциал двигательных единиц, зарегистрированных с мышцы, отводящей мизинец, при повторной стимуляции локтевого нерва. Обращает на себя внимание резкое снижение (декремент) амплитуды потенциалов (слева). Справа - нормализация амплитуды потенциалов после введения АХЭП
3. Лабораторная диагностика - иммунологические исследования (исследование сыворотки крови на уровень аутоантител). У всех больных миастенией необходимо проведение исследования сыворотки крови на уровень аутоантител к мышечному ацетилхолиновому рецептору (Acetylcholine Receptor Antibody, ACHR antibody), который считается одним из основных критериев диагностики заболевания. Важное значение имеет динамика этого показателя для оценки эффективности патогенетической терапии. Изучение уровня аутоантител к титин-белку (anti-titin-antibody) наиболее показательно у больных миастенией, сочетающейся с тимомой (повышение этого показателя отмечено в 78% случаев), а также у больных с поздним началом миастении без тимомы (84%). При миастении, сочетающейся с тимомой, важным показателем считают увеличение уровня антител к рианодиновым рецепторам саркоплазматического ретикулума (выявляют в 35% случаев), свидетельствующее о тяжёлом течении заболевания. Аутоантитела к мышечно-специфической тирозинкиназе (МИ8К) обнаруживают у 40-50% больных с серонегативной миастенией.
4. Лучевые методы. Исследование вилочковой железы (КТ, МРТ, пневмомедиатенография, рентгенография). Обнаружение тимомы, гиперплазии или, реже, атрофии вилочковой железы подтверждает заинтересованность патологического процесса в патологии вилочковой железы и усиливает показания к оперативному лечению.
Однако следует помнить, что томография переднего средостения не полностью решает вопрос о состоянии тимуса. Обнаружение зоны повышенной плотности еще не свидетельствуют о тимоме или гиперплазии тимуса. У здоровых людей, не страдающих миастенией или не имеющих тимомы при томографическом исследовании часто выявляется «жировая подушка», напоминающая контуры тимомы. Увеличение вилочковой железы по данным КТ или МРТ не является критерием диагностики миастении.
Степени достоверности диагноза
- Сомнительный: клиническая картина
- Вероятный: клиническая картина
- Достоверный (несомненный):
+ прозериновый тест
клиническая картина
+ прозериновый тест
+ декремент-тест
+ иммунологические исследования
Для объективной оценки тяжести клинических проявлений миастении используют количественную шкалу (QMGS), предложенную R. J. Barohn et al (1998). Она предусматривает оценку выраженности (0, 1, 2, 3) вовлечения в патологический процесс различных мышц (глазодвигательных, бульбарных, мимических, дыхательных, проксимальных и дистальных мышц конечностей, а также мышц шеи). Для выполнения исследования необходимы секундомер, динамометр, спирометр, а также стакан с водой. Исследование проводят после предварительной отмены антихолинэстеразных препаратов.
Таблица 2
Шкала количественной оценки тяжести клинических проявлений миастении QMGS (quantitative myasthenia gravis score) – Barohn R. J., 1998
Показатель |
Тяжесть симптома |
|||
0 (отсутствует) |
1 (умеренная) |
2 (средняя) |
3 (тяжёлая) |
|
Диплопия при боковом взгляде влево или вправо, с |
61 |
11-60 |
1-10 |
Спонтанно |
Птоз (взгляд верх), секунды |
61 |
11-60 |
1-10 |
Спонтанно |
Мышцы лица Нормальное закрытие века |
Нормальное |
Полное, слабое, некоторое сопротивление |
Полное, без сопротивления |
Неполное |
Глотание 1/2 чашки воды |
Нормальное |
Минимальное покашливание или прочистка горла |
Тяжелый кашель, удушье или новая регургитация |
Не может глотать |
Разговор после счета вслух от 1 до 50 (начало дизартрии) |
Отсутствует |
на 30-49 дизартрия |
на 10-29 дизартрия |
на 9 дизартрия |
Вытягивание правой руки (90 градусов сидячее положение), с |
240 |
90-239 |
10-89 |
0-9 |
Вытягивание левой руки (90 градусов сидячее положение), с |
240 |
90-239 |
10-89 |
0-9 |
ЖЁЛ, % от должного |
>80 |
65-79 |
50-64 |
<50 |
Динамометрия справа, кг: -мужчины |
>45 |
15-44 |
5-14 5-9 |
0-4 |
Динамометрия слева, кг: -мужчины -женщины |
>35 |
15-34 |
5-14 5-9 |
0-4 |
Подъем головы (в положении лежа на спине 45 градусов), с |
120 |
30-119 |
1-29 |
0 |
Вытягивание правой ноги (в положении лежа на спине 45 градусов), с |
100 |
31-99 |
1-30 |
0 |
Вытягивание левой ноги (в положении лежа на спине 45 градусов), с |
100 |
31-99 |
1-30 |
0 |
Предложено оценивать тяжесть клинических проявлений миастении по пятибалльной шкале МОТА (Вагойп К. I., 1996).
Шкала оценки тяжести клинических проявлений миастении MGFA (Myasthenia Gravis Foundation of America – Barohn R. J., 1996)
| 1 |
Изолированная слабость только окулярных мышц, во всех других мышцах сила нормальная. |
| 2А |
Преобладание умеренной слабости мышц туловища, либо проксимальных отделов конечностей, либо и того и другого. Также могут быть умеренное вовлечение в процесс бульбарной мускулатуры и слабость окулярных мышц любой степени выраженности. |
| 2В |
Преобладание умеренной слабости бульбарной и дыхательной мускулатуры либо и того и другого. Также могут быть умеренное вовлечение мышц туловища либо проксимальных отделов конечностей и слабость окулярных мышц любой степени выраженности. |
| ЗА |
Преобладание средней степени слабости мышц туловища, либо проксимальных отделов конечностей, либо и того и другого. Также могут быть умеренное вовлечение в процесс бульбарной и дыхательной мускулатуры и слабость окулярных мышц любой степени выраженности. |
| ЗВ |
Преобладание средней степени слабости бульбарной и дыхательной мускулатуры, либо и того и другого. Также возможны умеренное или средней степени тяжести вовлечение мышц туловища либо проксимальных отделов конечностей и слабость окулярных мышц любой степени выраженности. |
| 4А |
Преобладание тяжёлой степени слабости мышц туловища, либо проксимальных отделов конечностей, либо и того и другого. Также могут быть умеренное вовлечение в процесс бульбарной и дыхательной мускулатуры и слабость окулярных мышц любой степени выраженности. |
| 4В |
Преобладание тяжёлой степени слабости бульбарной и дыхательной мускулатуры. Также возможны умеренное, среднее или тяжёлое вовлечение мышц туловища либо проксимальных отделов конечностей и слабость окулярных мышц любой степени выраженности. |
| 5 |
Интубация (с механической вентиляцией или без таковой), кроме случаев обычных послеоперационных вмешательств. |
В клинической практике для оценки степени выраженности двигательных расстройств используют шкалу силы мышц конечностей, предложенную A. Szobor (1976).
Шкала силы мышц конечностей (A. Szobor, 1976)
0 баллов |
Движения в мышце отсутствуют. |
1 балл |
Минимальные движения в мышце, но вес конечности пациент не удерживает. |
2 балла |
Пациент удерживает вес конечности, но сопротивление, оказываемое исследователю, минимально. |
3 балла |
Пациент оказывает сопротивление усилиям изменить положение конечности, но оно незначительно. |
| 4 балла | Пациент хорошо сопротивляется усилиям изменить положение конечности, но имеется некоторое снижение силы. |
5 баллов |
Сила мышцы соответствует возрастной и конституциональной норме обследуемого. |
Дифференциальная диагностика
Дифференциальная диагностика миастении проводится с несколькими группами заболеваний:
1. При нарушении функций наружных мышц глаза - с прогрессирующей надъядерной офтальмоплегией, окулофарингеальной мышечной дистрофией, эндокринной офтальмопатией, спино- и оливоцеребеллярной дегенерациями, рассеянным склерозом, синдромом Фишера, синдромом Толосы-Ханта, митохондриальными цитопатиями, конгенитальными миастеническими синдромами и др. Прогрессирующая надъядерная офтальмоплегия отличается от миастении отсутствием птоза и стойким характером ограничения глазных яблок. Специфическим признаком является феномен «кукольных глаз». Выявляются также признаки недостаточности функций экстрапирамидной системы. Миастенический синдром в виде слабости и утомляемости мышц нередко имеет место при рассеянном склерозе, однако наличие мозжечковых и пирамидных симптомов, выраженность патологических рефлексов, поражение зрительного и других черепных нервов, снижение брюшных рефлексов, тазовые, чувствительные расстройства, своеобразное отношение к жаре и холоду, колеблемость симптомов, данные дополнительных исследований (участки демиелинизации на МРТ, изменение на глазном дне и др.) дают возможность исключить миастению.
2. При нарушении функций бульбарных мышц и лицевой мускулатуры - с ОНМК, стволовыми опухолями и энцефалитами, для которых типичны выраженные общемозговые симптомы, а также отсутствие динамичности нарушений и реакции на введение антихолинэстеразных препаратов. Иногда значительные трудности возникают при дифференциальной диагностике миастении и бокового амиотрофического склероза (БАС), при котором в некоторых случаях возможны не только клинические симптомы миастении, но и нарушения нервно-мышечной передачи и реакции на введение антихолинэстеразных препаратов. В таких случаях правильный диагноз можно поставить только после проведения ЭМГ, выявляющей при БАС признаки денервации и реиннервации, а также наличие большого количества характерных потенциалов фасцикуляций.
3. При преимущественно скелетной слабости - с различными миопатиями и миопатическими синдромами, синдромом Гийена-Барре (СГБ), токсическим поражением нервно-мышечной передачи (например, дифтерийной, медикаментозной), отравлении ботулинотоксином, синдромом Ламберта- Итона. Дыхательные расстройства и кризы при миастении следует дифференцировать с СГБ, для которого характерна арефлексия, нарушение состава ликвора, отсутствие нарушений нервно-мышечной передачи и реакции на введение антихолинэстеразных препаратов. Слабость мышц туловища и конечностей у больных миастенией дифференцируют с различными формами врождённых и приобретённых миопатий. Миопатический процесс, как правило, характеризуется отличным от миастении характером распределения двигательных расстройств: отсутствием (за редким исключением) признаков поражения экстраокулярной и бульбарной мускулатуры, дыхательных нарушений; чаще сопровождается снижением или отсутствием сухожильных рефлексов, различной степенью выраженности мышечных атрофии.
Клинические симптомы, напоминающие миастению, возможны и при других формах нарушения нервно-мышечной передачи, таких, как синдром Ламберта-Итона и ботулизм. Причём если для синдрома Ламберта-Итона не типичны экстраокулярные, бульбарные и дыхательные нарушения, то именно они составляют основное клиническое ядро ботулизма. Характерные для синдрома Ламберта-Итона слабость и утомляемость мышц туловища и конечностей при ботулизме выявляют относительно редко. Для обеих форм характерна гипо- или арефлексия. Эффект от введения антихолинэстеразных препаратов при синдроме Ламберта-Итона минимальный, а при ботулизме отсутствует. Нарушения нервно-мышечной передачи характеризуются снижением исходной амплитуды М-ответа и её существенным увеличением в процессе высокочастотной стимуляции (инкремент) или после максимального произвольного усилия.
В целом следует подчеркнуть, что главное отличие миастении от других форм патологии - динамичность симптомов и положительная реакция на введение антихолинэстеразных препаратов. По утверждению 3. П. Лайсека, «любого больного с варьирующей слабостью мышц, особенно, если она связана с поражением мышц, иннервируемых черепными нервами, и не сопровождается нарушением чувствительности и рефлексов, следует рассматривать как потенциального больного миастенией до тех пор, пока диагноз миастении не будет отвергнут всеми другими исследованиями.
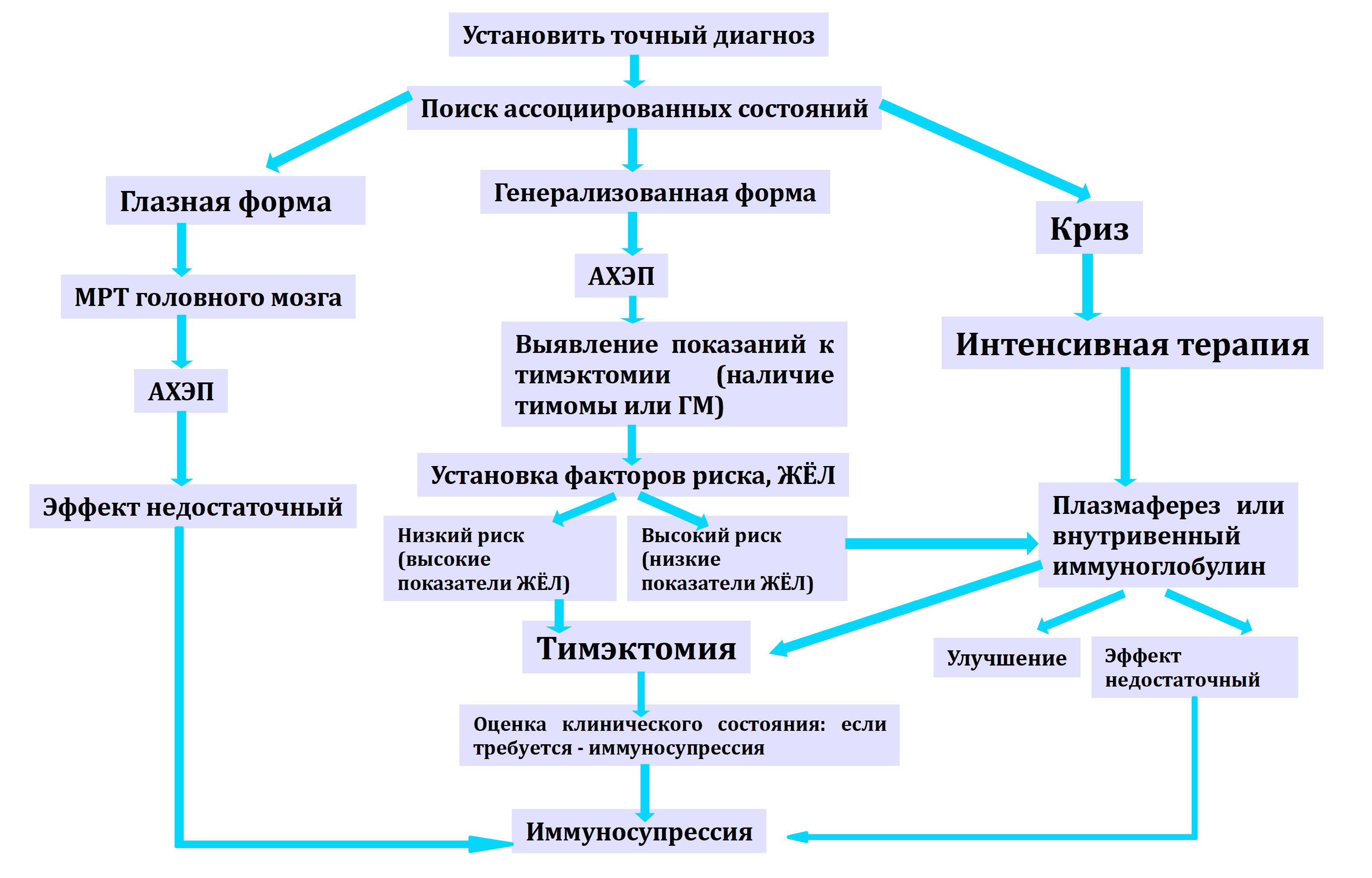
Алгоритм ведения пациентов с миастенией (A. Fauci et al., NY, 2005)
Лечение
Лечение миастении можно разделить на симптоматическое и патогенетическое. Первое направлено на улучшение нервно-мышечной передачи в синапсе, второе - на ликвидацию аутоиммунного процесса, лежащего в основе миастенических нарушений (как консервативным, так и оперативным способами). Существует также немедикаментозная терапия. Немедикаментозное лечение включает методы экстракорпоральной иммунокоррекции (гемосорбция и плазмаферез). К немедикаментозным методам лечения можно отнести и гамма-терапию на область тимуса. Данный метод применяют у пациентов, которым в силу тех или иных обстоятельств невозможно провести тимэктомию, а также как метод комплексной терапии после удалении тимомы (особенно в случаях инфильтрации опухоли в расположенные рядом органы). Суммарную дозу гамма-облучения подбирают индивидуально (в среднем 40-60 Грей).
I. Симптоматическая терапия
Улучшить передачу в нервно-мышечном синапсе можно за счет увеличения количества ацетилхолина и удлинения срока его пребывания в синаптической щели. Достигается это назначением антихолинэстеразных препаратов (АХЭП), которые относятся к базисной терапии миастении. Они разрушают холинэстеразу, препятствуя распаду ацетилхолина. Стандартных схем лечения АХЭП не существует. Важно подобрать оптимальный препарат и выработать режим его применения (дозировку и частоту приема). Оптимальной является минимальная доза АХЭП, оказывающая максимальный эффект без выраженных побочных реакций. Для определения суточной дозы используют прозериновую и калиминовую пробы. Начинают лечение с самой малой дозы и частоты (в зависимости от длительности действия АХЭП), постепенно увеличивая дозу до оптимальной. 1 таблетка и 1 ампула АХЭП = 1 стандартная доза. Максимальное суточное количество АХЭП - 24 стандартных дозы, однократно - 2 стандартных дозы.
Неостигмина бромид (Прозерин, простигмин) - АХЭП с длительностью действия до 2-3 часов. В связи с коротким и сильным действием используется для диагностики миастении, купирования острых ситуаций (инъекционная форма), реже - в качестве постоянной терапии (инъекционная и таблетированная формы). Лечебная дозировка соответствует диагностической. Хорошо действует на краниальные и скелетные мышцы.
Пиридостигмина бромид (Калимин, местинон) - АХЭП, наиболее широко используемый как в нашей стране, так и за рубежом. Длительность действия от 4 до 8 часов (в среднем 5-6 часов). Начинает действовать через 60 минут после приема внутрь, поэтому последующая доза принимается за 30 минут до окончания действия предыдущей. Основной препарат для базисного лечения миастении. Начальная доза 15-30 мг 3-4 раза в день, максимальная может достигать 120 мг каждые 3 часа. Дальнейшее наращивание дозы клинического эффекта не дает, но значительно увеличивает количество побочных эффектов. Более активно действует на краниальные мышцы.
Амбенония хлорид (Оксазил, мителаза) - АХЭП с длительностью действия 5-10 часов и началом действия через 0,5-1,5 часа после приема внутрь. Его особенность - преимущественное действие на мышцы туловища. Первоначально дается минимальная доза, которую затем постепенно увеличивают на 1 мг до оптимальной. В настоящее время при миастении используется редко.
Нейромидин (ипидакрин) - обратимый ингибитор холинэстеразы и блокатор калиевых каналов. Дозировка делится на 2-3 приема. Лечение курсовое (1-1,5 месяца) на фоне приема классических АХЭП.
Антихолинэстеразные препараты
| Препарат | Форма выпуска | Способ применения | ||||
| табл. | амп. | внутрь | п/к | в/м | в/в | |
| Прозерин (неостигмина метилсульфат) | 15 mg | 0,05%-1,0 | + | + | + | + |
| Аксамон (ипидакрин) | 20 mg | - | + | - | - | - |
| Нейромидин (ипидакрин) | 20 mg | 0,5%-1,0 1,5%-1,0 | + | + | + | + |
| Калимин (пиридостигмина бромид) | 60 mg | 0,5%-1,0 | + | + | + | + |
| Оксазил (амбеноний хлорид) | 5mg | - | + | - | - | - |
Препараты калия улучшают синтез и экскрецию ацетилхолина. Оптимальным является хлорид калия в порошке по 1,0 г 3 раза в день; порошок растворяют в стакане воды или сока и принимают во время еды. Противопоказания для использования больших доз калия - полная поперечная блокада проводящей системы сердца, нарушение выделительной функции почек.
Калийсберегающие диуретики вызывают задержку калия в организме за счет подавления активности альдостерона. Применяют спиронолактон перорально в дозе 0,025-0,05 г 3-4 раза в день.
II. Патогенетические методы лечения:
- 1.Иммуносупрессивная терапия:
- 2.Плазмаферез
- 3.Человеческий иммуноглобулин для внутривенного введения
- 4.Хирургическое лечение - операция тимэктомия.
- глюкокортикостероидная;
- цитостатическая.
Иммуносупрессивная терапия
Наибольшее распространение в качестве иммунорегуляторов получили кортикостероиды. Эффективность глюкокортикоидов при лечении миастении достигает, по отдельным данным, 80%. Из-за относительно быстрого наступающего эффекта их считают препаратами выбора у больных с витальными нарушениями, а также при дебюте заболевания с бульбарных нарушений и при глазной форме миастении. В настоящее время наиболее оптимальным считают приём глюкокортикоидов по схеме через день. Дозу преднизолона (метилпреднизолона) подбирают индивидуально, ориентируясь на тяжесть состояния больного. В среднем она составляет 1 мг/кг х сут.), но не менее 50 мг. Препарат принимают один раз в день утром. Лечение желательно начинать в условиях стационара. Эффект оценивают через 6-8 приёмов. В первые несколько дней некоторые пациенты могут отмечать эпизоды ухудшения состояния в виде нарастания мышечной слабости и утомляемости. Возможно, эти эпизоды связаны с прямым действием глюкокортикоидов на процессы освобождения синаптического медиатора и десенситизацией рецепторов. Это обстоятельство обусловливает необходимость временного уменьшения дозы антихолинэстеразных препаратов. По мере достижения эффекта и улучшения состояния больных дозу преднизолона постепенно уменьшают до поддерживающей. При длительном приёме глюкокортикоидов у ряда пациентов могут развиться побочные эффекты различной степени выраженности. Наиболее часто отмечают повышение массы тела, гирсутизм, катаракту, нарушение толерантности к глюкозе, артериальную гипертензию, остеопению. При развитии побочных эффектов, помимо симптоматической терапии, целесообразно уменьшить дозу препарата.
Цитостатики применяются при недостаточной эффективности глюкокортикоидов, при развитии выраженных побочных эффектов от применения ГКС, а также при наличии противопоказаний к их назначению (стойкая артериальная гипертензия, язвенная болезнь желудка и 12-перстной кишки, тяжелая форма сахарного диабета и др). Препаратом первого выбора считается азатиоприн, второго выбора - циклоспорин А (ЦСА), циклофосфамид, микофенолата мофетил и другие. По соотношению показателей эффективности и безопасности предпочтение отдают азатиоприну. При его длительном приеме примерно у 76% пациентов удается достичь ремиссии и отказаться от использования АХЭП. Недостатком лечения азатиоприном является медленное наступление эффекта. Препараты второго выбора применяют при тяжелом прогрессирующем течении миастении и недостаточном эффекте преднизолона и азатиоприна.
Азатиоприн (имуран). Начальная доза составляет 2,5-3 мг/кг в сутки, в дальнейшем - 1,5-2,5 мг/кг в сутки. Эффект наступает довольно поздно в сроки от 6 до 24 месяцев приема, имеется большое количество серьезных побочных эффектов: угнетение красного и белого кроветворения, поражение печени, повышение тератогенного риска. Возможно (у 20-30 % больных) развитие таких симптомов, как тошнота, рвота, диарея. Часто назначается в качестве дополнительного средства при ГКС-терапии.
Циклоспорин А. Начальная доза 5 мг/кг в сутки, делится на два приема, в дальнейшем эта доза уменьшается. В отличие от азатиоприна эффект наступает быстрее (от 1 до 3-х месяцев). Обладает высокой нефротоксичностью и тератогенностью. Нельзя сочетать с приемом нестероидных противовоспалительных средств. Оптимальный препарат при невозможности приема преднизолона.
Циклофосфамид используют при отсутствии эффекта от других иммунодепрессантов как в виде монотерапии, так и в сочетании с азатиоприном. Препарат вводят внутримышечно ежедневно в дозе 200 мг или через день в дозе 400 мг. Терапию начинают в условиях стационара, и только убедившись в хорошей переносимости препарата, можно переводить больных на амбулаторное лечение.
Микофенолата мофетил хорошо переносится и эффективен у 60-70% больных. По сравнению с азатиоприном он действует быстрее (клинический эффект появляется через 3-4 нед) и обладает меньшим количеством побочных эффектов. В качестве монотерапии препарат недостаточно эффективен, поэтому его назначают в дополнение к глюкокортикоидам в случаях, когда необходимо снижение их дозы. Микофенолата мофетил назначают перорально ежедневно по 2 г/сут с последующей коррекцией дозы в зависимости от эффективности лечения.
Анализ эффективности консервативного лечения проводится согласно международной классификации клинического эффекта, представленной в таблице 6.
Таблица 6 Международная классификация клинического эффекта
| Полная безмедикаментозная ремиссия (эффект А) |
отсутствие симптомов заболевания > 1 года без специфической терапии. |
| Медикаментозная ремиссия (эффект В) |
отсутствие симптомов заболевания либо минимальные проявления на фоне постоянного приема АХЭП или иммуносупрессивных препаратов. |
| Хорошая компенсация состояния (эффект С) |
существенный регресс симптомов и отсутствие прогрессирования болезни на фоне постоянной антихолинэстеразной и/или иммуносупрессивной терапии. |
| Отсутствие эффекта терапии (эффект О) |
прогрессирование заболевания, обострения с частотой > 1 раза в год, наличие стойких миастенических проявлений, ухудшающих работоспособность и самообслуживание пациентов |
Плазмаферез и внутривенное введение иммуноглобулина применяют для купирования обострения миастении, а также при миастеническом кризе. Плазмаферез также используют перед тимэктомией. Метод плазмафереза основан на заборе крови из локтевой или одной из центральных вен с последующим её центрифугированием, отделением форменных элементов и заменой плазмы либо на донорскую, либо на искусственную. Эта процедура приводит к быстрому (иногда в течение нескольких часов) улучшению состояния больных. Возможно повторное извлечение плазмы в течение нескольких дней или через день. Проводят замещение 2-3 л плазмы 3 раза в неделю до стойкого уменьшения слабости. Положительный эффект сохраняется 6-8 нед. Плазмаферез может приводить к водно-электролитным нарушениям, расстройствам гемостаза, гипотензии, гипоальбуминемии. Иммуноглобулин вводят внутривенно в течение 2-5 дней в суммарной дозе 2 г/кг. В среднем доза иммуноглобулина должна составлять 400 мг/кг/сутки в течение 5 дней. Улучшение, как правило, возникает через 3-10 дней и сохраняется в течение 1-4 мес. Метод эффективен у 78 % больных. Введение иммуноглобулина связано с риском инфицирования гепатитом В; изредка возможно развитие лихорадочного состояния, асептического менингита, транзиторной лейкопении, почечной недостаточности. При дефиците 1дА могут возникать анафилактические реакции.
Для коррекции возможных побочных эффектов глюкокортикоидной и иммуносупрессивной терапии можно применять иммуномодуляторы, полученные из вилочковой железы (тимуса экстракт, тималин и др.). Следует помнить, что эти препараты в редких случаях могут вызывать обострение миастении. Тималин регулирует количество Т- и В-клеток, активирует клеточный иммунитет, назначается по 5-10 мл/сут в/м, курс лечения 30-100 мл. Хирургическое лечение - операция тимэктомия или тимтимомэктомия.
Показания: опухоль вилочковой железы (тимома), вовлечение в процесс краниобульбарной мускулатуры, прогрессирующее или злокачественное течение миастении. У детей тимэктомия показана при генерализованной форме миастении, плохой компенсации нарушенных функций в результате медикаментозного лечения и при прогрессировании болезни.
Противопоказания: острая фаза миастении (выраженные
некомпенсированные бульбарные нарушения, а также нахождение больного в кризе), тяжёлые соматические заболевания, генерализация опухолевого процесса с наличием множественных отдаленных метастазов, когда речь идет о тимоме. Эффективность тимэктомии в настоящее время составляет 50-80%. Для оценки результатов операции используется схема С. Кеупез (1949) в модификации.
Таблица 7 Схема G. Keynes (1949) в модификации
| А (отличный эффект) |
Полное восстановление двигательных функций, работоспособность без медикаментозной поддержки |
| В (хороший эффект) |
Значительное улучшение состояния, практически полное восстановление двигательной функции и работоспособности при уменьшении суточной дозы калимина по сравнению с дооперационной в 2 раза и более и отсутствии необходимости в иммуносупрессивной терапии. |
| С (удовлетворительный эффект) |
Незначительное улучшение двигательной функции при постоянном приеме АХЭП и иногда преднизолона, отсутствие прогрессирования заболевания. |
| В (отсутствие эффекта) |
Отсутствие компенсации двигательных нарушений, сохранение прежних доз АХЭП или ухудшение после операции. |
| Е (летальность) |
Летальный исход вследствие миастении или других причин. |
В настоящее время вопрос эффективности тимэктомии, равно как использования того или иного хирургического доступа для выполнения операции, остается дискутабельным. Как правило, эффект тимэктомии оценивают в интервале от 8 до 12 мес. после операции. Однако клинический анализ показывает, что улучшение состояния больных наблюдается и в раннем послеоперационном периоде, причем у значительной части больных этот эффект может быстро исчезать. По мнению ряда исследователей, эффективность операции составляет около 80 %.
Этапы лечения миастенического и холинергического кризов
Этап 1: если есть реакция на АХЭП:
1) подбор адекватных доз АХЭП:калимин форте по 1-1,5 мл в/в или в/м - каждые 4-5 ч. или прозерин по 1,5-2 мл п/к каждые 3-4 ч; 2) немедленно начать патогенетическую терапию: пульс-терапия преднизолоном в/в капельно по 1000-2000 мг через день + 300-500 мг в/в во 2-й день;
3) далее - преднизолон перорально ежедневно по 1,5-2 мг/кг массы тела по схеме большая/малая доза;
4) препараты калия - в/в по 3 г /сут;
5) плазмаферез или иммуноглобулины человека О;
N3! Пульс-терапия относительно противопоказана при холинергическом и смешанном кризах из-за десентитизации АХЭП.
Этап 2: если нет реакции на АХЭП:
1) интубация и ИВЛ и немедленная отмена всех АХЭП;
2) на следующие сутки: прозерин и попытка отключения ИВЛ;
3) при восстановлении дыхания, не экстубируя больного, п/к прозерин каждые 3-4 ч., при устойчивом состоянии - экстубировать пациента;
4) если остаются дыхательная недостаточность и нарушение глотания - вновь подключить ИВЛ и больше АХЭП не вводить;
5) на следующий день - п/к прозерин и снова попытаться отключить ИВЛ;
6) если дыхание не нормализуется через 3 сут. - трахеостома. Продолжать или начать патогенетическую терапию;
7) плазмаферез или иммуноглобулины О;
8) Психотерапия и разъяснительная работа для профилактики передозировки АХЭП, а также для отключения ИВЛ обязательны!
Введение АХЭП при миастеническом кризе на фоне ИВЛ считается грубой ошибкой!
Рекомендации пациенту
При миастении противопоказаны чрезмерные физические нагрузки, инсоляции, препараты, указанные в таблице. Некоторый положительный эффект дает диета, богатая калием - печеный картофель, курага, бананы и др.
Таблица 8. Применение лекарственных средств при миастении
| Группа лекарственных средств |
Средства, которые могут увеличить слабость |
Безопасные средства |
| Антибактериальные средства |
Стрептомицин, гентамицин и другие аминогликозиды, полимиксин В, колистин, тетрациклин, линкомицин, клиндамицин, пенициллин (в больших дозах), ампициллин, ципрофлоксацин, сульфаниламиды |
Рокситромицин, цефалоспорины, левомицетин, эритромицин рифампицин, нитрофураны, налидиксовая кислота, изониазид фурадонин |
| Антиэпилептические средства |
Триметин, дифенин, барбитураты, бензодиазепины (в высокой дозе) |
Препараты вальпроевой кислоты, гексамидин, карбамазепин |
| Психотропные средства |
Нейролептики (аминазин, препараты лития, бензодиазепины (в высокой дозе), амитриптилин |
Тиоридазин (сонапакс), бензодиазепины (малые дозы) |
| Гормональные средства |
Кортикостероиды*, препараты АКТГ, оральные контрацептивы, окситоцин, гормоны щитовидной железы |
|
| Кардиологические средства |
(Р-блокаторы, хинидин, лидокаин, новокаинамид, антагонисты ионов кальция, ганглиоблокаторы, гуанетидин |
Дигоксин, резерпин, метилдофа, спиронолактон, триамтерен |
| Анальгетики и противовоспалительные средства |
Производные морфина, хинин, хлоракин, Э-пеницилламин |
Ацетилсасалициловая кислота, НПВС, пентазоцин, соли золота, бутадион |
| Другие средства |
Миорелаксанты, соли магния (аспаркам), йодсодержащие контрастирующие средства |
|
| Магний-содержащие слабительные средства |
Сульфат натрия |
|
| Хинидин |
Новокаинамид |
* Применение возможно при строгом контроле; нарастание слабости обычно возникает в начале лечения.
Правильная диагностика и своевременное назначение адекватных методов лечения приводят к компенсации двигательных расстройств более чем у 80% больных миастенией.
Особенности клиники, диагностики и терапии миастении у детей
Согласно современным данным миастения с дебютом клинических проявлений в детском возрасте составляет 10-24 % всех больных с данной патологией. Имеется общая тенденция к увеличению заболеваемости, в том числе у детей и подростков. В целом, ежегодно регистрируется 10 случаев миастении на 1 млн населения. По данным исследователей миастения встречается чаще, но не во всех случаях диагностируется. Однако, существует мнение, что на каждого выявленного больного приходится 2 недиагностированных случая, что обусловлено разнообразием клинических проявлений, особенностями течения болезни, несвоевременным обращением к специалисту. Ошибки первоначальной диагностики у детей составляют 91%. Это связано с недостаточной настороженностью врачей в отношении данной патологии, неумением детей охарактеризовать свои жалобы, а родителей - расценить их как проявление болезни.
Установлено, что миастения у детей отличается от миастении у взрослых степенью выраженности симптомов, особенностями клинических проявлений. Как известно, миастения относится к аутоиммунным заболеваниям, проявляется слабостью и патологической утомляемостью различных мышечных групп вследствие поражения нервно-мышечного синапса антителами к ацетилхолиновым рецепторам (АХР). Вместе с тем, существует группа врожденных миастенических синдромов, клинические проявления которых в значительной степени близки к выявляемым у больных аутоиммунной миастенией, но имеющим другой патогенетический механизм. В настоящее время известно, что в основе патогенеза врожденных миастенических синдромов лежит мутация генов, определяющих изменение структуры и функции АХР: нарушение числа рецепторов или аномалия их функционирования.
При одних синдромах страдают пресинаптические механизмы нервно-мышечной передачи, при других - постсинаптические, при третьих - одновременно и пресинаптические, и постсинаптические. При пресинаптическом поражении нарушается синтез, депонирование или высвобождение ацетилхолина, при комбинированном процессе наблюдается недостаточность ацетилхолинэстеразы; постсинаптические расстройства характеризуются аномалией АХР, их врожденным отсутствием. Большинство известных к настоящему времени синдромов наследуются по аутосомно¬рецессивному типу, исключая миастенический синдром, связанный с медленным закрытием ионных каналов и являющийся аутосомно¬доминантным. В сыворотке крови больных детей антитела к АХР не обнаруживаются, поскольку антитела связываются с АХР.
В соответствии с клинической классификацией выделяют:
- миастению новорождённых (неонатальную),
- врожденную миастению:
а) доброкачественную с офтальмопарезом или офтальмоплегией,
б) семейную детскую,
- юношескую миастению.
Неонатальная миастения (транзиторный или преходящий
миастенический синдром)
Отмечается у детей, родившихся от матерей, страдающих миастенией в 10-15% случаев. Развивается в результате перехода антител против АХР от больной миастенией матери к ее здоровому плоду. Выраженность симптомов у новорождённого зависит от концентрации антител в его крови. Клинические проявления носят преходящий характер, так как вещество, блокирующее синапсы в последующем в организме ребёнка не образуется. Симптомы возникают через несколько часов после рождения (или в период до третьего дня жизни) и характеризуются выраженной мышечной гипотонией, вялостью движений, маскообразным лицом, слабостью крика, сосания, поперхиванием, снижением безусловных рефлексов. Редко наблюдаются расстройства дыхания, птоз, офтальмопарез. Степень выраженности клинических проявлений может быть разной. Слабость значительно увеличивается в первые дни, затем отмечается регресс симптомов. Длительность их проявлений в среднем составляет 18 дней (от 5 до 60 дней), затем состояние полностью нормализуется. Прогноз благоприятный. Однако дети, рожденные от матерей, страдающих миастенией, нуждаются в тщательном наблюдении в течение первых дней жизни даже в тех случаях, когда на первый взгляд кажутся здоровыми и не вызывают опасений. Диагноз подтверждает высокий уровень антител к АХР у новорождённого. Пациенткам с миастенией противопоказано грудное вскармливание - можно только искусственное! Новорождённым с тяжелой генерализованной слабостью и дыхательными нарушениями показано обменное переливание крови. В случаях выраженных симптомов в/м перед кормлением (каждые 4 часа) вводится неостигмина метилсульфат 0,1-0,2 мл (в зависимости от веса ребенка), что улучшает сосание, глотание и нормализует процесс питания. Препарат может вводиться через назогастральный зонд в дозе, десятикратно превышающей ту, которая выбирается при парентеральном применении препарата. По мере регресса клинических проявлений доза препарата уменьшается. Одновременно с прозерином - утром 30 мг преднизолона в инъекциях (до полной компенсации симптомов миастении, обычно от 1 до 4 недель).
Врожденная миастения, редкое, как правило аутосомно-рецессивное заболевание, которое обусловлено несколькими генетическими дефектами, включающими патологию ресинтеза (восстановление) или накопления ацетилхолина, уменьшение конечной активации ацетилхолинэстеразы и нарушение функции АХР. Выделяют три категории патологии: с пресинаптическими, синаптическими или постсинаптическими нарушениями. Патология у лиц мужского пола встречается в 2 раза чаще. При врожденной доброкачественной миастении с офтальмопарезом или офтальмоплегией сразу после рождения или несколько позже отмечают симметричный птоз и офтальмоплегию. Это единственная форма миастении, при которой офтальмоплегия выступает в качестве первого клинического симптома. Если офтальмоплегия после рождения является парциальной, то в раннем или детском возрасте она становится полной. Обычно проявляется в первые 2 года жизни. Может наблюдаться лёгкая слабость мышц лица, но она не ведет к тяжёлым нарушениям при кормлении.
Генерализованная мышечная слабость развивается редко. Стёртые формы распознаются с опозданием, иногда впервые диагностируются в 20-30 лет. Заболевание, как правило, носит доброкачественный характер, не представляет угрозы для жизни. Титр антител к АХР не повышен. Иммуносупрессивная терапия не эффективна. Некоторый положительный эффект возможен при назначении ингибиторов ацетилхолинэстеразы.
Семейная инфантильная (детская) миастения
В основе патогенеза семейной инфантильной миастении может быть как пресинаптический дефект, связанный с нарушением ресинтеза ацетилхолина, так и постсинаптические дефекты медиатора в области АХР или врожденный дефект ацетилхолинэстеразы. Первые патологические симптомы выявляются у новорождённых в виде тяжелых бульбарных и дыхательных нарушений. Многие дети нуждаются в искусственной вентиляции легких. Не исключен летальный исход. Часто наблюдается птоз, но другие нарушения мышц глаза, как правило, не вовлекаются. Движения глазных яблок не ограничены. Обращает на себя внимание общая мышечная слабость, слабость мимической мускулатуры, которая появляется с рождения или в течение первого года жизни. Через несколько недель состояние улучшается, однако эпизоды слабости и дыхательных нарушений повторяются в течение детского, а иногда и зрелого возраста. Положительный эффект даёт назначение ингибиторов ацетилхолинэстеразы. С годами потребность в терапии обычно уменьшается. Тимэктомия и иммуносупрессивная терапия не дают улучшения.
Проксимальная мышечная слабость может наблюдаться при генетически детерминированных миастенических синдромах, а также в случаях иммунозависимой миастении. Так в 1995 году был описан синдром, связанный с медленным закрытием ионных каналов (Gomez and Gammack). В 1992 - поясно-конечностная миастения (Oh and Kuruoglu).
Синдром, связанный с медленным закрытием ионных каналов - наследственное заболевание, обусловленное патологией ионных каналов ацетилхолиновых рецепторов скелетных мышц. Наследуется по аутосомно-доминантному типу. Заболевание обычно проявляется в грудном возрасте, но может быть и у взрослых. Отмечается слабость, утомляемость мышц шеи, лопаток, офтальмопарез, мышечные атрофии. Не характерны птоз, бульбарные нарушения, слабость в ногах. Заболевание характеризуется медленным прогрессированием, поздней диагностикой. (в 10 лет и позже). Ацетилхолинэстеразные препараты не эффективны. Методов лечения не разработано. Диагноз подтверждает ЭМГ: повторная стимуляция нерва, частотой 3 импульса в секунду вызывает патологическое уменьшение амплитуд мышечных ответов (при стимуляции одиночными импульсами этого не наблюдается). Мышечная биопсия выявляет превалирование тела волокон I типа, возможна пучковая атрофия, дефекты конфигурации концевых пластинок.
Поясно-конечностная миастения - иммунозависимая форма, начинающаяся в возрасте после 10 лет. Болеют преимущественно девочки. Проявляется прогрессирующей мышечной слабостью в конечностях. Физическая нагрузка не ухудшает состояние больного. Сухожильные рефлексы, как правило, вызываются, но могут быть снижены. Могут поражаться мимические мышцы. Бульбарные, глазодвигательные нарушения отсутствуют. Клинические симптомы дают возможность думать о поясно- конечностной миодистрофии. Диагноз миастении подтверждают сохранность сухожильных рефлексов; ЭМГ: повторная стимуляция нерва демонстрирует декремент (снижение) амплитуды мышечного ответа. Уровень антител, связывающих рецепторы ацетилхолина, повышен. Лечение проводится в соответствии с принципами терапии других серопозитивных форм миастении.
Ювенильная миастения - иммунозависимая форма, при которой в результате нарушения иммунных механизмов происходит образование антител против АХР постсинаптической мембраны нервно-мышечного синапса, что ведет к уменьшению числа действующих постсинаптических Н- холинорецепторов в поперечно-полосатых мышцах и, таким образом, к нарушению передачи нервных импульсов через нервно-мышечные синаптические аппараты. Термин «ювенильная» встречает возражение у зарубежных авторов, так как болезнь у детей и взрослых, по их мнению, нередко протекает идентично.
Заболевание у ребенка может проявиться в различные периоды жизни, начиная с 6-ти месяцев, в 75 % случаев - после 10-ти лет (11-16 лет), причем прогностически более благоприятным считается начало миастении в препубертатном периоде, нежели в постпубертатном периоде. В настоящее время, как правило, выделяют две клинические формы: глазную и генерализованную. При первой - преимущественно страдают мышцы глаз, однако не исключено легкое поражение мышц лица и конечностей. При второй - процесс носит генерализованный характер, преобладает выраженная слабость конечностей, заинтересованность бульбарной мускулатуры. Помимо указанных форм описывают бульбарную; поясно-конечностную (скелетную), при которой имеет место поражение мышц туловища и конечностей; глоточно-лицевую. Основными клиническими проявлениями миастении у детей, как и у взрослых, являются: мышечная слабость патологическая мышечная утомляемость. Развитие заболевания чаще носит подострый или хронический характер, хотя возможен и острый вариант. При этом провоцирующими факторами, как правило, являются острые респираторные инфекции, интоксикации, эндокринные сдвиги. Дебют болезни в препубертатном возрасте чаще наблюдается у мальчиков, в постпубертатном - у девочек. В целом, заболевание у мальчиков протекает менее тяжело, как правило в виде глазной формы. Локальная форма заболевания у детей встречается реже, чем у взрослых: глазная - у 3,7 %, скелетно-мышечная у 4,7%, глоточно-лицевая - у 6 % от общего числа больных детей.
Вне зависимости от формы миастении первыми патологическими проявлениями являются глазные симптомы. Генерализация процесса, как правило, происходит в течение первых месяцев. При глазной форме в клинической картине доминируют глазодвигательные расстройства: птоз, обычно двусторонний, асимметричный. Реже страдают отдельные мышцы глазного яблока, что сопровождается диплопией. Слабость глазодвигательных мышц в начале непостоянна. При повторных осмотрах клинические проявления могут меняться. Двоение и птоз нарастает при физической нагрузке, продолжительном взгляде вверх; усиливаются к вечеру, уменьшаются после отдыха. Степень выраженности симптомов разнообразна. В тяжелых случаях может отмечаться полная наружная офтальмоплегия. Зрачковые реакции не нарушаются. У 40-50% больных во время дебюта обнаруживается слабость других мышечных групп. У детей с глазной формой миастении могут иметь место слабость мышц лица (чаще круговой мышцы глаза с одной или обеих сторон), легкая утомляемость в конечностях. Отсутствие грубого нарастания других миастенических проявлений в течение 2х лет свидетельствует о том, что генерализация процесса в последующем становится все менее вероятной. Такая форма миастении опасности для жизни не представляет, чаще наблюдается у мальчиков, развивается в препубертатном периоде. Течение, как правило, носит ремитирующий характер (с обострениями и ремиссиями). Обострения варьируют по тяжести и продолжительности от нескольких недель до нескольких лет. У 20% больных отмечаются длительные ремиссии. Для этой формы характерна серонегативность по отношению к АХР (то есть отсутствуют антитела к АХР).
Генерализованная форма миастении у детей встречается наиболее часто, преимущественно у лиц женского пола. Как правило, заболевание начинается в постпубертатном возрасте, чаще моносимптомно - со слабости глазодвигательных мышц (птоз и/или диплопия) у 72,2% детей, затем вовлекаются мышцы шеи (77,8% детей), мышцы туловища и конечностей, причем в отличие от взрослых больных страдают дистальные отделы (кисти - в 75% случаев, стопы - 41,7%), мимическая (75% и жевательная мускулатура (38%). Уже через год обращает на себя внимание выраженная диффузная мышечная слабость, утомляемость, симптомы поражения бульбарной группы мышц. Больные жалуются на затруднение при глотании пищи, попадание жидкости в нос (эти симптомы усиливаются в процессе еды), носовой оттенок голоса, утомляемость во время разговора. Заболевание у детей протекает крайне тяжело, с поражением дыхательной мускулатуры (78% наблюдений), миастеническими кризами (25% случаев). Спонтанные ремиссии не характерны. У многих больных наблюдается резистентность к антихолинэстеразным препаратам. Как и при миастении взрослых, отмечается серопозитивность по отношению к АХР (наличие антител к АХР), что подтверждает аутоиммунную природу заболевания. Дети с данной формой болезни имеют высокий риск развития аутоиммунных заболеваний, особенно тиреоидитов и коллагенозов. В 5 % случаев миастения у детей сочетается с тимомой (для сравнения у взрослых тимома диагностируется в 15% случаев и больше).
Установлено, что миастения у детей отличается от миастении у взрослых степенью выраженности симптомов, особенностями клинических проявлений. У больных детской аутоиммунной миастенией, в сравнении со взрослыми пациентами, значительно больше выражен птоз, слабость мимической мускулатуры (в частности, круговой мышцы глаза), мышц шеи, дистальных отделов конечностей. Чаще отмечается поражение дыхательной мускулатуры, генерализованное снижение мышечного тонуса. Клинические исследования свидетельствуют о том, что детская аутоиммунная и врожденная миастения имеют некоторые различия. При врожденной форме обращает на себя внимание более тяжелое поражение глазодвигательных мышц, негрубый птоз, мышечная гипотония, страдание дистальных отделов конечностей, меньшая заинтересованность мимической, бульбарной мускулатуры. Электромиографическое исследование свидетельствует о том, что больные врождённой миастенией достоверно точно отличаются от больных детской 41 миастенией и взрослых больных значительно меньшей величиной декремента амплитуды М-ответа, что может быть использовано при проведении дифференциального диагноза между указанными формами заболевания. Все выше указанные сравнительные данные статистически достоверны.
Постановка диагноза проводится на основании клинических, фармакологических, электромиографических и иммунологических критериев (доказательством последнего является концентрация антител к АХР более 0,4012 ммоль). Повышение титра антител к АХР при генерализованной миастении выявляется в 80-90% случаев. Следует помнить, что увеличение вилочковой железы по данным КТ или МРТ не является критерием диагностики миастении. Диагноз считается несомненным при подтверждении его по 4 критериям, достоверным - по 3 критериям, вероятным - по 2 критериям и сомнительным - по 1. Диагностика миастении в детском возрасте должна быть проведена до назначения патогенетической терапии, так как методы лечения при аутоиммунной и врожденной формах разные. Лечение аутоиммунной формы миастении у взрослых и детей в целом проводится по одним канонам. Лечение направлено на коррекцию относительного дефицита ацетилхолина и подавление аутоиммунного процесса. Однако, по мнению зарубежных авторов, детям с генерализованной миастенией и повышенным уровнем антител к АХР как можно раньше после уточнения диагноза должна быть проведена тимэктомия. При операциях, выполненных на ранних стадиях болезни, у большинства больных в течение 3х лет сохраняется ремиссия. Сразу после хирургического вмешательства должна быть начата кортикостероидная терапия. Преднизолон 1,5 мг/кг/сут (не выше 100 мг) парентерально, затем перорально. Через 5 дней назначают преднизолон через день (в течение 1 месяца). Доза препарата уменьшается на 10% ежемесячно, до поддерживающей (при которой клинические проявления болезни отсутствуют). Попытка отмены проводится через 1 год после полной нормализации состояния. Следует помнить, что высокие дозы кортикостероидов вначале могут вызывать нарастание симптомов, поэтому лечение следует начинать, пока больной находится в стационаре. Улучшение наступает после первой недели лечения и продолжается в последующие месяцы. Антихолинэстеразные средства одновременно с кортикостероидами поначалу не назначаются, так как на фоне гормонов повышается чувствительность к ним, что может привести к холинэргическому кризу. При необходимости могут применяться в последующем в те дни, когда больной не принимает кортикостероиды. Плазмаферез или внутривенное введение иммуноглобулина используются при крайней необходимости: у больных с дыхательной недостаточностью или в случаях, когда больные настолько слабы, что таким образом должны быть подготовлены к проведению тимэктомии.



























































































0 комментариев