Акушерские и перинатальные осложнения гестационного сахарного диабета. Лекция для врачей
Лекция для врачей "Акушерские и перинатальные осложнения гестационного сахарного диабета" (отрывок из книги "Сахарный диабет и репродуктивная система" - Дедов И. И., Шестакова М. В.)
Гестационный сахарный диабет
Эпидемиология, патогенез и факторы риска развития гестационного сахарного диабета
Эпидемиология. Гестационный сахарный диабет — наиболее частое нарушение обмена веществ у беременных, с которым встречаются эндокринологи и акушеры-гинекологи, что обусловлено как резким ростом заболеваемости СД 2 в популяции, так и улучшением качества его диагностики. Впервые случай ГСД (закончившийся материнской и перинатальной смертностью) был описан в 1823 г. в Берлине Н. Bennewitz. Спустя 106 лет М. Дункан выступил перед Обществом акушеров в Лондоне с докладом о послеродовом диабете и сообщил о высокой смертности детей и матерей при этом осложнении. Термин «гестационный сахарный диабет» появился в медицинской литературе только в 1961 г. и принадлежит}. O’Sallivan. В 1999 г. был опубликован научный доклад Комитета экспертов ВОЗ, где было предложено ГСД называть все состояния нарушения углеводного обмена, которые в предыдущих классификациях были представлены как нарушенная толерантность к глюкозе при беременности и собственно ГСД (диабет беременных). С этого времени ГСД стал определяться как нарушение толерантности к глюкозе различной степени тяжести, которое возникло или было впервые выявлено во время беременности.
Распространенность ГСД зависит от этнического состава населения, распространенности СД 2 в популяции и используемых программ скрининга. Так, ГСД в Европе осложняет до 4-6% беременностей, в США — до 3,5-17%, при этом он чаще развивается у латиноамериканцев и афроамериканцев. В Северной Америке, Великобритании и Австралии ГСД наиболее распространен у выходцев из Азии (Индийский субконтинент, Китай, Юго-Восточная Азия), другими популяциями с высоким риском являются народность маори в Новой Зеландии и коренное население островов Тихого океана.
В Туркменистане частота ГСД составляет 7,3%, Узбекистане — 3,6%. В России имеются пока единичные работы, посвященные распространенности ГСД, что связано с отсутствием в нашей стране налаженной процедуры выявления данной патологии беременности. Проведение скрининга выборочных групп женщин с различными факторами риска и нерандомизированная непопуляционная основа большинства исследований обусловили большую вариабельность полученных данных. Так, по данным Н.В. Трусовой и соавт. (2001), частота ГСД составила 4,03%, по другим данным — 2-4% случаев.
Патогенез ГСД. Беременность представляет собой физиологический стрессовый тест для р-клеток поджелудочной железы, становясь для организма «диабетогенным фактором». Физиологическая беременность характеризуется двумя главными изменениями в гомеостазе глюкозы. Во-первых, это непрерывная передача глюкозы к оплодотворенному яйцу, т.е. к плоду и плаценте. Трансплацентарный транспорт глюкозы осуществляется транспортерами глюкозы (GLUT), главным образом GLUT-1 и GLUT-3. Из-за утилизации глюкозы плодом и плацентой матери беременность можно охарактеризовать как состояние «ускоренного голодания» (в данный период уровень глюкозы падает быстрее, чем у небеременных женщин, в то время как липолиз и кетогенез активизированы). Синтез плацентой стероидных гормонов (плацентарного лактогена, эстрогенов, прогестерона), а также повышение образования кортизола корой надпочечников при одновременном изменении метаболизма и тканевого эффекта инсулина, ускоренное разрушение инсулина почками и активизация инсулиназы плаценты приводят во время беременности к состоянию физиологической инсулинорезистентности с компенсаторной гиперинсулинемией. Последствием инсулинорезистентности и недостаточной секреции инсулина для ее преодоления является повышение концентрации в плазме крови глюкозы, свободных жирных кислот, некоторых аминокислот и кетонов. В перерывах между приемами пищи выраженная инсулинорезистентность сопровождается избыточным синтезом глюкозы печенью, что служит главной причиной тощаковой гипергликемии у беременных. После еды выраженная инсулинорезистентность характеризуется уменьшением опосредованной инсулином утилизации глюкозы мышцами, что приводит к чрезмерному повышению постпрандиальной гликемии, которая продолжается достаточно долго и является нормой для беременных.
У ряда беременных инсулинорезистентность, сопровождающаяся повышенной потребностью в инсулине, превышает функциональный резерв р-клеток поджелудочной железы, выявляет скрытые дефекты инсулинового аппарата, что реализуется в развитии ГСД. Кроме того, к факторам, определяющим развитие патологической инсулинорезистентности, относятся генетические дефекты, приводящие к изменению чувствительности к инсулину в инсулинозависимых тканях (мутация генов субстрата инсулинового рецептора (СИР-1), гликогенсинтетазы, гормончувствительной липазы, β-адренорецепторов, разобщающего протеина UCP-1), а также молекулярные дефекты белков, передающих сигналы инсулина (снижение мембранной концентрации и активности внутриклеточных транспортеров глюкозы GLUT-4 в мышечной ткани).
Не до конца выяснена истинная распространенность моногенных вариантов СД среди беременных с ГСД. Исследования носили хаотичный характер и наиболее широко описан только один из вариантов MODY, связанный с мутациями в гене глюкокиназы (GCK MODY 2). Максимальное число обследованных пациентов (119) описано польскими авторами в 2007 г, но была оценена встречаемость мутаций только двух генов — GCK (MODY 2) и HNF-1α (MODY 3) — 3-6% всех случаев ГСД.
Австралийскими учеными (V. Rudland и соавт., 2015) из базы ГСД (n = 776) были отобраны 63 пациентки, у которых по результатам проведенного после родов ПГТТ было подозрение на GCK-MODY. Из 31 пациентки, согласившейся пройти тестирование, у четырех была выявлена мутация. Полученные результаты были затем экстраполированы на большую базу ГСД (n = 4415), прогнозируемая распространенность составила -0,5-1/100 ГСД. Авторами были предложены новые критерии отбора беременных с ГСД для проведения углубленного обследования, что позволит сократить частоту генетических тестов на 80% среди белых женщин: глюкоза в крови натощак более 5,5 ммоль/л и ИМТ < 25 мг/кг2. Также было впервые продемонстрировано отсутствие различий в дородовом НЬА1с между GCK-MODY и ГСД.
Дети матерей с GCK-MODY теоретически имеют 50% шанс унаследовать аналогичную мутацию, в этом случае плод будет, как правило, иметь нормальный вес при рождении. В случае инсулинотерапии у матери и плода с мутациями в гене GCK возможно снижение массы плода до 700 г, что значительно ухудшает перинатальный исход. В случае же подтверждения у будущей матери MODY 3 инициация инсулинотерапии должна быть максимально ранней для предотвращения макросомии плода и гипогликемических состояний, представляющих угрозу для жизни ребенка. Таким образом, у матерей с MODY рекомендуется регулярная ультразвуковая оценка роста плода для предварительного определения его генотипа и решения вопроса о инициации инсулинотерапии. После родов необходимо уточнить наличие мутации у новорожденного, так как в дальнейшем у ребенка может быть ошибочно диагностирован СД 1 или СД 2.
Частота встречаемости других генов-кандидатов в структуре ГСД в литературе не представлена.
У женщин с ГСД также встречаются и другие «пострецепторные» аномалии, так, например, у 50% женщин с ГСД были выявлены аномальная активность тирозинкиназы в скелетных мышцах и истощение резервов GLUT-4 (инсулинозависимый транспортер глюкозы) в адипоцитах. С другой стороны, аутоантитела к инсулину, островковым клеткам, глутаматдекарбоксилазе и/или тирозинфосфатазе были выявлены у 10% женщин с ГСД, а антитела к поверхности островковых клеток — у 31% пациенток с ГСД. Именно присутствие аутоантител (особенно нескольких типов аутоантител), а также наличие HLA-DR3, -DR4, которые обычно присущи людям с генетическим риском развития СД 1, определяют женщин с ГСД как группу высокого риска для последующего развития иммуногенного СД.
Факторы риска развития ГСД. Традиционно к факторам риска развития ГСД относятся: возраст женщины старше 30 лет, избыточная масса тела (более 20% от идеального ИМТ), СД 2 у близких родственников, ГСД в анамнезе, нарушенная толерантность к глюкозе (НТГ), глюкозурия во время предшествующей или данной беременности, многоводие и/или крупный плод в анамнезе, рождение ребенка с массой тела более 4000 г или мертворождение в анамнезе, быстрая прибавка массы тела во время данной беременности, артериальная гипертензия. Однако при стратификации беременных по группам риска ГСД удается диагностировать примерно в 50% случаев. По данным D. Baliutaviciene и соавт. (2002), К. Innes и соавт. (2001), от 8,2 до 23,1% беременных с развившимся ГСД не имеют факторов риска.
К группе высокого риска по развитию ГСД также относятся пациентки с синдромом поликистозных яичников из-за имеющихся у этих больных периферической инсулинорезистентности, гиперинсулинемии и НТГ. По данным J. Ecker и соавт. (2009), беременность двойней в 2 раза повышает риск развития ГСД в связи с двойным контринсулярным действием плацентарных гормонов за счет функционирования нескольких плацент, а беременность тройней — в 4-5 раз.
В последние годы значительно увеличивается частота ятрогенных вариантов ГСД, обусловленных применением во время беременности глюкокортикоидов, обладающих выраженным контринсулярным действием (например, при бронхиальной астме, надпочечниковой недостаточности, аутоиммунной тромбоцитопении, системной красной волчанке, гемолитической анемии).
По данным В. И. Краснопольского и соавт. (2010), частота ГСД у пациенток после экстракорпорального оплодотворения (ЭКО) достигает 12,6%, что обусловлено как традиционными факторами риска (возраст, ожирение, отягощенная по диабету наследственность, синдром поликистозных яичников), высокой частотой многоплодия, так и применением препаратов эстрогенов и индукцией овуляции (эндогенная гиперэстрогения) в программе ЭКО. А. Мауег (2005) рассматривает высокую распространенность ГСД при беременности после ЭКО как следствие применения агониста ГнРГ (трипторелина ацетата или диферилина).
J. Lipshitz и соавт. (1978) впервые был описан так называемый токолитический вариант ГСД, который опосредован способностью β-адреномиметиков усиливать гликогенолиз в печени. Лечение преждевременных родов β-адреномиметиками и/или большими дозами кортикостероидов повышает риск развития ГСД на 15-20%, причем женщины, длительно получающие терапию стероидами, имеют еще более высокий риск развития ГСД.
Прегестационное ожирение — один из ключевых факторов риска развития ГСД в связи с уменьшением числа рецепторов к инсулину на поверхности эффекторных клеток, что приводит к снижению связывания и уменьшению эффекта этого гормона. Таким образом, у пациенток с повышенной массой тела действие плацентарных гормонов может привести к усилению уже имеющейся инсулинорезистентности, в результате чего риск развития ГСД увеличивается в 2-6,5 раза, при ожирении эти показатели еще выше, достигая 17%. Так, по данным М. Torloni и соавт. (2009), повышение исходного ИМТ на 1 кг/м2 увеличивает вероятность развития ГСД на 0,92%. В японском исследовании было продемонстрировано, что у беременных с ИМТ < 25 кг/м2 ГСД развивался в 24,3 + 8,0 нед., а при ИМТ > 30 кг/мг2 уже в 20,6 ± 8,0 нед. (р < 0,05).
Акушерские и перинатальные осложнения гестационного сахарного диабета
Акушерские осложнения. Выраженные метаболические сдвиги в организме при ГСД отрицательно влияют на течение беременности и родов у беременных с ГСД, которые характеризуются большим числом акушерских осложнений (невынашивание беременности, преэклампсия, гестационная артериальная гипертензия (ГАГ), многоводие, материнский травматизм при родах крупным плодом, увеличение частоты кесарева сечения, учащение операционных и послеоперационных осложнений, инфекция мочевыводящей системы, перинатальные потери, риск возникновения гипофизарного некроза (синдром Шихана), рецидивирующие вульвовагиниты).
Последствия ГСД для матери и ребенка представляют серьезную не только медицинскую, но и экономическую проблему. Так, в 2009 г. затраты в США на лечение одной пациентки с ГСД составляют 3305 дол. и на одного ребенка — 209 дол. на каждый год жизни, а годовые суммарные затраты на лечение ГСД у беременных составили 596 млн дол. и 40 млн дол. было затрачено на лечение их детей.
Ожирение. Matthews Harvey и der Brucke (США) и Moller Christensen (Скандинавия) еще в 1938 г. впервые показали, что беременность и роды при ожирении в 75% случаев протекают с осложнениями. В настоящее время прегестационное ожирение рассматривается в качестве независимого фактора риска возникновения ГАГ и преэклампсии. По данным Ф. Ф. Бурумкуловой и соавт. (2011), пациентки с ГСД с неосложненным течением беременности имели наиболее низкие показатели исходного ИМТ — 25,8 (22,1-30,1) кг/м2, а наиболее высокий ИМТ — 34 (29,4-37,5) кг/м2 отмечался у беременных с умеренной преэклампсией (р < 0,001). I. Frederick и соавт. (2006) выявили, что увеличение прегестационного ИМТ на 1 кг/м2 повышает риск преэклампсии на 8%, а по данным М. Knight и соавт. (2010) у беременных с ИМТ > 50 кг/м2 (экстремальное ожирение) в 4,5 раза выше частота преэклампсии и в 6 раз — частота ГСД.
Исследование НАРО (Гипергликемия и неблагоприятные исходы беременности/Hyperglycemia and adverse pregnancy outcomes) продемонстрировало, что более высокий исходный ИМТ у беременных с ГСД (> 42,0 кг/м2 против < 22,6 кг/м2) независимо от уровня материнской гликемии был ассоциирован с массой тела новорожденного более 90-го перцентиля (3,52 [2,48-5,00]), процентом жировой ткани у новорожденного более 90-го перцентиля (3,28 [2,28-4,71]), первым кесаревым сечением (2,23 [1,66-2,99]), концентрацией С-пептида в пуповинной крови свыше 90-го перцентиля (2,33 [1,58-3,43]), преэклампсией (14,14 [9,44-21,17]) и досрочным родоразрешением (0,48 [0,31-0,74]).
Угроза прерывания беременности и преждевременных родов встречается при ГСД в 30-50% случаев, причем установлена четкая взаимосвязь между невынашиванием беременности и материнской гипергликемией. По данным Y. Yogev и соавт. (2007), М. Hedderson и соавт. (2003), при средней гликемии 6,3 ± 0,9 ммоль/л частота преждевременных родов у беременных с ГСД составила 65%, а при гликемии 5,9 ± 0,3 ммоль/л — 46%.
Многоводие осложняет течение беременности при ГСД в 20-60% наблюдений. В патогенезе возникновения многоводия основную роль играет полиурия плода, реакция водной оболочки плода в ответ на повышенное содержание глюкозы в околоплодных водах, так как она проходит через плацентарный барьер. Кроме того, гипергликемия у матери в 89% случаев сопровождается изменением функции амниотического эпителия, при этом в амниотической жидкости обнаруживаются в повышенных концентрациях глюкокортикостероиды, что не имеет места при неосложненном течении беременности. Многоводие у беременных с СД также связывают с нарушением глотательных движений у плода, развивающегося в условиях хронической гипоксии.
Гестоз различной степени тяжести, по данным отечественных авторов, развивается у 25-65% беременных с ГСД, в то время как зарубежные авторы дают гораздо более низкие цифры — 1,9-3,7%. По-видимому, это связано с различиями в классификациях, на которые ссылаются авторы. При этом, по данным Ф. Ф. Бурумкуловой и соавт. (2011) и С. Н. Лысенко и соавт. (2013), при выраженных признаках диабетической фетопатии (ДФ) умеренная преэклампсия развивается в 15,8% случаев, тяжелая преэклампсия — в 2,6%, тогда как в отсутствие ДФ — только в 8,2 и 1,3% случаев соответственно (р = 0,01). Фетоплацентарная недостаточность на фоне ГСД без преэклампсии выявляется в 50-76,4% случаев и характеризуется выраженной ишемией плацентарной ткани на фоне незначительных изменений ее метаболизма. При ГСД с гестозом фетоплацентарная недостаточность развивается чаще — в 85% случаев.
Сочетанные формы гестоза (например, на фоне ГСД, ожирения или АГ) расцениваются традиционно как более тяжелые. Так, К. Czajkowski и соавт. (2009), обследовав 1212 женщин с ГСД, установили, что экстренное кесарево сечение было проведено у 26% женщин с нормальным АД, у 41% беременных с ГАГ и в 50% случаев у женщин с прегестационной АГ. Кроме того, при беременности с ГСД и АГ отмечалось рождение детей с более низкой оценкой по шкале Апгар.
В патогенезе развития АГ при ГСД важная роль отводится гиперинсулинемии, которая повышает активность симпатоадреналовой системы, приводит к увеличению реабсорбции натрия и воды в проксимальных канальцах почек, способствует пролиферации гладкомышечных клеток сосудов, блокирует активность Na-K-АТФазы и Ca-Mg-АТФазы, увеличивая внутриклеточное содержание Na+ и Са2+, повышая чувствительность сосудов к вазоконстрикторам. Гиперинсулинемия и гиперлипидемия в сочетании с высоким уровнем ингибитора активатора плазминогена (PAI-1), лептина и TNF-α в дальнейшем могут привести к развитию у пациенток с ГСД серьезных кардиоваскулярных осложнений, т.е. беременность может рассматриваться как стресс-тест, предсказывающий здоровье женщины в последующей жизни.
Частота кесарева сечения у беременных с ГСД составляет 29-47%, при этом основными его причинами являются крупные размеры плода, цефалопельвическая диспропорция, клинически узкий таз, слабость родовой деятельности, дистоция плечиков и острая гипоксия плода. Тяжелые осложнения гестации (ГАГ и преэклампсия) в сочетании с крупными размерами плода также приводят к двукратному повышению частоты кесарева сечения у пациенток с ГСД. Канадские исследователи (1998) указывают на значительное увеличение по сравнению с общепопуляционными показателями частоты макросомии и кесарева сечения при ГСД, протекающем при наличии клинических проявлений диабета, — 29,6 и 28,7%, а без них — 13,7 и 20,2% соответственно. В исследовании, проведенном R. Gorgal и соавт. (2009), ГСД был определен как независимый фактор риска экстренного кесарева сечения.
Перинатальные осложнения ГСД. Частота ДФ при ГСД колеблется от 49 до 60%, и наиболее типичными ее признаками являются макросомия (вес новорожденного более 90-го перцентиля), пастозность мягких тканей, лунообразное лицо, короткая шея, гиперемия кожных покровов, петехиальные кровоизлияния, относительно короткие конечности, гипертрихоз (рис. 4.1), органомегалия.
Макросомия при ГСД, частота которой, по данным литературы, составляет 5,3-35%, служит основной причиной родового травматизма. J. Pedersen еще в 1952 г. высказал предположение, что ДФ связана с гиперсекрецией инсулина гипертрофированными β-клетками поджелудочной железы плода, возникающими в ответ на избыточное постоянное поступление к плоду глюкозы. При гиперинсулинизме повышается липогенез, отмечается задержка жидкости, склонность к отекам, нарастает масса тела плода. Лабильность уровня глюкозы в крови матери стимулирует активность системы гипофиз-кора надпочечников плода, приводит к гипертрофии надпочечников за счет увеличения зародышевой зоны коры, больших размером ядер и объема цитоплазмы, что в сочетании с анаболическим действием фетального инсулина обусловливает «кушингоидный» вид младенцев. Некоторые исследователи исходят из предпосылки об активации инсулином соматотропного гормона, стимулирующего анаболическую фазу азотистого обмена и значительно увеличивающего синтез белка во всех тканях и органах.
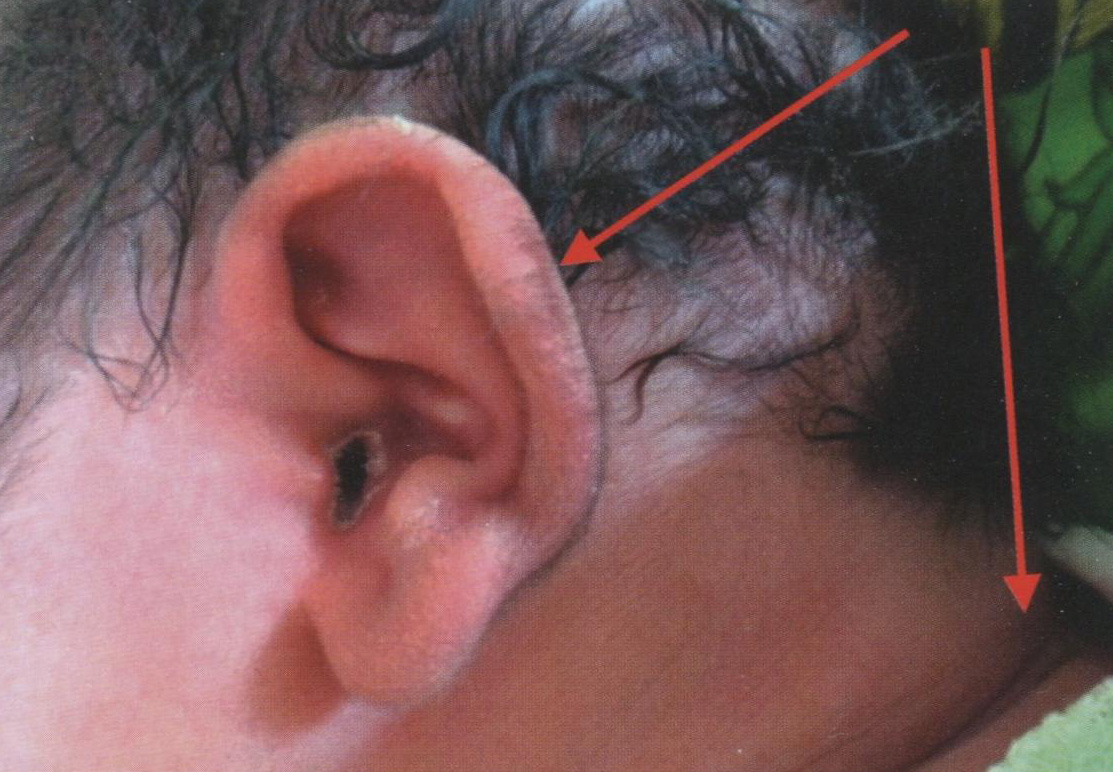
Рис. 4.1. Гипертрихоз края ушной раковины и утолщение шейной складки у новорожденного с диабетической фетопатией (ГСД у матери)
У новорожденных с признаками ДФ часто наблюдается висцеромегалия: кардиомегалия за счет избыточного отложения гликогена в миокарде и миокардиодистрофии; гепато-, спленомегалия из-за большей массы цитоплазмы и большего количества очагов кроветворения, при этом длина трубчатых костей либо соответствует гестационному сроку, либо отстает от гестационных норм (диспропорциональное телосложение, асимметричная макросомия).
В раннем неонатальном периоде примерно у 5% детей развивается респираторный дистресс-синдром в результате ингибирующего воздействия гиперинсулинемии на созревание легочного сурфактанта и угнетения синтеза лецитина. Высокая частота применения ИВЛ в раннем неонатальном периоде, в свою очередь, повышает заболеваемость в детском и подростковом возрасте.
Отделение плаценты после родов и резкое прекращение поступление глюкозы к плоду в условиях длительной фетальной гиперинсулинемии приводит к неонатальной гипогликемии. Метаболизм новорожденных с ДФ также характеризуется гипокальциемией, гипомагниемией, гипербилирубинемией, гипоксией, ацидозом, нарушением электролитного обмена, что служит причиной метаболической кардиопатии.
У выживших в неонатальный период детей с ДФ, не имеющих врожденных пороков развития, к 2-3 месяцам происходит полный регресс ее признаков. Однако, по данным ряда авторов, существует риск органического повреждения нервной системы в связи с неонатальной гипогликемией. Некоторые исследователи не выявили никакого влияния гипогликемии на психомоторное развитие детей, тогда как другие показали серьезное повреждение мозга. N. Boluyt и соавт. (2006) пришли к выводу о том, что имеющиеся данные весьма противоречивы, и для оценки влияния гипогликемии у новорожденных на их последующее психомоторное развитие и разработки рекомендаций по его коррекции необходимо провести хорошо разработанное проспективное исследование.
В 2001 г. С. Hales и D. Barker сформулировали понятие о «фетальном программировании», которое в дальнейшем было преобразовано в термин «метаболическая память». В настоящее время известно, что потомство матерей с ГСД имеют 5-кратный риск развития нарушенной толерантности к глюкозе по сравнению с потомством матерей без ГСД. По данным Т. Hillier (2007), нелеченый ГСД ассоциирован с двукратным риском повышения массы тела детей через 5-7 лет. Н. De Valk и соавт. (2009) и D. Lawlor и соавт. (2010) установили, что дети у матерей с ГСД имеют более высокий ИМТ по сравнению с обычными детьми, у 39,5% детей в дошкольном периоде и у 60% в начальной школе отмечаются проблемы с речью, а у 9,3% детей — проблемы с физической активностью.
Крупные размеры плода и его диспропорциональное телосложение приводят к высокой частоте родового травматизма. Так, дистоция плечиков плода при ГСД составляет 2,8-5,6%, перелом ключицы — 6-19%, паралич Эрба — 2.4- ,8%, травмы шейного отдела позвоночника — 42%, тяжелая асфиксия —1.4- 5,3%, а нарушение мозгового кровообращения травматического генеза — 20%. По данным S. Анооп и соавт. (2003), при родах через естественные родовые пути плодами массой 5000 г и более родовой травматизм отмечается в 59,5% случаев. В исследовании Р. Berle и соавт. (2003) дистоция плечиков при массе плода 4000 г встречается в 6,3% случаев, а при массе 4000-5000 г — уже в 25% случаев. Перинатальная смертность при этой патологии в целом в 5 раз выше, чем в популяции.
Вы читали отрывок из книги "Сахарный диабет и репродуктивная система" - Дедов И. И., Шестакова М. В.
Книга "Сахарный диабет и репродуктивная система"
Авторы: Дедов И. И., Шестакова М. В.

В руководстве рассматриваются все этапы становления репродуктивной функции женщин и мужчин и их возможные нарушения в условиях сахарного диабета. У женщин особое внимание обращено на половое созревание девочек, течение пубертата, нарушения менструального цикла, течение беременности и родоразрешение, особенности климактерического периода и менопаузальной гормональной терапии, а также выбор оптимального контрацептивного препарата при наличии сахарного диабета.
Особое внимание уделено рискам развития и стандартам лечения гестационного сахарного диабета. У мужчин, страдающих сахарным диабетом, подробно анализируются причины развития эректильной дисфункции и снижения либидо, нарушений эякуляции и фертильности, рассматривается медикаментозная и хирургическая коррекция выявленных нарушений. Отдельная глава посвящена причинам бесплодного брака при сахарном диабете, подробно анализируются механизмы формирования женского и мужского факторов бесплодия в условиях длительной гипергликемии. Детально, с опорой на огромный опыт работы отделения вспомогательных репродуктивных технологий ФГБУ «Эндокринологический научный центр», обсуждаются возможности вспомогательных репродуктивных технологий (ВРТ) при сахарном диабете.
Авторы надеются, что после прочтения данной книги у аудитории не останется сомнений в том, что проблема сахарного диабета, еще недавно считавшегося приговором для женщин и мужчин репродуктивного возраста, «запретом» на возможность иметь семью и детей, в современном мире успешно решается благодаря грамотным врачам и прогрессивным технологиям, позволяющим преодолевать все потенциальные нарушения репродуктивной сферы и иметь здоровое потомство.
Для эндокринологов и диабетологов, гинекологов и репродуктологов, педиатров, студентов и аспирантов, а также всех специалистов, принимающих непосредственное участие в лечение больных сахарным диабетом.
Содержание книги "Сахарный диабет и репродуктивная система" - Дедов И. И., Шестакова М. В.
Глава 1. Нарушения овариально-менструальной функции у женщин с сахарным диабетом
1.1. Особенности влияния сахарного диабета 1-го типа на становление и течение физиологического пубертата и менструальной функции у девочек и женщин репродуктивного возраста
1.2. Влияние различных нейропептидов на функционирование гипоталамического звена гипоталамо-гипофизарно-овариальной системы у девочек и женщин с сахарным диабетом типа 1
1.3. Нарушение импульсного режима гипоталамической секреции у женщин с сахарным диабетом типа 1 в репродуктивном возрасте
1.4. Патогенетические аспекты снижения гонадотропной функции гипофиза у девочек в период пубертата и женщин репродуктивного возраста с сахарным диабетом типа 1
1.5. Патогенетические аспекты овариальной дисрегуляции у девочек и женщин репродуктивного возраста с сахарным диабетом типа 1
1.6. Роль гестагенов в терапии нарушений овариально-менструальной функции у женщин с сахарным диабетом типа 1
1.7. Синдром поликистозных яичников при сахарном диабете типа 1
Глава 2. Контрацепция у женщин с сахарным диабетом
2.1. Актуальность вопросов контрацепции в репродуктивном периоде у женщин с сахарным диабетом
2.2. Актуальность вопросов контрацепции у женщин с сахарным диабетом в период перименопаузы
2.3. Методы контрацепции у женщин с сахарным диабетом
2.3.1. Комбинированные оральные контрацептивы
2.3.2. Оральные контрацептивы, содержащие только гестаген, и мини-пили
2.3.3. Парентеральные формы гестагенов (депо-препараты)
2.3.4. Гормональные рилизинг-системы
2.3.4.1. Вагинальная рилизинг-система НоваРинг
2.3.4.2. Трансдермальные контрацептивы
2.3.4.3. Левоноргестрел-содержащая внутриматочная система
2.3.5. Посткоитальная контрацепция
2.3.6. Негормональные методы
2.3.6.1. Внутриматочные контрацептивные средства
2.3.6.2. Хирургическая стерилизация
2.3.6.3. Традиционные методы контрацепции
2.3.7. Контрацепция в период лактации и послеродовом периоде у женщин с сахарным диабетом
Глава 3. Сахарный диабет и беременность
3.1. Оценка состояния женщины, планирующей беременность
3.2. Риски, связанные с беременностью у женщин с сахарным диабетом
3.2.1. Риск самопроизвольных абортов
3.2.2. Гипогликемия матери
3.2.3. Кетоацидоз при беременности
3.2.4. Диабетическая нефропатия
3.2.5. Беременность после трансплантации почки
3.2.6. Диабетическая ретинопатия
3.2.7. Артериальная гипертензия
3.2.8. Поражение коронарных артерий
3.2.9. Диабетическая нейропатия
3.2.10. Сахарный диабет и акушерские осложнения
3.3. Риски для плода
3.4. Подготовка к беременности
3.5. Тактика ведения беременности
3.6. Тактика ведения родов и послеродового периода
Глава 4. Гестационный сахарный диабет
4.1. Эпидемиология, патогенез и факторы риска развития гестационного сахарного диабета
4.2. Акушерские и перинатальные осложнения гестационного сахарного диабета
4.3. Старые и новые стратегии скрининга на гестационный сахарный диабет
4.4. Лечение гестационного сахарного диабета
4.5. Послеродовое наблюдение и реклассификация нарушений углеводного обмена
Глава 5. Менопаузальный синдром у женщин с сахарным диабетом
Глава 6. Урологические и андрологические заболевания при сахарном диабете
Глава 7. Бесплодный брак и вспомогательные репродуктивные технологии при сахарном диабете
7.1. Общие представления о механизмах репродуктивных нарушений у лиц с диабетом
7.1.1. Механизмы нарушений у женщин
7.1.2. Механизмы нарушений у мужчин
7.2. Сахарный диабет и лечение бесплодного брака методами вспомогательных репродуктивных технологий


































































































0 комментариев