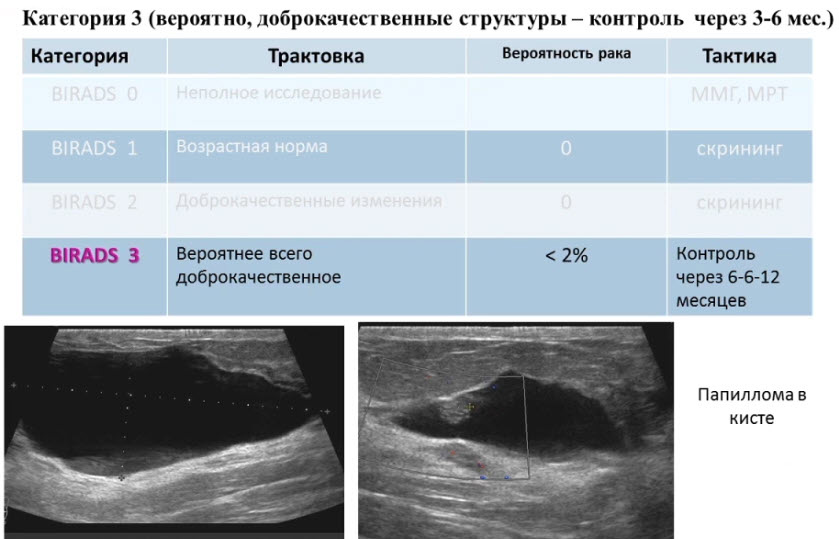
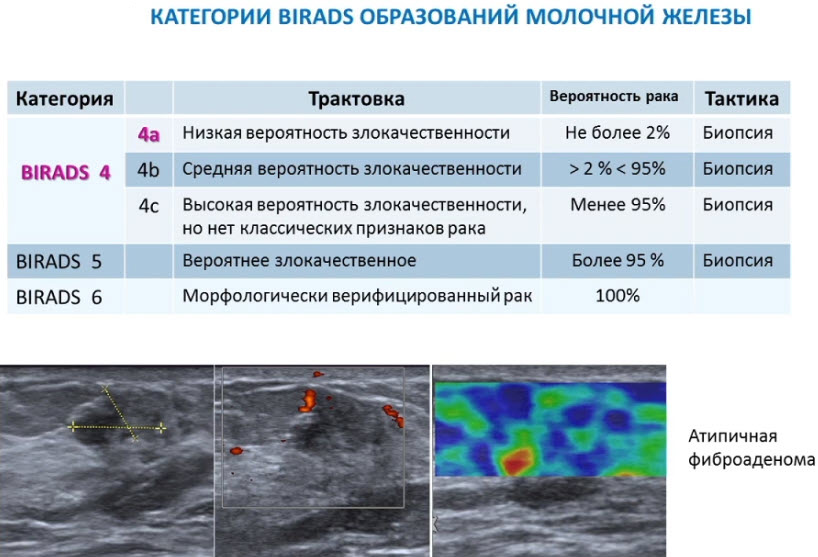
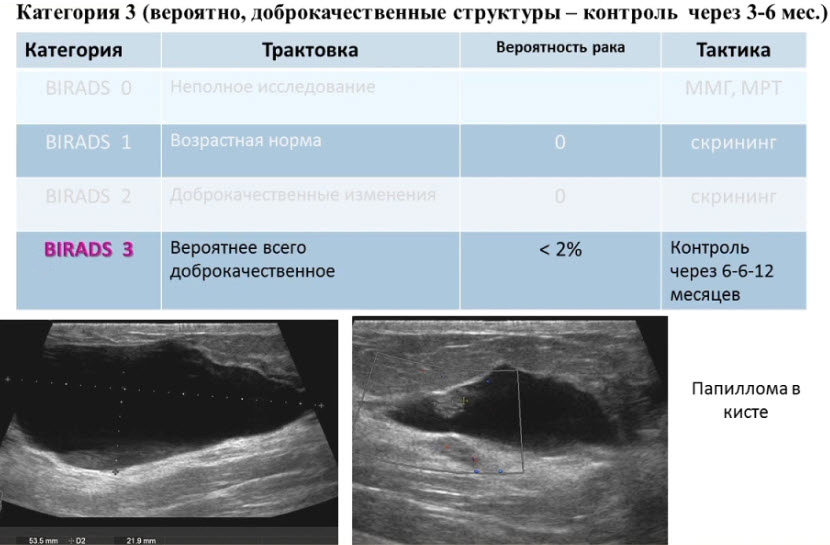
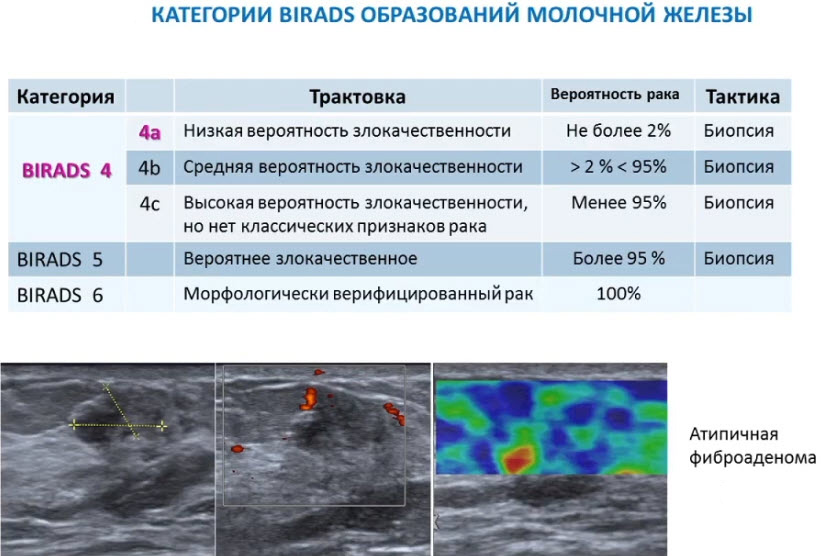
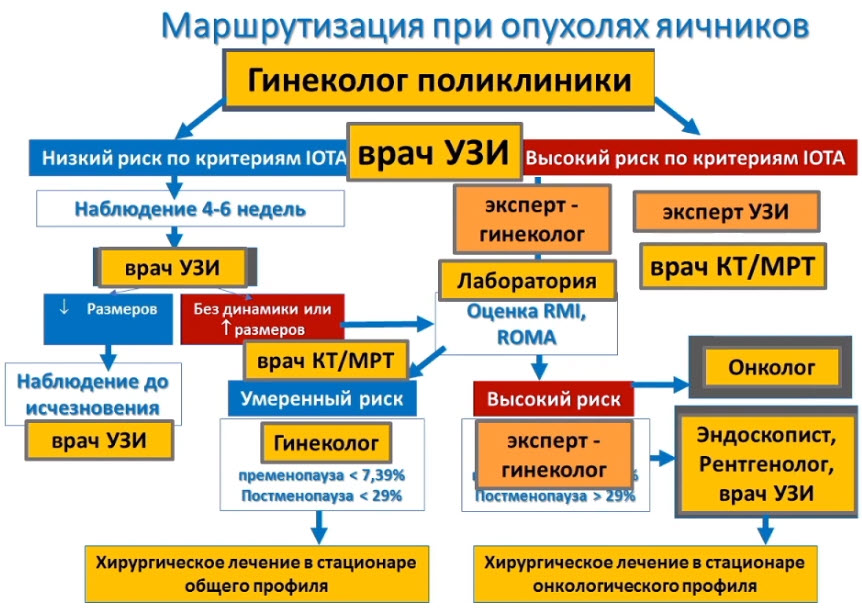
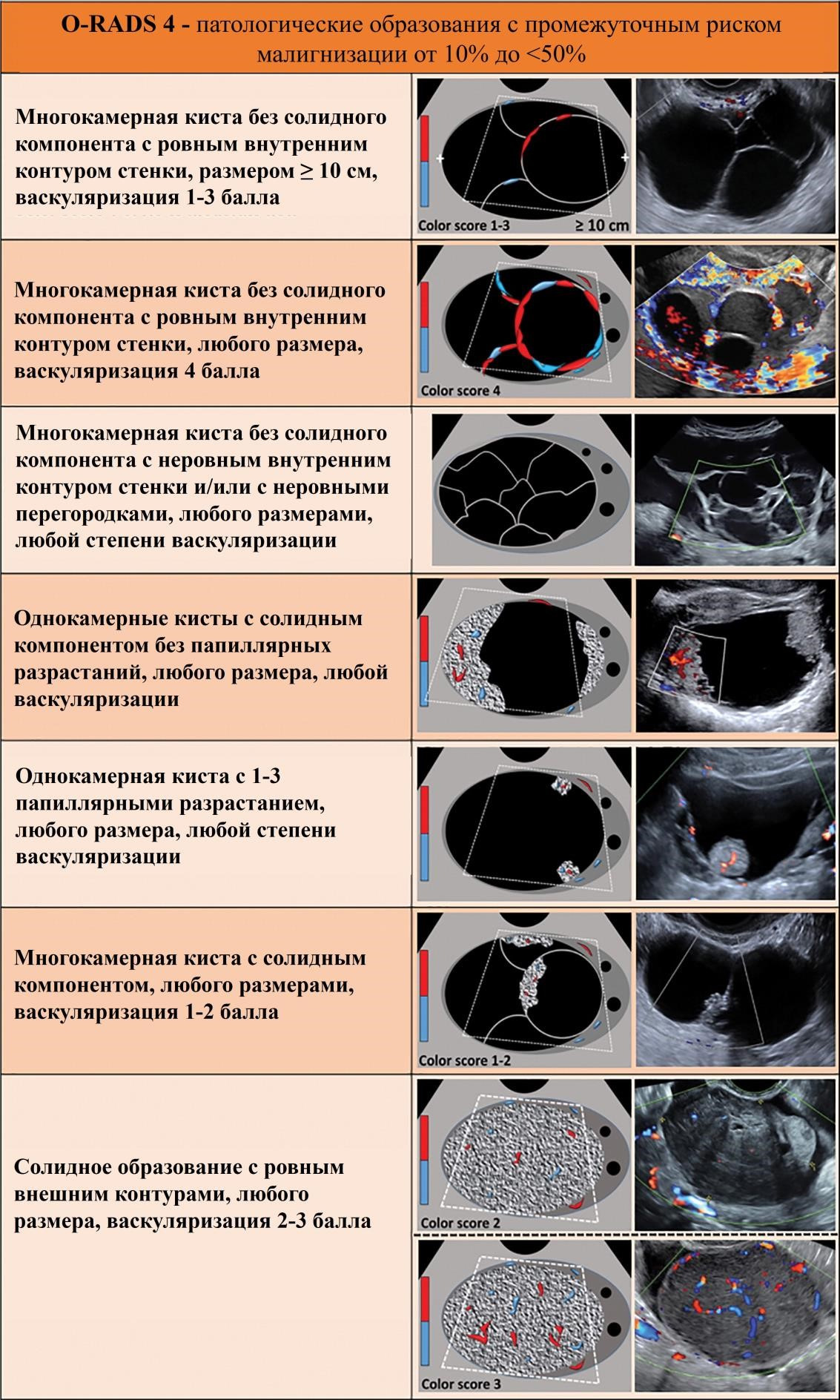
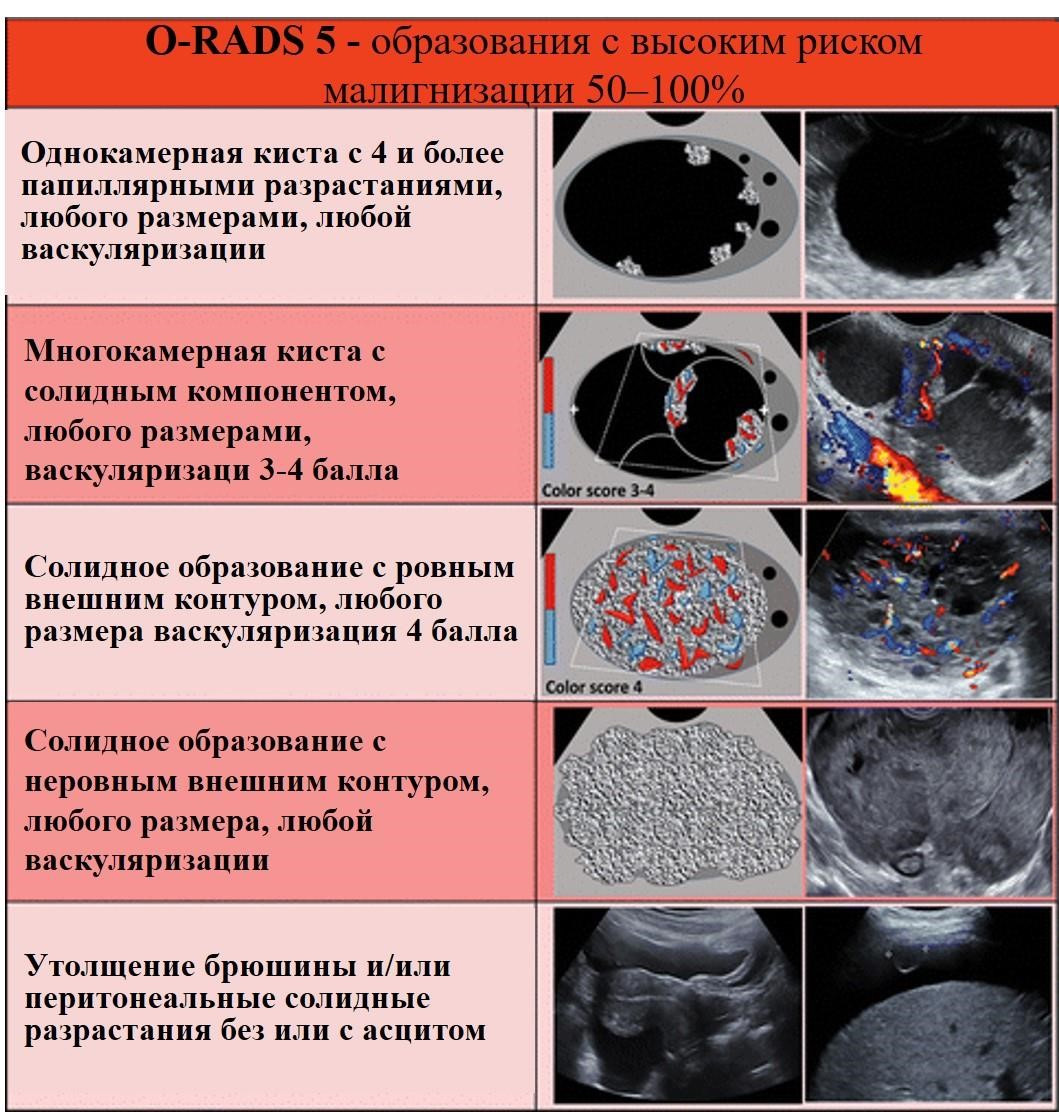
Лекция для врачей "Ранняя диагностика и лечение рака предстательной железы". Лекцию для врачей проводит д.м.н., профессор Раснер П. И.
На лекции рассмотрены следующие вопросы:
- Эпидемиология рака предстательной железы (РПЖ)
- Вероятность заболеть раком в течение жизни (мужчины, США)

- Риск для жизни
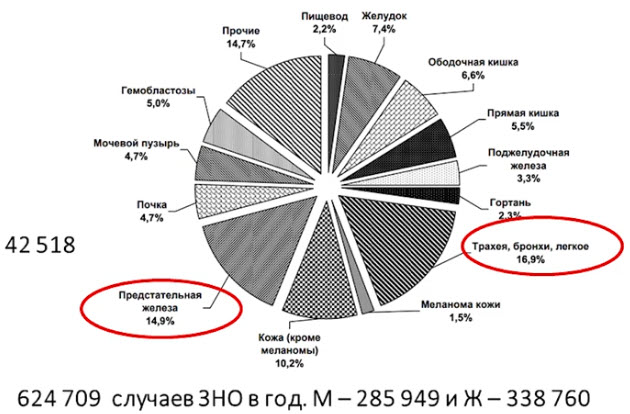
- Структура злокачественными новообразованиями среди мужского населения России 2018 г.
- Причины
- факторы внешней среды
- наследственность
- Наследственность
- При РПЖ у отца или брата риск заболеть увеличивается в 2-3 раза
- Если болеют 2 или 3 ближайших родственника - в 5 - 11 раз
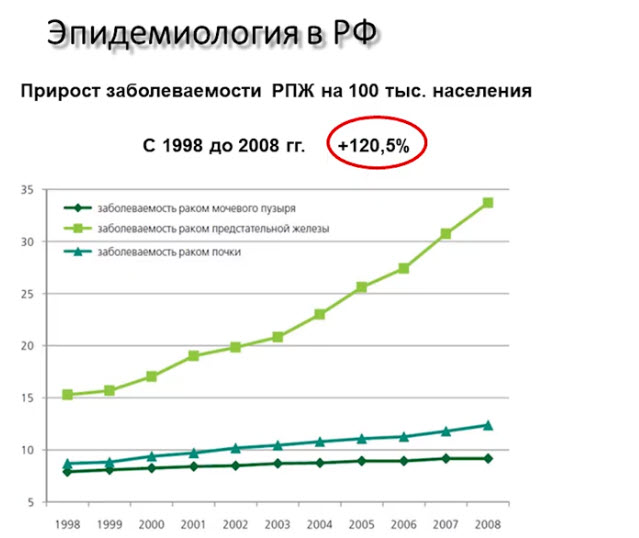
- Прирост заболеваемости РПЖ на 100 тыс. населения
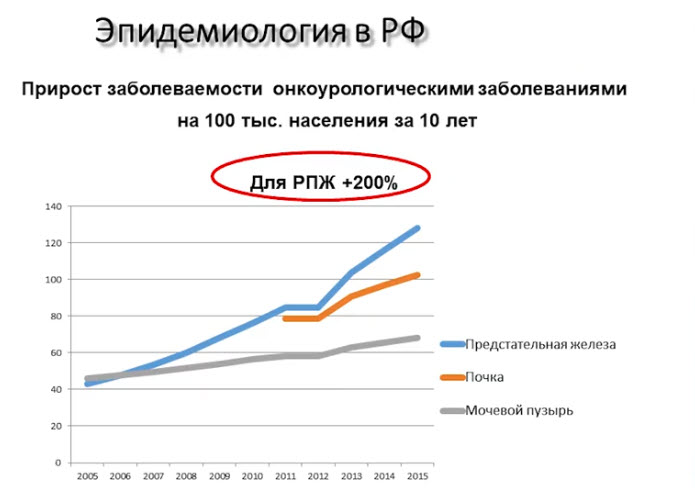
- Прирост заболеваемости онкоурологическими заболеваниями на 100 тыс. населения за 10 лет
- Прогноз 5-летней выживаемости при РПЖ в России...
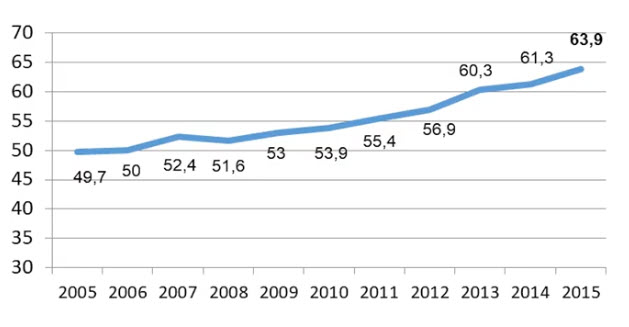
- Прогноз 5-летней выживаемости при раке предстательной железы в США...
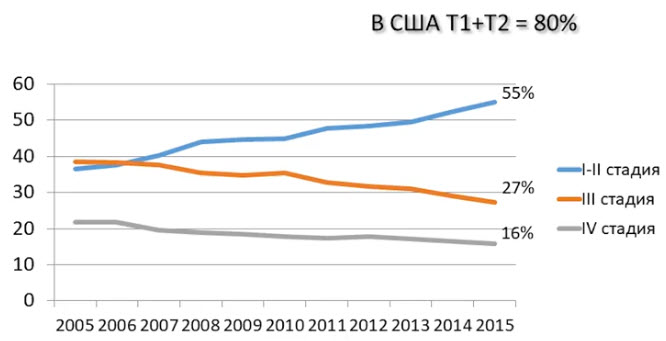
- Стадии РПЖ в РФ 2005-2015
- Клиническая картина
- На ранних стадиях РПЖ никак себя не проявляет
- Далее могут присоединиться симптомы расстройства мочеиспускания...
- При запущенных стадиях - боли в проекции простаты и в зоне метастатического поражения
- Диагностика
- Цель скрининга - выявление пациентов с ранними стадиями рака простаты и отсутствием клинических проявлений, которым показано радикальное лечение
- Диагностика
- Первый этап
- Пальцевое ректальное исследование
- Определение ПСА сыворотки крови
- Трансректальная ультрасонография
- Первый этап
- Пальцевое ректальное исследование. Симптомы
- Безболезненно?
- Уплотнения?
- Асимметрия?
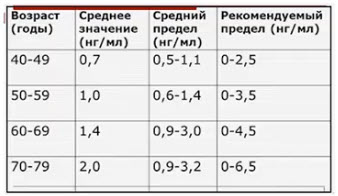
- Норма ПСА
- «Универсальная норма» - менее 4 нг/мл
- «Возрастная норма»
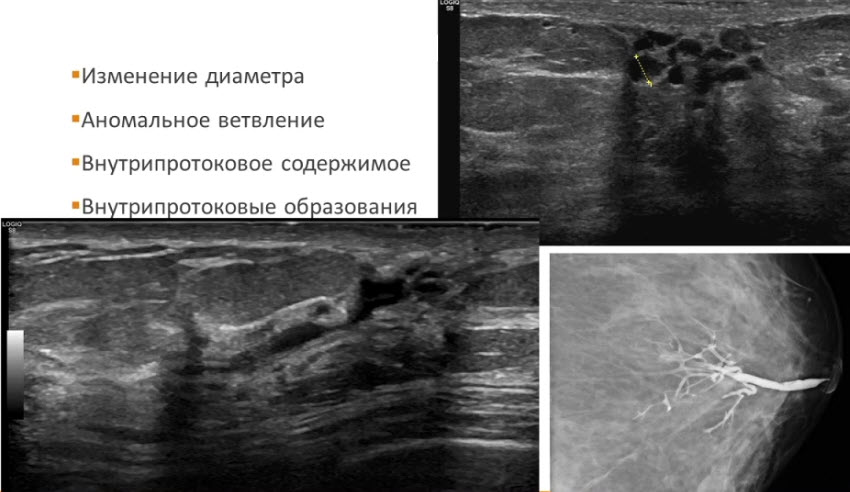
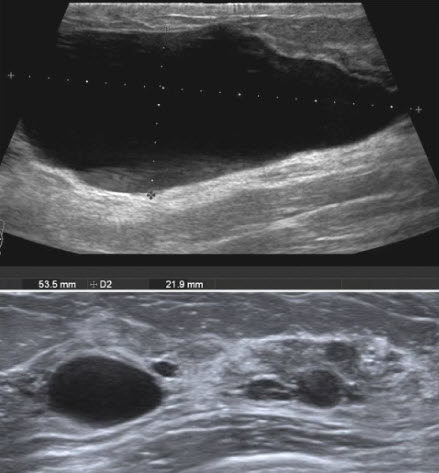
- УЗИ не очень информативный метод диагностики рака предстательной железы
- Диагностика рака предстательной железы. Второй этап
- Биопсия предстательной железы - основной метод диагностики РПЖ
- Минимум 12 точек
- Результаты биопсии
- Наличие РПЖ
- Степень злокачественности
- Распространённость в простате
- Диагностика рака предстательной железы. Третий этап. МРТ
- КТ не используется для диагностики рака предстательной железы
- Выбор метода лечения зависит от:
- Стадии заболевания
- Возраста и общего состояния здоровья
- Личных предпочтений пациента
- Умение врача
- Лечение
- Радикальная простатэктомия
- Лучевая терапия
- Активное наблюдение
- Гормональная терапия
- Комбинированное
- Другие методы (криотерапия, абляция простаты при помощи высокоинтенсивного ультразвука)
- У рака простаты четыре стадии. Полностью он излечим только на первых двух. Чтобы не попасть в число тех, кому помочь уже трудно, мужчина должен проходить регулярное обследование у уролога. Ежегодный осмотр всех мужчин старше 45-50 лет
Дополнительный материал "Ранняя диагностика и лечение рака предстательной железы"
Список сокращений
%свПСА – процент свободного простат-специфического антигена
-2проПСА – -2проэнзим свободного простат-специфического антигена
ASAP – мелкоацинарная атипическая пролиферация
ECPA и ECPA-2 – ранние антигены рака простаты
GSTP1 – глутатион-S-трансфераза Р1
KLK3 – ген, кодирующий белок ПСА
PHI – индекс здоровья простаты (Prostate Health Index)
PSCA – антиген простатических стволовых клеток
PSP 94 – секретируемый белок предстательной железы 94
TMPRESS2: ERG – химерный белок, образующийся при хромосомной мутации со слиянием генов TMPRESS2 и ERG uPA/uPAR – рецепторы активатора плазминогена урокиназы
БПЖ – биопсия предстательной железы
ВОЗ – всемирная организация здравоохранения
ДГПЖ – доброкачественная гиперплазия предстательной железы
ДПСА – доброкачественная фракция свободного простат-специфического антигена (BPSA)
инПСА – интактная фракция свободного простатспецифического антигена (intactPSA)
мРНК – матричная рибонуклеиновая кислота МРТ – магнитно-резонансная томография
сПСА – общий простат-специфический антиген
ОТ-ПЦР-РВ – обратная транскрипция, сопряженная с полимеразной цепной реакцией в режиме реального времени
ПЖ – предстательная железа
ПИН – простатическая интраэпителиальная неоплазия ПРИ – пальцевое ректальное исследование
проПСА – проэнзим свободного простат-специфического антигена ПСА – простат-специфический антиген
Введение
Одним из наиболее распространенных онкологических заболеваний у мужчин является РПЖ. В настоящее время он занимает второе место среди онкологических заболеваний по смертности у мужчин. В Северной Америке и Европе РПЖ является наиболее частым солидным раком, заболеваемость которым составляет 214 случаев на 1000 мужчин, опережая рак лёгких, рак прямой и ободочной кишок. В Российской Федерации за последние 10 лет численность больных с впервые установленным диагнозом РПЖ на 100 000 населения возросла на 300 %.
Основными, наиболее изученными факторами риска развития РПЖ являются возраст, расовая принадлежность, региональная зависимость заболеваемости, а также наличие отягощённого семейного анамнеза. Помимо этого, рядом исследований продемонстрировано влияние на частоту возникновения РПЖ и других факторов, таких, как гормональный статус организма, диета, факторы внешней среды и генетические особенности. Употребление в пищу жиров животного происхождения также является фактором риска развития РПЖ. В то же время получено доказательство того, что азиатская диета, богатая соей, морепродуктами, рисом, грибами шитаки, рыбой и зелёным чаем, оказывает некоторый защитный эффект, тем самым объясняя низкую заболеваемость РПЖ в странах Океании и Японии. Ещё одним фактором риска развития РПЖ является ожирение.
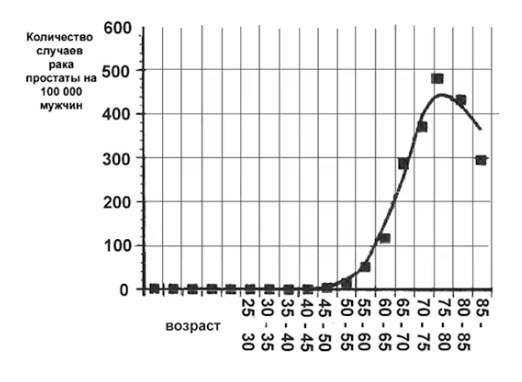
Данные многочисленных исследований продемонстрировали зависимость заболеваемости РПЖ от возраста и показали, что РПЖ редко встречается у мужчин младше 50 лет. Постепенное нарастание выявляемости отмечается с возрастом и достигает максимума к 80 годам. В возрастной группе старше 75 лет частота заболеваемости РПЖ по сравнению с мужчинами 50–54 лет выше в 20–80 раз. Очаги РПЖ при микроскопии находят у 30 % мужчин в возрасте 50–60 лет и у 70 % к 70–80 годам.
В результате активного внедрения в повседневную урологическую практику определения в сыворотке крови уровня ПСА, проведения БПЖ и новых методов диагностики РПЖ отмечается тенденция к улучшению результатов диагностики и лечения РПЖ. В свою очередь, средний возраст больных с впервые установленным диагнозом значительно снизился, что повлекло за собой увеличение процента выявления РПЖ на ранних стадиях (Т1-2). Ранняя диагностика РПЖ позволяет провести пациенту радикальное лечение на начальных стадиях развития заболевания: РПЭ, брахитерапию, дистанционную лучевую терапию, применить аблативные технологии (криоаблацию простаты, HIFU-терапию и др.). Тем не менее, несмотря на все успехи в диагностике и лечении РПЖ, существует ещё много проблем, которые предстоит решить в ближайшем будущем.
Анатомия и физиология предстательной железы
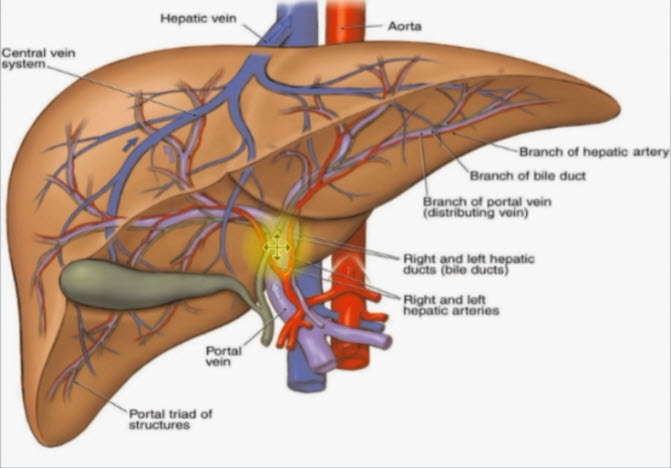
Предстательная железа – это непарный железисто-мышечный орган, который окружает простатическую часть мочеиспускательного канала и располагается между сфинктером мочевого пузыря и мочеполовой диафрагмой. Простата вырабатывает слабощелочной вязкий секрет, который составляет до 30–35 % объёма семенной жидкости. По форме ПЖ напоминает каштан. Длина ПЖ – 4–4,5 см, ширина 2,5–3 см, толщина 1,2–2 см. Объём простаты в норме – примерно 20–25 см3. Увеличение объёма ПЖ часто наблюдается при ДГПЖ, которая развивается в пожилом и старческом возрасте.
Со всех сторон ПЖ окружена соединительнотканной капсулой, которая является продолжением прямокишечной перегородки. В ПЖ выделяют основание, верхушку, переднюю, заднюю и боковые поверхности. Передняя поверхность простаты фиксирована к симфизу лобково-предстательной связкой. В непосредственной близости от связки располагается простато-везикулярное венозное сплетение (так называемый дорзальный венозный комплекс), которое принимает кровь от ПЖ, мочевого пузыря, семенных пузырьков и семявыносящего протока. Задняя поверхность ПЖ интимно прилежит к передней стенке прямой кишки, между ними располагается тонкий слой жировой клетчатки между двумя слоями соединительнотканной перегородки (фасция Денонвилье). По средней линии задней поверхности располагается срединная борозда, которая делит простату на правую и левую доли. К заднему участку основания ПЖ прилежат нижние отделы семенных пузырьков и ампулы семявыносящих протоков. Выводные протоки указанных образований открываются в центральной части семенного бугорка, располагающегося в средней части простатического отдела уретры. Паренхима ПЖ состоит из альвеол, которые группируются в 30–50 долек, окруженных фиброзно-мышечными перегородками. Каждая долька формирует проток, открывающийся на боковой поверхности семенного бугорка (рис. 1). Кровоснабжение ПЖ осуществляется через предстательно-пузырные артерии, которые делятся на нижние мочепузырные артерии, снабжающие кровью основание мочевого пузыря и нижний отдел мочеточника, и предстательные артерии, питающие ПЖ. У основания простаты предстательная артерия разветвляется, образуя главную заднебоковую ветвь, питающую основную часть железы, и переднюю ветвь, снабжающую кровью её переднебоковые отделы (рис. 2).
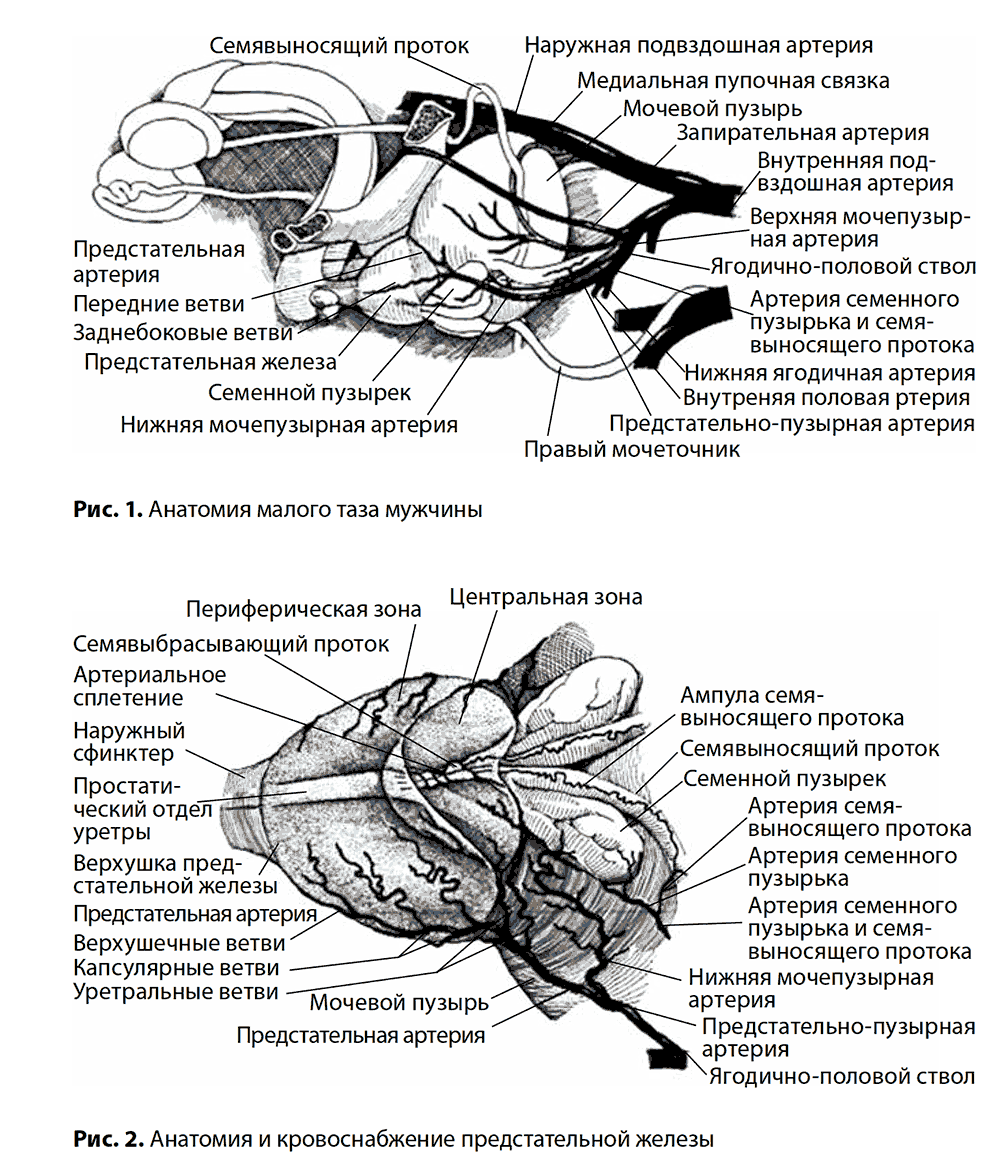
ПЖ иннервируется из простатического нервного сплетения. Лимфоотток осуществляется во внутренние подвздошные, крестцовые, околомочепузырные и наружные подвздошные лимфатические узлы.
По классификации Lously выделяют пять долей ПЖ: переднюю, заднюю, среднюю и две боковые доли. Позже G. Мc Nеаl предложил различать периферическую, центральную и переходную зоны, а также передний сегмент и зону сфинктера мочевого пузыря. В широкой урологической практике пользуются упрощенной схемой зональности ПЖ, где выделяют центральную, периферическую, переходную зоны и фибромускулярную строму (рис. 3).
Секрет ПЖ имеет сложный биохимический состав. Он принимает участие в разжижении эякулята с помощью протеолитических ферментов и, в частности, кислой фосфатазы, оказывает буферное и ферментативное воздействие на эякулят в целом, активизирует движение сперматозоидов. ПЖ выполняет также барьерную функцию, препятствуя проникновению бактериальных агентов из мочеиспускательного канала в паренхиму простаты и верхние мочевые пути. Содержащиеся в секрете ПЖ цинк-пептидные комплексы, лизоцим, факторы клеточного иммунитета, IgA, IgG и IgM обеспечивают выполнение этой функции.
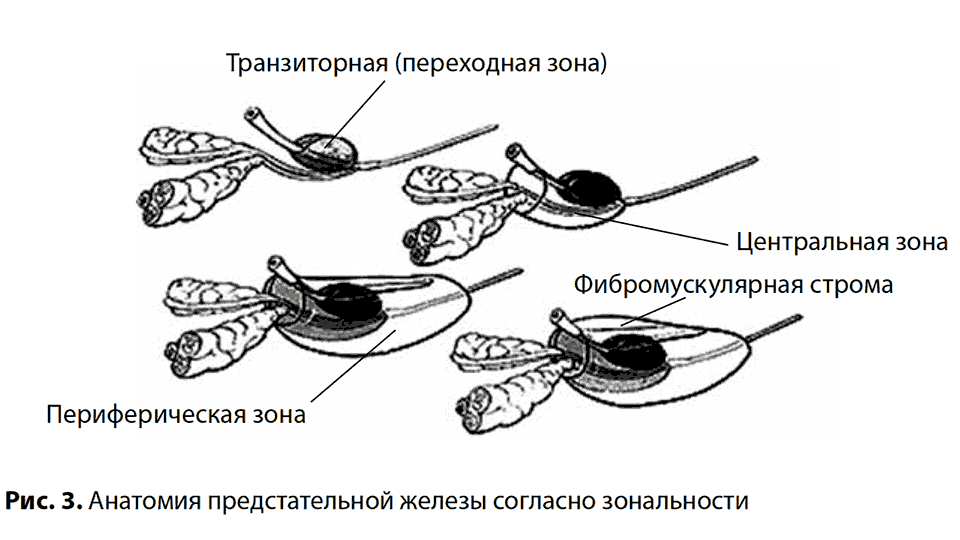
Общая характеристика и классификация рака предстательной железы
Как известно, РПЖ имеет мультифокальный рост и в 70 % случаев локализуется в периферической зоне, в 25 % – в центральной и около 5 % – встречается в переходной зоне простаты. Как отмечено выше, заболевание редко встречается у мужчин моложе 50 лет. Вместе с тем, многочисленные аутопсийные исследования у мужчин в возрасте 30–40 лет примерно в 20 % случаев показали наличие микроскопических очагов латентного рака в простате. Поскольку такие микроскопические опухоли растут крайне медленно, то клинически заболевание не проявляется. Со временем очаги латентного рака постепенно увеличиваются. Принято считать, что по достижении опухоли объема 0,5 см3 новообразование становится клинически значимым и требует проведения соответствующего лечения. Наиболее распространенной злокачественной опухолью простаты является ацинарная аденокарцинома.
Помимо ацинарной аденокарциномы простаты выделяют:
1) протоковую аденокарциному;
2) муцинозную (коллоидную) аденокарциному;
3) перстневидно-клеточную аденокарциному;
4) карциному с плоскоклеточной дифференцировкой;
5) базально-клеточную карциному;6) уротелиальную карциному в простате; 7) нейроэндокринные опухоли простаты:
— мелкоклеточную карциному;
— карциноид;
— крупноклеточную нейроэндокринную карциному;
8) саркоматоидную карциному;
9) лимфоэпителиомноподобную карциному;
10) недифференцированную карциному.
Основным методом диагностики РПЖ является гистоморфологическая оценка биопсии простаты, включающая оценку архитектурных, цитологических и некоторых сопутствующих признаков. Среди наиболее распространенных морфологических признаков аденокарциномы простаты выделяют: нарушение архитектоники желез, крупные гиперхромные ядра, хорошо видимые ядрышки, фигуры митоза и апоптотические тельца, амфофильную цитоплазму, голубой муцин, наличие розового аморфного секрета и кристаллоидов. Оценку степени дифференцировки аденокарциномы простаты проводят согласно шкале Глисона. Первоначальная система градации, предложенная Дональдом Глисоном в 1965 г., претерпела несколько пересмотров. Наиболее значимыми были пересмотры 2005 и 2012 гг. (рис. 5).
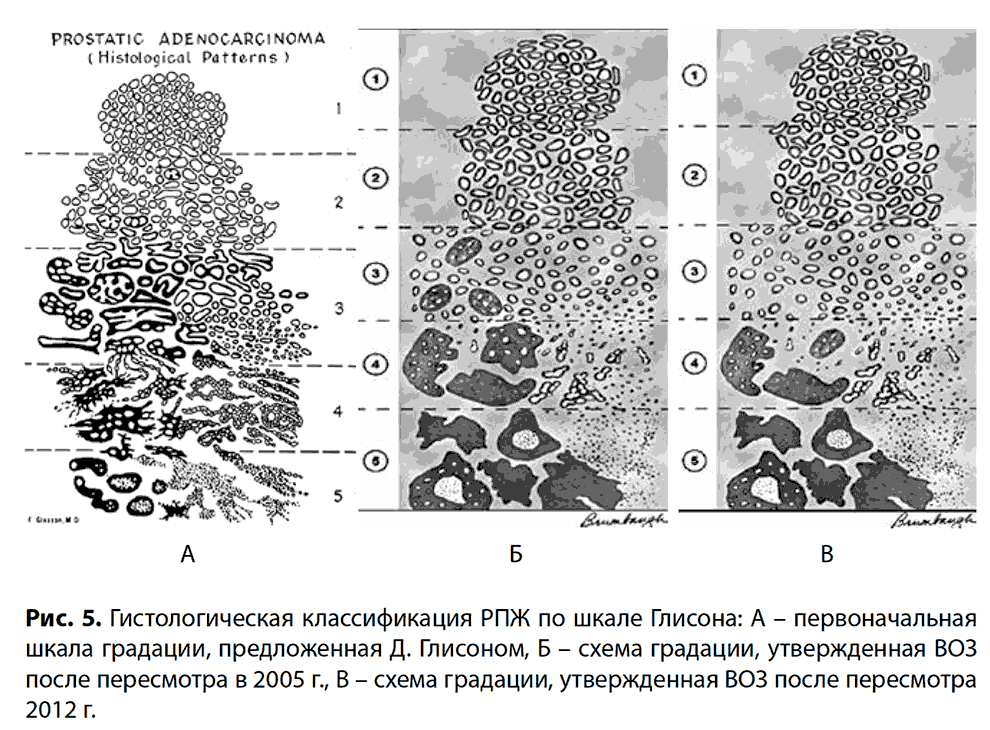
Классификация аденокарциномы простаты по шкале Глисона основывается на разнице в архитектонике железистых структур опухоли.
Выделяют пять степеней градаций (грейдов).
Грейд 1 представляет собой ограниченный узел, состоящий из плотно расположенных, одинаковых по форме (от круглых до овальных), хорошо сформированных желез с отсутствием или минимальной инфильтрацией ими окружающей стромы простаты. Использование этих строгих критериев достаточно редко и спорно в современной практике, требует выполнения иммуногистохимического типирования и достаточно часто описывается как атипичная аденоматозная гиперплазия. В настоящее время грейд 1 не используется в диагностике РПЖ.
Грейд 2 – узел с минимальной периферической инфильтрацией стромы, состоящий из мелких, одинаковой формы, менее тесно расположенных желез. Встречается редко и, как правило, обнаруживается в переходной зоне простаты. Обычно грейд 2 связан с более высоким грейдом и может быть рассмотрен как вторичный паттерн в образцах, полученных после трансуретральной резекции простаты. В настоящее время грейд 2 не рекомендован для использования при биопсии простаты, так как в биопсийном материале данная архитектоника не может быть оценена в полном объеме и имеет низкую воспроизводимость среди патологов, а также имеет низкую корреляцию с последующей оценкой образцов радикальной простатэктомии и может вводить в заблуждение врачей и пациентов предположением о низкой агрессивности опухоли.
Грейд 3 – наиболее распространенный паттерн. Представлен преимущественно более мелкими и хорошо сформированными, ограниченными стромой железами, которые проникают между доброкачественными протоками и ацинусами. Железы, как правило, меньше, чем в грейдах 1 и 2. Включение мелких крибриформных структур в паттерн 3 длительное время являлось довольно спорным, так как большинство экспертов включали все крибриформные структуры в грейд 4. В 2012 году данное решение о переносе всех крибриформных структур в грейд 4 было принято и утверждено к применению международным обществом патологов.
Грейд 4 наиболее широко представлен сливающимися, плохо сформированными железами. Тангенциальный срез желез 3-го паттерна может имитировать железы 4-го паттерна, что важно помнить при оценке образцов простаты, что обычно является основной причиной завышения балла при оценке биопсийного материала. В грейде 4 наиболее распространены решетчатые железистые структуры правильной и неправильной формы. Помимо этого встречаются так называемые гипернефроматоидные железы, представленные солидными пластами желез, состоящих из клеток с оптически светлой цитоплазмой.
Грейд 5 характеризуется отсутствием железистой дифференцировки. Он может быть представлен в виде солидных структур, шнуров клеток или единичных, в том числе перстневидных, опухолевых клеток. Также он включает в себя солидные решетчатые или папиллярные структуры с центральным комедонекрозом.
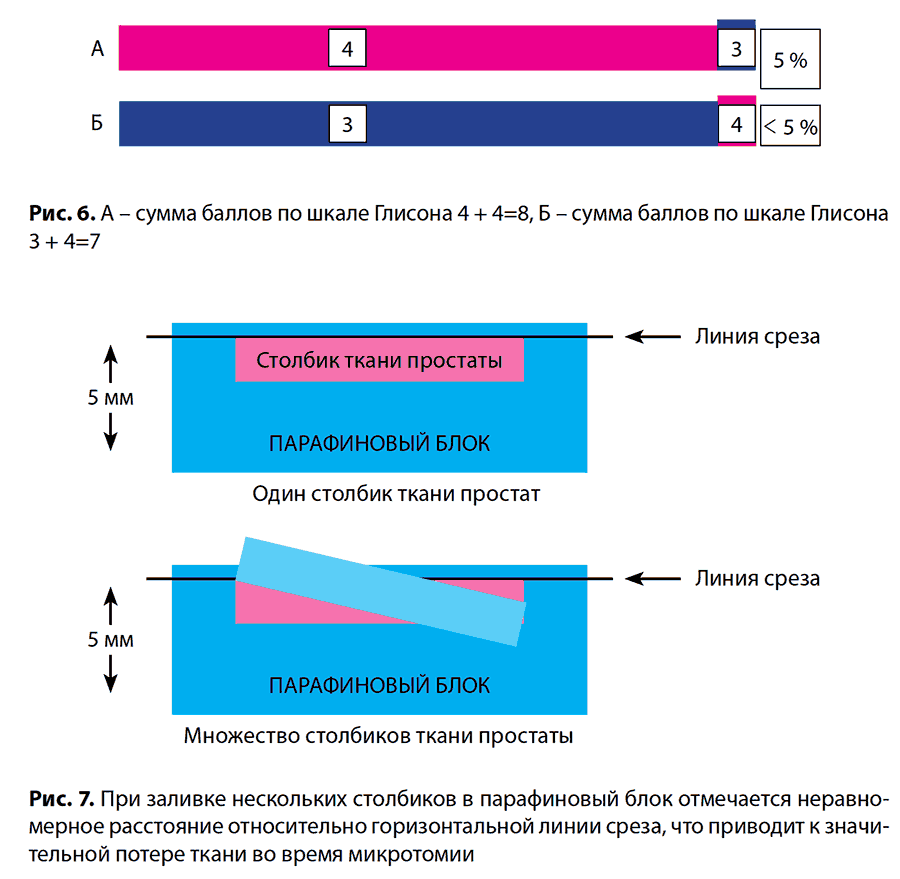
Для того, чтобы оценить степень дифференцировки опухоли по шкале Глисона, в биопсии простаты суммируют наиболее распространенный и наиболее тяжелый паттерн (грейд). Если наименее высокий паттерн встречается менее, чем в 5 % ткани, его не указывают в гистологическом заключении, но обязательно указывают более высокой паттерн, даже если он занимает менее 5 % исследованного материала (рис. 6).
Сумма баллов служит важным прогностическим критерием, позволяющим предположить скорость прогрессирования заболевания, метастазирования и прогнозировать выживаемость. Следует отметить, что для объективной оценки биопсийного материала и прогнозирования течения заболевания необходимо не менее 10–12 взятых биоптатов, размещение биоптатов в отдельные контейнеры (так называемое «картирование» биопсии ПЖ) с последующей заливкой в блок не более двух биоптатов. При этом длина каждого биоптата должна быть не менее 1 см. Существенным моментом также является профессионализм лаборантов, обеспечивающий надлежащую заливку и микротомию биопсийного материала. Множество столбиков в одной кассете приводит к неравномерной заливке парафином биопсийного столбика и может привести к потере значительного количества материала для гистологического исследования (рис. 7).
Несмотря на то, что система градации Глисона претерпела ряд изменений, до сих пор как у клиницистов, так и у пациентов существует множество вопросов в отношении прогноза течения заболевания. Например, показатели Глисона ≤ 6 могут быть расценены клиницистами как высокодифференцированная опухоль, а показатель Глисона 8–10 как одинаково низкодифференцированная опухоль. Сумма баллов 3+4=7 не тождественна сумме баллов 4+3=7, имеющей худший прогноз. Многочисленные исследования показали, что опухоли с показателем Глисона 7 значительно более агрессивны, чем новообразования с показателем Глисона ≤ 6 баллов. Некоторым больным с опухолями, соответствующими степени дифференцировки по Глисону ≤ 6, выбирается тактика активного наблюдения, в то время как с показателем Глисона 7 большинство урологов выбирают тактику активного лечения.
В ноябре 2014 г. в Чикаго состоялся экспертный совет, на котором была предложена новая система гистологической градации рака простаты. В обсуждении приняли участие 67 уропатологов из 21 страны мира, а также 20 урологов и онкоурологов, которые поддержали данную инициативу.
Консенсусом предложено использование прогностических групп, выделенных на основании суммы баллов по шкале Глисона, и их корреляции с пятилетней выживаемостью без биохимического рецидива. В исследовании приняли участие 5 крупных научно-практических центров (University of Pittsburgh, Memorial Sloan Kettering Cancer Center, Cleveland Clinic Foundation, Karolinska University, Johns Hopkins University), в анализ вошли 21 226 пациентов (табл. 1).

Таким образом, консенсусом, наряду с традиционной гистопатологической градацией опухоли по шкале Глисона, предложено указывать прогностическую группу, которая будет соответствовать сумме баллов по шкале Глисона:
• сумма баллов не более 6 – прогностическая группа I/V;
• сумма баллов 3+4=7 – прогностическая группа II/V;
• сумма баллов 4+3=7 – прогностическая группа III/V;
• сумма баллов 8 (4+4/3+5/5+3) – прогностическая группа IV/V;
• сумма баллов 9–10 (4+4/5+4/5+5) – прогностическая группа V/V.
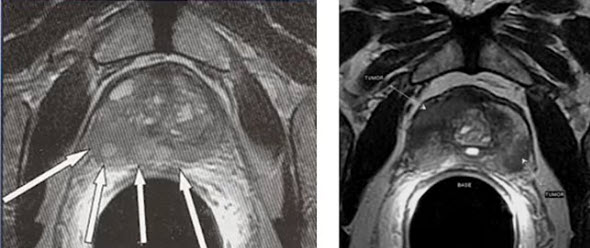
Ниже представлена схема оценки первичной опухоли согласно международной классификации РПЖ по системе TNM, которая была дополнена и пересмотрена в 2010 г. (рис. 8), где T1a – опухоль занимает ≤5 % материала после ТУРП, T1b – >5 % после ТУРП, T1c – опухоль выявлена при биопсии простаты, T2a – опухоль занимает менее половины одной доли простаты, T2b – одну долю простаты, T2с – обе доли простаты, T3a – опухоль выходит за пределы капсулы простаты с одной или с обеих сторон или определяется микроскопическая инвазия в шейку мочевого пузыря, T3b – определяется инвазия одного или обоих семенных пузырьков, T4 – опухоль вовлекает окружающие структуры: стенку мочевого пузыря, наружный сфинктер уретры, прямую кишку, леваторы, мышцы тазового дна.
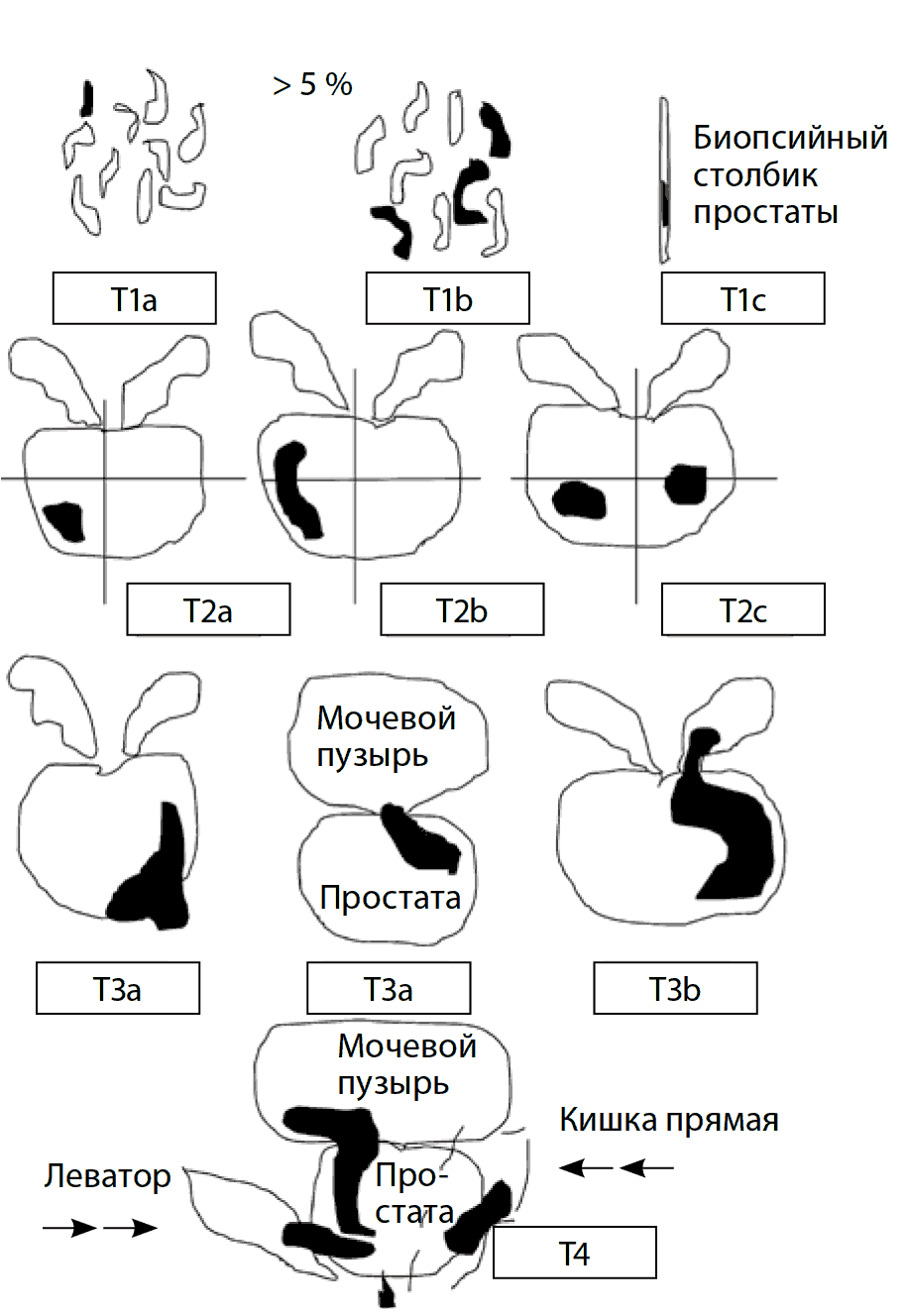
Рис. 8. Схематическая классификация рака предстательной железы по системе TNM (2010 г.)
Ранняя диагностика рака простаты
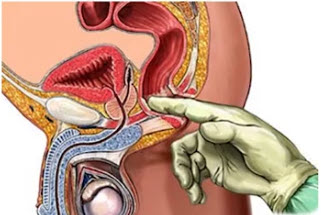
Пальцевое ректальное исследование
ПРИ – самый простой, дешёвый и безопасный метод диагностики РПЖ. ПРИ является обязательным при обследовании мужчин с наличием факторов риска РПЖ, но выполнение только ПРИ не может быть альтернативой показателю ПСА, так как основная масса опухолей ПЖ, выявляемых в ходе обследования, не определяется по данным ПРИ. Результаты исследования во многом определяются размерами опухоли, её локализацией, а также опытом и квалификацией врача. Данные, полученные при пальпации, не всегда легко интерпретировать, но малейшее подозрение является веским основанием для дальнейшего обследования больного и, в частности, для выполнения БПЖ. В среднем только в 1/3 случаев наличия пальпируемых узлов ПЖ впоследствии при биопсии морфологически верифицируют РПЖ (рис. 9).
Прогностическая ценность ПРИ довольно низкая. Еще в 1984 году G. W. Chodak и H. W. Schoenberg обследовали 811 отобранных пациентов в возрасте 50–80 лет, которым выполнялось ПРИ. 38 из 43 пациентов с обнаруженными изменениями по данным ПРИ была выполнена биопсия простаты. РПЖ был выявлен у 29 % обследуемых (11 из 38). В большинстве подобных исследований установлен 25 % уровень выявляемости РПЖ по результатам биопсии, выполненной в связи с обнаружением подозрительных участков по данным ПРИ. 68 % всех выявленных опухолей расценивались как клинически локализованные, однако только 30 % оказывались ограниченными пределами ПЖ после РПЭ. Группа исследователей показала, что у 25 % мужчин с распространённым РПЖ не имелось изменений по данным ПРИ. Таким образом, было определено, что чувствительность ПРИ составляет 55–69 %, специфичность – 89–97 %. Данные крупного исследования ERSPC продемонстрировали, что ПРИ не может использоваться в качестве метода скрининга РПЖ у пациентов с низким уровнем ПСА. Таким образом, ПРИ не является методом, достаточным для диагностики ранних стадий РПЖ, и не может быть рекомендовано в качестве основного метода постановки диагноза РПЖ.
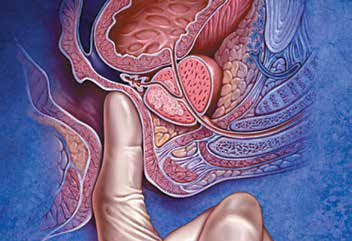
Рис. 9. Пальцевое ректальное исследование
Правильность трактовки результатов ПРИ во многом зависит от квалификации и опыта исследователя. Часто имеет место недооценка стадии, поскольку небольшие, расположенные в передних отделах железы опухоли, как правило, не пальпируются, а ложноположительные результаты наблюдаются у больных с ДГПЖ и простатитом. Этот метод, однако, иногда позволяет выявить РПЖ, когда уровень ПСА остается в пределах нормы, и представляет неточные, но полезные данные о стадии заболевания. Верно также утверждение, что РПЖ с наличием пальпируемых узлов имеет менее благоприятный прогноз, так как в этих случаях объём опухоли велик и имеется более высокая патологическая стадия заболевания, чем стадия Т1с, характерная для раковых опухолей, выявленных в ходе скрининга с использованием ПСА. Результаты ПРИ необходимо оценивать в комплексе с определением уровня ПСА и данными ТРУЗИ.
Трансректальное ультразвуковое исследование и гистосканирование предстательной железы
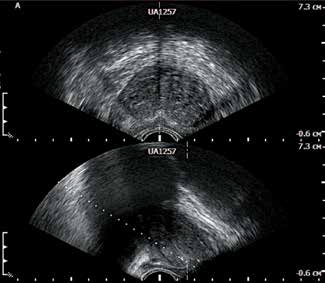
УЗИ органов малого таза получило широкое распространение, поэтому заслуживает наибольшего внимания. Около половины опухолей простаты диаметром более 1 см выявляется с помощью ультразвука. Особенно возрос интерес к исследованию с внедрением, начиная с 1968 года, ТРУЗИ, позволяющего точнее оценивать состояние ПЖ, а также определять её объём (рис. 10). С 1988 года повсеместно стала внедряться методика БПЖ под контролем ректального ультразвукового датчика, что позволило получать образцы тканей из подозрительных участков ПЖ. Тем не менее применение ТРУЗИ в качестве метода ранней диагностики РПЖ вызывает множество дискуссий ввиду его низкой специфичности и чувствительности. На основании опыта, суммированного R. L. Waterhouse и M. I. Resnick, было показано, что ТРУЗИ имеет низкую чувствительность и специфичность при скрининге. Чувствительность метода оказалась в пределах 71–92 % для РПЖ и 60–85 % для субклинических стадий болезни, специфичность колебалась в пределах 49–79 %. Исследование имело прогностическое значение в 30 % случаев. Чувствительность и прогностическая значимость ТРУЗИ как самостоятельного метода были выше по сравнению с ПРИ. Частота выявления рака среди ТРУЗИ-позитивных пациентов, у которых не выявлено изменений по данным ПРИ и исследования уровня ПСА, значительно ниже.
В связи с низкой специфичностью и чувствительностью ТРУЗИ отводят роль вспомогательного диагностического метода, используемого при наличии изменений в скрининговых тестах.
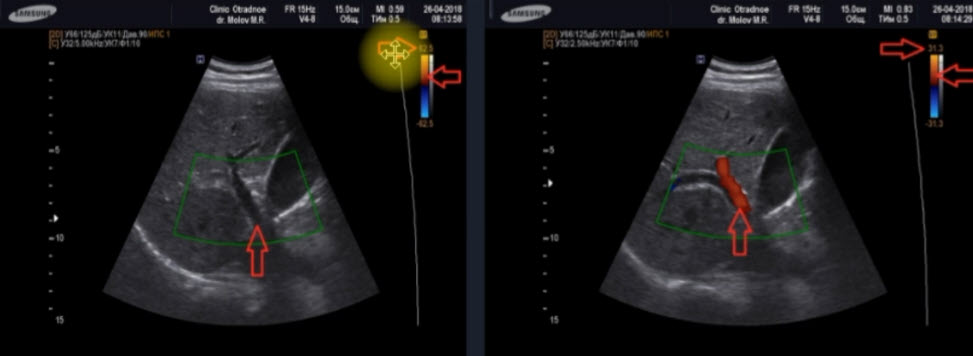
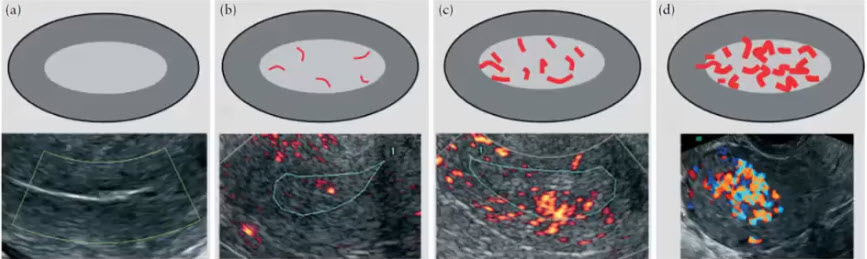
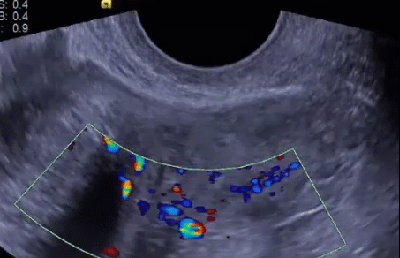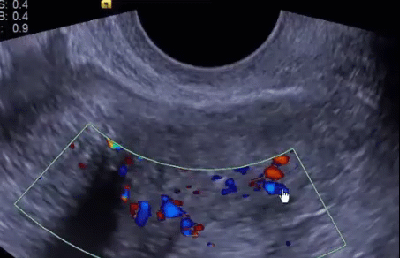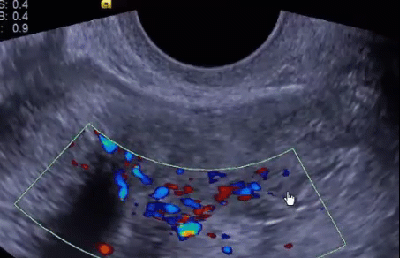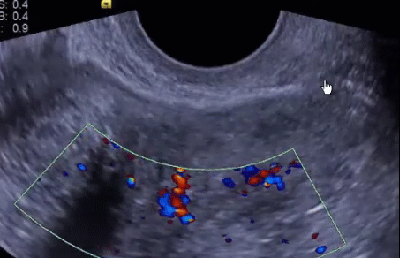
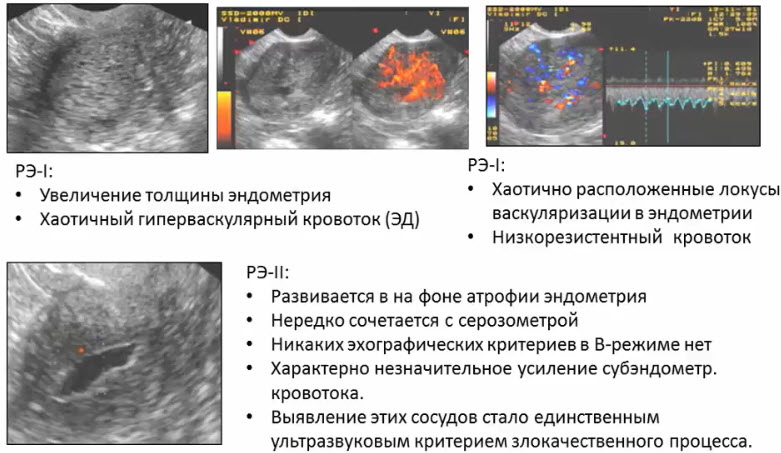
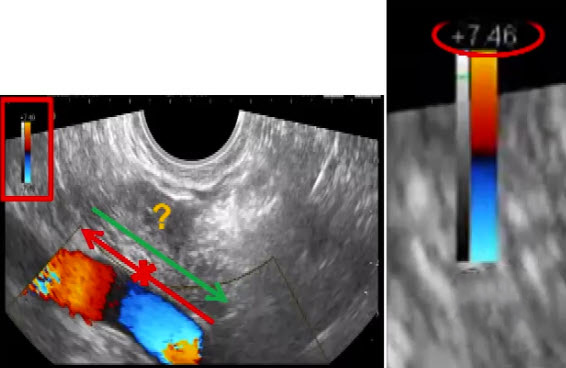
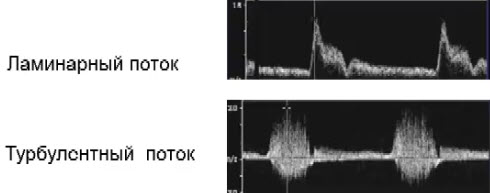
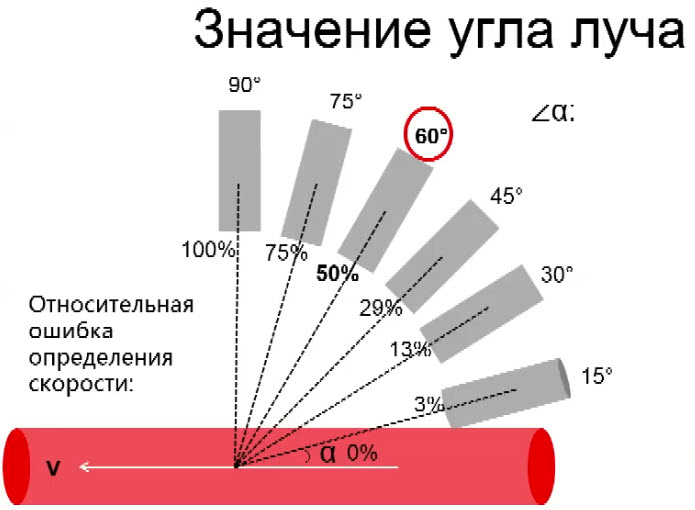
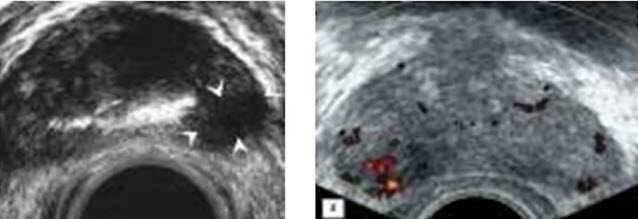
Научные и технические разработки последних лет привели к появлению новых технологий в ультразвуковой диагностике и, как следствие, современных ультразвуковых аппаратов с возможностью применения цветового эффекта Доплера, получения трехмерного изображения. При необходимости эффект Доплера может быть усилен введением контрастных средств. В настоящее время имеются данные ряда исследований по этой проблеме. Техническое усовершенствование стандартной методики ТРУЗИ стало возможным благодаря внедрению новых компьютерных технологий, программного обеспечения, развития микроэлектроники, что позволило создавать компактные ультразвуковые датчики с возможностями «искусственного интеллекта». Оценка так называемых серых зон ПЖ может быть облегчена с повышением рабочей частоты датчиков. Создание трехмерного изображения простаты по результатам ТРУЗИ или даже в режиме реального времени является другим перспективным направлением УЗИ. Область применения трехмерного УЗИ ПЖ обширна. Оно используется для точного измерения объёма простаты, избирательного взятия образцов железы во время биопсии, стадирования РПЖ и как метод контроля терапии. Ценность трёхмерного сканирования может быть повышена при совместном контрастном усилении или допплерографии ПЖ. Дополнительная информация о васкуляризации тканей ПЖ может повысить выявляемость РПЖ. Участки, пораженные опухолью, отличаются гиперваскуляризацией. Одним из дополнительных факторов прогноза РПЖ является плотность микрососудов в биоптатах простаты, пораженных раком. В результате нарушения кровоснабжения и кровотока происходит нарушение структуры ткани железы. Эти изменения могут регистрироваться с помощью доплеровской ультрасонографии, что повышает диагностические возможности ТРУЗИ. Доплеровская ультрасонография в зависимости от типа сканирования может быть цветовой и усиленной. Цветовая доплеровская ультрасонография позволяет визуализировать кровоток в режиме реального времени. Эта методика дает возможность оценить локальную васкуляризацию и выявить участки с нарушенным кровоснабжением. Усиленная доплеровская ультрасонография является одним из наиболее современных методов ультразвуковой диагностики (рис. 11). При использовании этого метода мельчайшие нюансы яркости цветового сигнала преобразуются в энергию доплеровского сигнала, который зависит от количества эритроцитов, активированных доплеровским эффектом. Усиленная доплеровская ультрасонография обладает большей чувствительностью в диагностике РПЖ. Тем не менее любые методики доплеровской ультрасонографии малоэффективны при оценке органов с низким кровотоком или органов, кровоснабжающихся сосудами небольшого диаметра. Эти факторы лимитируют широкое применение доплеровской ультрасонографии в диагностике РПЖ. Возможно, внедрение ультразвуковых контрастных средств приведет к улучшению визуализации кровоснабжения ПЖ как органа с низкой скоростью кровотока. Это позволит повысить информативность описанных выше методик ТРУЗИ.
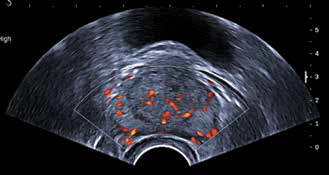
Рис. 11. Доплеровская ультрасонограмма
Несмотря на высокие темпы развития методов визуализации ткани ПЖ, в том числе и лучевой диагностики, одной из самых актуальных проблем при выявлении РПЖ остается сложность визуализации опухолевых очагов. Вследствие этого БПЖ порой выполняется лишь на основании повышенного ПСА, используя ТРУЗИ, что далеко не всегда позволяет дифференцировать подозрительные участки, поэтому забор материала производят из стандартных зон. Существует альтернатива – биопсия под контролем МРТ, но она технически и организационно довольно сложна и требует значительно больших временных и финансовых затрат.
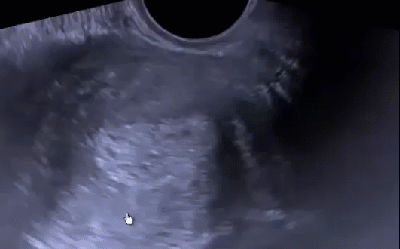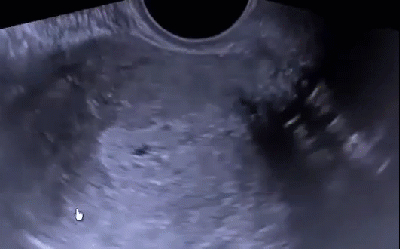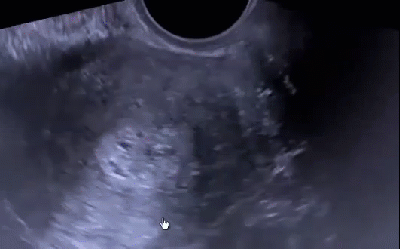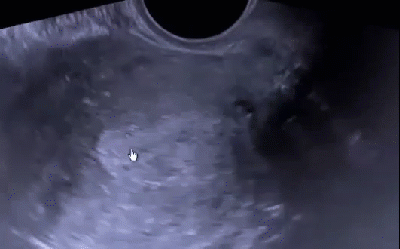
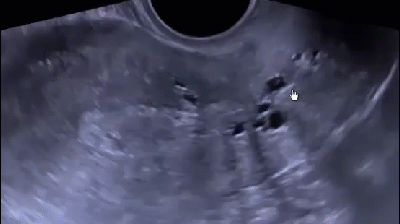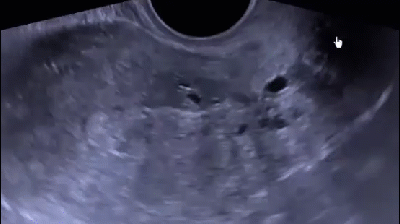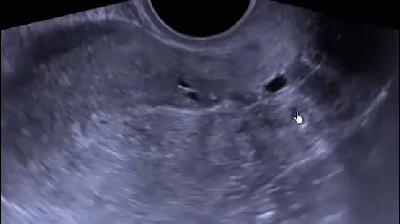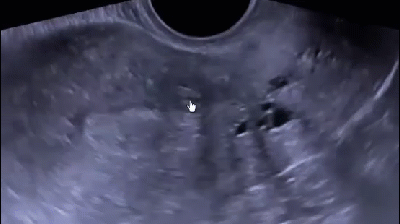
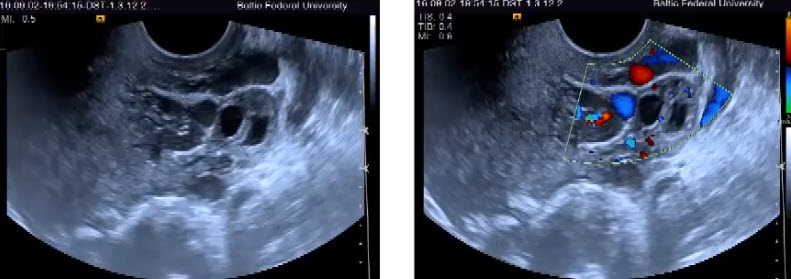
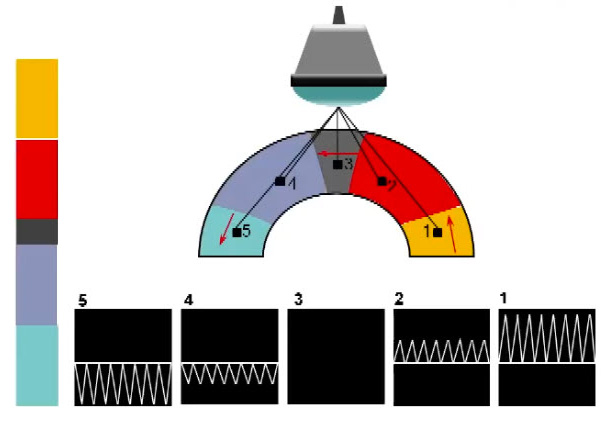
В последнее время активно внедряется методика гистосканирования (HistoScanning) ПЖ – более чувствительный и специфичный метод по сравнению с ТРУЗИ (рис. 12). Первое исследование по оценке эффективности HistoScanning включало 29 пациентов с подтвержденным диагнозом РПЖ. HistoScanning выполняли до РПЭ и его результаты сравнивали с послеоперационными гистологическими препаратами с шагом секции 5 мм. После анализа специалистами представленных данных стало понятно, что описанной работе присуща некоторая предвзятость, так как было достоверно известно, что у всех включенных пациентов имелся РПЖ. Поскольку в исследованиях подобного типа предвзятость неизбежна, авторы также обращали внимание на такие ключевые параметры, как локализация опухоли, максимальный размер основного опухолевого очага, мультифокальность, сторона поражения и экстрапростатическое распространение. Исследователи заявили о 100 % совпадении в отношении мультифокальности и стороны расположения опухоли.
Впоследствии были проведены крупные исследования по оценке диагностической эффективности системы HistoScanning. В настоящее время «положительными» считаются образования ПЖ, выявленные с помощью HistoScanning, объёмом более 0,2 мл. Histoscanning показывает 75 % чувствительность в отношении выявляемости РПЖ и определения локализации опухолевых очагов, в 64 % случаев – хорошую корреляцию в отношении объёма опухолевого поражения. Показатель чувствительности метода существенно выше для стадии pT3 (92 %) по сравнению с pT2 (59 %). Выявляемость РПЖ при гистосканировании зависит от степени дифференцировки ткани опухоли: например, для опухолей со степенью дифференцировки по Глисону 6 баллов – 50 %, 7 баллов – 74 % и 8–10 баллов – 100 %. Аналогичная ситуация наблюдается и в отношении размера опухолей. Histoscanning правильно определяет наличие малых (<1 мл) опухолей в 60 % случаев, а новообразований среднего и большого (> 5 мл) размера – в 87 и 82 % случаев соответственно. В последнее время активно изучается методика выполнения трансректальной БПЖ под контролем HistoScanning. Первые немногочисленные данные показывают значительные преимущества этой методики над традиционным ТРУЗИ в отношении выявляемости РПЖ.
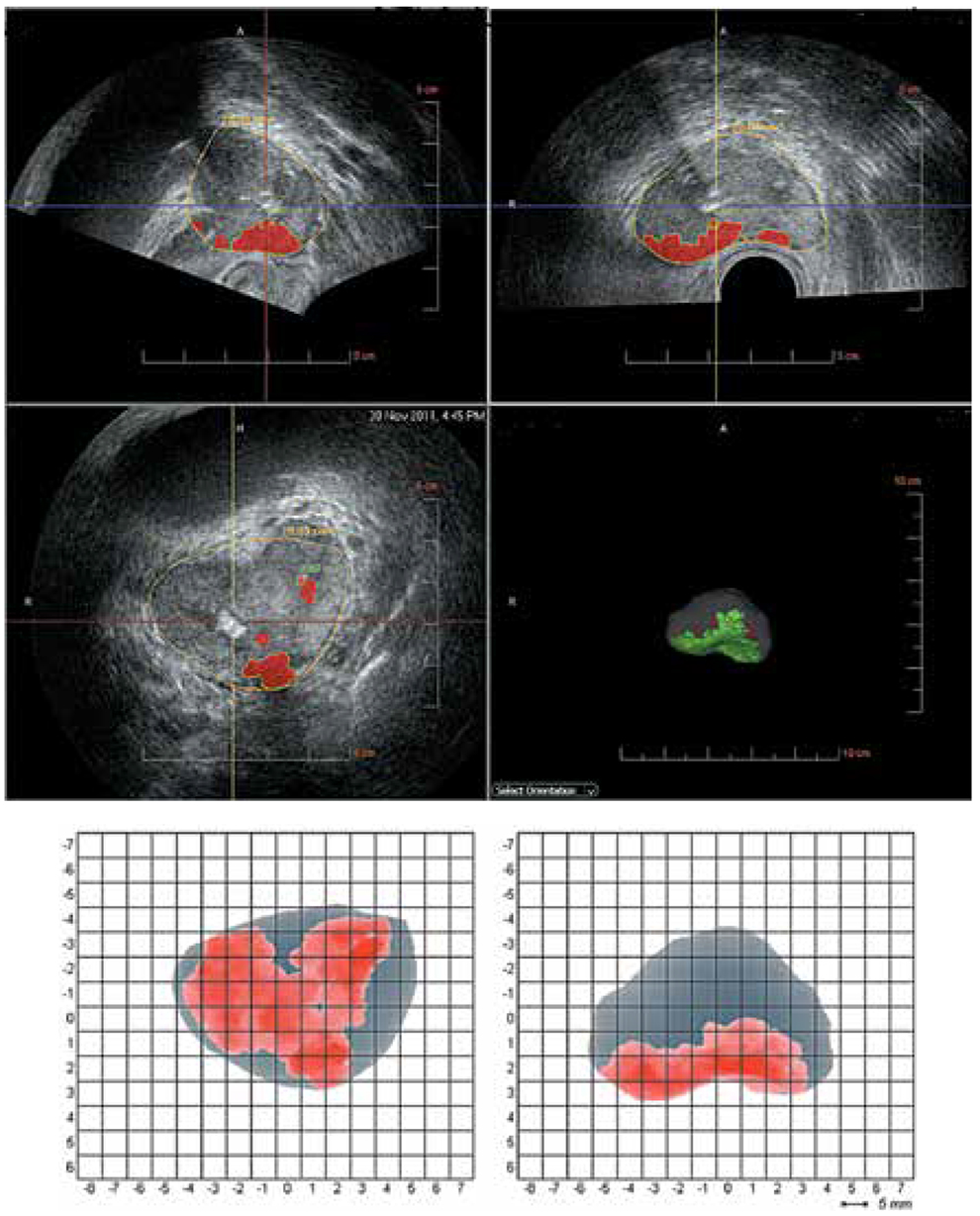
Рис. 12. Пример изображений, получаемых с помощью HistoScanning
Сегодня данные гистосканирования также используются при планировании нерво сберегающей РПЭ, а также малоинвазивных методов лечения, таких как брахитерапия, криоаблация, HIFU, фотодинамическая терапия или радиочастотная аблация простаты. Также в перспективе методика может позволить контролировать эффективность фокальной терапии.
Резюмируя вышесказанное, гистосканирование – относительно недорогой, неинвазивный метод, улучшающий диагностику РПЖ и эффективность БПЖ.
Простатспецифический антиген и биопсия предстательной железы
ПСА – это мономерная молекула с одной полипептидной цепочкой, состоящая из 237 аминокислот и нескольких дисульфидных мостиков. Этот гликопептид состоит на 93 % из аминокислот и на 7 % из карбогидратов. Ген, кодирующий ПСА (KLK3), располагается в длинном плече 19-й хромосомы и имеет 5 экзонов, 4 интрона, 2 запускающих участка. Так как ПСА относится к протеазам, его точкой приложения являются 2 белка жидкости семенных пузырьков (семиногелин 1 и 2) и фибринонектин семенной жидкости, что проявляется ее разжижением. Другие данные свидетельствуют, что ПСА может влиять на инсулиноподобный фактор роста (IGF) и способен связываться с ингибитором С-протеина. ПЖ постоянно секретирует ПСА, основная часть которого выбрасывается в семенную жидкость, и только незначительная часть попадает в ток крови.
В сыворотке крови содержатся такие формы ПСА, как свободный ПСА (свПСА или f-PSA), связанный ПСА (сПСА или c-PSA) с а1-антихимотрипсином (ПСА-АХТ-комплекс) и с а2-макроглобулином. Именно определение и сумма концентраций двух его форм в сыворотке крови (свПСА и ПСА-АХТ-комплекс) позволяет выявить концентрацию рутинного урологического маркера – общего ПСА (оПСА или t-PSA). Последние исследования, посвященные изучению свПСА, привели к обнаружению трёх его форм, которые являются энзиматически неактивными: проПСА, ДПСА (ВPSA) и инПСА (intact-PSA). ПроПСА будет подробно освещен в следующей главе ввиду его диагностической значимости. ДПСА или доброкачественная фракция свПСА является маркёром ДГПЖ и повышение этой фракции до 50 % свПСА свидетельствует о доброкачественном процессе в ПЖ. ИнПСА является неактивной фракцией свПСА. Клинические исследования показали, что соотношение инПСА/свПСА в случае РПЖ несколько выше, но полученные данные не позволяют с уверенностью рекомендовать инПСА в качестве рутинного маркёра РПЖ. В настоящее время принято считать, что высокий уровень оПСА сыворотки крови даёт основание подозревать наличие РПЖ. Общепринятым пороговым значением оПСА является 4 нг/мл, при превышении которого показано выполнение БПЖ. Однако многими исследователями показано преимущество снижения порогового значения оПСА до 3,0 и 2,0 нг/мл, при котором повышается выявляемость РПЖ по данным БПЖ. В то же время существуют данные, что снижение порогового значения увеличивает количество негативных БПЖ и увеличивает выявляемость клинически незначимых случаев РПЖ. Уровень значений оПСА в диапазоне 2,0–10,0 нг/мл часто сочетается с низкой выявляемостью РПЖ (менее 30 %). Эти границы принято называть «серой зоной», так как в пределах этих значений врачам порой трудно принять решение в отношении дальнейшего обследования пациента. С целью повышения диагностической ценности оПСА, особенно в случае диагностического поиска ранних форм РПЖ, используется целый ряд индексов: отношение свПСА/оПСА ( %свПСА), плотность ПСА (ПСАD), скорость прироста ПСА (ПСАV), уровень оПСА с учетом возраста и др.
После проведения ряда исследований доказано, что учёт норм оПСА в зависимости от возраста приводит к увеличению числа выявляемых случаев РПЖ у молодых мужчин и минимизирует количество выявленных случаев клинически незначимого РПЖ у пожилых пациентов. На основании большого контингента обследованных J. E. Oesterling и соавт. составили таблицу зависимости уровня оПСА от возраста: использование этих данных позволяет повысить чувствительность и специфичность теста (табл. 2).
Таблица 2. Значение норм оПСА с учетом возраста

Определение ПСАV является ценным методом оценки риска развития РПЖ. Считается, что для получения максимальной пользы от данного параметра должны быть оценены последние 3 показателя оПСА за 2-летний период или по крайней мере данные с интервалом 12–18 месяцев. Показатель ПСАV ≥ 0,75 нг/мл/год характерен для РПЖ.
С возрастом отмечается повышение оПСА, что может быть обусловлено увеличением объёма ПЖ за счёт ДГПЖ. Поскольку на значение оПСА влияет не столько возраст пациента, сколько объём простаты, учитывать его необходимо, так как в половине случаев РПЖ встречается вместе с ДГПЖ. Для этой цели используется показатель плотности ПСА – ПСАD, который вычисляется по формуле:
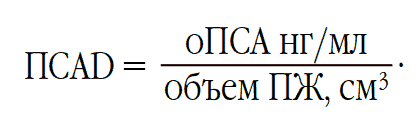
Значение ПСАD в «нормальной» ПЖ не должно превышать 0,15 нг/мл/см3. Превышение порогового значения с высокой вероятностью свидетельствует в пользу наличия РПЖ.
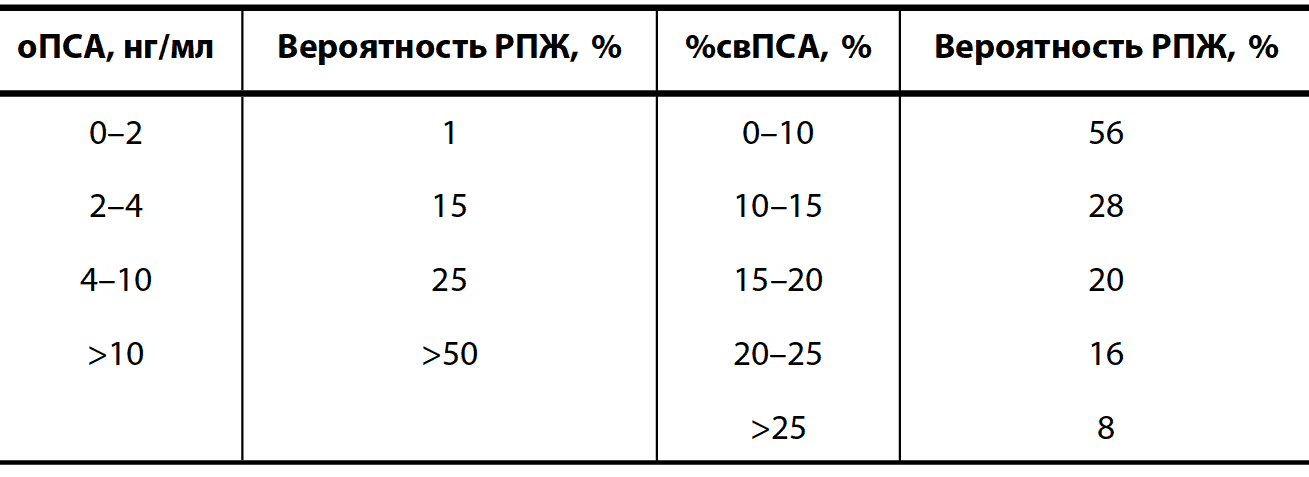
Ценным показателем для обследования урологического пациента является %свПСА. Многими исследователями показано, что %свПСА оказывается ниже в группе РПЖ по сравнению с группой ДГПЖ. Пороговым значением в настоящее время считается 20 %, ранее – 15 %. При значениях %свПСА ниже порогового показано выполнение БПЖ. Наибольшую диагностическую ценность этот тест имеет при значениях оПСА в «серой зоне» (2,0–10,0 нг/мл). К примеру, средняя вероятность выявления РПЖ по результатам БПЖ при оПСА в «серой зоне» – 20 %, а вероятность наличия РПЖ при %свПСА в диапазоне от 10 до 20 % – 24 % (табл. 3).
Известно, что оПСА является органоспецифическим маркёром и может повышаться при различных заболеваниях ПЖ (ДГПЖ, остром или хроническом простатите), после различных диагностических манипуляций (ПРИ, массажа простаты, цистоскопии, ТРУЗИ и др.) и ранее перенесённых операций (ТУРП, БПЖ и др.). Временной промежуток после ПРИ и других инвазивных манипуляций до определения в сыворотке ПСА – 2–3 недели, после обострения простатита или оперативного лечения – 1 месяц.
Таблица 3. Вероятность наличия РПЖ на основании оПСА и %свПСА
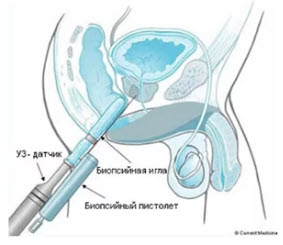
В настоящее время трансректальная мультифокальная БПЖ под ультразвуковым контролем является «золотым стандартом» ранней диагностики РПЖ (рис. 13).
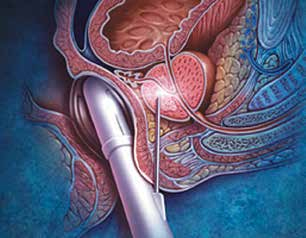
Рис. 13. Трансректальная биопсия простаты с использованием ультразвукового датчика
Показаниями к выполнению трансректальной БПЖ являются:
1) повышение уровня оПСА или низкие значения %свПСА;
2) подозрительные на рак данные ПРИ;
3) обнаружение гипоэхогенных зон в ткани ПЖ по данным ТРУЗИ;
4) сочетание указанных факторов.
Имеется ряд научных работ, согласно которым диагностическая ценность данной методики значительно выше по сравнению с БПЖ под контролем пальца или трансперинеальным (несатурационным) доступом.
Несмотря на то, что секстантная БПЖ продолжает применяться в урологической практике, показано, что данный метод имеет ряд недостатков вследствие недостаточного охвата периферической зоны ПЖ. В настоящее время мультифокальная БПЖ из 12 точек с латеральным направлением вколов в периферическую зону является рекомендуемой и выполняется в ведущих урологических клиниках мира. Существуют многочисленные данные, свидетельствующие, что биопсия из 12 точек улучшает выявляемость РПЖ на 24–38 % по сравнению с секстантной, а также показывает более высокую вероятность совпадения суммы баллов по шкале Глисона при биопсии и РПЭ, возможность дооперационной идентификации одно- или двустороннего поражения. Для определения достаточного числа образцов ткани и достижения наилучшей выявляемости РПЖ в зависимости от объёма ПЖ и возраста предложена Венская номограмма, которая может использоваться урологами при планировании БПЖ (табл. 4).
Таблица 4. Венская номограмма: число пункций в зависимости от возраста и объёма ПЖ
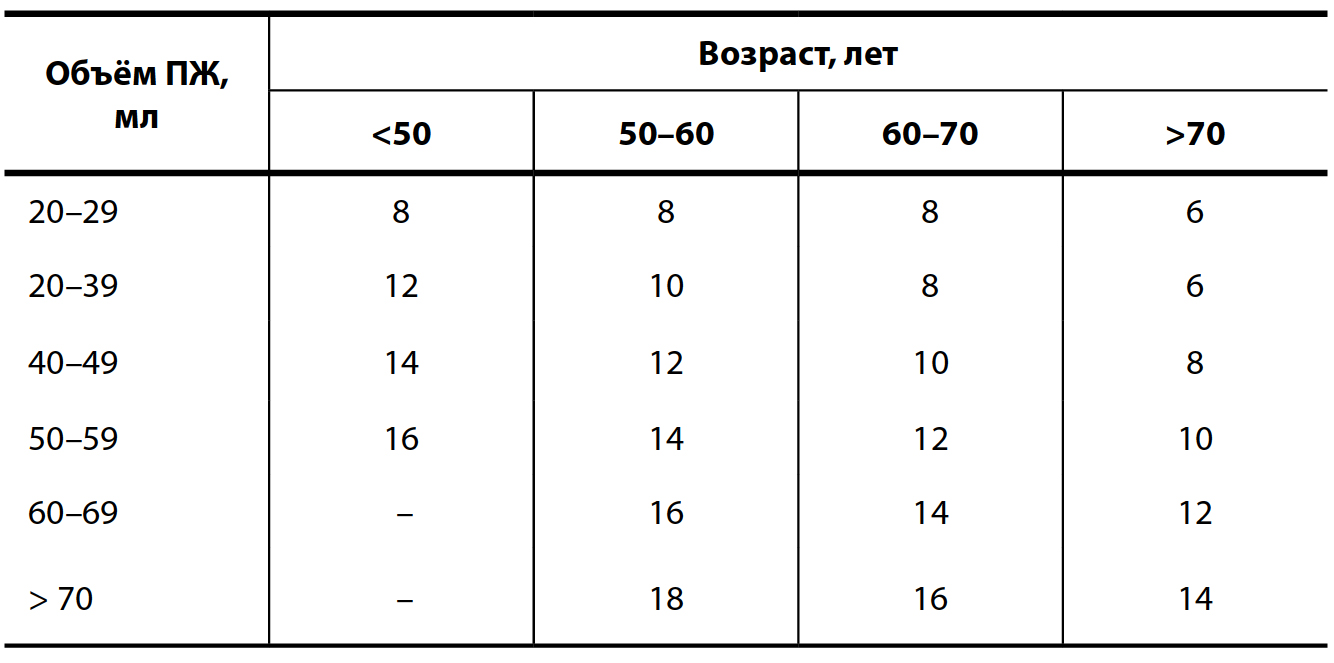
Перед выполнением трансректальной БПЖ все пациенты должны получить подробную информацию о биопсии, диагностической ценности разных способов биопсии, её осложнениях и методах их лечения. Пациенты должны также подписывать информированное согласие на проведение диагностической манипуляции. Перед биопсией выполняют очистительную клизму. За несколько дней отменяют приём антиагрегантов или антикоагулянтов. Профилактическая антибактериальная терапия таблетированными фторхинолонами или цефалоспоринами назначается в день манипуляции и продолжается в течение последующих 3–5 дней.
Помимо данных об общем состоянии пациента особое внимание уделяют проведению ПРИ, которое выполняют в положении пациента лёжа на левом боку с приведенными к груди коленями. При осмотре, как правило, используют гель с 2 % лидокаином («Катеджель»). В процессе осмотра оценивают размеры, форму, консистенцию ПЖ, особое внимание уделяют наличию очаговых уплотнений её ткани, выраженности срединной борозды, наличию болезненных при пальпации участков, наличию спаянности простаты с окружающими тканями, уплотнений в зоне семенных пузырьков.
После ПРИ в прямую кишку вводится ректальный ультразвуковой датчик (рис. 14). При ТРУЗИ проводят сканирование ПЖ в двух проекциях: в поперечном направлении, при этом производится измерение наибольшего переднезаднего и поперечного размеров ПЖ, а также в сагиттальном направлении с измерением наибольшего продольного размера простаты. Выполнение ультразвукового сканирования в двух проекциях позволяет автоматически рассчитывать объём ПЖ.
При секстантной БПЖ проводится забор столбиков ткани по парасагиттальной линии посередине между междолевой бороздкой и боковой границей ПЖ из основания, средней части и верхушки каждой доли под углом 45° (рис. 15).
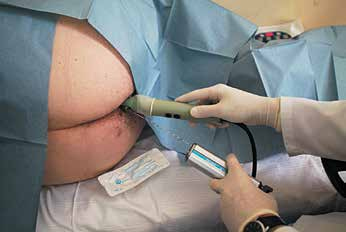
Рис. 14. В прямую кишку введён ректальный ультразвуковой датчик. Выполняется биопсия простаты с использованием автоматического устройства для биопсии PROMAG 2.2
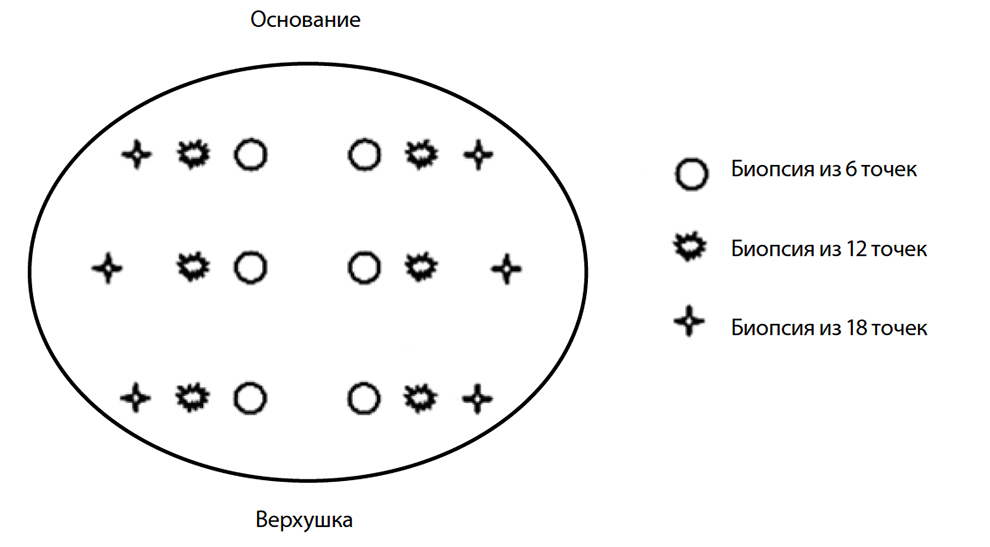
Рис. 15. Схематическое расположение мест пункции ПЖ при биопсии из различного числа точек
При биопсии из 12 точек места дополнительных пункций располагаются между стандартными вколами и латеральной границей соответствующей доли ПЖ. Пункция периферической зоны в данном случае производится под углом около 30°.
При мультифокальной биопсии из 18 точек между местом вкола при секстантной биопсии и боковой границей простаты осуществляется по 2 дополнительных вкола. При этом вторая дополнительная пункция производится под более острым углом – 20–25°.

Рис. 16. Контейнер для гистологического материала
Биоптаты маркируются раздельно и помещаются в специальные контейнеры, где фиксируются в 10 % формалине (рис. 16). Затем морфологи погружают каждый биоптат в парафин и выполняют продольные срезы с шагом 3 µm. На стекле располагают четыре серийных среза каждого кусочка. Препараты окрашивают гематоксилином и эозином.
При морфологическом исследовании биопсийного материала оценивают:
1) наличие или отсутствие злокачественной опухоли простаты;
2) сторону и локализацию поражённых опухолью столбиков ткани;
3) степень дифференцировки опухоли по шкале Глисона;
4) процент поражённой опухолью ткани;
5) при отсутствии карциномы ПЖ оценивают наличие участков простатической интраэпителиальной неоплазии (ПИН), мелкоацинарной атипической пролиферации (ASAP), а также участков атипии желез или хронического воспаления.
Частота развития осложнений после трансректальной БПЖ невысока (табл. 5). К ним относятся боль, острый простатит, гематурия, гемоспермия. Серьёзные осложнения после трансректальной БПЖ наблюдаются менее чем в 1 % случаев.
Более сложной задачей является определение сроков и количества вколов при повторной БПЖ после первичной негативной биопсии. Большинство специалистов рекомендуют выполнение повторной БПЖ через 3–12 месяцев после первичного исследования в зависимости от клинической ситуации. Как правило, повторная биопсия выполняется по сатурационной методике трансректальным или промежностным доступом (более 20 точек).
Таблица 5. Процент осложнений биопсии простаты независимо от количества столбиков

Сатурационная БПЖ выполняется по следующим показаниям:
1) пациентам с отрицательными биопсиями в анамнезе, но стойким подозрением на РПЖ (повышенный оПСА, рост оПСА и др.);
2) пациентам с предраковыми состояниями (ASAP, мультифокальная ПИН высокой степени);
3) пациентам, которые выбрали тактику активного наблюдения до принятия окончательного решения о лечении;
4) пациентам, которым планируется фокальная терапия.
В настоящее время предпочтительной методикой анестезии при трансректальной сатурационной БПЖ является комбинация интраректального введения 2 % геля с лидокаином и билатеральной инъекции 5 мл лидокаина в область сосудисто-нервных пучков ПЖ. Ряд данных свидетельствует о превосходстве комбинированной анестезии над изолированной инфильтрационной анестезией или только введением любриканта в момент проведения трансректального ультразвукового датчика (рис. 17).
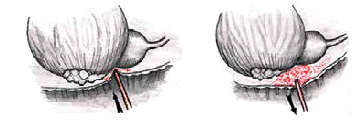
Рис. 17. Выполнение инъекции анестетика в область сосудисто-нервного пучка
Промежностная БПЖ выполняется под спинномозговой анестезией и требует госпитализации пациента.
Таким образом, на основании международного и собственного опыта мы считаем необходимым выполнение БПЖ только по расширенной методике (не менее 12 точек). Решение о выполнении повторной БПЖ принимается индивидуально.
Индекс здоровья простаты PHI
При поиске маркера, наиболее специфичного для выявления РПЖ, особое внимание исследователей было направлено на изучение изоформ свПСА. В 2001 году S. D. Mikolajczyk и соавт. с помощью иммуногистохимического исследования установили, что изоформа свПСА – проПСА – концентрируется в ткани периферической зоны ПЖ, где наиболее часто диагностируются агрессивные формы РПЖ, в то время как изоформа ДПСА обнаруживается в переходной ткани ПЖ, ассоциированной с ДГПЖ (рис. 18).
Эпителиальными клетками периферической зоны ткани ПЖ секретируется молекула-предшественник ПСА – проПСА. Молекула -2проПСА – изоформа проПСА, которая имеет наибольшее клиническое значение по сравнению с другими молекулами проПСА. Впервые форма – 2проПСА обнаружена в экстрактах опухолей. Она даёт более интенсивное окрашивание иммунохимическими красителями в тканях опухоли ПЖ по сравнению с доброкачественной тканью и является самой стабильной формой in vitro. Изоформа -2проПСА не может быть преобразована в ПСА, что является одним из факторов её клинического использования.
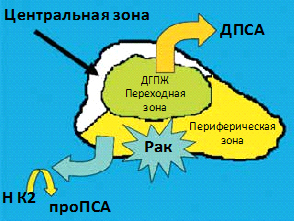
Рис. 18. Схематическое изображение локализации изоформ свПСА в ткани предстательной железы
В многочисленных исследованиях было показано, что наибольшую прогностическую значимость при обследовании мужчин на наличие РПЖ имеет комплекс 3 показателей: -2проПСА, свПСА и оПСА. Эти показатели были объединены расчётной формулой в Индекс Здоровья Простаты (Prostate Health Index, PHI). Данный расчётный индекс имеет весомое биологическое обоснование. Он аккумулирует в себе разнонаправленную динамику фракций ПСА, которая была отмечена при наличии злокачественной опухоли ПЖ. При РПЖ процент содержания свПСА в оПСА снижается, а доля проПСА в свПСА, наоборот, растет (рис. 19). Данная закономерность была учтена в формуле расчёта PHI, представляющей собой произведение доли -2ПроПСА во фракции свПСА на квадратный корень из величины оПСА:
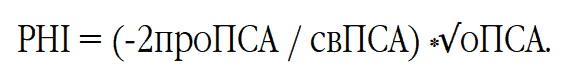
Некоторыми исследователями было показано, что использование РHI позволяет снизить количество «необязательных» биопсий. Это является следствием более высокой специфичности РHI по сравнению с оПСА и %свПСА при одинаковом пороге чувствительности и, соответственно, приводит к меньшему количеству ложноположительных результатов. Таким образом, преимущество в специфичности по сравнению с %свПСА составляет порядка 20 % (чувствительность 90 %). Это приводит к потенциальному сокращению количества «необязательных» биопсий на 20 %.
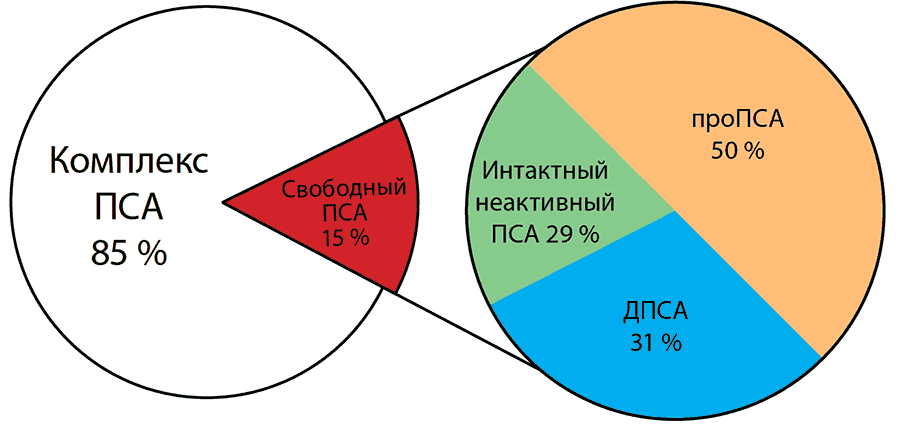
Рис. 19. Схема разнонаправленной динамики фракций ПСА при РПЖ
В относительно недавних работах исследователи продемонстрировали зависимость между вероятностью наличия РПЖ и величиной PHI при выполнении БПЖ. Показано, что для пациентов со значением PHI 25–39 вероятность наличия РПЖ относительно низкая и составляет 26,3 %. По мере увеличения PHI возрастает и вероятность наличия РПЖ. Так, при PHI выше 60 относительный риск наличия РПЖ возрастает более чем в 3 раза по сравнению с пациентами со значениями PHI ниже 25 и составляет 89,2 % (табл. 6). Для сравнения далее приведены данные по выявляемости РПЖ по данным БПЖ с помощью рутинных маркеров (оПСА и %свПСА) (табл. 7). Данные демонстрируют, что диагностические возможности РHI превосходят как оПСА, так и %свПСА, что доказывает его диагностическую эффективность.
Таблица 6. Вероятность наличия РПЖ в зависимости от величины PHI
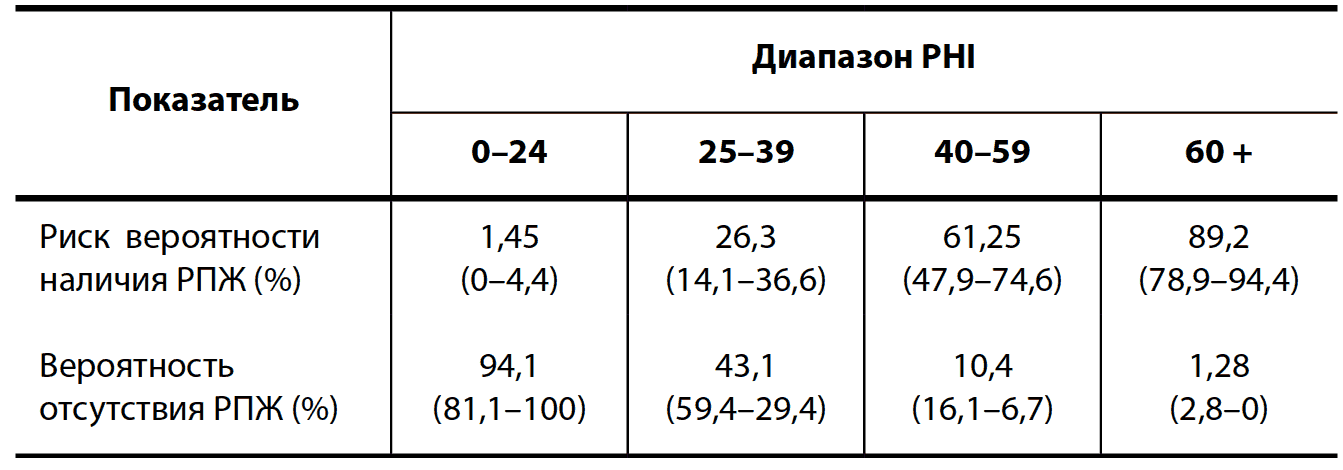
Таблица 7. Вероятность наличия и отсутствия РПЖ в зависимости от порогового значения оПСА, %свПСА и РHI
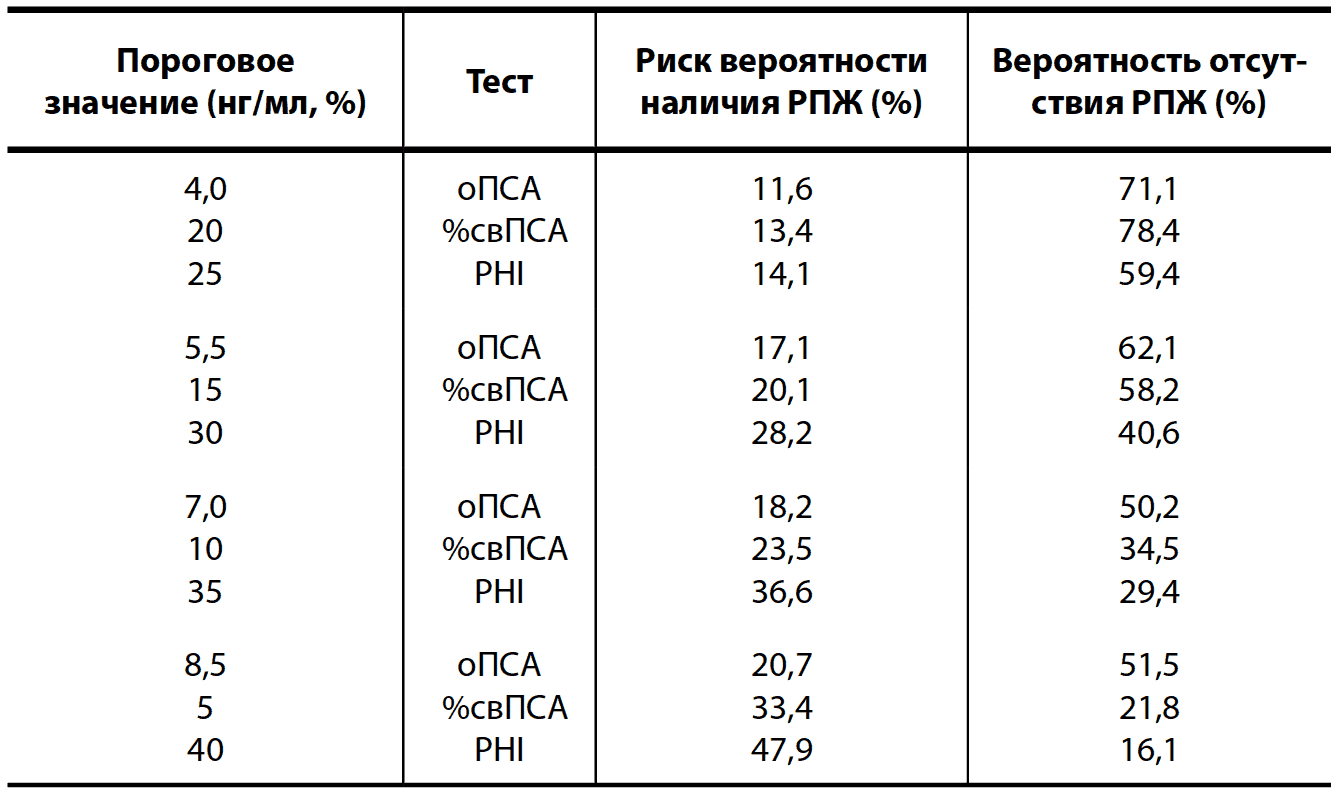
В настоящее время пороговым значением индекса принято считать 25, при превышении которого рекомендуется выполнение БПЖ. PHI рекомендуется определять как при решении вопроса о первичной биопсии, так и у мужчин, перенесших ранее «негативную» БПЖ при уровне оПСА 2,0–10 нг/мл («серая зона») и с отрицательными данными ПРИ.
Антиген рака простаты 3 (РСА3)
Другим перспективным методом ранней неинвазивной диагностики РПЖ является тест-система, основанная на количественном анализе РНК-продукта гена PCA3. Ген PCA3 был открыт в конце 1990 гг. в ходе сравнения транскриптомов нормальных и злокачественных тканей ПЖ. Дальнейшие исследования показали, что высокий уровень экспрессии PCA3 строго специфичен для аденокарциномы ПЖ, а не для других тканей простаты. Ген PCA3 расположен в хромосоме 9 в районе 9q21–22 и имеет размер 25 тыс. пар нуклеотидов. Ген состоит из 4 экзонов, которые содержат 7 сайтов полиаденилирования (рис. 20). PCA3 относится к некодирующим РНК и гиперэкспрессируется в тканях злокачественных опухолей ПЖ, а РНК-продукт этого гена присутствует в моче и эякуляте. В связи с этим количественный анализ РНК PCA3 в моче стал использоваться для неинвазивной диагностики РПЖ.
Метод определения мРНК в моче гена PCA3 основан на определении уровня экспрессии PCA3 и ПСА в клеточном осадке с помощью обратной траскрипции полимеразной цепной реакции в режиме реального времени (ОТ-ПЦР-РВ). Полученное значение PCA3 нормируют на число клеток простаты в анализируемом образце, определяемом, в свою очередь, по количеству мРНК гена KLK3, кодирующего белок ПСА. Индекс PCA3 рассчитывается по формуле:

Рис. 20. Структура генов PCA3 (А) и KLK3 (Б)
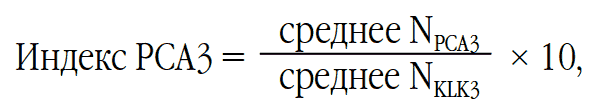
где N – относительное число копий мРНК PCA3 или KLK3.
Условия сбора мочи, её транспортировка и хранение активно исследовались разными группами ученых. Поскольку число клеток в моче относительно невелико, то для увеличения их количества перед сбором мочи проводится ПРИ с последующим массажем ПЖ.
В настоящее время достоверно установлено, что РСА3 является предиктором обнаружения злокачественной ткани ПЖ при первичной и повторной БПЖ. Высокие значение индекса РСА3 ассоциированы с более агрессивным РПЖ, объёмом опухолевого поражения и экстракапсулярным распространением процесса. Сегодня индекс РСА3, равный 35, является установленным пороговым значением современных тест-систем, при достижении которого рекомендуется выполнение БПЖ. Многочисленными исследованиями продемонстрировано преимущество использования индекса РСА3 при планировании БПЖ над рутинными маркерами, что позволяет снизить количество необязательных биопсий. Определение индекса РСА3 рекомендуется пациентам, которые перенесли одну негативную БПЖ со стойко повышенным уровнем оПСА и/или подозрительными данными ПРИ и ТРУЗИ. В мировой литературе имеются данные о ценности этого маркера при принятии решения относительно первичной БПЖ, особенно в диапазоне оПСА 2–10 нг/мл.
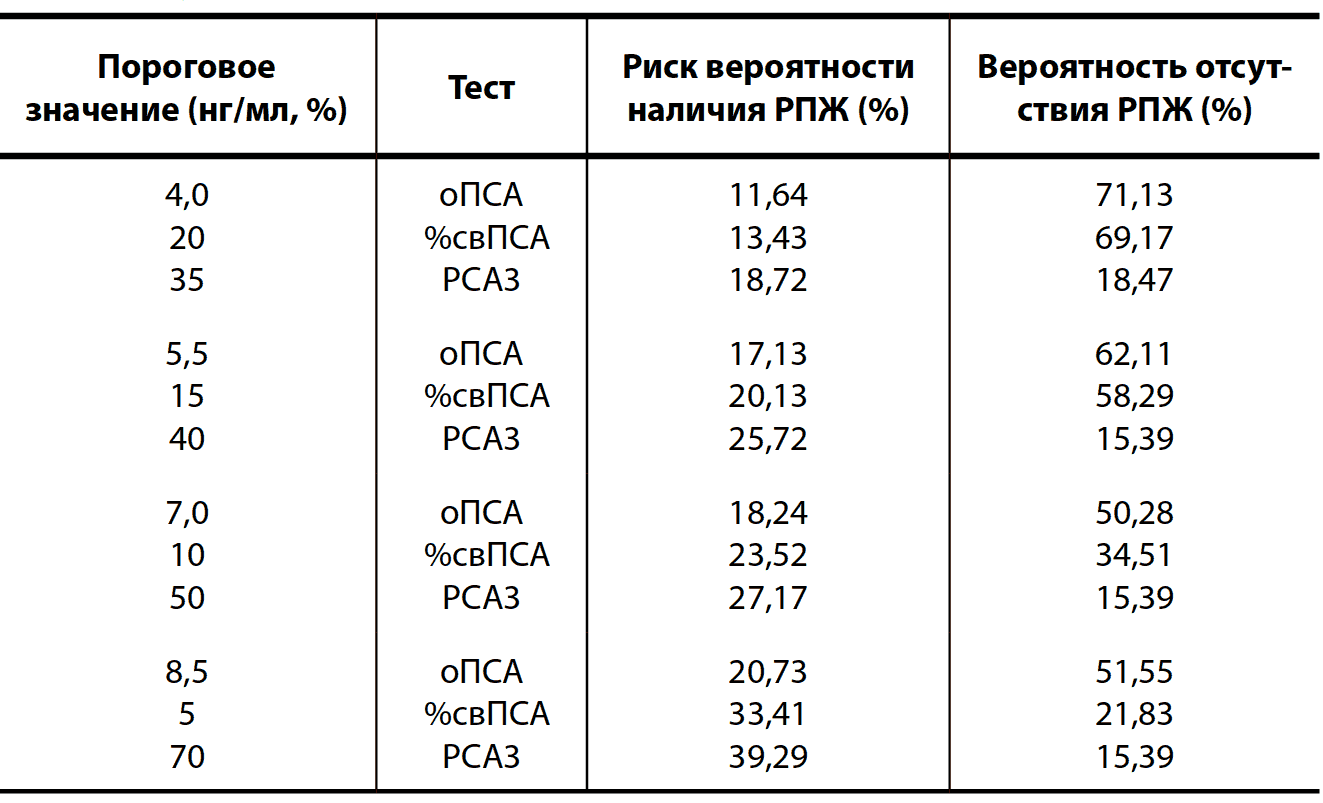
В России ведутся работы по созданию отечественной тест-системы РСА3, которая отличается тем, что в методике определения экспрессии используются преимущественно отечественные реактивы, поэтому тест будет гораздо дешевле западного аналога. В российском исследовании участвовало 245 пациентов. Полученные данные показали хорошие результаты диагностической ценности данной тест-системы. При определении вероятности наличия РПЖ на основании РСА3 получено преимущество над рутинными маркерами, такими как оПСА и %свПСА (табл. 8, 9).
Таблица 8. Вероятность наличия и отсутствия РПЖ в зависимости от величины индекса РСА3
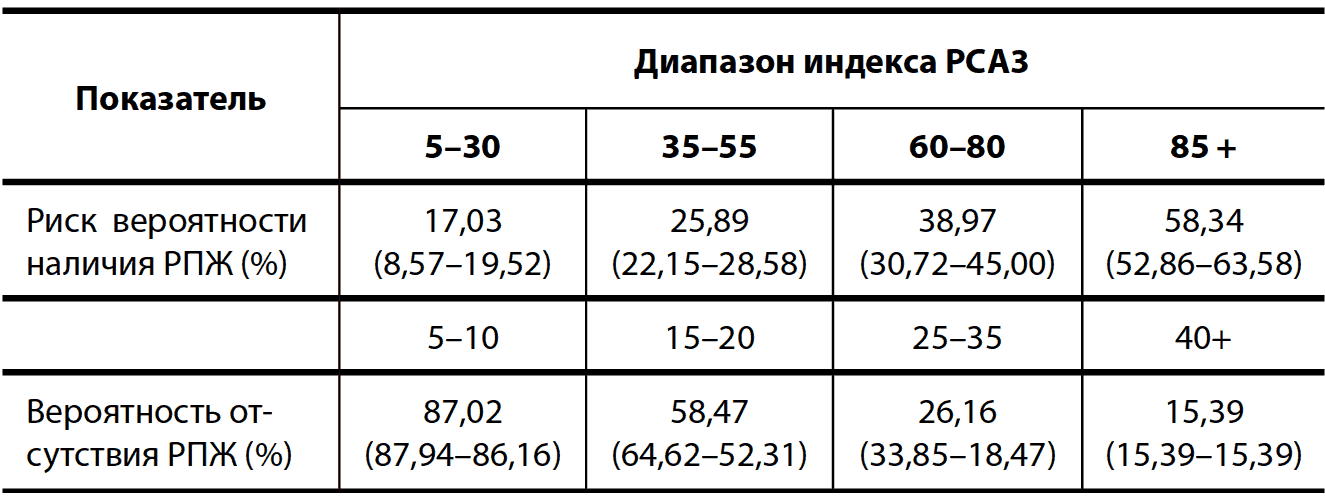
Таблица 9. Вероятность наличия и отсутствия РПЖ в зависимости от порогового значения оПСА, %свПСА и РСА3
Заключение
В настоящее время эпидемиология РПЖ в России неблагоприятная: при первичном установлении диагноза более 50 % мужчин имеют местно-распространённое или метастатическое заболевание (стадии Т3-Т4).
Результаты международных исследований, оценивающих эффективность скрининга РПЖ в Европе и США (ERSPC, PLCO и др.), невозможно полноценно экстраполировать на популяцию российских мужчин.
В России функционирует государственная программа по проведению всеобщей диспансеризации населения, действующая с 2013 г. Вместе с тем на этапах диспансеризации отсутствует стандартизированный алгоритм проведения ранней диагностики РПЖ; «группы риска» мужчин для углублённого обследования чётко не выделены; специалисты, участвующие в проведении ранней диагностики РПЖ, подготовлены недостаточно (особенно при проведении I этапа диспансеризации); программа повторных обследований мужчин и наблюдения за пациентами группы высокого риска РПЖ также не стандартизирована; обращение пациентов или их направление в специализированные центры, имеющие большой опыт в диагностике и лечении заболеваний простаты, безосновательно затруднено.
С учётом вышеизложенного важными являются следующие аспекты:
1. Необходимо продолжать развивать программы диспансеризации населения/ранней диагностики заболеваний ПЖ в России, ведущая роль в которых принадлежит урологу.
2. В рамках программ диспансеризации населения на I этапе необходимо ежегодно определять уровень оПСА крови всем мужчинам в возрасте 45–70 лет.
3. На I этапе диспансеризации «нормальным» значением должен считаться уровень оПСА крови <2,5 нг/мл.
4. Мужчины старше 70 лет, а также пациенты с ожидаемой продолжительностью жизни <10 лет не подлежат обязательному профилактическому обследованию в рамках диспансеризации врачами общей практики и участковыми врачами на предмет выявления РПЖ (их обследование предполагается по обращении к урологу по поводу расстройств мочеиспускания в соответствии с установленным порядком оказания специализированной медицинской помощи).
5. При проведении I этапа диспансеризации при наличии у пациента семейного анамнеза РПЖ необходимо ежегодное определение уровня оПСА крови начиная с 40 лет с последующим направлением пациента к урологу по достижении 45-летнего возраста независимо от уровня ПСА.
6. Показания к БПЖ или вопрос о её проведении определяются урологом.
7. Первичная БПЖ должна выполняться урологами, имеющими необходимое материально-техническое обеспечение, трансректальным доступом под ультразвуковым контролем с получением материала для гистологического (нецитологического) исследования не менее чем из 12 точек.
8. Персонализированное решение об определении уровня оПСА (разъяснение пациенту всех аспектов раннего выявления РПЖ и других заболеваний ПЖ), а также применение различных калькуляторов риска (SWOP и др.) и номограмм может использоваться урологами у отдельных групп пациентов.
9. Необходимо усовершенствовать алгоритм ранней диагностики заболеваний ПЖ на этапах диспансеризации – как для врачей общей практики, так и для урологов поликлинического звена. Также необходимо разработать дальнейшую «маршрутизацию» пациентов при подозрении на наличие РПЖ или его выявлении.
10. Необходимо разработать программу обучения медицинского персонала, участвующего в различных этапах диспансеризации/программы ранней диагностики заболеваний ПЖ.
11. Необходимо проводить российские исследования новых маркёров и методов визуализации ПЖ с целью их дальнейшего возможного использования в программах диспансеризации/ранней диагностики заболеваний простаты.