Острые лейкозы. Клинический случай. Лабораторная диагностика. Лекция для врачей
Лекция для врачей "Острые лейкозы. Клинический случай. Лабораторная диагностика" (отрывок из книги "Гематологический атлас" - Луговская С. А.)
Острые миелоидные лейкозы
Острые миелоидные лейкозы (ОМЛ) - гетерогенные заболевания с поражением гемопоэтических клеток-предшественников, характеризующихся блоком дифференцировки и неконтролируемой пролиферацией. ОМЛ встречаются наиболее часто у лиц старше 60 лет. В США частота встречаемости ОМЛ составляет 20-25 случаев на 100 000 населения у лиц старше 75 лет по сравнению с 2,5 на 100 000 человек в возрасте до 55 лет. Этиологические факторы в большинстве случаев неизвестны. ОМЛ могут развиваться de novo или в связи с предшествующей миелодисплазией, химиотерапией, ионизирующей радиацией, воздействием бензолпроизводных соединений, конституциональными хромосомными аномалиями. Риск развития ОМЛ возрастает при лечении солидных опухолей алкилирующими препаратами, ингибиторами топоизомеразы II, гидроксимочевиной. Повышен риск развития вторичных ОМЛ после высокодозной химиотерапии и аутологичной трансплантации при неходжкинских злокачественных лимфомах и миеломной болезни. Клиническая картина ОМЛ разнообразна и представлена в табл. 4.
Таблица 4. Клинические проявления острых миелоидных лейкозов

Острые миелоидные лейкозы с определяющими генетическими аномалиями
Ключевой особенностью данной группы ОМЛ является отмена требования 20% бластов (за исключением ОМЛ со слиянием BCR:: ABLl и ОМЛ с СЕВРА). Отмена порога минимального процента бластных клеток требует корреляции между морфологическими данными и молекулярно-генетическими исследованиями, чтобы гарантировать, что данная аномалия является ключевой в патогенезе заболевания. Еще одним важным компонентом новой классификации является введение раздела по ОМЛ с другими определенными генетическими изменениями, предназначенного для новых и/или необычных подтипов ОМЛ, которые могут (или не могут) стать определенными типами в будущих редакциях классификации ОМЛ.
Острые миелоидные лейкозы с BCR :: ABL1 и мутацией СЕВРА являются единственными ОМЛ с определенной генетической аномалией, для диагностики которых требуется не менее 20% бластов. Данное условие необходимо для исключения дублирования с ХМЛ. Отличить ОМЛ с BCR :: ABL1 от начальной фазы бластной трансформации ХМЛ бывает сложно, что требует дополнительных диагностических признаков ОМЛ.
Острый промиелоцитарный лейкоз с химерным геном PML :: RARA
Острый промиелоцитарный лейкоз в классификации ВОЗ с 2008 г. вынесен из категории ОМЛ, не охарактеризованных иным образом, в категорию ОМЛ с повторяющимися генетически-ми нарушениями и переименован в острый промиелоцитарный лейкоз с PML :: RARA, что подчеркивает значимость обнаружения этого гена.
Частота встречаемости 5-10%, преобладает у молодых лиц. Выделяют гипергранулярный и гипогранулярный варианты. Острый промиелоцитарный лейкоз имеет ряд клинических и биологических особенностей. Блок дифференцировки бластных клеток происходит на стадии промиелоцитов, которые составляют морфологический субстрат опухоли. Клиническая картина заболевания характеризуется выраженным геморрагическим синдромом, осложняется развитием диссеминированного внутрисосудистого свертывания (ДВС).
Аспирация костного мозга часто затруднена вследствие гиперкоагуляции и формирования сгустка в образце даже во время аспирации. Морфологическое исследование костного мозга при остром промиелоцитарном лейкозе важно, так как обнаружение типичных для этого варианта лейкоза гипергранулярных опухолевых клеток в значительно большем числе, чем в периферической крови, имеет диагностическое значение. Аспирационная биопсия костного мозга может расцениваться как метод скрининга, позволяющий быстро интерпретировать данные морфологического исследования, что дает клиницистам правильный ориентир для дальнейшего проведения молекулярно-генетического исследования и лечения больного.
Костный мозг гиперклеточный, процент атипичных промиелоцитов варьирует. Согласно рекомендациям экспертов ВОЗ, диагноз «острый промиелоцитарный лейкоз» устанавливается независимо от числа бластных клеток в костном мозге.
Бласты (атипичные промиелоциты) характеризуются средними размерами (диаметр 15-20 мкм), высоким ядерно-цитоплазматическим соотношением, анизоцитозом клеток и их ядер, выраженным полиморфизмом ядер (бобовидной, скрученной, складчатой, дольчатой формы). Ядра часто располагаются эксцентрично, характерна гиперхромия ядер, нередко отсутствие нуклеол. Цитоплазма голубого цвета с грубой, обильной, полиморфной азурофильной зернистостью. Гранулы варьируют по величине, форме. Крупные гранулы могут сливаться, образуя палочки Ауэра, иногда в виде пучков. В некоторых случаях наблюдаются разрушенные гипергранулярные промиелоциты, при этом гранулы и палочки Ауэра определяются внеклеточно. Количество бластов, содержащих зернистость, составляет не менее 40% (рис. 143).
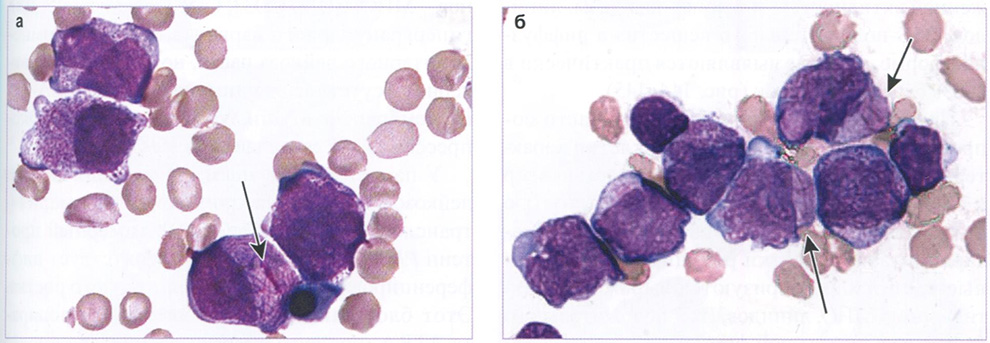
Рис. 143 (а, б). Костный мозг. Острый промиелоцитарный лейкоз с PML :: RARA. Бласты с азурофильной зернистостью и палочками Ауэра (указаны стрелкой). x1000
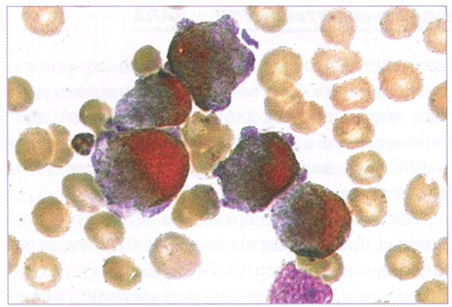
Рис. 144. Костный мозг. Положительная реакция на миелопероксидазу в бластах. x1000
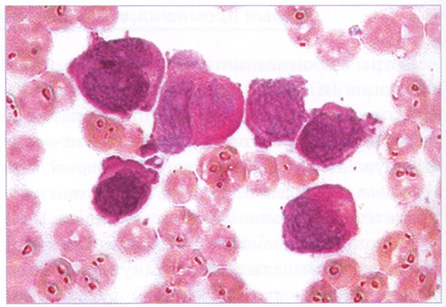
Рис. 145. Костный мозг. PAS-реакция в диффузной форме в бластах. x1000
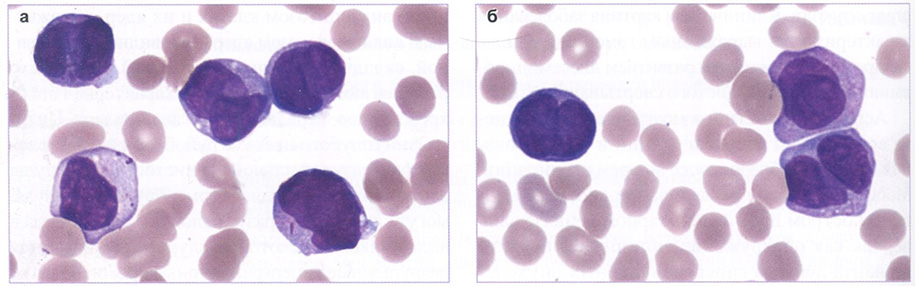
Рис. 146 (а, б). Периферическая кровь. Острый промиелоцитарный лейкоз (гипогранулярный вариант). x1000
Бластные клетки характеризуются выраженной активностью миелопероксидазы, липидов, PAS-положительного вещества в диффузной форме, которые выявляются практически в 100% бластных клеток (рис. 144, 145).
При гипогранулярном варианте, часто сопровождающемся лейкоцитозом, клетки характеризуются гиперхромией, уродливостью ядер и скудной, мелкой пылевидной зернистостью в цитоплазме (рис. 146). Эритроидный и мега кариоцитарный ростки редуцированы. Бластные клетки характеризуются выраженной активностью МПО, липидов, PAS-положительного вещества в диффузной форме.
Иммунофенотип бластных клеток острого промиелоцитарного лейкоза ассоциируется с выраженной экспрессией миелоидных антигенов - МПО, CD13, CD33, CD65, редко CD15. Для гипергранулярного варианта острого промиелоцитарного лейкоза часто, но не всегда характерно отсутствие экспрессии CD34 и HLA-DR на мембране атипичных промиелоцитов. Экспрессия CD56 встречается в 15-20% случаев.
У пациентов с острым промиелоцитарным лейкозом выявляется хромосомная аномалия - транслокация t(15;17) (q22;q21), химерный протеин PML :: RARA, который препятствует дифференцировке клеток гранулоцитарного ростка. Этот блок снимается при введении препарата ATRA (полностью трансретиноевая кислота), индуцирующего дифференцировку и апоптоз опухолевых клеток.
Клинический случай 1.
Острый промиелоцитарный лейкоз с химерным геном PML :: RARA
Пациент Н., 79 лет, доставлен в клинику по экстренным показаниям с выраженным геморрагическим синдромом.
Анализ периферической крови: WBC - 8,41 х 109/л, RBC - 2,02 х 1012/л, НЬ - 65 г/л, MCV - 96,0 фл, МСН - 32,2 пг, МСНС - 335 г/л, PLT - 21,0 х 109л.
Лейкоцитарная формула: бласты - 52%, палочкоядерные нейтрофилы - 1%, сегментоядерные нейтрофилы - 6%, эозинофилы - 1,0%, моноциты - 2%, лимфоциты - 38%, нормобласты - 2 на 100 лейкоцитов.
В пунктате костного мозга количество миелокариоцитов увеличено, количество мегакариоцитов снижено. Бласты составляют 97%, представлены клетками крупных размеров, с резким полиморфизмом формы ядер, обилием азурофильной зернистости и палочек Ауэра (рис. 147).
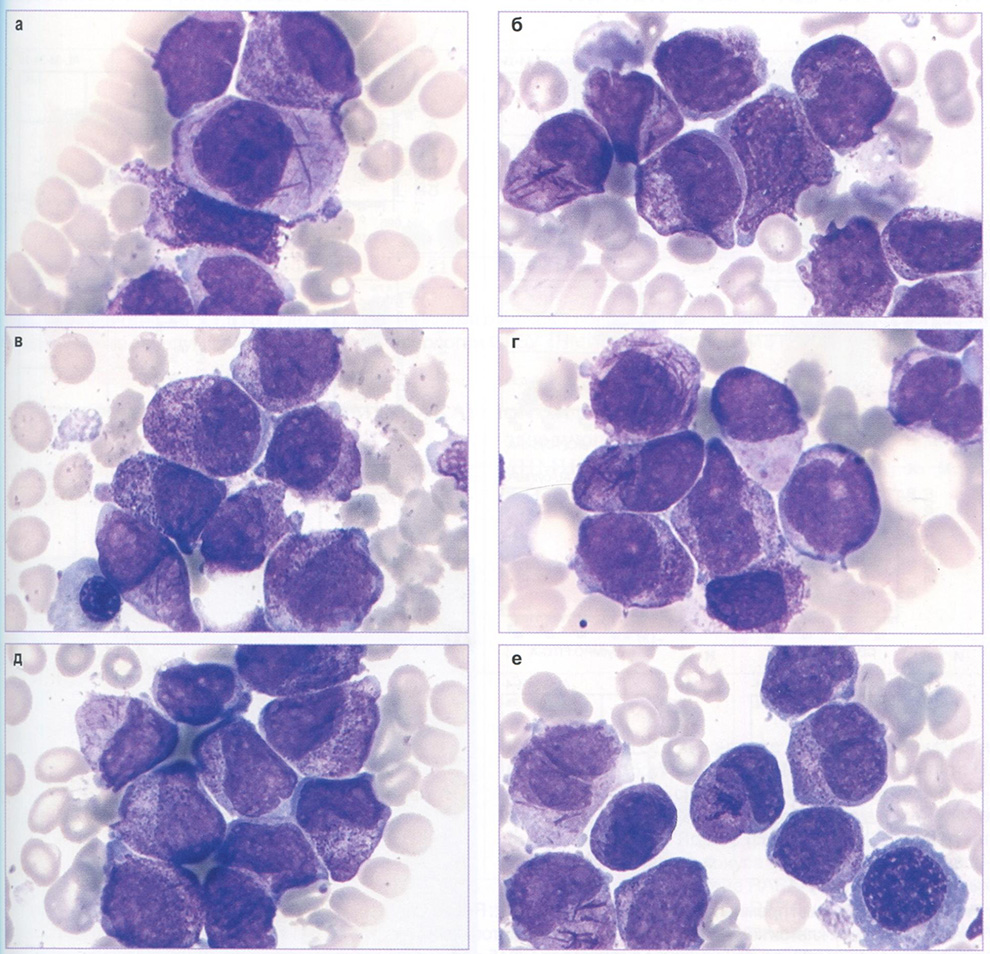
Рис. 147. Костный мозг пациента М. Острый промиелоцитарный лейкоз x1000
Цитохимические исследования: в бластах реакции на МПО и липиды положительные в 100% клеток, неспецифическая эстераза не подавляется фторидом натрия, PAS-положительное вещество - в диффузной форме в 100% бластов.
Иммунофенотип бластных клеток костного мозга CD34-CD38+HLA-DR-TdT-
CD7-MPO+CD117+CD13+CD33+CD9+CD15- CD36-CD64+CD4-CD14-cytCD3-cytCD22- cytCD79a-, что соответствует миелоидной линейной направленности (рис. 148).
Стандартное цитогенетическое исследование. Количество проанализированных метафаз: 25. Кариотип: 46,XY, t(15;17)(q24;q21)[4] /46, XY [21]. Заключение: выявлена диагностическая транслокация t(15;17)(q24;q21) (рис. 149). FISH-исследование с ДНК-зондом: PML :: RARA Translocation, Dual Fusion Probe
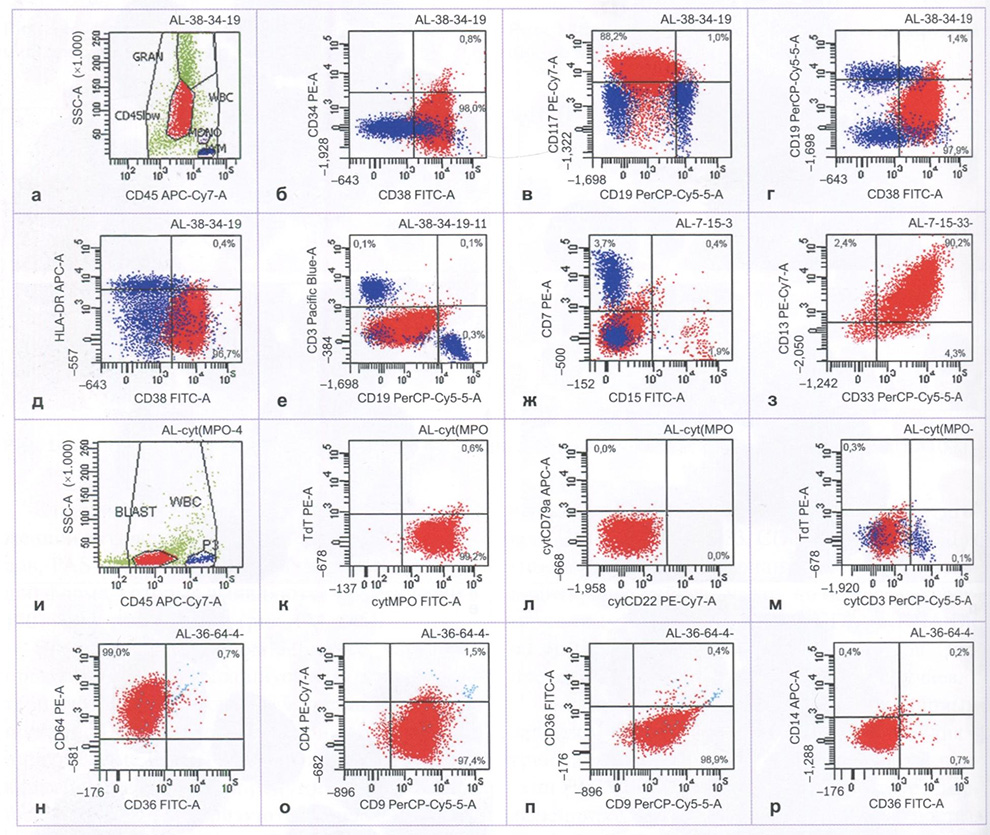
Рис. 148 (а-p). Острый промиепоцитарный лейкоз с PML:: RARA. Скатерограммы, полученные при иммунофенотипировании бластных клеток костного мозга на проточном цитофлюориметре FACS Canto II (Becton Dickinson). Выделение гейта бластных клеток по показателям экспрессии CD45 и бокового светорассеяния (а, и). Точечные графики экспрессии анализируемых маркеров (б-з, к-о). Опухолевая популяция выделена красным цветом, лимфоциты – синим
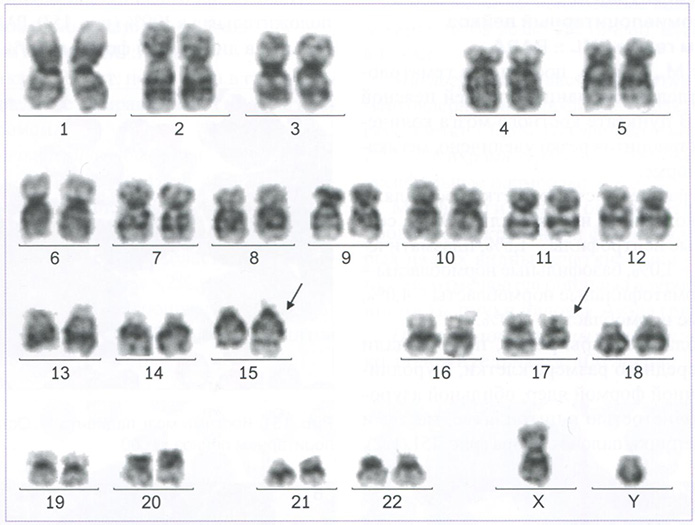
Рис. 149. Кариотип: 46, XY,t(15;17)(q24;q21). Стрелками отмечены поврежденные хромосомы. Микрофотография предоставлена заведующей лабораторией кариологии ФГБУ «НМИЦ гематологии» М3 России Т.Н. Обуховой
Заключение: в 86% ядер выявлена транслокация t(l 5; 17)(q24;q21) (рис. 150). Результаты цитогенетических исследований предоставлены заведующей лабораторией кариологии ФГБУ «НМИЦ гематологии» М3 России, к. м. н. Т. Н. Обуховой.
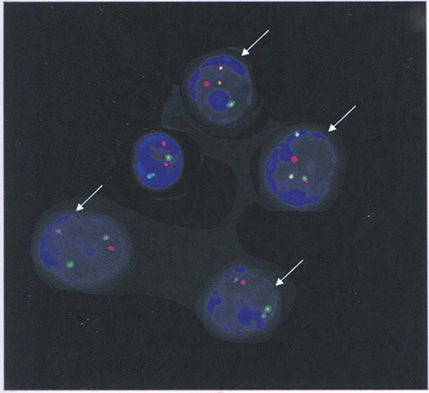
Рис. 150. FISH с ДНК-зондом с двойным слиянием для выявления t(15; 17)(q24;q21)/ PML :: RARA пациента H. Нормальное ядро содержит 2 красных сигнала от локуса гена PML/15q24 и 2 зеленых сигнала от локуса гена RARA17q21. Ядра с t(15; 17)(q24;q21) содержат 1 красный сигнал от локуса гена PML/15q24,1 зеленый сигнал от локуса гена RARA/17q21 и два слитных (желтых) сигнала от PML :: RARA на дериватах хромо-сом 15 и 17. Указаны стрелками. Микрофотография предоставлена заведующей лабораторией кариологии ФГБУ «НМИЦ гематологии» М3 России Т. Н. Обуховой
Вы читали отрывок из книги "Гематологический атлас" - Луговская С. А.
Дополнительные материалы для лекции
Острые лейкозы. Клинический случай. Лабораторная диагностика
Анемия. Лабораторная диагностика
Талассемии. Лабораторная диагностика. Клинический случай
Книга "Гематологический атлас"
Автор: Луговская С. А.

За последние 10-15 лет достигнут значительный прогресс в понимании молекулярно-генетической и эпигенетической основы развития лейкозов, что позволило определить новые диагностические и прогностические маркеры этих заболеваний. Тем не менее, несмотря на все большее проникновение молекулярных методов в онкогематологию, морфологический анализ имеет свою нишу и остается важным первичным звеном в сложном диагностическом поиске. Целью «Гематологического атласа» является обучение специалистов клинической лабораторной диагностики особенностям морфологической структуры клеток крови и костного мозга в норме и патологии.
Лабораторная гематология - комплексная и быстро развивающаяся область клинической лабораторной диагностики. За последние годы достигнут значительный прогресс в понимании молекулярно-генетической и эпигенетической основы развития лейкозов, что позволило определить новые диагностические и прогностические маркеры этих заболеваний. Несмотря на все большее проникновение молекулярных методов в онкогематологию, морфологический анализ сохраняет свою нишу и остается важным первичным звеном в сложном диагностическом поиске. Тем не менее на современном этапе важна интеграция морфологического метода с другими молекулярно-генетическими исследованиями и клиническими данными.
Целью гематологического атласа является обучение специалистов клинической лабораторной диагностики особенностям морфологической структуры клеток крови и костного мозга в норме и патологии. В атласе изложены основные сведения о строении клетки, современные представления о гемопоэзе, структурной организации костного мозга. Подробно описаны дифференцировка и созревание клеток эритропоэза, гранулоцитопоэза, лимфопоэза и мегакариоцитопоэза, которые иллюстрированы в виде рисунков и микрофотографий. В 5-м издании атласа дополнены разделы, касающиеся современной диагностики острых лейкозов, миело- и лимфопролиферативных заболеваний в соответствии с пересмотром классификации ВОЗ 2022 года. Атлас существенно дополнен новыми микрофотографиями, клиническими наблюдениями с описанием основных клинико-морфологических и иммунофенотипических характеристик.
Развитие технологий автоматического анализа крови позволило получить новые информативные эритроцитарные, ретикулоцитарные, тромбоцитарные и лейкоцитарные диагностические параметры, позволяющие не только охарактеризовать состояние эритро-, тромбо-, и лейкопоэза, но и определить диагностический алгоритм дальнейшего обследования пациента. Авторы останавливаются на эритроцитарных, тромбоцитарных и лейкоцитарных показателях, гистограммах и скатерограммах, которые наглядно демонстрируют аномальное распределение клеточных популяций. Подробно дана характеристика разнообразным анемиям с точки зрения патофизиологии, морфологической особенности эритрона, представлены алгоритмы дифференциальной диагностики анемий с учетом биохимических показателей.
В атласе приведена также лабораторная диагностика некоторых паразитарных заболеваний, диагностика которых осуществляется по пунктатам костного мозга, лимфатических узлов или в мазках крови, а также микрофотографии метастатического поражения костного мозга при различных солидных новообразованиях.
Содержание книги "Гематологический атлас" - Луговская С. А.
Строение клетки. Гемопоэз
Основные структурные компоненты клетки
Современные представления о кроветворении
Структурная организация костного мозга
Эритропоэз
Морфология клеток эритроидного ряда
Гранулоцитопоэз
Морфология клеточных элементов гранулоцитопоэза 36
Дифференцирование зрелых и незрелых гранулоцитов
Моноцитопоэз
Морфология клеток моноцитарного ряда
Мегакариоцитопоэз
Морфология клеток мегакариоцитарного ряда
Лимфопоэз
Морфология клеток лимфоидного ряда
Цитохимия гемопоэтических клеток
Острые миелоидные лейкозы
Острые миелоидные лейкозы с определяющими генетическими аномалиями
Острый промиелоцитарный лейкоз с химерным геном PML :: RARA
Острый миелоидный лейкоз с химерным геном RUNX1 :: RUNXlТ1
Острый миелоидный лейкоз с химерным геном CBFB :: МУН11
Острый миелоидный лейкоз с перестройкой КМТ2А
Острый миелоидный лейкоз с химерным геном DEk :: NUP
ОМЛ, связанный с миелодисплазией (AML, myelodysplasia-related — AML-MR)
ОМЛ, связанный с предшествующей терапией
Острые миелоидные лейкозы, определяемые дифференцировкой
Острый миелоидный лейкоз с минимальной дифференцировкой
Острый миелобластный лейкоз без созревания
Острый миелобластный лейкоз с созреванием
Острый миеломонобластный лейкоз
Острый моноцитарный лейкоз
Острый эритроидный лейкоз
Острый мегакариобластный лейкоз
ОМЛ, ассоциированный с синдромом Дауна
Острый базофильный лейкоз
Острые лимфобластные лейкозы
В-клеточные острые лимфобластные лейкозы
ОЛЛ из ранних В-клеток-предшественников (про-В-ОЛЛ, В-1)
Пре-пре-В-клеточный вариант ОЛЛ (В-П)
Пре-В-клеточный вариант ОЛЛ (B-III)
В-клеточный ОЛЛ (B-IV)
Т-клеточный острый лимфобластный лейкоз
Пре-Т-клеточный острый лимфобластный лейкоз
Т-клеточный острый лимфобластный лейкоз, кортикальный вариант
Лимфобластный лейкоз из ранних Т-клеточных предшественников
Острые лейкозы неясной линейности, иммунофенотипически определяемые
Смешанно-линейные варианты острых лейкозов
Острый недифференцированный лейкоз
Гистиоцитарные/дендритноклеточные неоплазии
Плазмоцитоидная дендритноклеточная неоплазия
Миелодиспластические новообразования
Новая терминология и классификации
Морфологические признаки дизгранулоцитопоэза
Морфологические признаки дизмегакариоцитопоэза
МДС с определяемыми генетическими аномалиями
МДС с низким количеством бластов и изолированной делецией 5q (MDS-5q)
МДС с низким количеством бластов и М?ЗВ1-мутацией (MDS-SF3B1)
МДС с биаллельной инактивацией ТР53 (MDS-biTP53)
Миелодиспластические новообразования, морфологически определяемые
МДС с низким количеством бластов (MDS-LB)
МДС гипопластический (MDS-h) 224 МДС с избытком бластов (МДС-ИБ)
Миелопролиферативные новообразования
Хронический миелолейкоз
Рћ-негативные миелопролиферативные новообразования
Первичный миелофиброз
Истинная полицитемия
Эссенциальная тромбоцитемия
Хронический нейтрофильный лейкоз
Хронический эозинофильный лейкоз
Ювенильный миеломоноцитарный лейкоз
Мастоцитоз
Миелодиспластические / Миелопролиферативные новообразования
Хронический миеломоноцитарный лейкоз
МДС / Миелопролиферативное новообразование с мутацией SF3B 1 и тромбоцитозом
Лимфопролиферативные новообразования
В-клеточные новообразования из зрелых (периферических) клеток
Моноклональный В-клеточный лимфоцитоз
Хронический лимфолейкоз / лимфома из малых лимфоцитов
Волосатоклеточный лейкоз
Лимфома маргинальной зоны селезенки
Диффузная В-клеточная лимфома из малых лимфоцитов красной пульпы селезенки
В-клеточная лимфома/лейкоз селезенки с выраженными нуклеолами (ранее «вариантная форма ВКЛ»)
Лимфоплазмоцитарная лимфома
В-клеточная лимфома маргинальной зоны
Фолликулярная лимфома
Мантийноклеточная лимфома
Плазмоклеточные новообразования и другие заболевания, сопровождающиеся парапротеинемией
Моноклональные гаммапатии
Первичная болезнь холодовых агглютининов
№М-моноклональная гаммапатия неопределенного значения (MGUS)
Не 1$И-моноклональная гаммапатия неопределенного значения
Моноклональная гаммапатия ренального значения (МГРЗ)
Плазмоклеточные новообразования
Плазмоцитома
Плазмоклеточная/множественная миелома
Острый плазмоклеточный лейкоз
Редкие плазмоклеточные опухоли, ассоциированные с паранеопластическим синдромом
Болезни тяжелых цепей
Крупноклеточные В-клеточные лимфомы
Диффузная крупноклеточная В-клеточная лимфома, NOS
Первичная В-клеточная крупноклеточная лимфома средостения В-клеточные лимфомы высокой степени злокачественности, неуточненные (NOS)
Лимфома Беркина
kSHV/HHV8 (Kaposi's sarcoma-associated herpesvirus / Human Herpes Virus 8) — ассоциированные В-клеточные пролиферации и лимфомы
Первичная лимфома серозных полостей
Зрелые Т- и НК-клеточные новообразования
Т-пролимфоцитарный лейкоз
Т-клеточный лейкоз из больших гранулярных лимфоцитов
НК-клеточный лейкоз из больших гранулярных лимфоцитов
Синдром Сезари
Агрессивный НК-клеточный лейкоз
Гепатолиенальная Т-клеточная лимфома Периферическая Т-клеточная лимфома неспецифицированная, NOS
Гематологический атлас
Анемии
Гипохромные анемии
Железодефицитная анемия
Анемии, связанные с нарушением синтеза порфиринов (сидеробластные анемии)
Нормохромные анемии
Анемии хронических заболеваний
Анемия при хронической почечной недостаточности
Апластическая анемия
Парциальная красноклеточная аплазия костного мозга .
Макроцитарные анемии
Мегалобластные анемии
Вп-дефицитная анемия
Гемолитические анемии
Гемолитические анемии, обусловленные наследственным дефектом мембраны эритроцитов
Наследственная микросфероцитарная гемолитическая анемия (микросфероцитоз, болезнь Минковского—Шоффара, наследственный сфероцитоз)
Овалоцитарная гемолитическая анемия (наследственный овалоцитоз, эллиптоцитоз)
Стоматоцитарная гемолитическая анемия (стоматоцитоз)
Гемолитические анемии, обусловленные нарушением структуры липидов мембраны эритроцитов (акантоцитоз) 440 Наследственные гемолитические анемии, обусловленные нарушением синтеза глобиновых цепей (гемоглобинопатии)
Талассемии
Гемолитические анемии, обусловленные носительством аномального гемоглобина
Серповидноклеточная анемия (гемоглобин S)
Гемолитические анемии, обусловленные носительством аномальных гемоглобинов С, D, Е
Гемолитические анемии, обусловленные дефицитом ферментов эритроцитов (эритроцитарные энзимопатии)
Гемолитическая анемия, обусловленная соматической мутацией стволовых гемопоэтических клеток Пароксизмальная ночная гемоглобинурия (болезнь Маркиафавы—Микели)
Анемии, обусловленные внеэритроцитарными факторами
Иммунные гемолитические анемии
Аутоиммунные гемолитические анемии
Гемолитические анемии, обусловленные механическим повреждением эритроцитов
Микроангиопатическая гемолитическая анемия Тромботическая микроангиопатия
Гемолитико-уремический синдром
Рекомендации Международного общества по лабораторной гематологии (ICSH) по стандартизации номенклатуры клеток периферической крови (2015 г.)
Наиболее часто используемые в диагностике анемий параметры клинического анализа крови
Изменения крови при некоторых паразитарных заболеваниях
Малярия
Краткая характеристика различных видов малярии и их лабораторная диагностика
Трехдневная малярия
Тропическая малярия
Четырехдневная малярия
Овале-малярия
Бабезиозы
Лейшманиоз
Висцеральный лейшманиоз
Кожный лейшманиоз
Трипаносомоз
Спирохетозы
Филяриатозы
Картина крови и костного мозга при некоторых заболеваниях
Патология тромбоцитов
Тромбоцитопения
Иммунная тромбоцитопения
Наследственная тромбоцитопения, ассоциированная с мутацией в гене МУН
Тромбоцитопатии
Синдром Бернара—Сулье
Тромбоцитоз
Патология лейкоцитов Аномалия Пельгера—Хюэта
Синдром Чедиака—Хигаши
Изменения морфологии гранулоцитов при септических и других критических состояниях
Картина крови при некоторых вирусных инфекциях
Инфекционный мононуклеоз
Хронический вирусный гепатит
Парвовирусная инфекция
Метастазы рака в костный мозг
Гистиоцитоз из клеток Лангерганса
Гемофагоцитарный лимфогистиоцитоз
Лизосомные болезни накопления
Болезнь Гоше
Болезнь Ниманна—Пика










































































0 комментариев