Белковая часть биохимического анализа. Лабораторная диагностика. Лекция для врачей
Лекция для врачей "Белковая часть биохимического анализа. Лабораторная диагностика" (отрывок из книги "Биохимические показатели в медицине и биологии" - Рослый И. М.)
Белковая часть биохимического анализа
Только с высоты обобщения можно познать истинную глубину
Гигантский путь совершила природа от простой химической связи до целого организма. Построение белков — первый и самый удивительный ее шаг. История изучения белка — это движение вниз к элементарной структуре, а сейчас началось движение вверх для теоретического обобщения.
Требования к познанию предмета (познавательные законы): 1) разделение на части и мысленный синтез для соединения с общими элементами других структур; 2) соединение частей в целое — поиск элементарной системы; 3) в частном факте искать проявление общей закономерности (общего элемента структуры); 4) выявление отдельных структурных уровней (многоэтажность, ведущая к обобщению); 5) обозначение неделимости как свойства высшего. Изучение белков обучает этим принципам познания, а значит, и мышления.
— Соединение частей дает новое качество (из атомов молекулы, из аминокислот белки).
— Структура: набор, порядок, последовательность, пространственная конфигурация.
— Функция: свойство структуры специфически взаимодействовать с другой структурой.
— Более сложная функция: это свойство структур взаимодействовать с другими структурами множественно и в пространстве.
— Структура статична, функция динамична.
— О структуре нельзя говорить без проявления функции (метафизика).
— Эволюция идет по пути совершенствования функций посредством отбора структур (активных центров).
В практическом отношении основной задачей изучения белкового обмена в организме является определение интенсивности потока аминокислот в крови при активации протеаз и сдерживающем влиянии на него ингибиторов ферментов. Накачка аминокислот в ткани — это особая функциональная система, биоэнергетически зависимая и сопряженная с ГГТ — гамма-глутамилтранспептидазой.
Со времен гениального ученика Эмиля Фишера Вальдшмидт-Лейца (1894-1972) в биохимии не изучалась интенсивность метаболических потоков. На примере пептидных связей он показал, что их расщепление в белках сопровождается эквивалентным повышением аминокислотных и карбоксильных групп. Но это элементарный, базовый уровень доказательства математических закономерностей. На уровне органов тканей и организма все гораздо сложнее, но именно это и является первой задачей биохимического анализа. Пептидная сущность белка была важнейшей интуитивной догадкой Э. Фишера, в 1904 г. предсказавшего полимерное строение белка. Клиническая биохимия — это не столько поиск и выявление каких-то экзотических параметров, а именно четкая подчиненность количественным закономерностям.
Проблема белка — это проблема всего естествознания, а путь, пройденный в исследовании белка, входит в общий ход развития естествознания. Особенность этого пути, как сказал Дж. Кендрью, заключалась в смене ориентиров: «Биология прежних лет целиком продвигалась сверху вниз — от целого организма до простого вещества. Новая биология начинает с другого конца и продвигается с самого низа вверх». Этот биологический лифт обязательно дает сбои объективного (недостаточность информации или несовершенство методов) и субъективного (неполноценность теоретических обобщений) характера, однако при таких остановках нужно двигаться вверх хотя бы мысленно. Небольшая история изучения белков позволяет понять, как это происходит.
История изучения белка началась с Якоба Беккари (1682-1766), который в 1728 г. выделил клейковину из пшеничной муки. Сходными внешними признаками обладали свернувшиеся сыворотки крови и белок куриного яйца. При сухой перегонке выделялась «летучая щелочь» (смесь аммиака и аминов). В 1759 г. А. Кессель-Мейер выделил клейковину из зерен пшеницы и отметил запах сыра при хранении. И. Руэль в 1773 г. выделил клейковину и из других растений и отметил, как и Беккари, аналогию с белками животного происхождения. В том же году А. Парматье обнаружил при нагревании утрату клейкости, эластичности и вязкости (денатурация') белков. К. Нейман в 1753 г. выделил из белка альбумин и приписал ему свертываемость яичного белка (свертывающая материя белка). Это и были первые из многочисленных характерных свойств белка. И. Жакен в 1793 г. ввел термин белок. К началу XIX в. научились характеризовать основные свойства белков. А. Фуркруа (1755—1809) из крови выделил три составные части и назвал их — альбумин, желатин и фибрин. «Сыворотка при нагревании похожа на яичный белок, легко распознается, и я именую его альбумином (albumine), поскольку оно присутствует в яичном белке, называемом albumen». Ж.Л. Пруст (1754—1826) выделил из ячменной муки гордеин, а Д. Таддеи в 1819 г. из клейковины муки выделил глиадин (растворим в спирте), зимом (нерастворим) и растительный альбумин. Д. Горхем в 1821 г. из кукурузы выделил зеин. В 1810 г. Гей-Люссак методом сжигания установил процентное содержание в белках углерода — 50%, водорода — 8%, азота — 15— 20% и кислорода — 20%, а также показал тождественность состава животных и растительных белков.
Г. Мульдер в 1844 г. на уровне дара предвидения ввел термин протеин и обозначил его как первичную субстанцию: «В растениях, как и животных, содержится вещество, которое в первых образуется, а у вторых составляет компонент пищи и имеет для тех и других большое значение. Оно легко меняет свой состав в зависимости от условий, называется протеином и является первичной субстанцией, т.е. белковым радикалом». Фактически Г. Мульдер соединил химическое изучение белков с физиологией. Путь от клейковины до постановки задачи о строении белка был нереален, но гипотеза Мульдера хорошо воспринималась из-за «склонности мыслить категориями аналогий и привычных представлений». Одновременно он ввел щелочной гидролиз.
К. Райхерт в 1849 г. установил способность белков к кристаллизации, а Ф. Гоппе-Зайлер дополнил свойства белка способностью соединяться с небелковыми соединениями, которые он назвал простетическими группами. П. Дени в 1858 г. обнаружил осаждаемость белков в солевых растворах. Ф. Гофмейстер в 1888 г. показал, что белки осаждаются электролитами. А. Коссель в 1895 г. назвал простейшие белки протаминами. В 1888 г. введено понятие объемной контракции. И наконец, в 1902 г. Э. Фишер выдвинул 4 постулата пептидной теории строения белка, которые оказались пророческими и были продолжением учения о конформации с тремя К (конституция, конфигурация и конформация), но на более высоком уровне. В дальнейшем сформировалось представление о том, что конформация молекул является ключом к пониманию функционирования живых организмов, и У. Астбери в 1946 г. ввел термин молекулярная биология и провел разделение белков на фибриллярные и глобулярные. Водородная связь при этом стала восприниматься как важнейшая упаковочная сила.
А. Браконно (1781—1855) начал поиск «основы» веществ животного происхождения методом кислотного гидролиза и с помощью серной кислоты выделил в 1820 г. первый компонент белка — клеевой сахар, названный гликоколом (глицином) за сладкий вкус. Он же в 1820 г. из белков говяжьего мяса выделил лейцин, названный так за счет белизны кристаллов. Принадлежность гликокола к аминокислотам установил О. Каур в 1858 г., в 1806 г. выделил аспарагин, но не идентифицировал его как аминокислоту, что сделал П. Дюлонг в 1826 г. В 1810 г. У. Волластон открыл цистин из мочевых камней, а из белков рога цистин был получен К. Мернером лишь в 1899 г. Использование кислотного гидролиза выявило еще одно важное свойство белков — гидролизуемость. Гидролизуемость, и энзимологическая, является и началом конца в жизни белка (обычный протеолиз) и средством доводки структуры до совершенства (ограниченный протеолиз).
Юный Ф. Бопп (1824—1849), ученик Ю. Либиха, из казеина молока выделил в 1848 г. тирозин. Полный список ученых, открывших все аминокислоты, представлен в табл. 13.
Таблица 13. Список ученых, открывших аминокислоты, источник, год открытия
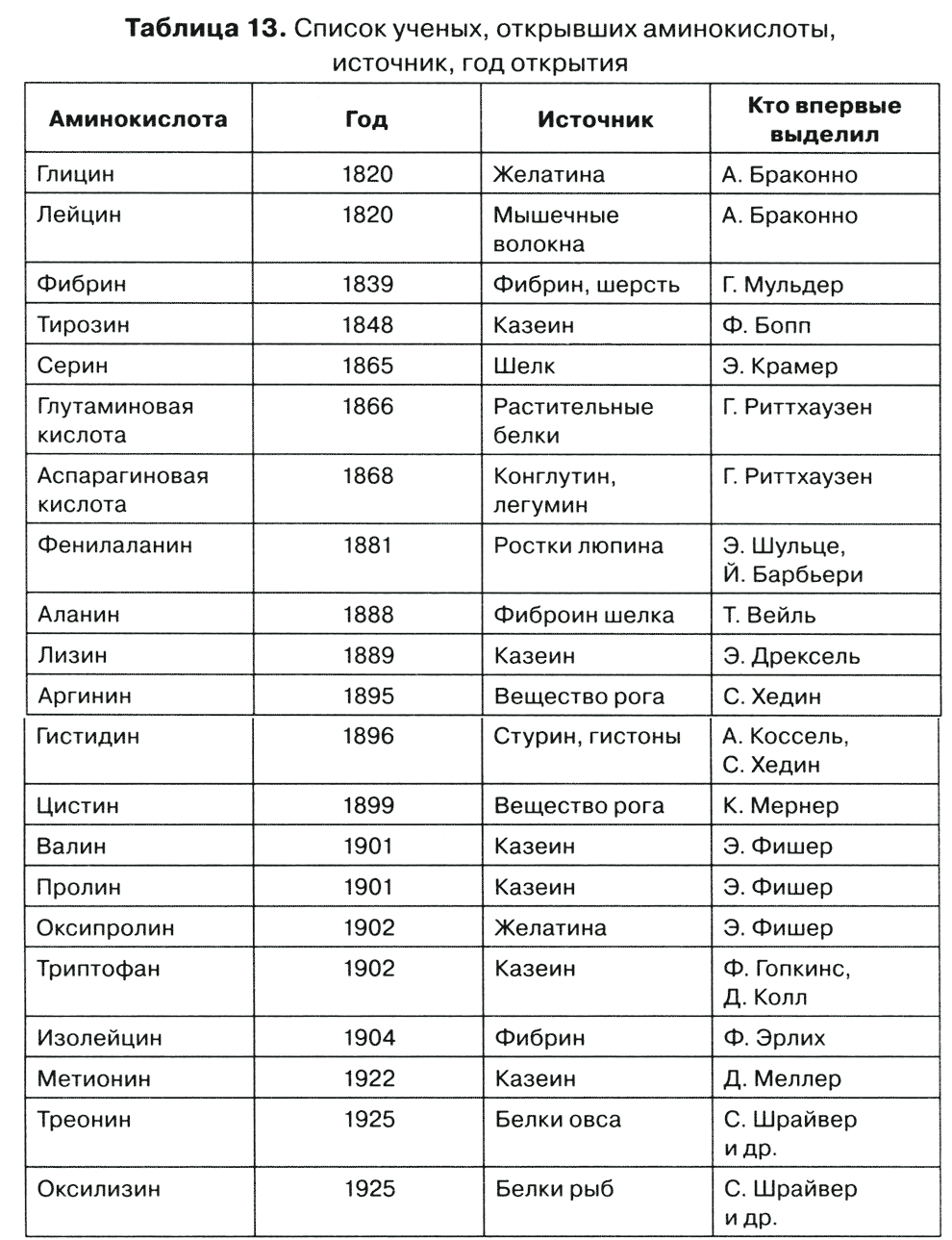
Итак, для установления полного элементарного состава белков понадобилось 100 лет, и, хотя бы в знак уважения к бесчисленным труженикам науки, следовало бы знать формулы и химические названия всех аминокислот, которыми мы насквозь пропитаны! Параллельно с выделением аминокислот начались работы по их синтезу, навеянные верой в чудеса химии и ограниченностью истинного знания белковой структуры. Э. Геккель на заседании Немецкого общества естествоиспытателей воскликнул: «Когда вы, химики, создадите истинный белок, то он закопошится!» И в 1850 г. А. Штреккер получил аланин с помощью циангидриновой реакции. Несмотря на встречный курс в изучении белка, расстояние до конечной цели (биологическая роль) не определялось.
«Свойства тел — суть функции их строения» — эта гениальная догадка А. Вюрца в настоящее время может быть сформулирована так: функция — это свойство структуры специфически взаимодействовать с другой структурой. Более сложная функция — это свойство структуры взаимодействовать с другой структурой, но в пространстве. А высшая функция — взамодействие на более высоком структурном уровне. В 1895 г. А. Байер сказал: «Нет никакой надежды выяснить природу белка». Однако его ученик оптимист Фишер считал, что «следует, по крайней мере, попытаться начать осаду этой неприступной крепости, воспользовавшись всеми современными средствами, т.к. только риск позволит нам расширить границы возможностей имеющихся в нашем распоряжении методов». Он выдвинул 4 постулата: 1) белки состоят из аминокислот; 2) аминокислоты содержат асимметрический атом углерода; 3) белковая молекула — линейный полимер; 4) а-аминокислоты создают линейный полимер с появлением пептидной связи, которыми дифференцировал известные факты на главные и второстепенные, а артефакты — на первичные и вторичные (в 1902 г. стал вторым нобелевским лауреатом). Одновременно составил опытную программу проверки своей гипотезы:
1) доказательство для природных аминокислот L-конфигурации;
2) конденсируемость с помощью пептидной связи; 3) установление специфичности протеолитических (пищеварительных) ферментов. Теория Фишера была высшим классическим достижением органической химии. Одномерность понимания этой теории притеняла ее эвристичность! «Колоссальное многообразие органического мира в химическом отношении не должно подчиняться тем ограничениям, которое предписывает наше неполное знание», — говорил Фишер. Пептидная связь не может быть панацеей на все возможные типы связей в живых системах, которые не только многочисленны, но и пространственно ориентированы. В 1925 г. было закончено «открытие» последних аминокислот — треонина и оксилизина. Химические теории требовали перевода их в пространство, т.е. трансформации линейного характера белковой цепи в глобулярный, который в физиологических условиях служит формой существования молекул огромной массы. Иначе: перевод одномерности понимания в трехмерность. Шаг в этом направлении сделал в 1922 г. Г. Штаудингер, который высказал мысль о том, что высокомолекулярные соединения не являются ассоциативными, а представляют собой многоатомные единые образования, названные им макромолекулами. А ведь уже при изучении углерода в 1877 г. А. Кекуле, создавший представление о четырехвалентности, писал: «Гипотеза о химической валентности приводит нас к допущению, что большое число отдельных молекул может соединяться в сеткообразные или губкообразные комочки, которые сопротивляются диффузии, и, согласно Грехему, называются коллоидами». Уже на уровне элементарных молекул создается их пространственный образ существования. Оказалось, что длинные подвижные полимерные цепи в среде малых молекул реализуют огромное число флюктуирующих форм (примитивное движение) и поэтому пространственное строение растворенного полимера, как и другие его свойства, описывается не конкретной структурой, а параметрами функции распределения. Была выделена водородная связь как главная упаковочная сила, и взаимодействие белков с водой выделяется как их особое свойство (уникальное взаимодействие с уникальной средой, а не только с отдельными молекулами). В воде особые кинетические, электрохимические, термодинамические, оптические и адсорбционные характеристики у белков, т.к. ей присущи: 1) самая высокая диэлектрическая постоянная; 2) высокая теплоемкость; 3) низкая вязкость; 4) значительное поверхностное натяжение; 5) высокая температура плавления и кипения; 6) более высокая плотность в жидком состоянии, чем в твердом. Вода — это полимерное соединение низкой молекулярной массы диполь-дипольного типа. Энергия водородных связей в структуре льда — 20 кДж/моль. В гидратной оболочке вода образует два слоя: 1) прочный (первичный); 2) диффузный (вторичный). В первом молекулы воды интенсивно взаимодействуют с ионами, строго ориентированы и перемещения ион совершает с первичным слоем. Вторичный слой удален от центра, более подвижен. В нативных условиях белки являются главными соединениями, связывающими воду, и она делится на 2 части:
1) свободную со свойствами чистой воды и 2) связанную молекулами или коллоидными частицами. 1 г сухого белка содержит 0,17 г воды, денатурированного — 0,22 г и нативного — 0,35 г воды. Денатурация нагреванием снижает содержание воды на треть. В кристаллах карбоксигемоглобина связанной воды 0,35 г. Растворение белка сопровождается контракцией растворителя и изменением свойств воды — не замерзает, при 0 °C повышает плотность, значительно снижает диэлектрическую постоянную. В. Пик и С. Мартин в 1913 г. показали, что растворение сухих белков приводит к контракции в объеме 5—8 мл на 100 г белка. Сухой препарат содержит 0,2—0,5 г воды на 100 г белка. Гидратная оболочка предохраняет белки от коагуляции. И хотя параллелизма между гидратацией и растворимостью нет, первая классификация белков основана на их растворимости. Коллаген в 1,5 раза больше связывает воды, чем альбумин, и при этом нерастворим. Большое число заряженных группировок повышает сродство к воде, но и парадоксально снижает его за счет образования солевых связей между соседними молекулами. Растворимость белков определяется концентрацией солей и зависит от pH. Кислоты и основания разрушают межмолекулярные солевые мостики и повышают растворимость белков, а нейтральные соли вызывают высаливание. Добавление глицина повышает растворимость белков. Ленгмюр в 1917 г. по аналогии с гидрофильностью и гидрофобностью коллоидов (термины Перрена 1905 г.) выделил у белков гидрофильные и гидрофобные группы. Гарди в 1899 г. определил амфотерный характер поведения белков. Именно амфотерность, гидрофобность и гидрофильность при многообразии аминокислотных последовательностей делает класс белков уникальным в смысле межмолекулярных взаимодействий, в том числе с водой. По Ленгмюру, в зависимости от близости к поверхности мономолекулярный слой может быть двумерным газом, жидкостью или кристаллом. Осмотическая характеристика белка мало связана с формой и гидратацией его молекул. Диффузия зависит от размера частиц и противостоит седиментации. Денатурация открыта Чиком и Мартином в 1910 г. как многостадийный процесс (снижение растворимости -» коагуляция -> флокуляция), от незначительных структурных изменений до полного разрушения скачкообразного типа по принципу «все или ничего». Необходимо понимать, что она характеризуется: 1) уменьшением растворимости и гидратации; 2) увеличением вязкости; 3) потерей специфической активности; 4) лучшей расщепляемостью протеолитическими ферментами; 5) неспособностью к кристаллизации; 6) увеличением внутренней энергии; 7) ростом энтропии.
При вариации pH среды происходит тонкая регулировка полярных свойств белковых молекул. Амфотерность белков — это продолжение амфотерности аминокислот и свидетельство двуединости живой природы в дополнение к регулировке функций. В 1931 г. Дж. Бернал обнаружил электрострикцию— сокращение объема раствора. Тизелиус в 1937 г. методом электрофореза выявил функциональную гетерогенность белков крови.
Белки для химии — самый сложный объект природы, для биологии — качественно новый уровень организации живого, для физики — первое обращение к проблематике строения веществ органического мира. Поэтому за проблемой строения возникли проблемы пространственной структуры белков и взаимосвязи строения с биологической функцией. По сути, это горизонтально-вертикальное, т.е. объемное комплементарное (специфическое), взаимодействие белков с продуктами иной природы. Белкам присуща специфичная спонтанная способность в тех или иных условиях принимать определенную пространственную конфигурацию. Поэтому трехмерность и является важнейшей специфической чертой молекулярной биологии.
У. Астбери ввел в 1946 г. термин «молекулярная биология» и показал, что конформация молекул служит ключом для понимания функционирования живых организмов. Он также ввел разделение на фибриллярные и глобулярные белки, а в 1952 г. Линдерштреманг сформулировал принцип пространственной организации с определением первичной, вторичной и третичной структур. Путь наверх стал доминирующим! В 1962 г. Блоут выдвинул конформационную гипотезу о спиралеобразующих и не образующих спирали аминокислотах и конформационном равновесии (представляет собой внутримолекулярное плавление, кристаллизацию и перекристаллизацию), когда белок элементарно живет! И это определяется природой растворителя, его концентрацией, степенью полимеризации, температурой, значением pH и ионной силой раствора. Различаются упорядоченное, промежуточное и неупорядоченное состояния. Кристаллы могут содержать до 50% по объему и 35% по массе воды, но кристалличность утрачивается при высыхании. Главное в том, что конформационное состояние в кристалле должно быть весьма близким к таковому в растворе! Пространственная структура — это ансамбль канонических регулярных форм. В растворах происходит обмен протонов с атомами водорода, которые располагаются даже внутри белковой молекулы, и это объясняет дыхание молекул, т.е. динамическими их свойствами. Глобулярная структура — это малая вязкость в растворе и большая плотность по сравнению с синтетическими пептидами. Упаковочная водородная связь требует сближения атомов до 0,18 нм, и первым шагом к внутри- и межмолекулярному переходу протонов является образование водородной связи, α-спираль при определенных условиях может переходить в
β-структуру. Концепцию гидрофобных взаимодействий обосновал У. Козман в 1959 г. В белках 35—45% аминокислот могут давать гидрофобные связи. Понятие «гидрофобные силы» лишено смысла, это связано с водным окружением из-за специфической структуры воды. Спиралеобразующая тенденция присуща не определенным остаткам аминокислот, а их определенным последовательностям. Существует как бы трансляционный код — процесс укладки цепи в глобулярную форму, т.е. жизненная сила. Для предсказания структуры нужны атомные модели и интуитивные соображения с последующим алгоритмом предсказания! Среднее содержание спиралей не превышает 35%, а сумма а-спиралей и 0-структур не более 50%, т.е. эти структуры не являются фундаментальными. Белки иррегулярны на большинстве локальных участков и деление на вторичную и третичную структуры лишено смысла. Различия в конформации белков в кристалле и растворе — исключения, а не правило. У белков очень высокий коэффициент упаковки — 75%, а у сферических тел — 74%, что очень близко к кристаллам. Жидкая вода и циклогексан — 58 и 44%. Отсюда слабая сжимаемость белка, в 20 раз меньше, чем у масла, и практически совпадает с коэффициентами сжимаемости олова и каменной соли. Плотность белка неравномерна, а дисульфидные мостики не увеличивают плотность. Клубок характеризуется гибкостью в 10 конформациях. Возможны 12 супервторичных структур, которые контактируют между собой. Д. Филлипс в 1967 г. в лизоциме увидел компактные глобулярные блоки в виде доменной организации (у домена ядро из 8—18 остатков, а всего 40—150). Между доменной организацией и размером белка связи нет. Ковалентно связанный фосфор в овальбумине влияет на процесс денатурации с вариантами взаимопревращений. Теонг в 1972 г. создал постадийную модель свертывания и развертывания белка, где развертывание начальное и завершающее, а деградация кооперативная. Специфичность белков имеет ряд градаций, позволяя молекулам включаться в функционирующие системы повышающейся степени сложности. Каждая клетка содержит 2 х 1013молекул, из которых 98% приходится на воду. Остается 400 млрд.
Таким образом, долгий путь познания истинной природы белка не достиг понимания его совершенства, но выявил целый спектр уникальных свойств, которые создают неограниченную палитру жизненных характеристик (или фенотипических свойств). Инструмент природы и мощен, и изящен, и неисчерпаем. Белок — исполнитель воли генетической программы, и его свойства в скромном перечислении следующие:
1) клейкость -> первые натуральные признаки;
2) эластичность -> первые натуральные признаки;
3) вязкость -> первые натуральные признаки;
4) адсорбция — способность принимать на себя;
5) абсорбция — способность отдавать себя;
6) гидратация — способность принимать воду пустотами;
7) набухание — способность принимать воду и увеличивать объем;
8) растворимость — и как истинных растворов, и как коллоидов;
9) гидролизуемость — начало конца (полный гидролиз) и доводка до совершенства (ограниченный протеолиз);
10) наличие изоэлектрической точки — уход из среды функционирования;
11) высаливание — осмотическая (ионная) податливость;
12) денатурация — физиологическая (изменение активности ферментов) и патологическая (выпадение в осадок);
13) осаждение электролитами — приземление;
14) осаждение солевыми растворами — зависимость от внешней среды;
15) амфотерность — использование свойств аминокислот и диалектическое единство противоположностей;
16) полимерность— стеклообразование—высокоэластичность-пластичность;
17) компактность — и как экономия структуры, и как оптимальная для окружения форма существования в биологической среде;
18) комплементарность — строгое стерическое соответствие (элементарная функция);
19) несжимаемость — высшая категория структуры;
20) флуктуация — основа примитивного движения;
21) твердость — обязательное структурное свойство;
22) кристаллизуемость — структурная сохранность;
23) высокая степень упаковки — сохранение свойств при движении вверх (к целому организму);
24) взаимопереходы при изменении pH — колебательные движения;
25) гибкость за счет клубка в 10 вариантах — пространственная вариативность;
26) взаимодействие с водой как важнейшая характеристика — пример удивительной взаимосвязи среды и ее компонентов;
27) протонный обмен — примитивная буферная система;
28) осмотические свойства — регуляция потоков и объемов;
29) способность к лигандированию — вседоступность и всесвязываемость;
30) способность к конформационным изменениям в зависимости от биологической функции — многоуровненная адаптированность;
31) поглощение волн — связь с внешним миром;
32) свертываемость — особый тип защиты от внешних воздействий и дополнительный источник питания;
33) коллоидность — свойство сопротивляться среде;
34) самостоятельная пространственная укладка в глобулу — начиная от 300 аминокислот;
35) пространственные электростатические взаимодействия с внеш-ними заряженными группировками с изменением свойств белка;
36) кристаллизация воды вокруг гидрофобных групп белка с изменением свойств всей молекулы.
Такое многообразие свойств белка на молекулярном уровне создает предпосылку для формирования многообразных качеств более сложных живых систем. Лигандирование с другими веществами (НК, липиды, углеводы, металлы и т.д.) и объясняет функциональную неисчерпаемость. В крайне упрощенном виде структура белка как смысловое явление может быть описана в категориях графа логической структуры (педагогический прием) для развития способности видеть и описывать главное, не подчиняясь частностям. Это необходимо формировать в себе при дальнейшем изучении не только биохимии, но и других дисциплин.
Из представленного графа логической структуры по белку (см. рис. 3) следует мысленно выйти на интегрированное понятие нативности как совокупности многочисленных качеств (представлены и описаны выше), но в самом элементарном смысле она включает компактность, комплементарность и растворимость. Утрата этих свойств и обозначается как денатурация. Примитивно-наглядный пример денатурации — это сваренное яйцо, белок которого уже никогда не будет растворим.
Обилие функциональных свойств белка как призводного генома служит основанием для создания функциональных свойств продукта, несущего многочисленные эмоциональные признаки.
Функциональный элемент структуры белка — участок специфического взаимодействия с другой структурой. Важнейшее понятие, которое не только необходимо для познания функции, но и знание того, что в данном соединении концентрируются дополнительные факторы, и это место наибольшей чувствительности системы к внешним и внутренним воздействиям. Функциональный элемент — это отличие от общего плана строения, которое: 1) создается; 2) функционирует;
3) защищается; 4) повреждается; 5) регулируется и т.д. Всегда необходим поиск функциональных элементов в общем плане строения. Функционирование это и есть специфическое узнавание, а структурно-функциональный подход это подход к пониманию специфического взаимодействия
Биохимический анализ крови включает белковую, липидную, углеводную и энзимологическую составляющую. Эти показатели также можно разделить на метаболические и энзимологические.
Забор крови для анализа осуществляется с помощью антикоагулянтов, когда исследуются факторы свертывающей системы и без них, когда необходимо определить обычные биохимические параметры. Поэтому сывороткой называют бесклеточную часть крови, полученную без антикоагулянтов (цитрат или оксалат), а плазмой — жидкую часть со всеми факторами свертывания.
Термин «биологическая химия» был введен Карлом Нейбергом в 1903 г. Э. Пфлюгер в 1875 г. высказал мысль о том, что носителем жизненных функций является протоплазма, а в ней, в свою очередь, живой белок, который от мертвого отличается способностью к саморазложению. Друг Ф. Энгельса К. Шорлеммер познакомил его с трудами Э. Пфлюгера о тождестве живого белка и протоплазмы, в связи с чем в «Анти-Дюринге» в 1877—1878 гг. появилось известное определение жизни: «Жизнь есть способ существования белковых тел, существенным моментом которого является постоянный обмен веществ с окружающей их внешней природой, причем с прекращением этого обмена веществ прекращается и жизнь, что приводит к разложению белка». В белках содержится 51—55% углерода, 21—24% кислорода, 15—18% азота, 6—7% водорода, 0,3— 2,5% серы. Коэффициент пересчета 6,25 служит для оценки количества поступившего в организм белка. Азот — важнейший элемент структуры пептидной связи наряду с α-углеродным атомом и углеродом карбонила. Полипептидный тяж как основа первичной структуры белка — это последовательность -C-C-N- и проблема для выведения из организма токсичного аммония после катаболизма. В организме 5 млн белков, а в природе 1010—1012. Дальтон — единица молекулярной массы, равная массе водорода, названа в честь английского химика Джона Дальтона (1766—1844). Термины дальтон и молекулярная масса взаимозаменяемы. Пучок света через раствор белка проходит рассеиваясь (эффект Тиндаля) и на этом основан нефелометрический метод количественного определения белка. При электрофорезе белки распределяются так: альбумины — 55—73%, α1-глобулины — 2—5%, α2-глобулины — 5—9%, β- глобулины — 9—13%, γ-глобулины — 13—22%.
Глобулины имеют молекулярную массу — 100-150 000 дальтон, слабокислые или нейтральные, мало дикарбоновых кислот. ИЭТ (изоэлектрическая точка) — 6—7,3, нерастворимы в воде, но растворимы в слабых солевых растворах, высаливаются полунасыщенным раствором (NH4)2SO4. α1-глобулины — ингибиторы тканевых протеиназ и переносчики стероидных гормонов (транскортин), тироксина (ТСГ — тироксинсвязывающий глобулин), витамина А (ретинолсвязывающий белок — РСБ), витамина В12 (транскобаламин). а2-глобулины транспортируют гемоглобин (гаптоглобин), медь (церулоплазмин), мочевую кислоту (уратсвязывающий глобулин — УСГ), фосфолипиды в ЛВП. β-глобулины формируют С-реактивный белок, белки свертывающей системы и системы комплемента, транспортируют железо (трансферрин), геминовую группу (гемопексин), 17-гидроксикортикостероиды (стероидсвязывающий глобулин), холестерин и другие липиды в ЛНП. γ-глобулины в основном иммуноглобулины (состоят из 4 полипептидов: два тяжелых — 446 АМК, 50 000 дальтон и два легких — 214 АМК, 25 000 дальтон), но не все они являются иммунными белками.
Протамины, молекулярная масса 4000—12 000, содержат 50—80% основных кислот. Многие получили название по источнику получения: сальмин — молоко лосося, клупеин — икра сельди, скумбрии — молоко скумбрии. Делают компактной ДНК сперматозоидов. Гистоны, молекулярная масса 11 000—24 000, 20—35% аргинина и лизина, НЭТ 9,5-12.
Проламины — растительные белки в семенах злаковых, нерастворимы в воде, солевых растворах, щелочах, кислотах, экстрагируются 70% этанолом. Много неполярных АМК: зеин — кукуруза, гордеин — ячмень, глиадин — пшеница, авенин — овес. Глютелины — растительные белки, нерастворимы в воде, но растворяются в разбавленных щелочах и кислотах. В них больше аргинина и меньше пролина. К ним относится глутенин — пшеница, глутелин — кукуруза, ориденин — рис. Протеноиды (склеропротеины) белки опорных тканей. Белки составляют 30% всех белков организма, в коже 40%, в костном скелете 50%, во внутренних органах 10%.
Коллаген имеет прочность стальной проволоки. Гидроксипролина и гидроксилизина в коллагене 25%, глицина — 30%, изолированная цепь коллагена содержит 1000 АМК и имеет массу 105 дальтон. В коллагене тип вторичной структуры — коллагеновый. Три цепи дают трехжильный кабель, а виток спирали из трех аминокислот с одной водородной связью. Плоские кольца пролина и оксипролина с боковыми радикалами АМК придают жесткость суперспирали, препятствуя их прогибанию. Три спирали дают тропоколлаген, который является субъединицей коллагена. При длительном нагревании он превращается в желатин, который образует гель. Эластины — белки крупных артерий, богаты глицином и пролином, способны к растяжению. Кератины — белки волос, ногтей, шерсти, много серосодержащих аминокислот. Известны две конформации: альфа- и бета-кератины. Первые состоят из альфа-спиралей, стабилизированных водородными связями и дисульфидными мостиками. Нагревая и вытягивая их, можно получить бета-кератин, у которого на уровне вторичной структуры бета-конформация. Это отмечается на локтевых сгибах рукавов при вытягивании шерстяных изделий.
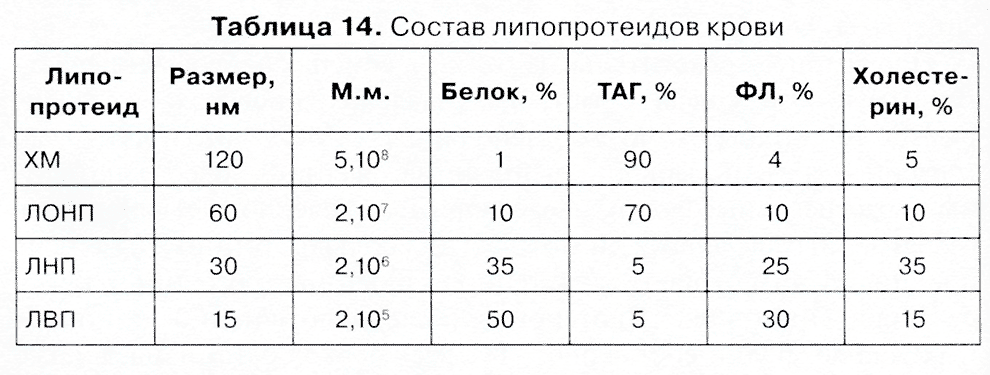
Липопротеиды — содержат в качестве простетической группы липиды. Различают хиломикроны (ХМ), пре-β-липопротеиды (ЛОНП, липопротеиды очень низкой плотности), β-липопротеиды (ЛНП, липопротеиды низкой плотности), α-липопротеиды (ЛВП, липопротеиды высокой плотности) (табл. 14).
Через 12—14 ч после приема пиши плазма не содержит ХМ. ЛОНП и ЛВП образуются в печени, а ЛПЛ, активируемая гепарином, образует ЛНП. В мембранах содержатся протеолипиды, белка содержится 65—85%, и он составляет сердцевину. Растворяются в неполярных растворителях (смесь хлороформ:метанол =1:1).
Таблица 14. Состав липопротеидов крови
Фосфопротеиды — казеин молока, овальбумин, вителлин яиц. Пепсин, фосфоглюкомутаза. Фосфорилирование белков-ферментов — основа их физиологической денатурации.
Металлопротеиды — помимо транспортных белков есть и белки- ферменты (дипептидазы, алкогольдегидрогеназы).
Гликопротеиды истинные и протеогликаны (глюкозаминопро-теогликаны), которые содержат маннозу, галактозу, N-ацетил- глюкозамин, N-ацетигалактозамин и др. Среди них обнаруживают гликозамингликаны, содержащие гетерополисахариды (гиалуроновая и хондроитинсерная кислота, гепарин, гепаран-, дерматан-, кератансульфаты). Связь через аминокислоты аспарагин (гликози-ламидная связь), серин и треонин (О-гликозидная связь). ГП выполняют транспортную (транскортин, церулоплазмин), каталитическую (энтерокиназа, глюкозоксидаза, холинэстераза, РНК-аза), гормональную (кортикотропин, гонадотропин), свертывающую (фибриноген, протромбин), структурно-механическую функции.
Хромопротеиды: гемпротеиды, хлорофиллпротеиды, кобамидпротеиды, ретинальпротеиды, флавопротеиды.
Нуклеопротеиды: хроматин, рибосомы, информосомы.
Таблица 15. Важнейшие белки крови
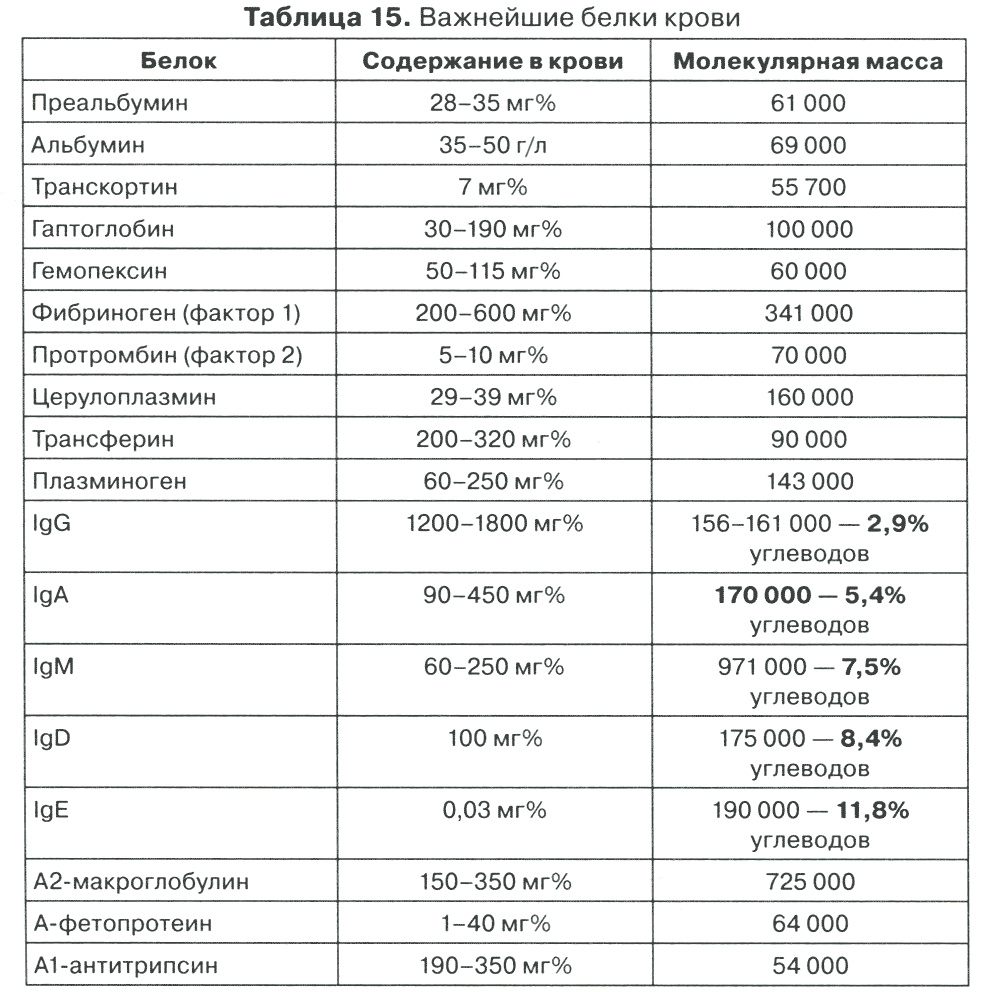
Среди иммуноглобулинов наибольшее содержание углеводов в IgE, которые известны своей аллергической настроенностью, что вполне закономерно. Именно углеводы являются структурной доминантой всех рецепторных взаимодействий, а также и возможной причиной неспецифического взаимодействия (или аллергизации). Хорошо известна любому липкость сахарного сиропа, а это и есть наглядная иллюстрация неспецифической липкости.
Основным белком крови является АЛЬБУМИН (м.м. 69 000) (табл. 15), который определяется с помощью бромкрезолового зеленого, имеющего желтый цвет при pH 4,2, а при взаимодействии с альбумином приобретающего зеленое окрашивание, которое и регистрируется при 630 нм. Альбумин служит первым барьером детоксикации в организме, хорошо растворим и менее подвержен денатурации. Высокий уровень альбуминов указывает на состояние белок-синтетической функции печени, а также детоксицирующих возможностей организма. В норме содержание альбумина составляет 35—50 г/л. Образно говоря, это важнейший стабилизатор основных физиологических состояний, мощный фактор жизнеобеспечения. Именно поэтому у новорожденных он составляет 75—80% от общего белка в период элементарного выживания, и только затем увеличивается количество неальбуминовых фракций. Альбумин при электрофорезе часто присутствует в виде двух полос: с более быстрой и более медленной подвижностью, но в равных количественных взаимоотношениях с нормальным альбумином. Альбумин является кислым белком с ИЭТ около 5, содержит 17% глу, 8% асп и 11—15% лей. При формировании третичной структуры образует 3 структурных домена и 9 функциональных субдоменов, которые стабилизированы дисульфидными связями. При лечении некоторыми антибиотиками возможно развитие вторичной альбуминемии. В сутки синтезируется 10—33 г альбумина, и в организме содержится 310—330 г, из которых внутри сосудов — ПО—130 г, а вне сосудов — 200 г. В сутки распадается 10—12 г альбумина, который выделяется преимущественно через кишечник. Альбумин дважды переходит из капилляров в ткани и обладает сильным аффинитетом к анионам (SO4-, С1- и др.), билирубину, гормонам, лекарствам. Альбумин имеет 180 титруемых зарядов, а при pH 7,4 чистый заряд равен 18. В присутствии ртути альбумин полимеризуется в меркаптальбумин. Время его полужизни 15 дней. Синтезируется в клетках Купфера у больных циррозом печени в количестве 10—16 г, а разрушается до 4 г в желудочно-кишечном тракте. Теряется со слюной и калом, а другая часть распадается за счет пиноцитоза в клетках до аминокислот. Уровень альбумина в крови сохраняется при 6—7-дневном голодании. Падение плазматической концентрации способно компенсаторно усилить синтез IgM. При перфузии альбумина синтез собственного не меняется, т.е. не регулируется плазматической концентрацией. Синтез ЛВП в микросомах протекает параллельно с синтезом альбумина. В 1909 г. Старлинг вывел закон о том, что жидкость выталкивается наружу гидростатически, а возвращается за счет онкотического давления. Покидает белок кровеносное русло в любом месте, а возвращается через лимфатическую систему. В интерстиции альбумина в 1,4 раза больше, чем в плазме. В смешанной слюне содержится 0,15—0,30 г/л альбумина, поступающего из крови со значительной модификацией, и, вероятно, регулирующего соотношение ионизированного и неионизированного кальция. Акцептор жирных кислот в плазме, который в 10 000 раз снижает их концентрацию в крови. Анальбуминемия характеризуется низким ростом, эпилептиформными припадками, увеличением содержания холестерина, снижением Са+ до 8,4 мг%.
Помимо альбумина в сыворотке необходимо определять общий глобулин для оценки нарушений белкового метаболизма при раке, инфекционных, иммунологических и других заболеваниях. Глобулины содержат много триптофана по сравнению с альбуминами человека. Определение глобулинов возможно только в сыворотке, т.к. фибриноген также содержит много триптофана. Триптофан альбумина вносит не более 7—10% количественных значений показателя. Нормальные значения общих глобулинов 2,5—3,6 г% (25—35 г/л). У новорожденных 1 г%, но к 4—6 мес. достигает уровня взрослых. Глобулин и его отношение к альбумину (А/Г коэффициент) — крайне важный показатель. Глобулин повышен при диареях, шоках, пневмониях, туберкулезе, тифозной лихорадке, печеночной патологии. Понижен при анемиях, нефротическом синдроме, голодании.
Ранее разделение белков проводили высаливанием с помощью сульфата аммония. Белки, осаждающиеся до 50% насыщения (NH4)2SO4, называются глобулинами, а более 50% — альбуминами. Псевдоглобулины растворяются в дистиллированной воде, а эугло-булины— в недистиллированной. Серенсен в 1915 г. провел исследования по взаимодействию белков плазмы с органическими красителями, и с тех пор стало ясно, что молекулярная природа взаимосвязи транспортирующих и транспортируемых веществ — важнейшая молекулярно-медицинская проблема, а жизненные функции для поддержания гомеостаза и есть транспортные функции. Макротранспорт — это перенос с кровью и интерстициальный перенос, а трансцеллюлярный перенос — это питание нейронов клетками глии. Перенос же кислорода является особым типом транспорта. Внеклеточно его переносят эритро- и хлорокруорины с молекулярной массой 3 млн.
При любой, и особенно инфекционной, патологии возможны самые различные взаимоотношения между уровнем общего белка и альбумина. Крайние варианты — 89 г/л для общего белка и 38 г/л для альбумина, или 50 г/л альбумина при 64 г/л общего белка напоминают вариант с низким нижним давлением или «обезглавленное» давление крови, что имеет различный не только биохимический, но и клинический смысл. А ведь это фактический прообраз многих фиэнологических систем и состояний колебательного типа (pH, давление, пульс и т.д.).
Принято считать, что гиперпротеинемия связана с глобулинами, а гипопротеинемия с альбуминами. С учетом возможных колебаний уровня белка в крови нагрузка на детоксицирующие системы организма будет различна в зависимости от быстроты его изменения. Снижение уровня белков в крови связано обычно с неконтролируемым неспецифическим протеолизом, что сопровождается появлением в крови многочисленных пептидов. Противовесом протеазного фона служит высокий ингибиторный фон, который обеспечивается в основном двумя ингибиторами al-AT и а2-МГ. При этом второй является уникальным сорбентом и ингибитором протеаз разного происхождения.
Предварительная, а часто и окончательная оценка диспротеинемии возможна по тимоловому показателю (норма 0—20 ЕД/л), который в большей степени отражает не столько изменение соотношения нормальных белков, сколько появление в крови фракции денатурированных белков для скорейшей их утилизации или элементарный глюконеогенный фонд. Тимоловый реактив вызывает помутнение такой сыворотки. Более точное определение соотношения белков осуществляется методом электрофореза на бумаге, где выявляются соответствующие пятна разной подвижности (α1,-, α2-, β, γ-глобулины).
При диспротеинемиях уровень деградированных пептидов повышен, а возникновение среди них особых фракций пептидов в больших количествах способно вызывать энцефалопатические проявления, как при ожоговой болезни. Инфекционный психоз обязательно сопровождается повышением в крови пептидов различного состава. А тяжесть течения шизофрении зависит и от загруженности альбумина разными метаболитами, т.е. его детоксицирующей способности. Таким образом, массивная денатурация белков, преципитаты, видимые на глаз, пептиды разного размера, определяемые другими методами, — это признаки тяжелейшей внутрисосудистой катастрофы и причина пептидного звена эндотоксикоза, разрешаемого адаптивными механизмами ферментемии.
Каскадный механизм специфического протеолиза заложен в механизм активации свертывающей системы, которую компенсирует гепарин. Он же одновременно служит и активатором ЛПЛ — липопротеинлипазы липопротеинов и тем самым при избытке усиливает липолиз в крови. Поэтому уровень фибриногена и бета-липопротеинов — БЛП — в крови больных взаимосвязан метаболически, их константный уровень обеспечивается общим регулятором (гепарином) и является прогностически важным показателем. Поэтому при благоприятных исходах тяжелых инфекционных заболеваний высокие БЛП сочетаются с низкими значениями фибриногена, и наоборот. Повышение обоих показателей одновременно прогностически неблагоприятно — это косвенно свидетельствует о дефиците гепарина в кровеносном русле, метаболическом блоке основных путей обмена белков, липидов и углеводов, а также об изменении реологических свойств крови. Сумма фибриногена и бета-липопротеидов не должна превышать 1000 мг% в идеале при неосложненном течении инфекционного заболевания.
И только с учетом этого показателя возможно отслеживать нацеленное (точечное) воздействие экзогенных факторов. Мощность ферментных систем должна обеспечивать обновление белков печени наполовину за 10 дней, у инертных коллагеновых белков период обновления составляет 300 дней. Крысы с более высоким уровнем активности ферментов имеют средний период полуобновления белков в пределах 3,5 сут. Коэффициент изнашивания (суточная потеря) по Рубнеру составляет 23 г белка на 70 кг веса. В сутки при этом выделяется 20—30 г мочевины при содержании в крови — 20—30 мг%. 100—120 г белка в сутки необходимо при общем калораже 2500 ккал, и норма белка повышается на 10 г при увеличении калоража на 500 ккал. Мощность ферментов переваривания на примере пепсина составляет 50 кг белка за 2 ч 1 г пепсина. Все ткани организма используют аминокислоты крови — 32-55 мг% — и накачивают их против градиента концентрации системой транспорта при участии ГГТ, т.к. в тканях их содержание значительно выше — до 500 мг%. Связано это не только с необходимостью использовать их для синтеза белка, но и стабилизировать их структуру в противовес мочевине. Только глицин, пролин и аланин не влияют на скорость ферментативных реакций, и поэтому для них должна быть особая избирательность поступления. Глицин создает микроклеточную буферную среду для улучшения растворимости веществ. В лабораториях трисглициновый буфер считается оптимальным буферным раствором для модельных биологических экспериментов. В сутки организм использует до 30 г аспарагиновой кислоты и до 40 г глицина, что не может быть обеспечено пищевыми белками. Физиологическая мощность альбумина — 1 г удерживает 18 г воды.
Вы читали отрывок из книги "Биохимические показатели в медицине и биологии" - Рослый И. М.
Купить книгу "Биохимические показатели в медицине и биологии" - Рослый И. М.
Книга "Биохимические показатели в медицине и биологии"
Автор: Рослый И. М.

Работа по оценке биохимических показателей крови человека и животных предназначена врачу любой специальности и посвящена отсутствующему в системе медицинского образования разделу — умению писать лабораторный эпикриз, следовательно, понимать метаболическую сущность биохимических показателей как важнейшего элемента физиологического, а значит, и клинического мышления. Биохимия — это философия медицины, но количественная.
Читателю предложено начать с отбора и осмысления той информации из фундаментальной биохимии (любой организм — это биохимическая машина), которая необходима врачу для практического использования в конкретной ситуации с конкретным пациентом. Одновременно эта информация должна дать ориентиры на глубинное (вплоть до молекулярного уровня) понимание патологии с учетом основных биохимических процессов, которые более известны в теории как патогенетические механизмы и редко упоминаются (хотя непременно должны упоминаться) в практике врача любого профиля.
Монография представлена в виде текста, цветных иллюстрированных схем, таблиц с комментариями без формул, что делает сложнейший медицинский материал доступным для широкого круга читателей: студентов медицинского и биологического профиля, врачей, научных сотрудников, абитуриентов, аспирантов и соискателей, а также для любого любознательного человека, который интересуется собственным организмом, хочет иметь правильные научные представления о самом себе.
Купить книгу "Биохимические показатели в медицине и биологии" - Рослый И. М.
Содержание книги "Биохимические показатели в медицине и биологии" - Рослый И. М.
Глава 1. Молекулярная биология как основа формирования логического мышления
Глава 2. Некоторые смысловые заповеди научной логики
Глава 3. Биология и медицина: приоритет фундаментального знания или клинического мышления?
Глава 4. Алкоголизм как модель физиолого-биохимических закономерностей в танатогенезе или фундаментальные закономерности на примере изучения алкоголизма
Глава 5. Белковая часть биохимического анализа
Глава 6. Ферменты крови
Глава 7. Метаболический смысл ферментемии (историко-методическое наблюдение)
Глава 8. Метаболический анализ ферментемии
Глава 9. Субстратная основа ферментемии
Глава 10. Свертывающая система — основной источник субстратов для лихорадочно-интоксикационного синдрома или организменный буфер основных метаболических потоков в патологии
Глава 11. Физиологическое обоснование ферментемии
Глава 12. Биохимические показатели в переводе на язык физиологии
Глава 13. Биохимические механизмы физиологических процессов или фундаментальные причины уникальных явлений
Глава 14. Биохимические показатели крови беременных как пример выраженной физиологической адаптации
Глава 15. Формирование термогенеза у новорожденных
Глава 16. Метаболическая характеристика онтогенетического развития
Глава 17. Медико-биологические параллели: цитолитический синдром или адаптационный механизм?
Глава 18. Субстраты токсикоза и биоэнергетика (немного теории)
Глава 19. Термогенез, лихорадка и биоэнергетика организма в биохимических показателях крови
Глава 20. Туберкулез как пример сжигающего термогенеза
Глава 21. Способ выявления общего адаптивного механизма по биохимическим показателям крови на примере инфекции, беременности у людей и у интактных крыс
Глава 22. Субстраты эндотоксикоза и биоэнергетика организма
Глава 23. Сравнительная характеристика биохимических показателей крови интактных крыс и человека с учетом их физиологических особенностей
Глава 24. Триада ферментов и триада механизмов в оценке метаболизма животных и человека
Глава 25. Биохимические особенности экспериментально-клинического состояния животных
Глава 26. Механизмы поддержания общего белка плазмы крови как основа биохимического гомеостаза в экспериментальных и клинических условиях
Глава 27. Метаболические эффекты в системе гомеостаза у крыс при воздействии кокарбоксилазы
Глава 28. Фундаментальные закономерности в оценке адаптивных механизмов по биохимическим показателям сыворотки крови
Глава 29. Метаболические основы становления психофизиологических свойств и способы их оценки: онтогенетический старт
Глава 30. Метаболический алгоритм анализа адаптивных механизмов в онтогенезе и его лабораторно-клиническая иллюстрация
Глава 31. Биохимические признаки адаптации.
Способ оценки метаболизма больных пищевой токсикоинфекцией по биохимическим показателям крови
Глава 32. Алкогольная интоксикация в развитии пищевой токсикоинфекции
Глава 33. Вирусные гепатиты как пример экономного термогенеза
Купить книгу "Биохимические показатели в медицине и биологии" - Рослый И. М.










































































0 комментариев