Основные синдромы врожденных пороков сердца (артериальная гипоксемия, сердечная недостаточность). Детская кардиохирургия. Лекция для врачей
Лекция для врачей "Основные синдромы врожденных пороков сердца (артериальная гипоксемия, сердечная недостаточность). Детская кардиохирургия (отрывок из книги "Детская кардиохирургия: Руководство для врачей" - Л. А. Бокерия, К. В. Шаталова)
Основные синдромы врожденных пороков сердца
Клинические проявления заболеваний сердца у детей могут быть весьма вариабельными. При аномалиях развития коронарных артерий возможно наличие признаков стабильной ишемии миокарда (ангина кормления) или развития инфаркта миокарда. Ряд аномалий развития аорты может манифестировать дисфагией. Однако в большинстве случаев заболеваний сердца у детей может присутствовать один (или сочетание нескольких) из следующих синдромов: сердечная недостаточность, артериальная гипоксемия, легочная гипертензия, нарушения ритма сердца, артериальная гипертензия. Наиболее значимые для клиницистов синдромы - артериальной гипоксемии и сердечной недостаточности.
Артериальная гипоксемия
Врожденные пороки сердца, протекающие с артериальной гипоксемией (SatаO2 менее 90%, раО2 менее 60 мм рт. ст.), характеризуются наличием циркулярной гипоксии, обусловленной веноартериальным сбросом крови, гиповолемией малого круга кровообращения и параллельным функционированием кругов кровообращения. Однако и в случаях отсутствия исходных предпосылок к гипоксии ее возникновение в ходе прогрессирования болезни (сердечной недостаточности, легочной гипертензии) предопределяет общность патологических механизмов. Большинство патологических и компенсаторных реакций у этих пациентов является ответом на снижение напряжения кислорода в тканях, ключевую роль в их регуляции играет гипоксия-индуцируемый фактор (ГИФ).
Гипоксия-индуцируемый фактор представляет собой транскрипционный фактор, состоящий из двух полипептидных цепей. β-Субъединица экспрессируется конститутивно, α-субъединица (α1- и α2-изоформы) является регуляторной, содержит кислородзависимый домен деградации (ODDD) и два домена, активирующих транскрипцию (TAD). Уровень ГИФа зависит от стабильности соответствующей матричной рибонуклеиновой кислоты (мРНК), на которую негативно влияют микроРНК и мРНК-дестабилизирующий белок. В условиях нормоксии под влиянием пролилгидроксилазы как минимум один остаток пролина ODDD гидроксилируется, после чего при посредстве белка фон Хиппеля-Линдау происходит связывание ГИФα с убиквитином, что делает его мишенью для протеосомной деградации. Для поддержания каталитической активности пролилгидроксилазы необходимы кислород, Fe2+ , 2-оксиглутарат, аскорбат. Она ингибируется оксидом азота (II), некоторыми промежуточными продуктами цикла Кребса (фумарат, сукцинат) и свободными радикалами кислорода, которые вызывают окисление Fe2+ активного центра пролилгидроксилазы и угнетение фактора инактивации ГИФ.
Сиртуин 3, активируя супероксиддисмутазу, модулируя компоненты цепи переноса электрона и активируя некоторые ферменты цикла Кребса, способствует снижению образования свободных радикалов кислорода и тем самым дестабилизации ГИФа. Фактор инактивации ГИФ, гидроксилирующий аспарагин-803 в TAD в присутствии кислорода, пространственно препятствует взаимодействию ГИФ и коактиватора транскрипции р300/СВР (рис. 3, а).
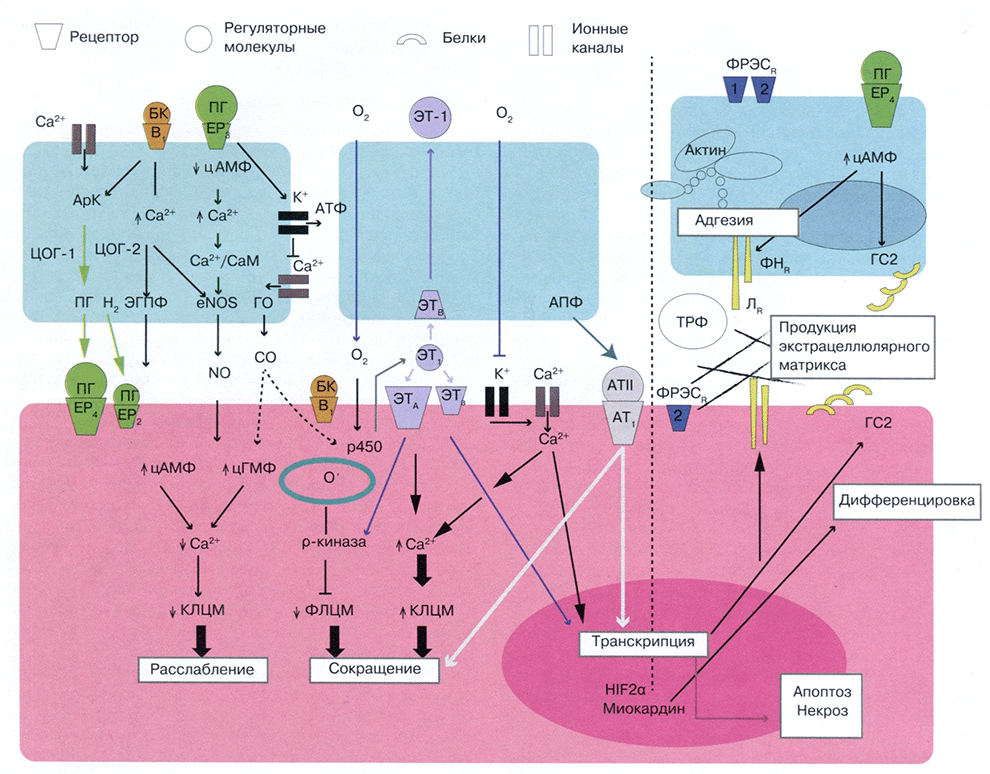
Рис. 2. Регуляция открытого артериального протока у плода и механизмы его функциональной и анатомической окклюзии.
Голубые фигуры - эндотелиоциты, розовая - гладкомышечная клетка артериального протока. АрК - арахидоновая кислота; ЦОГ циклооксигеназа; ЕР (2,3,4) - рецепторы простагландинов; ПГ - простагландины; БК - брадикинин (с его рецепторами В1, и В2); ГО - гемоксигеназа; ЭГПФ - эндотелиальный гиперполяризующий фактор; СаМ - кальмодулин; КЛИМ - киназа легких цепей миозина; ФЛЦМ - фосфатаза легких цепей миозина; ЭТ-1 - эндотелии-1; ЭТА. ЭТВ - эндотелиновые рецепторы; ТРФ - трансформирующий ростовой фактор β; ФРЭСр - рецептор фактора роста эндотелия сосудов; ФНК - рецепторы к фибронектину; ЛR - рецепторы к ламинину; ГС2 - гиалуронат-синтетаза 2; HIF2a - гипоксия-индуцируемый фактор 2α; цАМФ - циклический аденозин монофосфат; цГМФ - циклический гуанозин моногросфат; АПФ - ангиотензинпревращающий фермент; АТII - ангиотензин II
В условиях гипоксии влияние пролилгидроксилазы и фактора инактивации ГИФ ослабевает, ГИФα стабилизируется и димеризуется с ГИФβ. После взаимодействия с коактиваторами (рЗ00/СВР и изоформой пируваткиназы М2) инициируется транскрипция факторов, регулирующих клеточный адаптивный ответ на гипоксию. Среди мишеней ГИФ - гены, принимающие участие в регуляции эритропоэза и метаболизма железа, ангиогенеза и сосудистого тонуса, метаболизма глюкозы и внеклеточного матрикса, клеточной пролиферации и апоптоза (рис. 3, б).
Увеличение продукции фактора роста эндотелия сосудов (ФРЭС) под влиянием ГИФ является ключевым звеном регуляции ангиогенеза. После взаимодействия ФРЭС с рецептором на поверхности эндотелиоцита происходит трансформация последнего с изменением апикально-базальной полярности, ослабление межклеточных контактов, разрушение базальной мембраны и межклеточного матрикса. Рост эндотелиальной почки идет по пути градиента концентрации ФРЭС. При этом не должны нарушаться межэндотелиальные контакты. Взаимодействие разных эндотелиальных почек обеспечивает слияние смежных ростков. В основном за счет слияния вакуолей достигается образование просвета. Кровоток по вновь образовавшемуся сосуду увеличивает оксигенацию тканей и снижает уровень факторов ангиогенеза, на этом фоне обеспечивается стабилизация эндотелия (рис. 4).
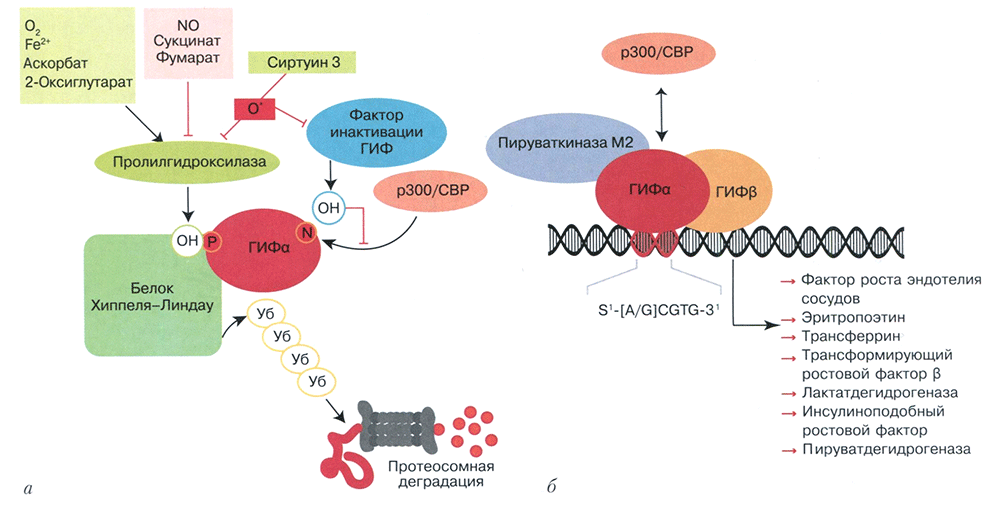
Рис. 3. Регуляция активности гипоксия-индуцируемого фактора в условиях нормоксии (а) и гипоксии (б):
а - при нормальном напряжении кислорода ГИФα подвергается убиквитин (Уб)-опосредованной протеосомной деградации, контролируемой пролилгидроксилазой при участии белка фон Хиппеля-Линдау. Связыванию ГИФα с коактиватором транскрипции препятствует кислородозависимое гидроксилирование аспарагина фактором инактивации ГИФ; б - снижение напряжения кислорода тормозит ингибирующие ГИФα факторы, ГИФα димеризуется с ГИФβ, и взамодействует с кофакторами транскрипции и инициирует ее.
Более высокие уровни таких ангиогенных факторов, как ФРЭС, тромбоцитарный фактор роста и лептин, характерны для больных с врожденным пороком сердца (ВПС). Наибольшие их значения отмечены у пациентов с гипоксемией, обструкцией выхода из ПЖ, легочной гипертензией и при наличии коллатеральных артерий. Следует заметить, что гипоксией индуцируемая стимуляция ФРЭС, приводящая к увеличению проницаемости сосудов в дебюте, может лежать в основе синдрома капиллярной утечки, который в данном аспекте может рассматриваться как глобальный незавершенный ангиогенез в ответ на острое гипоксическое повреждение тканей.
Гипоксия-индуцируемый фактор вызывает увеличение экспрессии эритропоэтина, трансферрина и его рецептора, угнетает синтез гепсидина. Итогом этих процессов является стимуляция эритроцитопоэза. Однако при врожденных пороках сердца значимость этого компенсаторного механизма резко ограничена. Во-первых, поскольку эритроцитопоэз инициирован не гемической гипоксией, а иными патологическими механизмами, он не способен привести к ожидаемому улучшению оксигенации тканей. В условиях веноартериального шунта объемная концентрация кислорода мало зависит от концентрации гемоглобина и значительно больше - от величины этого шунта. Веноартериальный сброс в сочетании с гиповолемией малого круга кровообращения, поддерживая низкое напряжение кислорода в тканях, запускают порочный круг, имеющий и негативные последствия: потребление субстратов (в частности, железа, как показано выше, необходимого и для обеспечения адаптационных к гипоксии механизмов), ухудшение реологических условий с нарастанием тканевой гипоксии, гемостатический дисбаланс и т. д. Несмотря на дефицит факторов свёртывания и тромбоцитов, эритроцитоз у цианотических больных, ухудшая реологические свойства крови и обусловливая эритроцитарный сладж, сопровождается развитием тромбоза различных локализаций (сосуды мозга, легочная артерия, системные вены) у 30-40% больных. Кроме того, эритроцитоз не способствует увеличению оксигенации тканей, поскольку поток через сечение капилляра в единицу времени не зависит от количества эритроцитов.
Также ГИФ вызывает фенотипическую трансформацию и индукцию пролиферации фибробластов через стимуляцию транскрипции инсулиноподобного фактора роста 2 и трансформирующего фактора роста α. Параллельно с этим он способен через посредство тканевого ингибитора матричной металлопротеиназы и ингибитора активатора плазминогена 1-го типа вызывать матриксную модификацию, а также инициировать апоптоз. Финалом этих процессов служит развитие фиброза, который клинически проявляется симптомами «часовых стекол» и «барабанных палочек», а также диастолической дисфункцией миокарда желудочков.
При снижении напряжения кислорода в тканях ГИФ способен увеличить экспрессию ферментов гликолиза (фосфосфруктокиназы-1 и ее аллостерического регулятора фруктозо-2, 6-бифосфата, енолазы-1), лактатдегидрогеназы, пируватдегидрогеназы, переносчиков глюкозы, повышая тем самым ее содержание в клетке, а также оптимизировать дыхательную цепь митохондрий для функционирования в условиях гипоксии. Лактат и пируват, в свою очередь, способны вызывать дальнейшее накопление ГИФ.
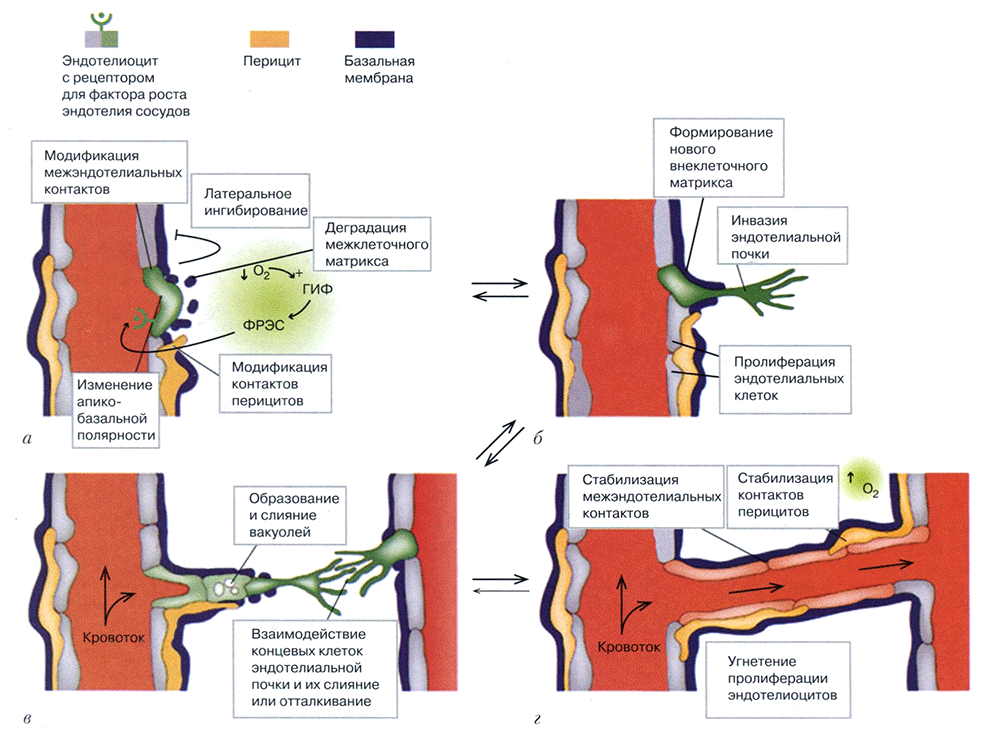
Рис. 4. Этапы ангиогенеза:
а - снижение напряжения кислорода в тканях определяет повышение уровня ГИФ и активацию транскрипции ФРЭС; связывание последнего с рецептором на поверхности эндотелиоцита приводит к изменению апикобазальной полярности, ослаблению межэндотелиальных контактов, деградации межклеточного матрикса; б - рост эндотелиальной почки, включающей как пролиферацию эндотелиоцитов, так и новые отложения внеклеточного матрикса, идет по градиенту концентрации ФРЭС; в - взаимодействие концевых клеток эндотелиальной почки с их взаимным притяжением или отталкиванием регулирует их соединение; образование и слияние вакуолей в эндотелиоцитах является одним из механизмов образования просвета нового сосуда; г - кровоток по вновь образованному сосуду уменьшает гипоксию и активность проангиогенных сигналов, происходит стабилизация межклеточных контактов и межклеточного матрикса
Гипоксия-индуцируемый фактор принимает участие во многих путях, регулирующих активацию и дифференцировку макрофагов, лимфоцитов, нейтрофилов. Эти процессы сопровождаются секрецией широкого спектра цитокинов (фактор некроза опухоли α, интерлейкинов-1 и -6 и т. д.), что обусловливает взаимосвязь между гипоксией, сердечной недостаточностью и воспалением.
Завершая краткое рассмотрение сигнальных путей, активируемых снижением напряжения кислорода в тканях, можно констатировать, что независимо от причины, вызывающей гипоксию (снижение сердечного выброса, веноартериальный шунт, дыхательная недостаточность и т. д.), реакция организма на нее относительно стереотипная. Она зависит от длительности существования и степени выраженности гипоксии и состоит в вазодилатации и ангиогенезе, пролиферации клеток и запрограммированной их гибели, модификации межклеточного матрикса, стимуляции эритроцитопоэза. При наличии определенного баланса эти процессы способны увеличить устойчивость к гипоксии. Однако их эскалация обусловливает формирование патологических состояний, усугубляющих влияние гипоксии.
Клинические проявления синдрома артериальной гипоксемии
Основное клиническое проявление артериальной гипоксемии - цианоз, который при врожденном пороке сердца носит обычно центральный характер. Степень его выраженности зависит от анатомии врожденного порока, объема легочного кровотока, функциональных и органических изменений сосудистой стенки, активности функционирования артериовенозных анастомозов. Для пороков с дуктус-зависимым системным кровотоком характерным является дифференцированный цианоз.
У новорожденных чаще всего необходимо дифференцировать дыхательные и сердечные причины цианоза. В связи с этим важным представляется тест с дыханием 100% кислородом. При дыхательной недостаточности после его проведения в течение 10 мин отмечается существенное увеличение раО2, тогда как при наличии врожденного порока сердца его прирост обычно не превышает 15 мм рт. ст.
У больных с врожденными пороками сердца, при которых величина легочного кровотока зависит от тонуса легочного инфундибулума (тетрада Фалло, двойное отхождение сосудов от правого желудочка с обструкцией выхода из правого желудочка и др.), степень выраженности гипоксии может варьировать вплоть до развития одышечно-цианотического приступа. Это состояние характеризуется прекращением антеградного легочного кровотока вследствие спазма выводного отдела правого желудочка. Наряду с нарастанием цианоза и возможным синкопальным состоянием, физикальным его проявлением служит исчезновение систолического шума над выходом из правого желудочка.
У больных с врожденными пороками сердца, при которых уровень гипоксемии определяется величиной легочного кровотока, соотношение легочного и системного кровотока достаточно хорошо коррелирует с насыщением крови кислородом. Так, Qp:Qs, равное 2:1, соответствует SataO2 85%, 1:1 78%, 0,5:1 - 70%.
Сердечная недостаточность
Адекватный сердечный выброс определяется взаимоотношением преднагрузки желудочка, величиной постнагрузки и удовлетворительной контрактильной функцией миокарда, а также должной частотой сердечных сокращений. Развитие сердечной недостаточности у больных с ВПС может быть вызвано увеличением преднагрузки, обусловленной существованием внутрисердечных шунтов (ДМЖП, ДМПП, аномальный дренаж легочных вен п т. д.) или недостаточностью клапанов, увеличением постнагрузки из-за наличия врожденных обструкций (коарктация аорты, легочный или аортальный стеноз) или снижением сократимости миокарда вследствие гипоксического/ишемического поражения миокарда. Последнее может быть вызвано как прямым нарушением коронарного кровотока (аномалии коронарных артерий), так и вторичным его повреждением у пациентов с выраженной артериальной гипоксемией.
Среди особенностей сердечной недостаточности при ВПС следует отметить большую долю правожелудочковой недостаточности, а также феномен недостаточности единственного желудочка, обеспечивающего системный и легочный кровоток.
При длительно существующем патологическом процессе формируются как функциональные, так и структурно-геометрические изменения миокарда, называемые ремоделированием сердца. Основные геометрические типы ремоделирования левого желудочка связаны с патогенетическим механизмом, приводящим к его формированию: основополагающая высокая преднагрузка или же пост нагрузка. В первом случае объемная нагрузка левого желудочка обусловливает увеличение длины кардиомиоцитов, уменьшение толщины стенки левого желудочка, увеличение его объема и приводит к изменению геометрии по эксцентрическому типу. Во втором случае в ответ на высокое конечное систолическое давление возникает компенсаторное увеличение числа саркомеров и толщины кардиомиоцитов, толщины стенки левого желудочка и изменение его геометрии в сторону концентрической гипертрофии. Наряду с гипертрофией миокарда диастолическая жесткость будет определяться степенью выраженности фиброза миокарда, объективная оценка которого в педиатрии затруднена. В связи с этим интерес может вызвать применение тканевого допплера в сочетании с определением такого маркера фиброза миокарда, как галектин-З. Особо следует отметить состояние нормальной пост- и сниженной преднагрузки, определяемое как концентрическое ремоделирование, оно характеризуется увеличением диастолической жесткости миокарда на фоне сниженного конечного диастолического объема желудочка и нормальной массы миокарда. Подобные случаи связаны с риском развития острой сердечной недостаточности после восстановления нормальной преднагрузки.
При длительном существовании нарушений системной гемодинамики происходят процессы фетализации фенотипа миокарда - трансформация синтеза эффекторных и регуляторных белков миокарда в сторону их изоформ, характерных для внутриутробного периода. Фетализации подвергаются сократительные белки (актин и миозин), ионные каналы, энзимы, что оказывает влияние как на морфофункциональные нарушения, так и на клинический статус пациента.
Из множества существующих патогенетических механизмов развития сердечной недостаточности у детей немалая роль в настоящее время отводится гипотезе генетического модифицирования. При прогнозировании развития многих форм патологии сердечно-сосудистой системы учитываются результаты генетического тестирования (Guidelines tor the diagnosis and management of hypertrophic cardiomyopathy-2007; Guidelines for the diagnosis and management of familial dilated cardiomyopathy-2007; Genetic testing in cardiovascular disease-2007). Так, на сегодняшний день известно о взаимосвязи между дефицитом транскрипционного фактора STAT3 и развитием перинатальной кардиомиопатии. Дефицит этого фактора ассоциирован с нарушением выработки пролактина, в том числе с продукцией его антиангиогенных и проапоптотических субформ. Они могут обусловливать миокардиальную ишемию и усиливать оксидативный стресс. Повышенный уровень β-адренергической киназы (GRK2) оказывает влияние на функциональную активность α2-адренорецепторов и ассоциирован с развитием сердечной недостаточности у детей раннего возраста. Высокий уровень концентрации аутоантител к β-адренорецепторам провоцирует отрицательные инотропные эффекты и, связываясь со своей мишенью в кардиомиоцитах, является независимым фактором риска развития кардиомиопатии.
Гипотеза о роли апоптоза в развитии сердечной недостаточности у детей объясняет прогрессирующую дисфункцию левого желудочка отчасти как результат запрограммированной гибели кардиомиоцитов. В ряде исследований отмечено усиление процессов апоптоза после повреждения миокарда вследствие длительной артериальной гипоксемии, процессов ишемии, а также реперфузии. Активация процессов апоптоза наблюдается также при заболеваниях сердца, сопровождающихся ремоделированием левого желудочка. Внешний путь индукции апоптоза начинается с взаимодействия белков клеточной поверхности, относящихся к семейству Fas-рецепторов (Fas-R), со специфическими лигандами (Fas-L). Образование в процессе апоптоза митохондриальной поры, выделение цитохрома С и активация апоптоз-индуцирующего фактора APF-1 способствуют перестройке цитоплазматической мембраны и связыванию с клеточной поверхностью аннексина-V, что, в свою очередь, инициирует запрограммированную гибель миоцита. Сигнальные пути инициации апоптоза и некроза часто оказываются общими. Выявление маркеров апоптоза (sFas-R, sFas-L, цитохром С, аннексии V) и его регуляторов (супероксид- дисмутаза и оксид азота) в процессе формирования хронической сердечной недостаточности у детей с кардиомиопатиями и врожденными пороками сердца представляется актуальным для оценки отдаленного прогноза. Достаточно известными триггерами апоптоза являются цитокины (особенно интерлейкины и фактор некроза опухолей), повреждение митохондрий, оксидативный стресс. Фактор некроза опухоли a (TNF-α) является цитокином, продуцируемым моноцитами и макрофагами. Он действует как мультипотентный модулятор иммунного ответа, играет значительную роль в патогенезе воспалительных заболеваний миокарда. В период поствоспалительной регенерации TNF-α наряду с интерлейкином (IL)1β стимулирует экспрессию молекул адгезии, что способствует восстановлению сосудистой стенки.
Воспаление играет важную роль в происхождении и прогрессировании нарушения сосудистого сопротивления. Медиаторы воспаления продуцируются иммунокомпетентными клетками (в норме и при патологии) и иными (кардиомиоциты, эндотелиоциты) клетками (в условиях патологии). Интерлейкин-1 является цитокином с двумя молекулярными формами, которые характеризуются идентичным биологическим действием, включая синтез белков острой фазы, хемотаксис полиморфно-ядерных гранулоцитов, высвобождение полиморфно-ядерных гранулоцитов. Транскрипция гена IL-1 активируется при повреждении соединительной ткани, как инфекционного, иммунного, так и механического характера. Интерлейкин-8 избирательно стимулирует способность нейтрофилов и Т-лимфоцитов мигрировать в поврежденные и воспаленные ткани. Выделенный из эндотелия, он может регулировать воспалительный процесс путем влияния на взаимодействие нейтрофилов, способствуя миграции активаторов тканевого фиброза. Хемокины - семейство малых протеинов, выполняющих функцию межклеточных посредников для контроля активации и миграции различных клеточных элементов к очагу воспаления в случае возникновения иммунных реакций. Выделяют два основных класса хемокинов: альфа-хемокины (опосредующие преимущественно хемотаксис нейтрофилов) и бета-хемокины (способствующие хемотаксису моноцитов и лимфоцитов). Активность хемокинов проявляется при острых и хронических воспалительных процессах. С одной стороны, их уровень возрастает в ответ на острое ишемическое повреждение сократительного миокарда, с другой низкий базовый уровень увеличивает тяжесть структурного повреждения и является независимым предиктором смертности при хронической сердечной недостаточности.
Возникновение патологических гемодинамических условий создает предпосылки для активации процессов ремоделирования, включающих стойкое изменение структурной организации, происходящее на всех уровнях: это активация отдельных участков генома, молекулярные, клеточные, а также интерстициальные изменения. Пусковым стимулом ремоделирования является также нейрогормональная активация (норадреналин, ангиотензин II, эндотелии-1, локальные пептиды, стимулирующие пролиферацию клеток). В результате этого активируются генная модуляция раннего ответа, включающая индукцию синтеза сократительных белков и неконтрактильных протеинов, таких как предсердный натрийуретический пептид и Na-K-АТФ-аза.
Натрийуретические пептиды - это семейство вазоактивных пептидов, обладающих рядом кардиопротективных свойств. В настоящее время к ним относятся предсердный натрийуретический пептид (А-НУП), мозговой натрийуретический пептид (В-НУП) и последовательно открытые вслед за ними С- и D-типы натрийуретических пептидов. Стимулом для высвобождения А-НУП и В-НУП является повышение конечного диастолического давления в камерах сердца в ответ на нарастание преднагрузки, а также увеличение гидростатического давления в ликвородинамической системе. Для предсердного натрийуретического пептида характерно участие в регуляции как системного, так и локального гидробаланса (серозные полости, фолликулярные полости, ликворные пространства). Те же эффекты определяют его участие в регуляции объема клеток, в частности астроглии: гормон уменьшает их объем путем подавления входа воды или увеличения ее выхода из клетки через регуляцию активности Na+/H+-порта, К+- и Сl --каналов. В центрах гипоталамуса натрийуретические пептиды при участии цГМФ- и NO подавляют гормонопоэз и в то же время вызывают подобное непрямое ингибирование гормонопоэза в аденогипофизе.
У новорожденных наиболее высокая концентрация натрийуретического пептида наблюдается в первые трое суток жизни, а затем прогрессивно снижается в течение первой недели.
Выработка А-НУП и В-НУП происходит в первую очередь в предсердных кардиомиоцитах и в меньшем количестве - в миоцитах желудочков. Хранение этих пептидов осуществляется в виде прогормона в предсердных гранулах, а в ответ на стрессовое воздействие происходит их выделение в системный кровоток. Под воздействием протеаз исходные формы расщепляются на неактивный N-концевой (NT-proANP и NT- proBNP) и активный С-концевой фрагменты. При наличии сердечно-сосудистых заболеваний экспрессия генов гормона активируется в кардиомиоцитах желудочков в большем объеме. Синтез С-НУП и D-НУП осуществляется эндотелием сосудов. Натрийуретические пептиды подавляют секрецию ренина, альдостерона и ангиотензина II, а также симпатическую активацию. Являясь естественными антагонистами ренинангиотензинной, симпатико-адреналовой систем, альдостерона и вазопрессина, НУП усиливают диурез, выделение с мочой натрия, вызывают периферическую вазодилатацию, снижают артериальное давление, пред- и постнагрузку. Кроме того, пептиды снижают синтез и высвобождение эндотелина, подавляют рост гладких мышечных, эндотелиальных клеток и кардиальных фибробластов. Разрушение НУП осуществляется нейтральной эндопептидазой - ферментом, наибольшее количество которого содержится в эпителиальных клетках проксимального канальца нефрона.
Также известна немаловажная роль эндогенных вазодилататоров в компенсации нарушений системной гемодинамики, регуляции сосудистого тонуса, участии в качестве нейротрансмиттеров в синаптической передаче, в регуляции процессов апоптоза. Синтез оксида азота (NO) происходит при действии на мембранные рецепторы эндотелиоцитов ацетилхолина, адреномедуллина, гистамина, брадикинина, АТФ. NO-синтетаза помимо образования оксида азота стимулирует синтез интерлейкина-1, альфа-интерферона. Вазодилатирующий эффект оксида азота опосредуется активацией образования в гладкомышечных клетках цГМФ, подавлением вазоконстрикторного действия ангиотензина II. Синтезированный клетками эндотелия оксид азота выделяется не только через базальную мембрану в сторону гладкомышечных клеток кровеносных сосудов, но и через апикальную мембрану, где тормозит адгезию тромбоцитов и лейкоцитов крови к эндотелиальной выстилке стенки сосуда.
Антиагрегантное действие оксида азота отчасти опосредовано простациклином, образующимся в эндотелии. Эндотелины локализованы в эндотелии сосудов легких, сердца, почек, плаценты, поджелудочной железы, надпочечников, головного мозга, сосудах гладких мышц. Наличие двух форм эндотелинпревращающего фермента (мембранно-связанной и внутриклеточной) определяет и разные места образования эндотелинов - в цитоплазме и на поверхности клеточной мембраны. Эндотелинпревращающий фермент вызывает не только образование эндотелина, но и способен вызвать гидролиз и инактивацию па поверхности эндотелиоцитов ряда регуляторных пептидов и гормонов (инсулина, брадикинина, нейротензина и др.). Активация эндотелинпревращающего фермента происходит под влиянием цитокинов. Следствием специфического связывания эндотелина является активация систем вторичных посредников (фосфолипаза С, цГМФ и цАМФ, фосфолипаза D и А2) с последующим прямым действием на гладкую сосудистую мускулатуру. Связывание эндотелина с рецепторами гладких мышц сосудов вызывает их сокращение и вазоконстрикцию (через повышение концентрации внутриклеточного кальция), а также стимуляцию митогенеза и пролиферацию клеток (через активацию тирозинкиназы и фосфорилирование тирозина). Взаимодействие эндотелинов с рецепторами клеток эндотелия приводит к опосредованным эффектам в виде высвобождения из эндотелия вазоактивных факторов, обусловливающих расширение сосудов (оксид азота, гиперполяризующий фактор, простагландины). Кроме того, эндотелины изменяют секрецию гормонов гипофиза и надпочечников, стимулируют секрецию натрийуретических пептидов.
Постоянство объема циркулирующей крови и системной гемодинамики обеспечивается регуляторными гуморальными системами путем их влияния на концентрацию электролитов и воды. Наиболее значимыми из них являются: нейрогипофизарные гормоны, ренин - ангиотензин-альдостероновая система, натрийуретические пептиды, кортикостероиды и кортикотропин.
Вазопрессин (антидиуретический гормон) секретируется задней долей гипофиза, на его концентрацию в системном кровотоке влияют уровень осмолярности плазмы, артериальное давление, парциальное содержание ангиотензина II. Секреция вазопрессина зависит от его синтеза в гипоталамических нейронах и регулируется следующими стимулами: 1) сдвиги осмотического давления и содержания натрия в крови, воспринимаемые интероцепторами сосудов и сердца (осмо-, натрио-, волюмо- и механорецепторы), а также непосредственно гипоталамическими нейронами (центральные осмореценторы); 2) активация гипоталамических ядер при эмоциональном и болевом стрессе, физической и гемодинамической нагрузке; 3) гормоны плаценты и ангиотензин II, как содержащийся в кровотоке, так и образующийся в мозге. В процессе циркуляции вазопрессин не связывается с белками плазмы, но ассоциирован с тромбоцитами, выполняющими по отношению к гормону транспортную функцию. Эффекты вазопрессина реализуются за счет связывания пептида в тканях-мишенях с двумя типами мембранных рецепторов – V1 и V2. Стимуляция V1-рецепторов, локализованных на мембране эндотелиальных и гладкомышечных клеток кровеносных сосудов, через вторичных посредников инозитол-3-фосфат и кальций-кальмодулин вызывает сужение сосудов. Стимуляция V2-рецепторов базолатеральной мембраны клеток дистальных отделов почечных канальцев через вторичного посредника цАМФ вызывает повышение проницаемости стенки канальцев для воды, обусловливает ее реабсорбцию и концентрирование мочи. Вазопрессин является единственным гормоном, способным стимулировать канальцевую реабсорбцию воды без задержки натрия.
Функция кортикоидных гормонов заключается в регуляции общих метаболических процессов. Помимо этого гормоны оказывают определенное минералокортикоидное действие - способствуют задержке Na+, хлора и воды, усилению выведения катионов К+ и Са2+, а также повышению системного артериального давления за счет формирования положительного гидробаланса организма. Основные биологические эффекты кортикостероидов проявляются через взаимодействие с двумя типами рецепторов. V1-рецепторы расположены в клетках гладкой мускулатуры в комплексе с фосфолипазой С. Результат трансдукции сигнала в эти клетки выражается в сокращении сосуда. V2- рецепторы расположены в клетках почечных канальцев. Взаимодействие гормонов с этим типом рецепторов активирует аденилатциклазную систему, увеличивая в клетках концентрацию цАМФ и активность протеинкиназы А. В результате данной активации происходит фосфорилирование белка, стимулирующего экспрессию генов канальцевой системы для обеспечения реабсорбции воды. Определенную роль в системной регуляции играют гормоны щитовидной железы в связи с их способностью увеличивать потребление глюкозы кардиомиоцитом, стимуляцию синтеза белка, чувствительность мышечных клеток к действию адреналина. Состояние хронического гипотиреоза, в свою очередь, приводит к развитию гипометаболизма, выраженному снижению основного обмена. дислипидемии, торможению окислительных реакций, повышению трансмембранной и капиллярной проницаемости, накоплению кислых гликозаминогли-канов в тканях и увеличению их гидрофильности с развитием отечного синдрома.
Началом активации ренин-ангиотензин-альдостероновой системы является увеличение секреции ренина юкстагломерулярными клетками афферентных артериол почек, которое стимулируется следующими факторами: снижением давления крови в афферентных артериолах, снижением концентрации ионов Na+ в дистальных канальцах, симпатической стимуляцией почек, опосредуемой через β1-рецепторы, вазодилататорными простагландинами (простациклин, PgE2). Ренин-ангиотензинная система представляет собой механизм среднесрочного и долгосрочного регулирования артериального давления и поддержания почечного кровотока. В ответ на нарушения системной гемодинамики в почечных артериолах происходит активация выработки ренина в почках, под действием которого ангиотензиноген превращается в активную форму-ангиотензин, который, в свою очередь, под действием ангиотензинпреврашаюшего фермента переходит в ангиотензин II. Конечным результатом функционирования РАС является взаимодействие ангиотензина II с его тканевыми рецепторами. Сосудосуживающее действие ангиотензина II относится к среднесрочной регуляции, задержка натрия и воды под действием ангиотензина II и альдостерона - к долгосрочной регуляции.
Купить книгу "Детская кардиохирургия: Руководство для врачей" - Л. А. Бокерия, К. В. Шаталова
Книга "Детская кардиохирургия: Руководство для врачей"
Авторы: Л. А. Бокерия, К. В. Шаталова

В руководстве обобщены современные представления о хирургическом лечении заболеваний сердца у детей. Рассмотрены возрастные особенности физиологии и патофизиологии сердечно-сосудистой системы. Изложены современные взгляды на диагностику заболеваний, анестезиологическое и перфузионное обеспечение безопасности операции, интенсивную терапию после операции. Представлены условия и результаты применения систем экстракорпоральной поддержки сердечно-сосудистой системы и трансплантации сердца у детей. Большое место отводится рассмотрению анатомии, гемодинамики, семиотики и естественного течения врожденных пороков сердца, показаний, способов, а также результатов хирургического лечения врожденных заболеваний сердца. Особо выделен раздел по лечению нарушений ритма сердца и проводимости у детей.
Купить книгу "Детская кардиохирургия: Руководство для врачей" - Л. А. Бокерия, К. В. Шаталова
Раздел I. Общие вопросы
I.1. Кровообращение плода. Семиотика заболеваний сердца
I.2. Организация кардиологической помощи детям
I.3. Возможности эхокардиографии плода
I.4. Современные методы визуализации в детской кардиохирургии
I.5. Общие вопросы хирургии врожденных пороков сердца
I.6. Трансплантация сердца и сердечно-легочного комплекса у детей
I.7. Имплантаты в детской кардиохирургии
I.8. Эндоваскулярное лечение больных с врожденными пороками сердца
I.9. Анестезиологическое обеспечение в детской кардиохирургии
I.10. Интенсивная терапия в раннем послеоперационном периоде у детей после кардиохирургических вмешательств
I.11. Искусственное кровообращение у детей
I.12. Современные стратегии защиты миокарда у детей
I.13. Вспомогательное кровообращение у детей
Раздел II. Врожденные пороки сердца
II.1. Номенклатура и классификация врожденных пороков сердца
II.2. Аномалии формирования и положения сердца. Эктопия сердца. Аномалии дренажа системных вен
II.3. Аномалии развития предсердного сегмента
II.3.1. Дефект межпредсердной перегородки. Частичный аномальный дренаж легочных вен
II.3.2. Тотальный аномальный дренаж легочных вен
II.3.3. Стенозы и гипоплазия легочных вен
II.3.4. Трехпредсердное сердце
II.3.5. Врожденные аневризмы предсердий
II.4. Аномалии атриовентрикулярного соединения
II.4.1. Общий атриовентрикулярный канал
II.4.2. Врожденная патология митрального клапана
II.4.3. Аномалия Эбштейна
II.4.4. Бивентрикулярное прикрепление атриовентрикулярных клапанов. Смещенные атриовентрикулярные клапаны
II.5. Аномалии желудочкового сегмента
II.5.1. Дефект межжелудочковой перегородки
II.5.2. Двухкамерный правый желудочек
II.5.3. Criss-cross сердце
II.5.4. Врожденные дивертикулы сердца
II.6. Аномалии выхода из левого желудочка
II.6.1. Обструкция выхода из левого желудочка
II.6.2. Аортолевожелудочковый тоннель. Аневризма синусов Вальсальвы
II.7. Аномалии выхода из правого желудочка
II.7.1. Изолированная обструкция выводного отдела правого желудочка. Аномалии развития легочных артерий.
Сообщения между легочными артериями и левым предсердием
II.7.2. Атрезия легочной артерии с интактной межжелудочковой перегородкой
II.7.3. Агенезия клапана легочной артерии
II.8. Аномалии конотрункуса
II.8.1. Тетрада Фалло
II.8.2. Атрезия легочной артерии с дефектом межжелудочковой перегородки
II.8.3. Транспозиция магистральных сосудов
II.8.4. Двойное отхождение магистральных сосудов от желудочков сердца
II.8.5. Общий артериальный ствол
II.8.6. Аортолегочное окно. Аномальное отхождение одной из легочных артерий от аорты
II.9. Атриовентрикулярная и вентрикулоартериальная дискордантность
II.10. Пороки с одножелудочковой гемодинамикой. Операции обхода правого сердца
II.11. Синдром гипоплазии левых отделов сердца
II.12. Аномалии коронарных артерий
II.13. Открытый артериальный проток
II.14. Сосудистые кольца и сосудистые петли
К.В. Шаталов (глава написана при участии Н.С. Турдиевой)
II.15. Коарктация аорты. Перерыв дуги аорты. Гипоплазия дуги аорты
Раздел III. Другие заболевания сердца
III.1. Педиатрическая аритмология
III.1.1. Фетальные аритмии
III.1.2. Нарушения ритма сердца у детей
II.2. Гипертензионная сосудистая болезнь легких, ассоциированная с врожденными пороками сердца
III.3. Первичные опухоли сердца
III.4. Инфекционный эндокардит у детей
Купить книгу "Детская кардиохирургия: Руководство для врачей" - Л. А. Бокерия, К. В. Шаталова



























































































0 комментариев