Название и адрес медицинского центра
_______________________________________________________
Ультразвуковое исследование
Контрон СИГМА 210, ирис. Электронные линейный датчик 7,5 МГц и конвексный - 3,5 МГц
(название ультразвукового оборудования)
Врач ______________________________________
Пациент __________________________________
Исследование № ____________ от __.__.____
Исследуемый орган______________________
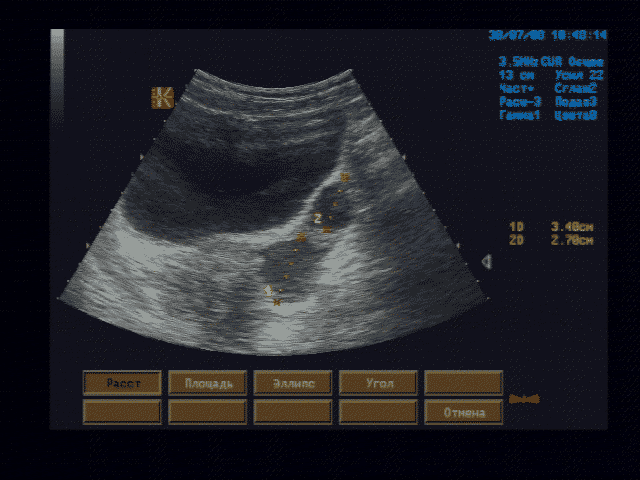
Протокол ультразвукового исследования печени
(УЗИ шаблон (пример, бланк) протокола ультразвукового описания патологии печени)
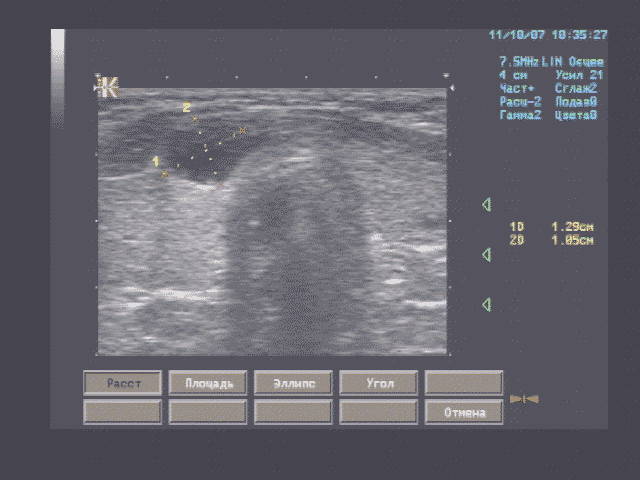
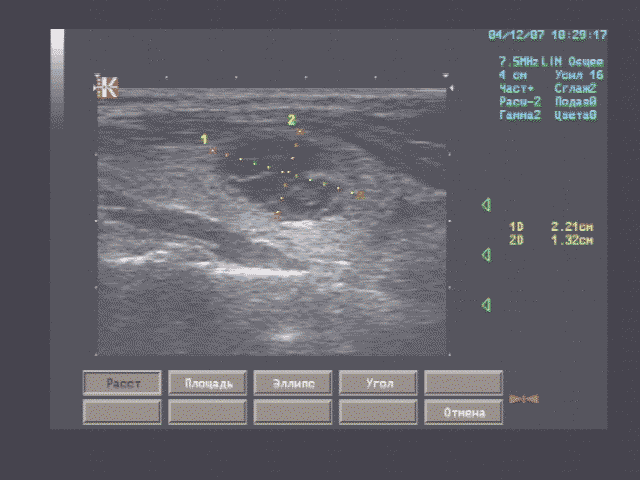
Печень - границы печени не расширены: нижний край правой доли у рёберной дуги, незначительно закруглён, переднезадний размер правой доли 119 мм, косой вертикальный 148 мм, переднезадний размер левой доли 59 мм, вертикальный 93 мм; контуры ровные, диафрагмальный контур нечёткий, паренхима неоднородная за счет гипоэхогенного участка вблизи правой боковой стенки желчного пузыря, имеющего округлую форму, диаметром 15 мм, имеющего ровные, относительно четкие контуры, однородное внутреннее строение; на остальном протяжении паренхима однородная, эхоструктура диффузно повышенной эхогенности рисунок зернистости нечёткий; внутрипечёночные жёлчные протоки не расширены, свободны, сосудистый рисунок обеднен.
Общий жёлчный проток диаметром 4 мм, стенки не утолщены, просвет свободный.
Регионарные лимфатические узлы не визуализируются.
Заключение
Эхографические признаки хронического гепатита, гипоэхогенного очага 5 сегмента печени.
Ультразвуковая диагностика не является основным методом и требует подтверждения диагноза другими методами обследования.
Подпись__________________________
Все протоколы УЗИ патология и норма
Купить профессиональную медицинскую литературу по УЗИ диагностике в интернет-магазине shopdon.ru
Купить профессиональную медицинскую литературу по УЗИ диагностике в интернет-магазине shopdon.ru
Книга "Практическое руководство по ультразвуковой диагностике. Общая ультразвуковая диагностика" - В. В. Митьков
Фундаментальное клиническое руководство подготовлено коллективом ведущих специалистов ультразвуковой диагностики. В книге представлены разделы, посвященные ультразвуковым диагностическим системам, физическим принципам ультразвуковой диагностики, ультразвуковой диагностике заболеваний печени, желчевыводящей системы, поджелудочной железы, пищевода, желудка, кишечника, селезенки, почек, мочевого пузыря, предстательной железы и семенных пузырьков, надпочечников, органов мошонки, лимфатической системы, молочных, щитовидной, околощитовидных и слюнных желез, органов грудной клетки.
Книга предназначена для врачей ультразвуковой диагностики, рентгенологов, радиологов, терапевтов, гастроэнтерологов, эндокринологов, хирургов, урологов, и всех заинтересованных специалистов.
Книга "Эхография в гинекологии" - Озерская И. А.

В 3 издании монографии «Эхография в гинекологии» рассмотрены все основные вопросы ультразвуковой диагностики в гинекологии, с которыми ежедневно сталкивается врач, обследующий органы малого таза у женщин в амбулаторной практике и гинекологическом стационаре. Внесены дополнения результатов собственных научных исследований, а также опыта работы ведущих лабораторий мира и нашей страны за последнее время. Особое внимание уделено вопросам стандартизации при обследовании миометрия, эндометрия и яичников, основанных на рекомендациях групп международных экспертов. Написаны новые главы, посвященные послеродовому периоду в норме и при осложнениях, ультразвуковому мониторингу при проведении аборта как медикаментозного, так и путем вакуум-аспирации, а также послеабортным и послеоперационным осложнениям, включая проблему рубца на матке.
Каждая глава состоит из небольшого этио-патогенетического раздела, подробно освещены вопросы эхографической диагностики, включая данные цветового картирования, допплерометрии, новых, недостаточно распространённых методик и дифференциально-диагностические критерии. Каждая глава иллюстрирована большим количеством эхограмм как типичного, так и нетипичного изображения рассматриваемой патологии. Определены диагностические возможности эхографии, цветового картирования и допплерометрии во всех рассматриваемых разделах гинекологии. Представлены новые направления диагностики и лечения, внедряемые в гинекологическую практику в течение последних лет. В приложение включены таблицы всех нормативных параметров, предложены протоколы ультразвукового исследования органов малого таза и проведения эхогистеросальпингоскопии.
Книга рассчитана на врачей ультразвуковой диагностики, гинекологов, акушеров, онкогинекологов, хирургов и врачей смежных специальностей.
Купить книгу "Эхография в гинекологии" - Озерская И. А.
Книга "Эхокардиография от Рыбаковой" - М. К. Рыбакова, В. В. Митьков

Данное издание представляет собой практическое руководство по эхокардиографии, в котором отражены все современные технологии, применяемые в настоящее время. Исключительный интерес для специалистов представляет CD-ROM с подборкой видеоклипов по всем основным разделам, включающих редкие случаи диагностики.
Особенность издания - попытка объединить и сравнить результаты эхокардиографического исследования сердца и паталогоанатомический материал по всем основным разделам.
Большой интерес представляют разделы, содержащие новые технологии исследования, такие как трех- и четырехмерная реконструкция сердца в реальном времени, тканевая допплерография. Большое внимание уделено также классическим разделам эхокардиографии – оценке легочной гипертензии, клапанных пороков сердца, ишемической болезни сердца и ее осложнений и т.д.
В книге представлены огромный иллюстративный материал, большое количество схем и рисунков, приведены алгоритмы тактики проведения исследования и диагностики по всем разделам эхоКГ.
Руководство помогает разрешить спорные и злободневные вопросы, позволяет ориентироваться в расчетах и измерениях, содержит необходимую справочную информацию.
Книга написана сотрудниками кафедры ультразвуковой диагностики ГБОУ ДПО «Российская медицинская академия последипломного образования'' Министерства здравоохранения Российской Федерации» (база – ГКБ им. С.П. Боткина, Москва).
Издание предназначено для специалистов эхокардиографии, врачей ультразвуковой и функциональной диагностики, кардиологов и терапевтов.
Купить книгу "Эхокардиография от Рыбаковой" - М. К. Рыбакова, В. В. Митьков
Книга "УЗИ в акушерстве и гинекологии. Том 1 Акушерство" - Мерц Эберхард
Данное издание является наиболее полным иллюстрированным руководством по ультразвуковой диагностике в акушерстве и гинекологии.
Авторы постарались охватить все известные на сегодняшний день режимы УЗИ, но тем не менее основной акцент делается на наиболее доступных методиках, технике, глубоком анализе результатов. Результаты ультразвуковых исследований приводятся в тесной корреляции с клиническими и лабораторными данными, что значительно повышает ценность диагностической информации и формирует у врача клиническое мышление. Первый том посвящен УЗИ в акушерстве.
Рассматриваются ультразвуковые параметры матери и плода на разных сроках гестации, различные варианты патологии беременности.
Отдельные главы посвящены ультразвуковой допплерографии и трехмерному УЗИ в режиме реального времени, ультразвуковой поддержке инвазивных диагностических и лечебных процедур. В приложении дается подробная справочная фетометрическая информация.
Книга предназначена для акушеров-гинекологов, специалистов по ультразвуковой диагностике женских консультаций и акушерских стационаров, студентов медицинских вузов и факультетов.
Купить книгу "УЗИ в акушерстве и гинекологии. Том 1 Акушерство" - Мерц Эберхард
Книга "Ультразвуковая диагностика в акушерстве и гинекологии: в 2 томах. Том 2. Гинекология" - Мерц Эберхард
Данное издание является наиболее полным иллюстрированным руководством по ультразвуковой диагностике в акушерстве и гинекологии. Авторы постарались охватить все известные на сегодняшний день режимы УЗИ, но тем не менее основной акцент делается на наиболее доступных методиках, технике, глубоком анализе результатов. Результаты ультразвуковых исследований приводятся в тесной корреляции с клиническими и лабораторными данными, что значительно повышает ценность диагностической информации и формирует у врача клиническое мышление.
Второй том посвящен проблемам ультразвуковых исследований в гинекологической практике: УЗ-анатомии здоровой женщины, порокам развития и заболеваниям женского полового тракта. Отдельные главы посвящены трансвагинальному и трансректальному методам исследования, а также УЗИ молочных желез.
Книга предназначена для акушеров-гинекологов, специалистов по ультразвуковой диагностике женских консультаций и акушерских стационаров, студентов медицинских вузов и факультетов.
Книга "Основы ультразвукового исследования сосудов" - В. П. Куликов

Руководство «Основы ультразвукового исследования сосудов» предназначено для тех, кто хотел бы получить по возможности краткую, но достаточно полную и главное практически полезную информацию по ультразвуковой диагностике сосудистой патологии. Автор, профессор Куликов Владимир Павлович, известен специалистам по первой в России книге, посвященной дуплексному сканированию сосудов, и руководству для врачей по ультразвуковой диагностике сосудистых заболеваний.
В Руководстве представлены важнейшие сведения о технике исследования, ультразвуковых критериях нормы и патологии кровеносных сосудов, основанные на международных согласительных документах и практическом опыте работы автора. Особое внимание уделено стандартизации техники, объема и терминологии описания ультразвукового исследования сосудов.
Книга предназначена для врачей ультразвуковой и функциональной диагностики, сосудистых хирургов, неврологов и кардиологов, а так же для студентов и врачей, обучающихся по программам ультразвукового исследования сосудов.
Купить книгу "Основы ультразвукового исследования сосудов" - В. П. Куликов