Лекция для врачей "Карбокситерапия для лица против морщин и улучшения цвета лица" (отрывок из книги "Карбокситерапия в физиотерапевтической практике" - Н. Г. Куликова)
Карбокситерапия области лица и декольте
Диоксид углерода вводится в зону лица и декольте при выраженных нарушениях тургора, снижении эластичности и появлении дряблости и морщинистости. После применения дезинфицирующих средств, проблемная зона области лица или декольте равномерно прорабатываются через каждый сантиметр (рис.29).
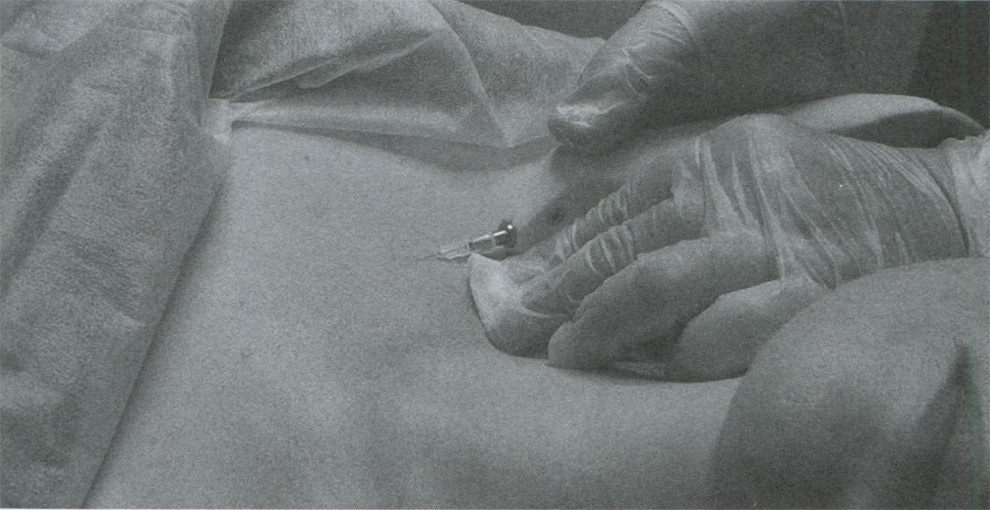
Рис. 29 Карбокситерапия области декольте
За одну процедуру в области лица, например на уровне носогубной складки, допустимо введение диоксида углерода на глубину 2 мм с использованием иглы 27*8 G (4 тт).
В среднем, курс карбокситерапии области лица составляет 5-7 процедур с периодичностью его выполнения 1 -2 раза еженедельно в течение 3-4 недель. Длительность одной процедуры на области лица составляет 25-30 минут. При выполнении карбокситерапии в области декольте вводят не более 27*8 G (4 mm) диоксида углерода. В среднем, курс карбокситерапии области декольте, шеи, в зону второго подбородка составляет 7-10 процедур. В область декольте, шею, зону второго подбородка допустимо введение диоксида углерода на глубину 2-10 мм с использованием иглы 27*8 G (4 mm). Длительность одной процедуры в области декольте и шеи составляет 15-20 минут с периодичностью выполнения 1-3 раза в неделю в течение 2-4 недель. Общий эффект от процедур карбокситерапии области лица или декольте сохраняется 6-8 месяцев и более при соблюдении рекомендаций косметолога и врача-физиотерапевта. Карбокситерапия великолепно устраняет отёчность в области лица, шеи, застойные явления, связанные с нарушением кровообращения в области головы. При этом улучшается цвет лица, уменьшается пигментация и исчезают тёмные круги вокруг глаз. Особенно выраженный эффект отмечен от применения карбокситерапии в области нижних век: улучшается цвет кожи, исчезают мелкие морщинки за счёт уплотнения кожи по причине активизации в ней образования коллагена и, формирования более «сжатого» соединительно-тканного каркаса (уплотняется подкожно-жировая клетчатка). Всё вышеуказанное приводит к тому, что так называемые «мешки» под глазами исчезают, а мелкие морщины разглаживаются (рис.31).

Рис. 31 Карбокситерапия области лица
С целью уменьшения тёмных кругов в периорбитальной области, повышение эластичности кожи и уменьшение гиперпигментации, карбокситерапию выполняют на глубину до 1 мм иглой 27*8 G (4 mm). За одну процедуру вводят не более 1,0 см2 диоксида углерода. Курс лечения из 5-6 процедур включает по 2 процедуры еженедельно и по 2-3 инъекции в каждую зону. Курсовое применение КДТ приводит к тому, что так называемые «мешки» под глазами исчезают, а мелкие морщины разглаживаются.
Интрадермальные инъекции на протяжении 6-и недельного курса лечения с периодичностью введения диоксида углерода в периорбитальную зону однократно в течение каждой недели обеспечивают стойкий эффект, сохраняющийся на протяжении 6-8 месяцев отдалённого периода наблюдения, что подтверждается гистологическими методами исследования.
Особенно эффективны интрадермальные инъекции в периорбитальные зоны с однократным введением диоксида углерода в течение недели короткими курсами - до 2-3- недель.
Залогом результативности карбокситерапии в периорбитальной области лица является введение его в крайне поверхностные структуры дермы - (0,5 - 1 мм) на небольшую глубину, что обеспечит формирование структурных изменений в периобатальных тканях. Поверхностное введение диоксида углерода объёмом 1-2 см2 потенцирует активизацию микрокровотока, что улучшит цвет и устранит тёмные круги вокруг глаз, а стимуляция коллагенеза обеспечит выравнивание кожной поверхности.
При морщинистом типе лица
Оптический видеомониторинг, оптическая типометрия, 3D- моделирование кожи - бесконтактные технологии, позволяют в режиме реального времени объективно оценивать и анализировать макро- и микрорельеф кожи с регистрацией количественных показателей числа мелких и глубоких морщинок лица и области шеи, зоны декольте, что позволяет оценить площадь зон воздействия в трёхмерном пространстве. При анализе возрастных профилей возможно получение информации о рельефе поверхности (глубине впадин, высоте выступов, длине участков профиля, углах и радиусах участков профиля), площади и объёме участков поражения.
При морщинистом типе лица процедуры карбокситерапии выполняют иглой 27*8 G (4 mm) на глубину 1 мм под углом 15-30 градусов так, чтобы расстояние между вколами не были более 2-3 см. За одну инъекцию вводят 1 -2 см2 диоксида углерода. Процедуры проводят еженедельно в виде 2-х инъекций. Полученные эффекты свидетельствуют о том, что во многих случаях карбокситерапия может с успехом заменять блефаропластику, так как её физиологическое действие связано с активизацией SMAS-слоёв кожи лица (рис.34).
В структуру SMAS-слоёв кожи лица входят коллагеновые и элластиновые волокна в схожем соотношении с дермой. SMAS- слои кожи лица кожи лица формируют достаточно прочный каркас, который при хорошем уходе и правильном ОЖ сохраняется до 40-50 лет практически без серьёзных изменений. Однако, с увеличением возраста, при наличии вредных привычек, др. SMAS-слои кожи лица начинают деформироваться, теряют свою каркасную функцию на фоне снижения выработки природного коллагена и эластина. При снижении эластичности кожи выполняют инъекции по всей поверхности лица, шеи, декольте глубиной 1-2 мм иглой 15-20 G (4 mm). Дозировка диоксида углерода за одну инъекцию - 1-5 см2. Курс лечения еженедельно по 1-2 процедуре - 3-4 недели. Доказано эффективное воздействие карбокситерапии при воспалительных и рубцовых поражениях лица и тела акне.
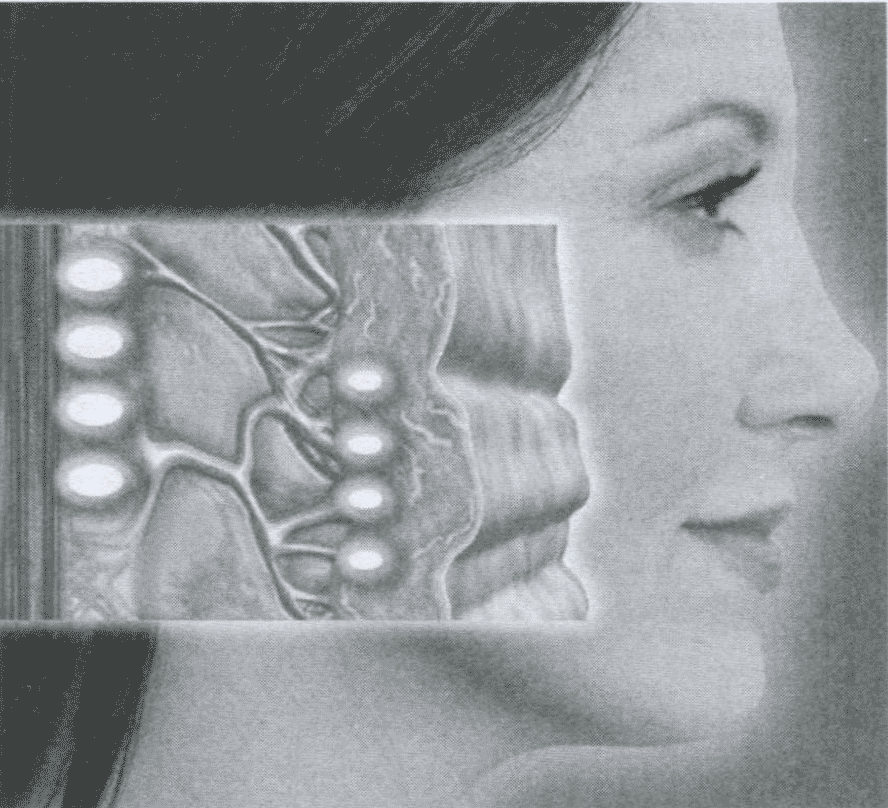
Рис. 34. Технология карбокситерапии на уровне SMAS-слоёв кожи лица
Карбокситерапия улучшает цвет лица, уменьшает пигментацию и исчезают тёмные круги вокруг глаз. Особенно выраженный эффект отмечен от применения карбокситерапии в области нижних век: улучшается цвет кожи, исчезают мелкие морщинки за счёт уплотнения кожи по причине активизации в ней образования коллагена и, формирования более «сжатого» соединительно-тканного каркаса (уплотняется подкожно-жировая клетчатка). Всё вышеуказанное приводит к тому, что так называемые «мешки» под глазами исчезают, а мелкие морщины разглаживаются.
Залогом результативности карбокситерапии в области лица и декольте является введение его в различные плоскости: поверхностно (1 мм), на среднюю глубину (3-4 мм) и подкожно (внутрь жировых отложений) (6-10 мм). При поверхностном введении идёт активизация микрокровотока, при воздействии на среднюю глубину - стимуляция коллагена и выравнивание поверхности, при подкожном введении - расщепление жировых (адипоцитов) клеток. Сочетание карбокситерапии с ретинодами в области лица, а также шеи и декольте, поверхности бёдер и живота, позволяет восстановить эластичность кожи и естественные защитные её функции.
Вы читали отрывок из книги "Карбокситерапия в физиотерапевтической практике" - Н. Г. Куликова
Книга "Карбокситерапия в физиотерапевтической практике"
Автор: Н. Г. Куликова

В центре внимания данной книги находятся существующие в настоящее время научно-практические и теоретические знания по одному из разделов физиотерапии – карбокситерапии, а также частные методики карбокситерапии в восстановительной медицине пациентов с дерматологической, неврологической, хирургической патологией, а также в косметологии, эстетической медицине и антивозрастных программах. Монография отражает материалы по карбокситерапии в физиотерапевтической практике, широко использующейся у пациентов с различной патологией с лечебной и профилактической целями.
В монографию включены научные и практические данные о физиологическом и лечебно-профилактическом действии карбокситерапии при внутрикожном/подкожном (инъекционном и не инъекционном) введении диоксида углерода (СО2) в маркированные зоны участков тела человека. Монография отражает материалы об устройстве типовых карбокситерапевтических аппаратов, показания и противопоказания к применению данного метода у пациентов с многопрофильной патологией.
Достаточно полно представлен материал об оборудовании, технике и методике проведения карбокситерапевтических процедур, показания/ противопоказания/ограничения и особенности проведения процедур КДТ в зависимости от индивидуальных показателей пациентов. Автор акцентирует внимание на этиопатогенетический механизм физиологического воздействия КДТ и предлагает частные методики с тестовым самоконтролем.
Монография предназначена для врачей-физиотерапевтом, дерматологов, косметологов, студентов высших и средних медицинских учебных заведений, организаторов здравоохранения и главных врачей ЛПУ. Монография подготовлена в помощь для обучения технике проведения процедур карбокситерапии и повышению их эффективности в физиотерапевтической практике.
Содержание книги "Карбокситерапия в физиотерапевтической практике" - Н. Г. Куликова
Карбокситерапия. Механизм действия физических факторов и карбокситерапии. История развития карбокситерапии в России и мире.
Механизм действия физических факторов Механизм действия карбокситерапии. Методика проведения карбоксипроцедур.
Механизм действия карбокситерапии.
Не инъекционная карбокситерапия (японская методика).
Методика проведения процедур инъекционной карбокситерапии.
Оборудование.
Показания, противопоказания, осложнения, нежелательные последствия карбокситерапии.
Осложнения, нежелательные реакции и ограничения КДТ
Сочетание карбокситерапии с другими физическими факторами.
Сочетание карбокситерапии с ФФ
Противопоказания для применения карбокситерапии с ФФ
Применение карбокситерапии и профилактическом лечении, эстетической медицине. В эстетической медицине.
В антивозрастных программах
При дерматологической патологии (псориазе, дерматите, нейродермите, акне, др.)
При заболеваниях позвоночника и суставов.
При заболеваниях позвоночника
Карбокситерапия в лечении бактериальных и интерстициальных циститов.
В спортивной медицине
Карбокситерапия болевом синдрома в спорте.
При ушибах и травмах нервных волокон.
В общей и пластической хирургии.
Карбокситерапия при рубцовой патологии (дефиброзирующий эффект). Карбокситерапия в неврологии.
Карбокситерапия при люмбоишиалгии. Карбокситерапия в нейростоматологии.
Роль карбокситерапии в физиотерапевтической аппаратной косметологии.
Регенеративная терапия на основе карбокситерапии и PRP в неврологии и восстановительной медицине
Сочетание методик
Карбокситерапия и PRP в лечении болевого синдрома
Инъекционная карбокситерапия и расфокусированная Ударно – Волновая Терапия (в дальнейшем – УВТ) – актуальность сочетанного применения
Сочетанное применение Ударно-волновой терапии и инъекционной карбокситерапии. Причинно – следственные факторы, определяющие целесообразность их сочетанного применения
Механизмы действия и каскад биологических эффектов запускаемых в мягких тканях при воздействии УВТ. Протоколы процедур для аппаратов расфокусированной УВТ при лечении пациентов с ЗИБМТ и метаболическим синдромом
Параметры и настройки аппарата УВТ, которые определяют эффективный и безопасный лечебный профиль его протоколов
Особенности профилей протоколов у пациентов с ЗИБМТ и метаболическим синдромом и формирование топографических карт при проведении процедур УВТ. Последовательность сочетанного применения Ударно-волновой терапии и инъекционной карбокситерапии