Клеточный метаболизм. Клиническая микроэлементология. Лекция для врачей
Лекция для врачей "Клеточный метаболизм. Клиническая микроэлементология" (отрывок из книги "Клиническая микроэлементология" - Скальная М. Г.)
Клеточный метаболизм
Из энтероцита железо (II) должно поступить в кровь для дальнейшего транспорта. Экспорт из клетки происходит при участии комплекса гепсидина-ферропортина (FPN). При этом железо должно быть преобразовано железо(III). Окисление железа происходит с помощью фермента гефетина (ферроксидазы), относящегося к семейству церулоплазмина. Затем железо(III) связывается с молекулой трансферрина, основного транспортера железа в периферической крови. Связанное с трансферрином железо транспортируется в органы-мишени, к которым относятся костный мозг, кровь, печень, мышцы. Запасы железа в клетках представлены ферритином. При увеличении потребности костного мозга в железе ферритин в первую очередь используется для целей гемопоэза.
На поверхности клеток трансферрин соединяется с соответствующим рецептором (TfR1) и путем эндоцитоза поступает внутрь клетки. В кислой среде эндоцитозных везикул происходит превращение железа(III) железо(II).
Транспорт железа в клетку (рис. 3.2). Транспорт железа к клеткам-мишеням происходит иначе, чем поступление в энтероциты. Основным транспортером железа к периферическим органам и тканям являетcя трансферрин. На поверхности клеток трансферрин взаимодействует со специфическим рецептором трансферрина (TfR). Каждый рецептор TfR способен присоединить 2 молекулы трансферрина. При этом молекула трансферрина переносит 1-2 молекулы железа. Трансферрин транспортирует железо в те ткани, которые экспрессируют TfR. Комплекс трансферрина с TfR усиливает экспрессию транспортера DMT1. Внутри клетки железо восстанавливается до железа(II) при помощи эпителиального простатического антигена 3 (STEAP-3).
В норме лишь небольшая часть железа не связана с трансферрином — ITBI. NTBI представлено комплексами железа с низкомолекулярными соединениями, такими как аскорбаты, фосфаты, цитраты, АТФ, с низкой аффинностью к железу, так что комплексы легко диссоциируют. В дальнейшем это соединение принимает активное участие в реакции Фентона, сопровождающейся накоплением активных радикалов кислорода и, как результат, оксидативным стрессом и повреждением тканей (рис. 3.3).
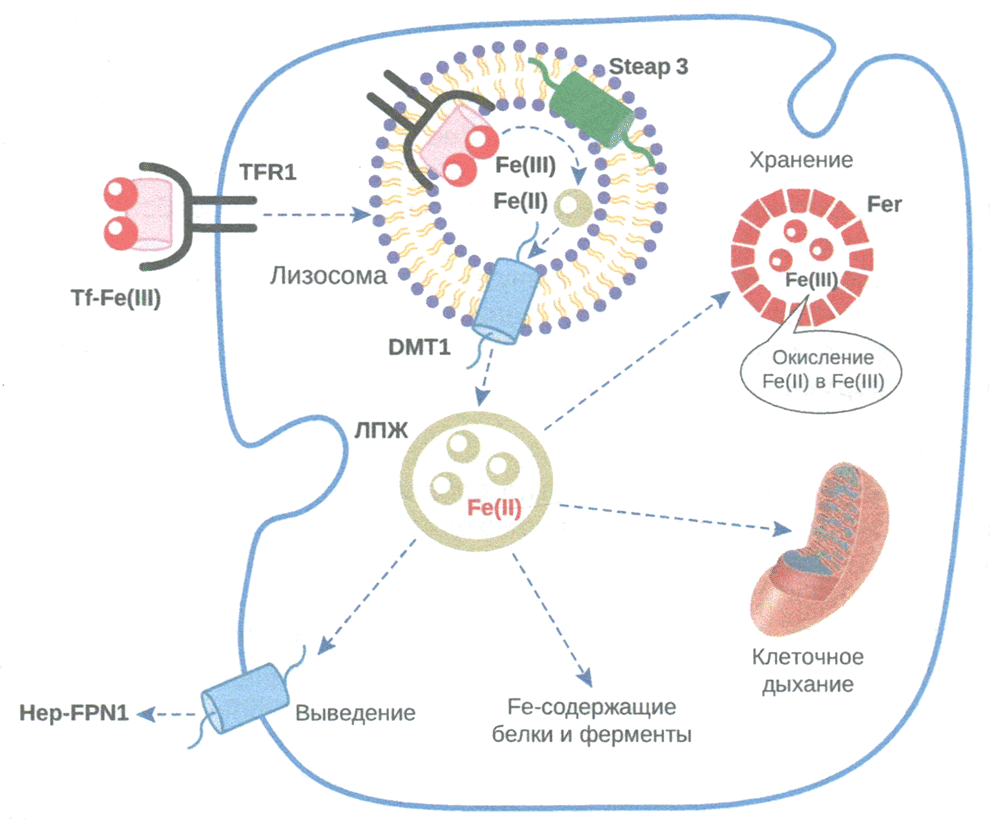
Рис. 3.2. Поступление и распределение железа в клетке
Tf — трансферрин; TfR1 — рецептор трансферрина 1; Fer — ферритин; FPN1 — ферро портин 1; Нер — гепсидин; DMT1 — транспортер двухвалентных металлов 1; ЛПЖ — лабильный пул железа
Накопление NTBI отмечается при вторичной перегрузке организма железом, гемолитической анемии, гемохроматозе, терминальных стадиях почечной недостаточности. Эта форма железа транспортируется внутрь клетки благодаря цинковым транспортерам ZIP14 и ZIP8, а также DMT1 в печень, поджелудочную железу и сердце.
Транспорт железа внутри клетки. Поступившее с TfR1 в клетки органов-мишеней железо(III) превращается в железо(II) при участии ферроксиредуктазы эпителиального простатического антигена 3 и затем транспортируется из эндосом с помощью DMT1.
Внутри клеток железо находится в форме ферритина и лабильного пула (ЛПЖ) (см. рис. 3.2). Основу последнего составляет железо(II). Железо из ППЖ может транспортироваться к компартментам клетки, использоваться в ферментных реакциях или депонироваться и использоваться по потребности.
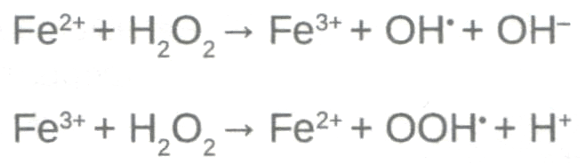
Рис 3.3. Реакция Фентона
ЛПЖ представлен хелатными соединениями железа с анионами, полипептидами и поверхностными компонентами мембран. Именно этот пул железа в условиях избыточного поступления обладает выраженной редокс-активностью, вызывая окислительный стресс и перекисное окисление липидов.
Депо внутриклеточного железа представлено ферритином (рис. 3.4). Молекула ферритина в основном содержит железо (III), связанное с гидроксидным или фосфатным анионами. NTBI составляет в норме не более 1 %. В физиологических условиях одна молекула ферритина связывает до 2000 атомов железа, при этом предельная насыщенность ферритина может достигать 4500.
Ферритин состоит из Н (тяжелой) и L (легкой) цепей. Изначально это деление было связано с обозначением различий ферритина в миокарде (heart) и печени (liver). Было показано, что соотношение H/L цепей в некоторых тканях и системах различно. Содержание L-цепей больше в ферритине печени и селезенки и достигает 90 % всего ферритина, тогда как в сердце и ЦНС ферритин в основном представлен Н-цепями. Различия проявляются в функциях ферритина с преобладанием Н- или L-цепей. Так, тяжелые цепи ферритина участвуют в антиоксидантной защите, поэтому их больше в органах и тканях с высокой метаболической активностью.
При повышении потребности организма железо, депонированное в ферритине с тяжелыми цепями, быстро высвобождается. Железо в митохондриях и ядре клетки представлено именно этой формой. Особенность легких цепей состоит в более высокой аффинности к железу и устойчивости к внешним факторам, что необходимо при длительном сохранении железа в органах-депо.
В клетке железо сосредоточено в основном в митохондриях — 20-50 % общего количества железа в клетке, где оно вовлечено в процесс производства гема и биогенез кластера Fe-S. В поступлении в митохондрии железа, необходимого для биосинтеза гема и кластера Fe-S, участвуют соответственно транспортер FLVCR1B и митоферрины (MFRN1/2). Митохондрия — центральный орган клеточного метаболизма, с ней связано аэробное окисление жирных кислот, глюкозы, деградация аминокислот, производство АТФ и воды. Некоторые типы клеток накапливают митохондриальную форму ферритина. При возросшей потребности организма митохондриальный ферритин высвобождает железо в цитоплазму клетки при помощи кофактора ядерного рецептора 4 (NCOA4).
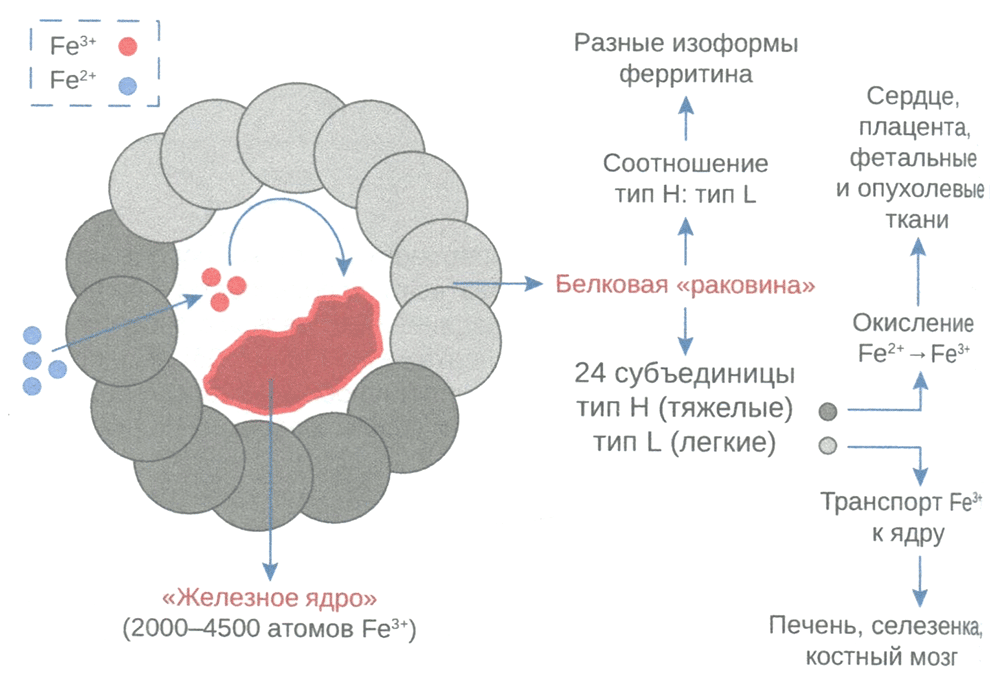
Рис. 3.4. Строение молекулы ферритина
Транспорт железа из клетки. Элиминацию железа из клеток осуществляет белок FPN. Активность FPN зависит от гормона гепсидина, который вырабатывается в печени под влиянием ряда стимулов. Гепсидин связывается с FPN, что приводит к деградации последнего и экспорту железа из клетки (см. рис. 3.2). При воспалении наблюдается избыточная выработка ИЛ-6, что повышает активность гепсидина. Это создает условия для снижения выведения железа из клеток и избыточной аккумуляции ферритина.
При высоком уровне насыщения трансферрина железом гепатоциты уве личивают синтез и высвобождение гепсидина, который, связываясь с FPN, приводит к снижению абсорбции железа в энтероцитах и высвобождению из макрофагов. Напротив, когда насыщение трансферрина железом низ кое, продукция гепсидина снижается, что позволяет FPN осуществлять транспорт железа из клеток. Действие гепсидина на обмен железа комплексное и заключается не только в блокировании всасывания в кишечнике, но и в снижении содержания рециркулирующего железа из макрофагов и мобилизации запасов железа из органов-депо. Повышенная выработка гепсидина обусловлена участием Янус-киназ (JAK) и активации STAT-сигнального пути в печени. Повышение содержания гепсидина сопровождается блокированием высвобождения железа из депо и поступления из энтероцитов.
Экспортируемое из клетки железо(II) должно быть преобразовано в железо(III). Процесс происходит при помощи фермента СР. Затем железо(III) связывается с трансферрином.
Вы читали отрывок из книги "Клиническая микроэлементология" - Скальная М. Г.
Дополнительный материал
Дефицит селена в организме человека. Избыток селена. Причины
Нарушение обмена меди. Болезнь Вильсона-Коновалова. Клиническая микроэлементология
Книга "Клиническая микроэлементология"
Автор: Скальная М. Г.

Большинство жителей России периодически или на постоянной основе принимает БАДы, содержащие те или иные микроэлементы. В последние годы прежние взгляды на применение микроэлементных препаратов коренным образом изменились. Это связано с накоплением новых научных данных, количество которых растет.
Данная книга содержит обзор и анализ современных концепций в клинической микроэлементологии. Автор описывает новые подходы в лечении микроэлементозов, собственные наблюдения из практики и рекомендации, накопленные в течение многих лет. В главах издания представлены конкретные клинические примеры успешного лечения различных заболеваний.
Для практикующих врачей, а также студентов медицинских и биологических вузов.
Содержание книги "Клиническая микроэлементология" - Скальная М. Г.
Глава 1. Нарушения обмена меди
1.1. Обмен меди в физиологических условиях
1.1.1. Поступление в организм
1.1.2. Усвоение в желудочно-кишечном тракте, абсорбция
1.1.3. Клеточный метаболизм
1.1.4. Экскреция меди
1.2. Основные медьсодержащие ферменты
1.3. Регуляция обмена меди в организме
1.4. Особенности жизненного цикла клетки в условиях избытка меди. Купроплазия и купроптоз
1.5. Перепрограммирование обмена меди при онкологических заболеваниях
1.6. Влияние меди на органы и системы
1.6.1. Система крови
1.6.2. Иммунная система
1.6.3. Эндокринная система
1.6.4. Сердечно-сосудистая система
1.6.5. Система покровных тканей
1.6.6. Опорно-двигательный аппарат
1.6.7. Нервная система. Нейродегенеративные заболевания
1.7. Генетические заболевания, связанные с обменом меди
1.7.1. Болезнь Менкеса
1.7.2. Болезнь Вильсона—Коновалова
1.7.3. Синдром MEDNIK
1.7.4. Ацерулоллазминемия
1.7.5. Другие болезни
1.8. Дефицит, избыток и перераспределение меди в организме
1.8.1. Дефицит меди
1.8.2. Избыток меди
1.9. Оценка статуса меди в организме человека
1.10. Примеры из практики
1.11. Профилактика и лечение
1.11.1. Средства коррекции дефицита меди
1.11.2. Средства коррекции избытка/перераспределения меди
1.11.3. Профилактика нарушений обмена меди
1.12. Анкета «Риск нарушений обмена меди»
Литература
Глава 2. Нарушения обмена цинка в клинической практике
2.1. Обмен цинка в физиологических условиях
2.1.1. Поступление в организм
2.1.2. Усвоение в желудочно-кишечном тракте
2.1.3. Клеточный метаболизм
2.1.4. Экскреция цинка
2.1.5. Основные цинксодержащие ферменты
2.1.6. Апоптоз клетки
2.2. Регуляция обмена цинка
2.3. Перепрограммирование обмена цинка при онкологических заболеваниях
2.4. Влияние цинка на органы и системы
2.4.1. Иммунная система
2.4.2. Эндокринная система
2.4.3. Система покровных тканей
2.4.4. Пищеварительная система
2.4.5. Опорно-двигательный аппарат
2.4.6. Нервная система. Нейродегенеративные заболевания
2.4.7. Зрительный анализатор
2.4.8. Сердечно-сосудистая система
2.4.9. Система крови
2.5. Генетические заболевания, связанные с обменом цинка
2.6. Причины дефицита и избытка цинка в организме
2.7. Оценка статуса цинка в организме человека
2.8. Примеры из практики
2.9. Лечение и профилактика нарушений обмена цинка
Клиническая микроэлементология
2.9.1. Лечение
2.9.2. Профилактика
2.10. Анкета «Риск нарушений обмена цинка»
Литература
Глава 3. Нарушения обмена железа в клинической практике
3.1. Обмен железа в физиологических условиях
3.1.1. Поступление в организм
3.1.2. Усвоение в желудочно-кишечном тракте
3.1.3. Клеточный метаболизм
3.1.4. Экскреция железа
3.1.5. Основные железосодержащие ферменты
3.1.6. Регуляция обмена железа
3.2. Особенности жизненного цикла клетки в условиях избытка железа
3.3. Перепрограммирование обмена железа при онкологических заболеваниях
3.4. Влияние железа на органы и системы
3.4.1. Система кроветворения
3.4.2. Сердечно-сосудистая система
3.4.3. Железо и мышечная система
3.4.4. Иммунная система
3.4.5. Эндокринная система
3.4.6. Нервная система. Нейродегенеративные заболевания
3.5. Генетические заболевания, связанные с обменом железа
3.6. Причины дефицита и избытка железа в организме
3.7. Оценка статуса железа в организме человека
3.8. Примеры из практики
3.9. Лечение и профилактика нарушений обмена железа
3.9.1. Лечение
3.9.2. Профилактика
3.10. Анкета «Риск нарушений обмена железа»
Глава 4. Нарушения обмена селена
4.1. Обмен селена в физиологических условиях
4.1.1. Поступление в организм
4.1.2. Усвоение в желудочно-кишечном тракте, абсорбция
4.1.3. Клеточный метаболизм
4.1.4. Экскреция селена
4.1.5. Основные селенсодержащие ферменты
4.1.6. Регуляция обмена селена
4.2. Особенности жизненного цикла клетки в условиях избытка селена
4.3. Влияние селена на органы и системы
4.3.1. Иммунная система
4.3.2. Эндокринная система
4.3.2.1. Щитовидная железа
4.3.2.2. Углеводный обмен
4.3.2.3. Мужская эндокринная система
4.3.2.4. Женская эндокринная система
4.3.3. Сердечно-сосудистая система
4.3.4. Опорно-двигательный аппарат
4.3.5. Нервная система. Нейродегенеративные заболевания
4.4. Генетические заболевания, связанные с обменом селена
4.5. Дефицит, избыток и перераспределение селена в организме. Распространенность и причины
4.5.1. Дефицит селена
4.5.2. Избыток селена
4.6. Оценка статуса селена в организме человека
4.7. Примеры из практики
4.8. Профилактика и лечение
4.8.1. Средства коррекции дефицита селена
4.8.2. Средства коррекции избытка селена
4.8.3. Профилактика нарушений обмена селена
4.9. Анкета «Риск нарушений обмена селена»
Глава 5. Нарушения обмена марганца
5.1. Обмен марганца в физиологических условиях
5.1.1. Поступление в организм
5.1.2. Усвоение в желудочно-кишечном тракте, абсорбция
5.1.3. Клеточный метаболизм
5.1.4. Экскреция из организма
5.2. Основные марганецсодержащие ферменты
5.3. Регуляция обмена марганца в организме
5.4. Особенности жизненного цикла клетки в условиях избытка марганца
5.5. Влияние марганца на органы и системы
5.5.1. Клинические данные о дефиците марганца
5.5.2. Иммунная система
5.5.3. Эндокринная система
5.5.4. Опорно-двигательная система
5.5.5. Нервная система. Нейродегенеративные заболевания
5.6. Генетические заболевания, связанные с обменом марганца
5.7. Дефицит, избыток и перераспределение марганца в организме
5.7.1. Распространенность и причины дефицита марганца
5.7.2. Избыток марганца
5.8. Оценка статуса марганца в организме человека
5.9. Примеры из практики
5.10. Профилактика и лечение нарушений обмена марганца
5.10.1. Средства коррекции дефицита марганца
5.10.2. Средства коррекции избытка/перераспределения марганца
5.11. Анкета «Риск нарушений обмена марганца»



























































0 комментариев