Остеопороз. Симптомы. Лекарственная терапия. Лекция для врачей
Отрывок из книги "Руководство по натуральной медицине" - Пиццорно Дж. Е., Мюррей М. Т. Купить книгу
Клиническая картина
• Обычно протекает бессимптомно до появления сильной боли в спине.
• Распространен у женщин в постменопаузе и мужчин старше 70 лет или принимающих ингибиторы ароматазы и глюкокортикоиды.
• Отсутствие травматических переломов бедра и позвонка.
• Уменьшение роста.
• Определяется как Т-критерий на уровне —2,5 или ниже минеральной плотности кости (МПК) у молодого здорового взрослого.
Общие положения
• Остеопороз (ОП) является наиболее распространенным заболеванием костей у людей и представляет серьезную угрозу для здоровья женщин в постменопаузальном периоде. Особенности включают: низкую костную массу, ухудшение микроархитектуры костной ткани, хрупкость костей, снижение прочности костей и повышенный риск переломов.
• Каждый год в США происходит приблизительно 1,5 млн переломов вследствие остеопороза (ОП), из которых 250 тыс. переломов бедра.
• После остеопоротического перелома бедра риск смерти женщины удваивается; риск смерти мужчины увеличивается втрое.
• -2096 пациентов, перенесших остеопоротический перелом шейки бедра, умирают в последующие 6 мес, 50 % выживших не смогут ходить без посторонней помощи, а 25% нуждаются в длительном домашнем уходе.
Хотя по прогнозам афроамериканцы являются этнической группой с наименьшим риском ОР, заболевание встречается у 53 % афроамериканских женщин и 24% афроамериканских мужчин. Это означает, что более чем у половины всех афроамериканских женщин и у четверти всех афроамериканских мужчин развивается остеопения или остеопороз.
• У белой расы риск низкой костной массы и ОП еще выше; в настоящее время прогнозируется развитие заболевания у 77% женщин и у 4396 мужчин.
• Латиноамериканцы, однако, страдают в наибольшей степени: 86% латиноамериканских женщин и 53% латиноамериканских мужчин теряют столько костной ткани, что риск переломов остеопороза значительно возрастает.
• С 2015 до 2025 г. у латиноамериканцев ожидается увеличение частоты переломов вследствие остеопороза на 175%. Более 50 % патологических переломов отмечается у женщин с остеопенией, к тому же эта группа женщин, перенесших патологический перелом, подвержена такому же риску переломов, что и женщины с ОП.
• Переломы позвонков грудного и (или) поясничного отдела вызывают боль, уменьшение роста и выраженный кифоз или деформацию грудного отдела позвоночника с ограничением объема движений, изменением походки, ограничением функции легких и проблем, связанных с пищеварением. Перелом позвоночника предполагает увеличение риска последующих переломов позвоночника как минимум в 5-7 раз.
• Депрессия, тревожность, низкая самооценка и потеря зубов тоже являются следствием остеопороза.
Патофизиология
• Ремоделирование кости — это процесс резорбции (разрушения) костной ткани и ее формирования. При резорбции кости остеокласты вызывают ферментативное растворение минералов и белков. Остеобласты образуют белковый матрикс коллагена для реминерализации и формирования кости. Ремоделирование кости обычно представляет собой равновесие между ее резорбцией и формированием. Дисбаланс между удалением и замещением приводит к потере костной ткани и риску перелома.
• Костная масса быстро увеличивается в детском возрасте; это увеличение ярко выражено в позднем подростковом периоде, но продолжается и после 20 лет. У женщин процесс формирования костной ткани завершается к 17 годам. Пик костной массы приходится на 28 лет, после чего происходит ее медленная потеря со скоростью 0,4 % в год, главным образом в области шейки бедренной кости. После менопаузы потеря костной ткани ускоряется на 2 % каждый год в первые 5—10 лет. Этот процесс продолжается у женщин старше 70 лет с гораздо меньшей скоростью.
Факторы риска остеопороза
• Генетические факторы: уровень пика костной ткани определяется генетическими факторами. Переломы в анамнезе у родственников первой степени родства повышает риск переломов. Молодые дочери женщин с ОП переломами и родственники первой степени родства с ОП обладают субнормальной костной массой. Чернокожие женщины обладают большей костной массой по сравнению с белыми женщинами. На сегодняшний день доступно геномное исследование, позволяющее определить предрасположенность к дефекту рецепторов витамина D (VDR). Женщины с дефектом VDR требуют значительно большего уровня витамина D, предпочтительнее в виде D3. Новый ключевой генетический фактор: полиморфизм сайтов VDR, часть которых может обладать повышенной потребностью в витамине D.
• Дефицит витамина D: роль витамина D в поддержании нормального состояния костной ткани недооценивается. Плотность кости напрямую связана с 25-гидроксихолекальциферолом [25(ОН)D3] и обратно пропорциональна переломам всех типов.
• Дефицит витамина К; остеокальцин, который вводит кальций (Са) в кость, и матриксный белок Gla, который предотвращает отложение кальция в артериях, являются витамин-К-зависимыми белками.
• Образ жизни: образ жизни, гормональные факторы, Са, прием витаминов D и К2 физические упражнения, возраст менархе, регулярность менструального цикла, а также употребление алкоголя и табака оказывают большее влияние, чем генетические факторы, которые составляют всего 30 % риска развития ОП. Требования в период достижения пика костной массы: сбалансированная диета, адекватные калории, постоянный прием белка и Са на протяжении всей жизни. Са, Mg, витамин К2 и витамин D3 имеют критически важное значение для пожилых женщин. Потребности в Са с возрастом меняются: после 65 лет организм женщины усваивает на 50 % меньше Са, чем в молодости. Активность ферментов почек, продуцирующих активный витамин D, снижается.
• Пищевой белок: высокое потребление животного, а не растительного белка связано с повышенным риском перелома костей предплечья. Красное мясо является источником кислоты, вызывая высвобождение солей из кости для создания кислотного баланса и поддержания кислотнощелочного гомеостаза. Диета, богатая фруктами, овощами и растительными белками, является щелочной диетой.
• Курение: сигареты содержат большое количество кадмия и никотина, которые вызывают потерю костной ткани. Курящие женщины теряют костную ткань быстрее, обладают более низкой костной массой и характеризуются более высокой частотой переломов. У курильщиц менопауза наступает на 2 года раньше. Курение повышает печеночный клиренс эстрогенов.
• Алкоголь: употребление 200 мл алкоголя в день (злоупотребление) повышает риск падений и перелома бедренной кости. Умеренный прием алкоголя снижает риск перелома бедренной кости у пожилых женщин; алкоголь в небольших дозах замедляет резорбцию кости, повышая уровень эстрадиола и экскрецию серотонина.
• Отсутствие физической активности: лица с высокой активностью обладают большей костной массой; длительное пребывание в постели или прикованность к инвалидной коляске вызывает стремительную потерю кости. Упражнения снижают риск ОП за счет стимуляции остеобластов.
Гормональные факторы остеопороза
• Менопауза: все женщины утрачивают костную ткань, однако ускоренная потеря происходит в первые 5 лет менопаузы. Снижение уровня эстрогена уменьшает скорость резорбции кости. Чем раньше это происходит до наступления среднего возраста менопаузы (51 год), тем быстрее кости утрачивают защитный эффект эндогенного эстрогена. Преждевременная менопауза (до 40 лет), позднее менархе в подростковом возрасте, периоды аменореи из-за низкого уровня эстрогена в репродуктивном возрасте (например, гипоталамическая аменорея) или частые менструации повышают риск развития остеопороза. Костная масса позвоночника у женщин, пропустивших до половины ожидаемых менструальных периодов, на 120/0 меньше; у женщин, пропустивших более половины периодов, костная масса на 31 % меньше костной массы здоровых женщин из контрольной группы.
• Концентрация Са в крови строго поддерживается в узких границах. Снижение запускает повышенную секрецию паратгормона (ПТГ) и снижает секрецию кальцитонина щитовидной и паращитовидными железами. Избыток Са запускает сниженную секрецию ПТГ и повышает секрецию кальцитонина.
• ПТГ повышает содержание Са в сыворотке, увеличивая катаболизм остеокластов в кости, снижает экскрецию Са почками, повышает всасывание Са в кишечнике и повышает преобразование в почках 25-(OH)D3 дополнительные факторы
Чем больше факторов риска, тем выше потенциальное снижение костной массы и риск переломов. Факторы риска сами по себе не включают адекватную оценку низкой костной массы, но помогают при клинической оценке рисков для разработки оптимальной стратегии профилактики. Риск для каждой женщины — это наиболее важный параметр здоровья костей в будущем. Заболевания и лекарственные препараты могут нарушать нормальный метаболизм кости.
• Вторичные причины потери костной ткани:
— лекарственные препараты: ингибиторы ароматазы, цитотоксические препараты, избыточная терапия гормонами щитовидной железы, агонисты гонадотропин-релизинг фактора или его аналоги, некоторые антиконвульсанты при длительном приеме (например, фенитоин), применение глюкокортикоидов более З мес;
— генетические нарушения: гемохроматоз, гипофосфатазия, несовершенный остеогенез, талассемия, нарушения баланса Са, экскреция Са с мочой; — эндокринопатии: избыток кортизола, синдром Кушинга, гипертиреоз, недостаточность гонад, первичный гиперпаратиреоз, гиперкальциурия, дефицит витамина D, заболевания желчного пузыря, СД(1), гипоталамическая аменорея, преждевременная недостаточность яичников;
— заболевания ЖКТ: первичный билиарный цирроз, мальабсорбция, гипохлоргидрия, непереносимость лактозы, целиакия, болезнь Крона, тотальная гастрэктомия, шунтирование желудка;
— другие заболевания: анкилозирующий спондилоартрит, хроническая почечная недостаточность, лимфома и лейкоз, множественная миелома, нервная анорексия, булимия, ревматоидный артрит.
Диагностические принципы остеопороза
• Обследование всех женщин в постменопаузальном периоде на факторы риска — анамнез, физикальное обследование, диагностические тесты. Цели обследования: выявить женщин с риском ОП или переломов, диагностировать ОП и (или) определить тяжесть ОП, исключить все вторичные причины потери костной ткани, определить факторы риска падений и травм.
• Диагностика рисков переломов ВОЗ по шкале оценки рисков переломов FRAX: анамнез пациента (личный анамнез переломов после 40 лет, анамнез переломов шейки бедра у родителей, курение, злоупотребление алкоголем, прием глюкокортикоидов, ревматоидный артрит или другие вторичные причины ОП), тест на плотность кости и калькулятор рисков FRAX являются инструментами для определения риска переломов. Необходимо использовать калькулятор FRAX для ПМ женщин с низкой плотностью костной ткани, но без ОП. Он определяет вероятность развития ОП в ближайшие 10 лет и вероятность перелома шейки бедра. Калькулятор риска FRAX доступен в онлайн-версии.
• для выявления факторов риска акцентируйте внимание на анамнезе и физикальном обследовании. Физические признаки ОП: уменьшение роста более чем на 3,8 см (необходимо измерять рост ежегодно). Выраженный кифоз в грудном отделе позвоночника, кариес, потеря зубов, рецессии десен, боль в пояснице.
• Рентгенологическое исследование МПК: исследование МПК — наилучший метод диагностики ОП. Золотым стандартом диагностики является ДЭРА. К другим методам относятся: КТ, УЗИ пяточной кости, рентгенография; ни одно из этих исследований не является идеальным с точки зрения диагностики и последующего наблюдения.
• Необходимо регистрировать массу тела, чтобы выявить женщин с низким ИМТ и, следовательно, с повышенным риском низкой МПК. Расспросите и обследуйте пациента на предмет острой или хронической боли в пояснице, признаках болезненности при перкуссии и исследовании плотности кости. Оцените риск падений, который повышается с приемом лекарств, влияющих на равновесие и координацию; мышечную слабость, нарушение зрения, падения, обмороки, потери сознания в анамнезе, трудность при стоянии или ходьбе, артрит/или нейропатия нижних конечностей.
Тест на минеральную плотность кости
• Тест МПК — это оптимальный метод подтверждения диагноза ОП. Существует несколько методик измерения МПК, но золотым стандартом остается ДЭРА.
• ДЭРА дает меньшее облучение, чем рентгенография или КТ. Этот метод может измерять плотность бедренной кости и позвоночника. Предпочтительное место измерения для исследования МПК — бедренная кость, особенно у пациентов старше 60 лет, поскольку измерения в области позвонков ненадежны из-за внекостной оссификации. Исследования позвоночника могут быть полезны у женщин в постменопаузальном периоде, у которых потери костной ткани выше из-за низкого уровня эстрогена. Периферические локализации ДЭРА дают точный, не менее полезный результат. Они могут не коррелировать с риском переломов и показателями МПК, полученными при исследованиях бедренной кости и позвоночника.
• Рекомендации Североамериканского общества менопаузы (NAMS) по показаниям к исследованию ДЭРА:
— женщины в постменопаузальном периоде с вторичными причинами потери костной ткани (например, лечение стероидами, гиперпаратиреоз);
— рентгенологические признаки остеопении;
— все женщины в возрасте 65 лет и старше;
— женщины в постменопаузальном периоде (возраст 50 лет и старше) с дополнительными факторами риска [перелом после менопаузы, вес ниже 56 кг, перелом бедренной кости в анамнезе, курение, ревматоидный артрит, употребление более 2 единиц алкоголя в день (одна единица = 354 мл пива, 118 мл вина или 30 мл крепкого алкогольного напитка)];
— женщины в постменопаузальном периоде (независимо от возраста) с патологическими переломами после менопаузы, низким весом тела, переломом позвоночника или бедренной кости в семейном анамнезе.
• Отчет о результатах теста на МПК: стандартное отклонение Z-балла или Т-балла. Z-балл основан на стандартном отклонении от среднего значения МПК у женщин той же возрастной группы. Т-балл основан на среднем значении пика МПК у здоровых молодых женщин. Критерии ВОЗ для диагностики ОП определяются с помощью Т-баллов.
Лабораторные исследования метаболизма кости
• Биохимические маркеры обмена костной ткани:
— анализ мочи на выявление продуктов распада костной ткани (перекрестносвязанный N-телопептид коллагена 1-го типа или деоксипиридин);
— оценка обмена кости связана с потерей костной ткани; не предназначена для диагностики ОП или мониторинга потери костной ткани;
— использование ДЭРА для измерения МПК; анализ мочи на определение резорбции костной ткани, чтобы измерить скорость обмена;
— уменьшение маркеров распада в моче за 2-летний период расширило число методов измерения МПК, но значение маркеров в клинической практике еще не подтверждено.
• Дополнительные исследования вторичных причин потери МПК: Са, суточный Са в моче, ПТГ, тиреостимулирующий гормон, свободный тироксин, альбумин сыворотки, щелочная фосфатаза сыворотки, СОЭ, общий анализ крови и уровень витамина D. Непрямые тесты на определение абсорбции Ca. уровень желудочной кислотности и витамина 1).
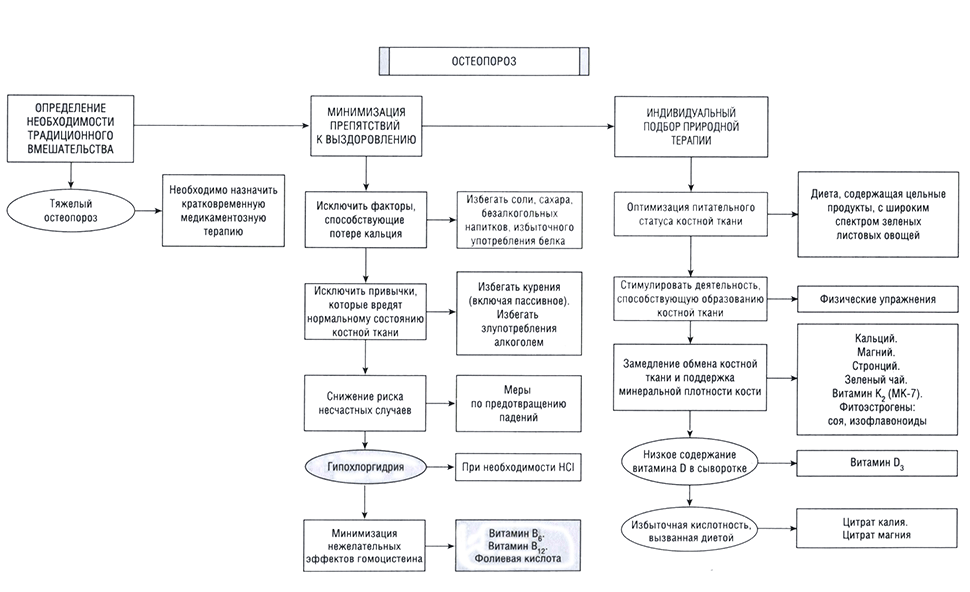
Терапевтические принципы остеопороза
Цели лечения и предотвращения остеопороза:
• сохранение адекватной костной массы;
• сохранение прочности костей;
• предотвращение хрупкости костей;
• предотвращение разрушения микроархитектоники костной ткани;
• предотвращение или уменьшение риска переломов.
Вероятно, можно было бы в значительной степени предотвратить остеопороз, однако в настоящее время нет соответствующих фармакологических препаратов. Число пролеченных больных на одного излеченного для предотвращения одного перелома бедренной кости у женщин в возрасте от 55 до 64 лет составляет 4406 для бифосфонатов (БФ). В случае деносумаба необходимо лечить 334 женщины в течение З лет, чтобы предотвратить один перелом бедренной кости. Невзирая на эти факты, руководство Североамериканского общества менопаузы (NAMS) рекомендует фармакотерапию в следующих случаях:
• все женщины в постменопаузальном периоде с предшествующим ОП или переломом бедренной кости либо позвоночника;
• все женщины, у которых значения МПК в поясничном отделе позвоночника, шейке бедра или всего тазобедренного сустава составляют —2,5 и ниже;
• все женщины в постменопаузальном периоде, Т-балл которых составляет от —1,0 до -2,5, а также с 10-летним риском, основанным на калькуляторе результатов FRAX для основных переломов ОП (позвоночник, тазобедренный сустав, плечо или запястье) и равным как минимум 20 % для перелома шейки бедра и как минимум 3 % — при высоком риске.
Фармакотерапия: многочисленные препараты для лечения ОП [например, БФ, селективные модуляторы эстрогеновых рецепторов (СМЭР), ралоксифен, ПТГ, эстрогены и киьцитонин]. Эти препараты, за исключением эстрогена, изучались на предмет влияния на переломы только у пациентов с клиническим диагнозом ОП или диагнозом ОП, поставленным на основании МПК. Абсолютное снижение риска переломов было самым значительным у женщин с высоким риском переломов.
Лекарственная терапия
• ГЗТ: эстроген-заместительная терапия (ЭЗТ) и ГЗТ снижают скорость обмена и резорбции костной ткани. ЭЗТ может снижать скорость резорбции у женщин в период пременопаузы. ЭЗТ и ГЗТ снижают риск на 54%. ЭЗТ и ГЗТ более эффективны для снижения риска переломов, если их прием начинают в первые 5 лет менопаузы. Если принимать эти препараты более 10 лет, они дают еще большее снижение риска — 75 % для переломов запястья и 73% для переломов шейки бедра. Системные пероральные или трансдермальные эстрогены и эстроген-прогестерон в стандартных дозах повышают МПК во всех отделах у женщин в постменопаузальном периоде. Средняя разница МПК после 2 лет лечения составляет 6,8% для пояснично-крестцового отдела и 4,1 % — для шейки бедра. Дневная доза 0,625 мг конъюгированных конских эстрогенов с прогестероном или без него (медроксипрогестерона ацетат или пероральный микронизированный прогестерон), принимаемая в течение З лет, может повысить МПК позвоночника на 3,5-5,096, МПК тазобедренного сустава — на 1,7 %. ГЗТ может снизить риск перелома шейки бедра (34%), перелома позвоночника (3496) и переломов других костей (24%). Даже дозы ниже стандартных доз эстрогена могут увеличить МПК позвоночника и шейки бедра на 1-396 (например, при их систематическом поступлении через вагинальное кольцо). Стандартные дозы эстрогена или эстроген-прогестерона могут снизить риск переломов у женщин в постменопаузальном периоде на 27%. Несмотря на эти исследования, препараты, содержащие только эстроген или эстроген-прогестерон, разрешены только для профилактики, а не для лечения постменопаузального ОП, поскольку возрастает риск рака молочной железы, тромбов, инсультов, несмертельных инфарктов миокарда, желчнокаменной болезни, болезненности молочных желез, маточных кровотечений и головных болей. Необходим индивидуальный подход к лечению с определением соотношения риск/польза. ГЗТ и ЭЗТ лучше всего действуют в первые 5-10 лет после менопаузы. Оптимальная и максимальная длительность применения еще не установлены. ЭЗТ и ГЗТ не рассматриваются как первичное длительное лечение, за исключением женщин, не переносящих БФ, или женщин, у которых симптоматика не поддается лечению другими препаратами.
• БФ: ингибируют остеокласты, уменьшая резорбцию костной ткани. Необходимо повышать МПК позвоночника и тазобедренного сустава у женщин в постменопаузальном периоде независимо от их возраста. Несмотря на мнение о том, что БФ снижают риск переломов позвоночника у женщин с ОП на 40-70%, а частоту переломов шейки бедра и других переломов — на 50%, эти показатели ненадежны, как было показано выше при описании NNT. Большинство БФ в США (алендронат, ибандронат и ризендронат) предназначены только для перорального ежедневного или периодического приема. Золендроновая кислота назначается внутривенно (в/в). Ответ в форме МПК дает сходные результаты при еженедельном пероральном введении алендроната и ризендроната, ежемесячном пероральном введении ибандроната и ризендроната и внутривенном введении ибандроната раз в З мес. Применяйте БФ с осторожностью, взвешивая потенциальную пользу и серьезный риск. Неразрешенные вопросы, связанные с БФ, касаются качества кости; у некоторых пациентов возможно увеличение частоты переломов в отдаленном периоде и потенциальное чрезмерное подавление обмена костной ткани в отдаленном периоде, что приводит к ломкости костей. Проблемные случаи: нетипичные, плохо заживающие переломы; атипичные переломы бедренной кости. Реакция врачей на эти жалобы: перерыв в приеме препарата, частота и длительность которого в настоящее время изучается. Другие проблемы, связанные с БФ: ОП нижней челюсти (остеонекроз нижней челюсти) у пациентов, принимающих высокие дозы БФ внутривенно, и пациентов, получающих лучевую терапию при раке головы и шеи. Характеристики остеонекроза нижней челюсти: длительное (более 6—8 мес) заживание повреждений ротовой полости после операций или удаления зубов. Его частота при внутривенном введении БФ у пациентов без облучения шеи — 12%. Частота случаев, связанных с ротовой полостью, — 0,03-0,06 %. Тем не менее операции в ротовой полости повышают заболеваемость в 7 раз. Спорным остается вопрос, нужно ли прекращать прием БФ перед удалением зубов. Многие практические врачи приостанавливают прием БФ до заживления ран в ротовой полости. Редкие долговременные осложнения приема БО. остеопоротические переломы тела бедренной кости, которые проявляются в виде болей в области бедренной кости в продромальном периоде и могут быть двусторонними. Использование БФ в настоящее время ограничено максимум до 5 лет, для возможности ремоделирования кости. Тщательно наблюдайте за МПК, чтобы убедиться в стабильно минимальной потере костной ткани после прекращения приема БФ. Применение БФ в течение 5 лет может обеспечить такую же длительную защиту, как и при лечении БФ, длящемся более 5 лет. Побочные эффекты пероральных БФ: нарушения со стороны верхних отделов ЖКТ (например, дисфагия, эзофагит, язвы пищевода и желудка). Меры предосторожности: гипокальциемия и нарушения со стороны почек, редкие преходящие гриппоподобные состояния при больших пероральных и внутривенных дозах. Тщательно соблюдайте инструкции по применению. Основная польза: снижение боли
и страданий, улучшающее качество жизни; спасение жизней (переломы головки бедренной кости). Используйте инструмент FRAX для определения риска переломов при низком МПК, но еще не развившемся ОП. Используйте БФ только по показаниям, при правильном лечении и мониторинге нежелательных явлений, а также нарушении ремоделирования кости и только тогда, когда натуральные методы не дают положительных результатов.
• СМЭР: нестероидные агонисты и (или) антагонисты эстрогена.
Ралоксифен (60 мг ежедневно) разрешен для профилактики и лечения ОП и является единственным СМЭР, разрешенным в настоящее время для лечения ОП. Ралоксифен может значительно улучшить показатель МПК на 1,6-2,696 для поясничного отдела и на 1,2—2,1 % — для шейки бедра.
• ПТГ: анаболик, который назначают в виде ежедневных подкожных инъекций, стимулирующих формирование остеобластов и повышающих плотность трабекул кости у женщин с ОП. Терипаратид (Форстео) разрешен для лечения ОП у женщин в постменопаузальном периоде. В дозе 20 мкг на инъекцию ежедневно терипаратид повышал ПМК поясничного отдела позвоночника на 8,6% и ПМК шейки бедра — на 3,5% по сравнению с плацебо. Он также снижал частоту новых переломов позвоночника на 65% и других костей — на 5396. К сожалению, даже хроническое интермиттирующее повышение ПТГ на фоне стандартной дозы терипаратида (20 мкг в день), как оказалось, вызывает ряд нежелательных побочных эффектов: тошноту, судороги в ногах и головокружения, кальциемию, гиперкальциурию и гиперурицемию с гипермагниемией. Кроме того, в связи с развитием остеогенной саркомы (крайне агрессивного рака кости) практически у половины животных в исследованиях на крысах терипаратид идет с «черной рамкой» FDA, предупреждающей о его потенциальных долгосрочных побочных эффектах. К тому же хроническое повышение ПТГ вызывает снижение когнитивных функций.
• Кальцитонин: разрешен для лечения, но не для профилактики постменопаузального ОП; доступен в виде назального спрея и подкожных инъекций. Интраназальный спрей в дозе 200 МЕ ежедневно в течение 5 лет у женщин в постменопаузальном периоде с ОП снижал риск новых переломов позвоночника на 33 % по сравнению с плацебо. Эффекта в отношении тазобедренного сустава и невертебральных переломов не наблюдалось. Кальцитонин в виде спрея может также уменьшать боль в костях, связанную с компрессионными переломами позвоночника.
• Исследуются новые методы лечения: некоторые из них в настоящее время еще недоступны в США [например, тиболон и пероральный ранелат стронция (Protelos)]. Деносумаб (Пролиа), человеческое моноклональное антитело к активатору лиганда к рецептору RANk (ядерного фактора каппа В), разрешен к применению и показан для лечения женщин в постменопаузальном периоде, подверженных высокому риску ОП переломов, или женщин с непереносимостью либо неэффективностью других методов лечения. Препараты, находящиеся в стадии разработки: СМЭР и полноразмерный ПТГ.
Факторы, связанные с образом жизни
Подход, основанный только на образе жизни, неэффективен для предотвращения потери ПМК и переломов, однако он дает основу для натуральных методов лечения, направленных на профилактику и лечение ОП. Курение ускоряет потерю костной ткани и снижает костную массу. У курящих женщин менопауза наступает на 2 года раньше, чем у некурящих. У курящих женщин, находящихся в постменопаузальном периоде, выше частота переломов. У курильщиц может быть повышен риск переломов шейки бедра, особенно среди женщин старше 60 лет. Курение в анамнезе увеличивает риск будущих переломов независимо от МПК. Умеренное употребление алкоголя связано с повышением МПК у женщин в постменопаузальном периоде, однако употребление более семи единиц алкоголя в неделю влечет за собой повышенный риск падений. Употребление более двух единиц алкоголя в день повышает риск ОП переломов (одна единица = 350 мл пива, 118 мл вина или 30 мл крепкого спиртного напитка).
• Физические упражнения: физическая активность — главный определяющий фактор плотности кости. Один час умеренной нагрузки З раза в неделю предотвращает потерю костной ткани и повышает костную массу у женщин в постменопаузальном периоде. И поднятие тяжестей, и силовые тренировки положительно влияют на развитие кости, ее функцию и поддержание нормального состояния. Женщины, практикующие физические упражнения, могут повысить ПМК позвоночника на 2%. У женщин с постоперационной менопаузой, принимающих эстроген, подключение силовых тренировок улучшает МПК. Определенные упражнения не обязательно могут повышать МПК, однако они могут снизить риск переломов вследствие падений. Упражнения, направленные на укрепление мышц и улучшение равновесия, уменьшают риск падений и связанных с этим травм на 75% у женщин в возрасте 75 лет и старше. Неподвижность удваивает скорость выведения Са с мочой и калом, приводя к отрицательному балансу Са. Наиболее эффективный способ укрепления костей — это физическая активность. Простые силовые упражнения: ходьба или тай-чи. Простые укрепляющие упражнения: гантели или эспандеры. Проконсультируйтесь со специалистами, которые посоветуют эффективные упражнения, безопасные виды физических упражнений и упражнения, которых следует избегать.
Пищевые факторы
К диетическим факторам, которые могут быть предполагаемой причиной ОП, относятся следующие.
• Низкое содержание Са, витамина Кт Mg, высокий уровень употребления фосфора.
• Диета с высоким содержанием белка.
• Окисляющая диета.
• Высокий уровень потребления соли (половина ацидоза, спровоцированного диетой — большая часть которого нейтрализуется за счет изъятия Са из костей, — вызвана избыточным употреблением соли, что отрицательно влияет на выделение кислоты почками).
• Дефицит микроэлементов.
• Вегетарианская диета (лакто-вегетарианская и веганская): более
низкий риск ОП. Костная масса вегетарианцев не отличается от всеядных пациентов в 30, 40 и 50 лет, но отличается в более позднем возрасте. Снижение случаев ОП у вегетарианцев вызвано снижением потери костной ткани в более позднем возрасте. Диета с высоким содержанием белка и фосфатов повышает экскрецию Са с мочой. Повышение суточного потребления белка с 47 до 142 г удваивает выделение Са с мочой. Противоположная точка зрения: диета с высоким содержанием белка повышает экскрецию Са с мочой и выработку кислоты, вызывая отрицательный баланс Са только в случае неадекватного суточного приема. Лучше повышать потребление Са в совокупности с фруктами и овощами для создания ощелачивающего эффекта, чем уменьшать поступление белка. Разумный компромисс: старайтесь обеспечить потребление как минимум 20 г белка в день, особенно у лиц старше 80 лет, но не превышая 60 г. Ключевым фактором в данном случае является системное рН-влияние пищевых продуктов. Пищевой ацидоз, типичный при употреблении пищи с высоким содержанием белка и соли, заставляет организм нормализовать РН за счет буферизации Са, изъятого из костей. Введение добавок Са может предотвратить избыточную потерю костной ткани, однако они могут усилить образование кальцинатов в почках у пациентов с предрасположенностью к этому. Возможная стратегия, помогающая снизить риск образования камней в почках, — использование цитрата Са.
• Соляная кислота: Са должен подвергаться ионизации со стороны желудочной кислоты, чтобы произошло его всасывание. Слабая ионизация Са — главная проблема карбоната Са. Снижение кислотности желудочного сока происходит у 40% женщин в постменопаузальном периоде, однако эффект повышения РН достигается только в случае, когда слабо растворимые соли Са, такие как Са карбонат, принимаются утром натощак. Голодающие пациенты с недостаточной кислотностью желудочного сока усваивают только 4% принятого внутрь Са в виде карбоната, в то время как нормальная кислотность желудочного сока обеспечивает всасывание 2296. Предпочтительные предварительно ионизированные формы Са: цитрат, лактат или глюконат. В случае сниженной кислотности 45% Са всасывается при приеме формы цитрата. Однако если Са принимается с пищей, наблюдается небольшое отличие в его абсорбции даже у пожилых пациентов с атрофическим гастритом или пациентов, принимающих антагонисты Нгрецепторов.
• Сахар: после употребления рафинированного сахара экскреция Са с мочой увеличивается. Среднестатистический американец употребляет 125 г сахарозы, 50 г кукурузного сиропа и других простых сахаров, стакан газированного напитка с фосфатами и высокую дозу белка ежедневно.
• Безалкогольные напитки: содержат много фосфатов, но не кальция. Потребление на одного человека в США: 450 мл/сут. Безалкогольные напитки — главный фактор риска нарушения кальцификации растущих костей у детей. Уровень Са в крови обратно пропорционален числу бутылок безалкогольных напитков, выпитых за неделю.
• Зеленые листовые овощи: употребление в пищу зеленых листовых овощей (например, шпината, листовой капусты, петрушки, салата) предотвращают развитие ОП. Это богатые источники широкого спектра витаминов и минералов, входящих в состав здоровых костей (Са, витамин Кр бор).
• Изофлавоноиды сои: данные о потенциальной способности белков сои или ее изофлавоноидов изменять метаболизм и резорбцию костной ткани противоречивы и недостаточно подтверждены. Соевые бобы содержат фитоэстрогены (генистеин, даидзеин и глицитеин), по молекулярной структуре аналогичные 17+-эстрадиолу. Связывание изофлавоноидов с эстрогенными рецепторами происходит преимущественно с эстрогенными [3-рецепторами, указывая на то, что изофлавоноиды действуют как селективные модуляторы эстрогенных рецепторов. Даидзеин обладает молекулярным сходством с препаратом иприфлавон, который используется в Европе для лечения ОП. Иприфлавон — это БАД, используемая в США. МПК является золотым стандартом в области параметров, определяющих риск нетравматических переломов и обмена костной ткани, и является независимым прогностическим фактором. Соя может сыграть определенную роль в замедлении костного обмена и повышении МПК у женщин благодаря ее эстрогенному эффекту на костную ткань. Различные варианты дозы, длительности приема и рецептуры препаратов на основе сои, а также различные выборки пациентов — возможные причины противоречивых результатов относительно влияния изофлавоноидов на обмен костной ткани и КМП. Однако важным фактором является и способ всасывания изофлавоноидов в кишечнике. Существенный эффект на пептиды в моче наблюдается у азиатских женщин, отсутствующий, однако, у женщин европеоидной расы. Возможно, это происходит из-за превращения даидзеина в его активный метаболит эквол под воздействием кишечной флоры и в связи с тем, что только 1/3 белых женщин способна метаболизировать изофлавоноиды в эквол, в то время как такая способность есть у половины азиатских женщин. Изофлавоноиды сои могут также оказывать больший эффект у женщин в постменопаузальном периоде, чем у женщин в периодах пре- или перименопаузы. Недооцененное влияние со стороны соевых продуктов может быть связано с количеством Са в некоторых из них или в диетах, содержащих соевые продукты. Рациональный клинический совет: необходимо увеличить содержание соевых продуктов в качестве профилактики ОП у женщин в пре-, пери- и постменопаузе. Всем женщинам с высоким риском ОП необходимо назначать добавки сои, чтобы суточная доза изофлавоноидов составляла 90 мг ежедневно.
Биологически активные добавки
Кость нуждается в постоянном поступлении многих питательных веществ. дефицит любого из них отрицательно влияет на здоровье костей. Помимо витамина К и бора кости необходимы следующие:
• Кальций: адекватное потребление кальция необходимо очень молодым женщинам и пожилым людям. Тем не менее кальций лишь незначительно эффективен в замедлении потери МПК у женщин в перименопаузе и в ранней менопаузе. БАДЫ могут улучшить эффективность фармацевтических агентов, предназначенных для лечения потери костной массы. Более высокое потребление кальция и добавки (от 500 до 2000 мг/сут) не связаны с более низкой частотой переломов бедра. Кальций в дозе 1000 мг + 400 МЕ витамина D в день снижает переломы бедра на 29% по сравнению с плацебо. У женщин в постменопаузальном периоде добавки кальция снижают потерю костной массы на 5096 в непозвоночных частях скелета. Действие наиболее выражено у женщин, у которых исходное потребление кальция было низким, у пожилых женщин и у женщин с установленным ОП. Потеря позвоночной кости была уменьшена при приеме от 1000 до 2000 мг кальция в день в течение года. Кальций в рационе необходим на протяжении всей жизни женщины; потребность возрастает с возрастом из-за меньшей абсорбции и конверсии кальция почками. Однако только добавление кальция не предотвращает ускоренную потерю костной массы, происходящую вскоре после менопаузы. Спустя 10 лет после менопаузы добавка кальция снова помогает уменьшить возрастную потерю костной массы. Адекватное поступление кальция имеет большое значение, но существует риск передозировки. Кальций является лишь одним из многих факторов питания и образа жизни, которые влияют на здоровье костей.
• Витамин D: поддерживает баланс кальция, усиливая всасывание в кишечнике. Повышенная абсорбция кальция снижает опосредованную ПТГ резорбцию кости. В США основными источниками витамина D являются обогащенные молочные продукты. Потребление снижается с возрастом. Дозы витамина D должны быть достаточными для повышения уровня в сыворотке до эффективного диапазона. Тем не менее у пожилых женщин в постменопаузальном периоде даже неадекватная доза от 700 до 800 МЕ в день связана со сниженным риском переломов бедра и других непозвоночных костей. Витамин D в сочетании с добавками кальция снижает уровень потери костной массы, особенно у пожилых женщин.
Витамин D также улучшает мышечную силу и равновесие, тем самым снижая риск падения.
• Магний: может быть так же важен для профилактики и лечения ОП, как и добавка кальция. Женщины с ОП имеют более низкий уровень магния в костной ткани, чем женщины без ОП. Дефицит магния у человека связан с пониженным уровнем наиболее активного витамина D в сыворотке также наблюдаемым при ОП. Механизм: либо фермент, ответственный за превращение в зависит от магния, либо магний опосредует секрецию ПТГ и кальцитонина. Прием в дозе от 250 до 750 мг (в виде гидроксида магния) в течение года несколько улучшал МПК. Магний является кофактором щелочной фосфатазы, участвует в минерализации костей. У женщин с ОП часто встречается низкий уровень магния, а его дефицит связан с аномальными кристаллами минералов кости. У некоторых женщин со сниженной МПК частота переломов не повышается, возможно, из-за того, что их минеральные кристаллы кости имеют высокое качество, отчасти из-за высокого содержания магния в тканях. У женщин в постменопаузальном периоде добавление магния в дозе от 250 до 750 мг в день в течение 6 мес с последующим приемом 250 мг в день в течение 6—18 мес без добавления кальция увеличило МПК.
• Стронций: нерадиоактивный элемент почвы, физически и химически похожий на углерод. Ранелат стронция специально используется для терапии ОП в клинических испытаниях, но недоступен в США. Стронций в больших дозах стимулирует формирование костей и уменьшает их резорбцию. Данные клинических испытаний непоследовательны. Клиническое исследование: среди женщин в постменопаузальном периоде с переломами позвонков в анамнезе частота новых деформаций позвоночника была самой низкой (38,896) при самой низкой дозе стронция. Хлорид стронция является наиболее распространенной формой в США, но он не был исследован. Из-за потенциальных побочных эффектов более высоких доз, включая рахит, дефекты минерализации костей и нарушение метаболизма витамина D, целесообразно использовать низкие дозы, пока не будут проведены дополнительные исследования.
• Цинк: необходим для образования остеобластов и остеокластов. цинк усиливает биохимическое действие витамина D и поддерживает синтез костных белков. Дефицит цинка обнаруживается в сыворотке и кости пожилых людей с ОП.
• Медь: дефицит вызывает аномальное развитие костей у растущих детей и способствует ОП. Добавка меди ингибирует резорбцию кости: З мг в день в течение 2 лет значительно снижали потерю костной массы у женщин в постменопаузальном периоде.
• Марганец: дефицит марганца является скрытым, но важным фактором при ОП. Он вызывает снижение отложения кальция в кости и стимулирует выработку мукополисахаридов, обеспечивая основу для кальцификации.
• Цинк, медь и марганец: эта комбинация с кальцием может быть более эффективной, чем один кальций, для предотвращения потери костной массы у женщин в постменопаузальном периоде.
• Бор: добавки снижают экскрецию кальция и магния с мочой и повышают уровень 17-(3-эстрадиола и тестостерона в сыворотке у женщин в постменопаузальном периоде. Добавки бора помогут предотвратить потерю костной массы.
• Кремний: во время роста костей и ранней кальцификации кремний поддерживает связи между коллагеном и протеогликанами. Бедные кремнием рационы вызывают аномальное развитие черепа и задержку роста у животных; добавки кремния позволяют частично предотвратить потерю трабекулярной кости.
• Фолиевая кислота и витамин В12; высокий уровень гомоцистеина может способствовать потере костной массы. Гомоцистеин, продукт расщепления метионина, стимулирует развитие ОП, если он не выводится из организма. Женщины с высоким гомоцистеином имеют в 2 раза более высокий риск непозвоночных переломов, вызванных ОП, чем женщины с низким гомоцистеином. Тем не менее нет никакой связи между уровнем гомоцистеина и МПК шейного или поясничного отдела. Это говорит о том, что риск пе реломов является результатом ухудшенного состояния кости. Фолат способствует реметилированию гомоцистеина до метионина. Его добавление женщинам в постменопаузальном периоде снижает уровень гомоцистеина. В12 также снижает уровень гомоцистеина. Исследуемая дозировка: 5 мг фолата + 1500 мкг В12 в течение 2 лет снижали частоту переломов бедра на 78 0/0 по сравнению с плацебо.
• Витамин В6: также помогает контролировать уровень гомоцистеина. У людей с гомоцистинурией добавка В6 нормализует повышенный уровень гомоцистеина. Дефицит Вб может замедлить заживления перелома, нарушить рост хряща, вызвать образование дефектной кости и усилить ОП. Вб может влиять на выработку прогестерона и оказывать синергетический эффект на чувствительную к эстрогену ткань. Дефицит Вб распространен даже среди здоровых людей.
• Витамин С: способствует образованию и сшиванию некоторых структурных белков в кости. Дефицит аскорбата может вызвать ОП. Цинга, вызванная дефицитом витамина С, также связана с аномалиями костей.
• Витамины К1 и К2 (менахинон): противовоспалительное действие К1 помогает предотвратить чрезмерную активацию остеокластов. К2 требуется для активации 2 белков, необходимых для регуляции кальция: остеокальцина, который приносит ионы кальция к костной ткани, что способствует образованию кристаллов кальция, и матричного белка Gla, который предотвращает отложение кальция в сосудистой сети. Витамин К2 необходим для формирования, ремоделирования и восстановления костей, потому что остеокальцин является зависимым от витамина К белком. Низкое потребление витамина К увеличивает риск переломов шейки бедра у женщин. Формы витамина К: витамин К1 (филлохинон), МК-4 (форма витамина К) и МК-7 (форма витамина К2 с более длинной цепью). Низкое потребление витамина К связано с повышенной потерей костной массы у пожилых людей. Метаанализ рандомизированных контролируемых исследований добавок К1 или МК-4 в высокой дозе 45 мг/сут (15 мг каждые 6—8 ч) в течение более 6 мес показал снижение потери костной массы. Рекомендуемое потребление: от 90 до 120 мкг в день, однако оптимальная защитная доза и форма витамина К не установлены. В большинстве исследований МК-4 использовался в дозах, в 400 раз превышающих рекомендации для К1, и в них принимали участие исключительно японские женщины в постменопаузальном периоде, что исказило результаты в пользу японской диеты и генетики. МК-7 содержится в натто (самая высокая концентрация в ферментированных соевых бобах) и сыре, а в более низких концентрациях — в мясе и молочных продуктах. Небольшие количества могут вырабатываться полезными для здоровья кишечными бактериями из поступающего с пищей витамина Кр если запасы К1 в организме превышают потребности в выработке факторов свертывания крови. МК-7 является более мощной и биодоступной формой с гораздо более длительным периодом полувыведения, чем МК-4. В качестве ежедневной добавки (0,22 ммоль в день) МК-7 более эффективен в отношении карбоксилирования остеокальцина, чем МК-4. МК-7 показывает более длительное время удержания и более высокий уровень в сыворотке при длительном приеме. Менахиноны с более длинной цепью (МК-7) являются более гидрофобными, увеличивая период полувыведения. У японских женщин в постменопаузальном периоде потребление натго имеет обратную связь с частотой переломов бедра. Вероятной причиной противоречивых клинических результатов является эффект, затрудняющий интерпретацию статуса витамина D. На результаты влияет его дефицит.
• Иприфлавон: полусинтетический изофлавоноид, аналогичный изофлавоноидам сои и одобренный в Японии, Венгрии и Италии для лечения и профилактики ОП. Он продемонстрировал впечатляющие результаты в клинических исследованиях. Иприфлавон (200 мг З раза в день) увеличил измерения МПК на 2 и 5,896 через 6 и 12 мес у женщин с ОП. Иприфлавон (600 мг в день) вызывал увеличение МПК на 696 через 12 мес, в то время как МПК в контрольной группе снизился на 0,3 0/0. Встречающиеся в природе изофлавоноиды, такие как генистеин и даидзеин, содержащиеся в сое, могут обеспечивать аналогичные преимущества. Учитывая преимущества соевых изофлавоноидов против рака молочной железы, рекомендуется употребление соевых продуктов. Механизм действия: усиление действия кальцитонина (см. ранее) на метаболизм кальция. Иприфлавон не оказывает эстрогеноподобного действия. Самое последнее и обширное исследование не показало положительных результатов. Иприфлавон может не играть важную роль в лечении ОП. Он может быть более подходящим для женщин с остеопенией или для профилактики, но не для лечения ОП. Частота снижения количества лимфоцитов и отсутствия эффекта требует тщательного взвешивания риска и пользы. Иприфлавон может быть рекомендован для терапии женщин, у которых другие методы лечения ОП недопустимы, не переносятся или противопоказаны. Необходим мониторинг МПК, чтобы подтвердить пользу; следует контролировать уровень лимфоцитов для выявления побочных эффектов.
Фитотерапия
• Зеленый чай (Camellia sinensis): потребление зеленого чая может защитить от ОП. Зеленый чай богат полифенолами и является основным источником витамина К1. Дозировка: от З до 5 чашек в день, обеспечивающая 250 мг полифенолов (катехинов) ежедневно, или экстракт зеленого чая, обеспечивающий такое же количество полифенолов. Полифенолы зеленого чая нарушали резорбцию кости и стимулировали активность остеобластов в лабораторных экспериментах.
Протокол лечения
Наиболее эффективным подходом к ОП является профилактика. Необходимо оптимизировать пиковую массу кости в молодые годы и минимизировать последующую ее потерю в пожилом возрасте. Чтобы максимизировать пиковую массу кости (даже с наследственными и другими немодифицируемыми факторами риска), необходимы правильный образ жизни, полноценное питание и упражнения с умеренным весом в детстве и подростковом возрасте. Также необходимо исключить курение и чрезмерное потребление алкоголя. Улучшение образа жизни и добавки могут снизить риск у многих женщин, но не у всех. для женщин с уже установленным диагнозом факторы питания и образа жизни служат дополнением к традиционным методам лечения. Основные задачи: предотвратить потерю костной массы и снизить риск переломов. В случаях фактического ОП (в сравнении с остеопенией) необходимо использовать следующие рекомендации в сочетании с соответствующим традиционным лечением, включая отпускаемые по рецепту лекарства:
• упражнения: поднятие тяжестей 4 раза в неделю, а также силовые тренировки и (или) тренировки со свободными весами 2 раза в неделю;
• привычки:
— употребление менее 7 единиц алкоголя в неделю;
— исключение курения, в том числе пассивного;
— меры по предотвращению падений;
рацион: сбалансированная диета с акцентом на достаточное количеств белка; ежедневное употребление соевых изофлавонов, зеленых листовых овощей; достаточное количество кальция, магния, витаминов D и Следует избегать факторов, которые способствуют выведению кальция из организма (например, соль, сахар, избыток белка и безалкогольные напитки).
Биологически активные добавки
• ВМК.
• Основные БАДы:
— кальций: 1000—1200 мг в день;
— магний: 350—500 мг в день;
— витамин В3: от 2000 до 5000 МЕ/сут (измеряют уровень в крови и корректируют дозу соответственно);
— витамин В : 25—50 мг в день;
— фолат, оптимально 5-МТГФ: 800 мкг в день;
— витамин Вт; 800 мкг в день;
— витамин К2 (МК-7): 100 мкг в день;
— рыбий жир: 1000 мг ЭПК и ДГК в день;
— изофлавоноиды сои: 90 мг в день или иприфлавон: 600 мг в день; — стронций: от 170 до 680 мг 1 раз в день (см. описание выше).
Фитотерапевтические средства
• Зеленый чай: от З до 5 чашек в день или экстракт зеленого чая, содержащий от 250 до 300 мг полифенолов (катехинов) в день.
Отрывок из книги "Руководство по натуральной медицине" - Пиццорно Дж. Е., Мюррей М. Т. Купить книгу

Купить книгу "Руководство по натуральной медицине" - Пиццорно Дж. Е., Мюррей М. Т.
В книге рассмотрены актуальные вопросы применения немедикаментозных средств в лечении различных заболеваний. В основу изложения материала положен нозологический принцип, раскрывающий современный взгляд на клиническую картину, этиологию и патогенез различных заболеваний. В отличие от большинства медицинских справочников и руководств, в этом издании представлены основы лечебного питания, которые демонстрируют эффективность и механизмы лечебного действия пищевых и биологически активных веществ. Особое внимание уделено применению в лечебном питании специализированных пищевых продуктов, в частности биологически активных добавок к пище. Освещены механизмы их действия, а также использование в лечении (диетотерапии) сердечно-сосудистых заболеваний, сахарного диабета, ожирения, болезней костно-суставной системы, заболеваний желудочно-кишечного тракта, кожи и других патологий. Наряду с питанием значительное место отведено фитотерапии, физиотерапии, лечебной физкультуре, психологическим методам воздействия. В конце каждого раздела, посвященного определенному заболеванию, приведен краткий протокол лечения немедикаментозными средствами.
Содержание книги "Руководство по натуральной медицине" - Джозеф Е. Пиццорно, Майкл Т.
Алкогольная зависимость
Артериальная гипертензия
Астма
Атеросклероз
Атопический дерматит (экзема)
Афтозный стоматит (афтозные язвы/афтоид/язвенный стоматит)
Аффективные расстройства
Бактериальный синусит
Бесплодие, женское
Бесплодие, мужское
Бессонница
Болезни пародонта
Болезнь Альцгеймера
Болезнь Паркинсона
Бронхит и пневмония
Вагиниты
Варикозное расширение вен
Вирусный гепатит
ВИЧ/СПИД: принципы и методы природной медицины
Воспалительные заболевания кишечника
Воспалительные заболевания органов малого таза
Выпадение волос у женщин
Герпетиформный дерматит
Гипертиреоз
Гипогликемия
Гипотиреоз
Глаукома: острая (закрытоугольная) и хроническая (открытоугольная)
Глютенчувствительная целиакия
Дисплазия шейки матки
Доброкачественная гиперплазия предстательной железы
Желчнокаменная болезнь
Застойная сердечная недостаточность
Здоровье беременных и первичная профилактика болезней у взрослых
Инфекционная диарея
Камни в почках
Кистевой туннельный синдром
Крапивница
Красный плоский лишай
Лейкоплакия
Макулярная дегенерация
Менопауза
Меноррагия
Мигрень
Миома матки
Многоформная эритема
Нарушение пищеварения
Обыкновенные и конглобатные угри
Ожирение
Остеоартроз
Остеопороз
Отит среднего уха
Подагра
Порфирии
Предменструальный синдром
Проктологические заболевания
Простой герпес
Протозойная инфекция кишечника и системные заболевания
Псориаз
Рак: комплексная немедикаментозная поддержка
Рассеянный склероз
Ревматоидный артрит
Розацеа
Сахарный диабет
Себорейный дерматит
Сенильная (возрастная) катаракта
Синдром гипервентиляции / Дисфункциональное дыхание
Синдром дефицита внимания с гиперактивностью
Синдром раздраженного кишечника
Синдром фибромиалгии
Синдром хронической усталости
Стенокардия
Стрептококковый фарингит
Трихомониаз
Фиброзно-кистозная мастопатия
Хронический кандидоз
Цистит
Эндометриоз
Эпилепсия
Язвенная болезнь
Посмотреть примеры страниц из книги "Руководство по натуральной медицине" - Пиццорно Дж. Е., Мюррей М. Т. Купить книгу








































0 комментариев