Ультразвуковая диагностика портальной гипертензии у детей. Лекция для врачей
Лекция для врачей "Ультразвуковая диагностика портальной гипертензии у детей". Лекцию для врачей проводит врач УЗИ, врач функциональной диагностики, стаж 50 лет, высшая категория, профессор Михаил Иванович Пыков
Дополнительный материал
Список сокращений
ВРВ — варикозно расширенные вены
ВРВП — варикозно расширенные вены пищевода
ГЭК — гастроэзофагеальное кровотечение
ДСРА — дистальный спленоренальный анастомоз
МПШ — мезентерико-портальное шунтирование
ПГ — портальная гипертензия
ПКА — портокавальный анастомоз
ППП — портальная перфузия печени
ПСР — портосистемное разобщение
ПСШ — портосистемное шунтирование
ПФПГ — подпеченочная форма портальной гипертензии
СПГ — синдром портальной гипертензии
ЭС — эндоскопическое склерозирование
Введение
Синдром портальной гипертензии (СПГ), или синдром повышения давления в воротной вене, не является самостоятельным заболеванием. Тем не менее, он часто встречается при патологических процессах, когда нарушается циркуляция крови в системе воротной вены. В промышленно развитых странах основной причиной портальной гипертензии (ПГ) у взрослых в 85–90 % случаев является цирроз печени. По данным ВОЗ, более 200 млн человек, или 5 % населения планеты, являются носителями вируса гепатита — основного фактора, ответственного за последующее развитие цирроза печени и СПГ.
Подпеченочная форма портальной гипертензии (ПФПГ) у детей является патологией, требующей активного лечения уже в раннем детском возрасте в связи со значительным числом тяжелых осложнений, наблюдаемых у этого контингента больных.
Наиболее грозным осложнением заболевания, представляющим значительные трудности в лечении и основную угрозу жизни ребенка, по праву считают гастроэзофагеальное кровотечение (ГЭК). Следует подчеркнуть, что более чем в половине наблюдений детей с ПФПГ первое кровотечение возникает до 7-летнего возраста. По данным А. Yancy и соавт. (2000), с момента начала кровотечений 30 % больных погибают в течение 2–4 лет после двух-трех их рецидивов.
Целью хирургического лечения ПФПГ является надежное предотвращение ГЭК, лечение гиперспленизма и снижение давления в системе воротной вены. В лечении СПГ выделяют следующие основные направления:
1) операции портосистемного шунтирования (ПСШ);
2) эндоскопическое склерозирование (ЭС) варикозно расширенных вен пищевода (ВРВП);
3) операции портосистемного разобщения;
4) трансплантация печени.
До настоящего времени дискуссионными остаются вопросы выбора метода хирургического лечения как на высоте ГЭК в случае безуспешности консервативной терапии, так и в плановом порядке для их предупреждения.
Среди основных вариантов вмешательств наиболее эффективными и перспективными считаются методы лечения ПГ с помощью ПСШ. Эти операции позволяют значительно снизить или нормализовать давление в портальной системе и эффективно предупреждать рецидивы кровотечений.
Несмотря на все больший интерес, проявляемый хирургами к применению ПСШ в практике лечения детей с ПФПГ, остается значительное число неясных и спорных вопросов, требующих углубленного исследования и анализа. Операции ПСШ не всегда выполнимы, а в некоторых случаях приводят к прогрессированию печеночной недостаточности и развитию портосистемной энцефалопатии.
Остаются актуальными вопросы, касающиеся выбора варианта хирургического лечения ПФПГ у детей в зависимости от возраста, течения патологического процесса, индивидуальных анатомических особенностей ребенка.
Значительные трудности могут возникать в случае частичного или тотального тромбоза магистральных сосудов портальной системы, традиционно используемых для создания анастомозов.
Огромное влияние на лечение больных с ПГ, вызванной циррозом печени, оказало появление в 80-х гг. возможности трансплантации печени и широкое распространение этой операции в настоящее время.
В 1998 г. de Ville de Goyet разработал новый способ лечения больных с внепеченочной портальной гипертензией — мезентерико-портальное шунтирование (МПШ) — операцию, позволившую осуществить радикальную коррекцию заболевания с восстановлением портальной перфузии печени.
Неоднозначность эффекта различных видов оперативных вмешательств, а также высокая частота рецидивов ГЭК (25–40 %) вынуждают проводить дальнейшее изучение портопеченочной гемодинамики для выработки наиболее рациональной хирургической тактики и повышения эффективности оперативного лечения. Поэтому лечение и профилактика кровотечений из варикозно расширенных вен (ВРВ) пищевода и желудка по-прежнему составляет основу показаний для хирургического вмешательства при ПФПГ у детей. Хирург, участвующий в лечении пациентов, должен быть знаком со всеми формами лечения — от консервативных до самых современных хирургических подходов лечения СПГ — и владеть ими.
Краткий исторический обзор
В 1889 г. Banti описал заболевание, проявляющееся спленомегалией и анемией, которая ранее не ассоциировалась с известными гематологическими заболеваниями. Он считал, что селезенка является основной причиной заболевания, приводящей к анемии, вторичному циррозу печени и склерозу селезеночной и воротной вен. Спустя несколько лет стало ясно, что Banti описал целую группу заболеваний, которые в настоящее время распознаются как цирроз, нецирротическая ПГ и синдром тропической спленомегалии.
Позже Ravenna исследовал большое количество пациентов со значительной спленомегалией без выраженной патологии со стороны печени и назвал это заболевание застойной спленомегалией. В 1898 г. Banti описал ПГ, включающую синдром спленомегалии и гастроинтестинального кровотечения.
История хирургического лечения ПГ шла по нескольким направлениям.
В первую очередь, разрабатывались паллиативные методы, направленные на предотвращение осложнений заболевания, прежде всего кровотечения из ВРВП, поскольку радикального способа коррекции ПГ не существовало.
История создания портокавальных анастомозов начинается с экспериментальных работ российского хирурга Н. В. Экка, который в 1877 г. у собак лигировал печеночный конец воротной вены и накладывал портокавальный анастомоз (ПКА) «бок в бок». В результате формировался функционирующий ПКА «конец в бок».
Пять лет спустя, в 1882 г., E. Vidal впервые успешно выполнил ПКА «конец в бок» у больного с кровотечением из вен пищевода. Кровотечение было остановлено, однако в последующем у больного развился рецидивирующий асцит и энцефалопатия, что в итоге привело к летальному исходу.
В 1945 г. Whipple и в 1948 г. Linton впервые применили спленоренальный анастомоз, а Blakemore (1948) описал использование аутовенозной вставки для создания Н-образного ПКА.
В детской хирургии Marion в 1953 г. и Clatworthy в 1955 г. описали мезокавальный анастомоз, при котором пересеченная общая подвздошная вена разворачивалась и анастомозировалась в бок с верхней брыжеечной веной.
В 1972 г. Drapanas впервые использовал синтетический Н-графт для создания портосистемного анастомоза. В этот период начали обращать внимание на некоторые другие технические аспекты операции. Оптимальным считали проходимый анастомоз достаточно малого диаметра. Это должно было ограничить отведение крови из системы воротной вены и развитие энцефалопатии, но в тоже время обеспечить достаточную декомпрессию варикозных вен пищевода.
В 1967 г. Warren описал дистальный спленоренальный анастомоз, направленный на селективную декомпрессию селезеночно-желудочного бассейна при сохранении кровотока по воротной вене. Благодаря этому результаты шунтирующих операций значительно улучшились. В последующие годы в мировой практике получили распространение так называемые парциальные сосудистые ПКА. Основная идея этих операций — ограничение диаметра создаваемого портокавального соустья. В результате достигался не полный, а парциальный, то есть частичный, сброс портальной крови и сохранялся остаточный приток ее к печени. Оптимальным считался анастомоз диаметром 8–10 мм.
Спленоренальные анастомозы и ПКА малого диаметра позволили использовать хирургические методы для лечения ПГ у детей. Последующее накопление опыта и внедрение в практику микрохирургической техники расширило показания к портокавальному шунтированию у маленьких детей, что позволило значительно улучшить результаты операций по профилактике кровотечений из ВРВ пищевода и желудка.
Одновременно с развитием сосудистой хирургии в лечении ПГ изучались и другие возможности хирургического лечения СПГ. В 1898 г. голландским врачом A. S. Talma была предложена оментопариетопексия, то есть создание обходных сосудистых коллатералей путем подшивания большого сальника к передней брюшной стенке. Идея Talma дала начало новому направлению в хирургии ПГ, названному органоанастомозами. Эти хирургические вмешательства были направлены на усиление коллатерального оттока из системы воротной вены. Его сторонники использовали для этой цели не только сальник, фиксируя его к печени, почке и полой вене, но и такие органы, как демуконизированная тонкая кишка, желудок, печень, селезенка.
В 1950 г. Marion предпринял попытку выполнить гепатоспленопексию.
В дальнейшем были разработаны методики вначале подкожной, а затем и наддиафрагмальной транспозиции селезенки. Однако изучение отдаленных результатов данных вмешательств показало их малую эффективность. Поэтому в настоящее время эти операции практически не используются.
В XIX в. асцит лечили методом парацентеза, но в 1907 г. Ruotte применил перитонеовенозный шунт, используя большую подкожную вену. После большого разнообразия попыток усилить поток асцитической жидкости через большой сальник или мочевыделительную систему, Le Veen применил шунт с протезом между брюшной полостью и грудной клеткой. Уменьшение притока крови по селезеночной артерии было также признано как снижающее давление в воротной вене. Спленэктомия применялась более 100 лет назад для лечения асцита, развившегося на фоне цирроза печени. В итоге было установлено, что при этой операции можно снизить воротный кровоток на 2/3. Со временем, однако, спленэктомия из-за ее высокого риска, особенно для детей, была вытеснена лигированием селезеночной артерии или ее эмболизацией.
Прямые вмешательства на ВРВ начались с лигирования венечной вены желудка. Деваскуляризация желудка и пищевода была впервые выполнена в 1950 г. Крайлем. Использовались и другие модификации вмешательств с целью уменьшить их объем, в частности операция М. Пациоры (1974), получившая распространение в нашей стране. Однако после этих операций отмечалась высокая частота рецидивов кровотечений. Более радикальным методом остановки рецидивных кровотечений была транссекция пищевода или желудка с последующим реанастомозом, предложенная N. Tanner (1950).
Наиболее радикальной была модификация, предложенная M. Sugiura и S. Futagawa (1973). В этом же году M. Sugiura и S. Futagawa опубликовали статью «Новая технология для лечения варикозных вен пищевода», в которой предложили новый метод портосистемного разобщения для лечения СПГ, впоследствии получивший название операции Sugiura. Эта операция совместила в себе преимущества относительно эффективных операций деваскуляризации по Hassab и наложения эзофаго-эзофагоанастомоза по Walker.
Это была самая агрессивная из операций азигопортального разобщения, которая, тем не менее, сопровождалась довольно низким уровнем рецидивных кровотечений.
Уже к 1980 г. общее количество разработанных операций и их модификаций при СПГ превышало 100. В последующие годы их количество увеличилось. Однако в связи с развитием и внедрением в клиническую практику ортотопической трансплантации печени характер их изменился, благодаря появлению «малоинвазивных» эндоваскулярных и эндоскопических технологий. Еще в 1939 г. C. Crafoord и P. Frenckner предложили эндоскопическое склерозирование (ЭС) при ВРВП. Однако широкое распространение метод получил в 70-е гг., это было связано с неудовлетворительными результатами хирургического лечения. Внедрение в практику гибких эндоскопов позволило расширить лечебные возможности метода. В настоящее время эндосклерозирование наравне с хирургическими методами является ведущим в лечении детей с СПГ.
В 1955 г. Welch выполнил первую трансплантацию печени у собак. В 1963 г. группа исследователей под руководством Starzl осуществила первую успешную трансплантацию печени у человека.
Этиология и патогенез
У взрослых кровоток по воротной вене составляет 1000–1200 мл/мин.
Через воротную вену в печень ежеминутно поступает около 40 мл кислорода, что составляет более 70 % всего кислорода, поступающего в этот орган.
Нормальное давление в системе воротной вены, безусловно, зависит от многих факторов: возраста, центрального давления и т. д. В среднем портальное давление у взрослых составляет около 200 мм вод. ст. или около 5–7 мм рт. ст. (0,5–1,3 кПа), что обеспечивает портальную перфузию печени (ППП) через синусоиды со скоростью около 1 л/мин.
Давление в воротной системе у здоровых детей редко превышает 7 мм рт. ст. ПГ считается повышение давления в системе воротной вены выше 10–12 мм рт. ст.
Причины повышения давления в бассейне воротной вены разнообразны, но прежде всего они связаны с нарушениями оттока из воротной вены. В зависимости от уровня, на котором развилось препятствие, различают следующие формы ПГ: подпеченочная форма, связанная с обструкцией воротной вены и ее основных притоков; внутрипеченочная форма, которая может быть следствием пресинусоидальной обструкции (врожденный фиброз печени, врожденные или приобретенные артериопортальные фистулы, шистосомоз) и синусоидальной обструкции (цирроз печени), надпеченочная форма, связанная с обструкцией печеночных вен. К развитию ПГ у детей могут приводить следующие заболевания:
1. Пресинусоидальный блок:
- непроходимость сосудов системы воротной вены, тромбоз воротной вены или ее кавернозная трансформация, тромбоз селезеночной вены, врож¬денный порок развития воротной вены;
- врожденный фиброз печени;
- артериовенозная фистула;
- шистосомоз;
- гепатопортальный склероз.
2. Синусоидальный блок:
- заболевания печени;
- аутоиммунный гепатит;
- гепатит В и С;
- болезнь Коновалова-Вильсона;
- недостаток α1-антитрипсина;
- гликогенозы 4-го типа;
- токсические и лекарственные гепатиты;
- гистиоцитоз;
- болезнь Гоше;
- болезни желчевыводящих путей;
- атрезия желчевыводящих путей;
- кисты холедоха;
- синдромы внутрипеченочного холестаза;
- склерозирующий холангит.
3. Постсинусоидальный блок:
- синдром Бадда-Киари;
- непроходимость нижней полой вены;
- хроническая застойная сердечная недостаточность;
- полицетемия;
- системная красная волчанка;
- опухоли правого надпочечника и почки.
Отдельные виды ПГ с разной частотой встречаются в различных странах и континентах. Обструкция печеночных вен (болезнь Бадда–Киари) относительно часто встречается в Центральной и Южной Америке. В развитых странах Европы и Северной Америки соотношение между внутри- и подпеченочными формами ПГ приблизительно равно, что связано с высокой выживаемостью детей с паренхиматозным поражением печени, например, вследствие атрезии желчных ходов. В нашей стране около 90 % детей с ПГ, которые нуждаются в помощи хирурга, составляют больные с ПФПГ.
Главным фактором, определяющим лечебную тактику и прогноз при ПГ, является функциональное состояние печени. Пресинусоидальная обструкция (под- и внутрипеченочные формы) не приводит к нарушениям белковосинтезирующей функции печени, поэтому отсутствуют нарушения свертывающей системы и, следовательно, лечение должно быть направлено, прежде всего, на профилактику кровотечений.
Синусоидальная обструкция (внутрипеченочная форма) — цирроз печени.
В противоположность этому при постсинусоидальной обструкции (надпеченочная форма), вследствие высокого давления на выходе из печени, печеночная паренхима может подвергаться интенсивной деструкции вплоть до центрального некроза. Для этой формы характерны нарушения синтетической функции печени, коагулопатии и прогрессирующее развитие печеночной недостаточности. Несмотря на то, что у этих больных могут быть использованы паллиативные вмешательства, направленные на предотвращение угрожающих жизни кровотечений, единственным радикальным методом лечения этой формы заболевания является трансплантация печени.
Наиболее частой причиной подпеченочного блока воротного кровотока является обструкция внепеченочных отделов воротной вены, которая может иметь место на любом уровне. К тромбозу и кавернозной трансформации воротной вены могут привести гнойно-воспалительные заболевания пупка в период новорожденности, катетеризации пупочной вены, а также сепсис, возникающий в этом возрасте при остеомиелите, некротическом энтероколите, перитоните и др. Особыми факторами риска в период новорожденности являются процессы дегидратации и гиперкоагуляции.
Еще одной непосредственной причиной развития этой формы заболевания могут быть врожденные пороки развития воротной вены. В редких случаях пресинусоидальная ПГ может наблюдаться при увеличении воротного кровотока вследствие врожденной или приобретенной артериовенозной фистулы в системе воротной вены. Тем не менее, несмотря на все известные факторы развития заболевания, более чем в половине случаев причину заболевания установить не удается.
Патофизиология ПГ не до конца изучена, но считается, что развитие внутрисосудистого сопротивления и возрастающего портального кровотока является одной из основных ее причин. Первичная причина, безусловно, — возрастание сопротивления портальному кровотоку. При повышении портального давления выше 10–12 мм рт. ст. начинают образовываться и/или открываться коллатерали, позволяющие дренировать портальную систему с высоким давлением в систему низкого давления.
Основные места коллатерального кровотока из системы воротной вены — зоны естественных портосистемных анастомозов: гастроэзофагеальная, геморроидальная, параумбиликальная и забрюшинная.
Гастроэзофагеальная зона расположена в нижней трети пищевода между ветвями левой желудочной вены, впадающей в воротную вену, и ветвями пищеводных вен, впадающих в непарную и полунепарную вены и далее в верхнюю полую вену — анастомозы воротной и нижней полой вен.
Геморроидальная зона расположена в нижней части прямой кишки, между притоками верхней ректальной вены, впадающей через нижнюю брыжеечную и воротную вены, средней и нижней ректальных вен, впадающих во внутреннюю подвздошную вену и далее в систему нижней полой вены — анастомоз воротной и нижней полой вен.
Параумбиликальная зона расположена в области пупка, где своими притоками анастомозируют параумбиликальные вены, идущие в круглой связке печени к воротной вене, верхняя эпигастральная вена из системы верхней полой вены и нижняя эпигастральная вена из системы нижней полой вены — анастомоз нижней полой, воротной и верхней полой вен.
Забрюшинная зона расположена в поясничной области, между ветвями вен мезоперитонеальных отделов толстой кишки из системы воротной вены и пристеночных поясничных вен из системы нижней полой вены — анастомоз воротной и нижней полой вен. Кроме того, на задней брюшной стенке имеется анастомоз между ветвями поясничных вен из системы нижней полой вены и ветвями парной восходящей поясничной вены, являющейся началом непарной вены справа и полунепарной вены слева из системы верхней полой вены — анастомоз нижней полой и верхней полой вен. Анастомоз между поясничными и межпозвоночными венами, которые в области шеи являются ветвями верхней полой вены, — анастомоз нижней полой и верхней полой вен.
Повышение давления в системе воротной вены ведет к формированию естественных коллатеральных путей оттока, соединяющих бассейн воротной вены с системой общего венозного кровообращения с более низким давлением. Сброс крови через коллатерали, соединяющие воротное и системное венозное кровообращение, приводит к снижению давления в воротной вене.
Однако этот эффект часто нивелируется одновременно развивающимся гипердинамическим типом кровообращения. ПГ, как правило, вызывает нарушения функции автономной нервной системы. Это сопровождается повышением уровня циркуляторных цитокинов, что ведет к тахикардии, уменьшению системного и органного сосудистого сопротивления, увеличению сердечного выброса и объема плазмы и, вследствие этого, — к повышению давления в системе воротной вены.
Наибольшее клиническое значение имеет зона гастроэзофагеальных коллатералей — венозное сплетение пищевода. Кровотечения из геморроидальных вен в детской практике встречаются крайне редко и могут считаться казуистическими. Имеются описания кровотечений из варикозных вен, расположенных в тонком кишечнике. Параумбиликальная зона является путем коллатерального кровотока, особенного выраженного у детей с циррозом печени (классический симптом «головы медузы»).
Непосредственно выше кардии начинается так называемая палисадная зона. Ее длина составляет около 2–3 см. В этой области пищеводные вены проникают через мышечную пластинку слизистой гастроэзофагеального перехода и проходят внутри собственной пластинки. Особенность палисадной зоны заключается в высоком сосудистом сопротивлении, что создает предпосылки для разрыва вен на этом уровне.
Выше палисадной зоны располагается перфорантная зона протяженностью около 2 см. Особенностью этой зоны является наличие многочисленных коммуникантных сосудов между венами различных уровней. В пищеводе выделяют четыре уровня расположения венозных сосудов. Наиболее поверхностно в слизистой располагаются интраэпителиальные вены, дренирующиеся в поверхностное венозное сплетение подслизистого слоя. Это сплетение в свою очередь связано с глубокими венами подслизистого слоя.
Подслизистое сплетение и находящиеся снаружи от пищевода вены соединены перфорантными сосудами, проникающими сквозь мышечный слой пищевода. При повышении портального давления сосуды подслизистого слоя подвергаются варикозному расширению. Предполагается, что кровотечение средней степени тяжести возникает вследствие разрыва интраэпителиальных сосудов, в то время как разрыв вен подслизистого сплетения приводит к массивной кровопотере.
Еще выше, на протяжении 8–10 см, располагается поперечная перфорантная зона пищевода.
Для СПГ наиболее характерно расширение глубоких вен подслизистого слоя, особенно в перфорантной зоне. Именно эти вены и рассматриваются с эндоскопической точки зрения как ВРВП. Данные изменения, как правило, начинаются при повышении портокавального градиента более 7 мм рт. ст.
Помимо анатомических, патогенез ВРВП обусловливают и другие факторы. Большое значение может иметь патологический ретроградный кровоток из периэзофагеальных вен, через вены-перфоранты в подслизистое сплетение, обнаруженный во время дуплексосонографических исследований (McCormack et al., 1994).
Исследования последних лет показали, что в патогенезе ВРВП может играть роль состояние соединительной ткани. Было обнаружено, что при ПГ имеются два вида изменений в соединительной ткани. В литературе они получили наименования синдрома «соединительнотканной дисплазии» (синдром «слабости соединительной ткани») и синдрома «ригидной соединительной ткани». У больных с синдромом «ригидной соединительной ткани» обычно наблюдается асцит. При синдроме «слабости соединительной ткани», наоборот, чаще формируются многочисленные портосистемные коллатерали в желудочно-селезеночной зоне, что увеличивает риск пищеводных кровотечений.
Важную роль в патогенезе пищеводных кровотечений играют нарушения белоксинтезирующей функции печени, гиперфункция селезенки (гиперспленизм), нарушения свертывающей системы крови. Развитие варикозных вен пищевода очень часто сопровождается нарушением функции пищевода, недостаточностью нижнего пищеводного сфинктера и гастроэзофагеальным рефлюксом. Заброс кислого желудочного содержимого в пищевод вызывает повреждение истонченных стенок варикозных вен и провоцирует кровотечение.
В последние годы исследователи начали обращать внимание на еще одно осложнение ПГ, а именно портальную, или застойную, гастропатию. При данной патологии в верхней трети желудка возникает избыточное число подслизистых артериовенозных анастомозов между сосудами мышечного слоя слизистой оболочки, расширенными венами и прекапиллярами. В этом случае возрастает риск желудочного кровотечения, особенно вследствие воздействия пептических факторов на слизистую оболочку.
Повышение портального давления различной степени выраженности имеет место у всех больных с ПГ. Однако у многих из них пищеводно-желудочные кровотечения не возникают. Почему это происходит, окончательно установить не удалось. Большинство авторов не может выявить корреляцию между величиной портального давления и частотой кровотечений из ВРВ пищевода и желудка. По-видимому, здесь играет роль сочетание всех перечисленных выше факторов.
Острая кровопотеря из ВРВП и печеночная недостаточность являются основными причинами смертельных исходов у больных с ПГ. Опасное для жизни кровотечение из ВРВП нередко является первым признаком ПФПГ у детей. При этом острая кровопотеря, как правило, бывает массивной, так как кровь в ВРВП находится под давлением и быстро вытекает в просвет пищевода и желудка. Спонтанное тромбирование дефекта в стенке варикозно расширенной вены маловероятно. Это связано с тем, что, во-первых, у больных с СПГ имеют место нарушения функции печени и селезенки и, вследствие этого, нарушения свертывающей системы крови. Во-вторых, стенка вены из-за резкого растяжения теряет способность к обратному сокращению.
Таким образом, патогенез ПГ и кровотечений портального генеза у детей до конца не изучен. Очевидно только то, что в развитии кровотечений играют роль множество местных, региональных и системных факторов, каждый из которых имеет свое индивидуальное для конкретного больного значение. Сочетание затрудненного портального оттока крови, увеличения притока крови в воротную систему, развития коллатеральных путей циркуляции, нарушений функции печени и селезенки является главной причиной осложнений при СПГ.
Стадии портальной гипертензии
Для клинической оценки состояния больного выделяют три стадии течения заболевания, в основе которых использованы принципы классификации М. Д. Пациоры (1974).
1. Компенсированная стадия ПГ:
а) спленомегалия;
б) наличие ВРВ различной протяженности по длине пищевода;
в) возможна гепатомегалия.
2. Субкомпенсированная стадия ПГ:
а) стойкая спленомегалия;
б) наличие ВРВ различной протяженности по длине пищевода;
в) гепатомегалия;
г) гиперспленизм.
3. Декомпенсированная стадия ПГ:
а) стойкая спленомегалия;
б) наличие ВРВ различной протяженности по длине пищевода;
в) гепатомегалия;
г) прогрессирующий гиперспленизм;
д) кровотечения из ВРВП;
е) возможно, асцит.
Данная классификация позволяет определить порядок необходимого обследования и выбрать оптимальное лечение ПГ у каждого конкретного больного.
Методы диагностики
При изучении анамнеза заболевания следует обращать внимание на факторы, которые могли привести к развитию ПГ. Особое внимание обращают на анамнез периода новорожденности, семейный анамнез, особенно на наследственные заболевания и болезни печени. Характерными причинами заболевания, выявляемыми при сборе анамнеза, являются осложнения при заживлении пупочной ранки в грудном возрасте, омфалит, пупочный сепсис или катетеризация пупочной вены. Особое внимание обращается на наличие в анамнезе кровотечений желудочно-кишечного тракта.
Общеклиническое обследование позволяет определить степень физического развития ребенка, уточнить размеры печени и селезенки, выявить наличие асцита, печеночных знаков, расширение вен передней брюшной стенки и геморроидальных узлов, другие признаки ПГ. Следует отметить, что уже при первичном осмотре и объективном обследовании больного можно определить некоторые признаки ПГ.
Характерными признаками вторичного гиперспленизма у детей в возрасте до 3-4 лет являются увеличение живота и неустойчивый стул при отсутствии бактериологически подтвержденной кишечной инфекции. После 3 лет чаще отмечаются спленомегалия и пищеводные кровотечения. Высокая частота спленомегалии (100 %) и кровотечений (75-80 %) позволяют считать эти симптомы особо патогномоничными при ПФПГ (рис. 1).
Рис. 1. Ребенок 5 лет со спленомегалией
Клинико-лабораторные методы обследования уточняют степень гиперспленизма, функциональное состояние печени, состояние системы свертывания крови.
ФГДС позволяет определить наличие и степень ВРВП, а в экстренных ситуациях — источник кровотечения. Это имеет большое значение, так как у одной трети пациентов с ВРВП кровотечение может быть вызвано застойной гастропатией , язвенными поражениями желудка и двенадцатиперстной кишки. Кроме этого, ФГДС позволяет определить риск развития кровотечений и степень застойной гастропатии. Этот метод может с успехом применяться на высоте кровотечения с лечебной целью, для выполнения эндоскопического гемостаза.
Рентгенологическое исследование пищевода и желудка дает возможность выявить степень и протяженность варикозного расширения вен по длине пищевода, состояние нижнего пищеводного сфинктера, его функциональные возможности, гастроэзофагеальный рефлюкс.
Методы визуализации системы воротной вены являются основными в постановке диагноза СПГ. Они позволяют определить анатомию воротной системы, вид гемодинамического блока, степень развития коллатерального кровообращения. Используются следующие методы обследования:
1. Ультразвуковой метод диагностики позволяет неинвазивно оценить состояние печени и селезенки, уровень блока, наличие или отсутствие асцита.
2. Допплерография воротной системы позволяет уточнить качественные и количественные характеристики воротного кровотока, что определяет риск развития ГЭК.
3. Спленопортография, компьютерная ангиография позволяют точно визуализировать систему воротной вены, определить вариант гемодинамического блока, характер и степень выраженности коллатералей, выбрать оптимальный метод хирургического лечения.
Биопсия печени. Существуют три основных методики пункции печени: чрескожная, лапароскопическая, трансягулярная.
Чрескожная биопсия, или «слепой» метод, дает удовлетворительные результаты в случае диффузного поражения печени. Описано большое количество методик и используемых пункционных игл. Наиболее часто используется биопсийное механическое устройство Pro-Mag (рис. 2). Биопсия выполняется под наркозом, чаще всего межреберным доступом.

Рис. 2. Биопсийное механическое устройство Pro-Mag
Лапароскопическая и трансягулярная биопсии используются редко.
Цитологическое исследование пунктата костного мозга с одновременным исследованием периферической крови необходимо для диагностики гиперспленизма и определения показаний к сопутствующей спленэктомии. Пунктат обычно получают из гребня подвздошной кости. Признаками гиперспленизма являются такие изменения в пунктате костного мозга, как увеличение бластов, лимфоцитов, снижение лейко-эритроцитарного индекса и индекса созревания эритроцитов, уменьшение количества мегакариоцитов и тромбоцитов, угнетение их функции. Помимо этого, при определении показаний к спленэктомии учитывают изменения в периферической крови: снижение гемоглобина ниже 100 г/л, лейкоцитов — ниже 2,5 - 109л, тромбоцитов — менее 900 00 в 1 мкл.
Все перечисленные методы взаимно дополняют друг друга. В следующем разделе мы сочли необходимым более подробно остановиться на некоторых из них.
Ультразвуковое исследование
Комплексное ультразвуковое исследование включает в себя осмотр в В-режиме, дуплексное сканирование с цветным допплеровским картированием.
Для оценки кровотока в воротной вене служат показатели размеров сосудов, максимальная линейная скорость кровотока (V max), минимальная линейная скорость кровотока (V min), средняя линейная скорость кровотока (V mean), индексы периферического сопротивления — резистентности (RI), пульсаторный (PI) и объемный кровоток.
С помощью комплексного ультразвукового исследования могут выявляться следующие эхографические изменения при ПГ у детей:
1. Кавернозная трансформация на месте основного ствола воротной вены. При этом в области ворот печени определяется «сплетение» извитых тубулярных структур, состоящих из реканализированного тромба и портопортальных коллатералей ворот печени.
2. Изменения в направлении кровотока в воротной вене. В норме у здорового человека гепатопетальный поток отмечается в любом отделе портальной венозной системы. Цветное допплеровское картирование позволяет дать качественную оценку состояния воротной вены, определить направление кровотока.
3. Диффузные, как правило, умеренно выраженные изменения паренхимы печени в виде неравномерного повышения эхогенности паренхимы. Неоднородность изменений обычно обусловлена гиперэхогенной тяжистостью по ходу ветвей воротной вены. Размеры печени в большинстве случаев ПГ соответствуют возрастным показателям, однако почти у всех больных имеется гипертрофия хвостатой доли печени.
4. Спленомегалия различной степени выраженности, иногда сопровождающаяся диффузным повышением эхогенности паренхимы селезенки. Размеры селезенки в определенной степени соответствуют тяжести ПГ.
5. Диффузные изменения стенок желчного пузыря. В норме стенки желчного пузыря обычно не видны, но допускается их утолщение до 2 мм. При ПГ желчный пузырь, как правило, деформирован с резко утолщенными, до 4-5 мм, стенками. В толще стенок желчного пузыря обнаруживаются порто-портальные коллатерали.
6. Утолщение и повышение эхогенности малого сальника. В большинстве случаев повышение эхогенности малого сальника затрудняет визуализацию поджелудочной железы и крупных сосудов в этой области (верхней брыжеечной вены, фрагменты селезеночной и левой почечной вен).
7. Самопроизвольно образовавшиеся коллатерали — безусловный признак СПГ. К ним относят ВРВ пищевода и желудка, диафрагмальные, спленоренальные и спленогастральные коллатерали, коллатерали в стенке желчного пузыря, поджелудочной железы и т. д.
Исключительно важное значение приобретает УЗИ в экстренных ситуациях, когда больной поступает в клинику на высоте кровотечения. Во время УЗИ в этих случаях необходимо не только установить вид блока воротного кровотока, но и варианты анатомии магистральных стволов воротной вены, с которыми можно наложить декомпрессивный анастомоз. Также при УЗИ необходимо визуализировать левую почечную вену, пороки развития которой (рассыпчатый тип строения) имеются приблизительно у 3-10 % детей с ПФПГ.
Спленопортография
Рентгеноконтрастное исследование воротной системы позволяет получить отчетливое представление о состоянии портального кровообращения. Обследование проводится в рентгенкабинете под эндотрахеальным наркозом с деполяризующими миорелаксантами. Пункцию селезенки производят в положении больного на спине, в Х межреберьи по средней аксиллярной линии, иглой с мандреном. После прокола передней брюшной стенки мандрен удаляют, иглу вводят в пульпу селезенки на 1,5-2 см. При появлении крови из иглы в последнюю, в зависимости от массы тела ребенка, вводят 30-50 мл подогретого до 37 °С контрастного вещества и выполняют серию рентгенограмм. При оценке спленопортограмм обращают внимание на степень расширения селезеночной и воротной вен, деформацию сосудистого рисунка печени, забрасывание контрастного вещества в ветви воротной вены и состояние коллатеральных путей кровообращения (рис. 3).
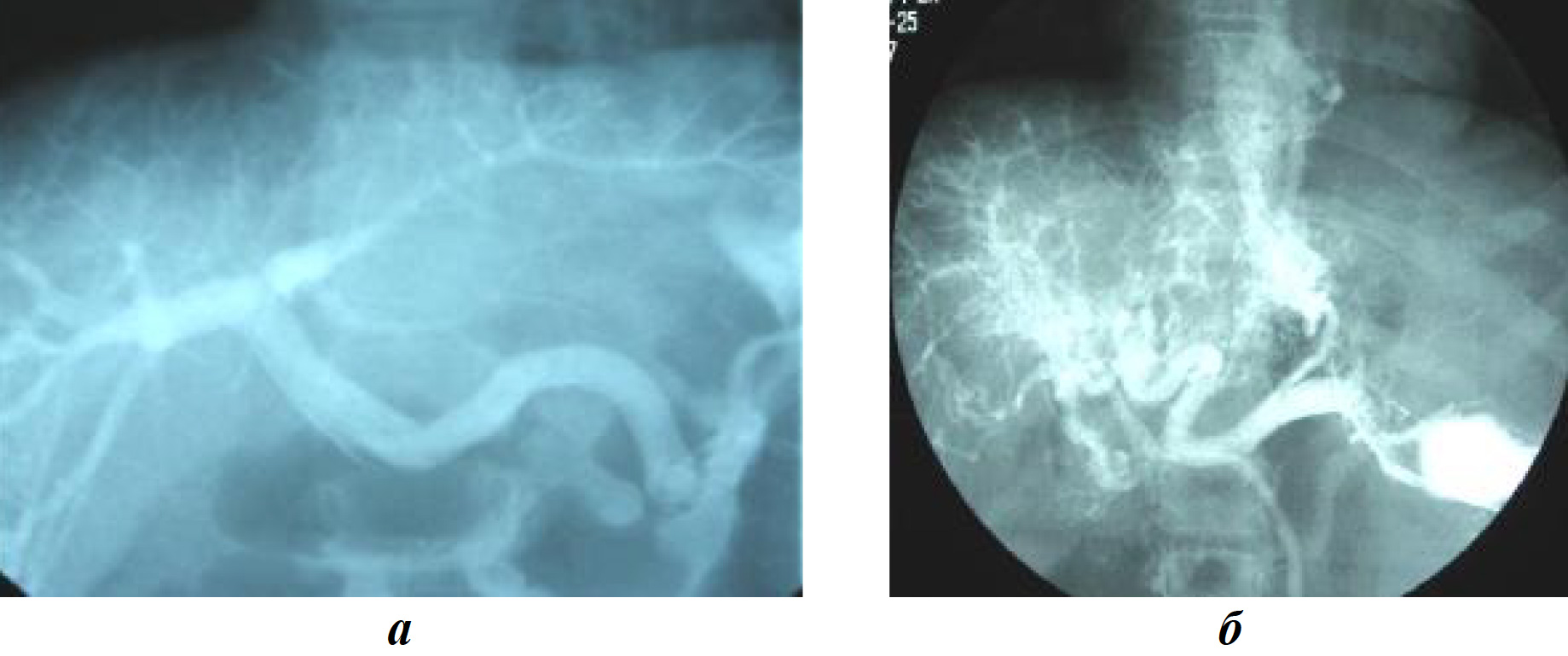
Рис. 3. Спленопортограмма: а — нормальная анатомия воротной вены; б — СПГ, подпеченочный блок, варикозная трансформация воротной вены
Фиброгастродуоденоскопия
Метод позволяет выявить и характеризовать варикозные вены в пищеводе и кардиальном отделе желудка. К данному исследованию у больных ПГ следует подходить с особой осторожностью. Травма истонченных варикозных вен может вызвать тяжелое пищеводное кровотечение. Вместе с тем выполнение исследования в экстренном порядке может быть затруднено вследствие продолжающегося кровотечения.
При осмотре ВРВП выявляются как расширенные и извитые стволы подслизистого слоя. По степени выраженности различают одиночные венозные стволы, венозные сплетения в области кардии и венозные сплетения, переходящие на пищевод. При поверхностном расположении вены имеют голубую окраску и выбухают в просвет как тяжи или узлы. При глубоком залегании, на фоне розовой оболочки пищевода видны продольные извитые тяжи того же цвета. Они не спадаются при раздувании пищевода воздухом или надавливании на них эндоскопом. Одновременно оцениваются пептические изменения слизистой пищевода, что позволяет прогнозировать вероятность кровотечения. Следует отметить, что у больных ПГ часто наблюдаются воспалительные и эрозивные изменения слизистой пищевода вследствие гастроэзофагеальной рефлюксной болезни (рис. 4).
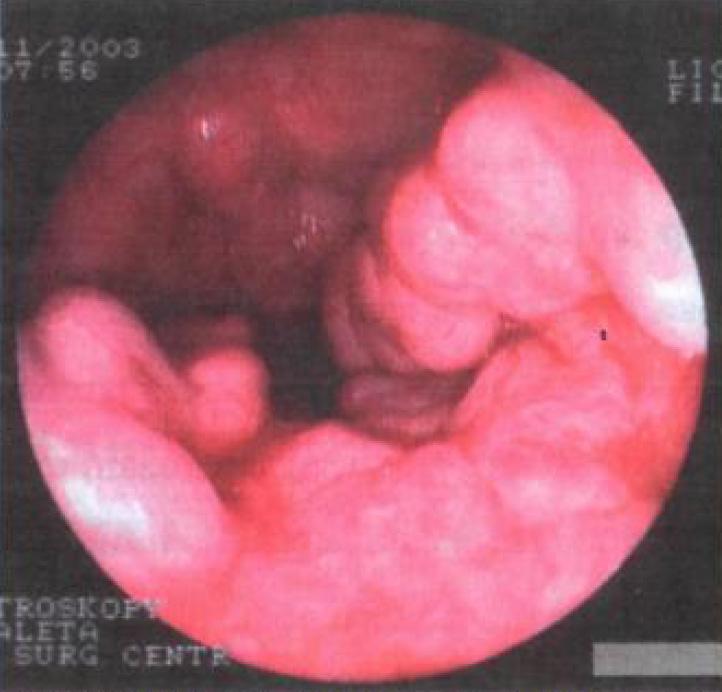
Рис. 4. ФГДС. Варикозное расширение вен пищевода
Протокол комплексной оценки состояния вен пищевода и желудка выделяет четыре степени ВРВП. В основу протокола положены принципы регистрации эндоскопических признаков ВРВП, предложенные Японским обществом по изучению портальной гипертензии в 1991 г. При выполнении исследования определяются локализация, протяженность и форма вен пищевода и желудка, а также наличие так называемых «вишневых пятен» и «красных знаков», которые являются предвестниками кровотечения. Обнаруженные изменения отмечают в виде стандартной схемы, которая позволяет врачу-эндоскописту четко представить себе имевшуюся ранее у больного патологию (Э. М. Колесников, В. В. Троян, 2004). Протокол эндоскопического исследования позволяет достаточно подробно и объективно оценить степень варикозного расширения вен, а также проводить динамическую оценку эффективности ЭС и прогнозировать риск развития кровотечений в будущем. Не менее важным является тот факт, что таким образом обеспечивается преемственность у больных с ПГ, которые могут годами лечиться в разных учреждениях и у разных врачей.
Консервативное лечение пищеводно-желудочных кровотечений при портальной гипертензии
Как отмечалось выше, пищеводные кровотечения являются самым опасным осложнением ПГ у детей. Они отличаются массивностью, упорством, малой склонностью к самопроизвольной остановке и сопровождаются высокой летальностью. Лечение кровотечений следует начинать с неотложных консервативных мероприятий, направленных на его остановку.
Гемостатические мероприятия при ПГ проводятся с соблюдением общих принципов лечения кровотечений желудочно-кишечного тракта. Больному назначают строгий постельный режим, голод, устанавливают назогастральный зонд и проводят седатацию. Осуществляют катетеризацию центральной вены, вводят витамин К, дицинон. Проводят мероприятия по восстановлению объема циркулирующей крови. Для гемостаза более показаны переливания свежезамороженной плазмы и отмытых эритроцитов, чем цельной крови. Обязательно оральное и внутривенное назначение антацидов, блокаторов Н2-рецепторов гистамина, ингибиторов протонового насоса.
Из местных мероприятий показано промывание желудка через назогастральный зонд холодным 0,5%-ным раствором №С1, можно с добавлением аминокапроновой кислоты. Это способствует остановке кровотечения и позволяет удалить токсичные продукты распада крови из организма. Чтобы избежать водной интоксикации, необходим тщательный контроль получаемой обратно жидкости при каждом промывании. Особенно это важно у маленьких детей. Иногда этих мероприятий достаточно для остановки кровотечения.
При отсутствии эффекта показано использование фармакологических препаратов, направленных на снижение давления в системе воротной вены. В настоящее время для этой цели используются две основные группы препаратов: вазоконстрикторы и вазодилататоры.
К вазоконстрикторным пептидам относятся вазопрессин и соматостатин, а также их синтетические аналоги: терлипрессин, октреотид, сандостатин и др. (табл.). Эти препараты назначают внутривенно. Возможно использование питуитрина, в состав которого входит вазопрессин. Средствами выбора при медикаментозном лечении кровотечений в настоящее время считаются соматостатин и его синтетический аналог октреотид. Механизм действия этих препаратов связан с тем, что они вызывают сужение артериальных сосудов внутренних органов и, соответственно, снижают приток крови в систему воротной вены. Эффективность препаратов вазопрессина, по данным разных авторов, оценивается от 30 до 70 %. При использовании вазопрессина возможно снижение перфузии печени и ухудшение ее функционального состояния. У взрослых могут иметь место спазмы коронарных сосудов. Антидиуретический эффект вазопрессина может привести к ятрогенной задержке жидкости в организме, гипонатриемии, водной интоксикации. Поэтому необходим тщательный мониторинг диуреза. Системные эффекты менее выражены при использовании сандостатина.
Вазоконстрикторы и способы их применения
| Препарат |
Первичное болюсное введение |
Постоянная инфузия |
Продолжительность лечения |
| Терлипрессин |
2 мг внутривенно |
1-2 мг каждые 4 часа внутривенно |
В течение 2 дней |
| Октреотид |
50 мкг внутривенно |
50 мкг/ч внутривенно |
До 5 дней |
| Соматостатин |
250 мкг внутривенно |
250 мкг/ч внутривенно |
До 5 дней |
Вазодилататоры (нитраты, антагонисты кальция) редко применяются для остановки кровотечений при ПГ. Механизм их действия объясняют снижением печеночного сосудистого сопротивления и раскрытием портосистемных коллатералей. Вместе с тем вазодилататоры снижают артериальное давление.
Общим недостатком фармакотерапии является частое, более чем в 50 % случаев, возобновление кровотечения после ее отмены. Нельзя не учитывать значения и такого фактора, как высокая стоимость данных препаратов. Например, один день лечения сандостатином стоит больше, чем один сеанс эндоскопической склерозирующей терапии. При продолжающемся кровотечении в ряде случаев возможно применение зонда-обтуратора Sengstaken- Blakemore (рис. 5).
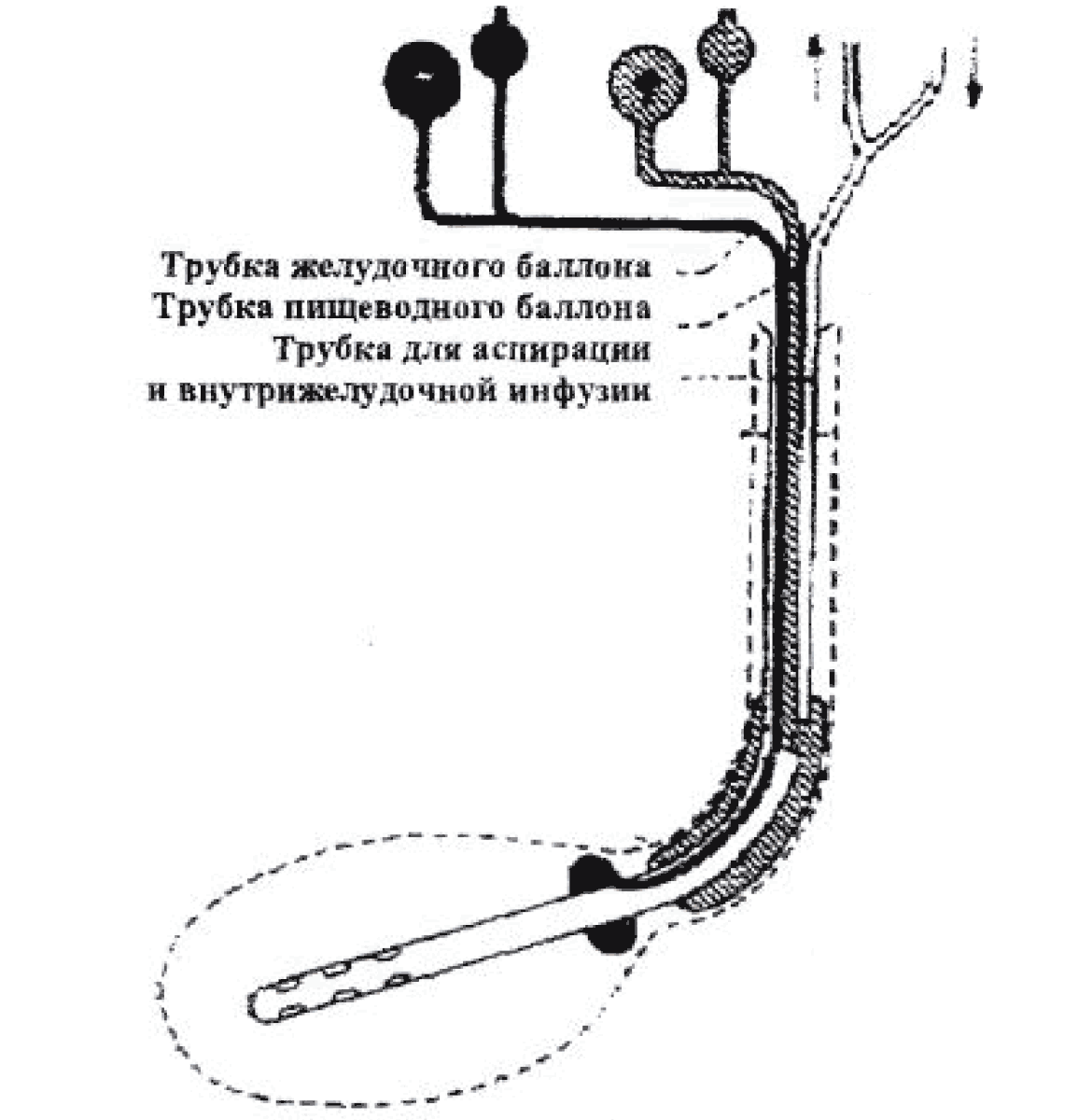
Рис. 5. Зонд-обтуратор Sengstaken-Blakemore (зонд Блэкмора)
При постановке зонда Блэкмора необходимо соблюдать определенные правила. Баллонная тампонада пищевода довольно болезненна и плохо переносится детьми. Всегда имеется опасность аспирации слюны. Поэтому данная процедура обязательно требует седатации ребенка и проводится вместе с интубацией трахеи. Обязательно и строго используется зонд, соответствующий по размеру возрасту ребенка. Зонд должен быть проведен через носовой ход. В желудочном баллоне зонда создают давление 40-60 мм рт. ст. Затем баллон подтягивают ко входу в пищевод и удерживают в натянутом состоянии. При необходимости натяжение поддерживают при помощи груза массой до 100 г. В проксимальном пищеводном баллоне создают давление до 40 мм рт. ст. и этим сдавливают варикозные вены. Через каждые 8 ч воздух из обоих баллонов следует выпускать, чтобы не вызвать пролежни в пищеводе. Одновременно выявляют, продолжается кровотечение или нет. Длительность использования зонда Блэкмора не должна превышать 48 ч.
Большинство авторов отмечает, что после использования зонда-обтуратора Блэкмора в 20-50 % случаев наступает рецидив кровотечения. Поэтому в последние годы все большее значение приобретает методика экстренной остановки пищеводного кровотечения при помощи эндоскопической склерозирующей терапии.
Эндоскопическая терапия варикозно расширенных вен пищевода
Выделяют следующие виды эндоскопического лечения ВРВП:
1. Эндоскопическое склерозирование.
2. Эндоскопическое лигирование.
3. Облитерация вен тканевыми композитами.
Для склерозирующей терапии ВРВП используются следующие препараты:
1) производные жирных кислот: этаноламинолеат, морруат натрия;
2) синтетические вещества: содиумтетрадецилсульфат (тромбовар), полидоканол (этоксисклерол);
3) препараты других групп: этиловый спирт, фенол, тиссукол (берипласт), гистоакрил (букрилат).
Большинство склерозирующих агентов может быть применено как для интра-, так и для паравазального введения. В США и Англии чаще используется тромбовар и этаноламинолеат, в европейских странах предпочитают этоксисклерол.
Сравнение различных видов препаратов не выявило существенных различий в их эффективности. Считается, что чем концентрированней склерозант, тем выше риск побочных действий, но и тем выраженней облитерирующий эффект.
Эндоскопические склерозирование проводят по принципу «снизу вверх» начиная от пищеводно-желудочного перехода и продолжая в проксимальном направлении на всем протяжении, где определяются варикозные вены.
Существуют следующие методы склерозирования ВРВП:
1) интравазальный — склерозирующее вещество вводится непосредственно в просвет вены;
2) паравазальный — склерозант вводится в субмукозный слой;
3) комбинированный.
При интравазальном склерозировании препарат при помощи инъектора вводят непосредственно в просвет варикозной вены или узла (рис. 6). Склерозант, в частности полидоканол, повреждает эндотелий сосуда и вызывает денатурацию белков. Оказывая в момент введения противосвертывающее действие, полидоканол в последующем стимулирует быстрое образование тромба, организация которого происходит в течение 7 дней.
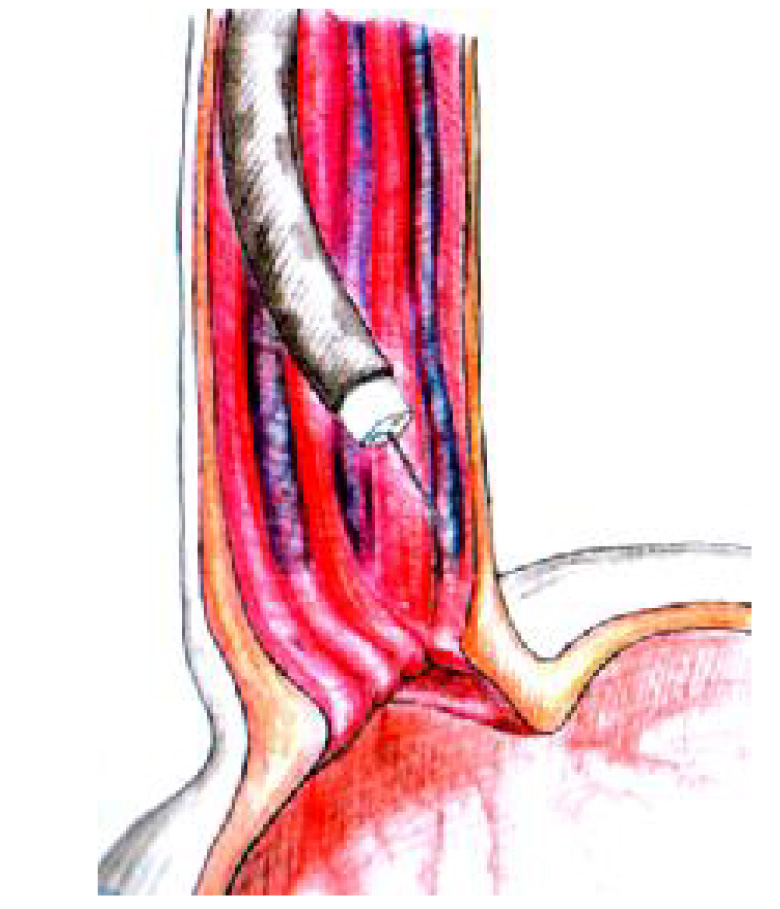
Рис. 6. Интравазальное склерозирование (по мат. А. Ю. Разумовского)
В качестве альтернативной методики было предложено вводить склерозант не в просвет сосуда, а в окружающие его ткани, т. е. паравазально. Основная цель паравазальной склеротерапии заключается в создании отека подслизистого слоя, который сдавливает поврежденный сосуд и, тем самым, останавливает кровотечение. В дальнейшем, за счет активизации склеротического процесса в окружающих тканях происходит укрепление стенки сосуда и ликвидируется варикозное его расширение.
Комбинированный способ лечения предусматривает сочетание интравазального и паравазального введения препарата и призван объединить преимущества обеих методик. При этом целесообразнее начинать с интравазального введения препарата, когда ВРВП отчетливо контурируются, и завершать паравазальным введением склерозирующего раствора. Комбинированная методика считается оптимальным способом склеротерапии.
В последнее время наметилась тенденция к использованию тканевых композитов, или так называемых «тромбиновых коктейлей». Их примером является тиссукол (берипласт). Это двухкомпонентный тканевой гель из концентрата человеческого фибриногена и тромбина. Кроме того, он содержит человеческий альбумин, L-аргинина гидрохлорид, L-изолейцин, глютаминат натрия, хлорид и цитрат натрия. Преимуществом тиссукола является то, что он способен вызывать локальный тромбоз сосудов без повреждения окружающих тканей.
Склерозирующая терапия может использоваться как для экстренной остановки кровотечения из варикозных вен, так и для профилактики и лечения. Результаты экстренной эндосклеротерапии у детей, как правило, хорошие. Кровотечение удается остановить у большинства детей (70-90 %), а частота рецидивов невелика.
Показаниями к профилактической эндосклеротерапии являются:
1. Варикозное расширение вен пищевода 1-2-й степени.
2. Внутрипеченочный гемодинамический блок.
3. Компенсированная и субкомпенсированная фаза заболевания.
4. Наличие развитых спонтанных спленоренальных коллатералей, по данным спленопортографии.
5. Сохраняющиеся ВРВП после оперативного лечения.
Профилактическая эндосклеротерапия довольно эффективна у детей со спонтанными спленоренальными анастомозами, которые образуются в забрюшинном пространстве и выявляются при проведении серийных спленопортограмм. Это связано с тем, что по мере облитерации варикозных вен пищевода возрастает функциональная нагрузка на спленоренальные коллатерали, что приводит к более полному их раскрытию. Аналогичный эффект может быть получен и у больных после портокавального шунтирования.
Склерозирующая терапия ВРВП является ведущим методом профилактики кровотечений у детей с хроническими заболеваниями печени и внутрипеченочным гемодинамическим блоком. В результате эндоскопического склерозирования селективно облитерируются варикозные вены в области пищеводно-желудочного перехода, где риск их разрыва особенно велик. В то же время параэзофагеальные коллатерали портосистемного шунтирования сохраняются, а портальная перфузия печени остается на высоком уровне. Кроме того, данная методика не препятствует последующей трансплантации печени. В отдаленном периоде после ЭС возможен рецидив ВРВП за счет притока крови в подслизистое сплетение из параэзофагеальных вен через межмышечные коммуникантные вены. Вероятность и частота рецидива ВРВП зависит от степени распространения склеротического процесса в подслизистом слое пищевода, достигнутого на предыдущих сеансах склеротерапии. При ЭС иногда наблюдаются так называемые «малые» осложнения в виде поверхностных изъязвлений слизистой, транзиторной гипертермии, загрудинных болей, дисфагии. Очень редко могут иметь место стриктуры или перфорации пищевода, тромбоз брыжеечных вен с инфарктом кишечника, абсцессы мозга вследствие напряженной бактериемии.
Эндоскопическое лигирование вен пищевода. Перевязка варикозных вен и узлов пищевода тонкой лигатурой вызывает облитерацию сосудов без введения склерозирующих веществ (рис. 7).
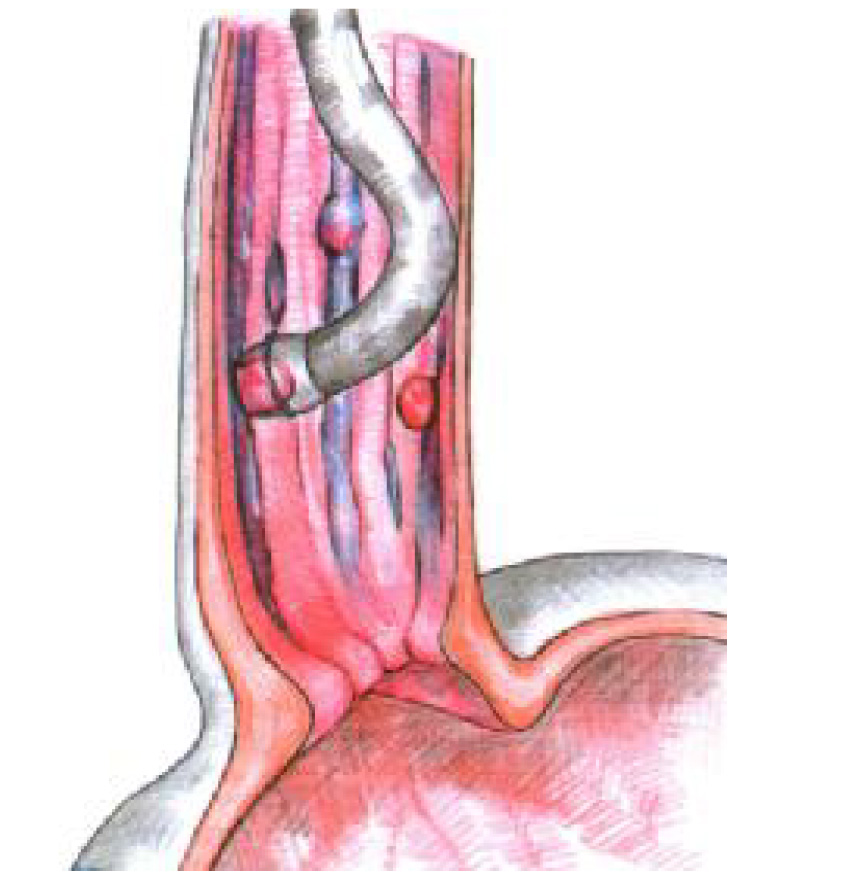
Рис. 7. Лигирование варикозных узлов пищевода (по мат. А. Ю. Разумовского)
Метод позволяет остановить острое кровотечение и ликвидировать ВРВП путем повторных лигировании. Методика заключается в аспирации узла в просвет аппарата и завязывания вокруг его основания тонкой лигатуры. Метод эндоскопического лигирования позволяет добиться облитерации ВРВП у 70-100 % пациентов, при этом частота осложнений ниже, чем при склеротерапии. Вместе с тем данный способ не следует применять у детей младшего возраста, у которых имеется риск полного захвата тонкой стенки пищевода в лигатуру и, вследствие этого, развития серьезных осложнений. К недостаткам метода относят также большую трудоемкость, в связи с чем лигирование применяется намного реже склерозирования.
Несмотря на успехи эндоскопических методов лечения, в значительном проценте случаев по ряду причин нельзя обойтись без хирургического вмешательства. Показания к операции возникают в тех ситуациях, когда сохраняется опасность кровотечений даже на фоне эндоскопического склерозирования или ребенок имеет более 2-3 эпизодов кровотечений в год.
Хирургическое лечение портальной гипертензии
Для профилактики пищеводных кровотечений, лечения ПГ или ее осложнений могут использоваться следующие хирургические методы:
1. Операции портосистемного шунтирования, т. е. операции, направленные на снижение давления в портальной системе и создание новых путей оттока крови: портокавальные, мезентерикокавальные, спленоренальные, рекс-шунт и другие типы сосудистых анастомозов, различные варианты органопексий.
2. Операции портосистемного разобщения (ПСР), т. е. операции, направленные на прекращение кровотока по ВРВП: операции разобщения и деваскуляризации.
3. Операции, направленные на улучшение печеночного кровотока и регенерацию печени: резекция печени, периартериальная нейрэктомия общей печеночной артерии, артериальные анастомозы.
4. Операции, направленные на отведение асцитической жидкости из брюшной полости: лапароцентез, дренирование брюшной полости, дренирование грудного лимфатического протока, перитонеально-венозное шунтирование и др.
5. Трансплантация печени.
Как уже упоминалось выше, в настоящее время практически не используются операции, направленные на улучшение печеночного кровотока и регенерацию печени, а также различные виды органопексий. Одни из этих видов — оментогепатопексия, гастрогепатопексия, колоногепатопексия — были рассчитаны на формирование анастамозов между сосудами воротной вены и печеночными венами при внепеченочной форме ПГ. Другие — гепатопневмопексия и спленопневмопексия, состоящие в перемещении части печени или селезенки в плевральную полость, рекомендовали для хирургического лечения декомпенсированного цирроза печени, осложненного асцитом и синдрома Бадда-Киари у взрослых. Данные операции довольно травматичны и, как показали последующие наблюдения, малоэффективны, поскольку достаточная сеть сосудистых анастомозов у этих больных не формируется.
Операции, направленные на улучшение печеночного кровотока и регенерацию печени — резекция печени, периартериальная неврэктомия общей печеночной артерии, артериальные анастомозы и др. носят паллиативный характер, недостаточно эффективны и могут применяться только в сочетании с другими методами.
Операции портосистемного разобщения
Анализ современной зарубежной литературы позволяет сделать вывод, что операции ПСР являются достаточно распространенным видом хирургического вмешательства при варикозном расширении вен пищевода и желудка, хотя применяются реже, чем портосистемное шунтирование и эндоскопическое лечение.
Показания к операциям ПСР обычно возникают: а) при множественном тромбозе портальной системы, в том числе после перенесенной ранее спленэктомии; б) при невозможности выполнить сосудистые операции вследствие малого калибра или аномалий сосудов; в) для экстренной остановки кровотечения при некупируемом пищеводно-желудочном кровотечении.
Операции ПСР предназначены для предотвращения или снижения кровотока по естественным портокавальным анастомозам в венозной системе пищевода и желудка. Предложены различные варианты подобных операций. В соответствии с видом основного оперативного вмешательства различают операции пересечения и реанастомоза (транссекции) пищевода или желудка, а также операции деваскуляризации пищевода и желудка.
В 1950 г. N. S. Tanner предложил две оперативные методики по лечению ВРВП: 1) поперечное пересечение и сшивание желудка в субкардиальном отделе; 2) пересечение с последующим сшиванием пищевода в наддиафрагмальном сегменте. Эти операции дают возможность разъединить венозные сети желудка и пищевода. Однако они не получили широкого применения из-за высокой травматичности и относительно частой несостоятельности швов пищевода и желудка.
Широкое распространение получила операция деваскуляризации, разработанная М. Д. Пациорой (1974) (рис. 8). Сущность ее состоит в прошивании и перевязке отдельными лигатурами варикозных вен кардиального отдела желудка и пищевода со стороны слизистой оболочки, перевязке венечной вены желудка и левых желудочных сосудов, иногда в сочетании со спленэктомией. Операцию выполняют из абдоминального доступа, она менее травматична и технически проста. Существенным недостатком данной методики является неполное разобщение интрамуральных вен желудка и пищевода. Мелкие вены гастроэзофагеальной сети анастомозов остаются неперевязанными, сброс крови по ним продолжается и даже увеличивается. Таким образом сохраняются условия для рецидива варикозного расширения вен и пищеводных кровотечений.
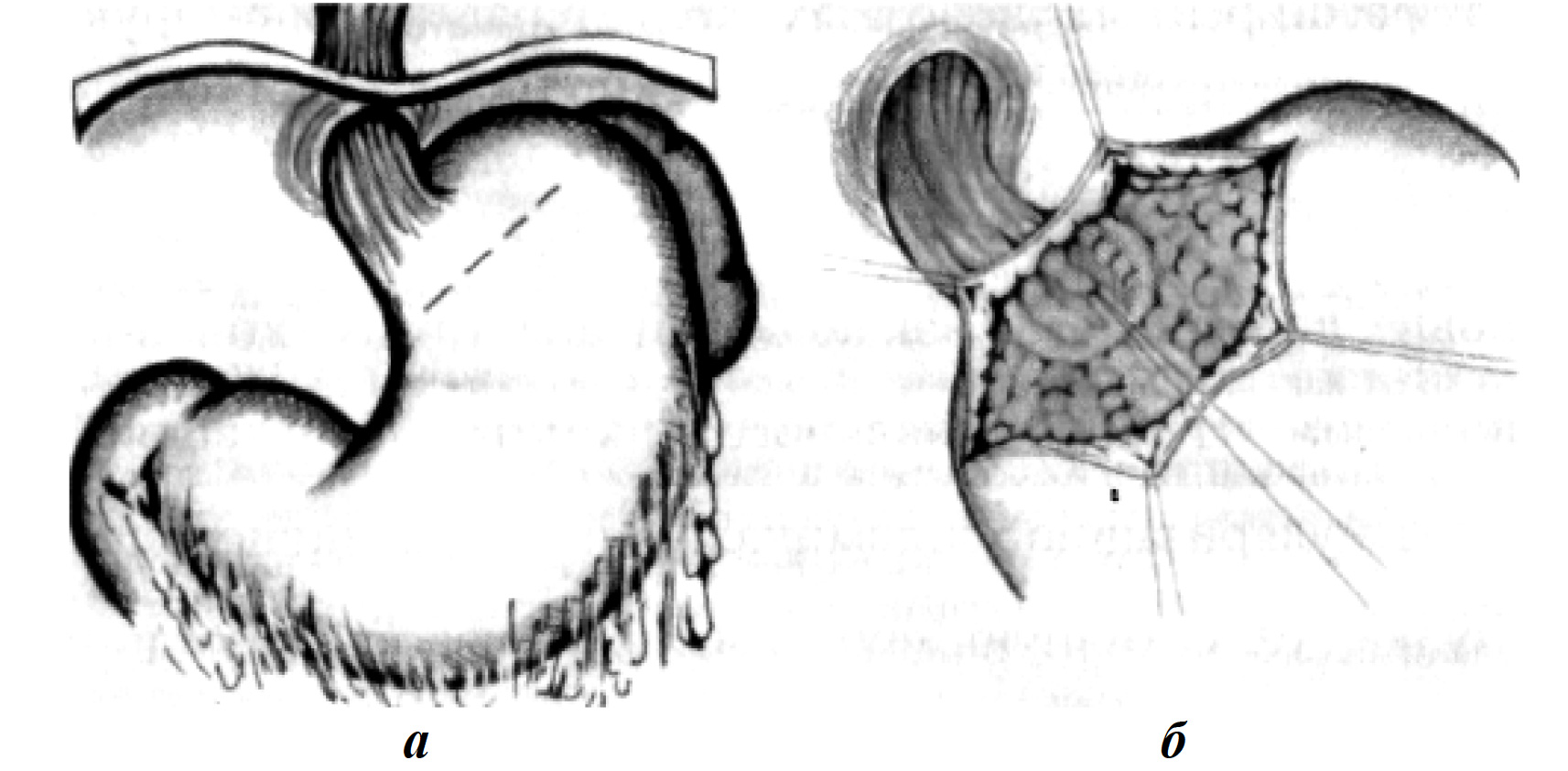
Рис. 8. Операция по М. Д. Пациоре (1974): а — гастротомия; б — прошивание ВРВ пищевода и желудка
Достаточно полное разобщение интрамуральных венозных сетей пищевода и желудка достигается при трансторакальной субмукозной транссекции пищевода по Walker (1982). Однако и эта операция нередко дает рецидивы и осложнения.
Наибольшей популярностью среди методов ПСР в настоящее время пользуется операция, предложенная в 1973 г. М. Sugiura и S. Futagawa (рис. 9).
Классическую операцию Sugiura выполняют в два этапа. На первом этапе производят торакотомию слева и перевязывают все коммуникантные ветви, идущие от расширенных венозных коллатералей, формирующих сплетение вокруг пищевода, сохраняя стволы блуждающего нерва и собственно параэзофагеальные коллатерали интактными. Затем пищевод пересекают выше или на уровне диафрагмы и накладывают анастомоз «конец в конец». Второй этап выполняют из абдоминального доступа. Производят спленэктомию, полную деваскуляризацию абдоминальной части пищевода и кардиальной части желудка, селективную проксимальную ваготомию и пилоропластику. Операция Sugiura позволяет ликвидировать явления гиперспленизма, разобщить венозную систему пищевода и желудка с параэзофагеальными коллатералями, снизить объем интрамурального кровотока пищевода, сохранить параэзофагеальные коллатерали в качестве естественных шунтов.
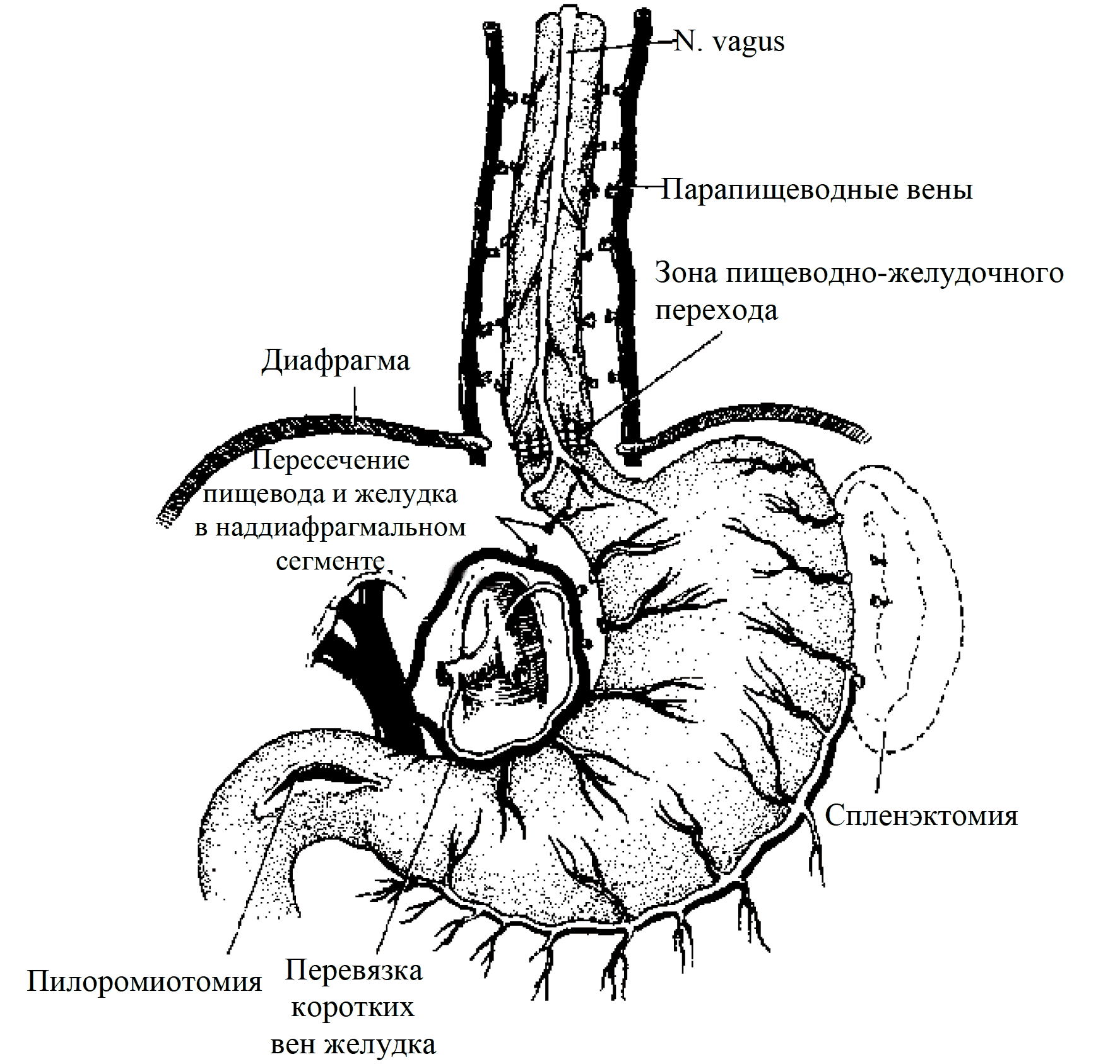
Рис. 9. Схема операции Sugiura-Futagawa
В последующем, с целью упрощения операции, было предложено использовать механическое сшивающее устройство для наложения эзофагоанастомоза, накладывать циркулярный гемостатический шов через все слои стенки желудка, вместо пересечения пищевода производить проксимальную селективную ваготомию, использовать фундопликацию по Toupet или Nissen для профилактики несостоятельности анастомоза и ГЭР. Операцию в настоящее время проводят с использованием только абдоминального доступа. Наиболее частыми осложнениями после операции Sugiura являются: транзиторная дисфагия, стеноз пищевода (2,5-4 %), несостоятельность анастомоза (6-7 %). Гастроэзофагеальная рефлюксная болезнь у оперированных больных, при использовании одной из методик фундопликации, развивается редко (4 %). Вместе с тем у большинства больных через 6-7 лет после операций ПСР наблюдается рецидив ВРВП. Это объясняется образованием новых коллатеральных вен вокруг пищевода и верхней части желудка. Частота рецидивов кровотечений в отдаленном периоде после абдоминального этапа операции Sugiura, по данным разных авторов, составляет 25-35 %.
Исследования портального кровообращения в послеоперационном периоде показали, что операция Sugiura не ухудшает перфузию печени. В то же время в желудке отмечается снижение органного кровотока и тканевого насыщения кислородом, которые восстанавливаются к 7-му дню после операции. Эти данные говорят о том, что обширная деваскуляризация может привести к тканевой гипоксии желудка и вызвать геморрагический гастрит, который сам по себе может быть причиной послеоперационных кровотечений. Поэтому объем деваскуляризации должен быть выбран оптимально, чтобы стремление выполнить операцию радикально не привело к развитию геморрагического гастрита.
В настоящее время используется иной вариант хирургической коррекции, получивший название транссекция пищевода. Операция осуществляется через лапаротомный доступ. Мобилизуют абдоминальный отдел пищевода и проксимальную часть желудка с перевязкой левой желудочной артерии. Через небольшую гастротомию в зону пищеводно-желудочного соустья вводится аппарат ПКС (аппарат, формирующий пищеводно-кишечное соустье механическим швом). Затем выполняется иссечение узкого участка пищевода и пересечением всех сосудистых анастомозов в этой зоне с формирование анастомоза аппаратом ПКС-18, ПКС-20 и дополнительным укрыванием линии шва отдельными серозно-мышечными узловыми швами. Далее производится ушивание гастростомы с проведением двухпросветного зонда в желудок и 12-перстную кишку (рис. 10).
Отдельно следует рассмотреть вопрос о показаниях к спленэктомии при операциях ПСР.
В хирургии СПГ показания к спленэктомии могут возникать в следующих случаях:
1. Наличие сегментарной или «левосторонней» портальной гипертензии, когда основное проявление болезни — кровотечения из ВРВ пищевода и желудка вследствие непроходимости (изолированного тромбоза) селезеночной вены.
2. Артериовенозные фистулы между селезеночной артерией и селезеночной веной, то есть когда причиной ПГ является нагрузка системы воротной вены объемом крови.
3. Инфантилизм у подростков, когда удаление селезенки больших размеров ведет к нормализации физических параметров организма.
4. Гиперспленизм.
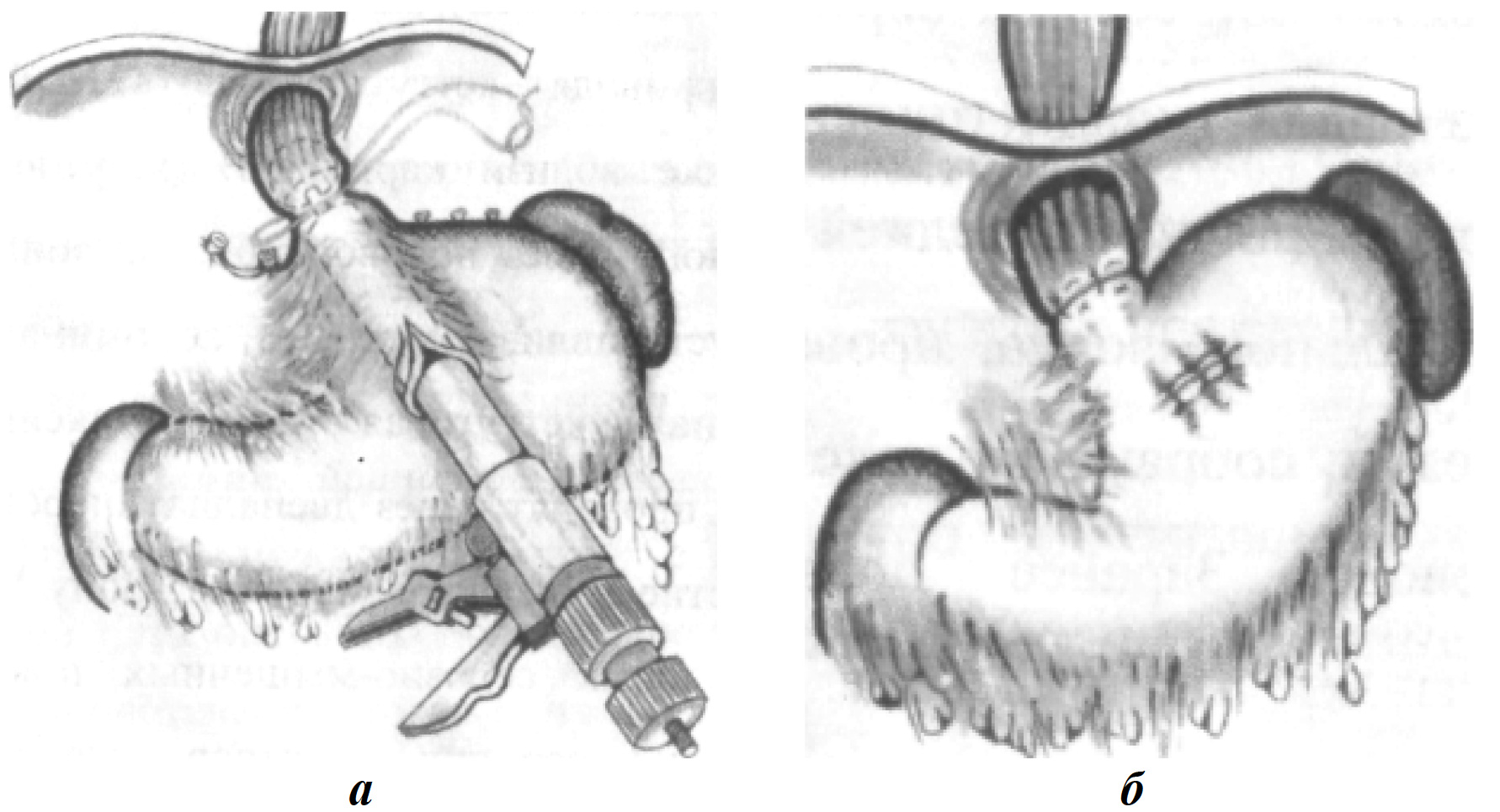
Рис. 10. Транссекция пищевода: а — введение прошивающего аппарата; б — дополнительная перитонизация дополнительными швами зоны соустья
Опыт выполнения спленэктомии при операциях ПСР показывает, что данный этап нередко технически трудно выполним и сопровождается большой интраоперационной кровопотерей. Возможны осложнения в раннем и отдаленном послеоперационном периоде — поддиафрагмальные абсцессы, постспленэктомический сепсис и др. При планировании спленэктомии все пациенты должны вакцинироваться от пневмококка и Haemophilus influenzae тип В для профилактики постспленэктомического сепсиса.
Операции портосистемного шунтирования
Ведущими методами хирургического лечения ПГ, в настоящее время являются различного вида шунтирующие операции (рис. 11).
Эти операции не используются для экстренной остановки кровотечений, однако они могут эффективно снизить портальное давление и вероятность развития варикозных вен пищевода.
Главными их недостатками являются: 1) печеночная энцефалопатия, вследствие отведения не прошедшей через печень крови из системы воротной вены в систему общей циркуляции; 2) возможное поражение печени из-за уменьшения или даже полного прекращения портального кровотока в печени.
Шунтирующие операции нельзя применять у больных, которые являются кандидатами на пересадку печени. Кроме того, примерно у 30-50 % детей эти операции нельзя выполнить из-за анатомических особенностей растущего организма или распространении тромбоза на селезеночную и верхнюю брыжеечную вены.
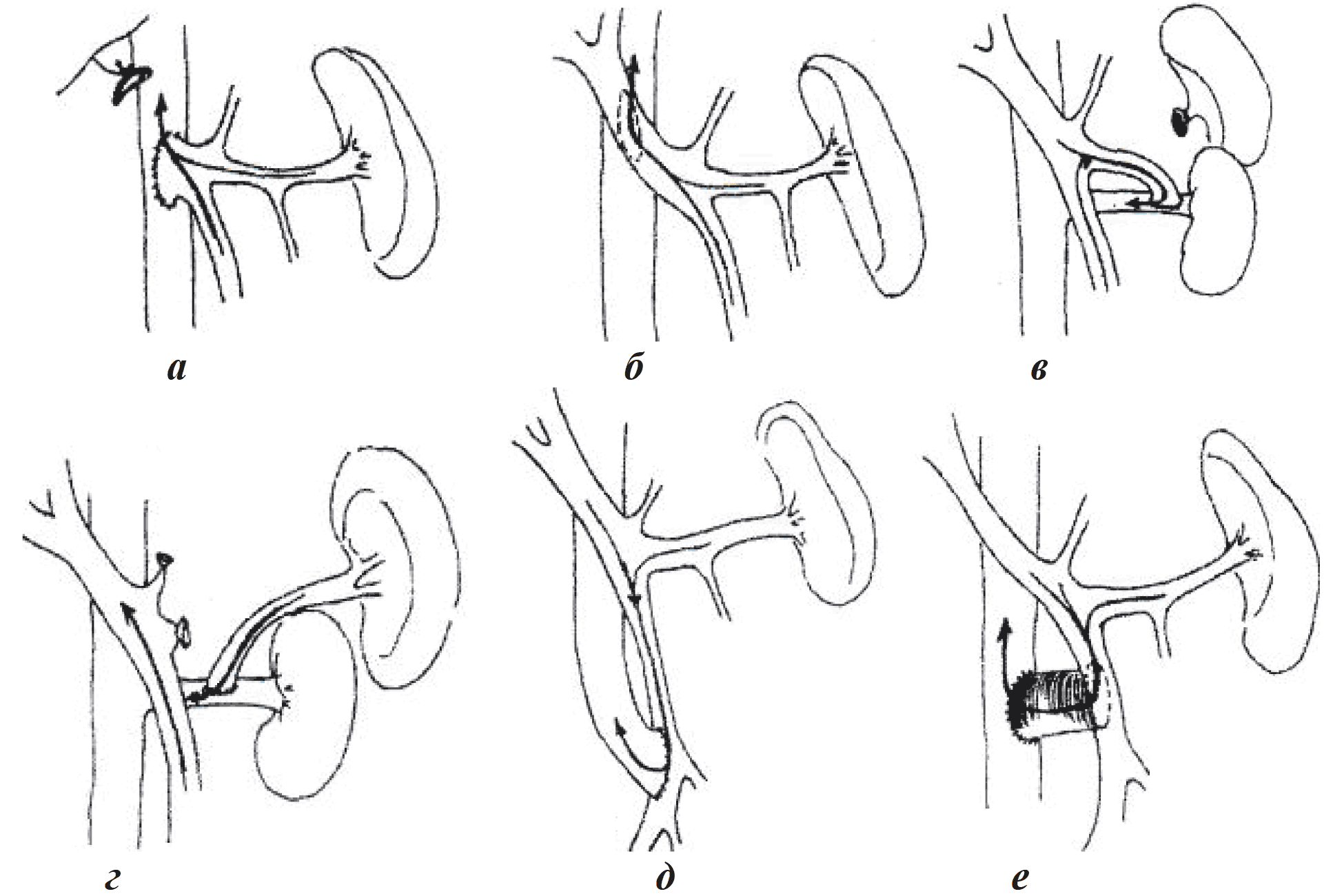
Рис. 11. Варианты шунтирующих анастомозов: а — портокавальный конец в бок; б — портокавальный бок в бок; в — проксимальный спленоренальный; г — дистальный спленоренальный; д — мезентерикокавальный; е — мезентерикокавальный со вставкой
Для успешного шунтирования следует соблюдать несколько условий: 1) используемые вены не должны быть поражены флебитом; 2) шунт должен быть достаточного диаметра для декомпрессии системы воротной вены; 3) шунт должен «расти» вместе с ребенком, для чего следует использовать узловые швы; 4) шунт должен разгружать всю систему воротной вены.
Главным недостатком ПКА является то, что они резко нарушают воротное кровообращение печени вплоть до его полного прекращения. Общий печеночный кровоток может снижаться до 40–50 % от исходного уровня. Причем при анастомозе по типу «бок в бок» данный показатель снижается за счет ретроградного кровотока. Меньше нарушают печеночный кровоток мезентерикокавальные анастомозы. Перевязка нижней полой вены при мезентерикокавальном анастомозе «конец в бок» обычно хорошо переносится детьми. Однако примерно у 10 % взрослых отмечаются отеки нижних конечностей. Использование H-образных шунтов в какой-то мере позволяет преодолеть анатомические сложности при создании сосудистых анастомозов. Для этих целей можно использовать сосудистые протезы, однако практически все они тромбируются в течение первых 2 лет после операции. Более физиологично использовать в качестве трансплантата для H-образных анастомозов аутовены.
Для декомпрессии портальной системы при плановых операциях у детей наиболее часто используют проксимальные и дистальные спленоренальные анастомозы. Эти операции меньше нарушают общий печеночный кровоток.
Проксимальный спленоренальный анастомоз (рис. 11, в) особенно целесообразно использовать при одновременном наличии показаний к спленэктомии, прежде всего вследствие гиперспленизма. Для выполнения анастомоза по типу «конец в бок» селезеночная вена должна быть длиной не менее 4–6 см. Выделение такого протяженного по длине участка вены сопряжено с определенными техническими трудностями. Возможна травма поджелудочной железы и развитие панкреатита в послеоперационном периоде. Кроме этого, применение данной операции ограничено техническими возможностями.
В 1967 г. W. Warren с соавт. разработали операцию селективного шунтирования — дистальный спленоренальный анастомоз (ДСРА) (рис. 11, г).
Эта операция направлена на селективную декомпрессию селезенки, вен желудка и пищевода, при сохранении портального кровотока. Операция получила довольно широкое распространение у детей и взрослых.
Главное преимущество дистального спленоренального анастомоза — это селективная декомпрессия пищеводно-желудочного бассейна портальной системы с сохранением притока мезентериальной крови к печени. При дистальном спленоренальном анастомозе энцефалопатия развивается только в 4,5 % наблюдений, однако послеоперационная летальность может достигать 16–25 %, а рецидивы кровотечений наблюдаются в 13–18 % случаев.
Селективная декомпрессия пищеводно-желудочного бассейна портальной системы приводит к постепенному уменьшению размеров селезенки, снижению и ликвидации явлений гиперспленизма. В этом заключается еще одно из важнейших преимуществ операций селективного шунтирования.
До операции больному необходимо выполнить комплексное обследование по изучению портальной гемодинамики, включая спленопортографию и ультразвуковую допплерографию. Это позволяет определить тип коллатерального кровообращения, анатомическое состояние и размеры сосудов, выбранных для наложения соустья.
При выполнении операции ДСРА наиболее оптимальным доступом является верхняя поперечная лапаротомия. Лигируют и пересекают все мелкие ветви, идущие от поджелудочной железы к селезеночной вене. Дистальный конец селезеночной вены отсекают от верхней брыжеечной, стенку ее рассекают для увеличения диаметра анастомоза. Выполняют полную мобилизацию левой почечной вены, в верхне-передней стенке которой высекают «окно». После пережатия сосудов производят системную гепаринизацию в дозе 100 ЕД/кг. Анастомоз между дистальным концом селезеночной вены и почечной веной накладывают по типу «конец в бок». При этом используют непрерывный шов нитью ПДС-6/0 или 7/0 с фиксацией его в двух точках во избежание гофрирования. В конце операции рекомендуется лигировать левую желудочную вену.
После операции больным необходимо провести ультразвуковое допплерографическое обследование портальной гемодинамики. Контрольные исследования следует выполнять через 1 и 6 месяцев после операции. Это позволяет определить анатомическое состояние сосудов соустья и функциональную активность анастомоза в отдаленные сроки после операции.
Послеоперационный ультразвуковой контроль эффективности операции шунтирования проводится по нескольким направлениям: 1. Определяют размеры селезенки, что позволяет оценить эффективность операции и степень регрессии гиперспленизма. 2. Определяют диаметр селезеночной вены и параметры кровотока в ней в воротах селезенки, где имеется хорошая возможность визуализации данного фрагмента вены. 3. Проводят визуализацию дистальных отделов селезеночной вены у ворот левой почки с определением допплеровских характеристик кровотока в этой области. 4. Проводят визуализацию самой зоны анастомоза с определением в нем кровотока венозного характера. Визуализация зоны анастомоза достаточно сложна и технически выполнима только при использовании высокоразрешающей ультразвуковой техники. Полностью проследить зону анастомоза у детей после спленоренального шунтирования удается редко, поскольку сосуды располагаются на значительной глубине и в различных плоскостях.
Необходимо отметить, что эхографическая картина сосудистого анастомоза может меняться в зависимости от сроков после операции. В первые 7–14 суток визуализация анастомоза может быть затруднена из-за отека окружающих тканей. В более поздние сроки анастомоз достоверно определяется при допплеровском сканировании и импульсной допплерографии как зона турбулентного кровотока по ходу почечной вены.
Одним из осложнений после проведенной операции ДСРА является образование гематомы у хвоста поджелудочной железы, которая на эхограмме определяется в виде округлого образования с довольно четкими границами.
Это осложнение не требует хирургического вмешательства, а контрольные исследования показывает регрессию гематомы в течение первых 3 недель после операции.
После операций ДСРА отмечается не столь быстрое обратное развитие варикозных вен пищевода как при тотальном шунтировании. Важно то, что полученной декомпрессии варикозных вен достаточно для предотвращения пищеводно-желудочных кровотечений. Многими авторами отмечено, что последующие эндосклерозирования вен пищевода у этих больных приводят к более быстрой ликвидации варикозного их расширения. По всей видимости, это связано с достаточной декомпрессией гастроэзофагеального бассейна воротной вены.
Явления гиперспленизма у больных снижаются или полностью исчезают в зависимости от степени уменьшения или нормализации размеров селезенки после операции.
Проходимость анастомоза после операций ДСРА, по мнению разных авторов, сохраняется в 90–95 % случаев в сроки от 6 месяцев до 10 лет.
Еще одним видом селективного анастомоза является спленоренальный анастомоз «бок в бок». Выполнение последнего предпочтительно в случаях близкого расположения селезеночной и почечной вен. Этот вид шунтирования обладает рядом преимуществ: сохранение селезенки, отсутствие изгибов и «колен» анастомозируемых сосудов, возможно его наложение у детей младшей возрастной группы при небольшом диаметре селезеночной вены.
В послеоперационном периоде у этих детей отмечается четкая корреляция между скоростью обратного развития варикозных вен пищевода и степенью проходимости анастомоза.
При хорошо развитой вене надпочечника и диаметре последней 9–10 мм, возможно выполнение спленоадренального анастомоза. Эта операция технически более простая, чем ДСРА. Она заключается в лигировании проксимального участка надпочечниковой вены и анастомозировании ее культи с селезеночной веной «конец в бок». В литературе так же описана техника спленокавального анастомоза, который может быть использован в тех случаях, когда почечная вена непригодна для наложения анастомоза вследствие недостаточной длины или рассыпчатого типа строения.
Таким образом, селективные виды ПКА эффективны для профилактики кровотечений у детей с ПФПГ. После селективных видов шунтирования, в отличие от неселективных операций, в послеоперационном периоде сохраняется портальная перфузия печени мезентериальной кровью.
Для адекватной функции анастомоза при его выполнении следует соблюдать следующие принципы: 1) анастомоз диаметром 7–10 мм должен накладываться с использованием монофиламентных нитей ПДС-7/0, при этом строго соблюдаются все правила наложения сосудистого шва; 2) необходима достаточная мобилизация сосудов и правильное топическое расположение анастомоза для предотвращения образования углов или поворотов сосудов вокруг оси после его наложения; 3) в послеоперационном периоде должно поддерживаться состояние гипокоагуляция для профилактики тромбирования анастомоза; 4) антиагрегантный и антитромботический препарат (дипиридамол) назначается всем пациентам сроком на 3 месяца после операции.
Исследования показали, что сосудистые портосистемные анастомозы эффективны как метод лечения и профилактики кровотечений из ВРВП и желудка. Однако все они являются паллиативными и не решают проблему ПГ в целом. Эти операции могут быть выполнены ограниченному числу больных. По данным ряда авторов, неудачи при наложении спленоренальных анастомозов могут иметь место в 50 % случаев. Большое число неудовлетворительных результатов диктует необходимость поиска других методов.
Мезентерико-портальное шунтирование (Рекс-шунт). В 1998 г. Ville de Goyet предложил новый метод оперативного лечения ПГ у детей — МПШ (Рекс-шунт), которое предусматривает создание нового пути поступления венозной крови в печень, в обход дискредитированной воротной вены. Операция позволяет снизить риск кровотечений и в какой-то мере восстановить портальный печеночный кровоток. Она заключается в наложении шунта из аутовены между верхней брыжеечной и левой ветвью воротной вены. Данное вмешательство можно считать радикальным способом лечения ПФПГ.
Техника операции: по ходу круглой связки печени в ее паренхиме выделяют левую ветвь воротной вены. Для этого пересекают «паренхиматозный мостик» между 3-м и 4-м сегментами печени. Выделяют притоки к сегментам печени, просвет вены вскрывают. При обнаружении «идеальной» эпителиальной выстилки большого диаметра и интенсивного ретроградного кровотока планируют наложение шунта. Для этого ниже поджелудочной железы выделяют верхнюю брыжеечную вену. Далее производят забор внутренней яремной вены для аутовенозной вставки. При помощи этой вставки верхнюю брыжеечную вену анастомозируют с левой ветвью воротной вены (рис. 12).
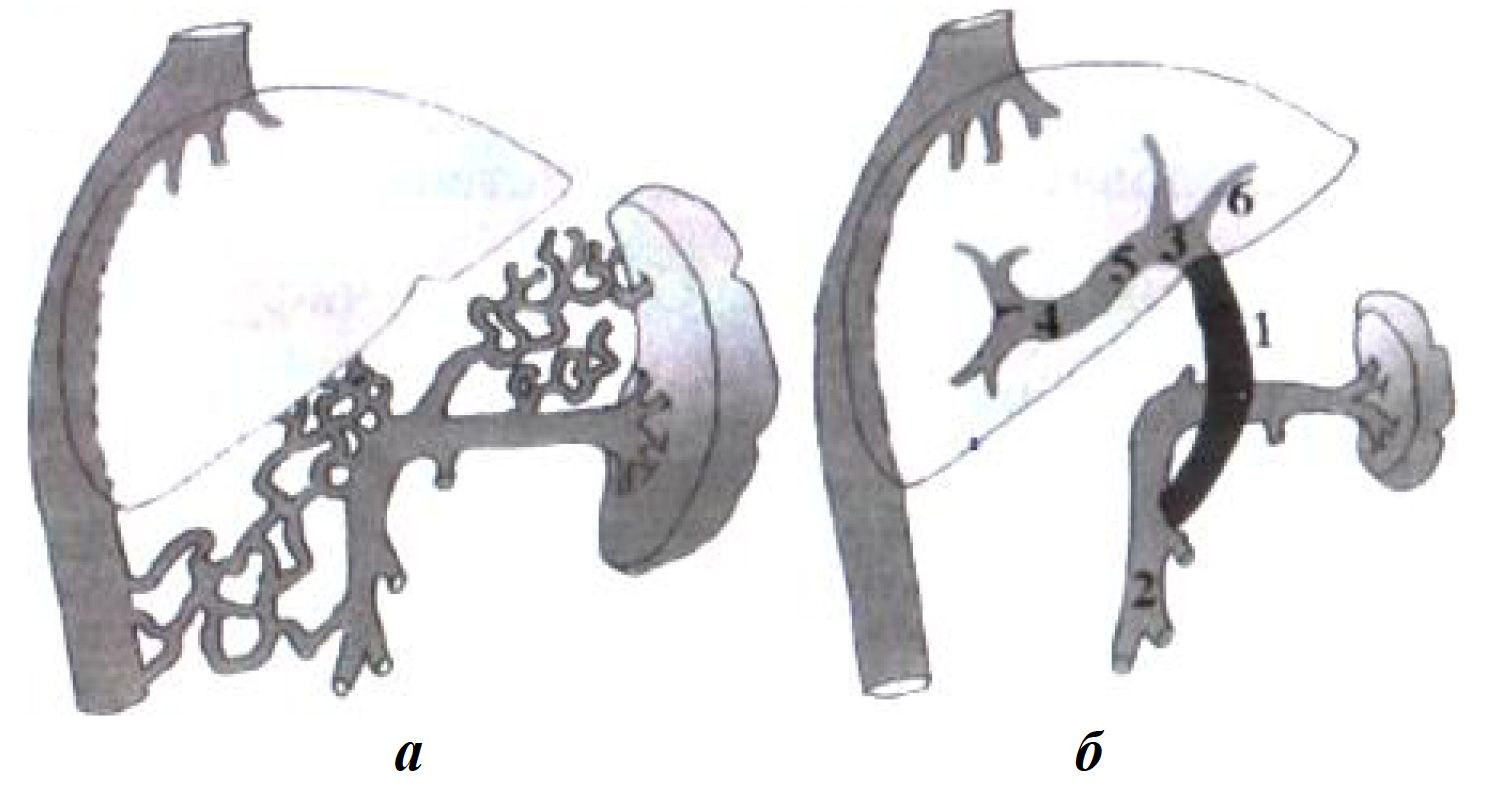
Рис. 12. Операция мезентерико-портального шунтирования (Рекс–шунт): а — подпеченочный блок; б — Рекс-шунт: 1 — внутренняя яремная вена; 2 — верхняя брыжеечная вена; 3 — венозный мостик между долями печени; 4, 5, 6 — вены печеночных сегментов
МПШ возможно только у 15–20 % больных. Примерно у 2/3 пациентов тромбоз может распространяться на брыжеечную и левую ветвь воротной вены, что делает выполнение этой операции невозможным.
Трансплантация печени
Отношение к хирургическому лечению ПГ у детей с паренхиматозным поражением печени в течение последнего десятилетия радикально изменилось с внедрением в клиническую практику трансплантации печени.
Первую трансплантацию печени у собак выполнил в 1955 г. Welch.
В 1963 г. группа исследователей под руководством Starzl осуществила успешную трансплантацию печени у человека. С тех пор число трансплантаций печени неуклонно растет. К 1994 г. в США было оперировано 3450 больных. Выживаемость в течение года после плановой трансплантации печени у больных группы низкого риска составляет 90 %, а пятилетняя выживаемость 85%. В целом, по данным UNOS Scientific Registry data (1997), трехлетняя выживаемость при трансплантации печени составляет 73,6 %, а пятилетняя — 68,8 %. Улучшение результатов связано с более тщательным отбором больных, усовершенствованием хирургической техники и методов ведения послеоперационного периода, а также с более частым выполнением повторных трансплантаций в случае отторжения. Усовершенствование методов иммунодепрессивной терапии также благоприятно отразилось на результатах операции.
Однако использование трансплантации печени как метода выбора при лечении портальной гипертензии у детей ограничивается сложностью подбора донорской печени, осложнениями иммуносупрессивной терапии, развитием оппортунистических инфекций и лимфопролиферативных заболеваний.
В качестве доноров обычно привлекаются родители или другие близкие родственники, имеющие ту же группу и резус-фактор крови, что и ребенок, и совпадение при типировании минимум по одному классу антигенов. Для трансплантации используют 2–3 сегмента печени донора с анастамозом по Ру. Операционную рану в течение нескольких дней не закрывают, что позволяет путем повторных биопсий контролировать реакцию отторжения в раннем периоде. В острой стадии отторжения используют иммуносупрессию с помощью солумедрола. Поддерживающую имуносупрессию можно проводить такролимусом, стероидами, целцептом, циклоспорином. Обязательна антибактериальная терапия.
По тяжести состояния потенциальные реципиенты разделяются на группы низкого, умеренного и высокого риска. К сожалению, по мере ожидания операции состояние больного может ухудшаться, что обусловливает его переход в группу более высокого риска. У больных, относящихся к группе низкого риска, результаты лечения гораздо лучше, а стоимость его ниже, чем у больных группы высокого риска, которым в процессе ожидания требуется интенсивная терапия.
Одной из сложных задач является определение оптимальных сроков выполнения операции. У больных, находящихся в терминальном состоянии, шансы на успех минимальны, а больным, которые могут вести относительно нормальный образ жизни в течение длительного времени, операция может быть не показана.
Если ребенок имеет прогрессирующее заболевание печени, необходимо определить причину прогрессирования процесса и функциональный резерв печени для того, чтобы решить, необходима ли трансплантация печени на данный момент, либо возможно применение паллиативных методов эндоскопического лечения и селективного ПСШ. В первую очередь трансплантация печени показана пациентам с тяжелыми осложнениями ПГ, такими как кровотечения и гиперспленизм или гепатопульмональный синдром с прогрессирующей печеночной недостаточностью. Если у ребенка нет явлений печеночной недостаточности и в ближайшие несколько лет трансплантация печени ему не понадобиться, то эндоскопические методы лечения являются терапией первой линии и позволяют снизить риск гастроэзофагеального кровотечения и дождаться донорского органа.
Профилактика пищеводных кровотечений у больных портальной гипертензией
Большое значение в профилактике кровотечений у этой группы больных имеет проведение курсов многоэтапного медикаментозного лечения, включающего антациды, Н2-блокаторы, ингибиторы протонового насоса, антигистаминные препараты, гепатопротекторы. Лечение следует обязательно проводить в осенне-весенние периоды, когда происходит обострение портальной гастропатии. Кроме этого, детям с портальной гипертензией рекомендуется госпитализация 2 раза в год, диета и ограничение физических нагрузок.
Заключение
Вряд ли найдется другая болезнь, для лечения которой было бы предложено так много различных оперативных вмешательств, как для СПГ. Данное обстоятельство свидетельствует о чрезвычайной сложности и актуальности проблемы ПГ и о неудовлетворенности хирургов результатами лечения.
Выживаемость детей с ПГ улучшилась за последние десять лет. Это является результатом нескольких факторов: прогрессом в фармакологическом контроле активных гастроэзофагеальных кровотечений, повышением эффективности и безопасности эндоскопических методов лечения ГЭК, признание роли хирургических методов лечения (ПКА) и дальнейшее развитие трансплантологии.
Дальнейшее улучшение непосредственных и отдаленных результатов хирургического лечения детей с СПГ связано с углубленным изучением портальной гемодинамики и, таким образом, совершенствованием механизма отбора пациентов к хирургическому лечению. Выбор оптимального метода лечения, определение соответствующего оперативного пособия и прогнозирование результатов хирургического лечения тесно связаны с более точной объективизацией понятий портальной гемодинамики, коллатерального кровообращения, оценке резервных возможностей печени.
Самоконтроль усвоения темы
1. Для СПГ характерны все следующие симптомы:
а) расширение вен пищевода и желудка 1-2-й степени; высокое давление в воротной вене; градиент давления между верхней полой веной и воротной веной 5 мм рт. ст.; отсутствие гепатомегалии; отсутствие гиперспленизма; отсутствие асцита;
б) расширение вен пищевода 3-4-й степени; нормальное давление в воротной вене; градиент давления между верхней полой веной и воротной веной менее 2 мм рт. ст.; наличие гепатомегалии; начальные признаки гиперспленизма; отсутствие в анамнезе кровотечений из ВРВП; асцит;
в) ВРВ подслизистого слоя пищевода; высокое давление в воротной вене; градиент давления между верхней полой веной и воротной веной 12 мм рт. ст.; умеренно выраженная гепатоспленомегалия; кровотечения из ВРВП в анамнезе; отсутствие асцита;
г) отсутствие ВРВП; сниженное давление в воротной вене; градиент давления между верхней полой веной и воротной веной 7 мм рт. ст.; начальные признаки гиперспленизма; отсутствие кровотечений из вен пищевода в анамнезе; асцит;
д) расширение вен пищевода и желудка от 1-й до 4-й степени; высокое давление в воротной вене; градиент давления между верхней полой веной и воротной веной 10-12 мм рт. ст.; гепатоспленомегалия; признаки гиперспленизма; в анамнезе кровотечения из ВРВ пищевода и желудка; наличие асцита.
2. Стадии течения СПГ:
а) начало, стабилизация, субкомпенсация, разрешение;
б) компенсация, субкомпенсация, стабилизация;
в) начало, компенсация, субкомпенсация, стабилизация, разрешение;
г) компенсация, субкомпенсация, декомпенсация;
д) компенсация, субкомпенсация, декомпенсация, разрешение.
3. В диагностическую программу СПГ входят следующие методы обследования:
а) анамнез, биохимический анализ крови, обзорная рентгенограмма органов брюшной полости и грудной клетки в двух проекциях, пункция селезенки, ирригография, цистоскопия, радиоизотопное исследование печени, ФГДС;
б) анамнез, обзорная рентгенограмма органов брюшной полости и грудной клетки в двух проекциях, пункция селезёнки, пункция печени, радиоизотопное исследование почек и печени, УЗИ органов брюшной полости, костномозговая пункция, цитологическое исследование пунктата костного мозга;
в) анамнез, общий и биохимический анализы крови, рентгенконтрастное исследование пищевода и желудка, спленопортография, пункция селезёнки, пункция печени, радиоизотопное исследование почек и печени, УЗИ органов брюшной полости, костномозговая пункция, цитологическое исследование пунктата костного мозга;
г) анамнез, общий и биохимический анализы крови, коагулограмма, ФГДС, УЗИ органов брюшной полости, рентгенконтрастное исследование пищевода и желудка, спленопортография, радиоизотопное исследование печени, пункция печени, цитологическое исследование пунктата костного мозга;
д) анамнез, общий и биохимический анализы крови, рентгенконтрастное исследование пищевода и желудка, спленопортография, пункция селезёнки, пункция печени, радиоизотопное исследование почек и печени, УЗИ органов брюшной полости, костномозговая пункция, цитологическое исследование пунктата костного мозга, ирригография, ректоскопия.
4. Виды гемодинамического блока при СПГ:
а) надпеченочный, внепеченочный, сочетанный, комбинированный;
б) сочетанный, подпеченочный, надпеченочный, комбинированный;
в) комбинированный, внутрипеченочный, сочетанный, надпеченочный;
г) надпеченочный, внутрипеченочный, подпеченочный, комбинированный;
д) сочетанный, подпеченочный, надпеченочный, комбинированный, внутрипеченочный.
5. Алгоритм мероприятий для остановки кровотечения из ЖКТ:
а) постановка зонда Блэкмора, назначение викасола, аминокапроновой кислоты, холод на живот, высокие очистительные гипертонические клизмы, биохимический и общий анализы крови, КЩС, мониторинг АД, ЧД, ЧСС;
б) мониторинг АД, ЧД, ЧСС, катетеризация кубитальной вены с постановкой катетера, постановка зонда Блэкмора, назначение викасола, аминокапроновой кислоты, холод на живот, биохимический и общий анализы крови, КЩС;
в) катетеризация югулярной и подключичных вен с постановкой катетеров, мониторинг АД, ЧД, ЧСС, постановка зонда Блэкмора, назначение викасола, аминокапроновой кислоты, холод на живот, биохимический и общий анализы крови, КЩС;
г) катетеризация югулярной и подключичных вен с постановкой катетеров, мониторинг АД, ЧД, ЧСС, назначение инфузионной и гемотрансфузионной терапии (свежезамороженная плазма, отмытые эритроциты), назначение октреотида, викасола, контрикала, антибиотиков, холод на живот, зонд в желудок;
д) катетеризация югулярной и подключичных вен с постановкой катетеров, мониторинг АД, ЧД, ЧСС, общий и биохимический анализы крови, КЩС, зонд в желудок с введением ледяной аминокапроновой кислоты, холод на живот, назначение инфузионной и гемотрансфузионной терапии (свежезамороженная плазма, отмытые эритроциты), титрование октреотида в возрастной дозировке, назначение викасола, контрикала, антибиотиков, оральное и внутривенное назначение антацидов, блокаторов Н2-рецепторов гистамина, ингибиторов протонового насоса, высокие очистительные гипертонические клизмы, постановка зонда Блэкмора;
е) катетеризация югулярной и подключичных вен с постановкой катетеров, мониторинг АД, ЧД, ЧСС, назначение инфузионной и гемотрансфузионной терапии (свежезамороженная плазма, отмытые эритроциты), назначение октреотида, викасола, контрикала, антибиотиков, холод на живот, зонд в желудок, постановка зонда Блэкмора, биохимический и общий анализы крови.
6. Правила и особенности постановки зонда Блэкмора у детей с СПГ при кровотечении из ВРВ пищевода и желудка:
а) ввести зонд через ротоглотку, седатировать ребенка, создать давление в пищеводном баллоне до 60-70 мм рт. ст., а в желудочном баллоне — 30-40 мм рт. ст., подтянуть зонд кверху, фиксировать к носогубному треугольнику пластырем, время первой экспозиции зонда — 6 ч;
б) ввести зонд через ротоглотку, седатировать ребенка, создать давление в пищеводном баллоне 20-30 мм рт. ст., а в желудочном баллоне — 30-40 мм рт. ст., подтянуть зонд кверху, фиксировать к носогубному треугольнику пластырем, время первой экспозиции зонда — 12 ч;
в) ввести зонд через носоглотку, седатировать ребенка, создать давление в пищеводном баллоне 20-30 мм рт. ст., а в желудочном баллоне — 30-40 мм рт. ст., подтянуть зонд кверху, не фиксировать зонд к носогубному треугольнику пластырем, время первой экспозиции зонда — 1 ч;
г) седатировать ребенка, ввести зонд через носоглотку, создать давление в желудочном баллоне 40-60 мм рт. ст., подтянуть зонд ко входу в пищевод и удерживать в натянутом состоянии , натяжение при необходимости поддерживать при помощи груза массой до 100 г, в пищеводном баллоне создать давление до 40 мм рт. ст., время постоянной экспозиции — 8 ч.
7. Медикаментозные препараты, используемые для остановки кровотечения из ВРВ пищевода и желудка у детей с СПГ:
а) октреотид, сандостатин, соматостатин, терлипрессин;
б) викасол, хлористый кальций, контрикал, тиссукол;
в) добутамин, верошпирон, папаверин, оксибутират натрия;
д) анальгин, папаверин, дибазол, берлиприл.
8. Хирургические методики, используемые для лечения СПГ у детей:
а) резекция кардиального отдела желудка, наддиафрагмальное реанастомозирование пищевода, пилоромиотомия, деваскуляризация желудка;
б) спленэктомия, портокавальное шунтирование, резекция доли печени;
в) спленоренальный анастомоз, мезентерико-портальный анастомоз (рекс-шунтирование), транссекция пищевода.
9. Профилактика кровотечений и диспансерное наблюдение за детьми с СПГ:
а) переливание крови и свжезамороженной плазмы, назначение антацидов, диета, назначение дибазола, папаверина, Н2-блокаторов; госпитализация 1 раз в год для обследования;
б) госпитализация 2 раза в год, переливание крови и свежезамороженной плазмы, назначение антацидов, диета, назначение дибазола, папаверина, Н2-блокаторов;
в) госпитализация 2 раза в год, диета, ограничение физических нагрузок, в осенне-весенний период назначение антацидов, блокаторов Н2-рецепторов, ингибиторов протонового насоса.
Ответы: 1 — д; 2 — г; 3 — г; 4 — г; 5 — г; 6 — г; 7 — а; 8 — в; 9 — в.
Книга "Детская ультразвуковая диагностика. Учебник. т.1. Гастроэнтерология" - Пыков М. И.

Коллектив кафедры лучевой диагностики детского возраста ГБОУ ДПО РМАПО Минздрава России подготовил учебник "Детская ультразвуковая диагностика". В работе принимали участие основные сотрудники кафедры, а также авторы из Москвы, Хабаровска, Твери, Перми.
Учебник "Детская ультразвуковая диагностика" будет состоять из нескольких томов (минимум пять).
В нем авторы постарались изложить наиболее проверенные временем и новые данные ультразвуковой диагностики в гастроэнтерологии, эндокринологии, ортопедии, уронефрологии, эхокардиографии, нейросонографии, в исследовании спинного мозга новорожденных, а также новый материал по патологии селезенки, вилочковой железы, легочной патологии у новорожденных. Первый том учебника посвящен детской гастроэнтерологии. Подробно рассматриваются возможности эхографии, допплеровских технологий в оценке печени, желчного пузыря, желчных протоков, поджелудочной железы, желудка с брюшным сегментом пищевода, толстой кишки, а также при остром абдоминальном синдроме. Отдельный раздел 1-й главы посвящен трансплантации печени у детей, "нормальному" развитию трансплантата, возможным осложнениям.
Представлено большое количество эхограмм, таблиц, рентгенограмм, рисунков. Издание предназначено для врачей отделений ультразвуковой диагностики, педиатров, неонатологов, детских хирургов.
Купить книгу "Детская ультразвуковая диагностика. Учебник. т.1. Гастроэнтерология" - Пыков М. И.
Книга "Детская ультразвуковая диагностика. Учебник. т.2. Уронефрология" - Пыков М. И.

Книга посвящена одному из самых сложных разделов педиатрии и детской хирургии - диагностике патологии мочевыделительной системы у детей. Бурное развитие ультразвуковой диагностической техники, огромный опыт, который накопили сотрудники нашей кафедры, работая в тесном контакте с нефрологами и урологами ведущих детских клиник Москвы, позволил во многом по-новому взглянуть на большинство проблем.
В учебнике "Детская ультразвуковая диагностика" подробно рассматриваются все существующие методики ультразвукового исследования мочевыделительной системы у детей.
На основании тщательного изучения эмбриогенеза, развития почек, мочевого пузыря, мочеточников разработаны высокоинформативные эхографические и допплерографические критерии при врожденных пороках системы, воспалительных изменениях, обструктивных уропатиях, почечной недостаточности (со всеми вытекающими из этого проблемами) и других патологических состояниях.
Учебник предназначен для врачей ультразвуковой диагностики, всех специалистов лучевой диагностики, педиатров, детских хирургов, урологов, неонатологов.
Купить книгу "Детская ультразвуковая диагностика. Учебник. т.2. Уронефрология" - Пыков М. И.
Книга "Детская ультразвуковая диагностика: Учебник. Том 3. Неврология. Сосуды головы и шеи" - Пыков М. И.

Третий том учебника посвящен одной из самых востребованных тем в детской ультразвуковой диагностике - исследованию центральной нервной системы.
В настоящее время невозможно себе представить грамотное ведение ребенка в раннем возрасте без скрининговой нейросонографии, а при неврологической патологии нейросонография используется как основной метод лучевой диагностики.
В учебнике "Детская ультразвуковая диагностика" подробно представлены различные методики ультразвуковой нейровизуализации, нормальная эхоанатомия, эхографические признаки практически всех патологических изменений центральной нервной системы, которые могут встретиться у маленького пациента.
Впервые освещаются вопросы оценки сосудов головы и шеи у детей различных возрастных групп.
Учебник предназначен для врачей ультразвуковой диагностики, неонатологов, детских неврологов, нейрохирургов, педиатров.
Книга "Детская ультразвуковая диагностика: Учебник. Том 4. Гинекология" - Пыков М. И.

Четвертый том учебника по ультразвуковой диагностике в педиатрии посвящен детской гинекологии. В данной книге приводятся совершенно новые статистические данные по размерам внутренних половых органов у девочек различных возрастных групп. В ином аспекте представлены острые заболевания живота и малого таза с возможностью определенной дифференциальной диагностики.
Учитывая, что в нашей стране декретируемый детский возраст был сдвинут до 18 лет, по многочисленным просьбам врачей детских лечебных учреждений приводится новая глава по ультразвуковой диагностике при беременности. Для педиатров это во многом совершенно новый материал. Мы повторно использовали большой пласт иллюстративного материала, однако в представляемом учебнике впервые в большом количестве публикуются уникальные эхограммы по врожденной патологии, острым заболеваниям, вариантам развития внутренних половых органов.
Учебник "Детская ультразвуковая диагностика" предназначен для врачей ультразвуковой диагностики, педиатров, детских хирургов, эндокринологов.
Купить книгу "Детская ультразвуковая диагностика: Учебник. Том 4. Гинекология" - Пыков М. И.
Книга "Детская ультразвуковая диагностика. Учебник том 5. Андрология, эндокринология, частные вопросы" - Пыков М. И.

В 5 томе освещаются вопросы ультразвуковой диагностики в детской эндокринологии. Отдельные главы посвящены возрастным нормативам в ультразвуковом аспекте, патологическим изменениям щитовидной железы, надпочечников. Большой раздел посвящен детской андрологии. Кроме возрастных изменений гонад, предстательной железы, пахового канала освещаются вопросы эхографии при самой различной патологии мошонки. Впервые приводится обобщенный материал по возможностям ультразвуковой диагностики при нарушениях формирования пола у детей.
Кроме того, в этом томе представлены разнообразные частные вопросы ультразвуковой диагностики в педиатрии, которые не вошли в предыдущие тома. Речь идет о возможности эхографии в исследовании селезенки, слюнных желез, тазобедренных суставов у детей, при остеомиелитах, аденоматозе и секвестрации легких у новорожденных.
Учебник предназначен не только для специалистов ультразвуковой диагностики, но и для детских хирургов, педиатров, неонатологов, эндокринологов, ортопедов.
Книга "Измерения в детской ультразвуковой диагностике: Справочник" - Пыков М. И.

Предлагаемый справочник является приложением к пятитомному учебнику по детской ультразвуковой диагностике. В нем собраны практически все методики исследования внутренних органов ребенка с большим иллюстративным материалом, таблицами, схемами. Для удобства пользования представленный материал по своему строению напоминает основной учебник, где в том же порядке располагаются данные по гастроэнтерологии, уронефрологии, центральной нервной системе, детской гинекологии, эндокринологии и некоторым частным вопросам.
В справочнике в основном приводятся нормативные показатели измерения тех или иных структур.
Для лучшего понимания материала иногда приводятся примеры патологических изменений. Впервые приводятся данные по некоторым вопросам, которые не затрагивались в учебнике, - вилочковая железа, крупные сосуды живота, неотложная медицина.
Справочник "Измерения в детской ультразвуковой диагностике" предназначен для широкого круга специалистов ультразвуковой диагностики, педиатров, неонатологов, детских хирургов, эндокринологов, неврологов и др.
Данный справочник является приложением к пятитомному учебнику «Детская ультразвуковая диагностика». Для удобства работы в отдельную книгу выделены все методики ультразвукового исследования в педиатрии и нормативные показатели для каждого органа, допплеровские показатели магистральных и интрапаренхиматозных сосудов с учетом анатомо-физиологических особенностей детского возраста. Естественно, чтобы не повторять учебник, исключены почти все данные измерений при различной патологии.
В справочник включен материал, которого не было в учебнике, - данные о вариантах гемодинамических показателей в крупных сосудах живота, о характеристике вилочковой железы, ультразвуковой диагностике в ургентных ситуациях.
Учитывая большой интерес специалистов к этим разделам эхографии, мы поместили нормативы допплеровских показателей, относящихся к сосудам брюшной полости, параметры вилочковой железы у детей с периода новорожденности до трех лет.
Купить книгу "Измерения в детской ультразвуковой диагностике: Справочник" - Пыков М. И.
































0 комментариев