Ревматизм. Long-COVID инфекции. Часть 6. Лекция для врачей
Методические рекомендации. «Особенности течения LONG-COVID инфекции. Терапевтические и реабилитационные мероприятия». Часть 6. "Ревматизм. Long-COVID инфекции"
Лонг-ковид: что такое лонг-ковид и как с ним бороться? Часть 1
Поражение дыхательной системы при LONG-COVID инфекции. Часть 2
Поражение сердечно-сосудистой системы при Long-COVID инфекции. Часть 3
Поражение эндокринной системы при Long-COVID инфекции. Часть 4
Поражение почек при Long-COVID. Часть 5
Неврологические заболевания. Long-COVID инфекции. Часть 7
Психиатрия. Long-COVID инфекции. Часть 8
Детский мультисистемный воспалительный синдром, ассоциированный с COVID-19. Часть 9
Мультисистемный воспалительный синдром у взрослых, ассоциированный с COVID-19. Часть 10
Медицинская реабилитация при Long-COVID инфекции Часть 11
Ревматизм. Long-COVID инфекции
В настоящее время не вызывает сомнения тот факт, что COVID-19 и иммуновоспалительные ревматические заболевания (ИВРЗ) имеют определенную общность, обусловленную системностью поражения различных органов и систем. Инфекция SARS-CoV-2 потенциально может вызывать запуск системного иммуновоспалительного процесса и локальных иммунологических нарушений у пациентов, имеющих генетические предпосылки в формировании процессов аутореактивности. При этом "тромбовоспаление" рассматривается в качестве универсального механизма как для COVID-19 (так называемая СOVID-19;ассоциированная коагулопатия), так и для ИВРЗ, который связан с гиперпродукцией провоспалительных цитокинов и образованием нейтрофильных внеклеточных ловушек (neutrophil extracellular traps – NETs), индуцирующих активацию/повреждение эндотелиальных клеток, тромбоцитов (тромбопатия), а также активацией системы комплемента и др. Предполагается, что одним из механизмов, инициирующих активацию воспалительного процесса, является молекулярная мимикрия. Установлено, что коронавирусы имеют общие молекулярные эпитопы с белками человека (например, гликопротеин S), которые играют ключевую роль в инвазии клеток хозяина.
Имитирующие эпитопы также могут присутствовать в синовиальной мембране и вызывать локальное воспаление.
SARS-CoV-2 ведет не только к развитию острых интерстициальных поражений легких, васкулопатий с вовлечением в патологический процесс сердечно-сосудистой системы, ЦНС, желудочно-кишечного тракта, почек и др., но и сохранению/формированию различных патологических состояний после выздоровления от этого инфекционного заболевания. В перечень постковидных синдромов входят артралгии, артриты, миалгии, васкулиты с поражением сосудов различного калибра, системная красная волчанка, антифосфолипидный синдром, болезнь Кавасаки, а также целый ряд иммунологических маркеров (антифосфолипидные антитела, антинуклеарные факторы и др.), которые характерны для широкого круга ревматических заболеваний.
Одним их вариантов клинических проявлений лонг-ковида является формирование суставного синдрома, который может быть связан с развитием поствирусного артрита (ПВА), характеризующегося полной обратной динамикой его развития на фоне элиминации вируса. Однако следует отметить, что суставной синдром, разившийся после перенесенного COVID-19, может являться дебютом системных аутоиммунных заболеваний (ревматоидный артрит, спондилоартриты, системная красная волчанка, болезнь Шегрена, системные васкулиты, воспалительные миопатии и др.), что требует расширения дифференциально-диагностического поиска и динамического наблюдения за этой группой пациентов.
В рамках постковидного суставного синдрома следует учитывать возможность формирования асептического некроза головок крупных суставов(коленные, тазобедренные), развившегося на фоне вирусной инфекции и применения глюкокортикостероидов (ГКС) для ее терапии.
Перенесенный COVID-19 может стать причиной развития или обострения фибромиалгии и синдрома хронической усталости (доброкачественный миалгический энцефаломиелит) – патологии, связанной с дисфункцией ноцицептивной и вегетативной нервной системы, для которой характерно наличие выраженной утомляемости, психоэмоциональных нарушений и хронической боли.
Формированию хронической боли в рамках постковидного синдрома могут способствовать депрессия, тревожность и психоэмоциональный стресс.
Скелетно-мышечные проявления лонг-ковида
Миалгии и артралгии относятся к числу характерных проявлений вирусной инфекции. Эти симптомы возникают у 50–90% больных в остром периоде COVID- 19 и имеют прямые взаимосвязи с тяжестью течения заболевания и наличием стойкой фебрильной лихорадки. В настоящее время отсутствует точная статистика частоты развития постковидного скелетно-мышечного синдрома у лиц ранее не имевших каких-либо ревматических заболеваний. Отмечается существенный «разброс» данных в зависимости от популяции и тяжести перенесенного COVID-19. В среднем через 6 месяцев наблюдения боли в суставах фиксируются у 9%, а миалгии – у 5–43% реконвалесцентов. У пациентов с легким течением COVID-19 в острой фазе отмечается более высокая частота и спектр «постковидных» симптомов, в том числе болей в суставах, по сравнению с тяжелым его течением.
Особенности течения скелетно-мышечных проявлений лонг-ковида представлены в наблюдательном проспективном одноцентровом исследовании. В изучаемую группу были включены 121 пациент с недифференцированным артритом (НДА) (воспалительный артрит, который не соответствовал критериям ни одного иммуновоспалительного заболевания суставов) и 324 пациента с ИВРЗ, перенесших новую коронавирусную инфекцию с марта 2020 по май 2021г. разной степени тяжести: бессимптомное - (15,1%), легкое течение - (41,9%), средней тяжести-(39,5%), тяжелое-(3,39 %). В 43,5% случаев пациенты были госпитализированы в стационар инфекционного профиля для лечения НКИ в связи с тяжестью состояния. Средний возраст пациентов составил 57,3 ± 13,5 лет, из них женщин -76,8%, мужчин-23,2%. Положительный мазок из рото/носоглотки на ПЦР SARS-COV2 выявлялся у 88,8% пациентов.
Среди пациентов с НДА у 80,0% отмечалась средняя степень тяжести течения COVID-19. Продолжительность периода от перенесенного COVID-19 до манифестации суставного синдрома составила от 1 до 6 мес. Были выявлены следующие клинические проявления суставного синдрома: артралгии, артриты синовиты, моноартрит и полиартрит. Наиболее часто поражались коленный, голеностопный и лучезапястный суставы. Все случаи полиартрита включали в себя вовлечение в патологический процесс мелких суставов кистей и стоп.
Развитие поствирусного артрита (ПВА) отмечено у 22,6% пациентов с быстрой обратной динамикой суставного синдрома на фоне применения НПВП (фото 1-4).
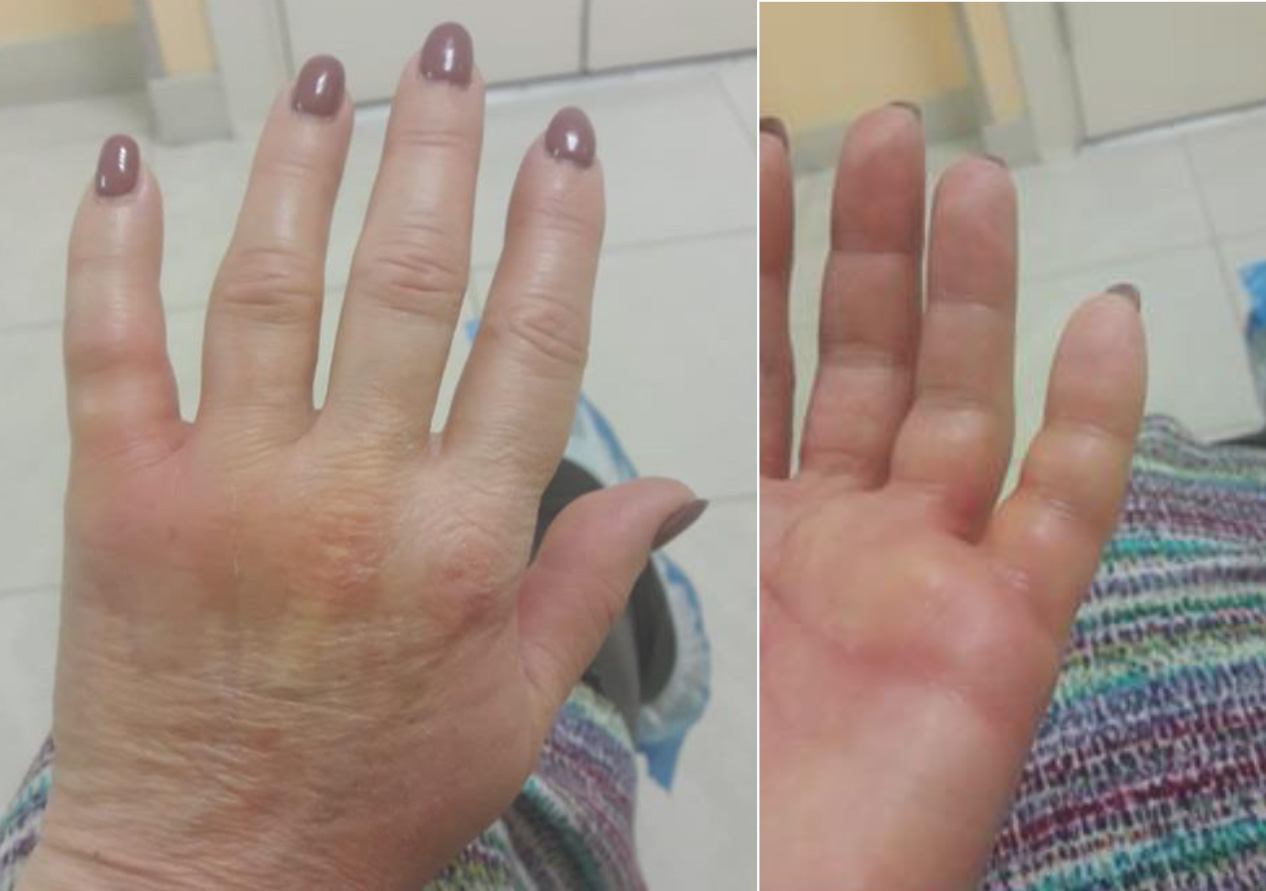
Фото 1. Артрит мелких суставов левой кисти (3,4 ПФС; 3,4 ПМФС). Вовлечение окружающих мягких тканей (из архива Трофимова Е.А.).
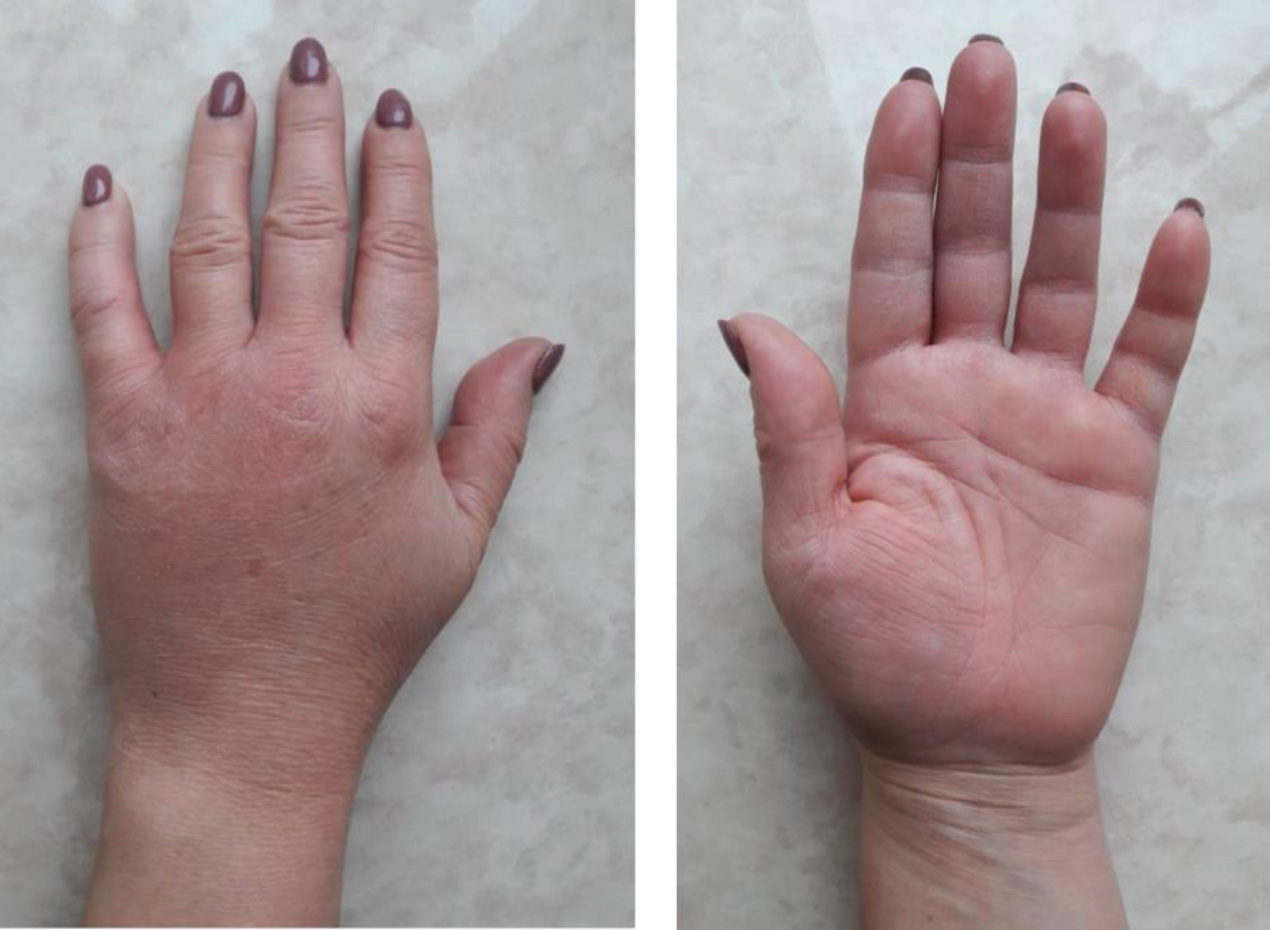
Фото 2. Уменьшение отека, гиперемии на фоне терапии НПВП. (из архива Трофимова Е.А.)

Фото 3. Полный регресс всех проявлений суставного синдрома на фоне приема НПВП в течение 14 дней (из архива Трофимова Е.А.).
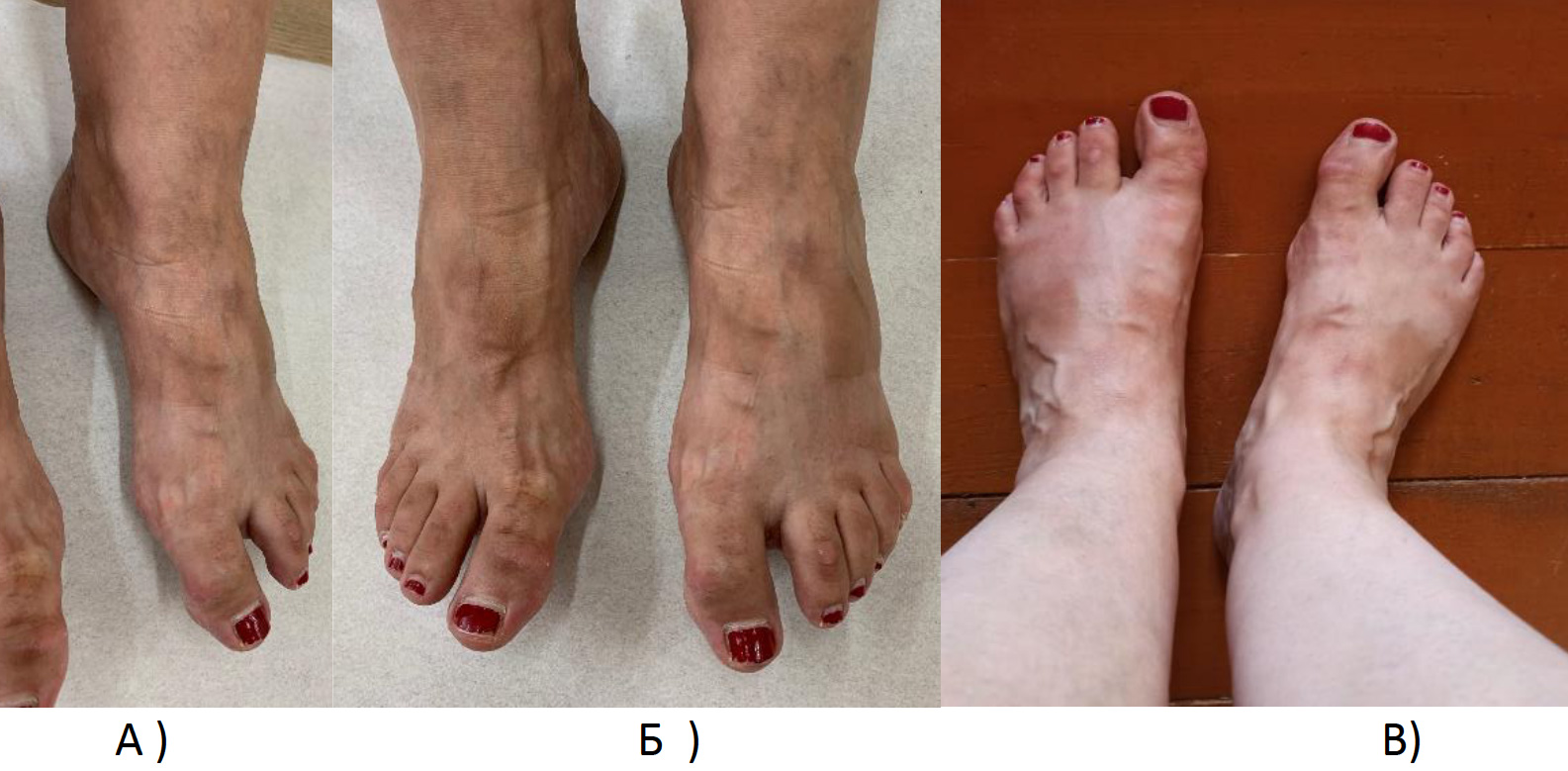
Фото 4. Поствирусный артрит с развитием припухлости ГСС, суставов стоп (А, Б – исходно, В – через 10 дней на фоне терапии НПВП) (из архива Трофимова Е.А.).
Поствирусный артрит (ПВА) выявлялся на фоне COVID-19 или в ближайшее время после перенесенной вирусной инфекции (1-4 недели). Данный вариант артрита характеризовался моно/олигоартритом коленных, голеностопных, ПМФС и ДМФС, а также припухлостью периартикулярных мягких тканей, отсутствием деструктивных изменений в суставах и хорошим клиническим ответом на лечение нестероидными противовоспалительными препаратами или ГКС.
Следует отметить, что ПВА, в большинстве случаев остается диагнозом исключения. Дифференциальная диагностика проводится с септическими, микрокристаллическими артритами, реактивными артритами, дебютом иммуновоспалительных ревматических заболеваний (ревматоидный артрит, аксиальные спондилиты, ДБСТ). Подтверждением этиологической роли SARS-CoV-2 является отсутствие признаков других ревматических заболеваний, включая повышение уровня мочевой кислоты, РФ, АЦЦП, АНФ, наличие HLA B-27.
Среди пациентов с недифферецированным артритом (НДА) определенный диагноз ревматического заболевания был верифицирован в 49% случаев в течение 3-6 месяцев. В этой группе обследованных чаще выявлялся ранний ревматоидный артрит (РРА). Формирование РРА из НДА включало симметричный артрит, быстрое увеличение числа болезненных и припухших суставов, преимущественно коленных, лучезапястных, проксимальных межфаланговых суставов кистей и плюснефаланговых суставах стоп, серопозитивность по ревматоидному фактору (РФ) и антителам к циклическому цитруллинированному пептиду (АЦЦП), При УЗИ суставов выявлялись теносиновиты и костно-хрящевые эрозии.
Наряду с этим через 3-6 месяцев после перенесенного COVID-19 у пациентов с НДА были диагностированы аксиальный спондилоартрит, болезнь Шегрена, псориатический артрит, полиостеоартрит, системная красная волчанка (СКВ), лейкоцитокластический васкулит (фото 5), геморрагический васкулит (фото 6), очаговая склеродермия (фото 7) аутоиммунное неуточненное заболевание (АИЗ), артралгии. У 51% больных диагноз НДА был сохранен.
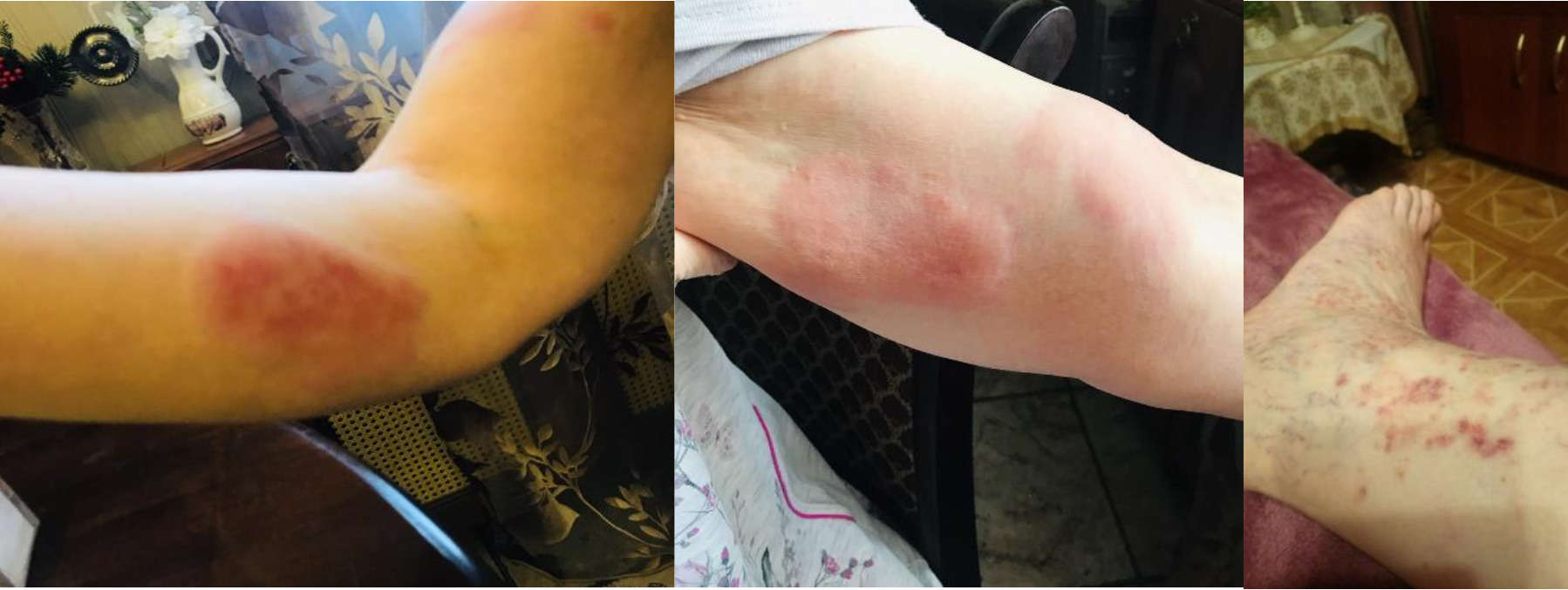
Фото 5. Пациентка К.64 г. Постковидный синдром. Дебют лейкоцитокластического васкулита через 6 недель после COVID-19. Пурпура багрово-красного цвета различного диаметра, возвышающаяся над поверхностью кожных покровов с локализацией на верхних конечностях без зуда. На коже голеней и стоп-мелкоточечные петехии красного цвета до 1-3 мм (собственное наблюдение).
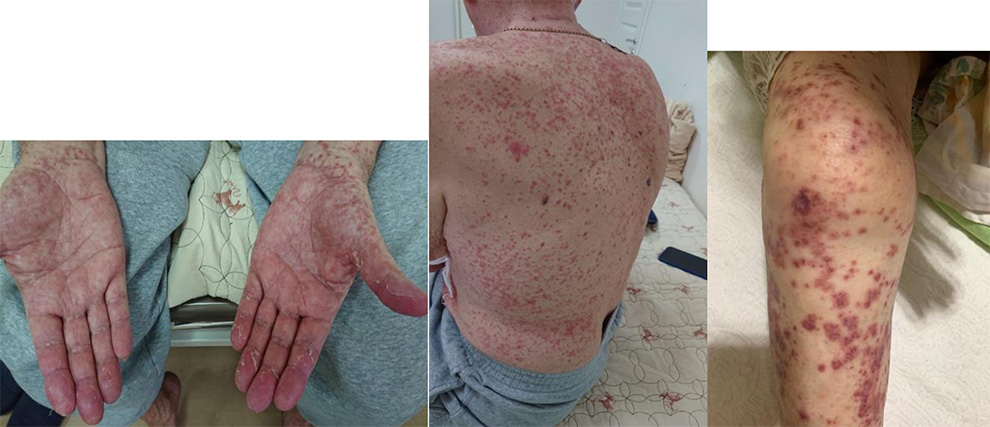
Фото 6. Пациент М., 72 г. Постковидный синдром. Дебют геморрагического васкулита через 4 недели после COVID-19 Мелкоточечная геморрагическая сыпь (2-3 мм в диаметре) симметричная, расположенная на ладонных поверхностях, коже спины, голеней и стоп, склонная к слиянию без зуда (собственное наблюдение).
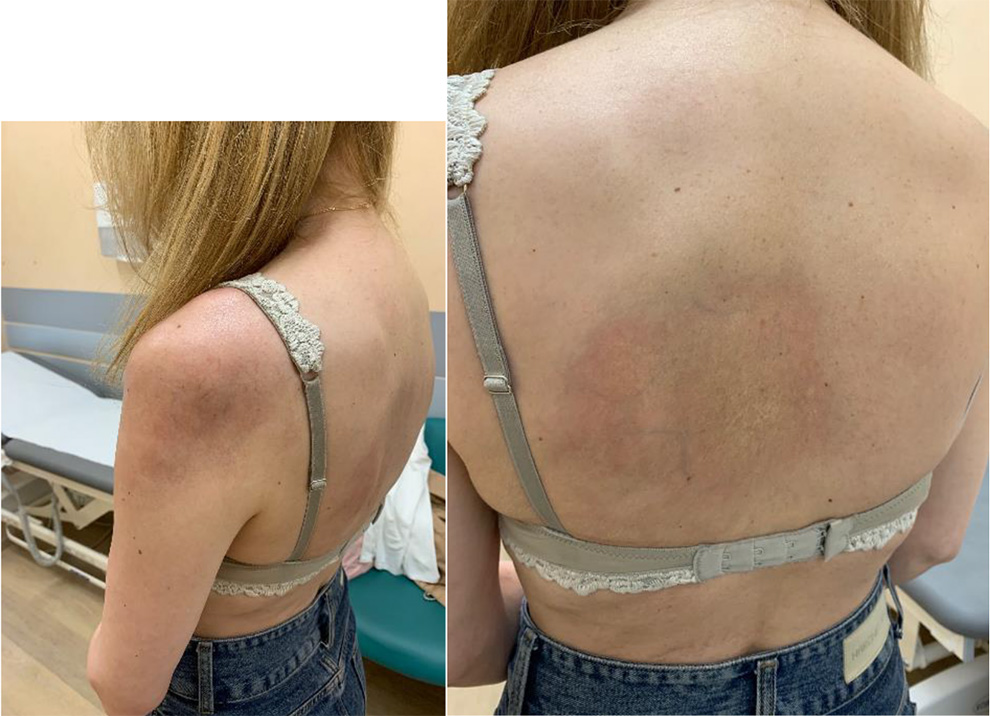
Фото 7. Больная З. 24 года. Дебют очаговой формы склеродеромии через 3 месяца после перенесенной НКИ. Очаги ограниченной гиперпигментации на коже левого плечевого сустава и в области левой лопатки (из архива Трофимова Е.А.).
Следует отметить, что недифферецированный артрит может трансформироваться в остеоартрит (ОА). На начальных этапах развития он характеризуется формированием асимметричного синовита чаще коленных суставов, болью при приседании на корточки и при спуске/подъеме по лестнице, а также непродолжительной (10-15 минут) скованностью.
Инструментальными методами диагностики раннего ОА следует считать наличие синовита, выявляемого с помощью УЗИ, наличием незначительного сужения суставной щели по данным рентгенографии КС и отсутствием остеофитоза, который является характерным рентгенологическим признаком развернутой стадии этого заболевания. Дифференциальная диагностика проводится с микрокристаллическими артритами, реактивными артритами, ревматоидным артритом, спондилоартритами. Лабораторным подтверждением диагноза раннего ОА является отсутствие признаков лабораторной активности, включая повышение уровня СОЭ и СРБ, мочевой кислоты, РФ, АЦЦП, АНФ и HLA B-27.
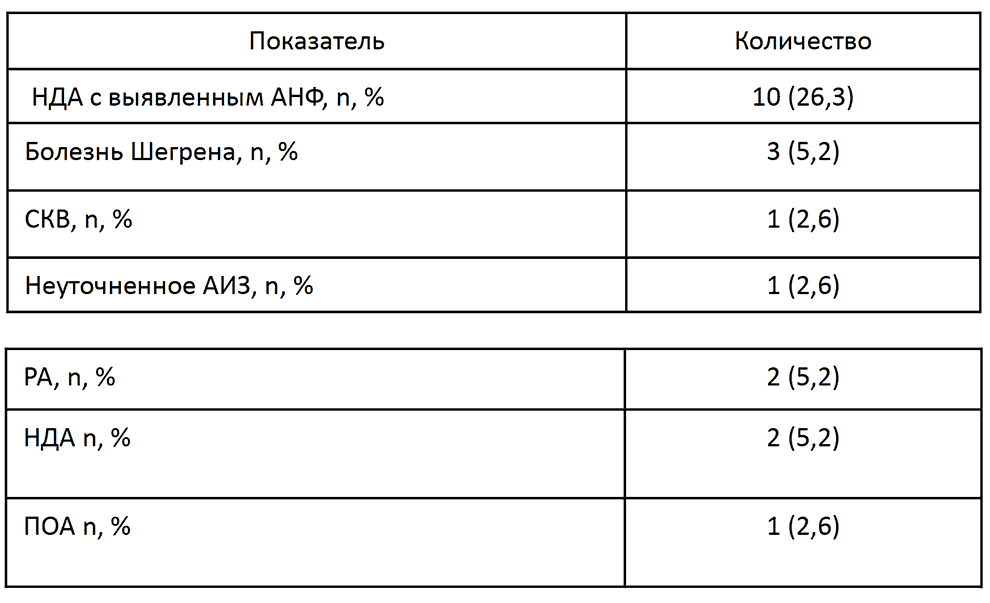
У 10 пациентов с НДА обращали на себя внимание диагностические значения АНФ (от 1:320 до 1:2560). Наибольшие значения АНФ наблюдались при последующей верификации критериальных диагнозов: болезнь Шегрена (1:1280 ), СКВ (1: 2560), АИЗ неуточненного (1:640) и РА (1:640 и 1:1280). При НДА и ПОА(полиостеоартрите) значения АНФ были ниже и составляли соответственно 1:320 и 1:640. Верификация критериальных диагнозов у пациентов с НДА и позитивным АНФ, развившимся после COVID-19 представлена в таблице 1.
Верификация критериальных диагнозов у пациентов с НДА и позитивным АНФ, развившимся после COVID-19 (n /%)
Определение диагностических значений АНФ (≥1:160 на клеточной линии Hep 2) у пациентов с НДА, перенесших COVID-19, требует проведения клинико-иммунологического обследования для исключения/подтверждения диагноза иммуновоспалительного ревматического заболевания (ИВРЗ). Однако следует учитывать, что позитивность по АНФ и антителам к ДНК может наблюдаться в рамках иммуноопосредовательного ответа на вирусную инфекцию у лиц без ИВРЗ и требует наблюдения в динамике.
Диагноз НДА может быть сохранен у пациентов с персистирующим суставным синдромом, но при отсутствии критериальных проявлений какого-либо ревматического заболевания и требует динамического наблюдения. Схема эволюции суставного синдрома после COVID-19 представлена на рис.1.
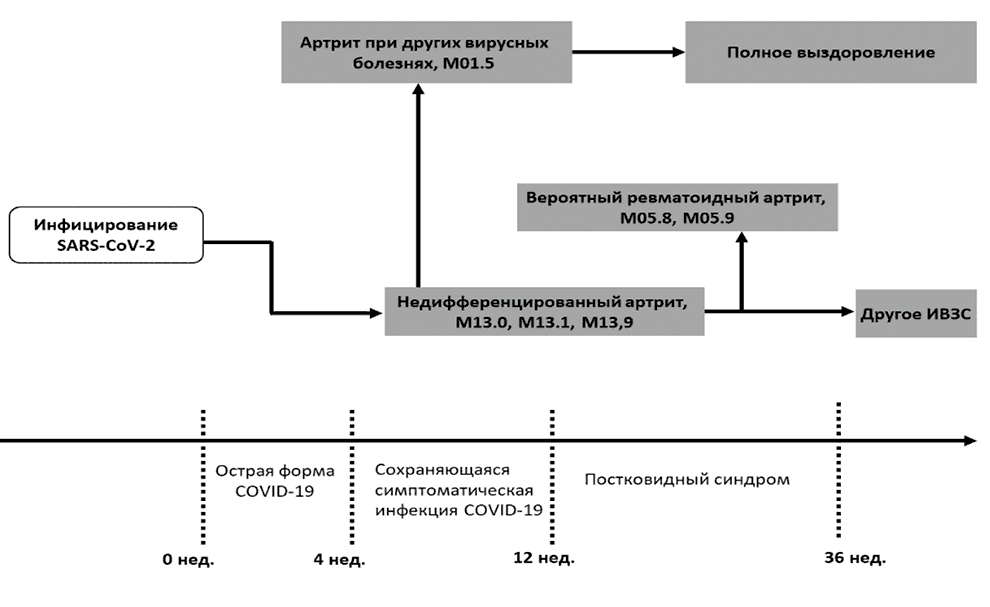
Рис. 1. Схема эволюции суставного синдрома после COVID-19.
Клинические проявления лонг-ковида у пациентов с ИВРЗ
В постковидном периоде (4-12 недель) у подавляющего числа пациентов с ИВРЗ отмечается существенное возрастание клинической и иммунологической активности болезни, требующее коррекции противоревматической терапии и динамического наблюдения.
При обследовании 230 пациентов с воспалительными заболеваниями суставов, позвоночника и СЗСТ постковидный синдром в виде слабости, одышки, артралгий, миалгии, похудания, снижения памяти, депрессии был выявлен в 25,9% случаев. В ранние сроки (от 4 до 8 недель) после перенесенной НКИ наблюдалось обострение основного заболевания, что в большинстве случаев (72%) потребовало госпитализации в стационар ревматического профиля для интенсификации терапии.
Обострение суставного синдрома отмечено у 83,4% пациентов с ревматоидным артритом (РА), перенесших COVID-19. Так, у 38,3% пациентов, на момент госпитализации или амбулаторного приема отмечалась высокая степень активности заболевания (DAS28 ≥ 5,1). Средняя степень активности РА (DAS28 ≥ 3,2) отмечена у 41,9% пациентов, а низкая активность выявлялась существенно реже- у 19,6% пациентов. В среднем через 3 ± 1,2 месяца после COVID-19 зафиксировано нарастание лабораторной активности РА: увеличение средних значений СРБ относительно исходных (с 26,08±0,92 до 31,28±6,34 мг/л) и РФ (с 29,5±10,12 до 50,1±11,64 ед/мл). У пациентов с СЗСТ в постковидном периоде отмечалось прогрессирование показателей клинической активности и существенное повышение уровня АНФ у пациентов с болезнью Шегрена (мах до 1:163840), СКВ (мах 1:40960) и ССД (мах до 1:5280).
Пациенты с интерстициальным поражением легких в рамках СЗСТ(ИПЛ), перенесших НКИ, имеют высокий риск осложненного течения лонг-ковида (прогрессирующий легочный фиброз, дыхательная недостаточность) и требуют динамического наблюдения и интенсификации лечения.
Отмечается сходство клинических признаков ИПЛ (кашель, одышка, крепитация) и КТ – признаков со стороны легких (матовое стекло, ретикуляци, тракционные БРЭ) у пациентов с СЗСТ и НКИ (таблица 2, рентгенограммы 1-2).
Общими признаками являются: сухой кашель, одышка на вдохе, крепитация при аускультации, КТ – признаки: двусторннее полисегментарное поражение интерстиция и сосудов легких (таблица 3).
Таблица 2. Наиболее частые варианты поражения легких при системных заболеваниях соединительной ткани.
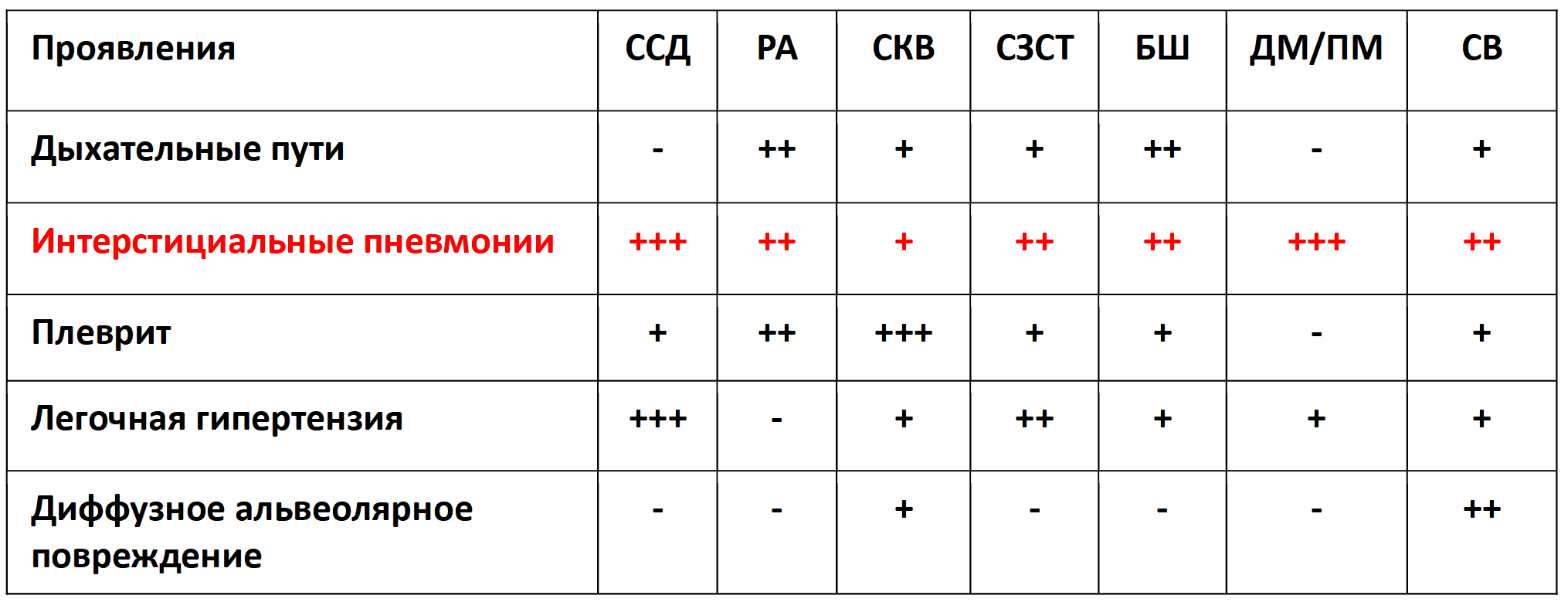
Примечание: ССД-системная склеродермия, РА-ревматоидный артрит, СКВ-системная красная волчанка, СЗСТ-смешанное заболевание соединительной ткани, БШ-болезнь Шегрена, ДМ-дерматомиозит, ПМ-полимиозит, СВ-системные васкулиты.
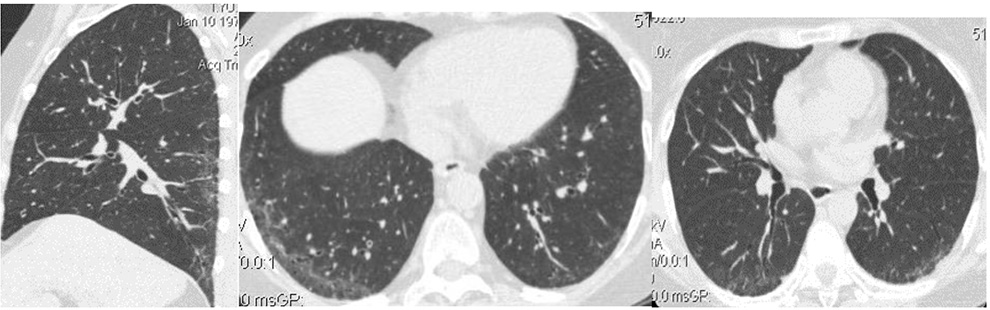
Рентгенограмма 1. МСКТ ОГК пациентки Р. 63 г. с системной склеродермией. от 09.07.2020 г. Картина двусторонних интерстициальных изменений, по типу «матового стекла» с тракционными бронхоэктазами в нижних долях обоих легких, больше справа.
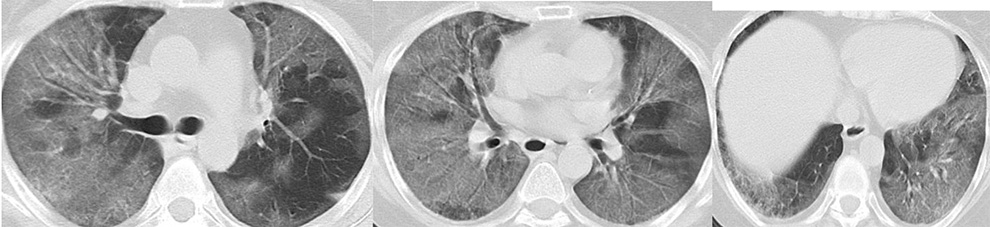
Рентгенограмма 2. КТ ОГК от 15.12. 2020 г. пациентки Р. на фоне НКИ. Диффузное уплотнение легочной ткани по типу «матового стекла», очаги консолидации, ретикуляции. Поражение более 75% легочной ткани. КТ4.
Таблица 3. Основные дифференциально-диагностические признаки COVID-19 и ИПЛ на фоне ИВРЗ

Показаниями для госпитализации в ревматологический стационар у пациентов с ИВРЗ после перенесенной НКИ являются: высокая клинико- лабораторная активность основного заболевания, увеличение числа пораженных органов и систем, отсутствие эффекта от проводимой терапии на амбулаторном этапе.
Возможные исходы лонг-ковида у пациентов с РЗ
Вероятными исходами лонг-ковида при РЗ являются: полная обратная динамика суставного синдрома у пациентов с поствирусными артритами, дебют либо обострение ИВРЗ, а также ухудшение течения коморбидной патологии (гипертонической болезни, ишемической болезни, хронической сердечной недостаточности, сахарного диабета, хронической болезни почек).
Рекомендации по ведению пациентов с ревматологическими проявлениями постковидного синдрома
Терапия постковидного синдрома у пациентов с ревматологическими проявлениями должна носить персонифицированный характер и определяться особенностями данного состояния у конкретного пациента – выраженностью висцеральной патологии (дыхательная и сердечная недостаточность, ХБП, и др.), наличием признаков системной воспалительной реакции, болей в суставах и мышцах, выраженной утомляемости, проблем в интеллектуально-мнестической и психоэмоциональной сферах.
У пациентов с постковидным артритом требуется назначение нестероидных противовоспалительных препаратов, коротких курсов ГКС (преднизолон ≤ 10 мг/сут в течение 5-7 дней), а при наличии депрессивных расстройств-назначение антидепрессантов и антиконвульсантов.
С учетом обострения течения ИВРЗ в посковидном периоде необходимо возобновление иммуносупрессивной терапии при легком течении НКИ через одну неделю после отрицательных мазков на SARS-CoV2, при среднем варианте течения –через 2-3 недели, а при тяжелом течении – через 4 недели.
Для пациентов с ревматоидным артритом, развившимся после НКИ, необходимо назначение базисной терапии в варианте метотрексата (15-25 мг в неделю) либо лефлуномида (20 мг в сутки) или сульфасалазина (2000 мг в
сутки). При средней и высокой активности заболевания, несмотря на прием синтетических базисных противоревматических средств, может быть начато применение ГИБТ или таргетных средств (таблица 4). При наличии воспалительного полиартрита показано применение ГКС (преднизолон ≤ 10 мг в сутки) или НПВС.
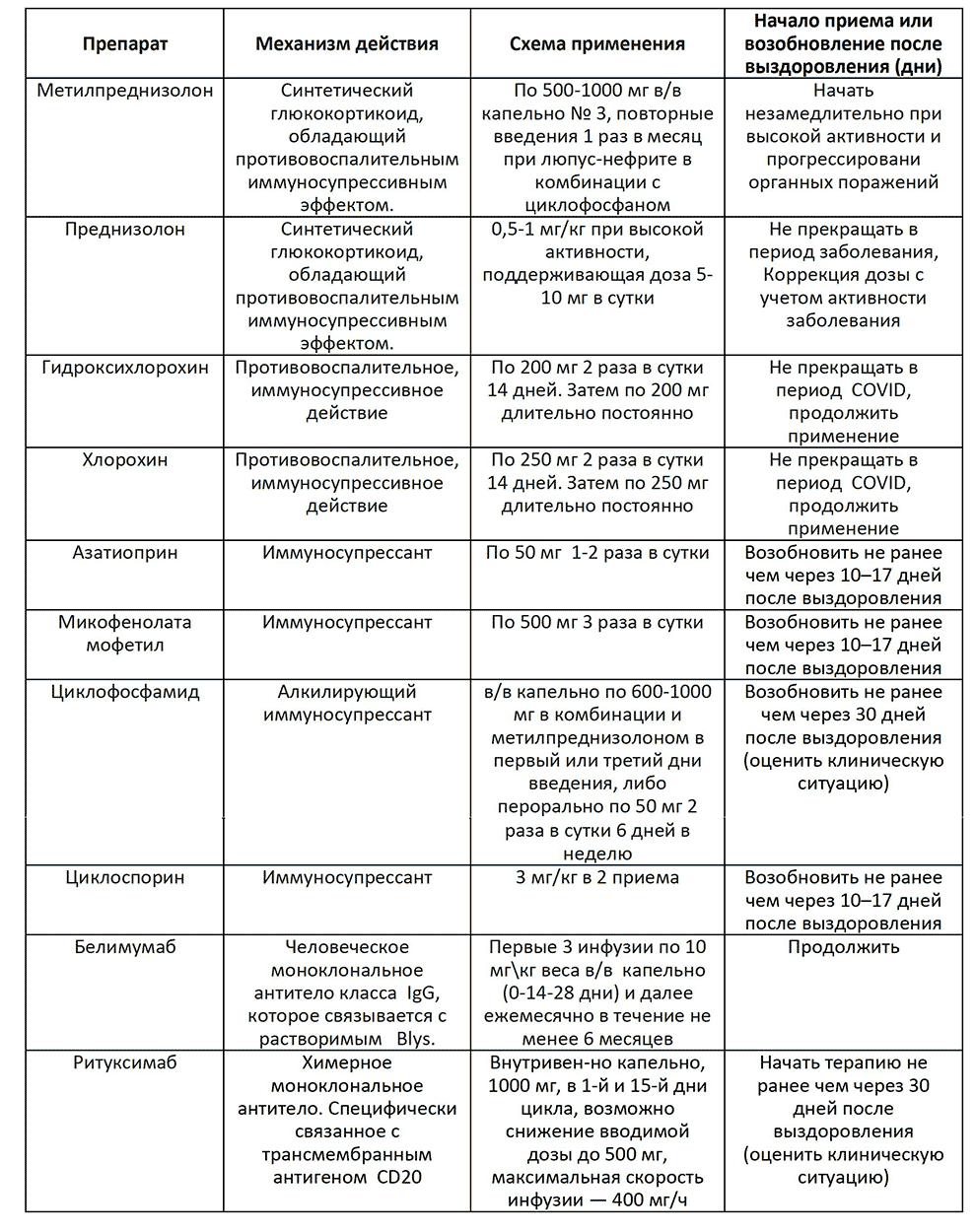
Таблица 4. Механизмы действия, дозы, схемы введения ГИБТ и таргетных средств при лечении пациентов с РА, перенесших COVID-19
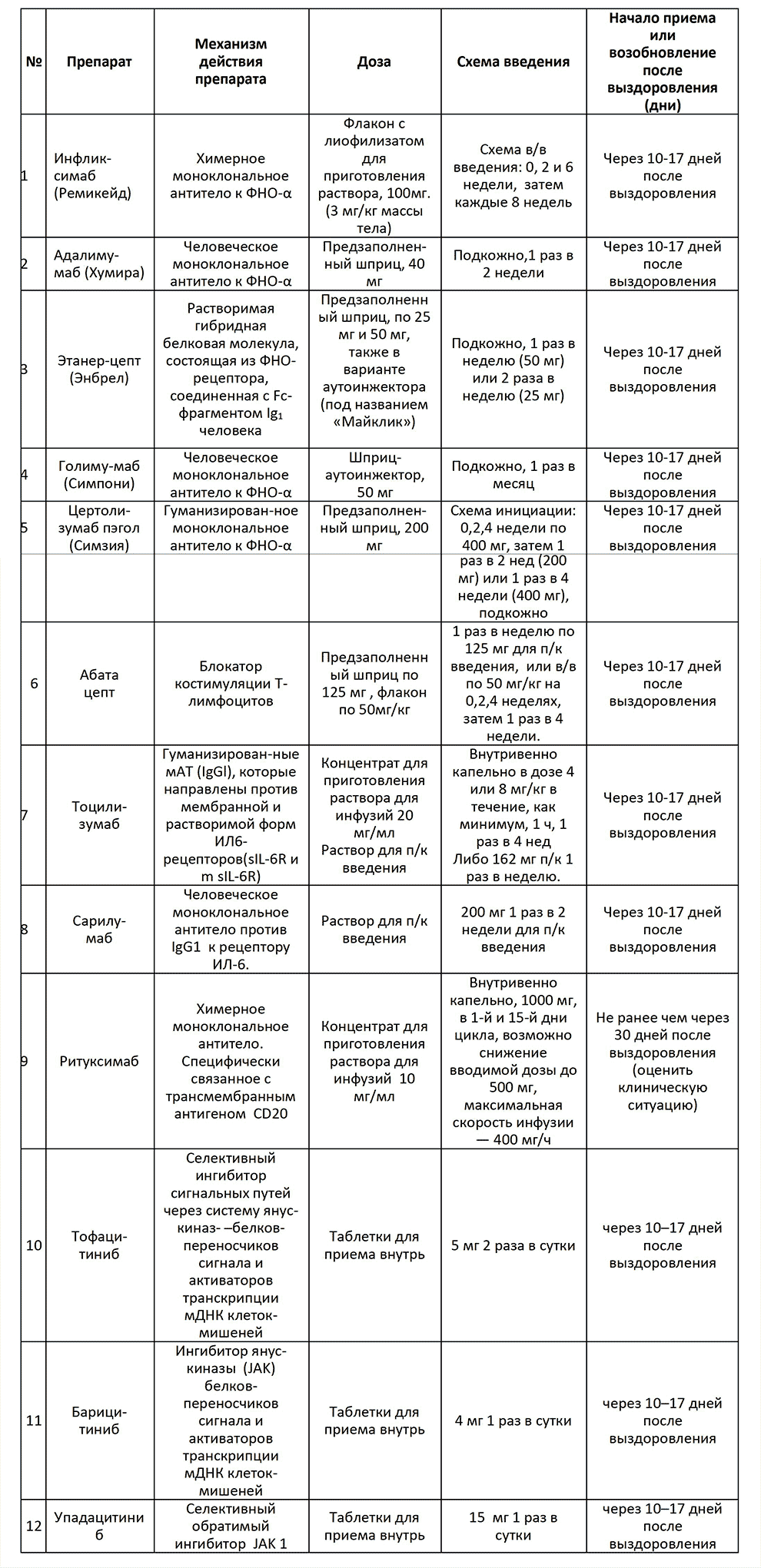
При сохраняющейся активности болезни показано назначение ГИБТ в варианте тоцилизумаба (внутривенно капельно в дозе 4 или 8 мг/кг 1 раз в 4 нед, либо 162 мг п/к 1 раз в неделю через 10-17 дней после выздоровления) либо ритуксимаба (внутривенно капельно, 1000 мг, в 1-й и 15-й дни цикла, не ранее чем через 30 дней после выздоровления (с учетом клинической ситуации).
Пациентам с впервые диагностированной СКВ применение аминохинолиновых препаратов следует назначать в полной дозировке: гидроксихлорохин (по 200 мг 2 раза в сутки) или хлорохин (по 250 мг 2 раза в сутки) в течение 10-14 дней, затем по 1 таблетке длительно постоянно. У беременных с СКВ использование гидроксихлорохина (200 мг в сутки) и хлорохина (250 мг в сутки) следует продолжить. Терапия ГКС и иммуносупрессантами проводится в полной дозе с учетом активности и органного поражения. По показаниям может быть начато применение белимумаба (таблица 5).
Таблица 5. Схемы назначения иммуносупрессивной и биологической терапии у пациентов с СКВ в постковидном периоде
Следует отметить, что терапия дексаметазоном в дозе 16-32 мг/сут, назначаемая в период лечения НКИ, может «смазывать» картину активности ИВРЗ. С учетом этой ситуации требуется обязательное назначение иммуносупрессивной терапии после выздоровления (с учетом представленных выше рекомендаций) и регулярное динамическое наблюдение за такими пациентами для коррекции лечения.
У пациентов с ранним ОА при болевом синдроме показано местное назначение НПВП в виде мазей или гелей (долобене-гель, крем долгит, ибупрофен-гель, диклак др.) или применение ацетоменофена в дозе до 3 г/сут.
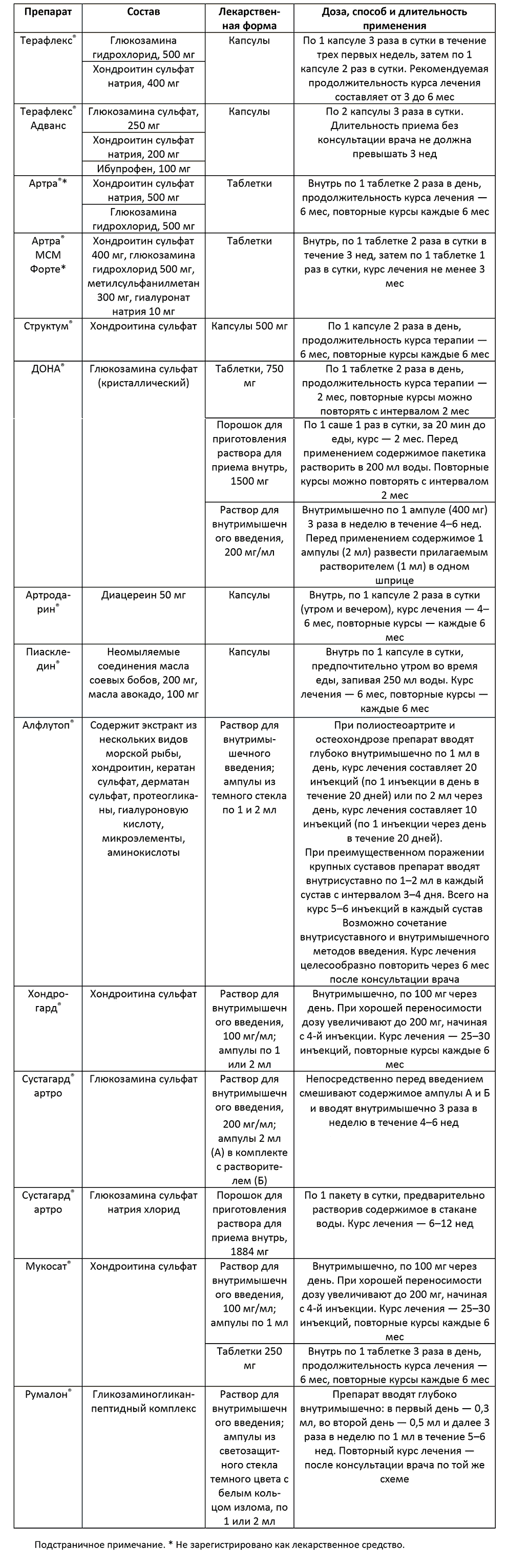
Особое место в схеме медикаментозного лечения коморбидных пациентов с остеоартритом (ОА) в условиях пандемии занимают симптоматические медленнодействующие препараты (SYSADOA). С учетом особенностей патогенеза COVID-19 в группе SYSADOA предпочтение следует отдавать парентеральным препаратам, не усиливающим протромбогенные свойства крови. У больных с воспалительным фенотипом ОА, развившегося после НКИ, препаратом выбора может быть Алфлутоп, который характеризуется ранним анальгетическим эффектом (на второй неделе терапии), нарастающим эффектом в течение трех месяцев по окончании курсового лечения и длительным периодом последействия – до 4–6 месяцев. Важным практическим преимуществом Алфлутопа, следует считать отсутствие его влияния на параметры гемокоагуляции и снижение потребности в НПВП, вследствие чего уменьшается риск тромботических осложнений, характерных для «лонг-ковида». Короткий курс применения Алфлутопа (десять внутримышечных инъекций по 2,0 мл через день) способствует удобству в применении и повышению приверженности к терапии пациентов с ОА. Применение SYSADOA может быть продолжено в период заболевания COVID-19 и в постковидном периоде (таблица 6). В настоящее время отсутствуют данные об эффективности внутрисуставного введения гиалуроновой кислоты у пациентов с ранним ОА, развившимся после НКИ.
При выраженном болевом синдроме и наличии реактивного синовита показано стартовое назначение НПВП (диклофенак 100 мг/сут, ацеклофенак 100-200 мг/сут, кетопрофен 100 мг 2 раза в сутки, напроксен 275 мг 2-3 раза в сутки, нимесулид 200 мг/сут, мелоксикам 7.5-15 мг/сут, целекоксиб 200 мг/сут, эторикоксиб 60 мг/сут) с учетом гастроинтестинальных и кардиоваскулярных рисков. Среди местных НПВП препараты Вольтарен Эмульгель 1% и 2% могут рассматриваться в качестве эффективной альтернативы применения системных форм НПВП и позволяют снизить лекарственную нагрузку или полностью отказаться от них. При низком уровне системной абсорбции (меньше 6%) применение местных форм Вольтарен Эмульгель позволяет достигать высоких терапевтических концентраций в очаге воспаления, уменьшать интенсивность боли на срок до 12 часов после однократного применения и ускорить восстановительные процессы в тканях.
Таблица 6 Структурно-модифицирующие препараты, применяемые для лечения пациентов с остеоартритом, перенесших COVID-19
Таким образом, в настоящее время существуют значимые особенности течения лонг-ковида в ревматологии, которые характеризуются формированием недифференцированного артрита, связанного с развитием поствирусного артрита, однако он может являться дебютом системных аутоиммунных заболеваний. Следовательно, пациенты с постковидным недифференцированным артритом должны быть направлены на консультацию к ревматологу с целью расширения дифференциально-диагностического поиска для постановки критериального диагноза и назначения патогенетической терапии. У пациентов с уже существующими ревматологическими заболеваниями в период лонг-ковида нередко отмечается обострение их течения, требующее коррекции терапии и интенсификации лечения с применением высокодозных схем глюкокортикоидов, цитостатиков и ГИБТ.
Список сокращений
АНФ-антинуклеарный фактор
АПФ-антиотензин превращающий фактор
АЦЦП-антитела к циклическому цитруллинированному пептиду
БПВП-базисные противовоспалительные препараты
ГИБТ-генно-инженерная биологическая терапия
ГК-глюкокортикоиды
ГХ-гидроксихлорохин
ДМФС-дистальные межфаланговые суставы
ИВРЗ-иммуновоспалительные ревматические заболевания
НДА-недифференцированный артрит
НКИ-новая короновирусная инфекция
ПВА-поствирусный артрит
РА-ревматоидный артрит
РФ-ревматоидный фактор
ПМФС-проксимальные межфаланговые суставы
ПЦР-цепная полимеразная реакция
НПВП-нестероидные противовоспалительные препатары
СКВ-системная красная волчанка
СЗСТ-системные заболевания соединительной ткани
ФНО-фактор некроза опухолей
DMARD-противоревматических препаратов, модифицирующих заболевание SYSADOA-медленно действующие симптоматические средства








































0 комментариев