Рак шейки матки. МРТ диагностика. Лекция для врачей
Лекция для врачей "Рак шейки матки. МРТ диагностика" (отрывок из книги "МРТ. Органы малого таза у женщин. Руководство для врачей. Практическая магнитно-резонансная томография" - Труфанов В. А.)
Рак шейки матки
Ежегодная частота встречаемости рака шейки матки составляет около 12 случаев на 100 тыс. женщин в Германии и 7,9 — в США. В мире данный показатель колеблется от 5 (Испания) до 45 (Колумбия) случаев на 100 тыс. женщин. На данную опухоль приходится 4% всех злокачественных новообразований.
В экономически развитых странах рак шейки матки занимает восьмое место среди онкологических заболеваний у женщин. Это наиболее распространенная злокачественная опухоль внутренних половых органов у женщин младше 50 лет и третья по частоте встречаемости (после рака тела матки и рака яичника) в постменопаузе.
Каждый год во всем мире регистрируют около 500 тыс. новых случаев рака шейки матки, и 350 тыс. женщин умирает от этого заболевания. Данная опухоль стоит на втором месте в списке причин смертности от онкологических заболеваний, большинство летальных исходов приходится на страны третьего мира.
Первый пик заболеваемости приходится на возраст 35-45 лет, второй — на 60—64 года. Ранее средний возраст развития рака шейки матки составлял 52 года, однако в последние годы отмечается тенденция к омоложению заболевания. Причиной тому является введение скрининговых исследований, благодаря которым удалось снизить риск развития рака шейки матки, в особенности в возрастной группе старше 50 лет. Другой причиной является смещение пика рождаемости на возраст 35—45 лет, что сопровождается проведением активного клинико-гинекологического обследования. В последние годы рак шейки матки все чаще выявляют именно в этой группе женщин.
Введение цитологического скрининга позволяет выявлять и лечить предраковые заболевания шейки матки у молодых женщин, тем самым распространенность данной опухоли удается контролировать. Предраковые заболевания встречаются гораздо чаше, чем сам рак шейки матки, и, как правило, развиваются к 30—40 годам, постепенно трансформируясь в злокачественную опухоль в среднем в течение 10 лет. Возникшая у женщин моложе 35 лет опухоль характеризуется более агрессивным течением.
В целом летальность от рака шейки матки с 1970-х годов уменьшилась примерно на 55% и продолжает постепенно снижаться; в настоящее время этот показатель не превышает 2%. Этот прогресс объясняется повсеместным внедрением программы скрининга, благодаря которой данное заболевание выявляют на ранних стадиях (IA и IB по классификации FIGO) с благоприятным прогнозом. Кроме того, изменилась тактика лечения, например, было доказано, что определенная категория пациенток лучше отвечает на комбинацию оперативного лечения с проведением лучевой и химиотерапии. Появилась тенденция чаще применять изолированное оперативное лечение, а не первичную лучевую терапию. Использование новейших минимально инвазивных хирургических технологий позволяет значительно улучшить качество жизни пациенток в послеоперационном периоде. Однако, несмотря на прогресс диагностики лечения рака шейки матки, наблюдаемый в последние десятилетия, прогноз при различных стадиях заболевания фактически не изменился. Средний относительный показатель пятилетней выживаемости при данном диагнозе в Германии не превышает 65%, а в США 70%; относительный показатель десятилетней выживаемости составляет 59 и 65% соответственно.
Патогенез
Основным патогенетическим фактором развития рака шейки матки является инфекция эпителия цервикального канала одним из онкогенных типов вируса папилломы человека (ВПЧ — Human papillomavirus, HPV). Высокий онкогенный потенциал имеют типы 16 и 18. В целом распространенность данного вируса составляет по различным источникам 5—20%, пик инфицирования приходится на возраст от 20 до 25 лет. Нередко наблюдается спонтанный регресс инфекции. Персистирование вируса сопровождается перестройкой эпителия слизистой оболочки цервикального канала. Основную группу риска составляют женщины с сопутствующими факторами риска, к которым относятся раннее начало половой жизни, низкий уровень гигиены половых путей, большое количество половых партнеров, частые генитальные инфекции, множественные беременности, длительный прием оральных контрацептивов и снижение иммунитета, например, при синдроме приобретенного иммунодефицита (СПИД). Дополнительными факторами являются курение и гиповитаминоз. Отдельная роль в патогенезе отводится генетической предрасположенности.
Плоскоклеточный рак шейки матки в своем развитии проходит несколько последовательных стадий, начиная с пролиферации эпителия через изменение морфологии и дисплазию клеток эпителия к формированию предракового состояния. Стадия предрака получила название интраэпителиальной неоплазии шейки матки или плоскоклеточной интраэпителиальной дисплазии, она переходит в carcinoma in situ и лишь затем, собственно, в инвазивный рак шейки матки. Первичные изменения, как правило, локализуются в нестабильной зоне, где плоскоклеточный эпителий влагалищной части шейки матки переходит в цилиндрический эпителий цервикального канала. Интраэпителиальную неоплазию шейки матки выявляют примерно у 3-5% сексуально активных женщин.
Частота встречаемости облигатных предраковых изменений (интраэпителиальной неоплазии шейки матки II, III стадий) в 100 раз больше, чем рака шейки матки, в течение двух последних десятилетий этот показатель демонстрирует тенденцию к росту. Наиболее ранние формы интраэпителиальной неоплазии шейки матки диагностируют в возрасте около 25 лет. Такие изменения могут спонтанно подвергаться обратному развитию, а могут трансформироваться в рак in situ (обычно в период с 25 до 35 лет), а затем — к 40 годам — собственно в рак шейки матки.
Патоморфология
Гистологически 80% всех раков шейки матки относятся к ороговевающему или неороговевающему плоскоклеточному типу. На втором месте по распространенности стоит аденокарцинома, на которую приходится около 15% всех опухолей. В течение последних 25 лет отмечается небольшой рост встречаемости аденокарцином. Данный гистологический тип опухоли сочетается с рецидивирующим или хроническим цервицитом и чаще возникает на фоне приема эстроген-содержащих препаратов, хотя в целом патогенез развития опухолевого процесса остается малоизученным. При аденокарциномах II—III стадий прогноз менее благоприятный, чем при плоскоклеточном раке. Около 3% аденокарцином шейки матки относятся к гистологическому подтипу высокодифференцированных муцинозных аденокарцином, которые получили название злокачественных аденом и имеют очень неблагоприятный прогноз, так как рано метастазируют в брюшную полость и плохо отвечают на лучевую и химиотерапию. В то же время благодаря высокой клеточной дифференцировке таких опухолей при гистологическом анализе их часто не расценивают как злокачественные образования.
Злокачественную аденому нередко выявляют на фоне синдрома Пейтца—Егерса, для которого характерны пигментация кожи и слизистых оболочек, опухоли яичников и множественные гамартомы желудочно-кишечного тракта. К редким гистологическим типам рака шейки матки также относят карциному, которая встречается примерно в 3% случаев и имеет менее благоприятный прогноз, чем аденокарцинома и плоскоклеточный рак. Среди других злокачественных новообразований шейки матки следует упомянуть нейроэндокринные опухоли, мелкоклеточные опухоли и рабдомиосаркому. Мелкоклеточные опухоли склонны рано давать метастазы, прогноз при этом гистологическом типе опухоли, как правило, неблагоприятный. Нейроэндокринные опухоли составляют только 0,3% всех новообразований шейки матки и характеризуются агрессивным ростом. Карциноидный синдром на этом фоне развивается редко, а клинические проявления не отличаются от таковых при плоскоклеточном раке.
Клинические проявления
На ранних стадиях опухолевый процесс протекает бессимптомно. Клинические проявления развиваются поздно и складываются из диспареунии (болевые ощущения при половом акте), появления отделяемого из влагалища и наружных кровотечений после полового акта. Последующее возникновение диффузных тазовых болей и болей в пояснице с иррадиацией в нижние конечности свидетельствует о распространении злокачественного процесса на прилежащие структуры.
Опухоли больших размеров могут вызывать боли при мочеиспускании и/или дефекации, появление кровянистых выделений в моче или стуле. Нарушение оттока лимфы при сдавлении опухолью лимфатических путей проявляется односторонним отеком нижней конечности; при метастазировании рака шейки матки в брюшину происходит увеличение окружности живота за счет асцита.
Общие симптомы онкологического заболевания складываются из слабости, повышенной утомляемости и потери массы тела. К поздним осложнениям опухолевого процесса относится метастазирование в легкие с развитием дыхательной недостаточности.
Стадирование
Наиболее широкое распространение получила классификация стадий рака шейки матки по FIGO, согласно которой выделяют четыре стадии процесса (табл. 6.2).
Представленная классификация была предложена до появления современных методов лучевой диагностики и отличается от других тем, что основана на данных бимануальной пальпации.
В классификации FIGO не предусмотрены результаты таких методов исследования, как УЗИ, КТ и МРТ, что, безусловно, является недостатком данной системы стадирования. Распространение рака шейки матки на влагалище с высокой степенью точности устанавливается при ректовагинальном исследовании и кольпоскопии, тогда как в определении размеров опухоли и инвазии параметрия физикальное исследование является менее достоверным.
По данным ряда исследований, результаты стадирования рака шейки матки по FIGO расходятся с интраоперационными данными в 30% случаев на стадии IB и примерно в 70% случаев на стадиях II—IV. Появление клинических симптомов, как, например, лихорадки и реактивного воспаления параметрия, зачастую приводит к переоценке распространенности опухолевого процесса. Кроме того, классификация по FIGO не предусматривает оценку состояния регионарных лимфатических узлов, что зачастую имеет решающее значение в определении прогноза. По этим причинам все большее число специалистов предпочитают использовать хирургическую систему стадирования рака шейки матки, классификацию по TNM, предложенную AJCC (American Joint Committee on Cancer — Американский объединенный комитет по изучению рака), или критерии UICC (United International Cancer Congress — Международный союз по борьбе с раком) (табл. 6.3).
Таблица 6.2 Стадии рака шейки матки согласно классификации Международной федерации акушеров и гинекологов (FIGO)
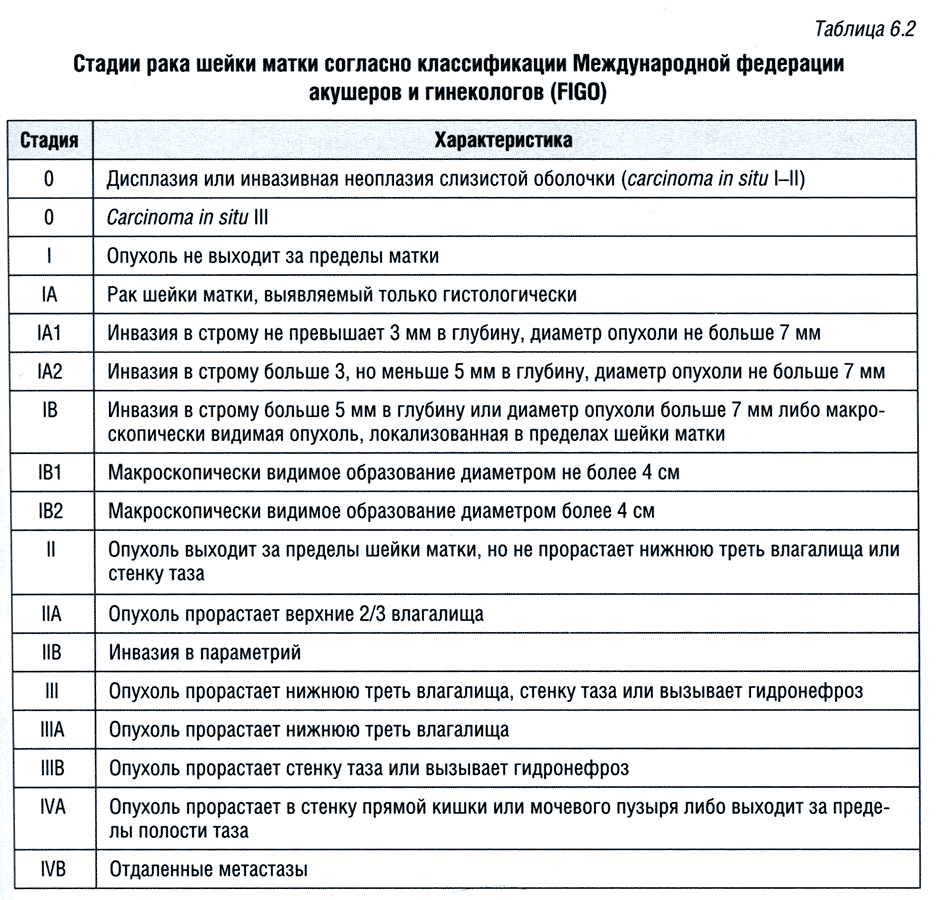
Таблица 6.3 Стадии рака шейки матки в соответствии с критериями Международного союза по борьбе с раком (UICC) и международной классификации стадий злокачественных новообразований (TNM)
Примечание: FIGO — International Federation of Gynecology and Obstetrics (Международная федерация акушеров и гинекологов); TNM (от англ, tumor, nodus, metastasis — опухоль, узлы, метастазы) — международная классификация стадий злокачественных новообразований; UICC — United International Cancer Congress (Международный союз по борьбе с раком).
Эти системы напрямую коррелируют с прогнозом. Согласно критериям классификаций FIGO и TNM оптимальным методом периоперационного исследования при раке шейки матки является МРТ. В качестве дополнительного метода исследования для установления операбельности опухоли, а также перед планированием неадъювантной лучевой или химиотерапии нередко выполняют лапароскопическую оценку состояния регионарных лимфатических узлов. При поражении парааор- тальных лимфатических узлов показано взятие биопсии лестничной группы лимфатических узлов. Определение опухолевых маркеров при раке шейки матки характеризуется низкой чувствительностью и специфичностью и потому не входит в стандартную программу обследования.
Типы роста
В подавляющем большинстве случаев рак шейки матки растет из места перехода цилиндрического эпителия в плоскоклеточный неороговевающий, для молодых женщин типичен экзофитный рост опухоли за пределы шейки матки. В пожилом возрасте по мере ретракции зоны перехода эпителия в цервикальный канал начинают преобладать эндофитные типы роста.
Для рака шейки матки характерен инвазивный рост с распространением на влагалище, тело матки, параметрий, мочевой пузырь, прямую кишку и брюшину. Одновременно опухоль метастазирует в лимфатические узлы таза, преимущественно в лимфатические узлы запирательной ямки, расположенные вокруг наружных, внутренних и общих подвздошных сосудов, пресакральные и парааортальные лимфатические узлы. Риск развития метастазов в регионарные лимфатические узлы прямо пропорционален стадии опухолевого процесса.
В стадии IA (микроскопическая инфильтрация стромы шейки матки) без вовлечения в процесс сосудов вероятность наличия метастазов в тазовых лимфатических узлах не превышает 1 %; в стадии IB этот показатель увеличивается до 10—20%.
При распространении опухоли за пределы шейки матки с поражением верхней части влагалища (ПА стадия) риск метастазирования в парааортальные или тазовые лимфатические узлы уже достигает 25%, а при инвазии параметрия (ПВ стадия) — 30%.
При опухолевом прорастании нижней трети влагалища или стенки таза (III стадия) вероятность поражения лимфатических узлов составляет 45%; при распространении процесса на мочевой пузырь или прямую кишку (IVA стадия) — 55%. Риск метастазирования опухоли в парааортальные лимфатические узлы становится значимым при стадии выше ПА (8—15%). Такие метастазы считаются отдаленными и редко наблюдаются изолированно, без поражения тазовых лимфатических узлов.
Гематогенный путь метастазирования при раке шейки матки встречается редко и, как правило, соответствует поздней стадии процесса. Риск развития отдаленных метастазов в течение 10 лет зависит от стадии опухолевого процесса и колеблется от 10—20% при IВ и ПА стадиях без поражения регионарных лимфатических узлов до 50—70% на ПВ—IVA стадиях с наличием метастазов в тазовые лимфатические узлы. Риск развития местного рецидива и проявления отдаленных метастазов является максимальным в течение первых 2 лет после проведения первичного лечения. В 60—80% случаев рецидив опухоли локализуется в полости малого таза.
Гистологические типы
Выделяют следующие гистологические типы:
• цервикальная интраэпителиальная неоплазия III степени;
• плоскоклеточная карцинома in situ;
• инвазивная плоскоклеточная карцинома:
- ороговеваюшая;
- неороговеваюшая;
- веррукозная;
• аденокарцинома in situ;
• инвазивная аденокарцинома;
• эндометриоидная аденокарцинома;
• светлоклеточная аденокарцинома;
• аденоплоскоклеточная аденокарцинома;
• аденокистозная карцинома;
• аденоидная базальная карцинома;
• мелкоклеточная карцинома;
• нейроэндокринная опухоль;
• недифференцированная карцинома.
Степень дифференцировки
• G0 — степень дифференцировки не может быть определена.
• G1 — высокая степень дифференцировки.
• G2 — умеренная степень дифференцировки.
• G3 — низкая степень дифференцировки.
• G4 — недифференцированная опухоль.
МРТ является наиболее точным методом (90%) в диагностике прорастания пара-метрия (дифференциация IB и ПВ стадий). В большинстве случаев благодаря МРТ удается избежать использования рекомендованных по системе FIGO рентгенологических методов исследования, таких как цистография, ректосигмография, ирригография с двойным контрастированием, так как МРТ значительно превосходит их в точности диагностики распространения опухоли.
В настоящее время MP-урография успешно вытесняет традиционную урографию, которая прежде выполнялась всем пациентам с раком шейки матки на поздней стадии или с рецидивом, а также при подозрении на обструкцию мочевыводящих путей. В этом аспекте применение МРТ является более эффективным.
На 0 (carcinoma in situ) и IA (микроинвазия) стадиях опухоль не удается прямо визуализировать с помощью КТ или МРТ. Тем не менее даже в этом случае можно использовать М РТ для оценки состояния органов малого таза и лимфатических узлов. В большинстве случаев перед МРТ проводят гистологическую верификацию рака шейки матки; таким образом, данный метод направлен не на диагностику опухолевого процесса, а на определение его стадии.
МРТ признана оптимальным методом для планирования радиохимиотерапии, а также для последующего наблюдения ответа опухоли на проводимое лечение. Для планирования лучевой терапии также широко используют КТ таза.
В послеоперационном периоде МРТ позволяет дифференцировать послеоперационный рубец или пострадиационные рубцовые изменения от рецидива опухоли примерно через 6 мес после окончания лечения. Именно поэтому во многих руководствах рекомендуется проводить данное исследование при подозрении на рецидив рака шейки матки.
Особенности методики магнитно-резонансной томографии
Перед началом обследования необходимо собрать краткий гинекологический анамнез пациентки. Ввиду того, что морфология матки в значительной степени зависит от гормонального статуса, крайне важно знать фазу менструального цикла на момент исследования, а также уточнить, не получает ли пациентка гормональную заместительную терапию. Кроме того, следует выяснить из анамнеза число родов и кесарева сечения, а также инвазивных манипуляций, например конизации шейки матки или кюретажа. При выполнении МРТ в динамике необходимо уточнить, какое оперативное вмешательство выполнялось пациентке, и проводилась ли лучевая терапия. Все эти данные важны для оценки полученных изображений.
Для определения стадии опухолевого процесса нужно получить четкое изображение морфологии малого таза, при этом высокие требования предъявляются к соотношению сигнал/шум, однородности MP-сигнала и пространственному разрешению. В связи с этим для исследования рекомендуется использовать поверхностные катушки для тела, которые повышают соотношение сигнал/шум лучше объемных катушек, а также улучшают пространственное разрешение или ускоряют процесс сбора данных. Поверхностную катушку укладывают на туловище таким образом, чтобы полностью покрыть зону планируемого сканирования. Альтернативные локальные катушки (эндоректальную и вагинальную) используют редко, они улучшают пространственное разрешение структур, располагающихся в непосредственной близости, но искажают общую анатомию исследуемой зоны, например уменьшают на изображении толщину прослоек клетчатки. В большинстве случаев после применения локальных катушек необходимо выполнять повторное исследование с поверхностной катушкой, чтобы оценить анатомию малого таза и, что особенно важно, состояние лимфатических узлов. Благодаря увеличению соотношения сигнал/шум, легкости в эксплуатации и комфорту пациенток при исследовании поверхностные катушки получили более широкое распространение, чем локальные.
Сканирование осуществляют в положении пациентки лежа на спине. Исследование не обязательно выполнять на голодный желудок, напротив, перед этим пациентке рекомендуется легкий завтрак. Умеренное наполнение мочевого пузыря позволит лучше визуализировать его стенку, матка при этом чуть отклоняется кзади. Слишком большое наполнение мочевого пузыря может вызывать беспокойство пациентки во время исследования и даже послужить причиной его прерывания.
Для получения качественного изображения необходимо элиминировать артефакты от перистальтики кишки путем введения спазмолитика непосредственно перед исследованием. Стандартно применяют гиосцина бутилбромид (Бускопан) — 40 мг внутривенно или внутримышечно. Период полувыведения данного препарата составляет 2—3 ч. Его эффект проявляется сразу же после внутривенной или через несколько минут после внутримышечной инъекции. При наличии противопоказаний к использованию Бускопана (гиперчувствительность, глаукома, управление автотранспортом сразу после обследования) внутривенно вводят 2 мл глюкагона. Технически двигательные артефакты можно уменьшить путем сокращения времени сбора данных.
Необходимыми критериями для получения качественных изображений малого таза являются высокое соотношение сигнал/шум и высокое пространственное разрешение, поэтому предпочтительнее применять поверхностные катушки. Улучшить разрешение можно, уменьшая поле обзора, к примеру, до 20x20 см с использованием перекрытия фаз (phase oversampling), что позволяет избежать артефактов наложения. Ввиду того, что поверхностные катушки очень восприимчивы к артефактам от дыхательных движений и движений передней брюшной стенки, рекомендуется во всех последовательностях накладывать преднасыщение (сатуратор).
Хотя бы в нескольких последовательностях поле обзора должно включать не только область таза, но и часть брюшной полости до ворот почек, чтобы возможно было оценить состояние парааортальных лимфатических узлов. В особенности это относится к пациенткам с раком шейки матки стадии ПВ и выше.
Исследование нужно начинать с выполнения локалайзера в трех плоскостях (аксиальной, корональной и сагиттальной), за которым следуют Т2-ВИ в двух основных плоскостях. Т2-ВИ отличаются максимальной контрастностью мягких тканей, на них удается оптимально оценить истинные границы опухоли. Изображения в данной последовательности представляют собой основу MP-визуализации малого таза.
Первую серию Т2-ВИ следует выполнять в сагиттальной плоскости с захватом тела, шейки матки, а также тазового дна; при этом используются тонкие срезы (4-5 мм) с высоким разрешением, небольшое поле обзора, матрица сбора данных 512x512, фазовое разрешение не менее 75%. По полученным изображениям устанавливаются косо-аксиальные Т2-ВИ, которые необходимо ориентировать перпендикулярно цервикальному каналу (рис. 6.17).
Как и в предыдущей последовательности, поле обзора должно захватывать дно матки и тазовое дно; рекомендуется использовать толщину среза 4—5 мм, матрицу сбора данных 512x512 и фазовое разрешение не менее 75%.
Изображения в косой аксиальной плоскости позволяют детально визуализировать шейку матки и околоматочную клетчатку, а также их топографические взаимоотношения. Угол наклона не должен превышать 45°, чтобы избежать сбора данных во фронтальной плоскости с наклоном вправо или влево.
При поражении влагалища с риском инфильтрации параметрия от околовлагалищной клетчатки в восходящем направлении следует выполнять дополнительные изображения в плоскости, перпендикулярной оси влагалища. Поражение мышц тазового дна (особенно мышцы, поднимающей задний проход) лучше оценивать на Т2-ВИ в корональной плоскости; эти данные имеют большое значение при планировании оперативного вмешательства.
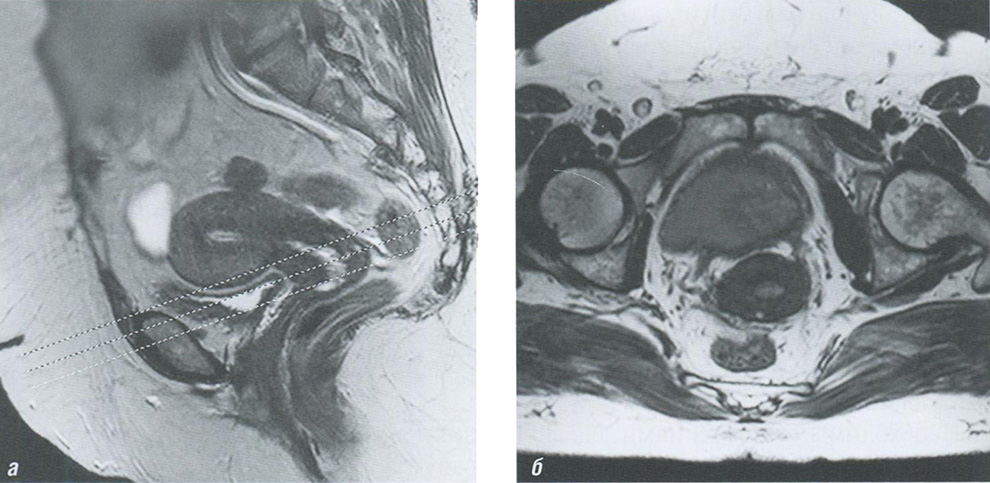
Рис. 6.17. Магнитно-резонансные томограммы матки. Схема ориентации косо-аксиальных срезов при исследовании рака шейки матки: а — ориентировать срезы следует перпендикулярно продольной оси цервикального канала; б — Т2-ВИ в косой аксиальной плоскости позволяют оценить структуру цервикального эпителия и целостность стромы шейки матки
Для исследования тазовой стенки и лимфатических узлов рекомендуют дополнительно выполнять протонно-взвешенные (proton density, PD) или Т1-ВИ в аксиальной плоскости. Сбор данных при этом следует проводить с уровня бифуркации аорты до тазового дна. Для этого используется толщина среза 6 мм, матрица 512x512, фазовое разрешение не менее 60%. При распространении опухоли на нижнюю треть влагалища (стадия ША и выше) следует включать в зону сканирования все паховые лимфатические узлы, так как туда осуществляется отток лимфы от данной области.
Для установления стадии рака шейки матки контрастное усиление, как правило, не требуется, так как это не улучшает дифференцировку опухоли на фоне окружающих тканей по сравнению с нативными Т2-ВИ. Нередко введение контрастного препарата, напротив, ухудшает дифференцирование границ образования на фоне параметрия.
На постконтрастных изображениях удается лучше оценить инфильтрацию стенок мочевого пузыря и прямой кишки (рис. 6.18). Опухолевое прорастание при этом визуализируется как нарушение целостности мышечной оболочки стенки этих органов, которая в норме на Т1-ВИ дает гипоинтенсивный MP-сигнал. Доказано, что контрастное усиление позволяет дифференцировать реактивный отек стромы (не накапливает контрастный препарат) стенки органа от опухолевой инфильтрации (накапливает контрастный препарат). Исследование с контрастным усилением предполагает выполнение Т1-ВИ до и после внутривенного введения контрастного препарата (рис. 6.19, 6.20). При выполнении нативных и постконтрастных Т1-ВИ лучше копировать ориентацию срезов с Т2-последовательностей.
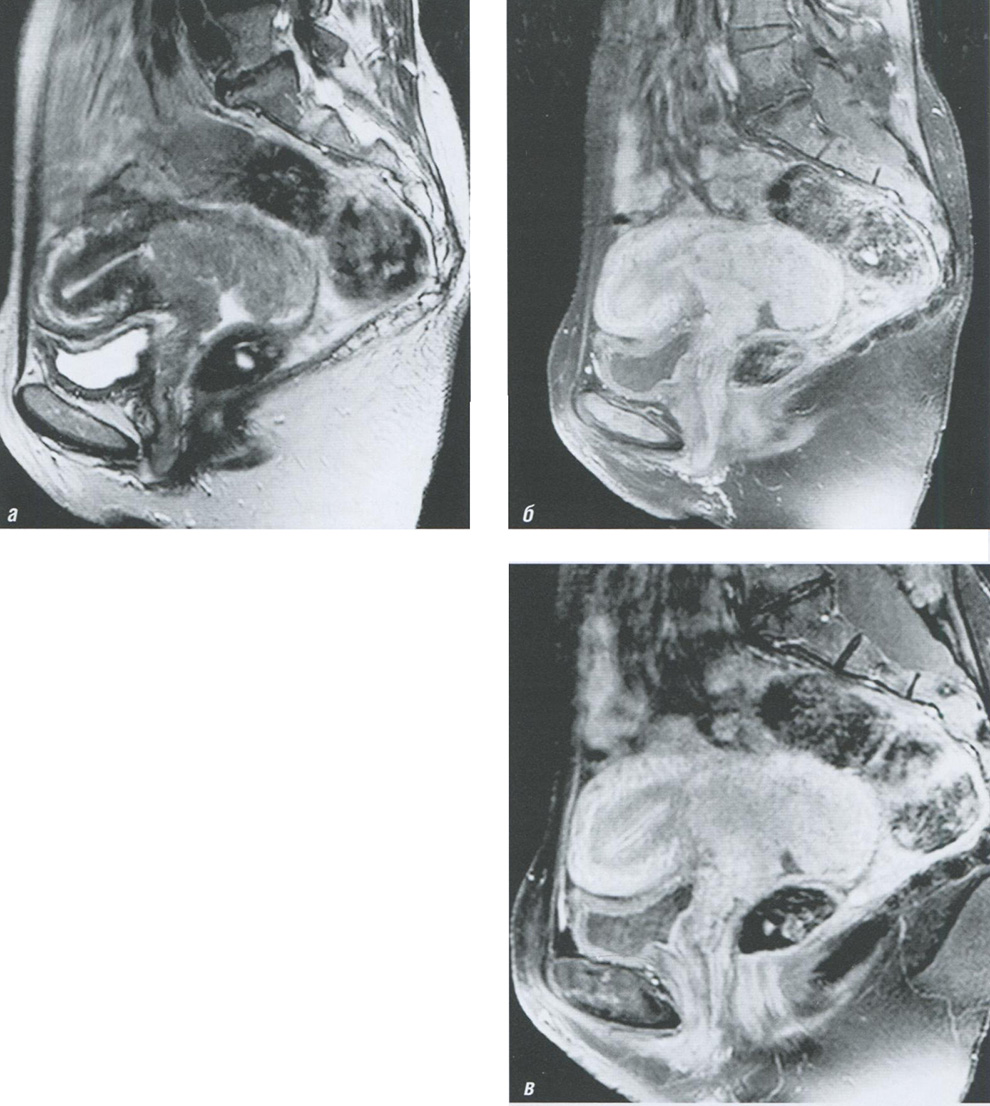
Рис. 6.18. Магнитно-резонансные томограммы матки, сагипальная плоскость: а — Т2-ВИ; б, в — постконтрастные T1-FS-BH. Рак шейки матки, IVA. Шейка матки расширена и деформирована за счет объемного образования с бугристым наружным контуром и неоднородной структурой. Опухоль прорастает задний свод, верхнюю и среднюю треть влагалища; гипоинтенсивная строма шейки матки на уровне опухоли не прослеживается. Утрата полоски жировой клетчатки между опухолью и стенками мочевого пузыря и прямой кишки свидетельствует в пользу прорастания стенок указанных органов. После внутривенного введения контрастного препарата ткань опухоли демонстрирует менее интенсивное накопление, чем неизмененный миометрий (гиповаскулярный тип)
Исследование с контрастным усилением проводят для дифференциальной диагностики между рецидивом опухоли и послеоперационными рубцовыми изменениями. Динамическое контрастирование с повторным сбором данных позволяет выполнять обсчет параметров накопления контрастного препарата в течение определенного промежутка времени.
Для ответа на отдельные вопросы, возникающие при стадировании опухолевого процесса, используют дополнительные импульсные последовательности. Необходимо помнить, что при прорастании опухоли за пределы шейки матки, а также при рецидиве рака, значительно возрастает риск метастатического поражения парааортальных лимфатических узлов. Исследовать лимфатические узлы этой группы лучше на Т2-ВИ в аксиальной плоскости при синхронизации с дыханием и с высоким разрешением, область сканирования при этом должна распространяться от ворот почек до бифуркации аорты.
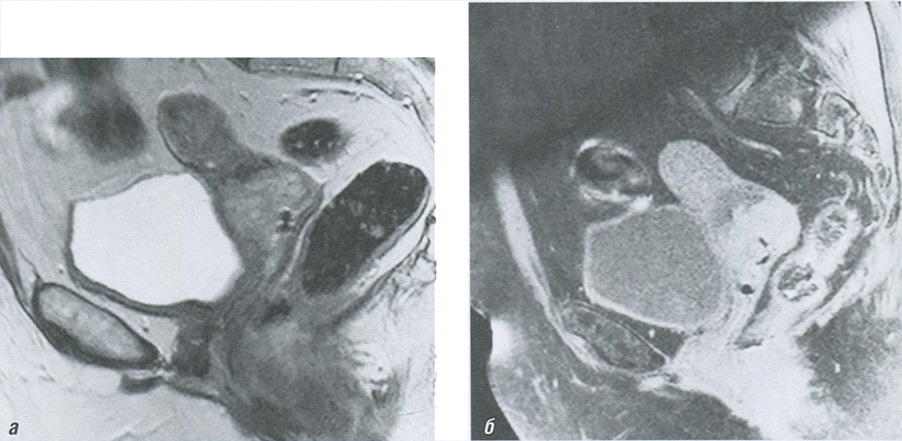
Рис. 6.19. Магнитно-резонансные томограммы с контрастным усилением при раке шейки матки, сагиттальная плоскость: а — Т2-ВИ; б — постконтрастное TI-FS-ВИ. Шейка матки расширена и деформирована, опухоль визуализируется в виде объемного образования, характеризуемого изогиперинтенсивным MP-сигналом на фоне гипоинтенсивной стромы шейки матки и менее интенсивного по сигналу миометрия. После внутривенного введения гадолиний-содержащего контрастного препарата она демонстрирует быстрое и интенсивное накопление, что говорит о высокой степени ее васкуляризации
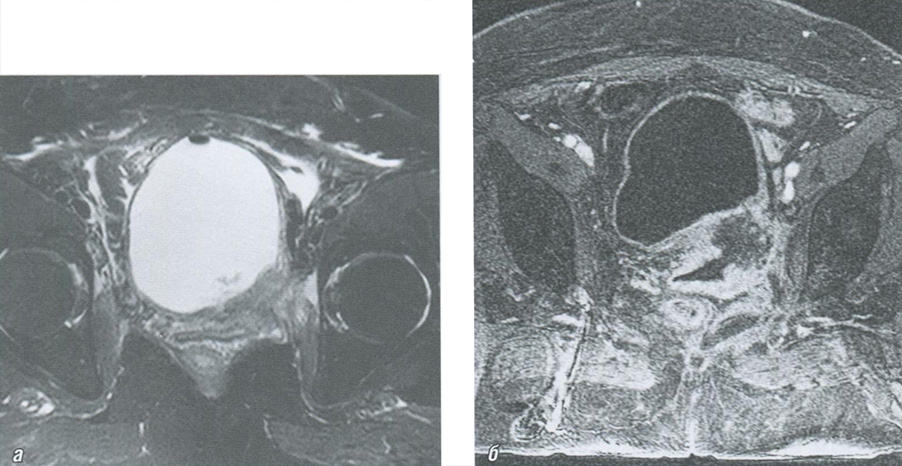
Рис. 6.20. Магнитно-резонансные томограммы с контрастным усилением при раке шейки матки, аксиальная плоскость: а — T2-FS-BИ/1; б — постконтрастное Т1-ВИ. На Т2-ВИ с подавлением сигнала от жировой ткани (а) опухолевая ткань дает изогипоинтенсивный MP-сигнал. Через 50 с после внутривенного контрастного усиления (б) на фоне интенсивно накапливающего контрастный препарат параметрия и стенки шейки матки опухолевая ткань выглядит гипоинтенсивной, что свидетельствует о гиповаскулярном типе опухоли
У пациенток с поздними стадиями рака шейки матки либо с местным рецидивом опухоли зачастую необходимо исключать обструкцию мочевыводяших путей. Для этого можно использовать такие же аксиальные Т2-ВИ, как и для исследования парааортальных лимфатических узлов. Дополнительные Т2-ВИ в последовательности TSE в корональной плоскости позволяют детально оценить мочевыводящие пути, к тому же для их получения требуется совсем немного времени. Для исключения индуцированного опухолью гидронефроза рекомендуется выполнять MP-урографию с контрастированием.
Как известно, лучевая терапия может осложняться формированием прямокишечно-маточных и пузырно-маточных свищей. Если на основании клинических проявлений подозревается развитие подобных осложнений, необходимо выполнять МРТ с контрастным усилением. До и после введения контрастного вещества выполняют Т1-ВИ в сагиттальной и аксиальной плоскостях. Для получения постконтрастных изображений сбор данных следует начинать через 60 с после введения препарата — в венозную фазу. В типичных случаях фистулы имеют вид нитевидных ходов с гипоинтенсивным просветом и стенкой, накапливающей контрастный препарат. Вспомогательными в выявлении фистул являются Т2-ВИ в последовательности IR (Inversion Recovery — инверсия—восстановление), при которых происходит обнуление сигнала от жировой ткани.
Книга "МРТ. Органы малого таза у женщин. Руководство для врачей. Практическая магнитно-резонансная томография"
Авторы: Г. Е. Труфанов, В. А. Фокина
В руководстве рассмотрены вопросы клинической анатомии малого таза у женщин. Представлены нормальная анатомия и магнитно-резонансная анатомия матки, яичников, маточных труб и влагалища. Изложены методические аспекты высокопольной МРТ малого таза.
Описаны преимущества МРТ в диагностике и дифференциальной диагностике доброкачественных и злокачественных опухолей женских половых органов. Подробно изложена магнитно-резонансная семиотика опухолей. Рассмотрены возможности МРТ при синдроме тазовых болей и бесплодии. Отдельные главы посвящены МРТ, используемой для распознавания аномалий развития матки и придатков, и безопасности проведения МРТ у беременных, а также применению методик магнитно-резонансной пельвиометрии и фетометрии с диагностической целью.
Книга предназначена специалистам по лучевой диагностике, акушерам, гинекологам, репродуктологам, а также может быть рекомендована для подготовки в системе дополнительного профессионального образования.
Содержание книги "МРТ. Органы малого таза у женщин. Руководство" - Г. Е. Труфанов, В. А. Фокина
Глава 1. Отдельные вопросы клинической анатомии женского малого таза
1.1. Морфологическое и клиническое деление малого таза у женщин
1.2. Задний отдел
1.3. Передний отдел
1.4. Средний отдел
1.5. Тело промежности
Глава 2. Методика магнитно-резонансной томографии малого таза у женщин
2.1. Подготовка и укладка пациентки
2.2. Радиочастотные катушки
2.3. Импульсные последовательности
2.4. Протокол сканирования
Глава 3. Нормальная и магнитно-резонансная анатомия органов женского малого таза
3.1. Эмбриональное развитие и нормальная анатомия матки
3.2. Магнитно-резонансная анатомия матки, яичников, маточных труб и влагалища
Глава 4. Магнитно-резонансная диагностика аномалий развития матки, придатков и влагалища
4.1. Патогенез
4.2. Классификация
4.3. Аномалии развития матки
4.4. Аномалии развития придатков матки
4.5. Аномалии развития маточных труб
4.6. Аномалии развития влагалища
4.7. Синдром Майера-Рокитанского-Кюстера-Хаузера
4.8. Аплазия влагалища при функционирующей матке
Глава 5. Магнитно-резонансная диагностика доброкачественных заболеваний матки
5.1. Миома матки
5.2. Аденомиоз матки
5.3. Доброкачественные заболевания шейки матки
5.4. Доброкачественные образования придатков матки
5.5. Неопухолевые заболевания придатков матки
5.6. Доброкачественные заболевания влагалища
5.7. Эндометриоз
Глава 6. Магнитно-резонансная диагностика злокачественных опухолей
6.1. Рак тела матки
6.2. Рак шейки матки
6.3. Редкие гистологические типы рака шейки матки
6.4. Злокачественные опухоли придатков матки
6.5. Неэпителиальные злокачественные опухоли яичников
6.6. Злокачественные опухоли маточных труб
6.7. Злокачественные опухоли влагалища
Глава 7. Магнитно-резонансная томография в диагностике поражения лимфатических узлов
7.1. Лимфатические узлы при магнитно-резонансной томографии в норме
7.2. Магнитно-резонансная семиотика патологически измененных лимфатических узлов
Глава 8. Магнитно-резонансная томография при синдроме тазовых болей
8.1. Гинекологические причины тазовых болей
8.2. Негинекологические причины тазовых болей
Глава 9. Магнитно-резонансная томография малого таза у женщин с бесплодием
9.1. Нормальная анатомия и физиология маточных труб
9.2. Методика магнитно-резонансной томографии
9.3. Наиболее часто встречающиеся патологические изменения при бесплодии
Глава 10. Магнитно-резонансная томография и беременность
10.1. Факторы риска магнитно-резонансной томографии при беременности
10.2. Безопасность проведения магнитно-резонансной томографии у беременных
10.3. Магнитно-резонансная пельвиометрия и фетометрия
10.4. Магнитно-резонансная томография в диагностике часто встречающихся неотложных состояний у беременных








0 комментариев