Иммунная система человека и защита организма от инфекций. Лекция для врачей
Отрывок из книги "Микробиология и иммунология для стоматологов" - Леонтьев В. К.
В книге "Микробиология и иммунология для стоматологов" - Леонтьев В. К. освещены современные представления о клеточном, тканевом и гуморальном иммунитете полости рта, иммунном ответе организма. Во второй и в третьей частях основное внимание уделено заболеваниям, вызванным микроорганизмами полости рта, а также ответным реакциям организма человека, средствам лечения и профилактики стоматологических инфекций.
Введение
Для защиты от патогенных микробов организм человека использует ряд механизмов. К ним относятся защитные факторы, действующие до или после проникновения возбудителя в организм хозяина (рис. 2.1).
Попавший во внутреннюю среду организма микроб должен быть распознан иммунной системой как чужеродная частица и уничтожен. Защитные механизмы хозяина можно разделить на две взаимодополняющие системы. Если система врожденного иммунитета (естественная резистентность) действует однотипно, независимо от предшествующей встречи с возбудителем, то система приобретенного иммунитета при первой встрече распознает и «запоминает» возбудителя, чтобы на повторную встречу с ним ответить быстрой и специфичной реакцией. Обе системы действуют согласованно и направлены на распознавание и устранение возбудителя. Основные свойства приобретенного иммунитета — быстрота и высокая специфичность распознавания, а также способность запоминать возбудителя, однако, по мере накопления новых данных о механизмах защиты, границы между двумя системами становятся все менее четкими.
В рожденный иммунитет
Для проникновения в ткани организма микробы должны преодолеть его механические барьеры, в большинстве случаев — это покрытые эпителием слизистые оболочки (рис. 2.2).
В тканях находятся разнообразные клетки (рис. 2.3) и молекулы (табл. 2.1), опосредующие неспецифическую, или раннюю, защиту против внедрившихся микробов.
Таблица 2.1. Защитные молекулы системы врожденного иммунитета

Рис. 2.1. Основные защитные механизмы

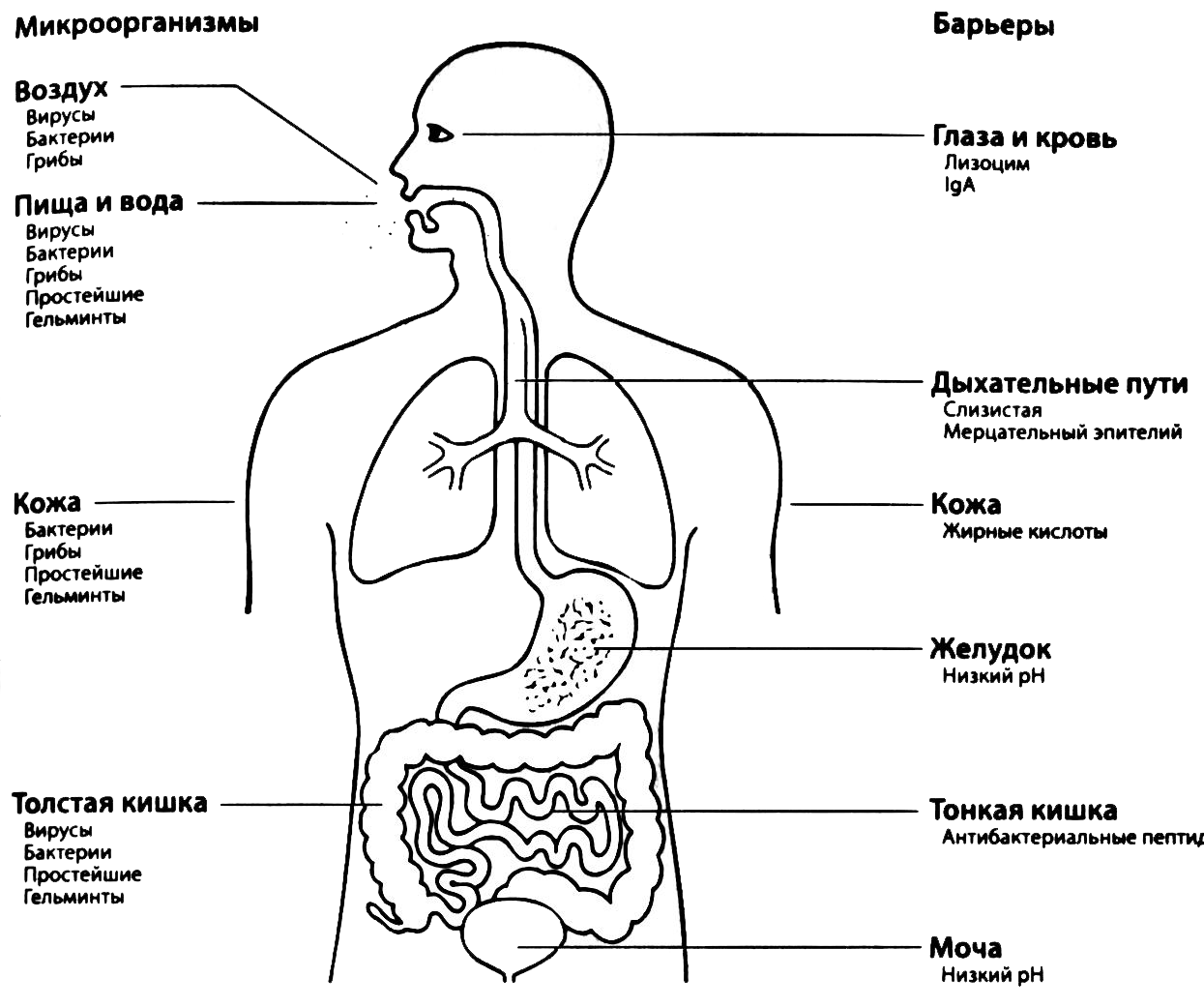
Рис. 2.2. Внешние факторы защиты. Вдыхая воздух и употребляя пищу и питье, человек постоянно контактирует с множеством микробов (в основном с бактериями и вирусами). Кожа, покрытая эпидермисом, представляет собой механический барьер для микробов. Бактерицидные секреты кожи, кислое содержимое желудка, слизь и работа ресничек мерцательного эпителия дыхательных путей препятствуют прикреплению и, следовательно, колонизации микробами этих тканей. Присутствующий в крови и секретах лизоцим, разрушая клеточную стенку, вызывает гибель многих видов бактерий. Другим важнейшим фактором защиты слизистых является IgA (см. раздел, посвященный антителам). По J. Н. L. Playfair and Р. М. Lydyard, Medical Immunology Made Memorable, 2nd ed. (Churchill Livingstone, Edinburgh, United Kingdom, 2000), публикуется с разрешения издательства Elsevier Science
Клетки системы естественной Резистентности
Фагоциты
Способностью к фагоцитозу обладают типа клеток — мигрирующие полиморфноядерные лейкоциты (ПЯЛ) (составляют большинство гранулоцитов крови) и макрофаги. В отличие от ПЯЛ, макрофаги. образующиеся из циркулирующих в крови моноцитов, представляют популяцию оседлых фагоцитов разных тканей и органов. При контакте с фагоцитами микробы быстро поглощаются и уничтожаются с помощью лизосомальных ферментов. Существует целый ряд молекул, способных прикрепляться к поверхности микробов (опсонизация) и затем прочно связываться с фагоцитами, ускоряя, таким образом, фагоцитоз. В качестве молекул, покрывающих поверхность микроба (опсонинов), могут выступать компоненты комплемента и антитела (см. ниже).
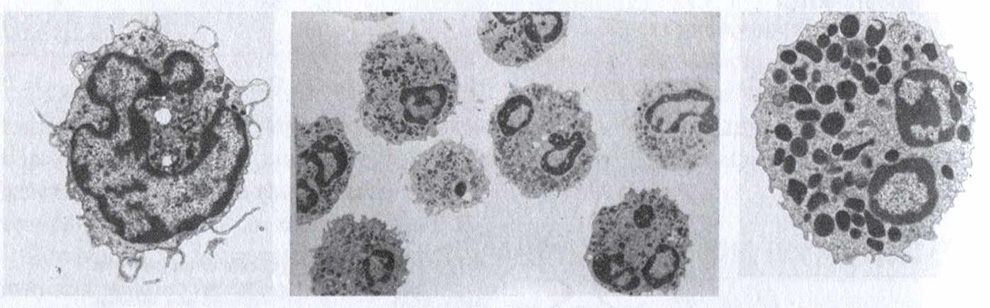
Рис. 2.3. Клетки врожденного иммунитета. ПЯЛ составляют многочисленную популяцию фагоцитов, циркулирующих в крови (слева), в то время как макрофаги (в центре) обеспечивают защиту разных тканей и органов. Тучные клетки (справа) — важнейшие участники острой воспалительной реакции, они присутствуют во всех тканях, однако больше всего их в слизистых (в lamina propria)
NK-КЛЕТКИ
Естественные киллеры (NK-клетки) — это крупные, похожие на лимфоциты клетки. Они распознают инфицированные вирусами клетки хозяина и при контакте с ними выделяют вещества, индуцирующие апоптоз. При этом вирусные частицы остаются внутри погибшей клетки, которая затем фагоцитируется.
Тучные клетки
Тучные клетки находятся во всех участках организма, однако больше всего их в эпителиальных тканях. Крупные цитоплазматические гранулы тучных клеток содержат биологически активные вещества (например, гистамин), играющие важную роль в развитии острой воспалительной реакции. Под действием активированных компонентов комплемента и при связывании находящихся на поверхности тучных клеток антител определенного класса (IgE) с антигеном (см. ниже) происходит быстрое высвобождение содержимого этих гранул.
Молекулы естественной защиты
Комплемент
Система комплемента включает около 20 разных белков, в том числе регуляторных. Комплемент участвует в трех важнейших защитных реакциях — воспалении, фагоцитозе и лизисе микробных клеток. Для функционирования системы комплемента необходима его «активация», которая, подобно активации системы свертывания крови, носит «каскадный» характер (рис. 2.4).
Система комплемента активируется при непосредственном контакте с микробами (альтернативный и лектиновый пути активации) или связанными с ними антителами (классический путь активации, см. ниже). При активации комплемента тем или иным путем важнейший его компонент, СЗ, присутствующий в сыворотке в высокой концентрации (около 1 г/л), подвергается ферментативному расщеплению, или активации, с образованием двух фрагментов — СЗa и СЗb. Если это происходит на поверхности бактерий, СЗb действует как опсонин, активируя фагоцитоз. Отщепившийся при этом СЗа вместе с С5а активирует тучные клетки и вызывает хемотаксис фагоцитов (нейтрофилов) к месту внедрения бактерий. В дальнейшем из компонентов С5-С9 формируется так называемый «мембраноатакующий комплекс», образующий отверстия в оболочке бактерий, что приводит к их лизису и гибели.
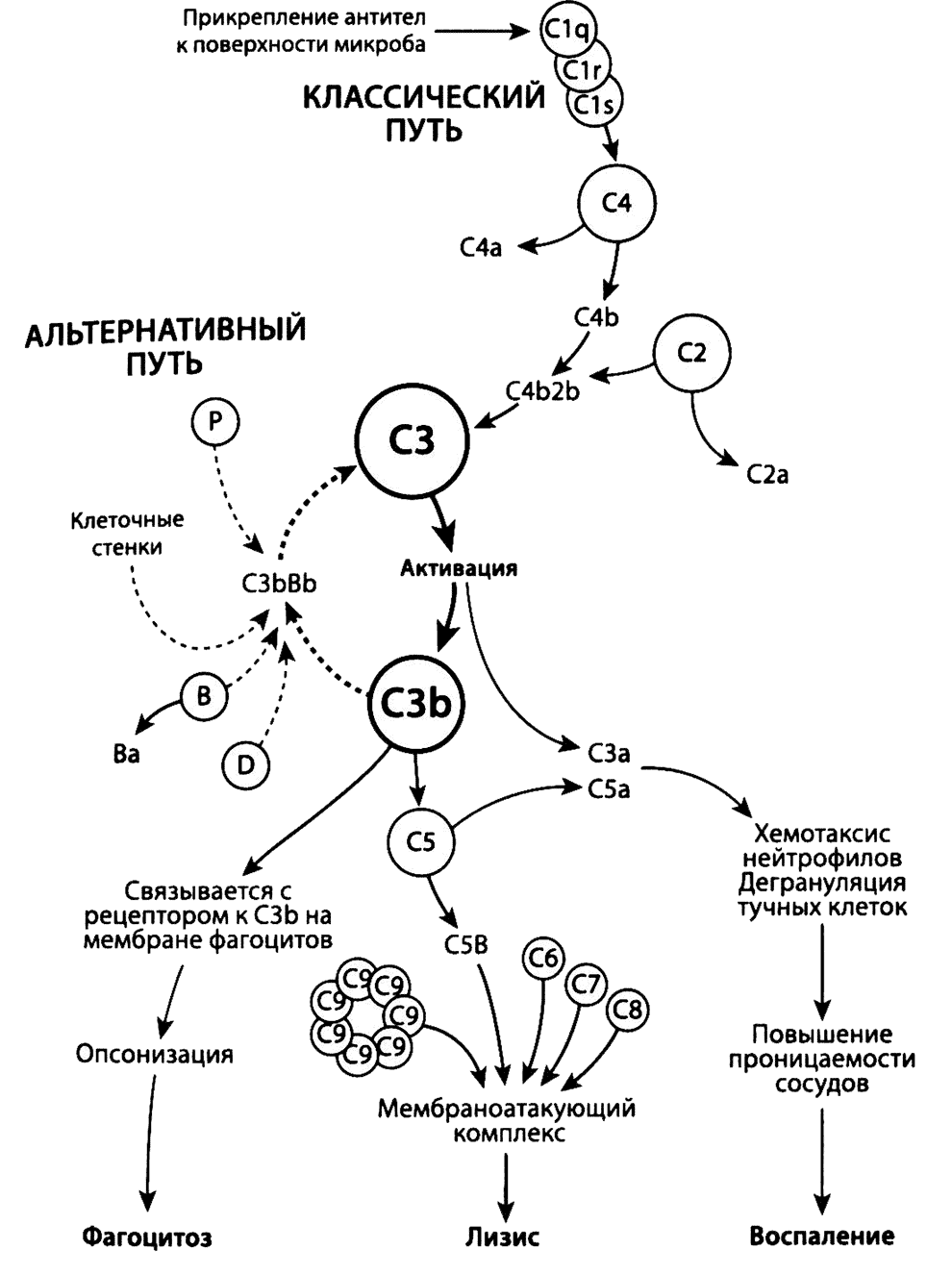
Рис. 2.4, Система комплемента. Показано расщепление важнейшего компонента, СЗ, ферментами (конвертазами) на фрагменты СЗа и СЗb при активации комплемента по альтернативному и классическому пути (конвертазами). Активацию по классическому пути запускают антитела. Активация комлемента по альтернативному пути идет очень медленно, однако этот процесс может ускоряться, если развивается на поверхностях, например бактерий. При активации по лектиновому пути (не показано) маннозосвязывающий лиганд соединяется с маннозными остатками на поверхности микроорганизмов, что приводит к образованию фермента конвертазы, расщепляющей компонент СЗ. В свою очередь расщепление СЗ запускает каскад реакций, приводящих к фагоцитозу или лизису микроорганизмов развитию воспаления (внизу). Активация комплемента находится под контролем ингибирующих факторов, которые предотвращают развитие этого процесса на поверхности собственных
Белки острой фазы
Белки острой фазы — это сывороточные белки, концентрация которых во время инфекций повышается. Они важны не только для защиты организма, но и для восстановления пораженных микроорганизмами тканей.
В табл. 2.2 перечислены некоторые важные белки острой фазы и их функции. Эти белки вырабатываются в печени под действием цитокинов (например, интерлейкина-1 [ИЛ-1], фактора некроза опухоли альфа [ФНО- α] и ИЛ-б), секретируемых макрофагами после контакта с микробами.

Цитокины
Цитокины представляют собой небольшие белки (обычно менее 15 кДа), обладающие разнообразными функциями, включая способность вызывать лихорадку (ИЛ-1) или усиливать воспалительную реакцию (ФНО-α). Выполняя роль химических посредников, осуществляющих межклеточные взаимодействия, цитокины имеют огромное значение для приобретенного иммунитета (см. ниже). Такие цитокины, как интерфероны, участвуют во врожденной противовирусной защите. Это целое семейство белков, синтезируемых ядросодержащими клетками организма в основном во время вирусной инфекции и предотвращающих размножение вирусов в других клетках, способствуя локализации инфекции. Интерфероны (ИФ) подавляют трансляцию РНК, нарушая таким образом синтез вирусных белков. В то время как интерфероны α и β вырабатываются большинством ядросодержащих клеток, ИФ-γ — только NK-клетками и клетками приобретенного иммунитета, Т-лимфоцитами. Позднее была открыта целая группа цитокинов, названных хемокинами, которые обеспечивают хемотаксис и активацию разных типов клеток, включая лимфоциты, макрофаги ПЯЛ. Фагоциты и эпителиальные клетки вырабатывают большое множество других противомикробных молекул, включая дефензины (см. гл. 10).
Распознавание
Первый и очень важный этап защитной реакции врожденного иммунитета заключается в том, что микроб распознается как чужеродное, или «не свое». Фагоциты для этого используют так называемые паттерн-распознающие рецепторы, включая рецепторы маннозы, скэвенджер-рецепторы и Toll-подобные рецепторы (см. гл. 10). Некоторые бактерии, например лишенные капсулы, распознаются компонентами комплемента, вызывая его прямую активацию по альтернативному и лектиновому пути (см. рис. 2.4).
Острое воспаление
Острое воспаление, развивающееся в ответ на инфекцию, представляет собой классическую защитную реакцию врожденного иммунитета. Оно обеспечивает быструю доставку к месту проникновения микроба защитных факторов крови (рис. 2.5).
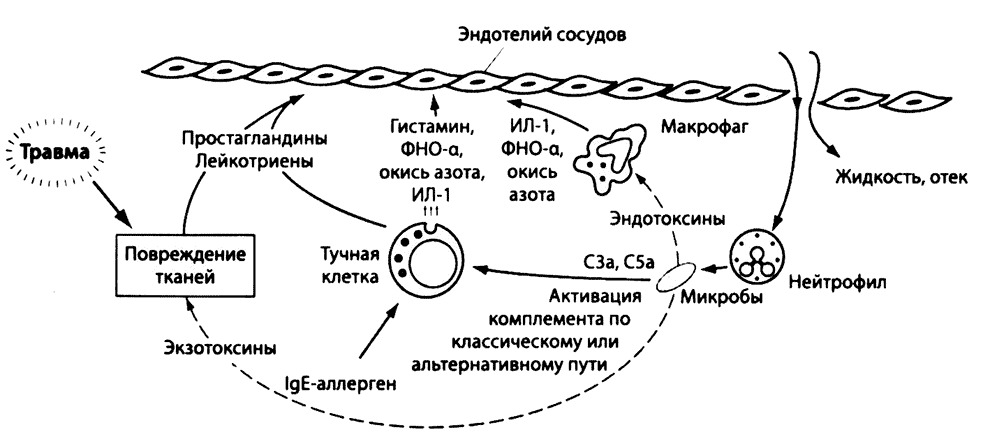
Рис. 2.5. Острая воспалительная реакция. Острое воспаление — это сложная многоэтапная реакция на повреждение клеток, имеющая сходное течение при повреждении тканей, обусловленном инфекцией или механическими факторами. Так, непосредственное поражение клеток микробными экзотоксинами ведет к выбросу медиаторов воспаления (простагландинов, лейкотриенов), повышающих проницаемость сосудистой стенки. Важнейшими участниками воспаления являются тучные клетки. Их активация при связывании через паттерн-распознающие рецепторы с микробами приводит к секреции провоспалительных цитокинов, включая ФНО-α, а активация под действием комплемента активированного любым из трех перечисленных выше путей путями (см. выше), — к бурному выявлению таких медиаторов воспаления, как гистамин. Стимулировать высвобождение медиаторов воспаления тучными клетками могут комплексы IgE с аллергенами и нейропептиды. Макрофаги под влиянием микробных эндотоксинов выделяют цитокины ИЛ-1 и ФНО-α, вызывающие расширение сосудов. Высвобождение разнообразных медиаторов приводит к нарушению контактов между эндотелиальными клетками, усилению адгезии ПЯЛ и моноцитов к эндотелию, их миграции в окружающие ткани и фагоцитозу микробов. Из крови в очаг развития воспалительной реакции поступает жидкость, содержащая фибриноген, антитела и другие продукты, обеспечивающие защиту тканей в период их восстановления.
Лимфоидная система
Система врожденного иммунитета отличается быстродействием и часто бывает способна уничтожить большую часть проникающих в организм микробов. Однако при этом, как правило, активируется и вторая линия защиты, представленная механизмами приобретенного иммунитета. Главную роль в нем играют лимфоциты, находящиеся в специализированной лимфоидной ткани и крови. Общий объем лимфоидной ткани у взрослого человека сопоставим с объемом футбольного мяча. Ее населяют несколько популяций лимфоцитов, каждой из которых присущи свои функции. Лимфоциты рециркулируют по всему организму и распознают чужеродные (в том числе микробные) молекулы, или антигены, с помощью специализированных рецепторов, непохожих на рецепторы клеток врожденного иммунитета (см. ниже).
Гетерогенность популяции лимфоцитов
Все лимфоциты делятся на две основные популяции — Т-лимфоциты (созревающие в тимусе) и В-лимфоциты (созревающие в костном мозге). Обе популяции лимфоцитов представляют собой мелкие клетки с узким ободком цитоплазмы, морфологи-чески неотличимые друг от друга. В-лимфоциты превращаются в плазматические клетки, специализирующиеся на выработке антител, которые защищают организм от внеклеточных микробов. Т-лимфоциты (Т-хелперы, Th, и цитотоксические Т-лимфоциты, Тс), напротив, участвуют в борьбе с внутриклеточными микробами — вирусами и некоторыми бактериями. Более подробно функции лимфоцитов описаны ниже. Разные популяции лимфоцитов отличаются друг от друга по поверхностным молекулам, играющим важную роль в их функционировании. Более узкие популяции Т-лимфоцитов (Т-хелперы 1-го и 2-го типов, или Th1 и Th2) различаются по спектру секретируемых ими цитокинов. Основные маркеры разных популяций лимфоцитов представлены в табл. 2.3.
Таблица 2.3. Маркеры лимфоцитов
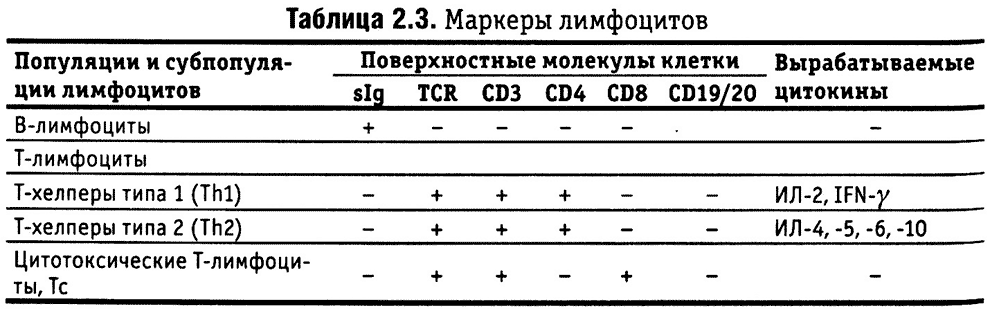
Лимфоидные органы и ткани
В 1 л крови содержится около 1-2 млрд лимфоцитов, что в 5-10 раз меньше, чем количество мигрирующих фагоцитов (ПЯЛ) системы врожденного иммунитета. Помимо крови, лимфоциты находятся в лимфоидных органах и тканях, в том числе в лимфоидной ткани, ассоциированной со слизистыми, выстилающими три основных тракта организма (желудочно-кишечный, мочеполовой и дыхательный). Поскольку этими путями в организм проникает большинство микробов, не удивительно, что более 50% лимфоидной ткани связано со слизистыми оболочками. Данный тип лимфоидной ткани (MALT, от англ, mucosa-associated lymphoid tissues) подробно описан в главе 10. На рис. 2.6 показано распределение лимфоидной ткани в организме.
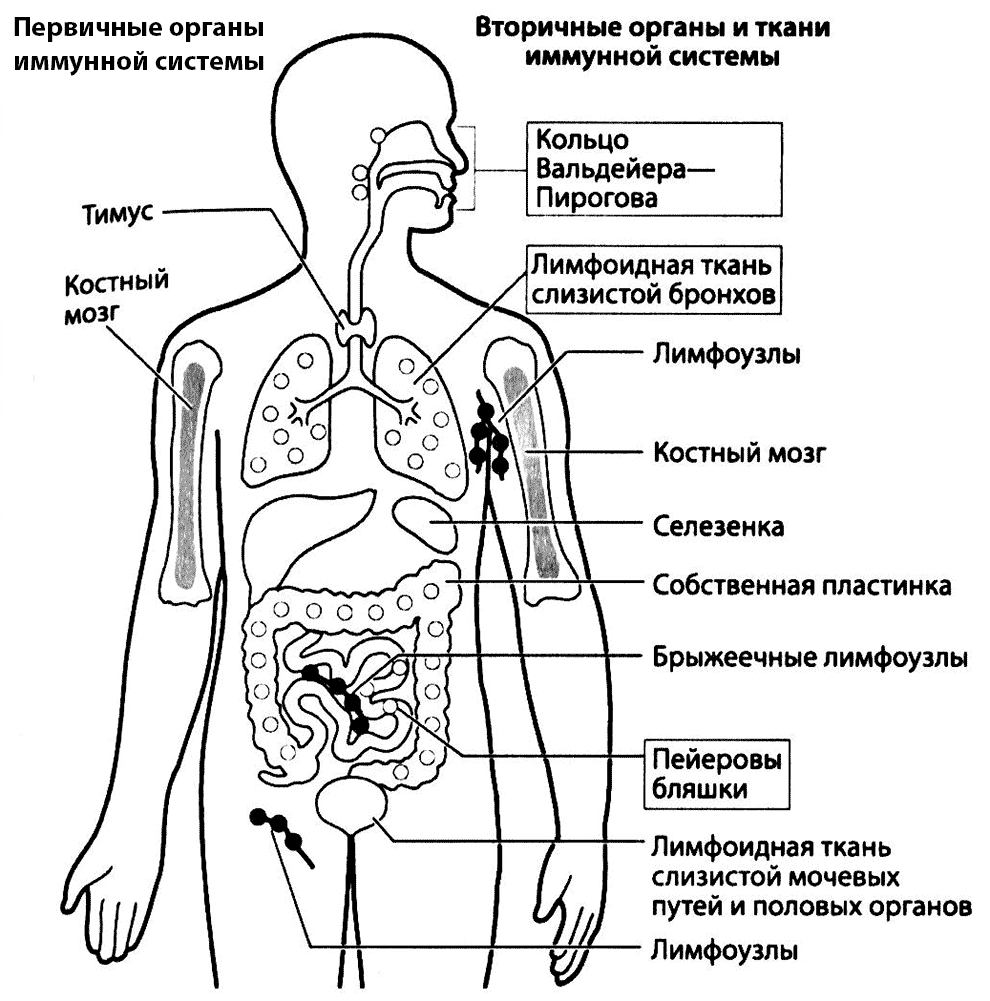
Рис. 2.6. Основные лимфоидные органы и ткани. Т- и В-лимфоциты созревают из стволовых клеток в первичных (центральных) лимфоидных органах — тимусе и костном мозге, а затем мигрируют во вторичные (периферические) органы, где осуществляют свои функции. К вторичным органам иммунной системы относится, в частности, MALT (показана в рамках)
Лимфатические узлы имеют размер от 1 до 10 мм и располагаются поверхностно или глубоко в тканях. В лимфоидных органах Т- и В-лимфоциты занимают разные области и взаимодействуют с другими клетками (например, дендритными), необходимыми для выполнения их функций. На рис. 2.7 показано строение типичного лимфатического узла. Во вторичных фолликулах лимфоузлов (и других лимфоидных тканей) располагаются «зародышевые центры», в которых находятся В-лимфоциты, пролиферирующие в ответ на контакт с антигеном. Эти органы важны для формирования клеток иммунной памяти. Являясь частью лимфоидной системы, лимфоузлы располагаются в основном в местах соединения лимфатических сосудов, где они действуют как «фильтры», очищающие лимфу от микробов и формирующие направленный против них иммунный ответ.
В селезенке Т- и В-лимфоциты заселяют белую пульпу (рис. 2.8). Иммунологическая функция селезенки заключается в фильтрации крови для ее очистки от микробов и формирования направленного против них иммунного ответа. В отличие от оседлых клеток, лимфоциты рециркулируют между кровью и лимфоидными органами (селезенкой, лимфоузлами). При этом лимфоциты, стимулированные антигеном в MALT, покинув эту ткань, во время рециркуляции стремятся мигрировать туда же (рис. 2.9). Циркулируя по всему организму, лимфоциты с помощью антигенспецифичных рецепторов (см. ниже) «следят» за проникновением в организм микробов. Большую роль в циркуляции лимфоцитов играют расположенные на их поверхности молекулы адгезии, обеспечивающие их связь со специализированными эндотелиальными клетками кровеносных сосудов. Прикрепляясь к этим эндотелиальным клеткам, лимфоциты могут мигрировать между ними, выходя во внесосудистое пространство. В лимфоузлах специализированные эндотелиальные клетки (высокий эндотелий) располагаются в паракортикальной области.
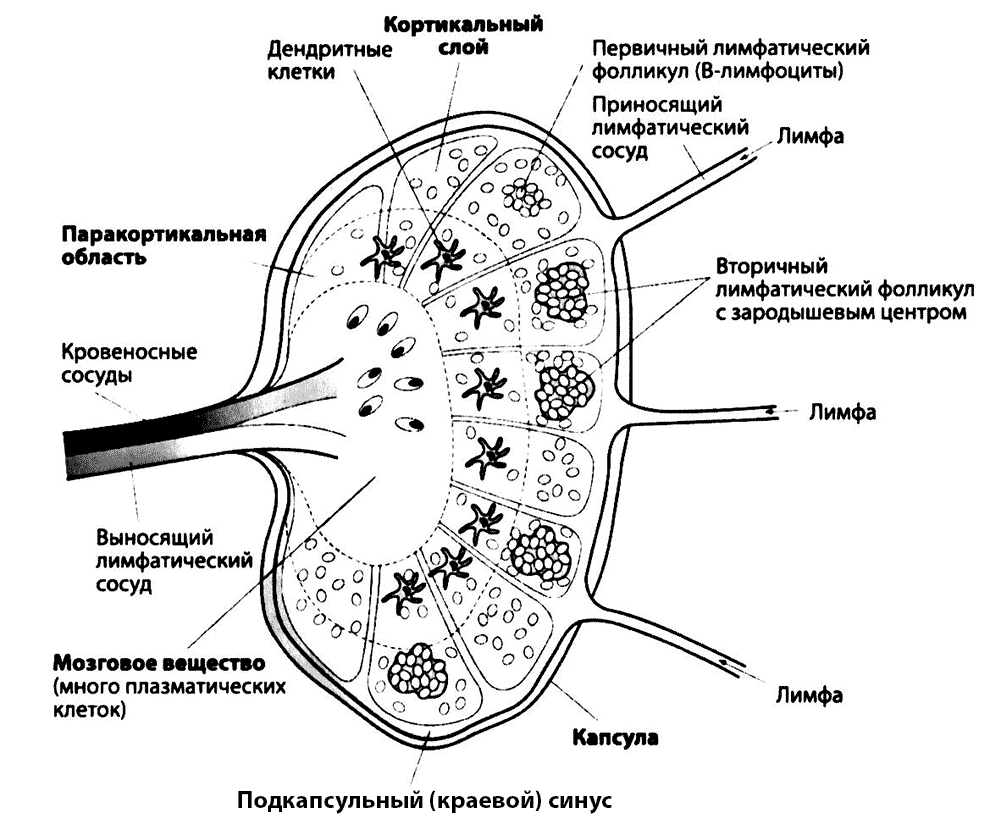
Рис. 2.7. Строение лимфатического узла. Кортикальный (наружный) слой содержит в основном В-лимфоциты, расположенные в лимфатических фолликулах. В некоторых из них, вторичных фолликулах, имеются зародышевые центры, где происходит пролиферация В-лимфоцитов, формирование клеток иммунной памяти, переключение класса антител и созревание аффинности. В кортикальном слое преобладают антигенпредставляющие дендритные клетки, в мозговом — плазматические клетки. Лимфа, поступающая в лимфатический узел по афферентным сосудам, достигает мозгового слоя, откуда попадает в выносящие сосуды. При прохождении через лимфоузел микробы улавливаются обширной сетью фагоцитирующих макрофагов. Эфферентные сосуды доставляют лимфу в грудной проток, откуда она возвращается в кровеносную систему
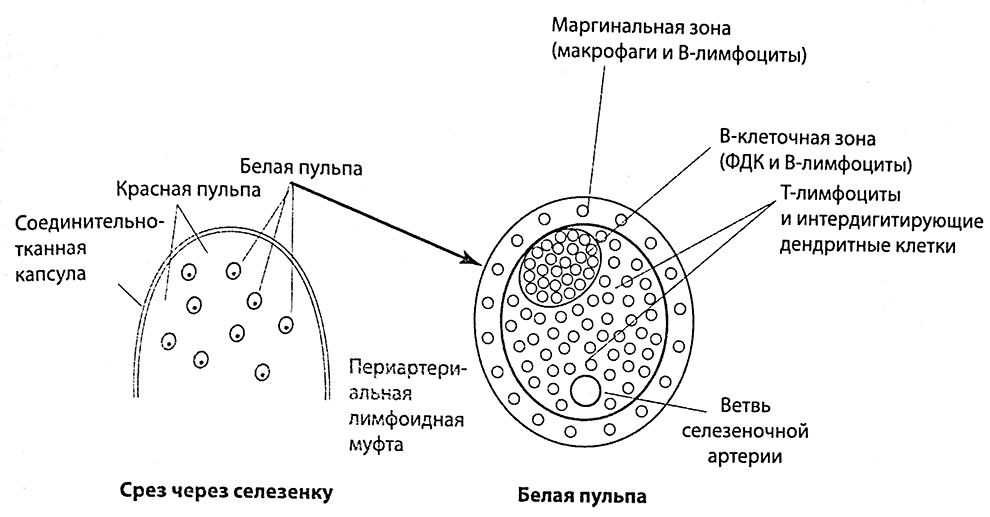
Рис. 2.8. Селезенка. Лимфоциты заселяют белую пульпу, а плазматические клетки и макрофаги чаще обнаруживаются в красной пульпе. Белая пульпа состоит из Т- и В-лимфоцитов, окружающих ветви селезеночной артерии наподобие чехла, который называется периартериолярной муфтой. Снаружи муфты располагаются макрофаги (МФ) и В-лимфоциты. Для функционирования лимфоцитов первичных и вторичных фолликулов важное значение имеют также фолликулярные дендритные клетки (ФДК).
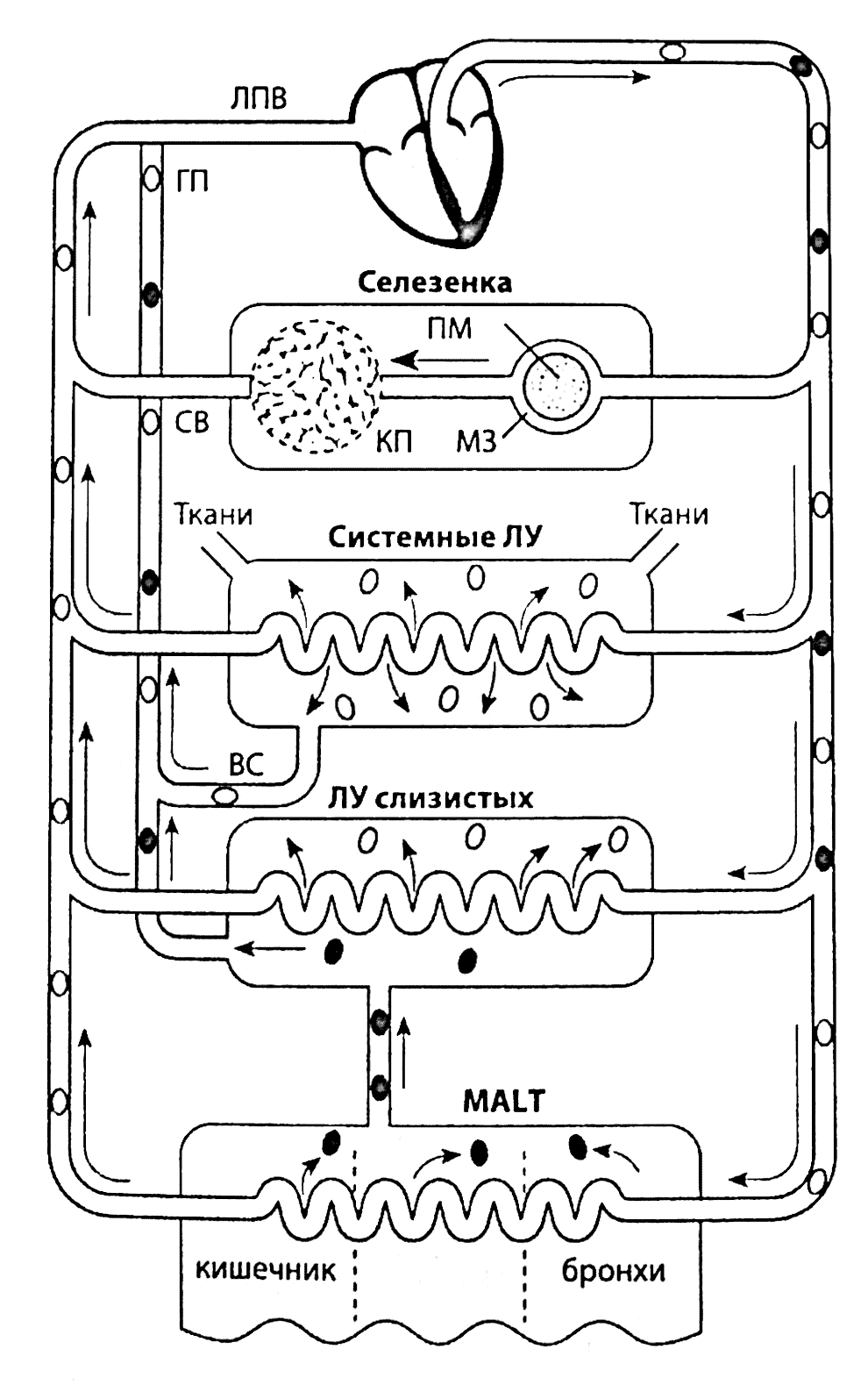
Рис. 2.9. Рециркуляция лимфоцитов. Лимфоциты (белые кружки) поступают в селезенку через маргинальную зону (М3) перартериолярной муфты (ПМ) и покидают ее через селезеночную вену (СВ), лежащую в красной пульпе (КП). Некоторые лимфоциты проникают в лимфоузлы из тканей, однако основная их часть приносится туда с кровью. В зоне, лежащей на границе между корковым и мозговым слоем, имеются капилляры со специализированным эндотелием, которые играют важную роль в рециркуляции лимфоцитов. Покидая лимфоузлы через выносящие лимфатические сосуды (ВС), лимфоциты попадают в грудной проток (ГП), который открывается в левую подключичную вену (ЛПВ), где они вновь попадают в кровоток. Рециркуляция лимфоцитов через MALT имеет свои особенности. Лимфоциты (черные кружки), стимулированные в каком-либо участке, например в кишечнике, через регионарные лимфоузлы попадают в кровоток и возвращаются не только в кишечник, но и в другие органы, выстланные слизистыми оболочками, например бронхи или мочеполовой тракт
Антитела: специфичность, классы и функции
Особенности строения и специфичность антител
Антитела давно известны как важнейшие молекулы, защищающие организм от инфекции. Они состоят из двух одинаковых тяжелых и двух одинаковых легких полипептидных цепей, удерживаемых вместе дисульфидными связями (рис. 2.10).
Как установлено в ранних исследованиях, молекула антитела состоит из двух фрагментов — F(ab)2, содержащего вариабельную часть молекулы, и Fc, кристаллизующегося фрагмента. Одна часть молекулы (N-концевой участок) связывается с антигеном, другая, состоящая из двух тяжелых цепей, выполняет вспомогательную функцию (см. ниже). Во многих случаях антитела играют роль «меток», с помощью которых другие молекулы и клетки иммунной системы распознают и связывают чужеродный материал. Специфичность антител обусловлена различием в строении аминокислотных последовательностей в гипервариабельных участках тяжелой и легкой цепей. Дисульфидные связи внутри этих цепей определяют их доменную структуру: легкая цепь состоит из двух, тяжелая — из четырех или пяти доменов, в зависимости от класса иммуноглобулина (см. ниже). В каждом из двух N-концевых доменов тяжелой и легкой цепей находятся гипервариабельные области, содержащие два разных набора аминокислот. Остальные домены обеих цепей одинаковы у всех антител данного класса. Аминокислотные последовательности гипервариабельной области формируют активный (антигенсвязывающий) центр антитела, который соединяется с частью антигена, называемой антигенной детерминантой, или эпитопом (рис. 2.11).
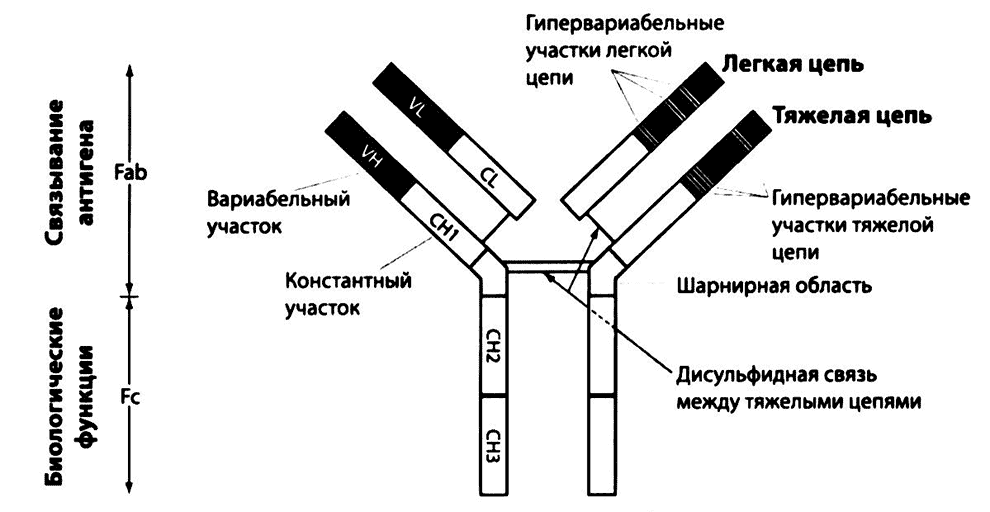
Рис. 2.10. Строение антитела (на примере молекулы IgG). Мономерная молекула иммуноглобулина состоит из двух тяжелых и двух легких цепей, соединенных дисульфидными мостиками, и имеет шарнирную область, придающую молекуле гибкость, необходимую для связывания с антигеном. Специфичность антител связана с Р(аb)2-фрагментом, а их биологические функции (связывание с Fc-peцепторами фагоцитов, активация комплемента и т. д.) — с Fc-фрагментом
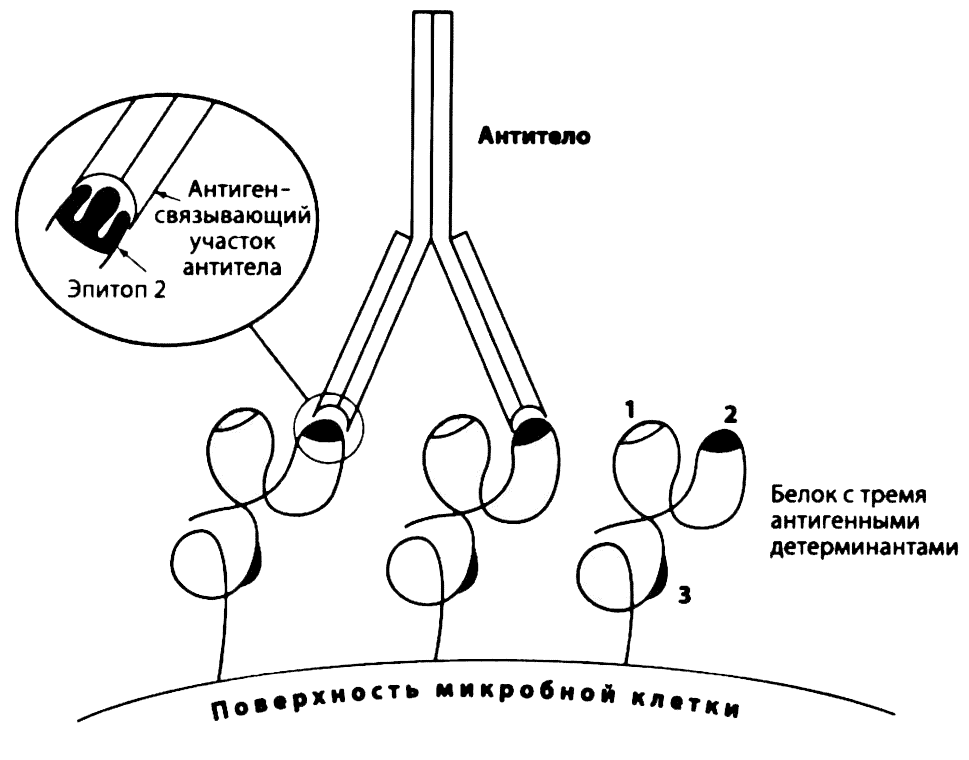
Рис. 2.11. Распознавание антителами антигенных детерминант (эпитопов). Микробные молекулы имеют несколько уникальных участков, которые вызывают выработку антител или развитие клеточного иммунного ответа. Антигенная детерминанта — это минимальный участок антигена, с которым может связаться активный центр антитела. Как показано на рисунке, антитело двумя своими активными центрами связывается с антигенными детерминантами одинаковых белков на поверхности микроба. Антитела распознают трехмерные антигенные детерминанты, а Т-лимфоциты — линейные аминокислотные последовательности
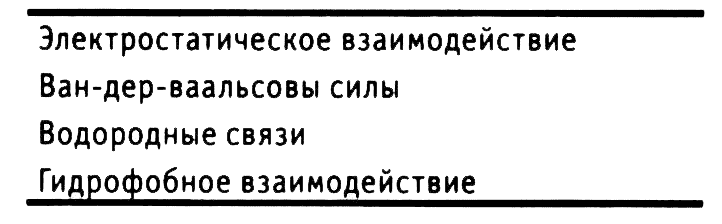
Специфичность активных центров антител обусловлена различием формы, заряда и других физических свойств образующих его аминокислот. Поэтому взаимодействие активного центра с антигенной детерминантой носит, по сути, физический характер (табл. 2.4). Силу такого взаимодействия называют аффинностью. На практике связь двух активных центов одного антитела с двумя антигенными детерминантами сильнее, чем сумма двух отдельных химических взаимодействий. Сила этой связи определяет авидность антител. Максимальной авидностью обладают антитела с несколькими активными центрами. Благодаря структуре антигенраспознающих участков антитела могут связывать антиген в растворе с образованием иммунных комплексов. Обычно эти комплексы удаляются из крови с помощью активированных компонентов комплемента (см. ниже), но в некоторых случаях они могут откладываться в сосудистой стенке, вызывая васкулиты или гломерулонефрит. Иммунные реакции, приводящие к повреждению тканей, называют иммунопатологическими.
Таблица 2.4. Виды химических связей, участвующих во взаимодействии антител с антигенными детерминантами
Классы антител
Другое название антител иммуноглобулины отражает глобулярное строение этих белков и наличие у них иммунологических функций. Все антитела делятся на пять классов, различия между которыми определяются строением тяжелых цепей (табл. 2.5).
Кроме того, антитела разных классов отличаются друг от друга размером, который зависит от количества входящих в их состав мономеров. Так, IgG состоит из одного мономера (рис. 2.10), a IgM - из пяти мономеров, соединенных небольшой полипептидной J-цепью (рис. 2.12). В состав одной молекулы иммуноглобулина могут входить легкие цепи только одного из двух типов, κ или λ.
Таблица 2.5. Классы иммуноглобулинов

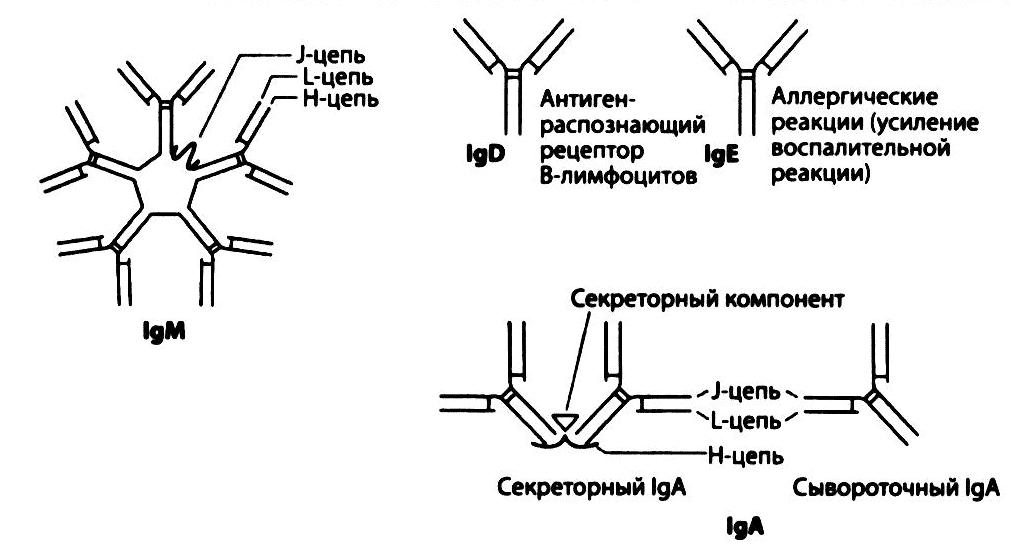
Рис. 2.12. Строение иммуноглобулинов разных классов. Молекула IgM состоит из пяти мономеров (т. е. является пентамерной), представленных двумя тяжелыми и двумя легкими цепями и соединенных небольшой полипептидной J-цепью. Подобно IgG, молекулы IgD и IgE представляют собой мономеры. Циркулирующие в крови IgA также являются мономерами, а секреторные IgA состоят из двух мономеров, соединенных, как и IgM, J-цепью. В состав димерной молекулы IgA входит также секреторный компонент (полипептидная цепь), присоединяющийся к IgA при прохождении через эпителий (рис. 2.13).
Функциональные различия между антителами
Каждый класс иммуноглобулинов выполняет свои функции. Хотя свойства иммуноглобулинов разных классов во многом сходны, в целом они оказывают разное действие на микробы и реализуют его в разных участках организма. При развитии иммунного ответа первым начинает вырабатываться IgM. В связи с крупными размерами IgM присутствуют в основном в крови (табл. 2.5), обеспечивая защиту от попадающих в нее микробов. Иммуноглобулины этого класса с высокой эффектив-остью активируют комплемент по классическому пути (рис. 2.4). Существует даже мнение, что антитела изначально возникли как средство защиты от капсульных микробов, поскольку капсула защищает микробы от действия активированного по альтернативному и пектиновому пути комплемента. На поверхности В-лимфоцитов IgM находятся в виде мономеров и выполняют функцию антигенраспознающих рецепторов.
Антитела другого класса, IgG, являются преобладающими иммуноглобулинами сыворотки. Подобно IgM, они также активируют комплемент. Однако для связывания фрагмента C1q две молекулы IgG должны прикрепляться к поверхности микробной клетки в непосредственной близости друг от друга. Молекулы IgG присутствуют во всех тканях и обладают Уникальной способностью проникать через плаценту в кровь плода, обеспечивая защиту новорожденного до созревания его собственной иммунной системы. Благодаря строению тяжелых цепей (γ-цепей) IgM могут связываться с фагоцитами (и нескорыми другими клетками), имеющими Fc-рецепторы к IgG.
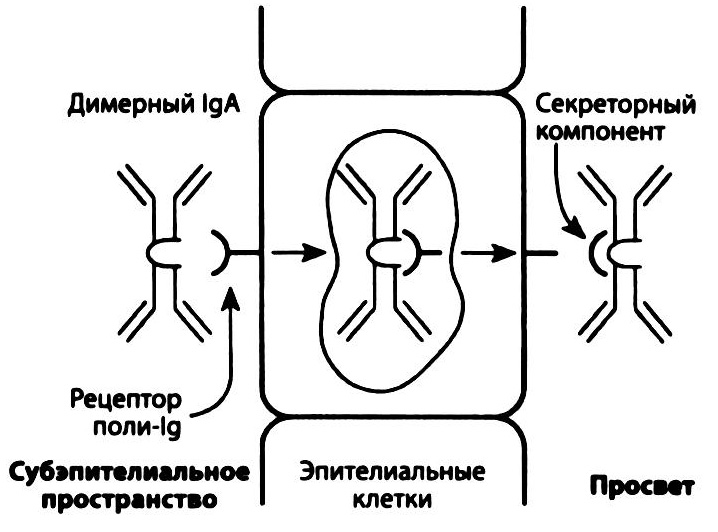
Рис. 2.13. Транспорт IgA на поверхность эпителия. Синтезируемый в собственной пластинке слизистой димерный IgA взаимодействует с поли-Ig рецептором на базальной поверхности эпителия (секреторным компонентом) и с помощью эндосом выносится на его апикальную поверхность. Фрагмент секреторного компонента остается связанным с IgA, защищая его от разрушения протеолитическими ферментами.
Практически все IgD находятся на по-верхности В-лимфоцитов, выполняя, как и IgM, функцию антигенраспознающих рецепторов (рис. 2.12).
Иммуноглобулины A (IgA) существуют в виде мономеров и димеров, в которых мономерные молекулы соединяются J-цепью. С помощью специализированных рецепторов эпителиальных клеток (рис. 2.13) димеры IgA проникают на поверхность слизистых дыхательного, мочеполового и желудочно-кишечного трактов (см. гл. 10).
Иммуноглобулины Е (IgE) обладают «анафилактической» активностью. Они связываются с тучными клетками через Fc-рецепторы и усиливают острую воспалительную реакцию (рис. 2.5). Считается, что IgE участвуют в защите участков слизистых, особенно подверженных гельминтной инвазии. При связывании IgE с антигенными детерминантами гельминтов тучные клетки активируются, вызывая миграцию эффекторных клеток и молекул к месту инвазии.
Противомикробная защита с участием антител
Прямое действие антител
Предотвращение контакта микробов и токсинов с клетками
Патогенные микробы обладают способностью связываться с эпителиальными клетками и благодаря этому проникать в организм, даже если целостность барьеров кожи и слизистых не нарушена в результате травмы, укуса насекомого и т.д. Такому связыванию препятствуют IgA, в большом количестве присутствующие на поверхности слизистых (рис. 2.14; см. также гл. 10). Вирусы, которые стремятся проникнуть через барьерные ткани, связываются определенными участками с некоторыми специфическими молекулами на поверхности клеток. Антитела (особенно IgG и IgM), распознающие такие участки, препятствуют этому процессу (негтрализация вирусов). Таким же способом антитела предотвращают связывание бактерий с клетками. Кроме того, IgM и IgG могут препятствовать связыванию бактериальных экзотоксинов с клетками макро-организма.
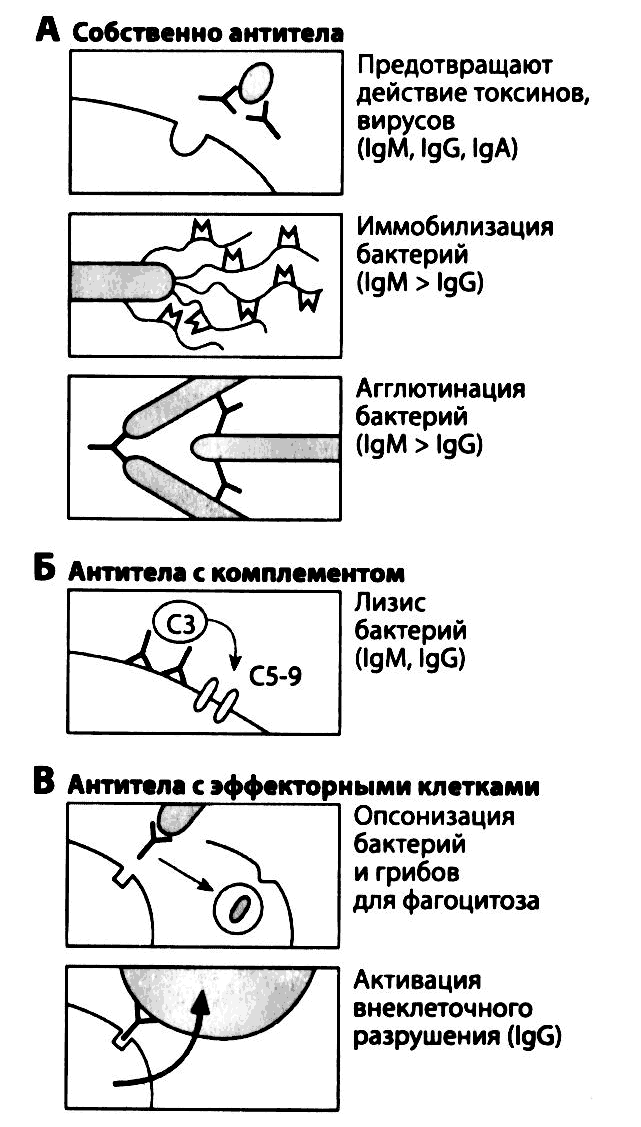
Рис. 2.14. Противомикробная защита, опосредованная антителами. (А) Собственное действие антител: IgM и IgG могут предотвращать прикрепление к клеткам вирусов, бактерий или их токсинов, а также приводить к иммобилизации бактерий посредством связывания со жгутиками. Кроме того, IgG и особенно IgM (имеющий 10 активных центров) могут перекрестно связывать антигенные детерминанты на поверхности микроорганизмов, вызывая их агглютинацию. (Б) Действие антител в сочетании с комплементом: в результате активации комплемента под действием антител компоненты С5-С9 образуют мембраноатакующий комплекс, вызывающий лизис бактерий. Следует отметить, что СЗb играет также роль опсонина, усиливающего фагоцитоз (не показано). (В) Действие антител в сочетании с эффекторными клетками: антитела (особенно IgG), связываясь с Fc-рецепторами фагоцитов, действуют как опсонины. Взаимодействие IgG, связанных с поверхностью крупных паразитов (например, гельминтов), с Fc-рецепторами фагоцитов вызывает выброс этими клетками ферментов и т.д.
Иммобилизация бактерий путем блокирования жгутиков и агглютинации
Такой способ противобактериальной защиты могут осуществлять IgM, IgG и IgA, однако наиболее эффективен в этом отношении IgM, являющийся пентамером.
Цитолитическое действие антител, опосредованное комплементом
Полная активация комплемента по классическому пути приводит к бактериолизу под действием мембраноатакующего комплекса (рис. 2.4).
Действие антител, опосредованное клетками
Опсонизация делает микробы более уязвимыми для фагоцитов
Фиксированные на микробной поверхности IgG могут связываться своими Fc-фрагментами с Fc-рецепторами фагоцитов, тем самым активируя фагоцитоз. Фрагмент СЗb, образующийся при активации комплемента по классическому пути (с участием IgG или IgM) и фиксирующийся на поверхности микробов, также относится к опсонинам, поскольку фагоциты несут рецепторы к нему. Иммуноглобулины А также могут опсонизировать микробы и связываться с Fc-рецепторами, однако активации комплемента они не вызывают.
Антителозависимая цитотоксичность
Этот вид цитотоксичности обусловлен высвобождением клетками-эффекторами молекул, вызывающих гибель клеток-мишеней. Лучшим примером защиты такого типа служит уничтожение крупных паразитов, которые не могут быть фагоцетировать. Эзофилы, связываясь через Fс-рецепторы с антителами (в основном IgG), которые покрывают поверхность гельминта, выбрасывают ферменты, разрушающие его покровные ткани и приводящие к его гибели. Впоследствии его фрагменты уничтожаются с помощью фагоцитоза.
Распознавание антигена лимфоцитами
В-лимфоциты
Выполнение лимфоцитами своих функций требует наличия на их поверхности специализированных рецепторов. У В-лимфоцитов такими рецепторами служат молекулы иммуноглобулинов. На поверхности каждого В-лимфоцита находится около 105молекул иммуноглобулинов одной и той же специфичности, т. е. молекул с идентичными гипервариабельными областями тяжелой и легкой цепей. Рецепторы разных В-лимфоцитов отличаются друг от друга по специфичности, и разнообразие этих молекул достигает порядка 108вариантов. Столь широкое разнообразие формируется во время созревания В-лимфоцитов и достигается путем случайного комбинирования нуклеотидных последовательностей, кодирующих гипервариабельные области антител.
В связи со специфичностью В-лимфоцитов лишь небольшое их количество (несколько тысяч) может распознавать антигены определенного микроба с последующей пролиферацией и превращением в плазматические клетки. Этот процесс, называемый клональной селекцией, требует участия Т-хелперов (см. ниже) и приводит к образованию множества В-лимфоцитов (клона) из одной клетки, стимулированной антигеном (рис. 2.15).
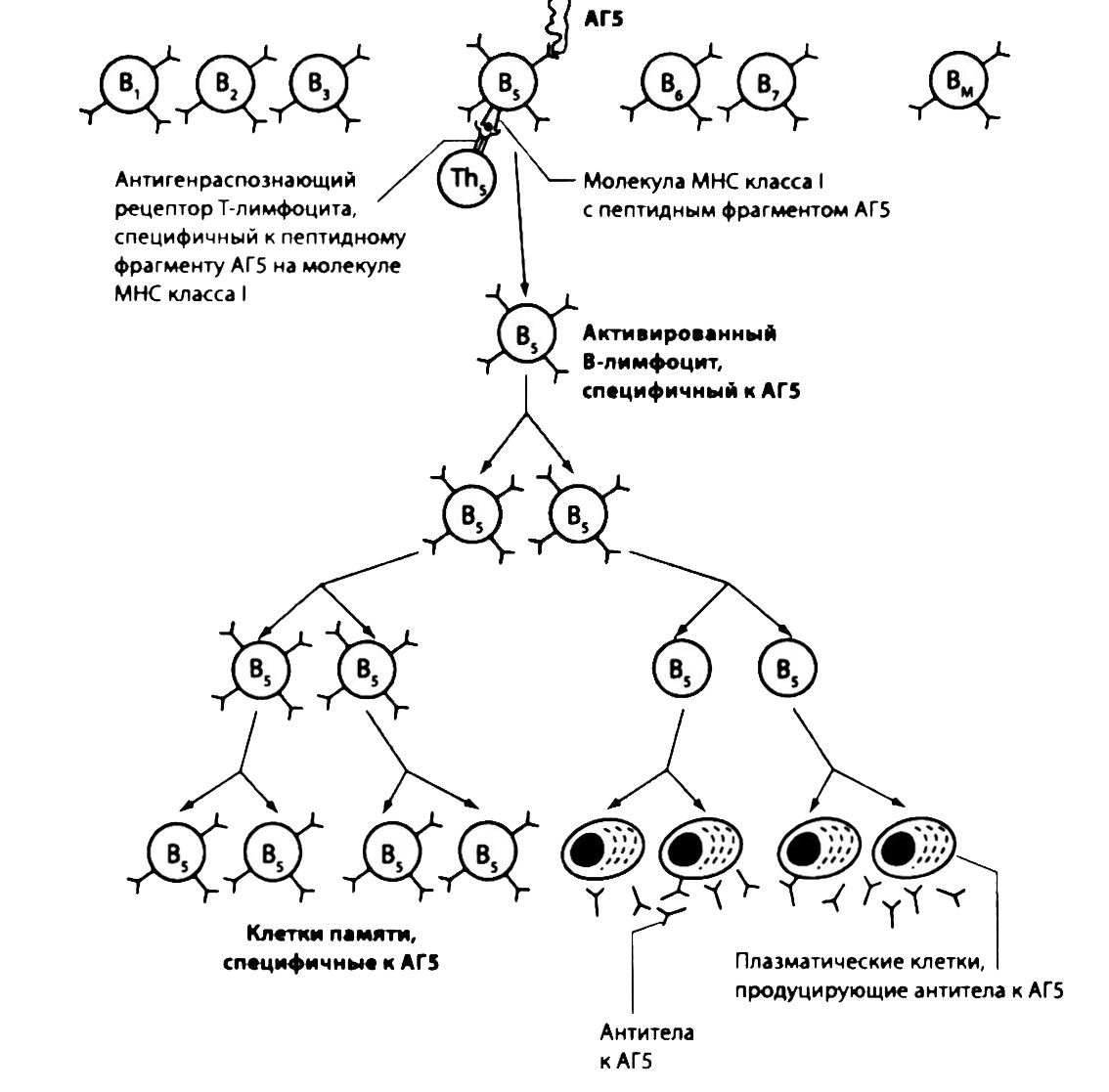
Рис. 2.15. Клональная селекция, клетки памяти и плазматические клетки. Каждый В-лимфоцит специфичен к определенной антигенной детерминанте. После специфичного связывания с антигенными детерминантами В-лимфоциты активируются и начинают пролиферировать под действием Th, распознавших антигенные пептидные фрагменты, представленные молекулами HLA II класса на поверхности В-лимфоцитов (см. ниже). Часть образовавшегося клона В-лимфоцитов превращается в плазматические клетки («фабрики по производству антител»), синтезирующие иммуноглобулины той же специфичности, которой обладали антигенраспознающие рецепторы материнской клетки. Остальные В-лимфоциты этого клона становятся клетками памяти, которые благодаря свой многочисленности обеспечивают более быстрый ответ на повторный контакт с тем же микроорганизмом. Следует отметить, что на схеме показан ответ лишь одного В-лимфоцита, а возбудитель может иметь тысячи антигенных детерминант, распознаваемых разными В-лимфоцитами
Часть клона превращается в антителопродуцирующие плазматические клетки, остальные — в клетки памяти, обеспечивающие защиту при повторном контакте с тем же возбудителем. В результате первичной инфекции число В-лимфоцитов, специфичных к данному возбудителю, многократно увеличивается (за счет клеток памяти), поэтому при реинфекции в ответ на антигены возбудителя вырабатывается гораздо больше антител (рис. 2.16). Этот процесс лежит в основе вакцинации.
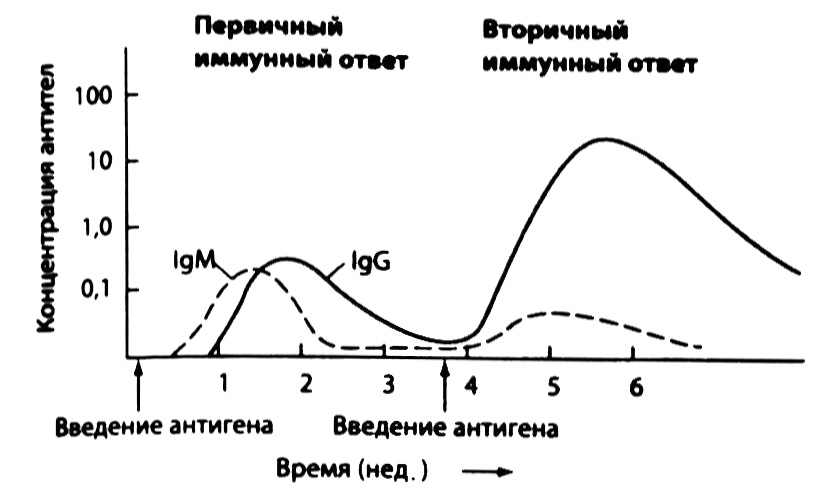
Рис 2.16. Гуморальный иммунный ответ. Первый контакт с определенным видом микробов активирует многие клоны В-лимфоцитов с образованием сначала IgMа затем IgG-продуцирующих плазматических клеток (первичный иммунный ответ). Этот процесс занимает достаточно много времени, поскольку исходное число В-лимфоцитов, способных к распознаванию антигенов данных микробов, относительно невелико. В результате иммунного ответа концентрация антител в крови повышается, но по мере удаления микробов из организма и прекращения антигенной стимуляции специфичных В-лимфоцитов постепенно снижается. При повторном попадании тех же микробов в организм клетки памяти отдельных клонов, образовавшихся в результате пролиферации В-лимфоцитов в ходе первичного иммунного ответа, под действием антигенной стимуляции вырабатывают антитела более быстро и в большем количестве (вторичный иммунный ответ). Следует отметить, что при первичном иммунном ответе в основном вырабатываются IgM, а при вторичном — IgG и других классов, за исключением IgM.
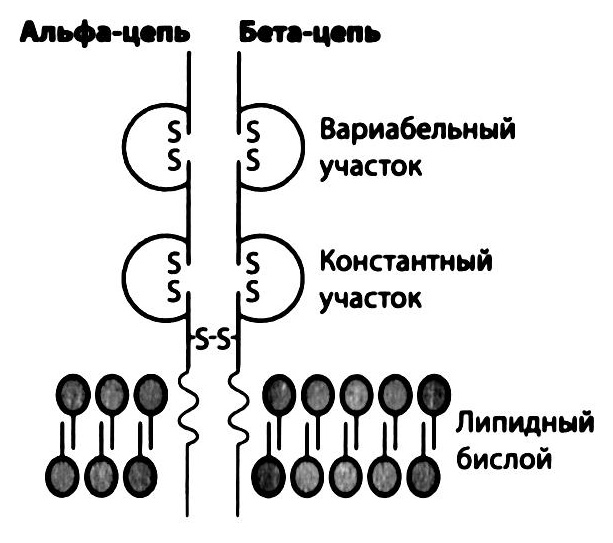
Рис. 2.17. Антигенраспознающий рецептор Т-лимфоцитов (TCR). Антигенраспознающими рецепторами Т-лимфоцитов служат не молекулы иммуноглобулинов, а две трансмембранные полипептидные цепи (у большинства Т-лимфоцитов – это α и β-цепи), соединенные ковалентными связями. Подобно антителам, N-концевые домены α и β -цепей несут вариабельные аминокислотные последовательности, определяющие спцифичность рецепторов в отношении антигенных детерминант. Незначительная часть Т-лимфоцитов несет рецептор, образованный γ - и Δ-цепями
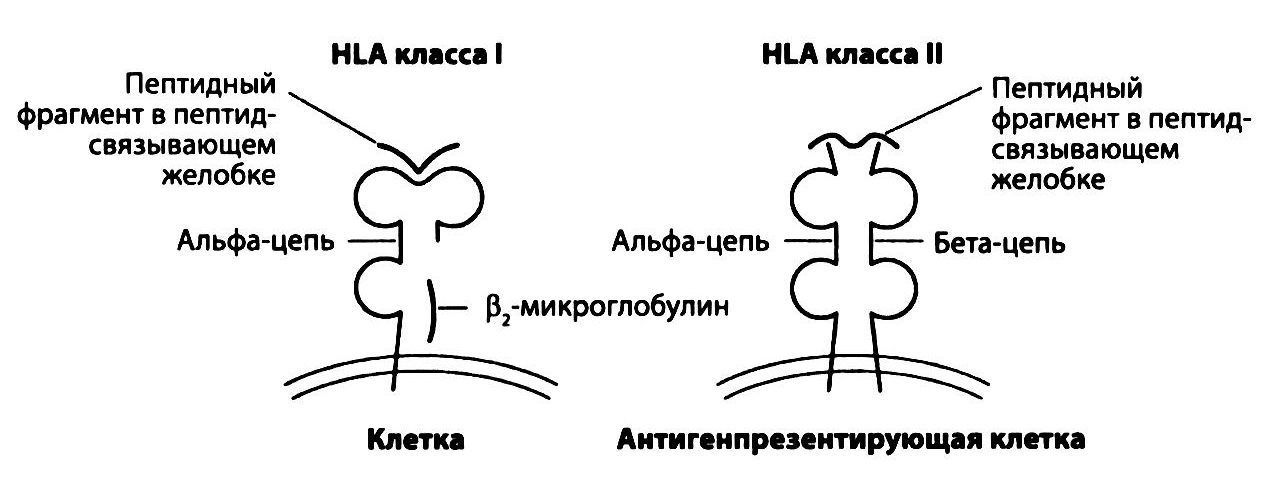
Рис. 2.18. Распознавание антигенов, представленных молекулами HLA I и II классов, Т-лимфоциты. Молекулы HLA I класса находятся на поверхности всех ядросодержащих клеток организма, а II класса — только на поверхности специализированных антигенпредставляющих клеток (АПК), включая дендритные клетки и В-лимфоциты. Оба типа молекул состоят из двух полипептидных цепей. Благодаря аминокислотной последовательности и особой третичной структуре a-цепи молекул HLA I класса α и β –цепи молекул HLA II класса могут связывать внутри клетки микробные пептиды и выносить их на ее поверхность для распознавания Т-лимфоцитами
Антигены HLA делятся на два класса: антигены I класса находятся на поверхности всех ядросодержащих клеток организма, антигены II класса — только на поверхности дендритных клеток, макрофагов и В-лимфоцитов. Такое распределение этих антигенов обеспечивает правильную работу цитотоксических Т-лимфоцитов и Т-хелперов. Первые из них могут уничтожать любые ядросодержащие клетки организма, зараженные вирусами. Цитотоксические лимфоциты «запрограммированы» на распознавание пептидных фрагментов микробных антигенов длиной 8-10 аминокислотных остатков, представляемых антигенами HLA I класса. Вторая популяция Т-лимфоцитов, Т-хелперы, распознают пептиды длиной 10-20 аминокислотных остатков, представляемые антигенами HLA II класса, и помогают макрофагам справиться с фагоцитированными, но не утратившими жизнеспособности микробами.
Для связывания пептидных фрагментов антигена с молекулами HLA требуется переработка (процессинг) антигена внутриклеточными ферментами. Переработка антигена может осуществляться одним из двух способов, в зависимости от того, каким путем этот антиген попал в клетку. В свою очередь, путь переработки антигена определяет тип молекулы HLA, представляющей его Т-лимфоцитам. Так, вирусы, внедрившиеся в клетку и попавшие в ее цитозоль, перерабатываются эндогенным путем, ведущим к связыванию вирусных пептидов с HLA I класса (рис. 2.19). Фагоцитированные микробы проходят экзогенный путь переработки, который приводит к связыванию их пептидных фрагментов с молекулами HLA II класса.
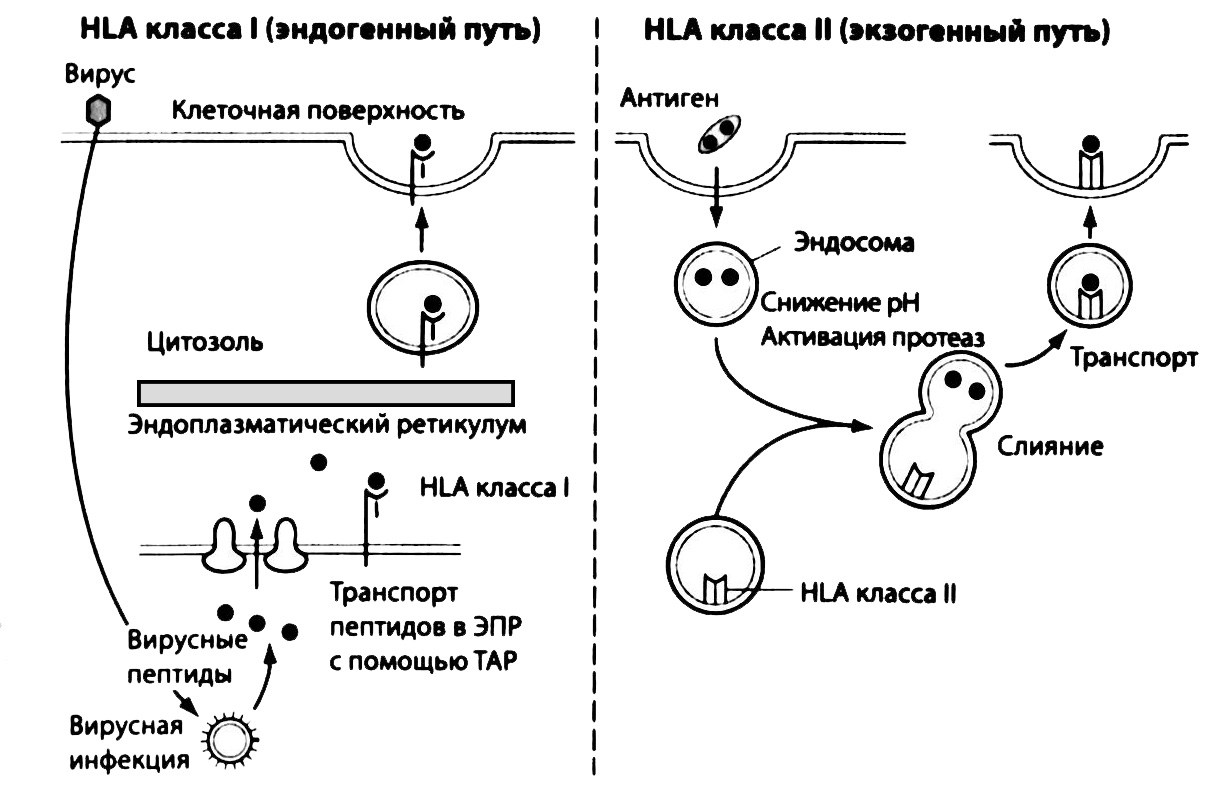
Рис. 2.19. Эндогенная и экзогенная переработка антигена. Заражающие клетку вирусы попадают в ее цитоплазму и начинают синтезировать свои белки. Некоторые из вирусных белков расщепляются протеолитическими ферментами и с помощью особых молекул (белков ТАР) транспортируются в эндоплазматический ретикулум. Затем вирусные пептиды связываются с молекулами HLA I класса и выводятся на поверхность клетки для распознавания Т-лимфоцитами. При экзогенном процессинге микробы попадают в клетку с помощью эндосом (в результате фагоцитоза или пиноцитоза) и подвергаются перевариванию, в том числе протеолитическими ферментами. Затем эндосомы сливаются с вакуолями, содержащими молекулы HLA II класса, которые связываются с антигенными пептидами и в таком виде транспортируются на поверхность фагоцита, где и распознаются Т-лимфоцитами
Развитие иммунного ответа
Индукция иммунного ответа: взаимодействие естественной резистентности и иммунной системы
Незрелые дендритные клетки, подобно макрофагам, осуществляют фагоцитоз микробов, используя для связывания с ними паттерн-распознающие рецепторы. После созревания дендритных клеток переработанные ими микробные антигены представляются соответствующим Т-хелперам, которые распознают пептидные фрагменты этих антигенов в комплексе с молекулами HLA II класса (рис. 2.20 и 2.21). Таким же образом Т-хелперы распознают антигенные пептиды на поверхности макрофагов. Взаимодействие антигенпредставляющих клеток с Т-лимфоцитами запускает их клональную пролиферацию с образованием большого числа клеток одной и той же специфичности (клеток памяти) и выработку ими цитокинов, что является основной функцией Т-хелперов (для сравнения см. клональную активацию В-лимфоцитов). Посредством секреции разных комбинаций цитокинов два типа Т-хелперов «помогают» разным типам клеток (рис. 2.20). Оба типа Т-хелперов экспрессируют на своей поверхности молекулы CD4, которые взаимодействует с участком молекулы HLA II класса, не связанным с пептидными фрагментами микробных антигенов. Пептидные фрагменты, представленные на поверхности дендритных клеток и макрофагов, активируют Th1 (рис. 2.21). Секретируемый ими ИЛ-2 запускает пролиферацию Т-лимфоцитов (аутокринная активация), а ИФ-γ стимулирует представление дендритными клетками пептидных фрагментов в комбинации с HLA I класса предшественникам цитотоксических Т-лимфоцитов CD8+. Связывание молекулы CD154 на поверхности Т-хелпера с ее лигандом, молекулой CD40, усиливает эту функцию дендритных клеток. Некоторые типы дендритных клеток могут подавлять иммунный ответ, например на пищевые антигены, поступающие в кишечник.
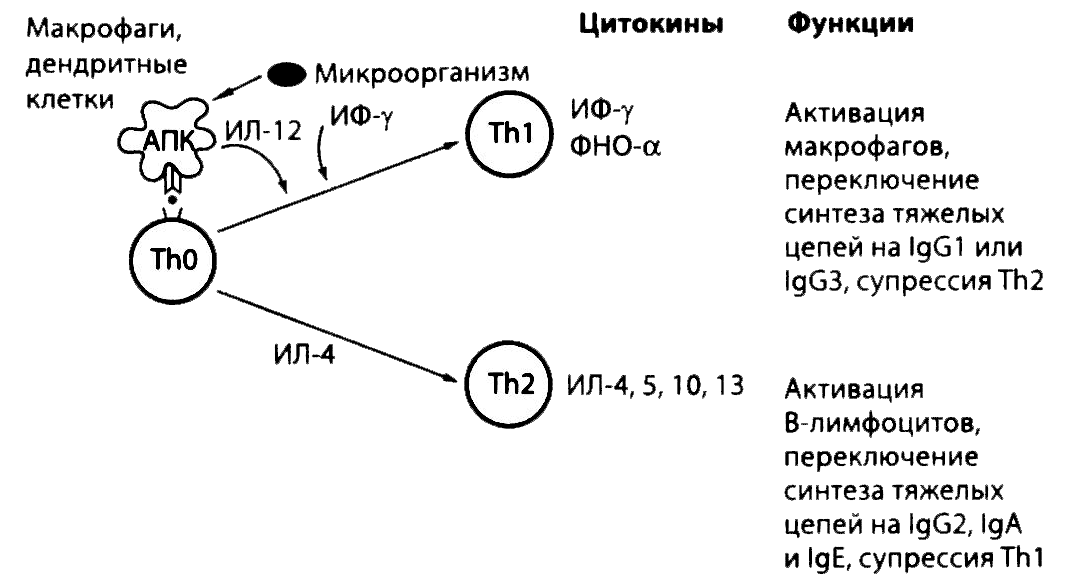
Рис. 2.20. Два типа Т-хелперов. Из антигенспецифичного Т-лимфоцита CD4+ образуются два типа хелперов, Th1 и Th2, различающиеся по спектру продуцируемых цитокинов. В то время как Th1 отвечают за клеточный иммунитет, направленный против внутриклеточных микробов (включая вирусы и бактерии), Th2 помогают В-лимфоцитам, стимулируя их пролиферацию и переключение синтеза антител на IgG2 и другие классы (IgA, IgE). Переключение синтеза антител на классы IgG1 и IgG3 идет с участием Thl
Активация В-лимфоцитов требует помощи Т-лимфоцитов
Антигены с повторяющимися последовательностями (например, полисахариды с многочисленными гексозными остатками) после распознавания рецепторами В-лимфоцитов могут непосредственно стимулировать их пролиферацию с образованием плазматических клеток, секретирующих IgM. Однако ответ В-лимфоцитов на большинство других антигенов требует участия Т-лимфоцитов. Хотя В-лимфоциты не способны фагоцитировать крупные частицы, они могут поглощать их фрагменты или продукты, связываясь с ними антигенраспознающими рецепторами. Таким же путем В-лимфоциты могут захватывать вирусы. После такого поглощения микробов или их продуктов В-лимфоциты подобно макрофагам, осуществляют экзогенную переработку микробных антигенов, в результате чего микробные пептиды оказываются на поверхности этих клеток в комплексе с молекулами HLA II класса. В таком виде эти пептиды распознаются соответствующими рецепторами Th2, а вырабатываемые последними цитокины (ИЛ-4, -5 и -6) помогают этим В-лимфоцитам пролиферировать и превращаться в плазматические клетки (рис. 2.22). Взаимодействие молекул CD154 на поверхности Th2 с лигандами CD40 на поверхности В-лимфоцитов приводит к переключению синтеза антител с одного класса на другой. Таким образом, часть В-лимфоцитов превращается в плазматические клетки продуцирующие IgG, и клетки памяти, из которых при повторном контакте с антигеном также будут образовываться плазматические клетки, синтезирующие IgG. Зародышевые центры фолликулов (рис. 2.7) — это области лимфоидной ткани, где происходит пролиферация В-лимфоцитов, переключение классов антител и формирование клеток иммунной памяти, а также селекция В-лимфоцитов с более высоким аффинитетом к антигену, которые с каждым повторным контактом с этим антигеном секретируют все более высокоаффинные антитела к нему.
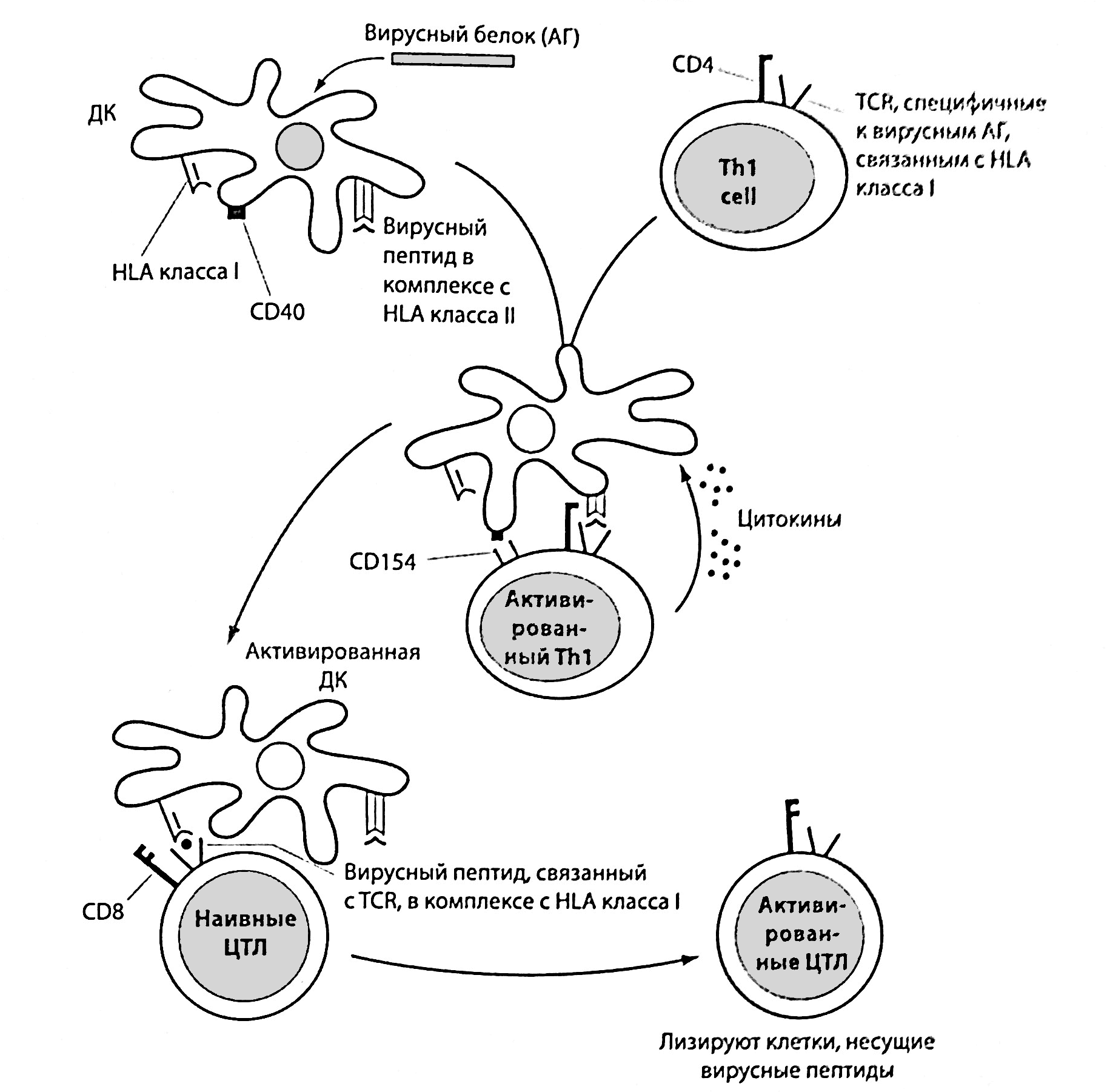
Рис. 2.21. Участие дендритных клеток (ДК) в механизмах врожденного и приобретенного иммунитета. Вирусы и другие микробы фагоцитируются незрелыми ДК, которые затем созревают и представляют антигенные пептиды в сочетании с HLA класса II Th1. В результате такого взаимодействия Th1 активируются, и находящиеся на их поверхности молекулы CD154 связываются с молекулами CD40 на ДК. Это приводит к выработке цитокинов, усиливающих функциональную активность ДК, которые начинают перерабатывать микробные антигены по эндогенному пути и представлять антигенные пептиды в комплексе с молекулами HLA I класса предшественникам цитотоксических Т-лимфоцитов CD8+. Под влиянием других цитокинов, включая ИЛ-2, секретируемый Th1, предшественники цитотоксических Т-лимфоцитов пролиферируют и превращаются в зрелые цитотоксические Т-лимфоциты
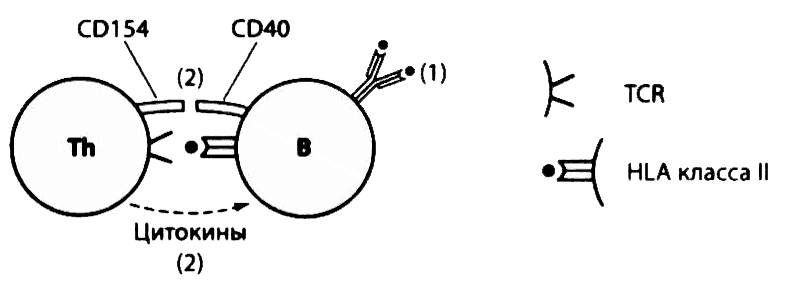
Рис. 2.22. Взаимодействие Т-хелперов с В-лимфоцитами. В-лимфоциты связывают антиген с помощью специфических антигенраспознающих рецепторов. После рецепторопосредованного эндоцитоза антигена происходит его переработка и соединение образовавшихся пептидных фрагментов с молекулами HLA II класса. Эти комплексы появляются на поверхности В-клетки, где они распознаются антигенспецифичными Т-хелперами. Активированные Th2 продуцируют цитокины, необходимые для пролиферации В-лимфоцитов и превращения их в плазматические клетки. Взаимодействие молекулы CD154 на поверхности Т-лимфоцитов с молекулой CD4O на поверхности В-лимфоцитов стимулирует переключение синтеза антител с IgM на другие классы
Опосредованные Т-клеточные механизмы защиты организма-хозяина: клеточный иммунитет
Мы уже познакомились с тем, как Тh2 помогают В-лимфоцитам в выработке антител, защищающих организм от микробов и даже гельминтов (см. выше). Другой тип Т-хелперов, Th1, могут непосредственно взаимодействовать с макрофагами, содержащими живые микробы (например, микобактерии), которые продолжают пролиферировать в их цитоплазме. Секретируемый Th1 цитокин ИФ- γ активирует макрофаги, стимулируя уничтожение ими внутриклеточных микробов (рис. 2.23). В некоторых случаях такая защита оказывается неэффективной, приводя лишь к избыточной стимуляции Th1 с развитием иммунопатологической реакции, или «гиперчувствительности», проявляющейся образованием гранулем. При туберкулезе такие гранулемы часто приводят к смерти, разрушая обширные участки леточной ткани.
Зрелые цитотоксические Т-лимфоциты взаимодействуют с инфицированным клетками, на поверхности которых представлены вирусные пептиды в сочетании с молекулами HLA I класса. Такое взаимодействие может запускать два механизма апоптоза инфицированной клетки. Один из них протекает с участием перфорина и гранзимов, содержащихся в гранулах цитотоксических Т-лимфоцитов (рис. 2.24), другой — с участием молекул Fas (CD95), количество которых на клетке-мишени в результате ее заражения возрастает. Перекрестное связывание молекул Fas со своими лигандами на поверхности зрелых цитотоксических Т-лимфоцитов (рис. 2.25) приводит к гибели зараженной клетки. Подвергшаяся апоптозу клетка сжимается, не высвобождая вирусы во внеклеточное пространство, что предотвращает заражение других клеток. Впоследствии погибшая клетка фагоцитируется, и поглощенные вместе с ней вирусы уничтожаются фагоцитами.
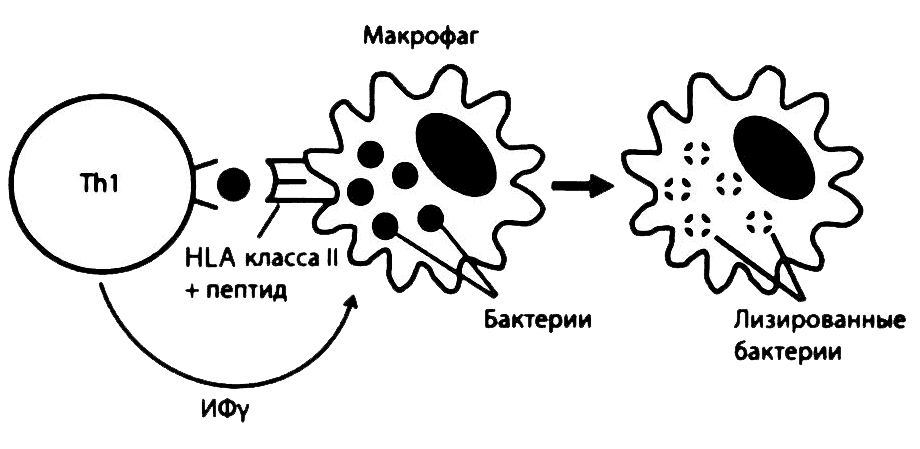
Рис. 2.23. Активация макрофагов Т-хелперами типа 1. Фагоцитированные макрофагами микобактерии (например, Mycobacterium tuberculosis или Mycobacterium leprae) с трудом подвергаются внутриклетоточному лизису, однако их фрагменты перерабатываются, в результате чего небольшие пептидные фрагменты микробных антигенов появляются на поверхности макрофагов. Специфические Th1, распознавшие эти пептиды, активируются и начинают вырабатывать ИФ-γ, который стимулирует внутриклеточный лизис микобактерий макрофагами
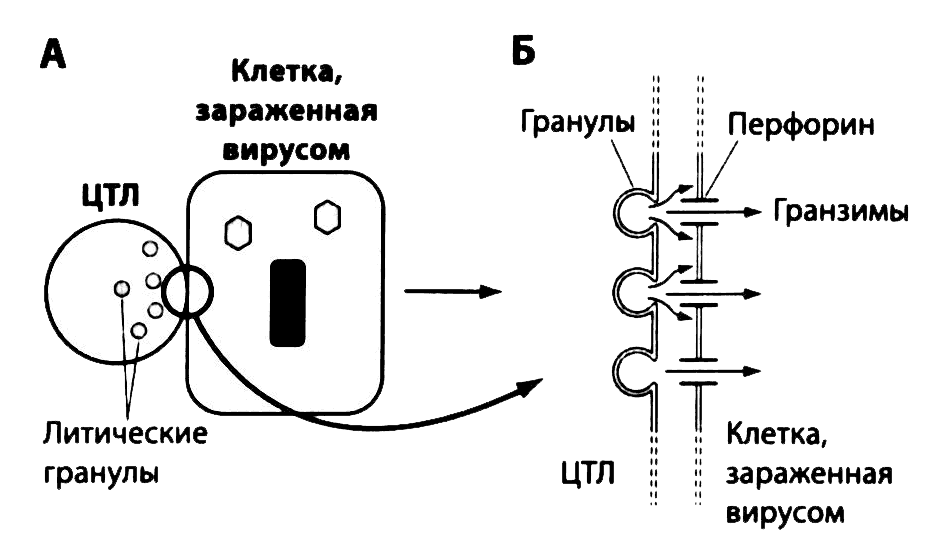
Рис. 2.24. Цитотоксичность Т-лимфоцитов, опосредованная перфоринами. (А) Зараженные вирусами клетки несут на своей поверхности вирусные пептидные фрагменты в комбинации с молекулами HLA класса I. При контакте с этими клетками цитотоксические Т-лимфоциты начинают высвобождать гранулы с перфорином, образующим поры в мембране клетки- мишени. (Б) Попадающие внутрь клетки-мишени ферменты (гранзимы) запускают механизм ее самоуничтожения (апоптоз)
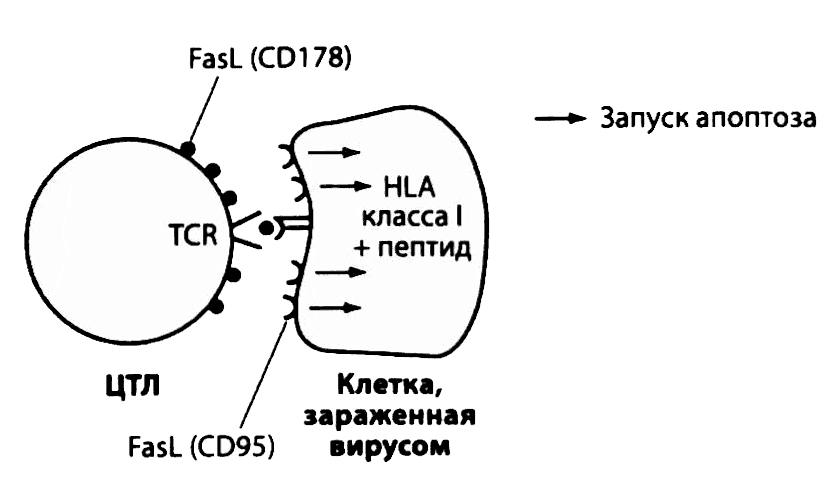
Рис. 2.25. Цитотоксичность Т-лимфоцитов, опосредованная молекулами FasL. Зрелые цитотоксические Т-лимфоциты при контакте с клеткой-мишенью активируются и начинают экспрессировать молекулы FasL. Взаимодействие FasL с молекулами Fas на поверхности зараженных клеток-мишеней индуцирует их апоптоз
Основные положения
Первую линию противомикробной защиты представляют механические барьеры организма (например, кожа) и секретируемые ими вещества, включая лизоцим, дефензины, короткоцепочечные жирные кислоты и т. д.
На микробы, преодолевшие эти барьеры, действуют:
• фагоциты, включая циркулирующие в крови ПЯЛ и фиксированные в тканях макрофаги, которые поглощают и уничтожают эти микроорганизмы;
• NK-клетки, уничтожающие инфицированные вирусом клетки;
• тучные клетки, выделяющие медиаторы воспаления;
• активируемая микробами или антителами система комплемента, которая в результате каскада ферментативных реакций стимулирует воспаление, образует опсонины и компоненты, приводящие к перфорации мембраны бактерий и их гибели;
• белки острой фазы, участвующие в защите организма и восстановлении поврежденных микробами тканей;
• цитокины — сигнальные молекулы, регулирующие иммунные реакции (интерфероны обладают также противовирусной активностью).
Второй линией защиты служит приобретенный иммунитет.
Главные клетки в системе приобретенного иммунитета — лимфоциты. Т-лимфоциты созревают в тимусе, а В-лимфоциты — в костном мозге.
Лимфоциты циркулируют в крови и присутствуют в специализированной лимфоидной ткани, включая лимфатические узлы и селезенку, а также в лимфоидной ткани, ассоциированной со слизистыми оболочками, — MALT.
В-лимфоциты вырабатывают антитела — «γ»-образные молекулы, у которых концевые домены тяжелой и легкой цепей несут гипервариабельные участки, служащие для специфического связывания антигенов.
В зависимости от типа тяжелых цепей все иммуноглобулины делятся на пять классов: IgA, IgG, IgM, IgD, IgE, выполняющих разные функции.
Функции антител включают подавление адгезии микробов и токсинов, иммобилизацию агглютинацию и опсонизацию микроорганизмов, активацию комплемента и стимуляцию выброса клетками противомикробных ферментов.
На поверхности В-лимфоцитов находятся иммуноглобулиновые рецепторы определенной специфичности. Связывание этих рецепторов с комплементарным антигеном вызывает пролиферацию В-лимфоцитов и превращение их в антителопродуцирующие клетки (клональная селекция). Часть клона В-лимфоцитов превращается в клетки памяти, более быстро отвечающие на повторный контакт с тем же антигеном.
Рецепторы Т-лимфоцитов распознают микробные антигены, только если они представлены молекулами МНС (у человека они называются молекулами HLA). Цитотоксические Т-лимфоциты уничтожают зараженные вирусом ядросодержащие клетки, распознавая с помощью TCR короткие пептидные фрагменты виусных антигенов, представленные молекулами HLA класса I на поверхности лих клеток. Т-хелперы распознают с помощью TCR более длинные пептидные фрагменты микробных антигенов, представленные молекулами HLA класса II на поверхности макрофагов, помогая последним уничтожать внутриклеточные микробы. В зависимости от способа переработки антигена его пептидные фрагменты связываются с молекулами HLA I или II класса.
Системы врожденного и приобретенного иммунитета взаимодействуют друг с другом. Антигенпредставляющие клетки (дендритные, макрофаги) связывают антиген паттернраспознающими рецепторами и после переработки представляют его в комплексе с молекулами HLA класса II Т-хелперам (лимфоцитам CD4). Такое взаимодействие приводит к активации и клональной пролиферации Т-хелперов с образованием клеток памяти той же специфичности и выработкой цитокинов. Т-хелперы первого типа (Th1) выделяют цитокины, стимулирующие представление антигена дендритными клетками в комплексе с молекулами HLA класса I лимфоцитам CD8, и цитокины, стимулирующие внутриклеточное переваривание микробов макрофагами. Т-хелперы второго типа (Th2) выделяют цитокины, стимулирующие пролиферацию В-лимфоцитов и переключение синтеза ими антител (с IgM на IgG).
Вы читали отрывок из книги "Микробиология и иммунология для стоматологов" - Леонтьев В. К.
Книга "Микробиология и иммунология для стоматологов"
Авторы: Ричорд Дж. Ламонт, Мэрилин С. Лонтц, Роберт А. Берне Дональд Дж. Лебланк
Актуальность книги Микробиология и иммунология для стоматологов связана с инфекционной (вирусной, микробной) этиологией основных стоматологических заболеваний, а также патологией пищеварительной и дыхательной систем организма человека. Это первое в России полноценное руководство по данной теме.
Главы первой части посвящены основам микробиологии полости рта. Рассмотрены особенности полости рта как среды обитания, вопросы идентификации и характеристики ее микрофлоры, физиологических особенностей, генетики и молекулярной биологии ее микробов, а также прикладным аспектам биологии полости рта. Подробно представлена иммунная система полости рта и механизмы защиты организма.
Освещены современные представления о клеточном, тканевом и гуморальном иммунитете полости рта, иммунном ответе организма. Во второй и в третьей частях основное внимание уделено заболеваниям, вызванным микроорганизмами полости рта, а также ответным реакциям организма человека, средствам лечения и профилактики стоматологических инфекций.
Книга для стоматологов и врачей смежных специальностей (гастроэнтерологов, микробиологов), преподавателей и студентов медицинских вузов.
Содержание книги "Микробиология и иммунология для стоматологов" - Ричорд Дж. Ламонт, Мэрилин С.
Основы микробиологии полости рта
Главе 1. Общая микробиология
Введение
Схемы классификации бактерий
Классификация бактерий
Строение бактериальной клетки
Мембраны
Липополисахариды
Пептидогликан клеточной стенки
Липотейхоевые кислоты
Другие важные структурные элементы бактериальной клетки
Бактериальный геном
Бактериальная хромосома
Репликация бактериальной хромосомы
Перенос генов у бактерий
Размножение и питание бактерий
Размножение
Источники и механизмы питания
Основы микробной экологии полости рта
Микробные биопленки
Экология микрофлоры полости рта и развитие стоматологических заболеваний
Основные положения
Глава 2. Иммунная система и защита организма от инфекций
Введение
Врожденный иммунитет
Клетки системы естественной резистентности
Молекулы естественной защиты
Лимфоидная система
Гетерогенность популяции лимфоцитов
Лимфоидные органы и ткани
Антитела: специфичность, классы и функции
Особенности строения и специфичность антител
Классы антител
Функциональные различия между антителами
Противомикробная защита с участием антител
Распознавание антигена лимфоцитами
В-лимфоциты
Т-лимфоциты
Развитие иммунного ответа
Индукция иммунного ответа: взаимодействие естественной резистентности и иммунной системы
Активация В-лимфоцитов требует помощи Т-лимфоцитов
Опосредованные Т-клеточные механизмы защиты организма-хозяина: клеточный иммунитет
Глава 3. Микробиоценоз полости рта
Микроэкологические особенности полости рта
Зубы
Мягкие ткани полости рта (пародонт, слизистая оболочка, язык)
Факторы, влияющие на колонизацию тканей полости рта микроорганизмами
Температура
Кислород
Факторы механического воздействия
Жидкости
Возраст организма-хозяина
Микрофлора полости рта
Факторы, способствующие началу формирования зубной бляшки
Зубной камень
Микрофлора слизистой оболочки
Современные представления о процессе формировании биопленки на поверхности зубов
Жидкости полости рта: слюна и ее действие на бактериальные клетки
Очищение полости рта от бактерий: агглютинины
Рецепторы адгезии к пелликуле
Антимикробные компоненты слюны
Слюна как источник питательных веществ для бактерий
Жидкость десневой борозды
Глава 4. Выделение, классификация и идентификация микроорганизмов полости рта
Разнообразие микрофлоры полости рта
Идентификация и классификация бактерий по последовательности генов
Значение гена для филогенетической систематики
Получение образцов микрофлоры полости рта
Идентификация бактерий полости рта
Молекулярные методы идентификации бактерий
Молекулярный анализ и номенклатура бактерий
Микроскопия бактерий полости рта
Культивирование бактерий полости рта
Потребности микробов в кислороде
Питательные среды
О Классификация культивируемых бактерий
Определение чувствительности микробов к антибиотикам
Глава 5. Микробная экология полости рта
Формирование микрофлоры полости рта
Колонизация полости рта бактериями
Значение поверхностных структур и молекул для адгезии микробов
Механизмы адгезии
Защитные факторы, препятствующие адгезии бактерий
Адгезия и метаболизм
Генная регуляция
Взаимодействие бактерий между собой
Взаимодействие бактерий с человеческими клетками
Глава 6. Физиология микроорганизмов полости рта
Кислото- и щелочеобразование микрофлоры полости рта
Кислотно-щелочной обмен в полости рта
Микроэкологические аспекты неодинаковой толерантности бактерий полости рта к кислотам
Толерантность к кислотам и специфические функции бактерий
Конститутивная и адаптивная толерантность микроорганизмов к кислотам
Щелочеобразование и толерантность бактерий к кислотам
Значение кислото- и щелочеобразования для вирулентности микроорганизмов и развития стоматологических заболеваний
Метаболизм кислорода, окислительный стресс и адаптация к нему
Источники кислорода для микробов полости рта
Уровень кислорода и окислительно-восстановительный потенциал зубной бляшки
Окислительный метаболизм, чувствительность к кислороду и кислородное повреждение бактерий полости рта
Системы восстановления
Физиология биопленок полости рта
Физико-химические градиенты, способность биопленок к концентрированию флюоридов и других антимикробных веществ
Питание микроорганизмов зубной бляшки в свете физиологии биопленки
Глава 7. Генетика и молекулярная биология микроорганизмов полости рта
Геномы и естественный генетический обмен
Естественный перенос генов
Молекулярный анализ микроорганизмов полости рта
Векторы как инструмент молекулярного анализа
Особенности плазмид, используемых при конструировании векторов
Применение эндогенных плазмид в молекулярном анализе
Применение в молекулярном анализе экзогенных плазмид и плазмид с широким спектром хозяев
Интегративные векторы
Транспозонный мутагенез
Глава 8. Прикладные аспекты молекулярной микробиологии полости рта
Изучение экспрессии генов: генетические подходы
Клонирование ДНК
ПЦР
Изучение функции генов
2 Значение регуляции генов
Метод идентификации микробных генов, экспрессируемых у человека
Геномика: задачи и пути их решения
Транскриптомика и протеомика
Транскриптомика
Протеомика
Глава 9. Популяционная генетика бактерий полости рта
Бактериальные виды, представляющие разные модели эволюции
Ограниченный половой процесс у бактерий
Различия в патогенности штаммов
Адаптация бактериальных клонов к среде хозяина
Размеры популяций патогенных и комменсальных бактерий
Различия в степени генетического разнообразия бактерий полости рта
Динамичность популяций микроорганизмов, населяющих полость рта
Внутривидовые различия бактерий полости рта по вирулентности
Методы идентификации штаммов и выявление вирулентных клонов
Генетическая структура популяции бактерий полости рта
Глава 10. Микробиология полости рта и иммунный ответ
Врожденная защита
Поверхности полости рта
Жидкая фаза: слюна
Местный приобретенный иммунитет
Е Инфекционные заболевания полости рта
Глава 11. Кариес
Введение
Эпидемиология кариеса
Бактериальная этиология кариеса
Локализация поражения при кариесе
Поддесневые структуры зуба
Поверхностный кариес корней зубов
Экспериментальные модели кариеса на животных
Модель кариеса на крысах
Инфицирование грызунов для изучения кариеса
Оценка результатов исследований на крысах
Перспективы моделирования кариеса
Иммунология кариеса и перспективы создания вакцины
Секреторные IgA — доминирующие иммуноглобулины слюны
Антигены-кандидаты для создания вакцины и системы их доставки
Перекрестно реагирующие антитела к антигенам стрептококков
Молекулярно-биологические методы в изучении кариеса
Молекулярные аспекты адгезии и образования колоний S. mutans
Реакции микроорганизмов на стресс и их роль в патогенезе кариеса
Геномная и постгеномная эры в изучении микробиологии кариеса
Глава 12. Болезни пародонта
Общие представления
Определения
Значение бактерий зубной бляшки для болезней пародонта: неспецифическая,
специфическая и экологическая гипотезы
Предполагаемые возбудители болезней пародонта
Вирулентные свойства потенциальных возбудителей болезней пародонта
P. gingivalis
A. actinomycetemcomitans
T.denticola
Е. corrodens
F. nucleatum
Р- intermedia
q- T.forsythia
Capnocytophaga spp
Иммунные механизмы разрушения ткани при пародонтите
Патогенез гингивита
Патогенез пародонтита
Вирулентные свойства бактерий и их способность уклоняться от иммунной системы
Иммунное разрушение тканей пародонта
Схема патогенеза болезней пародонта
Иммуноциты и резорбция кости
Использование лабораторных животных для изучения патогенеза пародонтита
Генетические факторы, влияющие на устойчивость к инфекциям пародонта
Глава 13. Вирусология полости рта
Что изучает вирусология полости рта
Что представляют собой вирусы
Жизненный цикл вирусов
Таксономия вирусов
Вирусы полости рта
Вирусы, способные вызывать патологические изменения в полости рта
Пикорнавирусы
Герпесвирусы человека
Папилломавирусы человека
Вирусы, встречающиеся в полости рта
Вирус гепатита В
Вирус гепатита D
Вирус гепатита С
Вирус иммунодефицита человека
Иммунная защита от вирусов
Роль врожденного иммунитета
Роль приобретенного иммунитета
Вакцины и противовирусная терапия
История создания противовирусных вакцин
Препараты противовирусных иммуноглобулинов и вакцин
Противовирусные химиопрепараты
Глава 14. Грибы и грибковые инфекции полости рта
Введение
Биология грибов
Морфология
Размножение
Патогенез микозов
Заражение
Вирулентность
Механизмы противогрибковой защиты
Неспецифические механизмы
Специфические механизмы
Противогрибковая терапия
Культивирование и идентификация грибов
Принципы противогрибковой химиотерапии
Характеристика отдельных микозов
Кандидоз
Аспергиллез
Криптококкоз
Гистоплазмоз
Бластомикоз
Паракокцидиоидомикоз
Мукоромикоз
Глава 15. Микробиологические аспекты эндодонтии
Источники инфекций
Бактерии, вызывающие инфекцию корневых каналов
Культивировать или не культивировать?
Эндодонтия «одного визита»
Микробиологический аспект корневой обтурации 406 ос X Антибактериальные средства, применяемые в эндодонтии
Современная очаговая инфекция
Глава 16. Системные заболевания, обусловленные микрофлорой полости рта
Пути генерализации инфекции
Нарушение барьера слизистой оболочки
Миграция микроорганизмов
Патогенный потенциал микрофлоры полости рта
«Мимикрия» микроорганизмов: изменение экспрессии генов под влиянием внешних сигналов
Защитные механизмы хозяина
Системные заболевания, связанные с микробами полости рта
Инфекционный эндокардит
Диссеминированное внутрисосудистое свертывание
Другие состояния, предположительно связанные с микробами полости рта
Белки теплового шока
Индуцированная микробами полости рта аутореактивность
Является ли воспаление связующим звеном между местной инфекцией полости рта и системным заболеванием?
Лечение и профилактика инфекций полости рта
Глава 17. Антибиотики и лечение инфекционных заболеваний
Антибиотики как класс химиотерапевтических препаратов
Ингибиторы синтеза клеточной стенки
Ингибиторы трансляции
Ингибиторы транскрипции и репликации
Антибиотики других групп
Лечение туберкулеза при помощи антибиотиков
Комбинации антибиотиков
Определение чувствительности микроорганизмов к антибиотикам
Применение антибиотиков в стоматологической практике
Применение антибиотиков в лечении одонтогенных инфекций
Выбор антибиотиков для лечения одонтогенных инфекций
Применение антибиотиков для лечения пародонтита
Применение антибиотиков для профилактики инфекций (антибиотикопрофилактика)
Другие аспекты применения антибиотиков в стоматологической практике:
лекарственные взаимодействия
Антибиотикорезистентность
Появление устойчивости после внедрения антибиотиков в клиническую практику
R-факторы и другие плазмиды лекарственной устойчивости бактерий
Приобретенная устойчивость к антибиотикам
Транспозоны и другие мобильные генетические элементы с генами антибиотикорезистентности
Значение мутаций для антибиотикорезистентности
Механизм эффлюкса: природная и приобретенная устойчивость, роль мутаций
Лекарственная устойчивость микроорганизмов полости рта
Антибиотикорезистентность в XXI веке
Значение генетических элементов в распространении лекарственной устойчивости
Множество механизмов устойчивости к антибиотикам
Глава 18. Профилактика инфекций в стоматологии
Основы противоэпидемического режима
Гарантия качества проводимых мероприятий
Профилактика перекрестной инфекции — это, по сути, комплекс организационных мер
Что означает управление риском?
Риски перекрестной инфекции в стоматологии
Пути распространения инфекции
Мероприятия в отношении «новых» инфекций
Практические аспекты профилактики инфекций в стоматологии
Терминология
Особенности профилактики перекрестной инфекции в общестоматологической практике
Общепрофилактические меры
Поэтапная профилактика инфекции
Стерилизация инструментов





























0 комментариев