Лекция для врачей "УЗИ диагностика митральных и аортальных пороков" (отрывок из книги Лекции по сердечно-сосудистой хирургии (изд-е 3-е переработанное, дополненное - Л. А. Бокерия)
Гипертрофия миокарда - один из основных морфологических признаков механизма адаптации в ответ на различные виды стрессов, воздействующих на миокард. Следует различать два основных типа гемодинамической нагрузки на миокард желудочков: давлением (постнагрузка систолическая) и объемом (преднагрузка диастолическая). При перегрузке камер сердца давлением миокард утолщается, с тем чтобы преодолеть систолический стресс, так как по закону Лапласа систолический стресс прямо пропорционален производной радиуса полости на систолическое давление и обратно пропорционален толщине стенки камеры. При перегрузке камер объемом и возрастании диастолического стресса радиус камеры увеличивается, а толщина ее стенок остается прежней. Утолщение миокарда происходит за счет утолщения саркомеров, а растяжение камер сердца - за счет их удлинения.
Гипертрофию миокарда, индуцированную систолической перегрузкой и сопровождающуюся его утолщением, принято называть концентрической. Концентрическая гипертрофия бывает двух типов: симметричная, когда толщина стенок приблизительно одинакова, и асимметричная, когда одна из стенок толще другой более чем в 1,5 раза. Гипертрофию миокарда, развивающуюся в ответ на диастолическую перегрузку, принято называть эксцентрической.
Все хронические заболевания клапанного аппарата сердца проходят три основные фазы развития: компенсации, субкомпенсации и декомпенсации (конечная фаза). К примеру, в начале развития изолированного митрального стеноза легочная гипертензия отсутствует, она возникает после нескольких лет существования порока, дальнейшее развитие порока может привести к недостаточности трикуспидального клапана. Понимание динамики развития пороков в сочетании с правильным применением ЭхоКГ позволяет не только поставить точный морфологический диагноз, но и установить стадию заболевания.
Нормальная анатомия митрального клапана
Митральный клапан является верхней границей приточного отдела левого желудочка (ЛЖ). Клапан состоит из двух створок - передней и задней. По бокам створки связаны переднелатеральной и заднемедиальной комиссурами. Створки крепятся своими основаниями к фиброзному кольцу клапана, а с помощью хорд связаны с папиллярными мышцами. Хорды крепятся по краям и по всей длине створки. В ЛЖ имеются две группы папиллярных мышц (переднелатеральная и заднемедиальная). Передняя створка клапана образует митрально-аортальное фиброзное продолжение (митрально-аортальный контакт).
Эхокардиография позволяет осуществлять комплексный подход к оценке митрального клапана: с помощью одномерной и двухмерной ЭхоКГ исследуют морфологические особенности клапана, подклапанных структур, состояние левого желудочка и левого предсердия (ЛП). Допплерография в импульсно-волновом и непрерывно-волновом режимах позволяет оценивать трансмитральные потоки в диастолу и систолу, градиенты между ЛЖ и ЛП расчетное систолическое давление в правом желудочке, расчетное диастолическое давление в легочной артерии. Цветовое допплеровское картирование кровотоков дает возможность оценить направление диастолического и систолического потоков, площадь регургитации.
Основные эхокардиографические параметры нормального митрального клапана, определяемые в двухмерном режиме: фиброзное кольцо клапана; толщина створок, которая в норме составляет 2-3 мм; количество папиллярных мышц, их длина, длина хорд и соотношение длин хорд и мышц: площадь левого атриовентрикулярного отверстия, межкомиссуральное расстояние.
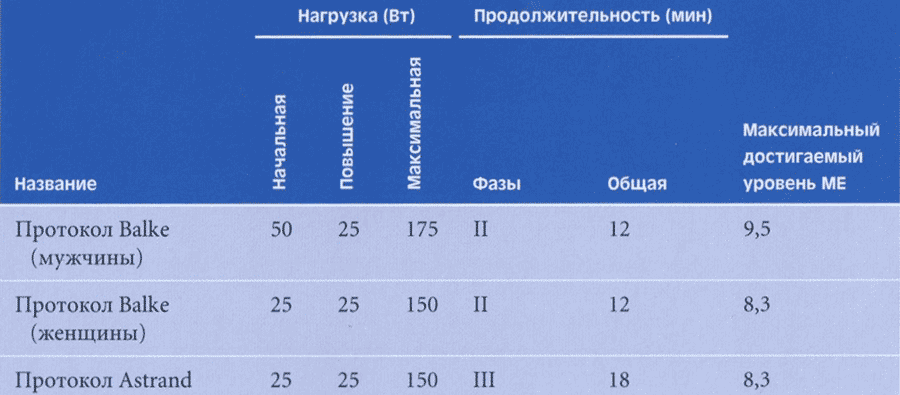
Нормальные значения диаметра фиброзного кольца митрального клапана у взрослых (по A. S. Pearlman): конец диастолы-27-40 мм, конец систолы - 29-36 мм, в среднем - 33 мм: у детей - см. таблицу 1. В таблице представлены диаметры митрального клапана в различных возрастных группах.
Функцию митрального клапана оцеивают в двухмерном режиме по степени подвижности створок и папиллярных мышц, амплитуде разнонаправленного движения створок и хорд. Функция клапана может быть исследована с помощью допплерографии в импульсно-волновом и непрерывно-волновом режимах: по скорости трансмитрального диастолического потока (пиковая скорость у детей - 1,0 м/с; у взрослых- 0,9 м/с); пиковому и среднему градиенту диастолического потока (пиковый градиент - до 7-8 мм рт. ст., средний - до 3-4 мм рт. ст.). В систолу на митральном клапане потока быть не должно.
Стеноз левого атриовентрикулярного отверстия (митральный стеноз)
Классификация пороков митрального клапана:
I. Ревматические поражения:
1. Митральный стеноз. Обструкция (ревматическая).
2. Митральная недостаточность. Ревматическая митральная некомпетентность, регургитация.
3. Митральный стеноз с недостаточностью (регургитацией).
4. Ревматическое пролабирование.
5. Острый и подострый эндокардит (исключая острый ревматический эндокардит); эндокардит (бактериальный, инфекционный, септический, злокачественный, язвенный, с вегетациями, инфекционная аневризма, абсцесс).
6. Другие поражения.
II. Неревматические поражения:
1. Митральная недостаточность специфической природы (кроме ревматической).
2. Пролапс (врожденный).
3. Неревматический митральный стеноз (врожденный).
4. Другие поражения.
Эхокардиографические признаки изолированного стеноза левого атриовентрикулярного отверстия:
Морфологические признаки:
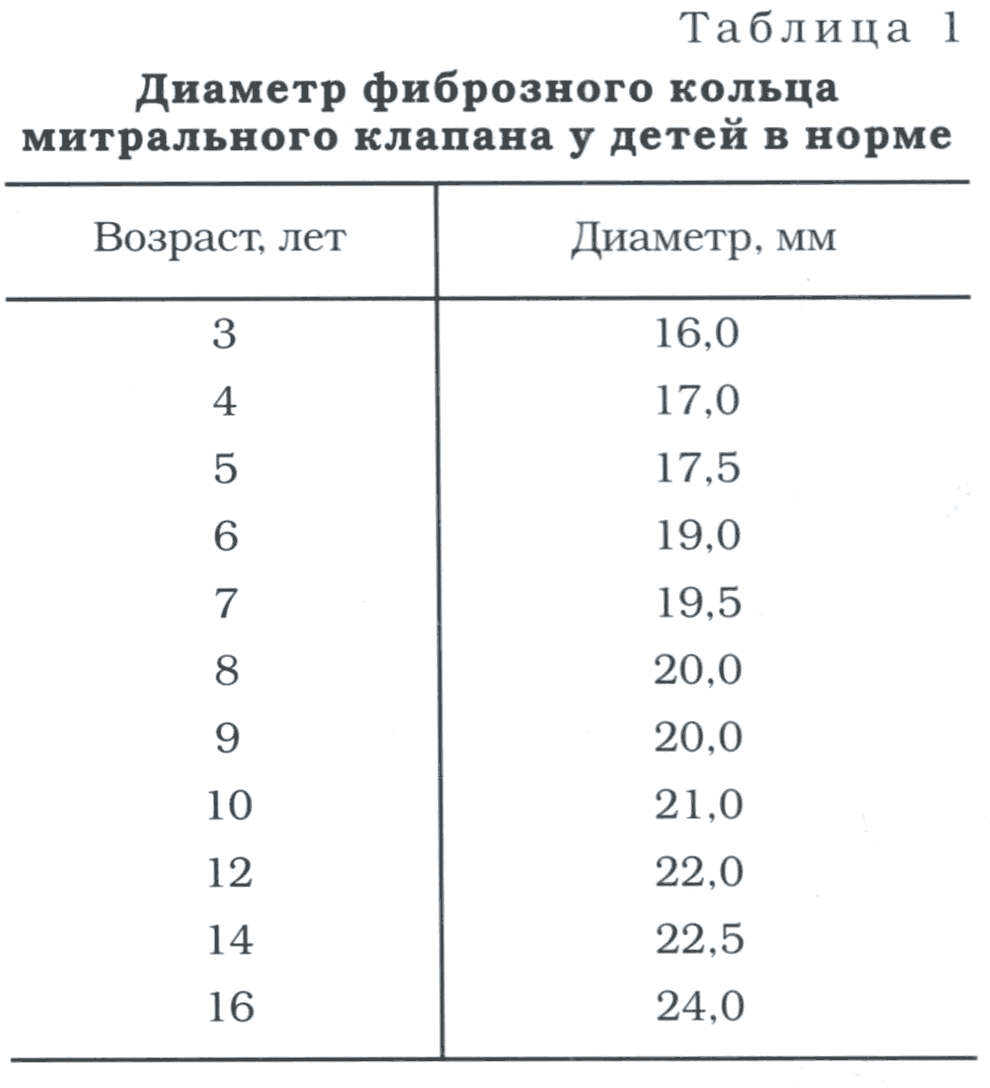
- уменьшение площади отверстия (рис. 1, а);
- утолщение створок митрального клапана (см. рис. 1, а);
- утолщение подклапанных структур - хорд и папиллярных мышц (рис. 1,6);
- спаяние створок по комиссурам (см. рис. 1, а);
- сращение хорд и папиллярных мышц;
- втянутость створок клапана в ЛЖ (см. рис. 1, 6);
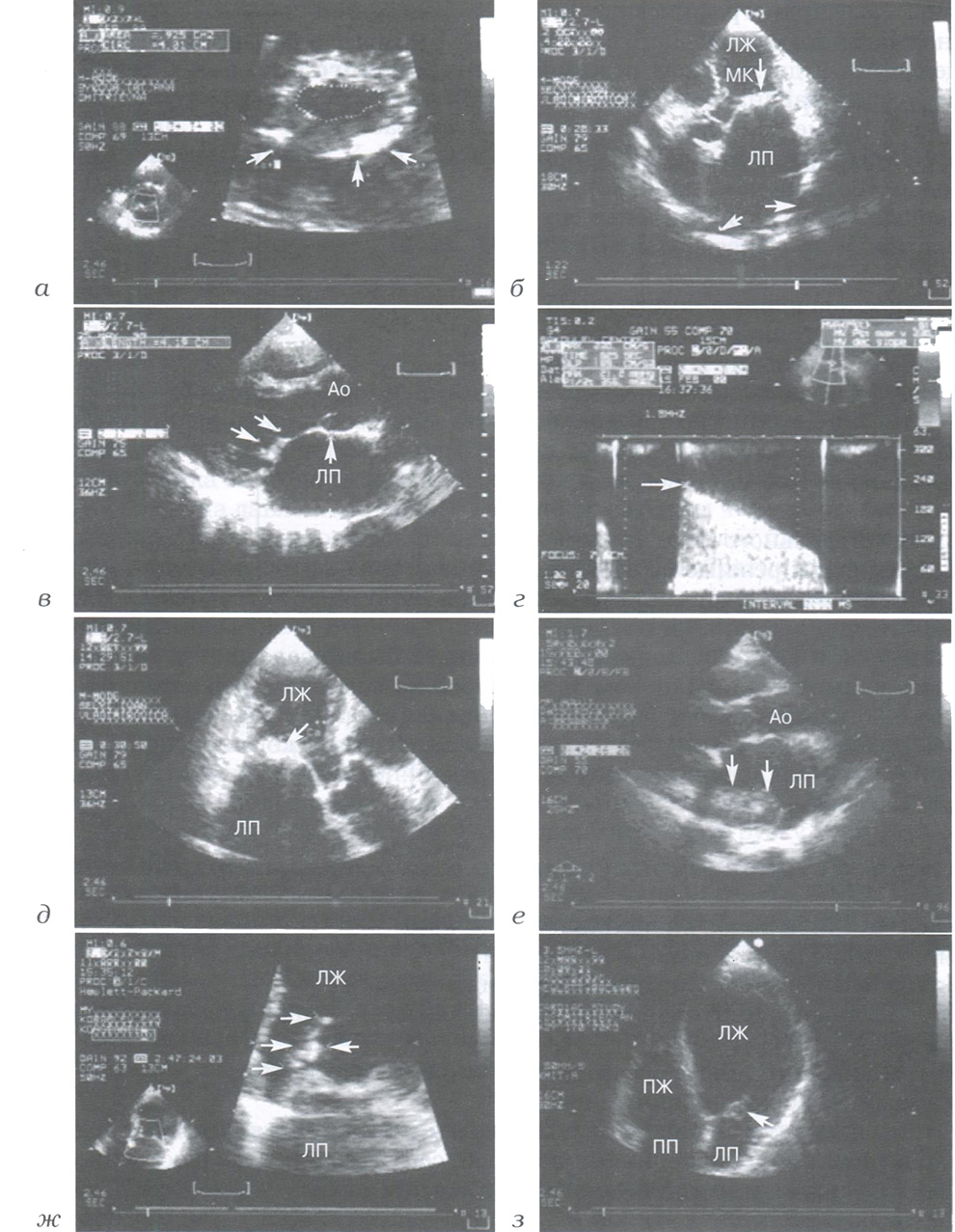
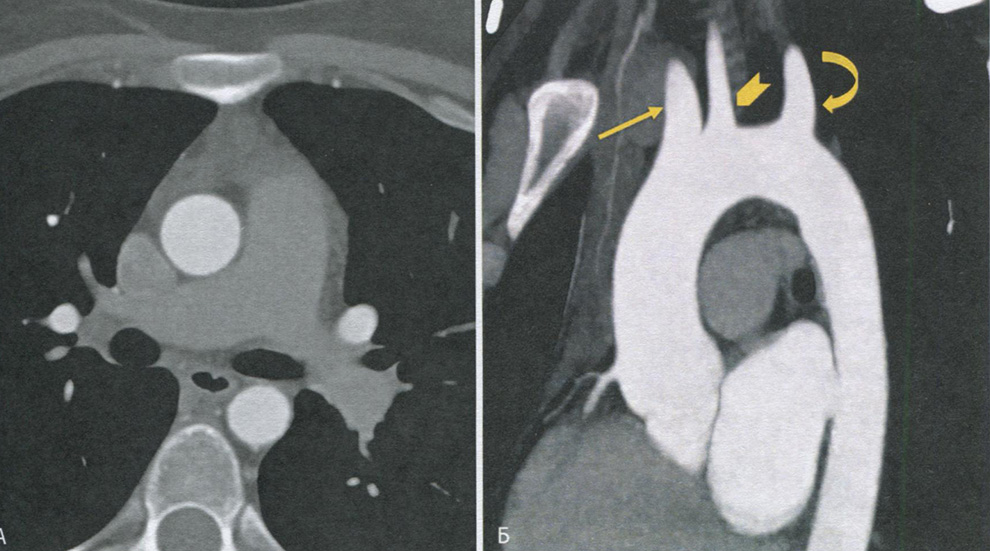
Рис. 1. Эхокардиографические признаки стеноза левого атриовентрикулярного отверстия:
а- суженное левое атриовентрикулярное отверстие; ревматическое поражение клапана (парастернальный доступ по короткой оси ЛЖ); стрелками обозначены очаги кальция в задней створке МК; б - резкое утолщение створок и хорд МК, их смещение в полость ЛЖ, большое ЛП, расширение легочных вен (указано стрелками) (верхушечный доступ, четырехкамерная проекция); в - утолщение створок и хорд МК, спаяние хорд, увеличение размеров ЛП (указано стрелками) (парастернальный доступ по длинной оси ЛЖ); г - допплерограмма (непрерывно-волновой режим); стеноз МК, пиковый диастолический градиент (указан стрелкой) между ЛП и ЛЖ составляет 21,2 мм рт. ст., а площадь отверстия-0,6 см2; д-резкий кальциноз створок МК (указан стрелкой) (верхушечный доступ по длинной оси ЛЖ); е - большой тромб в ЛП (указан стрелками), стеноз МК (парастернальный доступ по длинной оси ЛЖ); ж - вегетации на передней створке МК (указаны стрелками); инфекционный эндокардит; з - абсцесс передней створки МК (указан стрелкой); инфекционный эндокардит (верхушечный доступ, четырехкамерная проекция); ЛЖ - левый желудочек; ЛП - левое предсердие; ПЖ - правый желудочек; ПП - правое предсердие; МК - митральный клапан

- усиление эхогенности створок и подклапанных структур вплоть до выявления очагов кальция (см. рис. 1, а, Э);
- увеличение размеров левого предсердия (рис. 1, в);
- относительно малые размеры ЛЖ (см. рис. 1,6);
- расширение устьев легочных вен (см. рис. 1, б).
Функциональные признаки:
- ограничение подвижности створок;
- ограничение подвижности подклапанных структур;
- однонаправленность движения задней и передней створок;
- наличие диастолического градиента между ЛП и ЛЖ (рис. 1, г).
Степень выраженности митрального стеноза оценивают в первую очередь по площади отверстия: при площади отверстия менее 1 см2 - стеноз критический, 1-2 см2 - выра-женный, более 2 см2 - умеренный.
ЭхоКГ позволяет выявить осложнения митрального стеноза:
- кальциноз митрального клапана (см. рис. 1, Э);
- тромбоз левого предсердия и его ушка (рис. 1, е);
- легочную гипертензию;
- относительное увеличение размеров правых камер сердца;
- относительную недостаточность трикуспидального клапана;
- вторичный инфекционный эндокардит клапана (рис. 1, ж, з).
Эхокардиография в двухмерном режиме с высокой чувствительностью позволяет выявить степень кальциноза клапана и локализацию его очагов (табл. 2).
Диагностическим критерием наличия кальция в структурах клапана является локация ультразвуковой дорожки за ярким эхосигналом (см. рис. 1, д). При отсутствии ультразвуковой дорожки диагностика кальциноза неправомочна и речь может идти о выраженном фиброзе. В ряде случаев выраженный кальциноз передней створки и комиссур митрального клапана препятствует планиметрическому измерению площади отверстия. В этом случае для ее оценки используют допплерографию. Рекомендуется применение способа определения площади отверстия, предложенного L. Hatle и В. Angelsen в 1979 г., - по времени полуспада пикового диастолического градиента (РНТ1/2) на стенозированном клапане. Формула отражает зависимость между площадью отверстия и временем РНТ1/2 (рис. 1, г, см. рис. 2, а):
S=220/PHT1/2
Однако следует с осторожностью применять данный способ измерения у больных с фибрилляцией предсердий в связи с различными значениями времени падения пикового диастолического градиента из-за разной степени наполнения левого предсердия. В случае фибрилляции предсердий для уменьшения погрешности необходимо усреднение от 5 до 10 диастолических циклов.
Врожденный стеноз левого атриовентрикулярного отверстия встречается редко. Он обусловлен наличием надклапанной мембраны (рис. 2, 6), аномальных створок, хорд и перемычек между створками, а также утолщением створок, неразделением комиссур, укорочением хорд «баллонообразного» типа. Причиной стеноза может быть гипоплазия фиброзного кольца клапана, аномалии папиллярных мышц - «парашютообразный» тип.
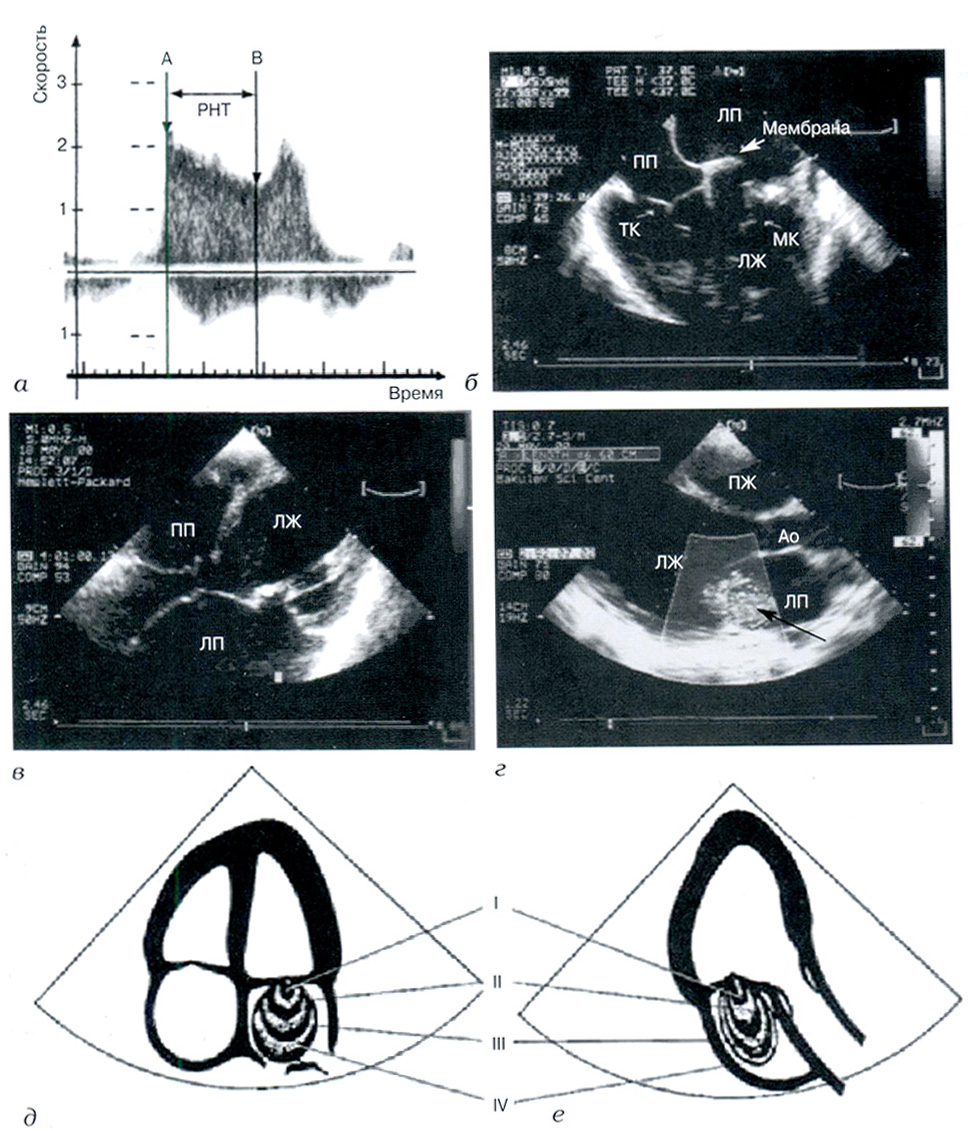
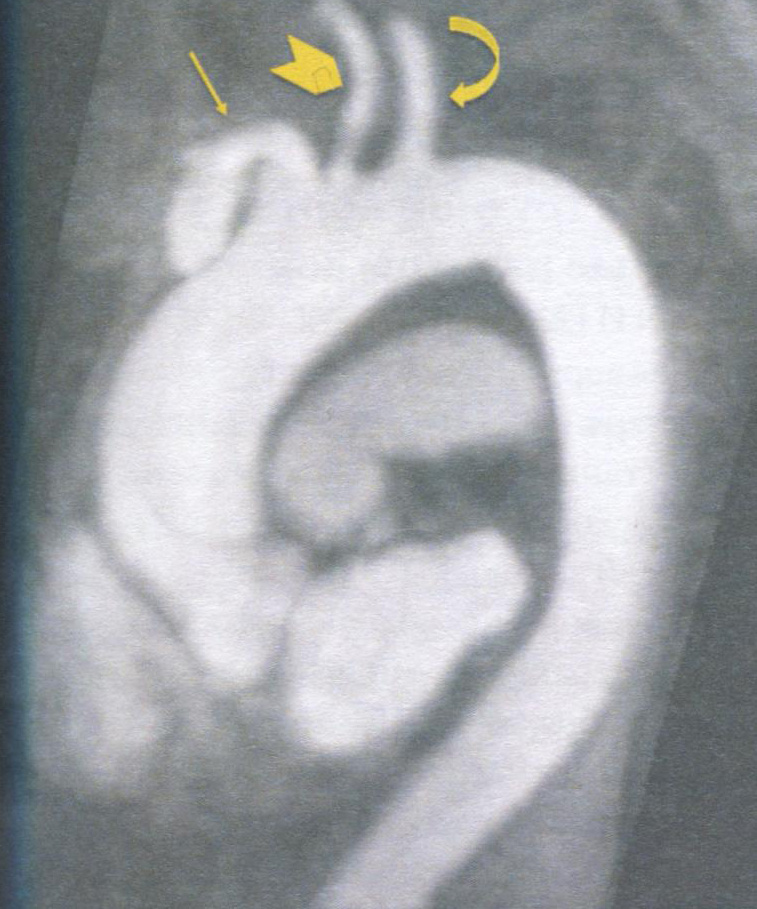
Рис. 2. Допплерография и двухмерное эхокардиографическое исследование в оценке патологии митрального клапана:
а - схема определения площади митрального отверстия при спектральном допплерографическом исследовании по времени полуспада пикового трансмитрального диастолического градиента: А - точка максимальной трансмитральной диастолической скорости потока: В - точка окончания потока пассивного наполнения ЛЖ; РНТ - время полуспада максимальной скорости потока; б, в - чреспищеводная ЭхоКГ в четырехкамерной проекции: б - врожденная надклапанная мембрана в ЛП, фиброзное кольцо митрального клапана резко сужено; в - врожденная недостаточность митрального клапана за счет укорочения и деформации хорд (верхушечный доступ). Стрелка указывает на измененные хорды; г- цветовое допплеровское картирование кровотоков (парастернальный доступ по длинной оси ЛЖ). Выраженная митральная недостаточность и эксцентрическая гипертрофия ЛЖ. Конечный диастолический размер ЛЖ составляет 6,6 см. Стрелкой указана недостаточность МК: д, е - схема полуколичественной оценки степени митральной недостаточности при цветовом допплеровском картировании кровотоков, оценка четырех степеней регургитации из верхушечного доступа: д - в четырехкамерной проекции; е - в проекции длинной оси ЛЖ; ТК - трикуспидальный клапан
Книга "Лекции по сердечно-сосудистой хирургии (изд-е 3-е переработанное, дополненное)"
Под редакцией: Л. А. Бокерия

В книге представлены лекции ведущих специалистов Научного центра сердечно-сосудистой хирургии им. А. Н. Бакулева РАМН по различным направлениям сердечно-сосудистой хирургии, а также смежным областям. Книга будет интересна для студентов, ординаторов, аспирантов, молодых специалистов и практикующих врачей.
Содержание книги "Лекции по сердечно-сосудистой хирургии" - Л. А. Бокерия
Раздел I. Общие вопросы сердечно-сосудистой хирургии
Современные медицинские информационные системы
Телемедицинские технологии в сердечно-сосудистой хирургии
Математические модели в сердечно-сосудистой хирургии:теория и практика
Основы мультиспиральной компьютерной ангиографии
Компьютерно-томографическая ангиография: показания, противопоказания, ограничения метода
Современная инструментальная неинвазивная диагностика в кардиохирургии: рациональный путь к диагнозу
Физические основы ультразвука. Локация в одномерном и двухмерном режимах. Допплеровское исследование внутрисердечных кровотоков
Ультразвуковая диагностика митральных и аортальных пороков
Чреспищеводная эхокардиография. Значение эхокардиографической диагностики во время операции (коррекция клапанной патологии, оценка сократимости миокарда у больных ишемической болезнью сердца)
Введение в кардиоанестезиологию
Современные подходы к проведению реанимации и интенсивной терапии в кардиохирургии
Интенсивная терапия новорожденных и детей первого года жизни в кардиохирургии
Реанимация и интенсивная терапия у взрослых пациентов
Искусственное кровообращение
Защита миокарда при операциях на открытом сердце (кардиоплегия)
Современные методы детоксикации в послеоперационном периоде в отделении интенсивной терапии
Инфекционный контроль в сердечно-сосудистой хирургии
Послеоперационные инфекционные осложнения в кардиохирургии
Реабилитация в кардиохирургии
Конструктивные формы и функциональные свойства протезов клапанов сердца
Клиническое использование искусственных клапанов сердца
Клеточные и генные технологии в лечении сердечно-сосудистой патологии
Раздел II. Врожденные пороки сердца
Врожденное одностороннее отсутствие легочной артерии
Внутрисердечная гемодинамика и ангиокардиографическая диагностика врожденных пороков сердца
Неонатальная кардиология
Врожденные пороки сердца с возросшим легочным кровотоком
Легочная гипертензия: клиника, диагностика и хирургическое лечение
Атриовентрикулярный канал: анатомия, диагностика и хирургическое лечение
Атрезия легочной артерии с дефектом межжелудочковой перегородки
Атрезия правого атриовентрикулярного отверстия
Диагностика тетрады Фалло
Хирургическое лечение тетрады Фалло
Двойное отхождение сосудов от правого желудочка
Аномалия Эбштейна: клиника, диагностика и хирургическое лечение
Лечение аномалии Эбштейна у детей раннего возраста (до трех лет)
Гипертрофическая обструктивная кардиомиопатия
Аномальное отхождение левой коронарной артерии от легочной артерии(синдром Бланда-Уайта-Гарланда)
Электрическая стимуляция сердца у детей
Раздел III. Приобретенные пороки сердца
Изолированные пороки митрального клапана
Изолированные пороки аортального клапана
Инфекционный эндокардит
Хирургическое лечение аневризм восходящей аорты
Раздел IV. Ишемическая болезнь сердца
Диагностика и тактика лечения больных с тяжелыми формами мультифокального атеросклероза
Острый коронарный синдром: патогенез, диагностика, лечение, подходы к реваскуляризации миокарда
Хирургическое лечение осложнений инфаркта миокарда
Операция реваскуляризации миокарда у больных с повышенным операционным риском
Альтернативные методы реваскуляризации миокарда
Миниинвазивная хирургия ишемической болезни сердца
Коронарография
Постинфарктные разрывы межжелудочковой перегородки
Раздел V. Аритмология
Клиника, диагностика, лечение тахиаритмий
Основы неинвазивной диагностики аритмий: поверхностное картирование, системы длительной регистрации электрокардиограммы, холтеровское мониторирование, электрокардиография высокого разрешения, вариабельность и турбулентность ритма сердца
Основы клинической электрофизиологии. Понятие нормы
Физиологическая электрокардиостимуляция
Имплантируемые кардиовертеры-дефибрилляторы в профилактике внезапной сердечной смерти
Раздел VI. Сосудистая патология
Врожденная гипоплазия грудного и торакоабдоминального отделов аорты
Коарктация аорты у детей старшего возраста и у взрослых
Хроническая ишемия нижних конечностей
Хроническая ишемия органов пищеварения
Альтернативные методы лечения венозной патологии
Актуальные вопросы диагностики и лечения лимфедемы и повреждений лимфатических сосудов
Хирургическое лечение окклюзирующих поражений брахиоцефальных артерий
Раздел VII. Сердечная недостаточность
Метод экстракорпоральной мембранной оксигенации в кардиохирургической клинике
Динамическая миовентрикулопластика (кардиомиопластика)
Вспомогательное и заместительное кровообращение
Трансплантация сердца в лечении критической сердечной недостаточности
Раздел VIII. Ранее читавшиеся лекции
Общие принципы реанимации и интенсивной терапии в кардиохирургической клинике
Применение полимеров в сердечно-сосудистой хирургии
Биологические протезы клапанов сердца
Хирургическое лечение ишемической болезни сердца
Вазоренальная гипертензия
Современная лучевая диагностика заболеваний сердца и сосудов
Тотальный аномальный дренаж легочных вен
Транспозиция магистральных артерий: морфология, диагностика порока и лечение больных
Ишемическая болезнь сердца (клиника, диагностика, лечение)
Реконструктивная микрохирургия артерий и вен
Асептика и антисептика. Профилактика и лечение гнойно-септических осложнений в кардиохирургии
Кардиоплегия (история, теория, разновидности)