ТРУЗИ допплерография в диагностике заболеваний простаты. Лекция для врачей
Допплерографическое исследование неизмененной предстательной железы
Кровоснабжение предстательной железы осуществляется из нижних пузырных артерий (см. рис 1.19). После отхождения от нижних пузырных артерий небольших ветвей к семенным пузырькам, основанию мочевого пузыря на уровне капсулы простаты в заднелатеральном ее отделе на уровне простатовезикального соединения происходит ее деление на две крупные группы простатических сосудов – уретральные и капсулярные ветви. Уретральные ветви идут прямо по ходу уретры и снабжают кровью периуретральные ткани и пространство возле шейки. Капсулярные ветви прободают капсулу железы, идут в радиальном направлении к центру, снабжая ткань наружных отделов железы.
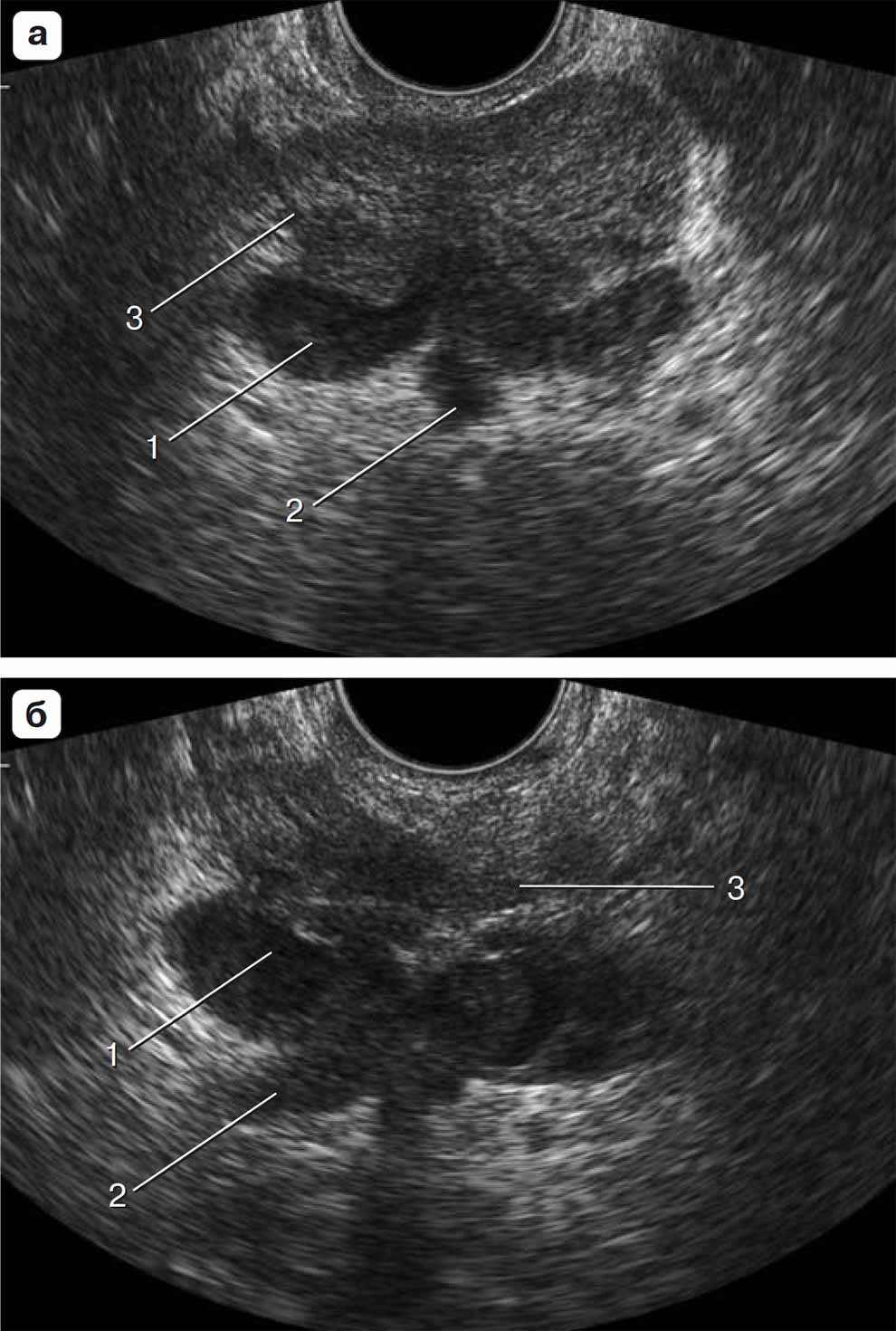
Рис. 1.41. Поперечный эхографический срез выше шейки мочевого пузыря. а – срез на уровне слияния семенных пузырьков (1) и семявыносящих трактов (2); 3 – ткань центральной зоны; б – срез чуть выше предыдущего. Визуализируются: 1 – семенные пузырьки; 2 – семявыносящие протоки; 3 – самый высокий (очень маленький по площади) срез конуса центральной зоны.
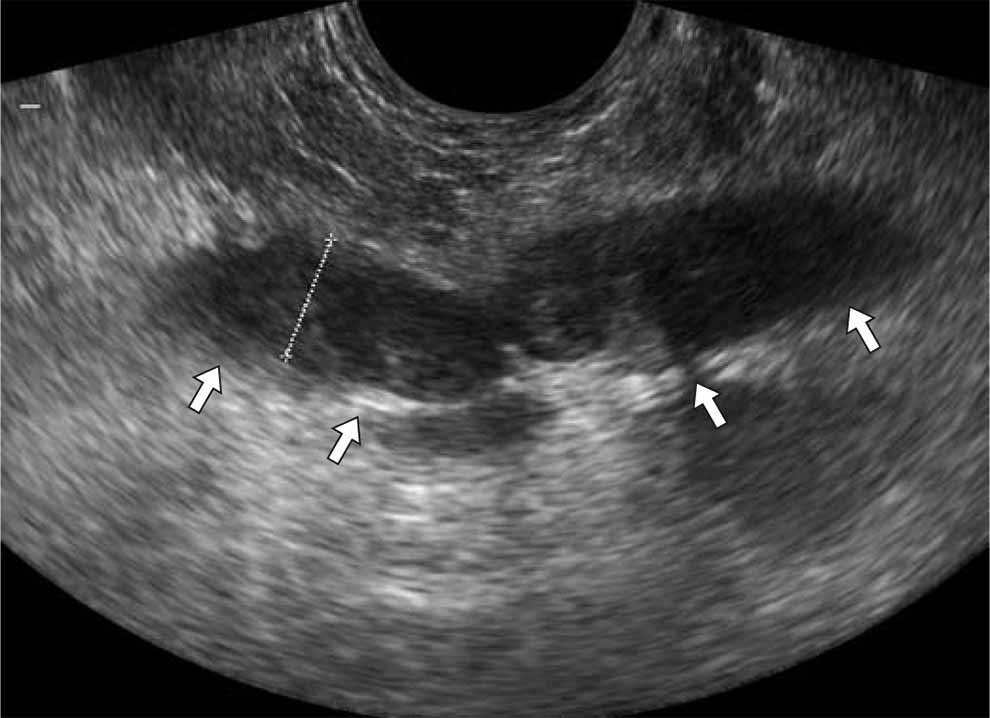
Рис. 1.42. Эхографический поперечный срез на уровне семенных пузырьков (стрелки). Предстательная железа в этом срезе уже не визуализируется.
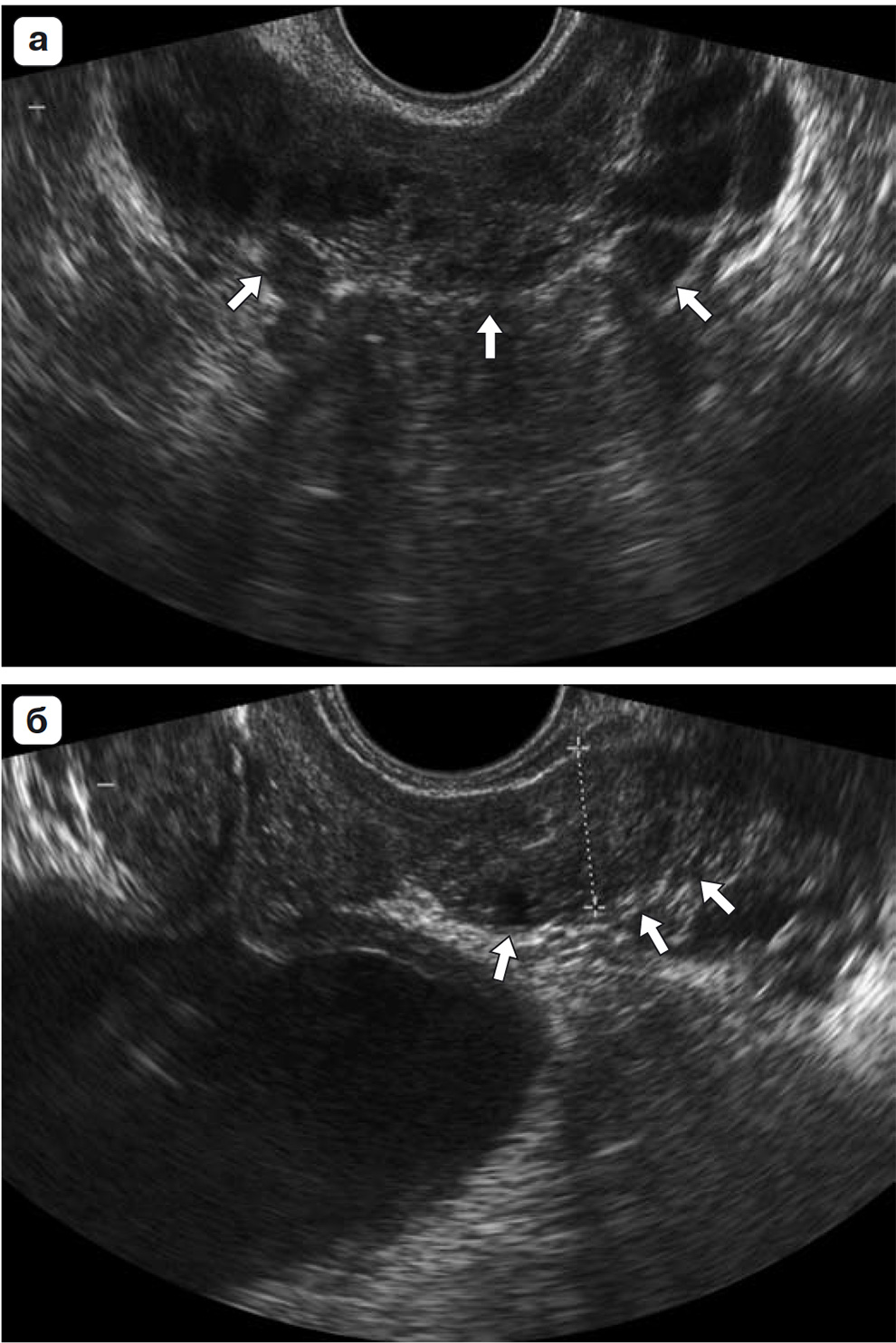
Рис. 1.43. Эхограммы перерастянутых жидкостью семенных пузырьков (стрелки). а – в поперечном срезе; б – в продольном срезе.
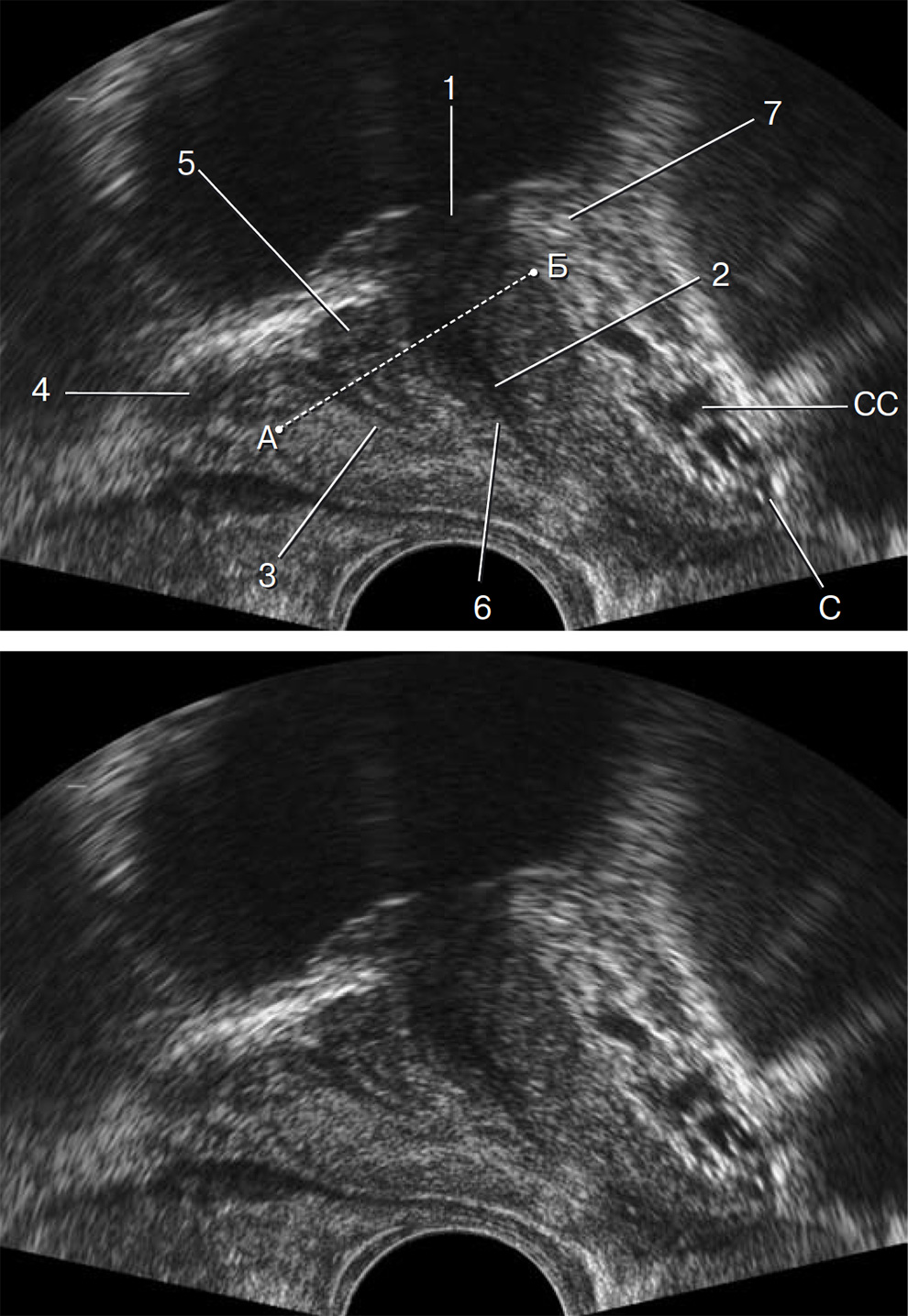
Рис. 1.44. Эхографический продольный срез на уровне уретры по ее боковому краю с одновременным изображением уретры и семявыбрасывающего тракта. Визуализируются: 1 – сфинктер мочевого пузыря; 2 – уретра; 3 – семявыбрасывающий тракт; 4 – семенной пузырек; 5 – семявыносящий проток; 6 – место слияния семявыбрасывающих протоков и уретры; 7 – фартук детрузора; А–Б – основание предстательной железы; С – верхушка предстательной железы; СС – сплетение Санторини
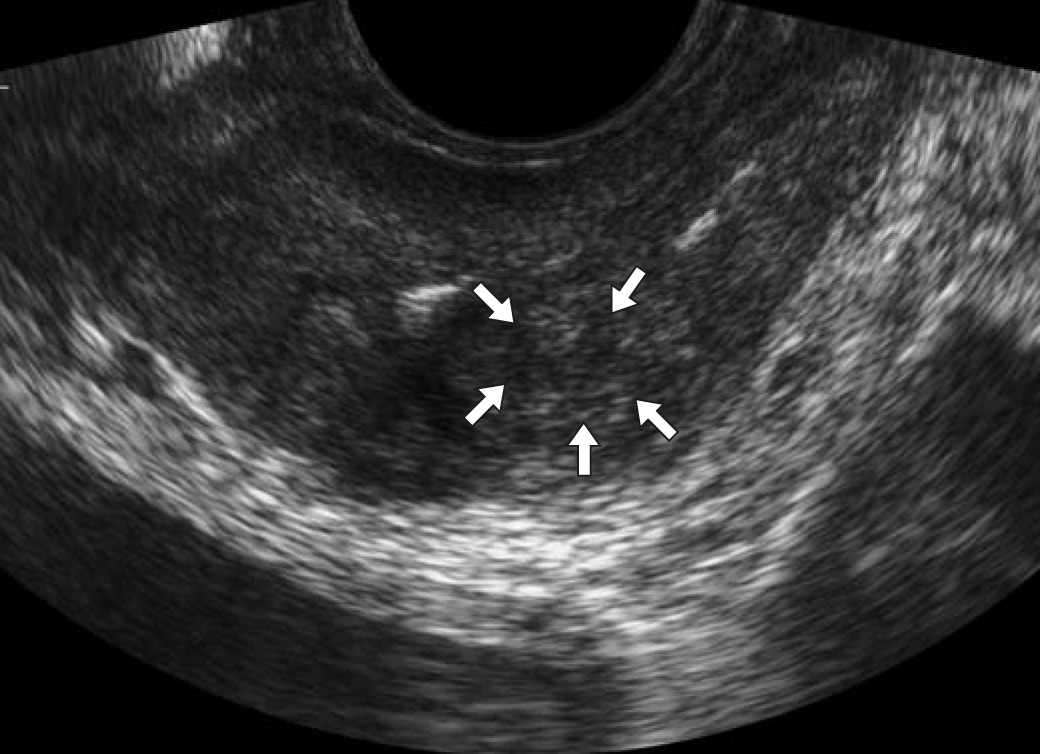
Рис. 1.45. Эхографический срез в непосредственной близости от уретры. Едва визуализируется овальной формы негиперплазированная изоэхогенная переходная зона (стрелки).
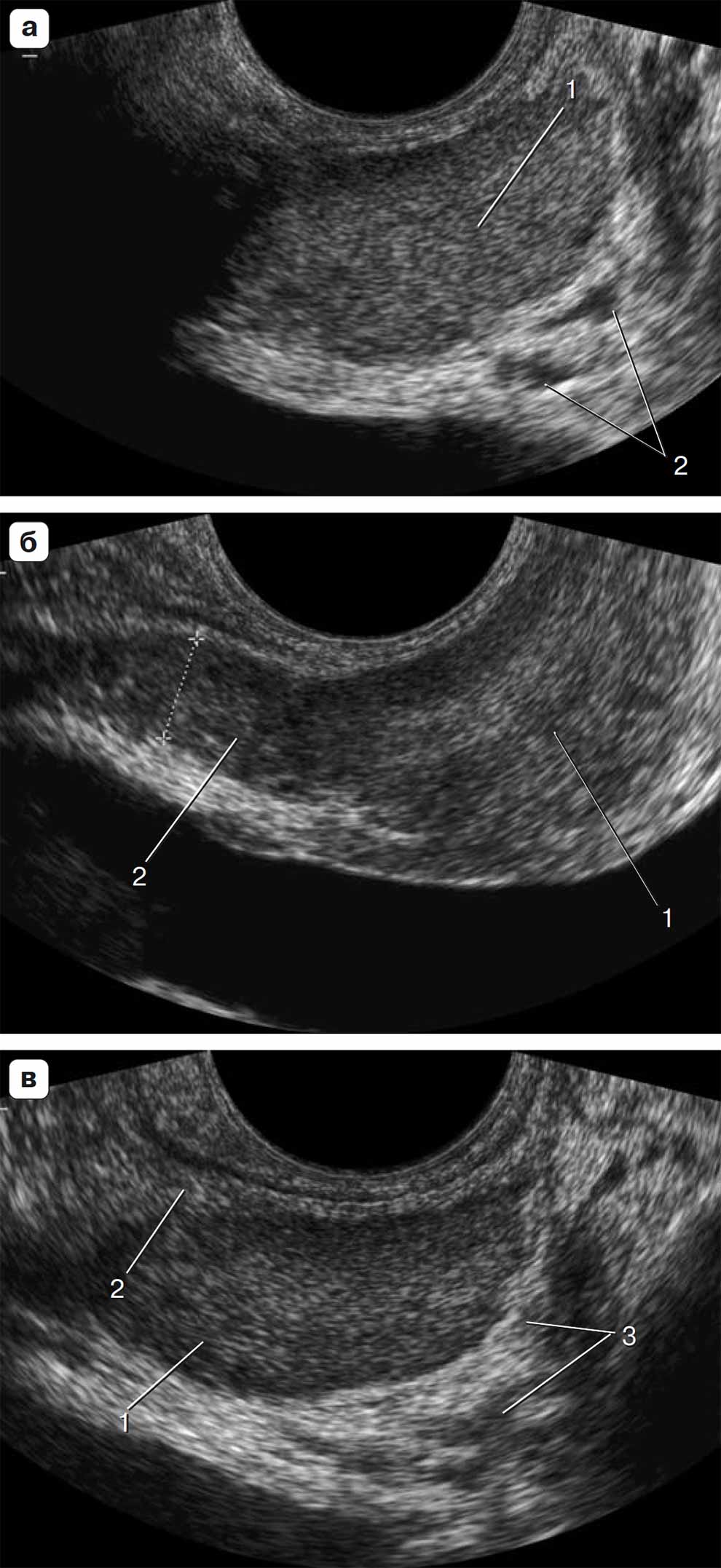
Рис. 1.46. Эхографические парасагиттальные срезы на уровне заднелатеральных отделов предстательной железы. а – в срез попадают только ткань периферической зоны предстательной железы (1) и сосудистые элементы нейроваскулярного пучка (2); б – более латеральный срез. Видны ткань периферической зоны (1), и семенные пузырьки (2); в – самый латеральный, тонкий срез предстательной железы. Визуализируются только ткань периферической зоны (1), вены простатического сплетения (2), вены сплетения Санторини у верхушки железы (3).
Венозный отток из предстательной железы осуществляется в вены сплетения Санторини. Глубокая дорсальная вена полового члена на уровне мембранозной уретры делится на три ветви – поверхностную вену и правое и левое латеральные (простатические) венозные сплетения. Простатические венозные сплетения свободно анастомозируют со срамным, пузырным и запирательным сплетениями и вместе с разветвленной сетью других сплетений формируют нижнюю пузырную вену, которая впадает во внутреннюю подвздошную вену.
Показания к проведению исследования:
- подозрение на рецидив рака предстательной железы после простатэктомии;
- острые воспаления для исключения абсцесса;
- хронические воспалительные изменения с целью уточнения генеза простатита, а также выраженности склеротических изменений в железе;
- узловые образования в предстательной железе с целью дифференциального диагноза;
- возможные аномалии васкуляризации железы, венозного оттока, наличие которых может привести к интраоперационным и ранним послеоперационным осложнениям;
- динамическое наблюдение на фоне лечения рака, аденомы предстательной железы.
Подготовка пациента: очистительная клизма накануне исследования вечером или в день исследования.
Методика проведения исследования. Качество визуализации сосудистых элементов, их количество, возможность визуализации сосуда с низкими скоростями кровотока, безусловно, зависят от чувствительности ультразвукового аппарата. Васкулярная анатомия предстательной железы гораздо лучше представлена в режиме энергетического картирования (ЭК), направленного ЭК, чем при цветовом картировании, из-за возможности регистрации потоков с небольшими скоростями кровотока, меньшей зависимости от угла наклона датчика, отсутствия феномена искажения допплеровского спектра. Оптимальным динамическим диапазоном является диапазон 103–109 дБ, частота повторения импульса – 390–400 Гц. Устанавливается частотный фильтр для регистрации возможно низких скоростей кровотока порядка 3,5–5 см/с. Датчик, защищенный специальным резиновым колпачком, вводится в прямую кишку на глубину 5–6 см. При необходимости исследования пенетрирующих вен из геморроидального сплетения цветовое или энергетическое картирование проводится практически на выходе датчика из прямой кишки (рис. 1.47).
Васкулярная ультразвуковая анатомия предстательной железы. При использовании аппаратов высокого класса в режиме ЭК без применения технологии трехмерной реконструкции и эхоконтрастных препаратов капсулярные артерии и вены в поперечных, косопоперечных срезах представлены точечными диаметром до 1 мм яркими диcкретными сигналами (рис. 1.48). Наибольшее количество пенетрирующих капсулу сосудов визуализируется у верхушки и основания железы (обычно – 2–4 сосуда) по заднелатеральному контуру (рис. 1.49). Уретральные сосуды идут от шейки мочевого пузыря к семенному бугорку. В косопоперечных срезах в режиме ЭК уретральные сосуды определяются в виде линейных, 2–4 не ветвящихся парауретральных структур, распространяющихся от шейки мочевого пузыря до семенного бугорка, не доходящих до периферической зоны (рис. 1.50). При острых воспалительных процессах в железе сосуды визуализируются и по семявыбрасывающим трактам. По заднему, заднелатеральному и частично перед нему контуру железы определяется скопление сосудистых элементов нейроваскулярного пучка (рис. 1.51).
Средние максимальные скорости кровотока в артериях предстательной железы составляют 8–13 см/с, в венах – 4–6 см/с. Среднее значение индекса резистентности, по данным К.Л. Локшина, равно 0,543–0,6; по данным A.K. Leventis и соавт., индекс резистентности по капсулярным и уретральным ветвям составляет 0,76–0,78. В норме радиальные артерии и вены, идущие от капсулы к уретральным сосудам по ходу протоков железы, при эхографии в цветовых режимах не визуализируются. На макропрепарате предстательной железы с заливкой Макропаком (рис. 1.52) можно видеть расположение радиальных, конвергирующих к центру сосудов железы. Ана логичная допплерографическая картина наблюдается при острых простатитах вследствие резкого усиления паренхиматозного кровотока.
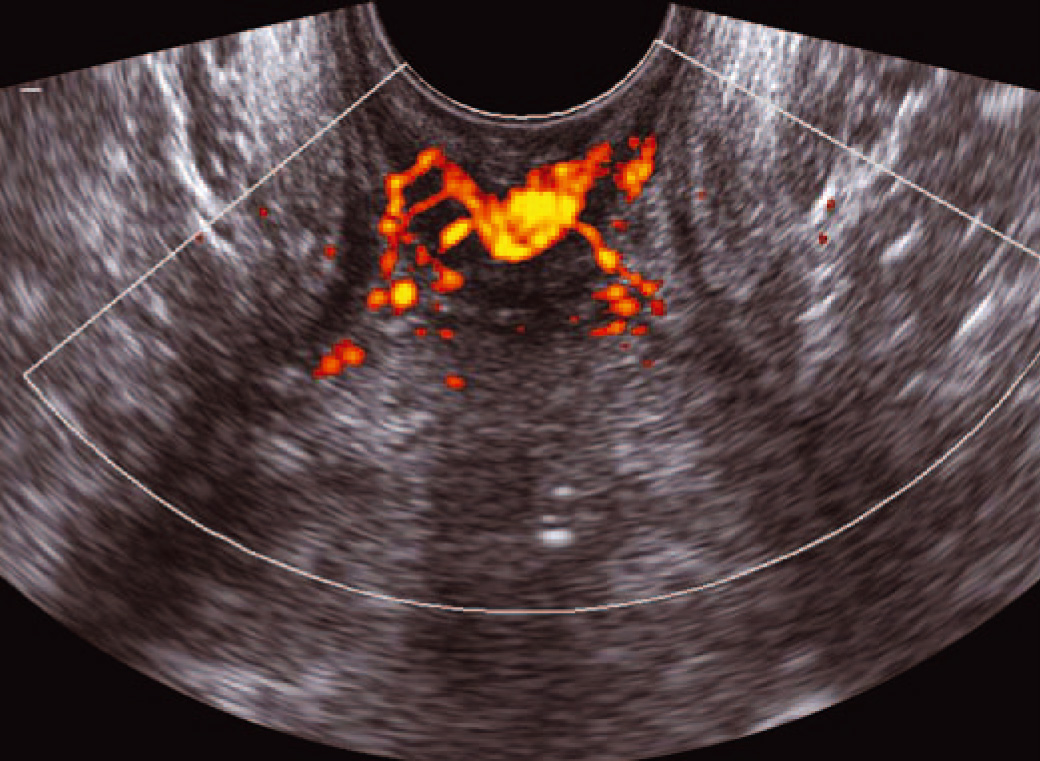
Рис. 1.47. Эхографический срез венозного геморроидального сплетения на уровне анального канала в режиме ЭК.
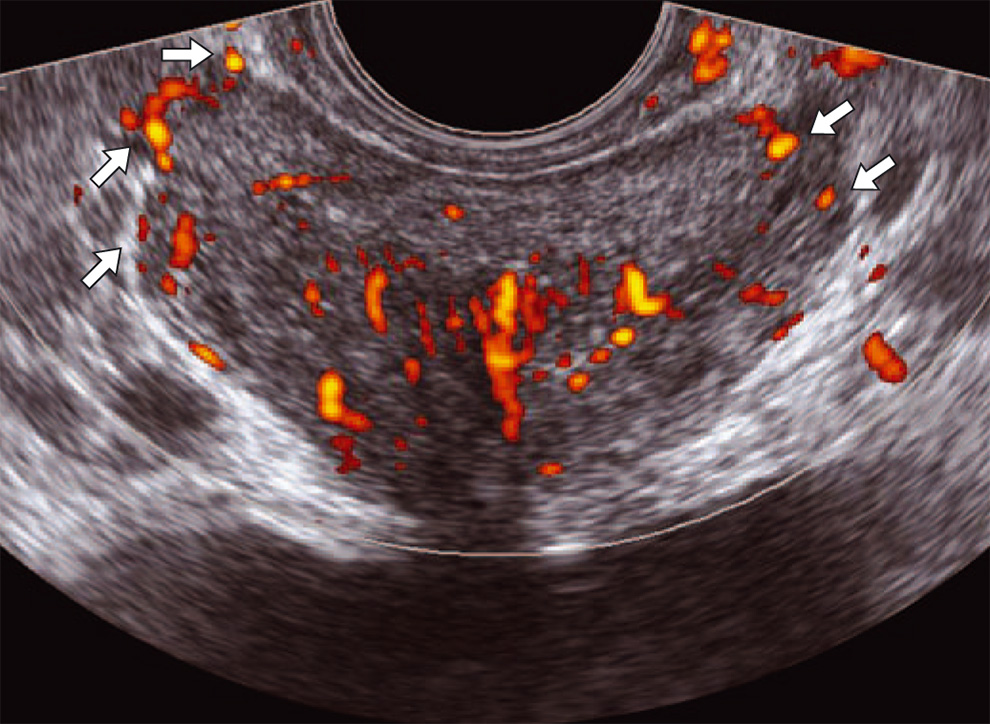
Рис. 1.48. Поперечный эхографический срез предстательной железы в режиме ЭК. Капсулярные сосуды определяются в виде дискретных точечных сосудистых структур не более 1 мм в диаметре (стрелки).
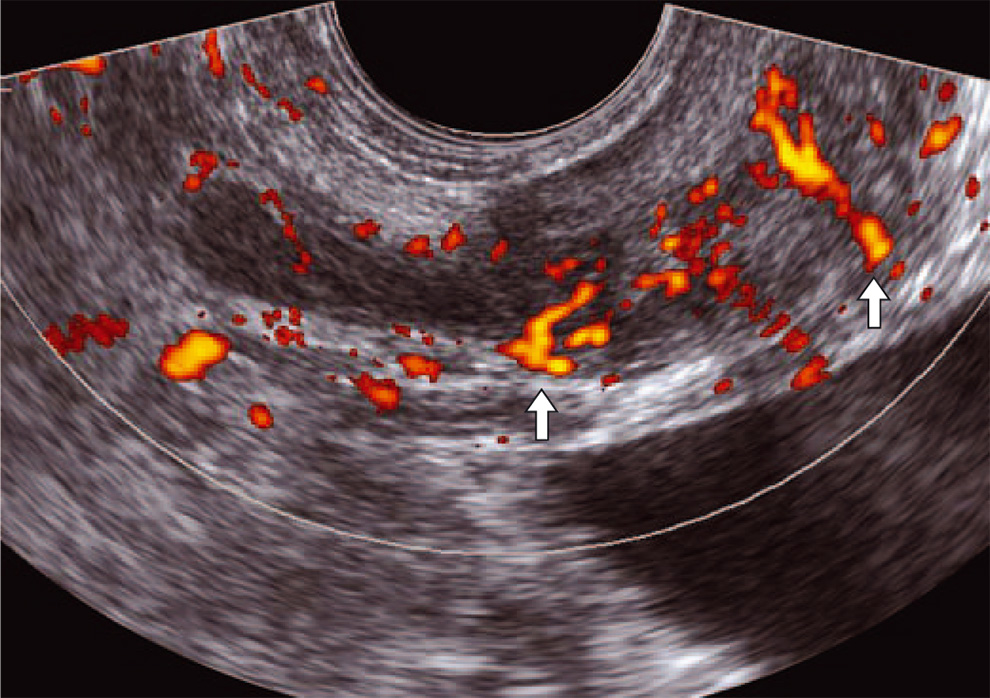
Рис. 1.49. Продольный эхографический срез предстательной железы в режиме ЭК. В области основания и средней части железы визуализируются пенетрирующие капсулу сосуды (стрелки).
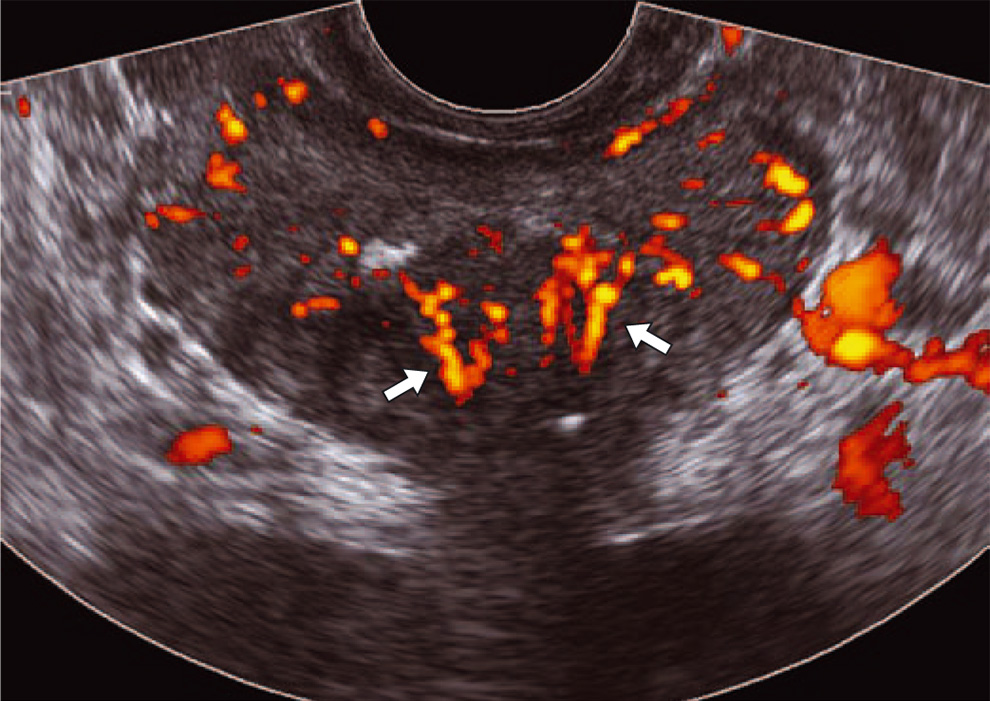
Рис. 1.50. Косопоперечный срез предстательной железы. В данном срезе хорошо видны уретральные сосуды (стрелки).
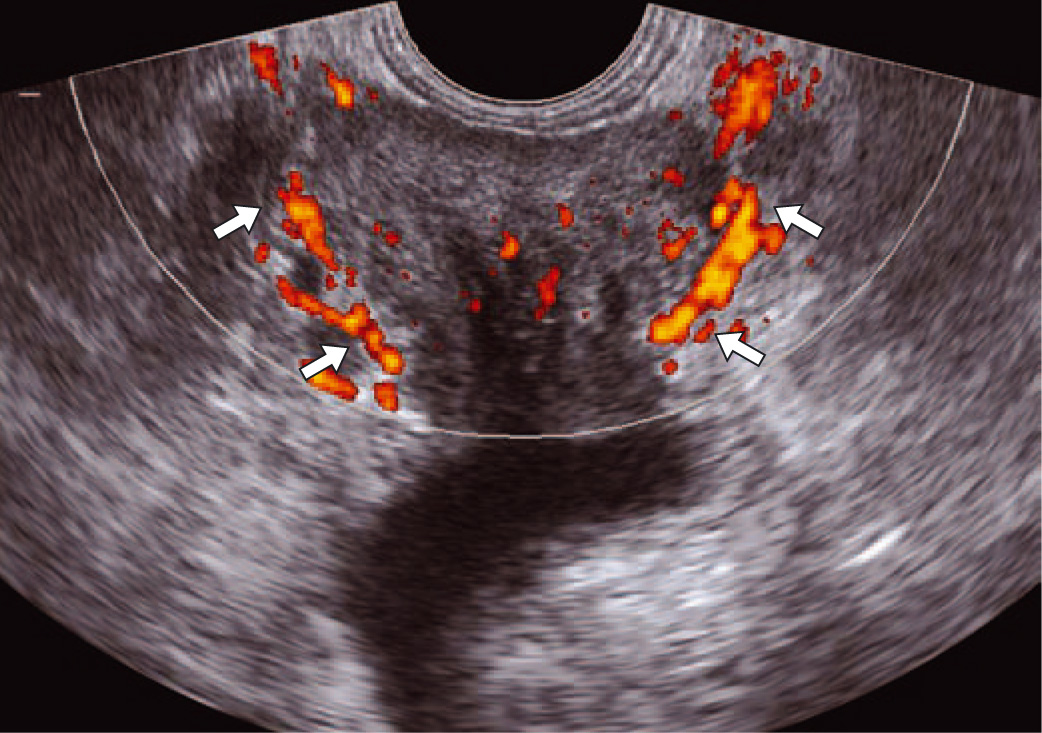
Рис. 1.51. Поперечный эхографический срез предстательной железы в режиме ЭК. На незначительном удалении от капсулы железы в ареоле из жировой клетчатки визуализируются элементы нейроваскулярного пучка (стрелки).
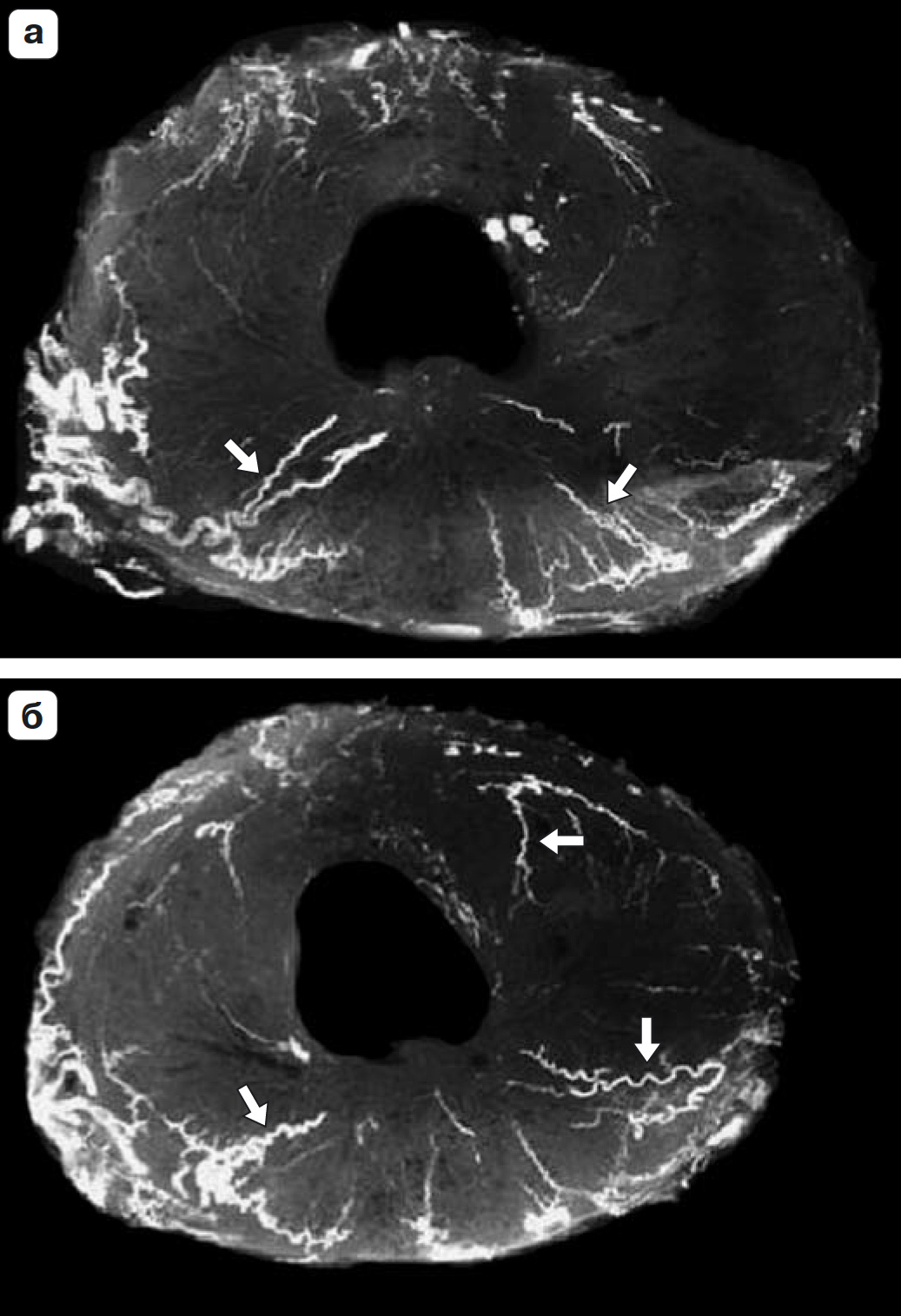
Рис. 1.52. Гистологический препарат предстательной железы с сосудистой заливкой Макропаком. а – срез на уровне семенного бугорка; б – срез выше семенного бугорка. Хорошо видны радиальные, конвергирующие к центру сосуды, которые в норме не визуализируются при ТРУЗИ (стрелки).
Расположение сосудистых элементов правой и левой долей в норме до статочно симметрично. Симметрия сосудистого рисунка является одним из наиболее важных показателей нормальной сосудистой архитектоники.
Дополнительный материал
Лекция для врачей "Трансректальная допплерография в диагностике заболеваний простаты". Лекцию для врачей подготовили уролог к.м.н. Савушкин М. С., д.м.н.Белова И. Б.
В статье приведены результаты трансректальной допплерографии простаты у 100 пациентов. Представлен сравнительный анализ показателей гемодинамики в сосудах простаты в норме и при различных её заболеваниях. Полученные данные могут иметь значение в дифференциальной диагностике заболеваний простаты при трансректальном ультразвуковом исследовании.
Хронический простатит, рак и доброкачественная гиперплазия предстательной железы (ДГПЖ) являются наиболее распространенной патологией у мужчин. Часто имеет место сочетание этих заболеваний. Учитывая высокую медицинскую и социальную значимость болезней простаты, их ранняя и точная диагностика имеет большое практическое значение. Среди методов диагностики заболеваний простаты, ультразвуковое исследование (УЗИ) играет важную роль. В результате использования высокочастотных датчиков трансректальное ультразвуковое исследование (ТРУЗИ) обладает неоспоримым преимуществом над другими методами ультразвукового исследования простаты. Возможности ТРУЗИ значительно расширились с появлением цветового допплеровского и энергетического картирования, импульсной допплерографии, трехмерной и эхоконтрастной ультразвуковой ангиографии. Использование этих методик позволяет визуализировать сосудистые структуры железы, производить оценку сосудистого рисунка, степени васкуляризации и изменений гемодинамики при различных заболеваниях простаты. Однако разные авторы дают неоднозначную оценку возможностям трансректальной допплерографии в выявлении и дифференциальной диагностике заболеваний простаты, что требует дальнейшего изучения этого вопроса.
Цель исследования
Уточнить диагностические возможности ТРУЗИ с допплерографией при заболеваниях простаты, сопоставив результаты ТРУЗИ с гистологическим материалом (биопсийным или послеоперационным).
Материалы и методы исследования
Для определения возможностей ТРУЗИ в диагностике заболеваний простаты нами в 2011 и 2012 годах было обследовано 100 пациентов. Из них: 15 здоровых добровольцев без патологии простаты в возрасте 18–55 лет (средний возраст 34 года) – группа сравнения,
25 больных раком предстательной железы (РПЖ) в возрасте 53–82 лет (средний возраст 69 лет), 30 больных ДГПЖ в возрасте 51–81 лет (средний возраст 67 лет) и 30 больных простатитом в возрасте 29–62 лет (средний возраст 47 лет).
Всем проводили пальцевое ректальное исследование, трансабдоминальное ультразвуковое исследование (ТАУЗИ) и ТРУЗИ с допплерографией на УЗ сканере Esaote MyLab 30. При этом использовали трансабдоминальный конвексный датчик с частотой 3,5 МГц и функцией улучшенной визуализации тканей (TEI), а также внутриполостной конвексный датчик с частотами 6,6 и 7,5 МГц. У всех обследуемых определяли уровень общего простатического специфического антигена (ПСА). Трансректальная допплерография включала цветовое допплеровское картирование (ЦДК), исследование в режиме энергетического допплера (ЭД), регистрацию и анализ характеристик кровотока в импульсно-волновом допплеровском режиме (спектральный допплер).
Пациентам с подозрением на РПЖ выполнена трансректальная мультифокальная биопсия простаты. Часть больных ДГПЖ получили радикальное оперативное лечение (чреспузырная аденомэктомия или трансуретральная резекция). В дальнейшем проводили сопоставление данных пальцевого ректального исследования, уровня ПСА, результатов ТАУЗИ и ТРУЗИ и полученного гистологического материала. Выполнено сравнение показателей гемодинамики в сосудах простаты в норме и при различных её заболеваниях. Статистическая обработка
результатов выполнена с использованием программного обеспечения Maple 9,50 2004 года и Microsoft Excel 2002 года. Определены средние значения и средняя арифметическая ошибка. Для оценки существенности различий между средними величинами вычислен коэффициент
достоверности (p) по критерию Стьюдента. Различия между сравниваемыми группами признаны статистически значимыми при уровне p < 0,05.
Результаты исследования
У здоровых добровольцев группы сравнения при допплерографии нормальный (неизмененный) тип васкуляризации простаты характеризовался сохранением нормальных размеров и хода сосудов, симметричностью сосудистого рисунка, отсутствием его очаговых или диффузных изменений (усиление или обеднение).
В режиме импульсной допплерографии зарегистрированы показатели кровотока в уретральных, капсулярных и интрапростатических артериях простаты у добровольцев группы сравнения и у больных простатитом, а так же в сосудах узлов гиперплазии у больных ДГПЖ и в сосудах опухолевой ткани у больных РПЖ. При этом были определены скорость кровотока (Vmin), средняя линейная скорость кровотока (Vсред), индекс пульсации (PI), индекс резистентности (RI), систоло-диастолическое соотношение (S/D).
При ТРУЗИ в режимах ЦДК и ЭД у всех (100%) больных ДГПЖ в узлах гиперплазии выявлен усиленный сосудистый рисунок гиперпластического типа. Для которого характерны одинаковый калибр и отсутствие прерывистости сосудов, огибание сосудами аденоматозного узла, расположение сосудов по периферии узла (рис. 1).
При трансректальной допплерографии у больных РПЖ злокачественные очаги в основном (80%) были гиперваскулярные с дезорганизованным типом сосудистого рисунка (извитые, прерывистые, разного калибра, хаотично расположенные сосуды) (рис. 2). Корректно измерить количественные показатели гемодинамики непосредственно в сосудах опухолевой ткани (РПЖ) удалось у 18 из 25 больных, в остальных случаях это не представлялось возможным из-за малого калибра, хаотичного расположения и выраженной извитости опухолевых сосудов.
У большинства (75%) больных простатитом при ТРУЗИ в режимах ЦДК и ЭД сосудистый рисунок был обычный (симметричный, без очаговых или диффузных изменений). У больных с выраженными фиброзными изменениями в простате (15%) сосудистый рисунок был диффузно ослаблен, обеднен, но оставался симметричным (рис. 3). У больных с обострением простатита (10%) сосудистый рисунок был диффузно усиленный, симметричный (рис. 4).
Сравнительный анализ показателей гемодинамики в артериях простаты в норме и при различных её заболеваниях представлен в таблице 1 и рисунках 5 и 6. Анализ полученных данных показал, что самые низкие средние значения Vmax, Vmin и Vсред были обнаружены в сосудах опухолевой ткани у больных РПЖ: 13,8см/с; 1,18 см/с; 7,49 см/с, соответственно (p < 0,05).
Эти параметры оказались меньше, чем у обследованных добровольцев без заболеваний простаты (группа сравнения): 16,78 см/с; 2,8 см/с; 9,8 см/с соответственно. Самые высокие средние значения Vmax, Vmin и Vсред обнаружены у больных ДГПЖ: 23,15 см/с; 3,5 см/с и 13,23 см/с, соответственно (p < 0,05).
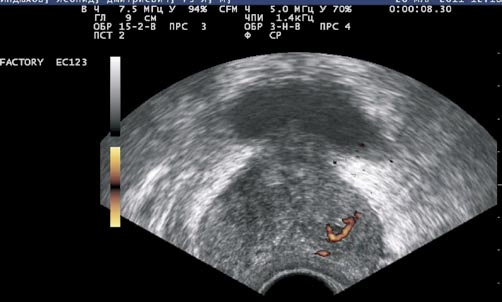
Рис. 1. ТРУЗИ простаты в режиме энергетического допплера. Выраженные артерии, огибающие узел доброкачественной гиперплазии
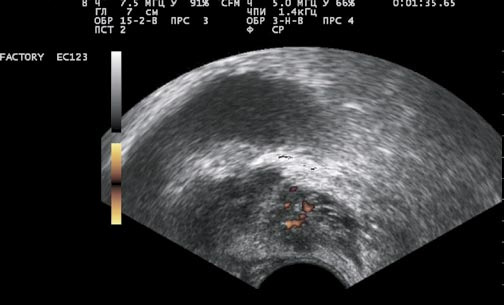
Рис. 2. ТРУЗИ простаты в режиме энергетического допплера. Сосуды ракового узла извитые, прерывистые, хаотично расположенные
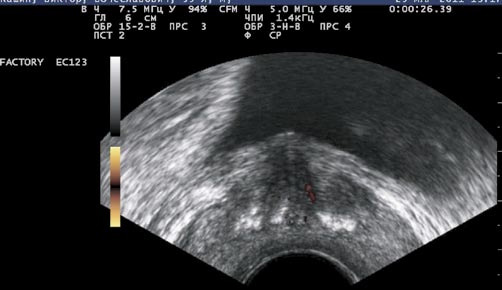
Рис. 3. ТРУЗИ простаты в режиме энергетического допплера. Симметричное ослабление сосудистого рисунка простаты при хроническом простатите с выраженными фиброзными изменениями
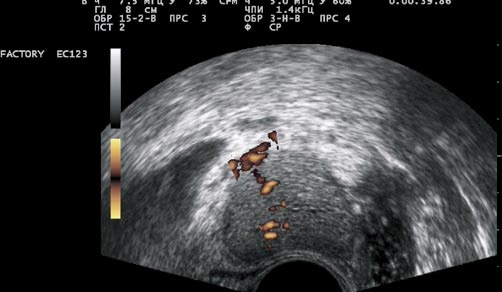
Рис. 4. ТРУЗИ простаты в режиме энергетического допплера. Симметричное усиление сосудистого рисунка при остром простатите
Табл. 1. Показатели гемодинамики в артериях простаты в норме и у больных различными заболеваниями простаты (p < 0,05)
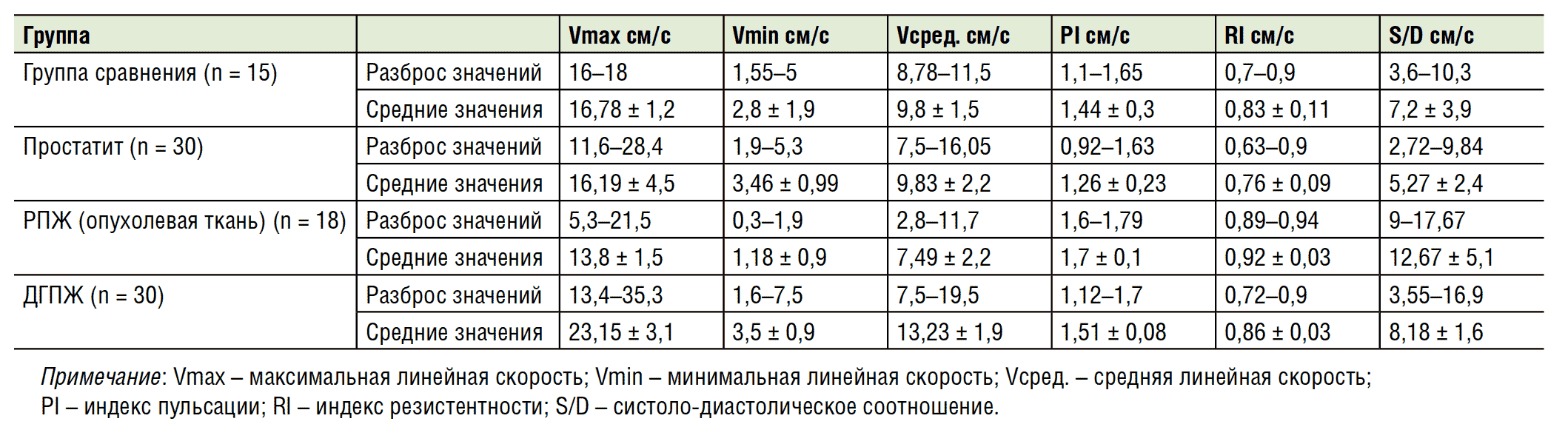
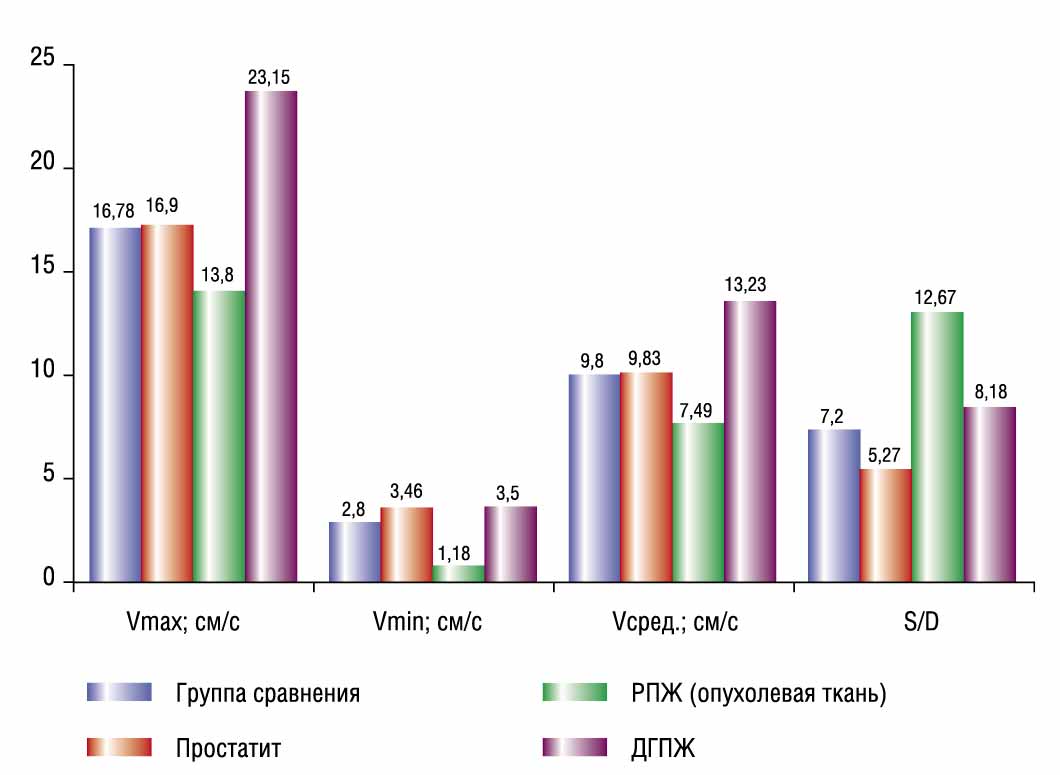
Рис. 5. Сравнительный анализ показателей гемодинамики в артериях простаты в норме и при различных её заболеваниях (p < 0,05)
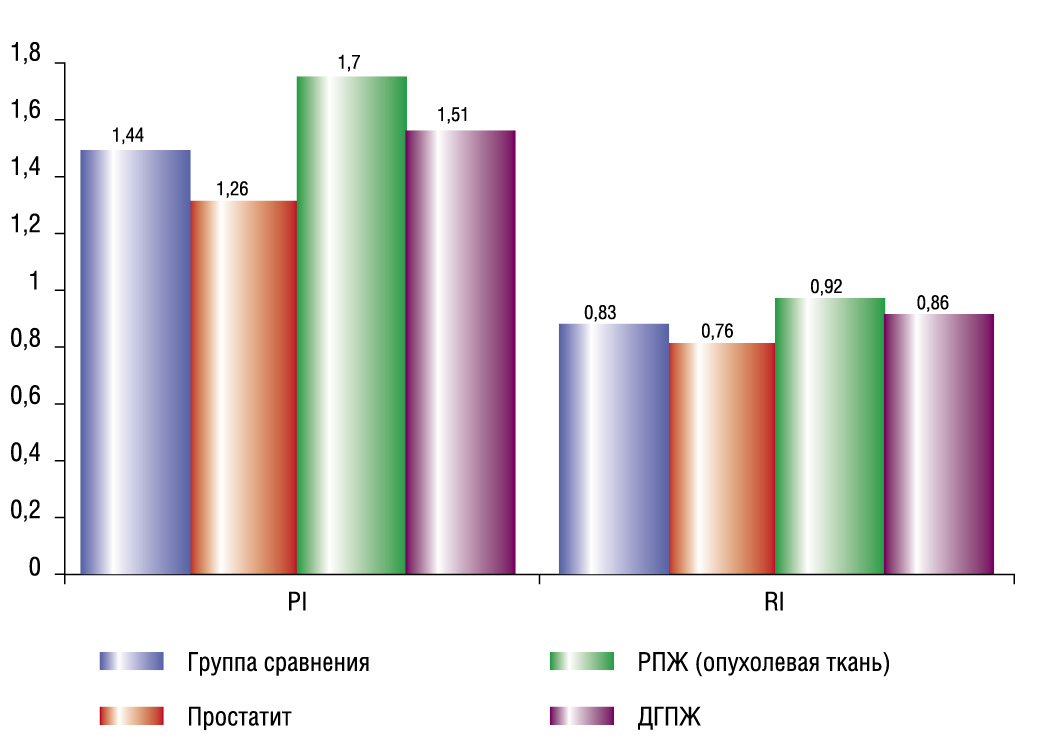
Рис. 6. Сравнительный анализ индексов пульсации и резистентности в артериях простаты в норме и при различных её заболеваниях (p < 0,05)
У больных простатитом среднее значение Vmax (16,- 19см/с) было меньше, чем в группе сравнения, но больше, чем в группе РПЖ; среднее значение Vmin (3,46см/с) было больше, чем в группе сравнения и приблизительно равнялось таковому в группе ДГПЖ; среднее значение Vсред (9,83 см/с) было приблизительно равно аналогичному показателю группы сравнения.
Самые высокие средние значения PI, RI, S/D были выявлены у больных РПЖ: 1,7; 0,92; 12,67 соответственно. Эти параметры оказались больше, чем в группе сравнения: 1,44; 0,83; 7,2 соответственно. Самые низкие средние значения PI, RI, S/D были выявлены у больных простатитом: 1,26; 0,76; 5,27 соответственно. Средние значения PI, RI, S/D у больных ДГПЖ (1,51; 0,86; 8,18 соответственно) были меньше, чем в группе РПЖ, но больше, чем в группе сравнения. Таким образом, в нашем исследовании выявлено, что показатели гемодинамики у больных РПЖ, ДГПЖ и простатитом и у пациентов группы сравнения достоверно отличались (p < 0,05).
Выводы
Таким образом, проведенное исследование показало, что ТРУЗИ улучшает выявление и дифференциальную диагностику заболеваний простаты. Современные допплерографические методики расширяют диагностические возможности ТРУЗИ. Показатели информативности комплексного ТРУЗИ в нашей работе оказались следующими: чувствительность – 80%; специфичность – 93%; точность – 75%. Степень васкуляризации, тип сосудистого рисунка и гемодинамические показатели у больных РПЖ, ДГПЖ, простатитом и у пациентов группы сравнения достоверно отличались. Для узлов ДГПЖ в нашем исследовании была характерна гиперваскуляризация и гиперпластический тип сосудистого рисунка. Очаги РПЖ были гиперваскулярные с дезорганизованным типом сосудистого рисунка. Степень васкуляризации и сосудистый рисунок у больных простатитом отличались от группы сравнения только при выраженных фиброзных изменениях простаты – симметричное, диффузное ослабление васкуляризации; и при обострении простатита – симметричное, диффузное усиление васкуляризации.
Полученные нами результаты исследования в целом соответствуют литературным данным. Однако, данные исследований разных авторов о методике измерений и показателях кровотока в сосудах простаты имеют заметные различия. Вопрос использования трансректальной ультразвуковой допплерографии в дифференциальной диагностике заболеваний простаты требует дальнейшего изучения.










0 комментариев