Гипоксически-ишемическая энцефалопатия новорожденных. Этиология и патогенез. Лекция для врачей
Лекция для врачей "Гипоксически-ишемическая энцефалопатия новорожденных. Этиология и патогенез" (отрывок из книги "Гипоксически-ишемическая энцефалопатия новорожденных" - Пальчик А. Б, Шабалов Н. П.)
Этиология и патогенез гипоксически-ишемической энцефалопатии (ГИЭ)
Основной причиной неонатальной ГИЭ является неадекватное поступление кислорода в ткани мозга вследствие сочетания гипоксемии и ишемии. Как правило, оба этих процесса развиваются взаимосвязанно и поэтому обсуждаются в литературе вместе.
Между тем A. Hill и J. J. Volpe (1992), условно разделяя эти процессы, следующим образом описывают наиболее важные причины церебральной гипоксемии и ишемии (табл. 2.1, 2.2).
Обсуждая представленную авторами схему, целесообразно подчеркнуть значение антенатальной асфиксии (в отечественных источниках чаще употребляется термин «антенатальная гипоксия») как фактора, лежащего в основе как гипоксемии, так и ишемии мозга и у доношенных, и у недоношенных детей. Это особенно важно, поскольку именно антенатальная и, как правило, более ранняя гипоксия является главным предрасполагающим фактором к развитию ГИЭ к моменту рождения, и именно антенатальная гипоксия является основной прямой причиной развития ДЦП (Nelson К.В., Ellenberg J. H., 1981).
Таблица 2.1 Основные причины церебральной гипоксемии
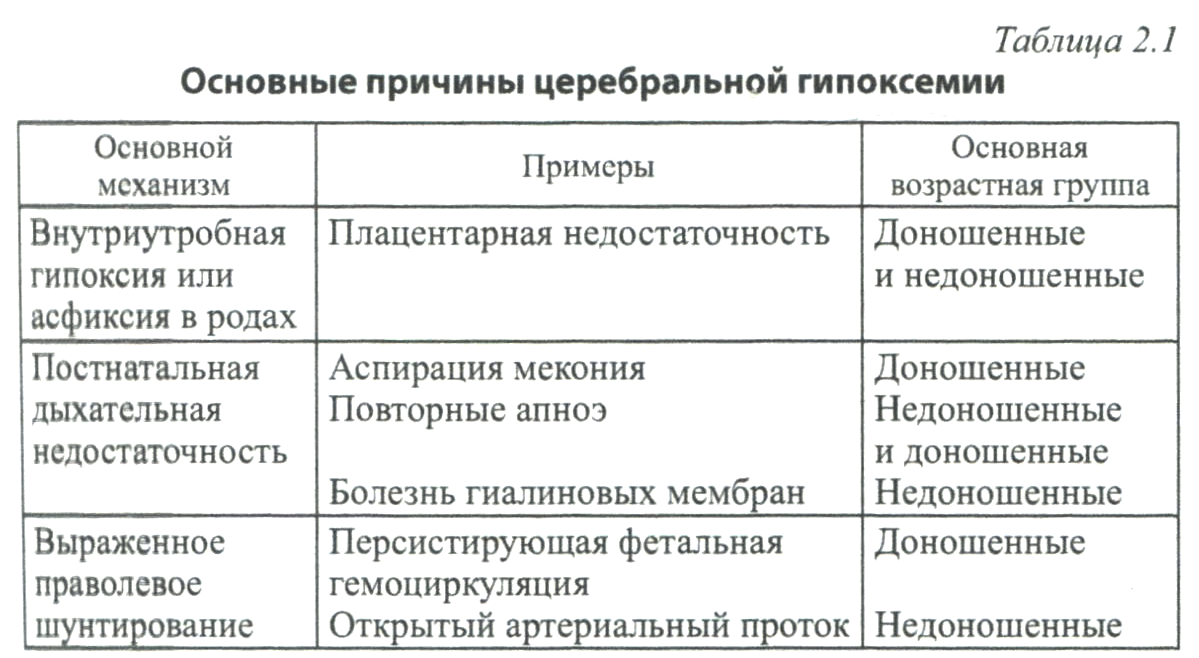
Таблица 2.2 Основные причины церебральной ишемии

Необходимо также упомянуть экспериментальные исследования, проведенные на приматах, в которых показано, что время возникновения, длительность и выраженность гипоксии влияют на морфологический субстрат перинатального поражения мозга и острая тяжелая асфиксия в основном вызывает изменения в стволовых структурах мозга, менее выраженная длительная асфиксия - диффузные корковые нарушения. Н. П. Шабалов и соавт. (2003), рассматривая реакцию новорожденного на тяжелую гипоксию сквозь призму патогенеза шока, отмечают 3 основных периода в течении острой гипоксии: нарушение дыхания и центральной гемодинамики; энергодефицит сердца и мозга; недостаточность отдельных органов или функциональных систем (полиорганная недостаточность).
Одним из важнейших механизмов патогенеза ГИЭ является нарушение мозгового кровотока. Первым ответом на значительную перинатальную гипоксию служит перераспределение сердечного выброса с увеличением кровоснабжения жизненно важных органов, в частности головного мозга (Volpe J. J., 2001). Дальнейшая артериальная гипотензия приводит к уменьшению церебральной перфузии. Существенным моментом в развитии гипоксически-ишемических поражений мозга является взаимоотношение церебральной гипоперфузии и сосудистой архитектоники мозга: у доношенных детей церебральная гипоперфузия вовлекает преимущественно кору головного мозга и парасагиттальные зоны на месте водораздела бассейнов передней, средней и задней мозговых артерий; у недоношенных детей эти зоны менее ранимы из-за наличия анастомозов с менингеальными артериями, а более уязвимо перивентрикулярное белое вещество в областях между субэпендимальными сосудами и пенетрирующими ветвями передней, средней и задней мозговых артерий (De Reuck J.L., 1984; Hill A., Volpe J. J., 1992; Volpe J.J., 2001). Церебральная гипоперфузия встречается чаще у недоношенных детей и диагностируется при скорости мозгового кровотока менее 10 мл/100 г ткани/мин. Этот показатель зависит от выраженности гипоксии, а также наличия гипо- или гиперкапнии (Greisen G., 1992; Greisen G. et al., 1987), и в норме у доношенного ребенка колеблется от 20 до 60 мл/100 г ткани/мин (Жетишев Р.А., 1990; Hedner Т., 1978). Р. А. Жетишев (1990) представил взаимосвязь показателей церебрального кровотока, сопротивления сосудов, систолического давления и внутричерепного ликворного давления у здоровых новорожденных и у детей с острой асфиксией различной степени тяжести на фоне антенатальной гипоксии и без нее. Отмечена роль снижения систолического давления и изменения сопротивления сосудов в зависимости от тяжести гипоксии и срока жизни ребенка в снижении церебральной перфузии и повышении внутричерепного давления. D. E. Ballot и соавт. (1993) выявили обратную зависимость возникновения ГИЭ от наличия стойкой легочной гипертензии. Авторы предполагают, что стойкая легочная гипертензия может снизить продукцию свободных радикалов, а следовательно, и возможность возникновения ГИЭ.
Особое значение в условиях изменяющегося системного АД имеет сохранность или нарушение цереброваскулярной ауторегуляции - механизма, при котором вазоконстрикция и вазодилатация артериол обеспечивают относительно постоянную перфузию при широких колебаниях системного давления. H. C. Lou (1988) отмечает, что механизм ауторегуляции мозгового кровотока при ГИЭ нарушается из-за «феномена пассивного давления» между системным АД и церебральным кровотоком. У здорового доношенного ребенка интенсивность мозгового кровотока относительно независима от системного АД (рис. 2.1). Значительные колебания системного давления у доношенного новорожденного низкой степени риска оставляют стабильной церебральную перфузию вследствие спазма и дилатации церебральных артериол, т.е. ауторегуляции церебральных сосудов. Данный механизм формируется только на последних неделях III триместра беременности. У недоношенных детей низкого риска, т.е. родившихся при оптимально протекавших беременности и родах, «плато» церебральной перфузии существенно меньше, и любые экзо- и эндогенные факторы могут способствовать гиперемии или ишемии мозга. Подобная ситуация обусловлена низким уровнем ауторегуляции церебральных сосудов из-за отсутствия мышечного слоя в пенетрирующих сосудах. Снижение системного давления у недоношенных детей <30 мм рт.ст. вызывает необходимость в интенсивной терапии.
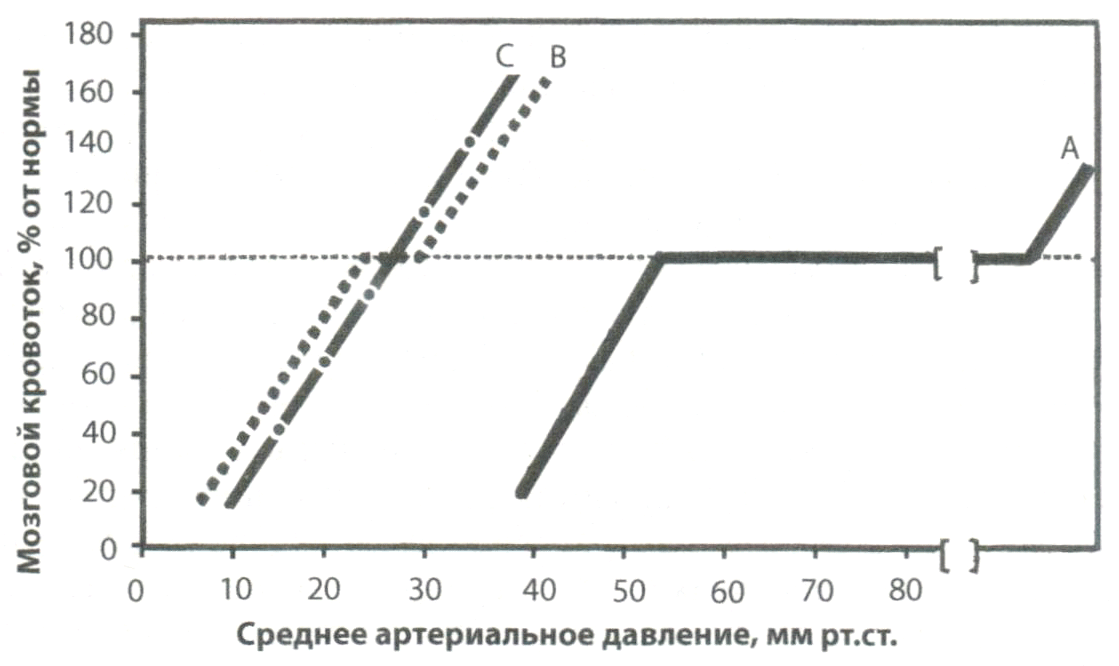
Рис. 2.1. Зависимость церебральной перфузии в процентах от нормы от системного АД у здоровых доношенных (А) и недоношенных (В) детей, а также у недоношенных детей с гипоксией (С) («феномен пассивного давления»).
Наряду с этим важно отметить, что объемная скорость мозгового кровотока в перивентрикулярном белом веществе существенно ниже, чем в кортикальном. Интенсивность мозгового кровотока в каротидном бассейне у взрослого человека колеблется от 40 до 60 мл/100 г ткани/мин, однако в перивентрикулярном белом веществе она составляет около 10 мл/100 г ткани/мин, у доношенных детей эти цифры составляют соответственно от 20 до 40 мл/100 г ткани/мин и 5 мл/100 г ткани в 1 мин, у глубоко недоношенных новорожденных - от 10 до 20 мл/100 г ткани/мин и 1,6-3,0 мл/100 г ткани/мин (Greisen G., Borch К., 2001; Volpe J.J., 2001).
В работе Л. Т. Ломако (1990) отмечается, что при перинатальных поражениях мозга у новорожденных в первые дни жизни преобладает гипокинетический тип гемоциркуляции, который в последующем переходит в гиперкинетический. Происходит снижение ударного и минутного объема кровотока, а также сердечного выброса с повышением тонуса артериальных сосудов. Выраженная прессорная реакция прекапилляров является причиной повышения диастолического и снижения пульсового давления.
Доставка кислорода тканям существенно зависит и от реологических свойств крови. Сохранение жидкого состояния циркулирующей и депонированной крови - одна из задач гемостаза - функциональной системы организма, обеспечивающей, кроме того, остановку и предупреждение кровотечений при нарушении целостности сосудистой стенки. Центральной фигурой гемостаза как ауторегуляторного процесса является тромбоцит, осуществляющий взаимосвязь эндотелия сосудистой стенки с плазменными белками, клетками крови и выполняющий ряд негемостатических функций: регуляцию тканевого роста, ангиогенез, пролиферацию нейроглии и т.д. Структурная вязкость крови существенно повышается при тяжелой асфиксии, полицитемии - факторах риска развития ГИЭ (Маряшева Н. В., 1987). У здоровых новорожденных в первые часы жизни характерна тромбогенная направленность гемостаза с диссеминированным внутрисосудистым свертыванием (ДВС) крови, сменяющаяся на 3-4-е сутки жизни гипокоагуляционной и гипоагрегационной тенденциями (Иванов Д. О., 1996; Шабалов Н. П. и др., 1986; Шабалов Н. П. и др., 1991). У детей с тяжелой и острой асфиксией при рождении тромбогенная направленность гемостаза становится еще более выраженной, чем у здоровых новорожденных (Вебер И. Н., 1988; Иванов Д. О., 1996; Чумакова Г. Н., 1987; Шабалов Н. П. и др., 1986; Шабалов Н. П. и др., 1991). Функциональное состояние системы гемостаза существенно зависит от течения беременности: у недоношенных детей, родившихся от матерей с длительным течением гестоза (более 4 нед.), хроническими заболеваниями желудочно-кишечного тракта, уже при рождении могут выявляться гипокоагуляционная и гипоагрегационная направленность гемостаза и различные виды кровоизлияний, в том числе и внутричерепные. Д. О. Иванов (1996) при лабораторном исследовании 26 параметров гемостаза выявил ДВС-синдром у 1/3 новорожденных с тяжелым течением постгипоксического синдрома при клинической манифестации геморрагического синдрома лишь у 11,1% детей.
Необходимо подчеркнуть, что особенности ауторегуляции сосудов головного мозга при гипоксически-ишемических поражениях мозга зависят от электролитного баланса и ряда биохимических факторов. Показано, что при гипоксии мозга отмечается нарастание концентрации К+ и Н+ во внеклеточной жидкости мозга, что приводит к увеличению активности корковых нейронов, дилатационной способности сосудов и снижению их констриктивной способности. Подобный эффект оказывают увеличение концентрации аденозина и осмолярность. В то же время гипоксия вызывает снижение концентрации внеклеточного Са2+ со снижением активности корковых нейронов, увеличением сократительной способности церебральных сосудов и уменьшением их дилатационной способности (Siosjo В. К., 1984). В исследованиях O. Pryds и соавт. (1988) с помощью клиренса 133Хе показано значительное увеличение мозгового кровотока в ответ на гипогликемию менее 1,7 ммоль/л.
Г. В. Яцык и соавт. (1994) с помощью спектроскопии ближней инфракрасной области спектра пытались объективизировать объем крови головного мозга в норме и у недоношенных детей с ГИЭ, однако не получили достоверной разницы между группами по этому показателю.
Резюмируя имеющиеся клинические и экспериментальные данные о нарушениях мозгового кровотока при перинатальной гипоксии, J.J.Volpe (2001) отмечает, что первоначально перинатальная гипоксия вызывает перераспределение кровотока между органами, а также гипоксемию и гиперкапнию, которые, в свою очередь, ведут к нарушениям сосудистой ауторегуляции, а дальнейшее сохранение гиперкапнии и гипоксемии — к снижению АД и скорости мозгового кровотока, что формирует ишемическое поражение мозга. С другой стороны, повышение АД как реакция на гипоксию закономерно приводит к увеличению скорости мозгового кровотока, что может способствовать развитию кровоизлияния. Ш. Р. Сафин (1991) показал, что перенесенная гипоксия нарушает формирование биоритма АД.
Несмотря на относительную резистентность к внутричерепной гипертензии у новорожденных по сравнению с детьми старшего возраста и взрослыми, при тяжелом гипоксически-ишемическом поражении головного мозга у доношенных детей, тяжелом пери- или интравентрикулярном кровоизлиянии у недоношенных детей или при гидроцефалии возможно повышение внутричерепного давления, которое зачастую приводит к экстенсивному некрозу мозговой ткани (Hill A., Volpe J. J., 1992). Максимум внутричерепной гипертензии приходится на период между 2-ми и 3-ми сутками жизни, что подтверждают измерения внутричерепного давления в субарахноидальных пространствах (Volpe J.J., 2001). У недоношенных детей изменения внутричерепного давления вследствие ишемии мозга имеют определенную специфику, и его увеличение приходится преимущественно на конец первых суток жизни (De Weerd A.W. et al., 1995).
Внутричерепная гипертензия является неблагоприятным про-гностическим признаком: из 32 детей, перенесших тяжелую гипоксию, у 7 в первые сутки жизни отмечалась внутричерепная гипертензия, из которых 3 умерло и у 4 развились тяжелые неврологические нарушения, при этом у умерших детей на аутопсии был обнаружен распространенный некроз мозгового вещества.
В целом J. J. Volpe (1974) представляет несколько цепочек патогенеза ГИЭ вследствие внутриутробной асфиксии, результатом которых становятся отек головного мозга и некроз мозгового вещества.
Внутриутробная гипоксия -> снижение насыщения кислородом и повышение насыщения углекислотой, ацидоз у плода -> внутриклеточный отек -> набухание мозговой ткани —»локальное снижение мозгового кровотока -> генерализованный отек мозга -> повышение внутричерепного давления —> генерализованное снижение мозгового кровотока -> некроз мозгового вещества.
Внутриутробная гипоксия -> снижение насыщения кислородом и повышение насыщения углекислотой, ацидоз у плода -> снижение сосудистой ауторегуляции -> снижение мозгового кровотока -> некроз мозгового вещества -> отек головного мозга.
И. А. Аршавский (1982) подчеркивал, что кратковременная внутриутробная гипоксия оказывает «тренирующее» влияние на плод и является, по его мнению, благоприятным фактором. Однако в серии работ показано, что длительный нелеченый гестоз, продолжающийся более 4 нед., уже неблагоприятно действует на плод (Кобозева Н. В., Гуркин Ю. А., 1973).
Механизмы патогенеза ГИЭ имеют свои особенности в зависимости от гестационного возраста ребенка и взаимосвязаны с морфологическим субстратом заболевания. Например, ГИЭ, протекающая с преимущественным поражением белого вещества, имеет следующие основные факторы развития: сосудистый анатомический фактор (дистальные поля кровоснабжения в перивентрикулярных зонах), церебральная циркуляция с пассивным давлением (опасность системной артериальной гипотензии), относительно ограниченная вазодилататорная способность в сочетании с гипоксемией, гиперкапнией и гипотензией, активность анаэробного гликолиза, присущая миелинопродуцирующей глии ранимость.
Приведенные данные свидетельствуют о близкой связи звеньев патогенеза с особенностями патоморфологии ГИЭ, которая будет рассмотрена в главе IV. Необходимо лишь упомянуть, что основные типы поражения мозга возникают не только в период гипоксии, но и в период, следующий за ней. В ряде случаев это может быть обусловлено «постреанимационной болезнью» (Монтгомери Т.Р., 1993; Шабалов Н. П. и др., 2003), а именно:
• эффектом реоксигенации («кислородный парадокс» - повреждающее воздействие на нейрон и глию высоких концентраций кислорода);
• длительной гипоперфузией и артериальной гипотензией;
• активностью протеолитических ферментов;
• формированием свободных радикалов и перекисным окислением липидов;
• интрацеллюлярным накоплением Са2+.
Экспериментальное изучение внутриутробной гипоксии на животных показало волнообразные изменения в мозге, когда после короткого периода нейродистрофических процессов под непосредственным влиянием гипоксии в мозге начинают доминировать синтетические, репаративные процессы, которые вновь сменяются нейродистрофическими и т.д. (Жукова Т. П. и др., 1984).
Книга "Гипоксически-ишемическая энцефалопатия новорожденных"
Авторы: Пальчик А. Б, Шабалов Н. П.

Настоящее руководство отражает многолетние многосторонние исследования авторов в области неонатальной неврологии, а также представляет обобщение научных достижений различных неонатологических и неврологических школ в этой области. Рассмотрены вопросы эпидемиологии, причины и механизмы развития гипоксических поражений головного мозга, представлены данные о морфологических изменениях в нервной системе новорожденного при гипоксии. Значительное место уделено клинической картине и современным методам диагностики гипоксически-ишемической энцефалопатии, приведены результаты оригинальных исследований авторов. Лечение рассматриваемых состояний представлено с учетом современных требований к назначению и контролю медикаментозной терапии.
Для неонатологов, педиатров, неврологов, врачей общей практики и студентов медицинских вузов.
Содержание книги "Гипоксически-ишемическая энцефалопатия новорожденных" - Пальчик А. Б.
Глава I. Эпидемиология и факторы риска возникновения гипоксически-ишемической энцефалопатии
Глава II. Этиология и патогенез гипоксическиишемической энцефалопатии
Глава III. Основные механизмы нейрохимических нарушений при гипоксически-ишемических поражениях головного мозга у новорожденных
Глава IV. Основные представления о патоморфологии гипоксических поражений головного мозга у новорожденных
Глава V. Морфофункциональные изменения в нейронных сетях при гипоксии и ишемии (модификация нейронов): пластичность и регенерация
Глава VI. Клиническая картина гипоксически-ишемических поражений головного мозга новорожденных
6.1. Нормальный и девиантный неврологический статус новорожденного
6.2. Классификации гипоксической энцефалопатии (фазовый принцип)
6.3. Классификации перинатальных поражений нервной системы (синдромологический принцип)
6.4. Особенности ряда синдромов гипоксических поражений мозга у новорожденных
6.4.1. Cиндром угнетения центральной нервной системы
6.4.2. Синдром повышенной нервно-рефлекторной возбудимости
6.4.3. Синдром внутричерепной гипертензии.
6.4.4. Судорожный синдром.
6.4.5. Кома
6.4.6. Синдром двигательных расстройств
6.5. Клинические особенности гипоксических поражений головного мозга у недоношенных детей
6.6. Течение гипоксических поражений головного мозга и клиническая картина восстановительного периода
Глава VII. Диагностика гипоксически-ишемических поражений мозга у новорожденных
7.1. Клиническая диагностика
7.1.1. Схемы неврологического обследования новорожденного
7.1.2. Шкала оценки поведения новорожденного Т. В. Brazelton
7.1.3. Неврологическая оценка доношенного новорожденного, по H. F. R. Prechtl
7.1.4. Французская схема неврологического осмотра новорожденного
7.1.5. Неврологическая оценка новорожденного
7.1.6. Скрининг-схемы оценки состояния нервной системы новорожденного (профиль угнетения–раздражения)
7.2.Ультразвуковая диагностика
7.2.1. Нейросонография
7.2.2. Допплерография
7.3. Аксиальная компьютерная томография
7.4. Магнитно-резонансная томография
7.5. Позитронно-эмиссионная томография
7.6. Околоинфракрасная спектроскопия
7.7. Магнитно-резонансная спектроскопия
7.8. Определение величины внутричерепного давления
7.9. Нейрофизиологическая диагностика
7.9.1. Электроэнцефалография
7.9.1.1. Рутинная ЭЭГ
7.9.1.2. ЭЭГ-картирование
7.9.1.3. Низкочастотная ЭЭГ, или ЭЭГ полного диапазона
7.9.1.4. Суммарная (амплитудная) ЭЭГ и мониторинг мозговой активности
7.9.1.5. Полиграфия
7.9.2. Вызванные потенциалы головного мозга
7.9.2.1. Слуховые стволовые вызванные потенциалы
7.9.2.2. Соматосенсорные вызванные потенциалы
7.9.2.3. Зрительные вызванные потенциалы.
7.9.3. Электромиография и электронейромиография
7.10. Видеозапись спонтанной двигательной активности плода, новорожденного и грудного ребенка
7.11. Биохимическая диагностика
Глава VIII. Прогноз при перинатальных поражениях головного мозга гипоксического генеза
Глава IX. Лечение и профилактика
9.1. Лечение в остром периоде гипоксических поражений головного мозга новорожденных
9.2. Лечение последствий гипоксических поражений головного мозга новорожденных
9.3. Профилактика гипоксических поражений головного мозга у новорожденных
Глава Х. Некоторые актуальные проблемы в представлениях о гипоксических поражениях головного мозга новорожденных
10.1. Границы понятий гипоксических поражений головного мозга новорожденных, гипоксически ишемической и неонатальной энцефалопатии
10.2. Сравнительная характеристика классификаций гипоксических поражений головного мозга у новорожденных
10.3. Границы понятий нормального и девиантного неврологического статуса новорожденного и ребенка раннего возраста
10.4. Проблемы диагностики гипоксических поражений головного мозга новорожденных
10.5. Корректность лечения гипоксических поражений головного мозга новорожденных
10.6. Взаимоотношение теоретической науки, нейронауки и клинической неонатальной неврологии
























0 комментариев