Лекция для врачей "COVID-19 и кишечная микробиота: подходы к комплексной терапии и реабилитации". Лекцию для врачей проводит профессор С. М. Захаренко
На лекции рассмотрены следующие вопросы:
- Применение любой стратегии защиты микрофлоры всегда лучше чем только антибиотикотерапия
- Стратегия защиты микрофлоры
- Позволяет уменьшить вероятность появления нежелательных лекарственных реакций
- То есть, мы управляем рисками
- Управляя рисками нежелательных лекарственных реакций, мы повышаем вероятность того, что пациент выполнит полный курс рекомендации
- То есть кроме управления рисками мы можем и управлять эффективностью проводимого лечения
- Позволяет уменьшить вероятность появления нежелательных лекарственных реакций
- Нежелательные эффекты антибиотиков
- Уменьшение разнообразия и плотности популяций кишечной флоры
- Влияние на физиологические механизмы восстановления эубиоза
- Рост резистентности ряда микроорганизмов с «депонированием в микробиоценозе» этих штаммов
- Модификация функциональной активности микробиоценоза
- Антибиотикоассоциированная патогенспецифическая и идиопатическая диарея
- Важная особенность:
- Отсроченный и не всегда клинически явный эффект
- Неспецифичность проявлений
- Пролонгированность существования
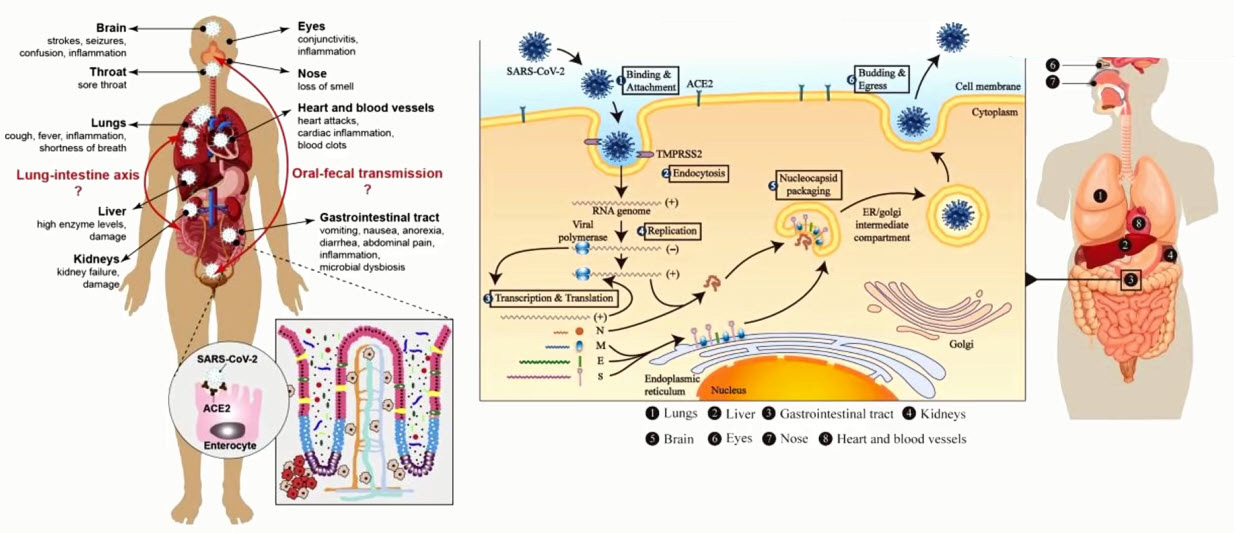
- SARS-CoV-2: органы-мишени
- Антибиотики при COVID-19: Реальность
- Данные из Китая, Испании и США показывают, что 6,9% диагнозов COVID-19 связаны с бактериальными инфекциями (3,5% диагностированы одновременно и 14,3%- после COVID-19), причем чаще у пациентов, нуждающихся в интенсивной терапии
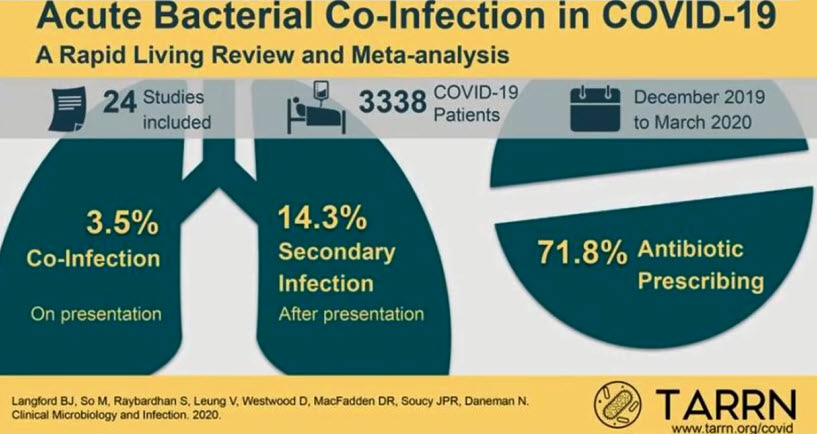
- Частота ко-инфекции и назначения антибиотиков
- 1016 пациентов с COVID-19, в том числе 12 с подтвержденной бактериальной внебольничной пневмонией (ЬСАР)
- Средний возраст 61 (48-74) год
- 46% (п = 473) составляли женщины
- 189 (19%) были госпитализированы из учреждения длительного ухода (LTCF), средний индекс коморбидности Чарлсона 2 (1-3)
- 57 (5,7%) имели иммунодефицитное состояние
- 118 (12%) госпитализированы в ОРИТ
- 310 (30,5%) отнесены к группе высокого риска развития септического шока
- Средняя продолжительность госпитализации 7,1 (4-12,7) дней
- Антибиотикотерапия
- 71% (717/1016) - получил хотя бы 1 дозу АМП
- В подгруппе пациентов, выживших после 5 дней госпитализации (п = 977), 100% доказанных / вероятных случаев и 81% возможных случаев (ЬСАР) и 59% пациентов без коинфекции получали антибиотики
- Большинство пациентов (67%) без признаков ко-инфекции и 45% пациентов с возможным ЬСАР прекратили прием антибиотиков в течение 48 часов
- Средняя продолжительность терапии
- 4,1 (1,1-10,2) дня для доказанной / вероятной ЬСАР
- 3,6 (1-5,8) для возможного
- 1 (0-4) дня при отсутствии бактериальной ко-инфекции ( Р<0,01)
- Использование антибиотиков со временем снизилось: май 61%; апрель - 75%; март 77% (Р <0,01)
- Продолжительность терапии была короче в мае 1 [0-4] дня), чем в марте или апреле - 2,9 [0-5,1] дня; Р <0,01.
- Частота ко-инфекции и назначения антибиотиков
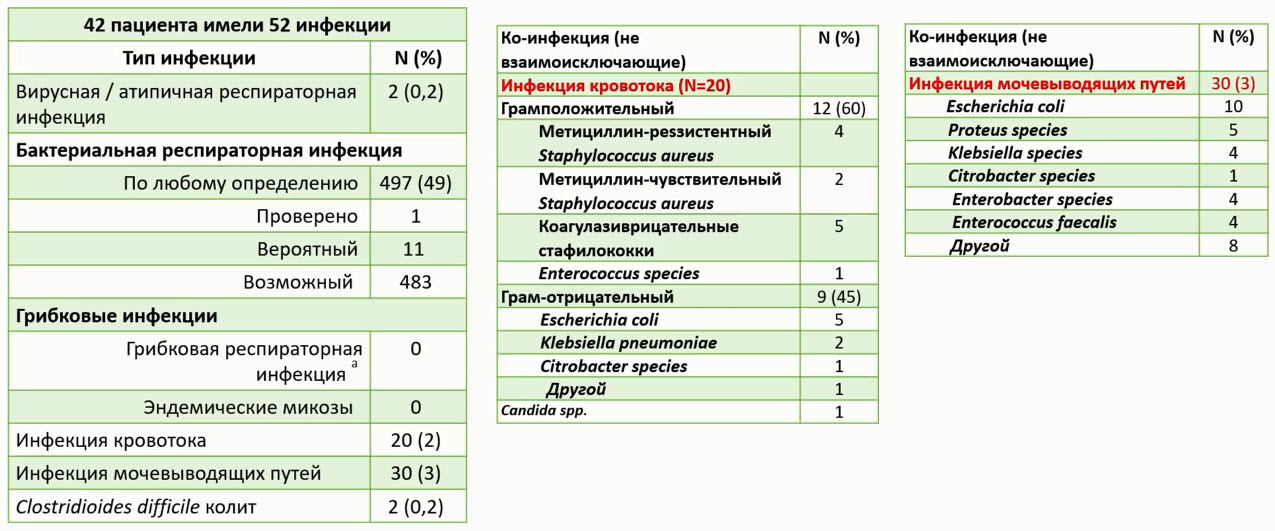
- Выбор АМП
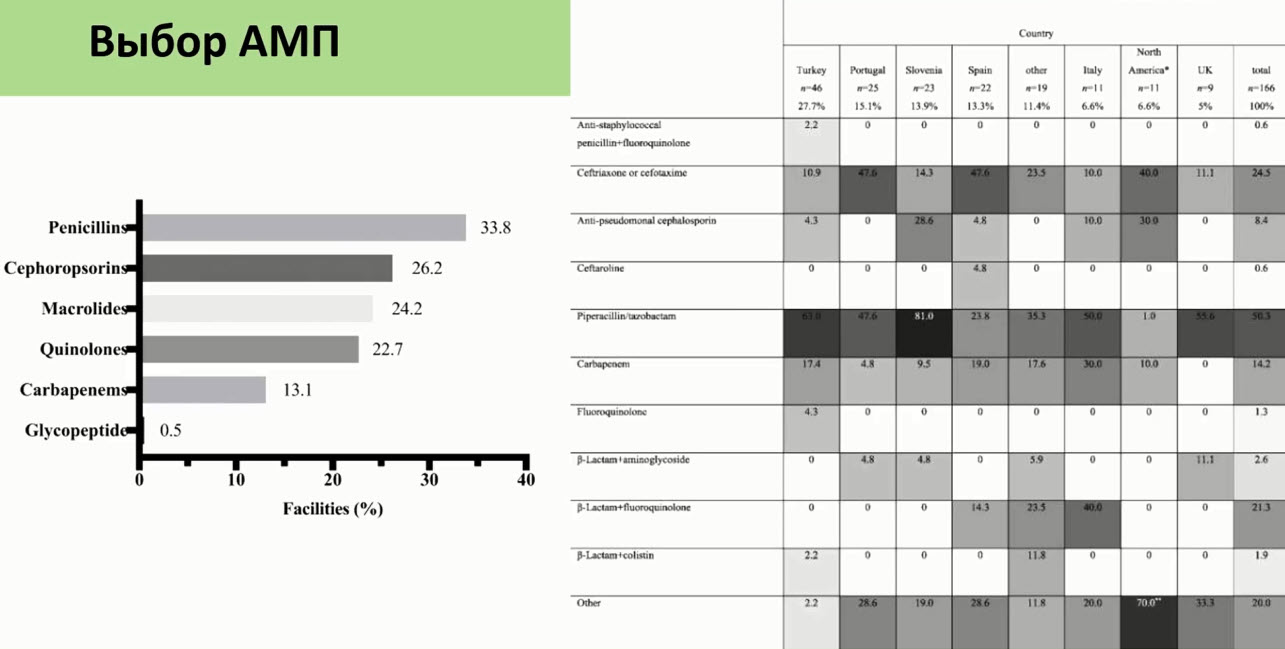
- Антибиотики-триггеры при ААД и CDI
- Комбинированная антибиотикотерапия
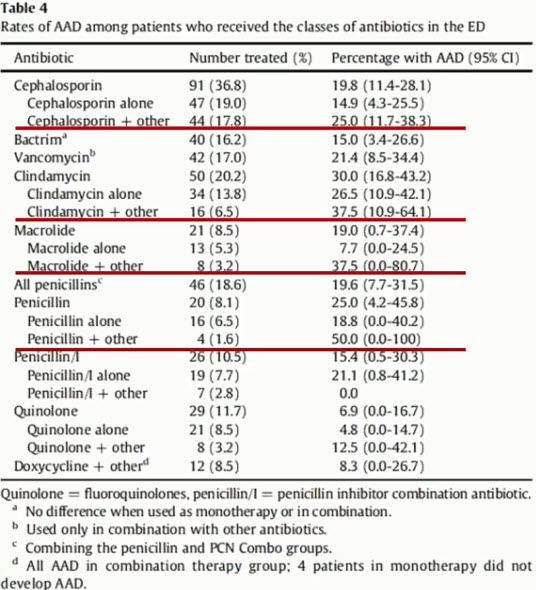
- Пациенты с COVID-19, поступающие в стационар в абсолютном большинстве случаев уже получали антибиотики
- Чаще всего в России на амбулаторном этапе применяются азитромицин и респираторные фторхинолоны
- Часть пациентов поступает в стационар переводом из других лечебных учреждений
- Пациенты в ОРИТ поступают как с амбулаторного этапа, так и переводами внутри стационара и из других стационаров
- Пациенты, проходящие лечение в ОРИТ в абсолютном числе случаев коморбидны и имеют факторы риска инфицирования микроорганизмами с МЛУ
- Риск развития ААД у них высокий
- Изменения микробиома кишечника при COVID-19
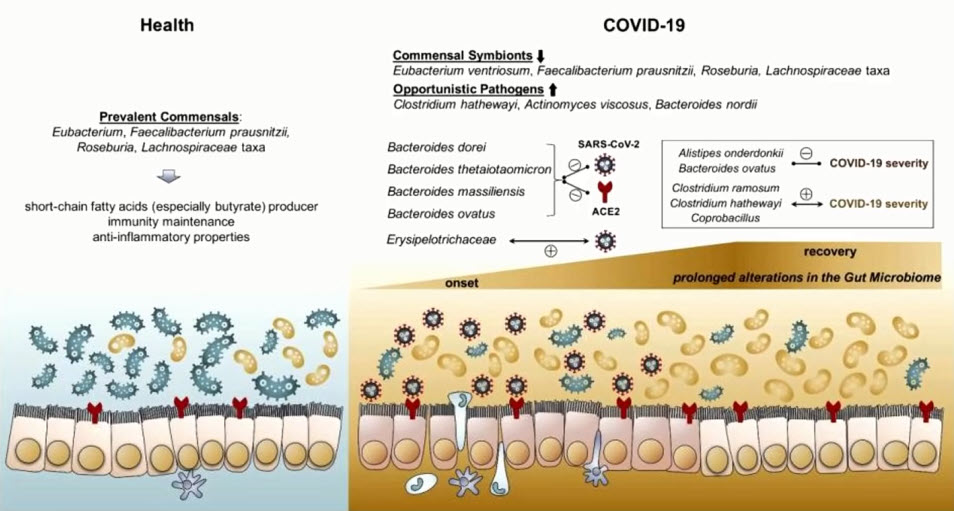
- Изменения микробиома кишечника при COVID-19
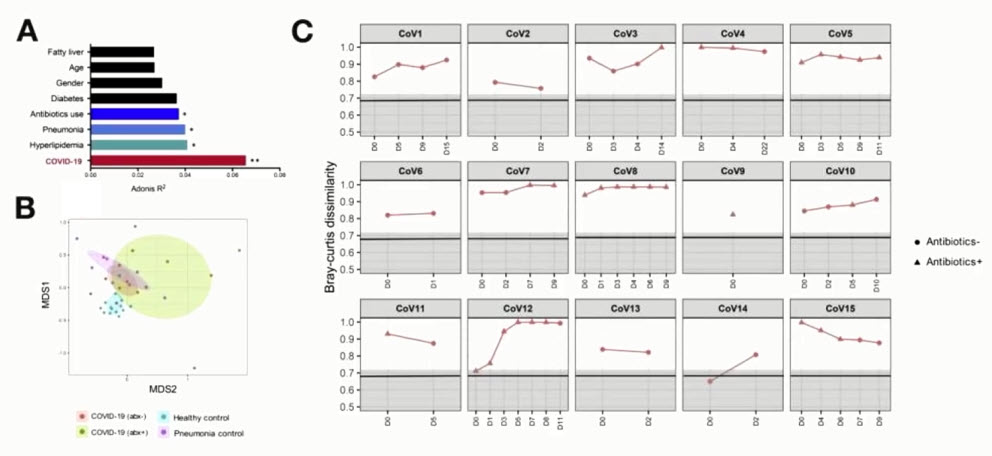
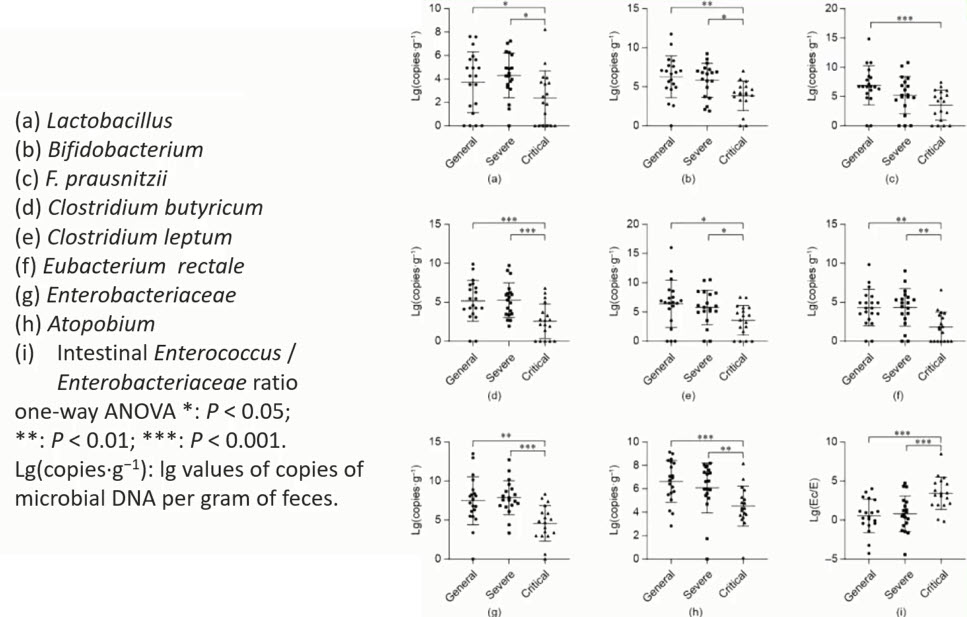
- Микробном кишечника при COVID-19
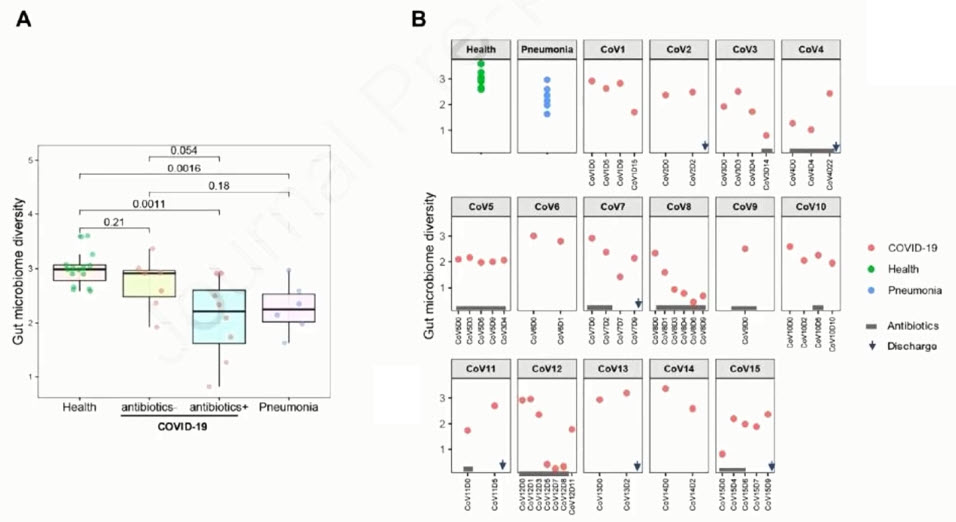
- Микробиом кишечника при COVID-19
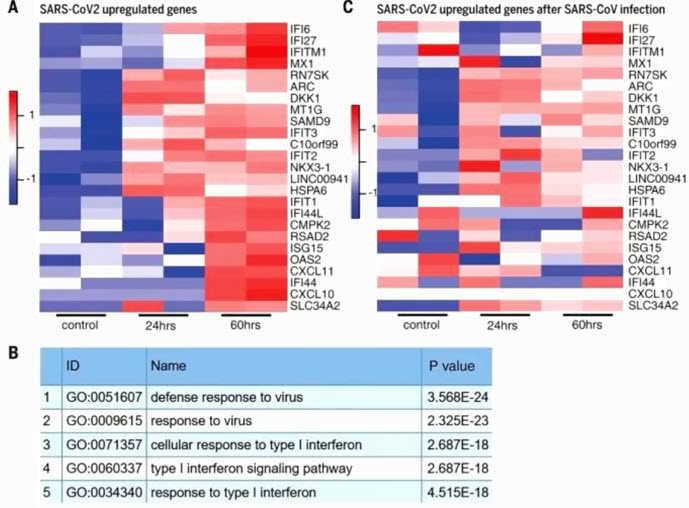
- SARS-CoV-2 меняет экспрессию генов энтероцитов
- SARS-CoV-2 и микробиота
- Lactobacillus в результате ферментации углеводов могут продуцировать молочную кислоту, и последующие изменения pH инактивируют различные вирусы
- Функциональность эпителиальных клеток толстой кишки в значительной степени зависит от присутствия в просвете бутирата как источника энергии, а основные бактерии, продуцирующие бутират в кишечнике, относятся к типу Firmicutes
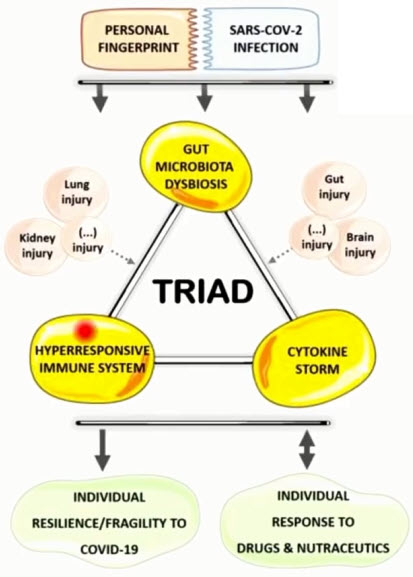
- Индивидуальные стратегии питания для профилактики лечения SARS-CoV-2
- SARS-CoV-2 усиливает воспаление и изменяет баланс микробиоты кишечника. Условно-патогенные микроорганизмы (Coprobacillus, Clostridium ramosum и Clostridium hathewayi) были обнаружены в большем количестве и коррелировали с тяжестью COVID-19. Противовоспалительная бактерия Faecalibacterium prausnitzii показала обратную корреляцию. Четыре члена Bacteroidetes могут подавлять экспрессию АСЕ2 и были снижены у пациентов с COVID-19. Персонализированные стратегии питания могут улучшить дисбактериоз кишечника и иммунный ответ у пациентов с SARS-CoV-2
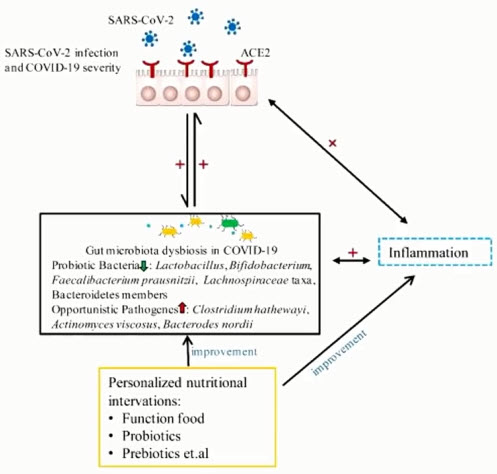
- Значение микроэкологических нарушений при пост-инфекционных состояниях
- Снижение метаболической мощности ЖКТ
- Нарушение барьерной функции кишечной стенки
- Нарушение иммуногенеза
- Благоприятные условия для УПФ (патобионтов)
- Энергодефицит
- Усиление провоспалительного потенциала кишечного содержимого
- Рост внекишечной «токсиновой» нагрузки
- Бактериальная транслокация
- Сетевая архитектура микробиома

- Микробный антагонизм в устойчивости микробиома
- Стрептомицин меняет соотношение микробных фил, подавляя Bacteroidetes у изолированных животных. Восстановление микробиоценоза связано с обменом микрофлорой между особями
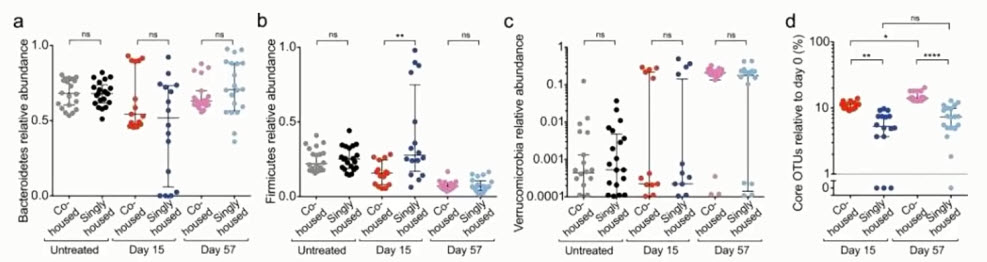
- Микробный антагонизм в устойчивости микробиома
- Способность сохранять или передавать комменсала Klebsiella michiganensis (Enterobacteriaceae) обуславливает устойчивости к колонизации после лечения антибиотиками
- К. michiganensis обычно вытесняла Е. coli и препятствовала колонизации Salmonella
- Введение in vivo галактита - питательного вещества, которое поддерживает рост только Е. coli - биколонизированным гнотобиотическим мышам, устраняло способность К. michiganensis препятствовать колонизации Е. coli
- Конкуренция за питательные вещества является основным механизмом межмикробного взаимодействия
- Микроэкологические нарушения при ААД
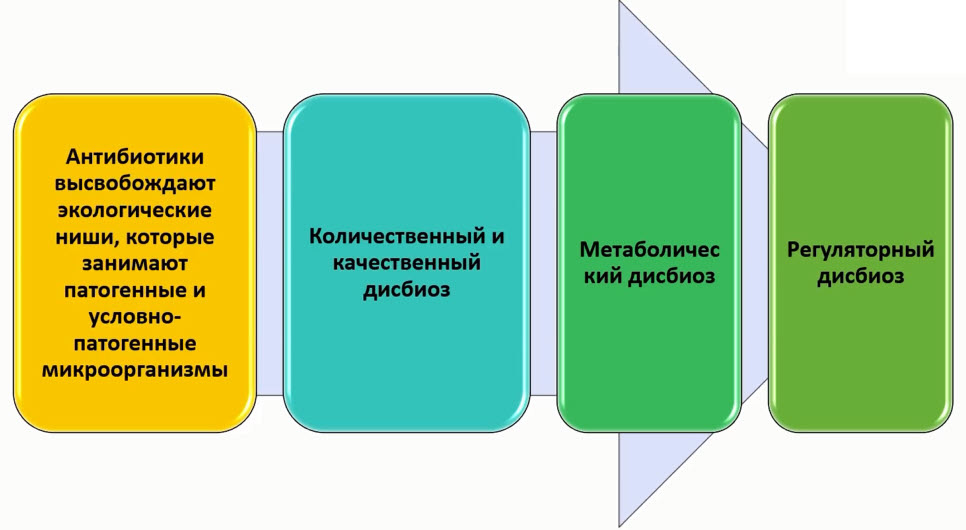
- Микробно-тканевой комплекс: формирование иммунологического ответа
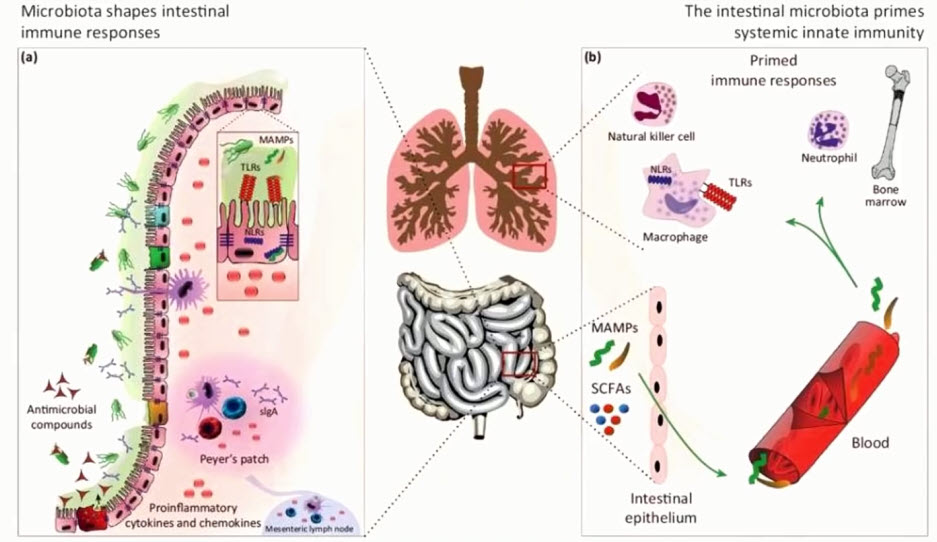
- Стимуляция иммунной системы увеличивает энергопотребность
- Во время реагирования на инфекционные заболевания или при восстановлении после них и заживлении иммунная система занимает самое высокое иерархическое место в потреблении энергии
- При активации иммунных клеток им требуется на 20-30% больше энергии, чем во время покоя
- Витамины, микронутриенты и иммунитет

- Роль цинка
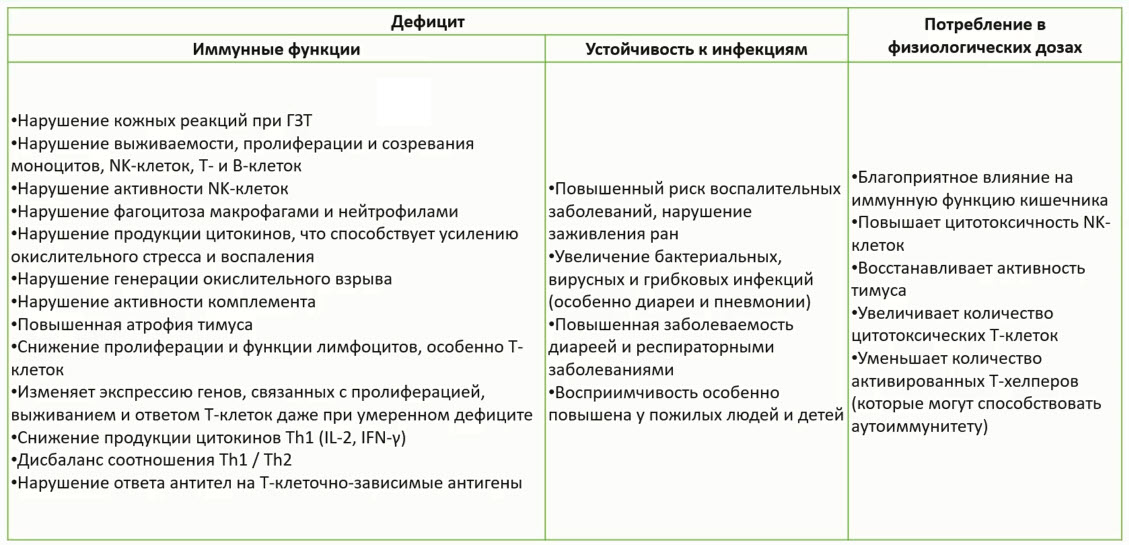
- Роль витаминов
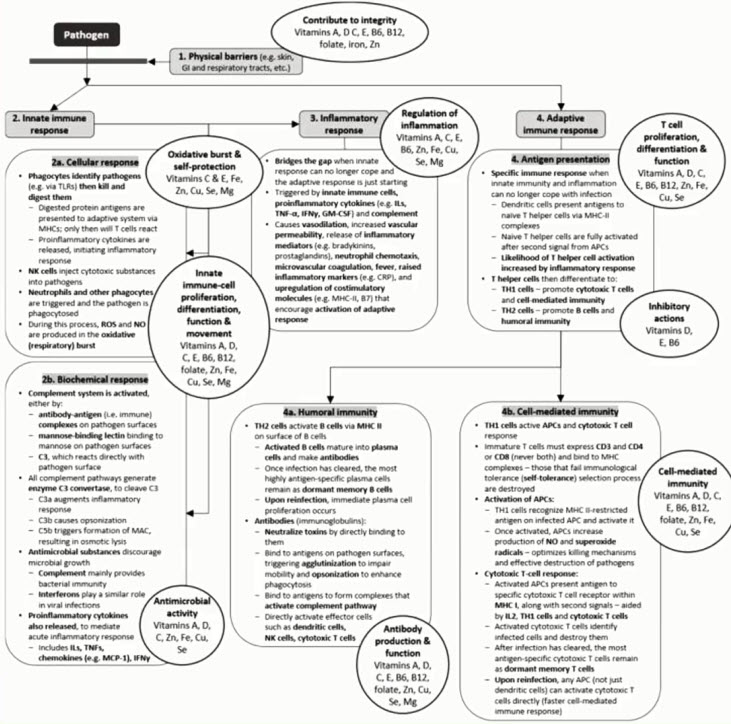
- Направления терапии АА-поражений ЖКТ
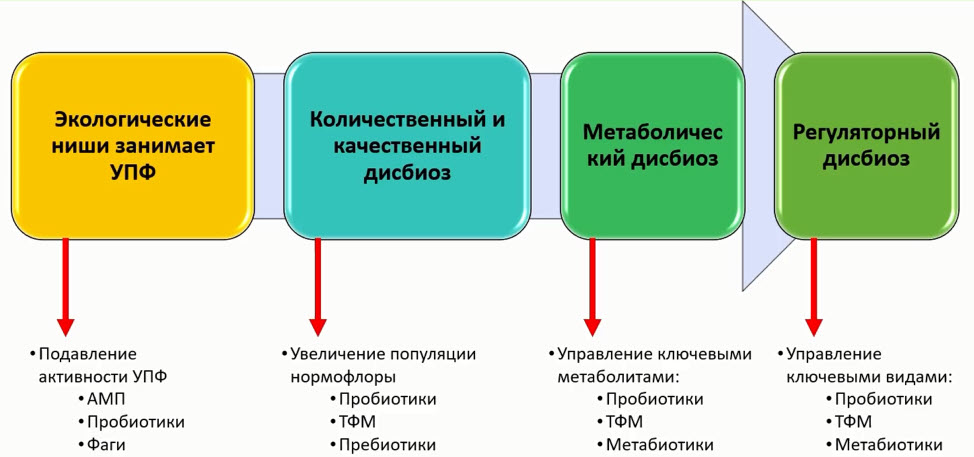
- Показания для применения пробиотиков с позиции доказательной медицины
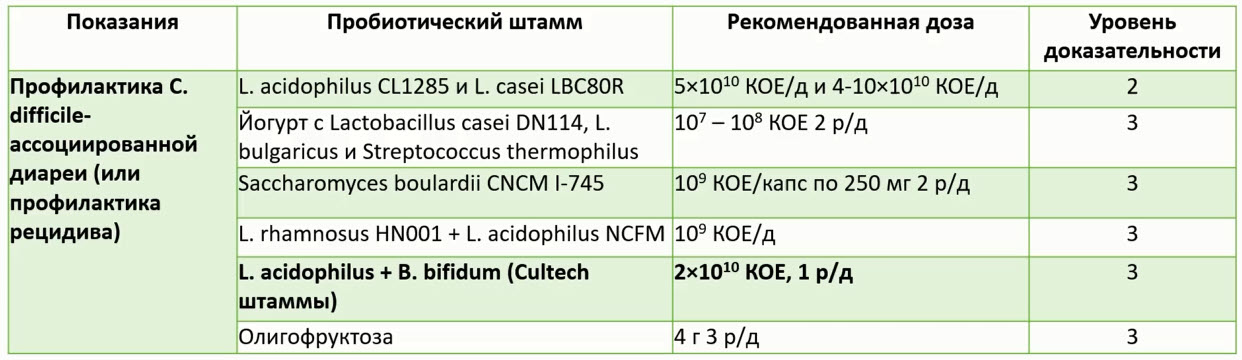
- Взгляды европейских врачей общей практики на пробиотики: результаты многонационального опроса
- Пробиотики в терапии пациентов с COVID-19
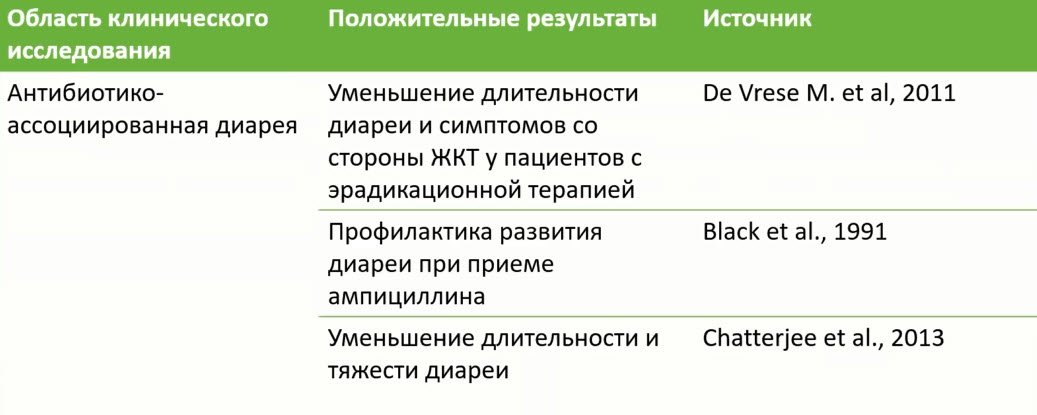
- Назначение пробиотиков во время и/или после антибактериальной терапии для профилактики и лечения различных побочных эффектов имеет убедительную доказательную базу
- В качестве пробиотиков используются препараты, содержащие различные виды и штаммы бифидо- и лактобактерий
- Применение пробиотиков для профилактики антибиотик-ассоциированной диареи достоверно более эффективно, если они назначаются как можно раньше с момента приема первой дозы антибиотика
- Пробиотические штаммы, имеющие большое значение для борьбы с инфекцией COVID-19
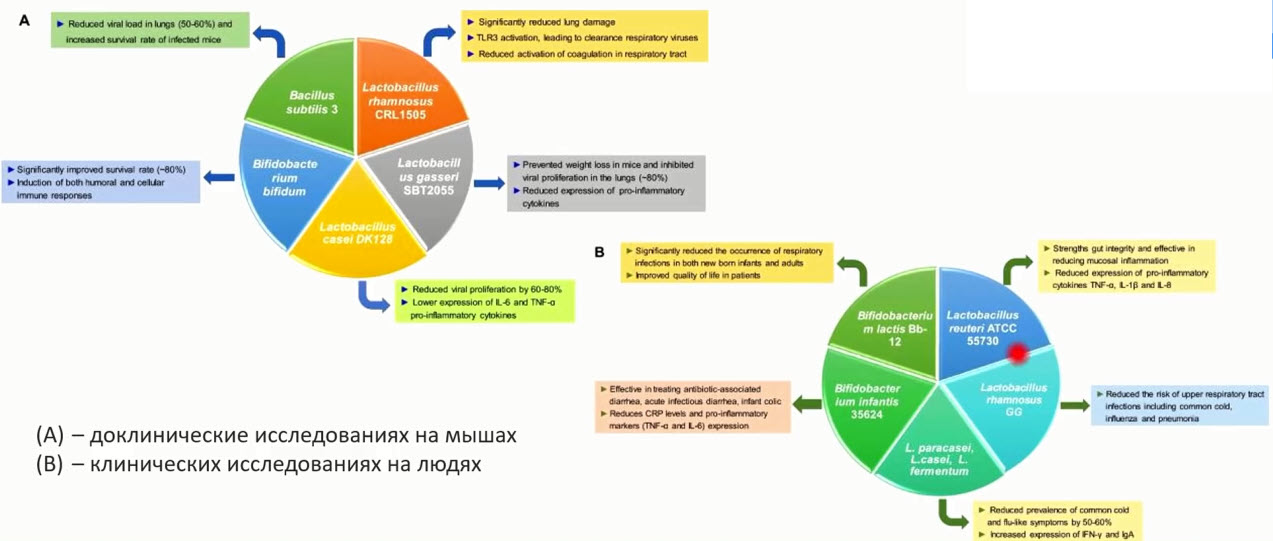
- Значимые эффекты пробиотиков при COVID-19
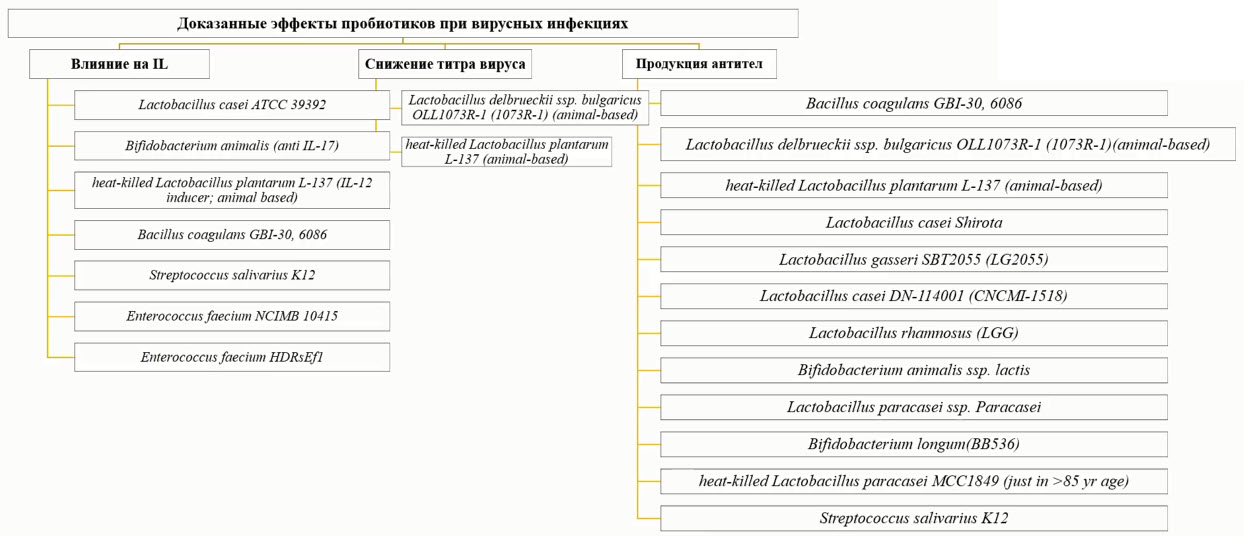
- Пробиотики: строжайший научный контроль
- Качество идентификации штамма(ов), генетическая предсказуемость эффектов
- Изученность механизмов действия пробиотик
- Польза конкретных эффектов пробиотика в данной клинической ситуации
- Наличие клинических исследований, доказывающих эффективность пробиотика
- Включение пробиотика в рекомендации по терапии и профилактике конкретных заболевании
- Возможность применения в необходимой разовой/суточной/курсовой дозе
- Отсутствие противопоказаний к применению
- Инструкция к препарату
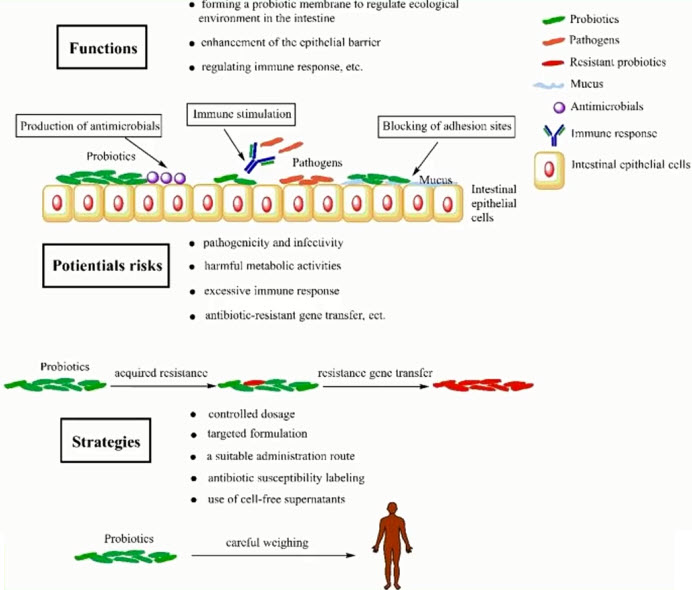
- Молекулярные эффекты пробиотиков в профилактике ААД
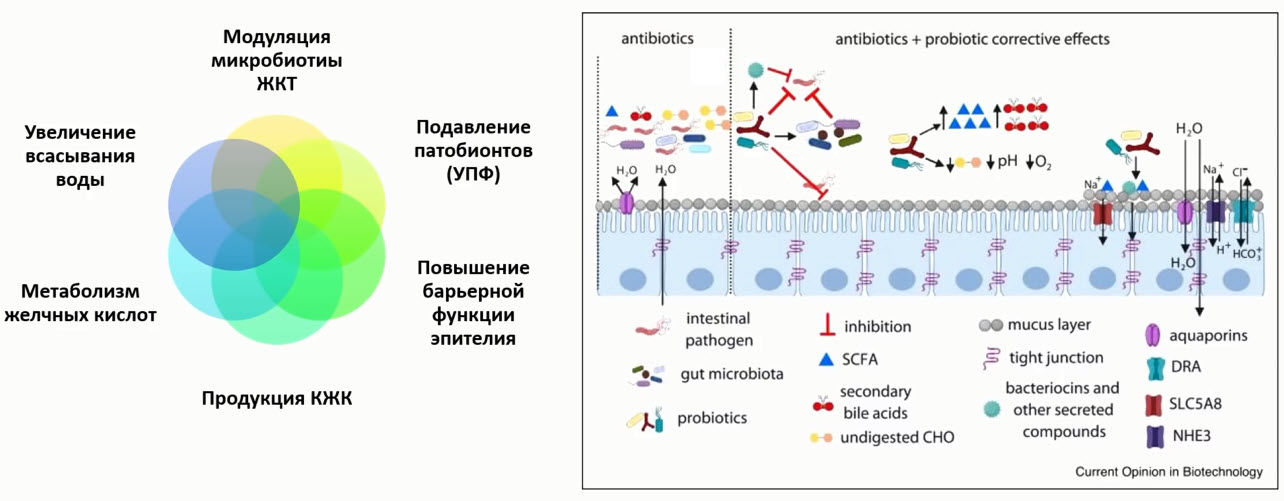
- Раннее начало профилактики
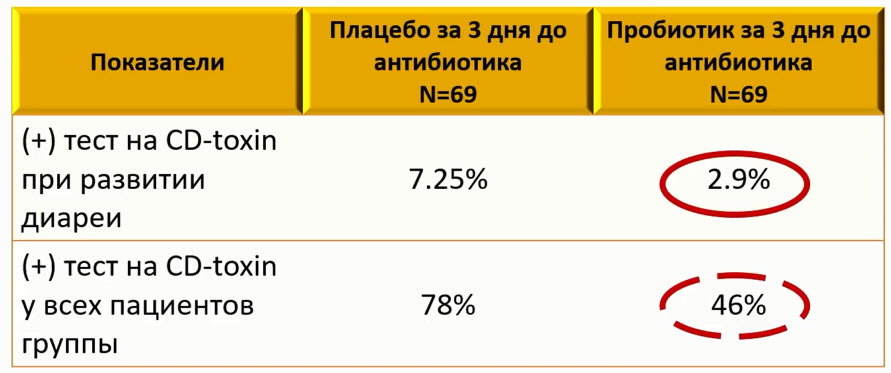
- Дозозависимый эффект пробиотиков
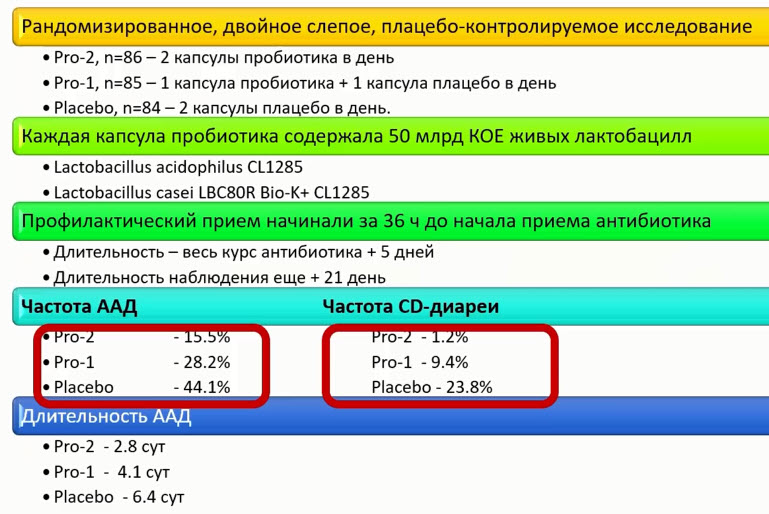
- Время-зависимая эффективность пробиотиков
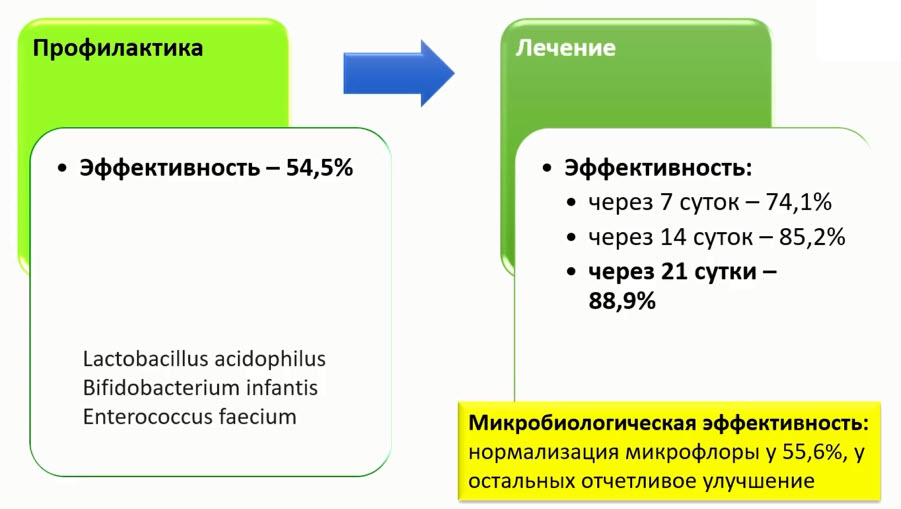
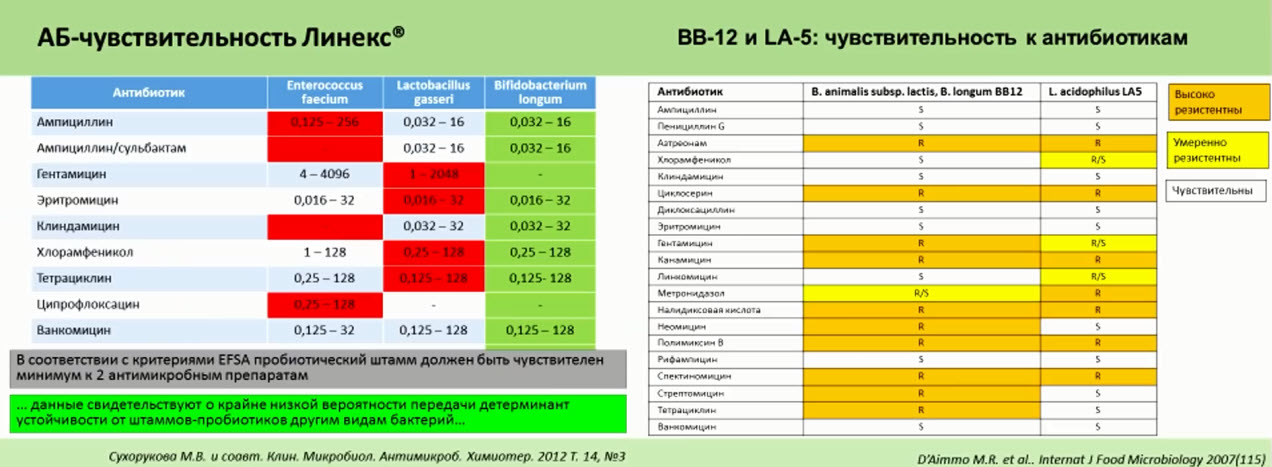
- ВВ-12 и LA-5 определены по фено- и генотипу (паспорт штамма)
- Комбинация пробиотиков и АМП
- Bifidobacterium animalis subsp. lactis BB-12 Антагонистическая активность
- Bacillus cereus
- Clostridium difficile
- Clostridium perfringens
- Type A Escherichia coli
- Listeria monocytogenes
- Pseudomonas aeruginosa
- Candida albicans
- H. pylori
- Salmonella enterica subsp enterica serovar Typhimurium
- S. enterica subsp. enterica serovar Typhi
- Shigella flexneri
- Shigella sonnei
- Campylobacter jejuni
- Lactobacillus acidophilus (LA-5)
- Являются кислотоустойчивыми микроорганизмами - 98% выживаемость при pH 2,0 в течение 1 часа
- При пероральном приеме способны временно колонизировать толстую кишку
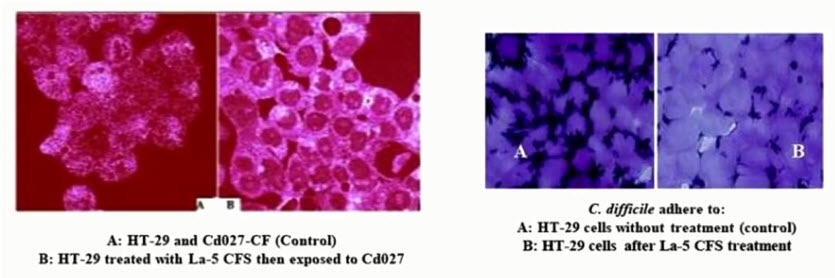
- Обладают антагонистической активностью в отношении Clostridium difficile:
- снижает адгезию С. difficile к клеткам эпителия
- уменьшает выработку токсинов С. difficile и их цитотоксичность
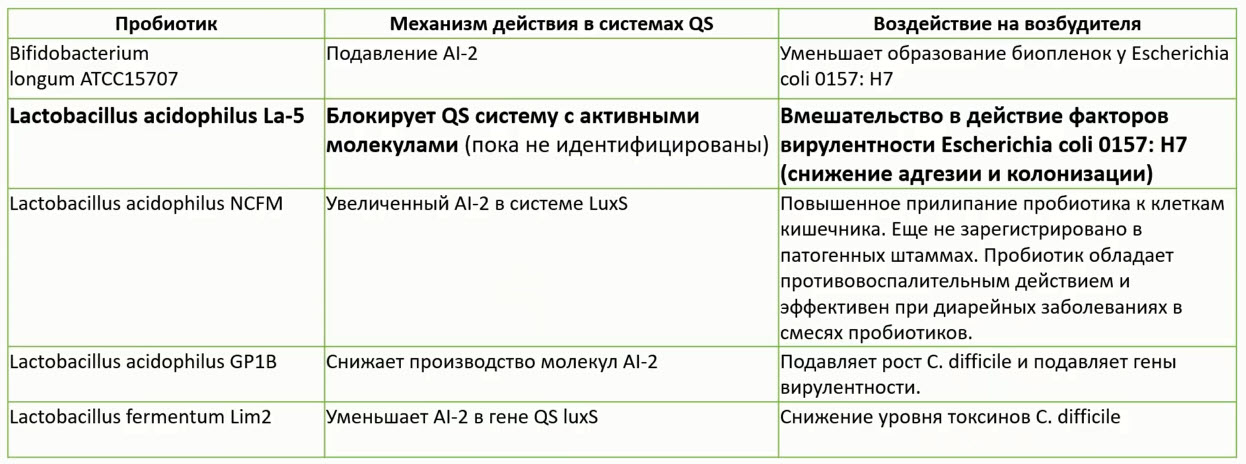
- Пробиотики нарушают Qs патогенов
- 1 + 1 ≥ 2: Преимущества комбинированных пробиотиков
- LA-5 и BB-12 обладают выраженной адгезий к внеклеточному матриксу, а - адгезия ВВ-12 возрастает более чем в 2 раза в присутствии лактобактерий (Ouwehand А.С. et al., LettAppI Microbiol 2000; Ouwehand A.C. etal., Lait2002)
- LA-5 и BB-12: активностью обладают как сами бактерии, так и супернатант
- При одновременном назначении LA-5 и ВВ-12 наряду с повышением продукции IL-10 повышается продукция и TNF-a, IFN-y и IL-12. При этом иммуномодулирующее действие комбинации этих штаммов более «мягкое», чем при применении монопрепаратов (Kekkonen R. Academic Dissertation. Helsinki 2008)
- LA-5 + BB-12 - повышает продукцию секреторных IgA у здоровых взрослых (Link-Amster et al., 1994), способствует повышению фагоцитарной активности лейкоцитов (Hatcher G. et al., Journal of Dairy Science, 1993; Schiffrin, E.J. et al., Journal of Dairy Science, 1995). Стимулирующий эффект сохраняется до 6 недель
- LA-5 и ВВ-12 способны влиять на Quorum-sensing в микробных популяциях Повышение колонизационной резистентности у детей в возрасте 1 мес (Langhendries J.Pet al., Journal of Pediatric Gastroenterology)
- Хорошо переносится новорожденными - 131 ребенок получал препарат в дозе 108/сут суммарно 68,1 чел/лет (АЫ-Hanna A. et al., J Pediatr Gastroenterol Nutr, 1998)
- Комбинация L. acidophilus LA-5 и В. animalis subsp. lactis BB-12 может оказывать сильное противовоспалительное действие посредством модулирования КК2-опосредованных NF-кВ и МАРК сигнальных путей в воспалительных эпителиальных клетках кишечника. Оба штамма, особенно их комбинация, могут быть новыми адъювантами для терапии ВЗК (Li S.C. etal. Nutrients. 2019Apr27;11(5). pii: E969)
- Пробиотики в профилактике ААД у взрослых
- Ретроспективный анализ с 1 января 2015 года по 30 июня 2017 года
- Сравнивалась частота диареи, вызванной Clostridium difficile (CDAD), у пациентов, принимавших некоторые антибиотики широкого спектра действия с пробиотиками и без них
- 5 574 обращения в больницу
- частота CDAD у пациентов, получающих пробиотик, составляет 0,96%
- частота CDAD у пациентов без пробиотика 2,19% (OR = 0,442; Р = 0,00743)
- Использование пробиотиков, начатое по крайней мере за 2 дня до тестирования С. difficile у пациентов, получающих антибиотики широкого спектра действия, было связано со статистически значимым снижением заболеваемости CDAD

- Клиническая эффективность ВВ-12 и LA-5
- Пробиотики vs ААД: экономика
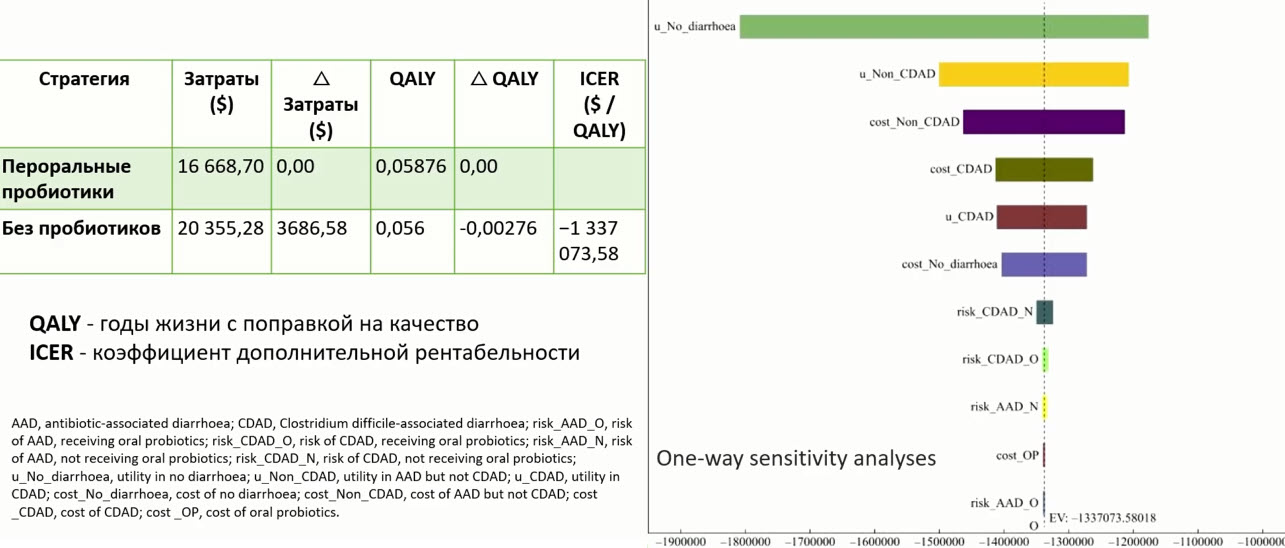
- LA-5 и BB-12 восстанавливают содержание бифидобактерий
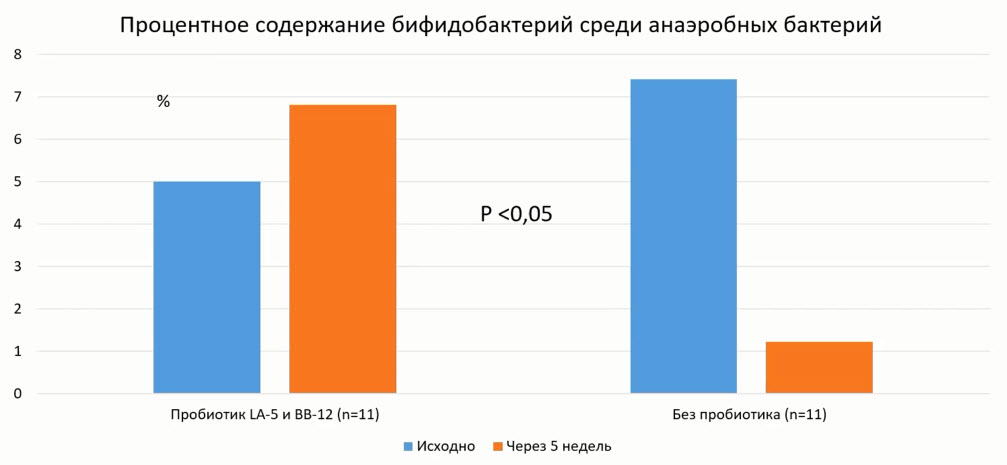
- Схема приема Линекс Форте
- Иммунопробиотик Комплинекс
- Состав
- Содержание активных компонентов в 1 капсуле:
- Лиофилизированные Lactobacillus rhamnosus GG - не менее 1х10 10 КОЕ
- Витамин В1 (тиамин) -0,4 мг
- Витамин В2 (рибофлавин) -0,5 мг
- Витамин В6 (пиридоксин гидрохлорид) - 0,4 мг
- Минерал: цинк 3 мг
- Схема приема
- Детям старше 6 лет и взрослым - по 1-2 капсулы в сутки во время еды
- Содержание активных компонентов в 1 капсуле:
- Состав

- Lactobacillus rhamnosus GG
- Lactobacillus rhamnosus GG (LGG) - запатентован в 1989 году благодаря его способности выживать и размножаться при кислотном pH желудочного сока и в среде, содержащей желчь, и прилипать к энтероцитам
- LGG способен защищать слизистую оболочку, повышая выживаемость кишечных крипт, уменьшая апоптоз кишечного эпителия и сохраняя целостность цитоскелета
- Благодаря своему лектин-подобному белку 1 и 2, подавляет некоторые патогены, такие как сальмонелла
- LGG способна стимулировать иммунную реакцию типа 1 за счет снижения экспрессии нескольких маркеров активации и воспаления на моноцитах и за счет увеличения продукции интерлейкина-10, интерлейкина-12 и фактора некроза опухоли-α в макрофагах
- Эффективность LGG доказана при инфекционной диарее, антибиотик- и Clostridioides difficile-ассоциированных диареях, СРК, ВЗК, инфекции дыхательных путей, аллергии, сердечно-сосудистых заболеваниях, НАЖБ, неалкогольном стеатогепатите, муковисцидозе и др.
- Lactobacillus rhamnosus GG (LGG) имеет статус GRAS
- Влияние кислой среды. После двух часов инкубации LGG в агрессивной кислой среде (рН=2,5) выживали 73% микроорганизмов, таким образом, данная бактерия высокоустойчива к защитным факторам желудка
- Сканирующая электронная микроскопия LGG выявила особые пили, обеспечивающие связывание с муцином в кишечнике. Полногеномное секвенирование LGG, установило наличие у данных бактерий ресничек (пили), которые отвечают за связывание с кишечной слизью человека
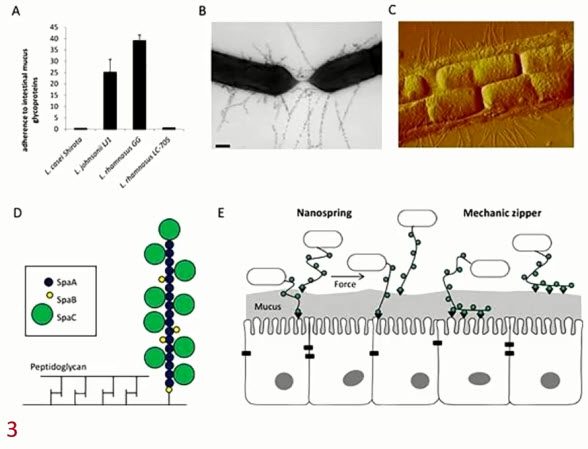
- Секретируемые белки как эффекторы LGG
- Два белка из супернатантов LGG р75 (~ 75 кДа) и р40 (~ 40 кДа) позже были переименованы в Major Secreted Protein - Mspl и Msp2 соответственно из-за разницы в молекулярной массе
- вызывают антиапоптический эффект
- способствуют росту клеток в толстой кишки человека и мыши и культивируемых эксплантатах толстой кишки мыши
- защищают барьерную функцию кишечного эпителия от повреждений, вызванных перекисью водорода, путем блокирования киназ МАР
- Два белка из супернатантов LGG р75 (~ 75 кДа) и р40 (~ 40 кДа) позже были переименованы в Major Secreted Protein - Mspl и Msp2 соответственно из-за разницы в молекулярной массе
- Экзополисахариды (ЭПС) LGG как модулирующие факторы адаптации
- Поверхность клеток LGG содержит 2 основных типа полисахаридов:
- длинные полисахариды, богатые галактозой
- более короткие полисахариды, богатые глюкозой /маннозой
- Длинные богатые галактозой ЭПС защищают клетку от комплемент-опосредованного лизиса и кателицидинов, специфических катионных антимикробных пептидов
- Изолированный ЭПС из LGG, по-видимому, противодействует цитотоксичности Bacillus cereus в отношении клеток Сасо-2 и стрептолизина-0 в отношении эритроцитов кролика
- ЭПС обеспечивают защиту от желчи
- Поверхность клеток LGG содержит 2 основных типа полисахаридов:
- Секретируемые противомикробные факторы LGG
- Молочная кислота не только меняет локальный pH в месте обитания LGGho и способствует антибактериальному действию других соединений, таких как органические кислоты или бактериоцины
- В культуральной среде LGG идентифицировано семь термостабильных пептидов с антибактериальной активностью в отношении энтероагрегативного штамма Е. coli ЕАЕС 042, Salmonella Typhi и Staphylococcus aureus
- Идентифицированы несколько генов, связанных с бактериоцином
- LGG продуцирует аутоиндуктор-2 (AI-2), который, как предполагается, является важной межвидовой молекулой QS, продуцируемой как Гр(+), так и Гр(-) бактериями
- AI-2-синтаза LuxS также влияет на метаболизм клеток
- Цинк способствует нормальному функционированию иммунной системы
- Влияет на барьерную функцию слизистых оболочек и кожи, поддерживая их целостность и репарацию
- Защищает клетки от оксидативного стресса (окислительного повреждения)
- Участвует во врождённом (нейтрофилы, моноциты) и приобретенном иммунном ответе (пролиферация, активация, дифференцировка и движение Т-клеток, продукция антител)
- Принимает участие в регуляции воспалительной реакции
- Улучшает фагоцитарную способность моноцитов-антибактериальная активность
- Витамины Bl, В2, В6 в Комплинекс
- Витамины Bl, В2 и ВБ способствуют нормальному энергетическому метаболизму
- Витамин В2 способствует поддержанию здоровья слизистых оболочек и способствует защите клеток от окислительного стресса
- Синергия компонентов в Комплинекс

- Пост-SARS-CoV2 функциональные расстройства ЖКТ
- Микробиота - это фактор сопряжения самых разных функций наших органов и систем в единую морфофункциональную структуру
- SARS-COV2 - одновременно запускает несколько патогенетических «ударов», однако у каждого пациента в том или ином варианте в этот процесс включается изменённая микробиота кишечника
- Дополнительными факторами являются медикаментозное повреждение ЖКТ, неадекватный воспалительный ответ
- Формирование пocт-SARS-CoV2 функциональных расстройств во многом зависит от адекватности / таргетности терапии в остром периоде
- Реабилитационные мероприятия после перенесенного COVID-19 заболевания сегодня, к сожалению, носят несистемный и неселективный характер
- Защитная парадигма
- Применять антибиотики по показаниям, в адекватной дозировке и оптимальной продолжительности
- Разумно заменять/усиливать антибиотикотерапию пробиотиками, бактериофагами
- Предупреждать/компенсировать нежелательные эффекты антибиотикотерапии (пре-, про-, сим-, син-, метбиотиками...)
- Защитная парадигма
- В зависимости от клинической ситуации выбирается оптимальный вариант пробиотической терапии
- Комплинекс - на любом этапе лечения COVID-19, при наличии потенциального/доказанного иммунодефицитного состояния, в периоде реабилитации после инфекции
- Линекс Форте - при необходимости применения антибиотиков, появлении симптомов поражения ЖКТ, а также появлении ААД
- В зависимости от клинической ситуации выбирается оптимальный вариант пробиотической терапии
Для просмотра лекции "COVID-19 и кишечная микробиота: подходы к комплексной терапии и реабилитации" передвиньте ползунок времени 00:56:13